Farmaci, progettazione dei
Farmaci, progettazione dei
La scoperta e lo sviluppo di un farmaco sono processi lunghi, ad alto rischio e molto costosi, cui contribuiscono principalmente la chimica e la farmacologia preclinica e clinica, ma che poggiano su conoscenze di base derivanti da una varietà di discipline, quali la genetica, la fisiologia, la microbiologia, la patologia e la biologia molecolare. Il cammino che conduce al farmaco inizia generalmente con l'identificazione di una sostanza chimica, di origine naturale o sintetica, dotata di promettenti proprietà farmacologiche; usualmente questa sostanza viene indicata con il termine inglese lead, che in italiano può essere tradotto con 'prototipo'. Dopo che la molecola prototipo è stata identificata, subisce un processo di ottimizzazione consistente in variazioni strutturali mirate, tramite le quali si cerca di migliorarne le caratteristiche farmacologiche, farmacocinetiche e di sicurezza. La molecola ottimizzata, se giudicata adatta a essere utilizzata come farmaco, è sottoposta a una sequenza di prove cliniche sull'uomo ‒ indicate come fasi I, II, III ‒ il cui esito positivo permette la presentazione di una richiesta di registrazione presso le autorità sanitarie.
Mediamente, le prove cliniche e la registrazione di un farmaco richiedono da otto a dieci anni a seconda del tipo di azione farmacologica coinvolta, il che significa che dal momento della scoperta del prototipo all'utilizzazione del farmaco passano circa undici-quindici anni. Dopo l'immissione sul mercato, il farmaco entra nella cosiddetta 'fase IV', consistente nel monitoraggio della sua azione terapeutica e degli effetti tossici su un numero di pazienti più elevato rispetto a quello dei pazienti coinvolti nelle fasi precedenti e quindi con risultati statisticamente più significativi. I problemi che emergono in questa fase possono determinare una restrizione d'uso o anche il ritiro del farmaco dal mercato. Al termine della protezione brevettuale un farmaco può essere prodotto e commercializzato da altre società del settore ed entrare nel gruppo dei farmaci cosiddetti 'generici'.
Le risorse, in termini di uomini e mezzi, necessarie per la realizzazione di un farmaco richiedono ingenti investimenti che, di fatto, rendono impossibile che ciò avvenga al di fuori del sistema industriale. La spesa per portare a termine lo sviluppo di un farmaco è cresciuta costantemente negli ultimi decenni ‒ attualmente si aggira tra i 600 e gli 800 milioni di euro ‒ per molteplici ragioni, tra le quali appare predominante l'esigenza di sicurezza, che induce le autorità sanitarie a richiedere accertamenti sempre più accurati, soprattutto a livello clinico, prima di autorizzare la commercializzazione di una nuova molecola; inoltre solo un decimo circa dei prodotti studiati raggiunge la registrazione. Per fronteggiare questi problemi, l'industria farmaceutica è intervenuta sia con soluzioni strutturali ‒ quali la formazione, per confluenza o acquisizione, di società sempre più grandi e potenti ‒ sia cercando di accelerare al massimo la scoperta di nuovi farmaci. Per abbattere i tempi che portano all'individuazione dei prototipi e i tassi di fallimento durante la loro messa a punto, il sistema industriale farmaceutico ha investito grossi capitali nelle tecnologie sviluppate a partire dagli anni Novanta del XX secolo.
I principî alla base dell'azione dei farmaci
Corpora non agunt nisi fixata. Questo principio, formulato da Paul Ehrlich (1913) agli albori della farmacologia molecolare, può essere così riformulato: non c'è azione senza interazione. Esso è alla base delle scienze del farmaco e permette di descrivere l'azione del farmaco in termini strutturali, sulla base dei legami che una data molecola con una data struttura è in grado di instaurare con la molecola bersaglio. Il principio esalta l'importanza della disposizione spaziale (stereochimica) degli atomi o dei gruppi di atomi che controllano la formazione dei legami tra il farmaco e il suo bersaglio, e rende possibile l'elaborazione di una serie di relazioni, note come 'relazioni struttura-attività', tra la struttura chimica di una molecola e la sua azione biologica e farmacologica. In alcuni casi, dopo la formazione del complesso reversibile iniziale, la situazione può evolvere verso la formazione di legami covalenti che rendono il complesso più stabile nel tempo. Le conseguenze di ciò a livello terapeutico possono essere molto diverse secondo l'oggetto biologico coinvolto. Nel caso della penicillina, per esempio, e di tutti gli antibiotici β-lattamici la formazione di un legame covalente è auspicabile, in quanto blocca un enzima essenziale per la sopravvivenza dei microrganismi sensibili; quando però la molecola bersaglio ha funzioni biologiche importanti per l'organismo del paziente, la formazione di legami covalenti può essere una complicazione che induce severi effetti collaterali: è il caso degli antitumorali alchilanti che sono in grado di reagire sia con il DNA delle cellule tumorali sia con quello delle cellule sane, con ovvie conseguenze a livello di tossicità.
Una delle conseguenze del principio di interazione è che molecole simili, interagendo in modo analogo, sono in grado di produrre effetti simili. Anche se questo corollario ha trovato un certo numero di eccezioni, esso è alla base dei processi di ottimizzazione e di una delle metodiche principali per la progettazione dei farmaci: la modulazione molecolare di farmaci noti. Al contrario, quando si progettano molecole per sviluppare farmaci innovativi, sia per patologie che necessitano di nuovi interventi terapeutici sia per nuovi tipi di malattie, ci si orienta verso strutture il più possibile differenti da quelle già note.
Il bersaglio
Il principale bersaglio dei farmaci attualmente usati sono le proteine e gli acidi nucleici, di cui è fondamentale conoscere le funzioni, la struttura chimica, la stereochimica e le caratteristiche chimico-fisiche: per esempio, la conoscenza della struttura a doppia elica del DNA ha permesso di spiegare l'interazione di intere classi di farmaci antitumorali e di conseguenza ha facilitato la progettazione di altri farmaci dello stesso tipo.
Le proteine, nella forma di enzimi, recettori, canali ionici, proteine di trasporto e pompe di vario genere, sono sicuramente il bersaglio più comune dei farmaci. Una volta che è stato individuato un bersaglio proteico e ne è stata riconosciuta l'importanza, diventa essenziale conoscerne la struttura chimica e sterica. Ciò è relativamente facile se la proteina è cristallizzabile o ha un peso molecolare inferiore ai 30.000 Da; in questo caso, infatti, le tecniche di diffrazione ai raggi X e la spettrometria di risonanza magnetica nucleare (NMR) permettono di stabilire la struttura tridimensionale della proteina e di determinare anche la natura dei complessi formati dalla proteina stessa con piccole molecole, siano essi ligandi naturali o di sintesi. È così possibile identificare il sito di interazione, gli amminoacidi che lo compongono e la stereochimica coinvolta e, di conseguenza, progettare le piccole molecole in grado di interagire con il sito sulla base della sua struttura. Un caso particolarmente favorevole è quello degli enzimi che, nella maggior parte dei casi, sono in grado di produrre cristalli la cui struttura può essere risolta. In genere, questi stessi cristalli, messi a contatto con una soluzione contenente un ligando, lo inglobano mantenendo la struttura cristallina e rendendo possibile la determinazione delle modalità di legame.
Tuttavia, molte proteine, in particolare quelle di membrana, sono difficili da cristallizzare. In tal caso, se è nota la struttura di un'altra proteina della stessa famiglia si può procedere per omologia (homology modelling) e costruire un modello, che naturalmente sarà meno preciso e attendibile di quello ottenuto direttamente ma utilizzabile per la progettazione di piccole molecole in grado di interagire con la proteina stessa e quindi di divenire farmaci utili. Questa è, a tutt'oggi, la situazione nel campo delle proteine che costituiscono i recettori di membrana, tra i quali solo la struttura di un recettore accoppiato alle proteine G (la rodopsina bovina) è stata risolta a livello atomico: la struttura cristallina di una proteina solubile, ricavata dalle cellule gliali del mollusco Lymnaea stagnalis, che ha la proprietà di legare l'acetilcolina. Questa proteina, chiamata AchBP (Acetylcholine binding protein), ha un'alta omologia con il recettore colinergico nicotinico (un recettore canale) ed è stata utilizzata per modellare per omologia la parte extracellulare del recettore stesso.
Il meccanismo d'azione
Anche se non mancano esempi illustri di farmaci scoperti e usati con successo prima che fosse chiarito il loro meccanismo d'azione (come nel caso dei sulfamidici), per essere in grado di progettare con sufficiente attendibilità un farmaco è essenziale conoscere, a livello molecolare, i processi fisiopatologici legati alla malattia da trattare. Spesso i meccanismi sono talmente complessi da permettere una certa varietà di linee d'intervento. È chiaro che in casi del genere, prima di passare alla progettazione del farmaco, si deve scegliere su quale anello della catena si vuole agire. Questa scelta può essere dettata da ragioni di selettività d'azione, in modo da ridurre gli effetti collaterali non desiderati; per esempio, il blocco della formazione dell'acido tetraidrofolico tramite l'inibizione degli enzimi che sono coinvolti nella sua sintesi è un modo per impedire lo sviluppo di microrganismi patogeni. I sulfamidici inibiscono il funzionamento di uno di questi enzimi, la pteroatosintetasi, che è presente solo nei procarioti; pertanto, dato che la loro azione è selettiva verso i microrganismi, provocano meno effetti collaterali rispetto agli inibitori dell'altro enzima coinvolto, la diidrofolatoreduttasi, che è presente sia nei microrganismi sia nei Mammiferi. Accade spesso che le cause di una malattia non siano del tutto chiare e che il processo che determina la patologia da trattare non sia noto a livello molecolare; in tal caso, la progettazione di farmaci assume un aspetto più empirico e viene basata sulla sperimentazione a tappeto o, in maneria più razionale, su ipotesi di lavoro formulate in base alle informazioni disponibili sulla fisiologia e la patologia in questione.
Prodotti biologicamente attivi e farmaci
Il numero delle molecole che hanno una qualche azione sui sistemi biologici è enorme, mentre quelle realmente usate in terapia sono poche migliaia. Ciò è dovuto al fatto che, per ottenere un effetto terapeutico, un prodotto non solo deve avere un'azione biologica, ma deve essere messo nelle condizioni di esercitarla, senza peraltro causare effetti indesiderati. Ciò significa che, in generale, il prodotto deve essere assorbito, trasportato e distribuito nel sito d'azione, resistere al metabolismo e all'eliminazione in misura tale da mantenere una concentrazione sufficiente allo scopo e, infine, non essere tossico per l'organismo alle dosi farmacologicamente efficaci, né direttamente né attraverso i suoi metaboliti. Il complesso di questi eventi costituisce la farmacocinetica e viene identificato spesso con l'acronimo ADME (assorbimento, distribuzione, metabolismo, eliminazione). Le proprietà farmacocinetiche e di tossicità (ADME/Tox) sono determinanti per il destino di un farmaco e contribuiscono a restringere enormemente il numero di prodotti biologicamente attivi utilizzabili come farmaci. In realtà, il numero delle molecole attive in via di sviluppo che si debbono abbandonare per problemi di farmacocinetica e tossicità è purtroppo molto elevato e costituisce una delle cause degli altissimi costi richiesti dalla realizzazione di un farmaco. Pertanto sono stati elaborati specifici saggi sperimentali e procedure computerizzate che forniscono previsioni teoriche sulle proprietà ADME/Tox di una molecola. In generale, è importante che la molecola in via di progettazione abbia caratteristiche il più possibile vicine a quelle della maggioranza dei farmaci (druglikeness).
La tossicità di un potenziale farmaco è tradizionalmente valutata sugli animali, in genere a uno stadio di sperimentazione del farmaco piuttosto avanzato. Tuttavia, la necessità di avere informazioni attendibili già all'inizio della fase di ottimizzazione ha favorito la ricerca di metodi alternativi, tra i quali sembra particolarmente promettente la proteomica: l'analisi delle proteine presenti nelle cellule di un tessuto prima e dopo l'esposizione alla sostanza da analizzare può dare informazioni preziose sulle conseguenze della sua presenza nelle cellule. La sensibilità del metodo permette l'uso di quantità minime di sostanza, anche nella fase iniziale dello sviluppo del farmaco.
Nell'ambito della farmacocinetica, grande rilievo assumono le trasformazioni metaboliche di un possibile farmaco, anch'esse studiate su animali e poi sull'uomo. Infatti, il metabolismo condiziona il tempo di emivita, e quindi il dosaggio e la via di somministrazione, e può contribuire alla tossicità del farmaco attraverso i prodotti di metabolizzazione. Tuttavia, sempre per evitare costosi fallimenti, appare necessario avere informazioni sulla stabilità metabolica il più presto possibile. A questo scopo sono stati messi a punto saggi in vitro che utilizzano microsomi o epatociti e sono state elaborate procedure computerizzate per prevedere il comportamento metabolico di una molecola.
L'introduzione di metodologie di analisi farmacologica e biologica HTS (High throughput screening), ossia estremamente rapide, efficienti e sensibili, ha rappresentato una svolta epocale nella progettazione dei farmaci. Queste metodologie permettono di valutare l'azione biologica e farmacologica di un prodotto, o di una miscela di prodotti, utilizzando quantità minime di sostanza e possono essere quasi completamente automatizzate, consentendo l'analisi di centinaia o migliaia di prodotti in una giornata ed eliminando così quello che per decenni ha rappresentato il fattore limitante nella ricerca di prototipi e nella fase di ottimizzazione dei farmaci. La loro introduzione ha determinato la necessità di disporre di sempre nuove molecole da sottoporre a valutazione farmacologica, il che ha condotto a sua volta all'utilizzazione massiccia di un'altra moderna metodologia, la sintesi combinatoriale.
La progettazione dei farmaci
L'identificazione del prototipo
Ciò che determina la ricerca di un farmaco è quasi sempre la necessità di fronteggiare un problema terapeutico. La chimica farmaceutica e la farmacologia sono le scienze che si occupano di questa ricerca, l'una identificando, progettando e sintetizzando molecole, l'altra valutandone l'azione farmacologica. In passato le origini molecolari di una malattia erano il più delle volte ignote e quindi mancavano informazioni sul bersaglio del farmaco destinato a curarla. Di conseguenza, per individuare il prototipo da sviluppare la chimica farmaceutica procedeva in modo largamente empirico, attraverso tentativi ed errori. Sempre più spesso però, grazie alla biologia molecolare, la natura e la struttura del bersaglio del farmaco sono note in modo più o meno dettagliato. Ciò permette oggi, al chimico farmaceutico, di intervenire in modo certamente più razionale e di giungere all'identificazione del prototipo in tempi generalmente più rapidi. Parallelamente, la sperimentazione farmacologica può essere più mirata e informativa.
La ricerca di un farmaco inizia con la ricerca di una molecola prototipo, vale a dire una molecola che abbia una promettente azione sulla malattia che si vuole curare senza possedere, però, tutte le caratteristiche per poter essere definita farmaco. Queste caratteristiche sono numerose e quasi tutte essenziali. Una, ovviamente discriminante, è quella della potenza: il prodotto deve essere attivo a dosi molto basse per poter essere somministrato in quantità tali da minimizzare gli effetti collaterali indesiderati. Tipicamente, un prototipo ha un'attività nell'ordine micromolare (10‒6 moli/l), mentre per un prodotto ottimizzato ci si aspetta un'attività nell'ordine nanomolare (10‒9 moli/l). Anche la selettività di azione, spesso insufficiente nei prototipi, è una caratteristica importante per minimizzare gli effetti secondari, soprattutto per i farmaci che agiscono sui sistemi recettoriali. L'importanza cruciale della farmacocinetica è già stata trattata: spesso un prototipo ha una farmacocinetica insufficiente e una stabilità metabolica inadeguata, che devono essere migliorate prima di poterlo utilizzare come farmaco. Altre proprietà importanti per un farmaco sono la stabilità chimica e la facilità di sintesi, che spesso debbono essere opportunamente modulate. Infine, in molti casi il prototipo non ha le caratteristiche di brevettabilità che sono indispensabili per iniziare lo sviluppo di un farmaco. Il problema fondamentale diventa quindi quello dell'individuazione del prototipo stesso.
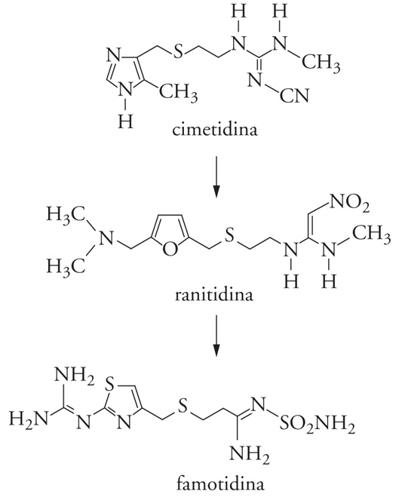
Una molecola prototipo può essere individuata attraverso varie strategie; una via sempre attuale è quella della scoperta casuale. Gli esempi in proposito sono numerosi e illustri, a partire dalla penicillina G: in questi casi la fortuna è andata di pari passo con l'attenzione e la preparazione dei ricercatori. Un'altra via è la manipolazione di farmaci già esistenti: basandosi sul principio che molecole simili generalmente producono azioni farmacologiche simili, si può utilizzare come prototipo un farmaco già sperimentato; è chiaro che per ottenere la brevettabilità del prodotto tali manipolazioni debbono introdurre delle novità a livello sia strutturale che terapeutico. Questa strategia ha ricadute importanti dal punto di vista terapeutico, perché i prodotti di seconda generazione presentano in genere proprietà farmacologiche e farmacocinetiche migliori del farmaco originale. Un esempio di questo approccio è rappresentato dai farmaci antiulcera ranitidina e famotidina, comparsi dopo la cimetidina, il primo a essere immesso sul mercato (fig. 2).
Accade spesso che, durante le manipolazioni molecolari di farmaci noti, si identifichino prodotti con azioni biologiche importanti e diverse da quelle del farmaco di partenza; oppure si possono utilizzare come prototipi dei metaboliti attivi di farmaci già in uso. Molti farmaci hanno effetti collaterali, che spesso si evidenziano nella fase IV, attribuibili a un meccanismo di azione diverso da quello responsabile dell'azione principale. Se tale meccanismo può essere utile per trattare un altro problema terapeutico, il farmaco può diventare il prototipo per l'identificazione di una nuova molecola che agisca esclusivamente con questo meccanismo. Il complesso delle sostanze naturali, d'origine vegetale o animale, è da sempre una fonte preziosa di prototipi e di farmaci. Alcuni, oltre ad avere grande efficacia terapeutica, hanno poi costituito i prototipi per successive modificazioni molecolari, come è successo per la penicillina G che è stata il punto di partenza per tutte le penicilline semisintetiche.
Un metodo praticato diffusamente nella ricerca di prototipi è quello della sperimentazione a tappeto, che può consistere nel provare gli effetti di una molecola su una vasta gamma di modelli farmacologici per individuare eventuali attività terapeutiche (extensive screening), oppure nella sperimentazione di un numero molto grande di molecole su un unico modello farmacologico per individuare il prototipo da sviluppare (random screening). Naturalmente, più consistente è il numero e più diversa la struttura chimica delle molecole che si sottopongono all'analisi farmacologica, più alta è la probabilità di identificare un numero adeguato di prototipi attivi. La risposta a questa necessità è stata la sintesi combinatoriale, una strategia mediante la quale si fa reagire una serie di miscele di reagenti ottenendo una miscela di prodotti, indicata come 'libreria', raccolta in un unico contenitore. Il numero di molecole diverse presenti in ciascuna libreria è derivabile dal calcolo combinatorio. Per esempio, facendo reagire dieci diversi acidi carbossilici con dieci alcoli diversi si otterrà, teoricamente, una libreria di cento esteri diversi. Se esistono una metodica per la valutazione dell'attività biologica di questa miscela e una metodica per individuare il prodotto, o i prodotti, che rendono eventualmente attiva la miscela, si possono trovare in tempi molto rapidi nuovi prototipi. L'industria farmaceutica ha creduto in questa metodica e ha investito ingenti risorse nel suo sviluppo, che è stato esponenziale negli ultimi dieci anni. Sono oggi in via di sviluppo numerose molecole identificate e ottimizzate con questo tipo di approccio.
Le metodiche di progettazione dei farmaci fino a ora illustrate si possono applicare sempre, ma sono particolarmente utili quando manca qualsiasi informazione sull'oggetto biologico che costituisce il bersaglio del farmaco. Fortunatamente, però, i progressi delle scienze di base hanno fatto sì che sempre più frequentemente le informazioni sui geni (genomica) e sulle molecole proteiche (proteomica) di una cellula o di un tessuto abbiano reso nota la causa della patologia e il bersaglio del farmaco da progettare, e che spesso sia nota nei dettagli anche la struttura del bersaglio stesso. Questo rende possibile quella che viene in genere chiamata 'sintesi razionale' di un farmaco, cioè una progettazione a partire dalla conoscenza, più o meno approfondita, dell'oggetto con cui il farmaco deve interagire.
Le procedure che costituiscono la sintesi razionale sono diverse, a seconda che la disposizione nello spazio degli atomi dell'oggetto biologico con cui il farmaco deve interagire sia conosciuta in dettaglio oppure no. Il primo caso è quello in cui la cristallografia a raggi X, la risonanza magnetica o tecniche equivalenti permettono di localizzare nello spazio, con accettabile precisione, gli atomi dell'oggetto biologico. In questa metodica, che è generalmente indicata come progettazione basata sulla struttura (SBDD, Structure based drug design), sono di importanza cruciale i metodi della chimica computazionale e della modellistica molecolare. Nel caso in cui sia conosciuto l'oggetto dell'interazione ma non la sua struttura fine, se sono noti il ligando naturale e altre molecole di sintesi che si legano al sito di azione con affinità variabile, la sintesi razionale può partire dalla struttura delle molecole che si sono dimostrate affini per l'oggetto biologico (LBDD, Ligand based drug design). Questa situazione è frequente nel caso dei recettori, in particolare i recettori di membrana, la cui struttura è risultata finora molto difficile da risolvere.
Un caso particolare ma molto importante di sintesi razionale è quello in cui il ligando naturale o sintetico è di natura peptidica. I prodotti di questo tipo non si prestano a divenire farmaci, a causa della sfavorevole farmacocinetica dovuta alla presenza dei legami peptidici (scarsa biodisponibilità e ridotta stabilità metabolica). In situazioni come queste è altamente desiderabile individuare molecole che abbiano la stessa azione farmacologica ma struttura non peptidica: questi prodotti vengono indicati come 'peptidomimetici'. La progettazione di un peptidomimetico parte usualmente dall'esame della disposizione spaziale dei gruppi caratterizzanti gli amminoacidi che svolgono un ruolo chiave nel processo di interazione. In genere, si tende a mantenere tali gruppi nella stessa disposizione, sostituendo però i legami peptidici con altre strutture chimiche aventi caratteristiche più accettabili dal punto di vista farmacocinetico. Un peptidomimetico individuato a posteriori è la morfina, che si lega ai recettori oppioidi come i due agonisti naturali met-encefalina e leu-encefalina.
Una delle tecniche più recenti, nota come 'ricerca delle relazioni struttura-attività per mezzo di NMR' (Roberts 2000), utilizza la risonanza magnetica nucleare ed è particolarmente adatta a individuare ligandi per proteine delle quali non siano noti la struttura del sito di azione o il ligando naturale, come è il caso della grande maggioranza delle proteine individuate con la genomica e la proteomica. Quando si sono individuate due molecole che si legano in zone vicine della proteina, anche se con affinità molto bassa, si procede a legare opportunamente i due frammenti con un connettore adatto. In genere la nuova molecola avrà un'affinità molto più alta e potrà essere utilmente usata come prototipo. In alcuni casi la giunzione di molecole con affinità micromolare, ma anche millimolare, ha prodotto ligandi con affinità nanomolare.
L'ottimizzazione del prototipo
Una volta individuato un prototipo è necessario migliorarne le caratteristiche farmacologiche e farmacocinetiche che non si ritengono adeguate. Si cerca di raggiungere questo scopo attraverso successive modificazioni molecolari, rese razionali dal fatto che, come già detto, molecole con struttura simile danno in genere lo stesso tipo di risposta biologica. Ai giorni nostri, l'aiuto principale viene dalla modellistica molecolare, che naturalmente è utilizzabile al meglio quando è nota la struttura del sito di azione. L'ottimizzazione dell'interazione con il bersaglio biologico deve considerare anche le conseguenze farmacocinetiche della modulazione.
Un altro approccio largamente usato è la sostituzione isosterica. Il concetto di 'isosteria' ha origini chimico-fisiche, ma è stato utilizzato soprattutto in chimica farmaceutica, evolvendosi fino alla definizione, molto ampia, della 'bioisosteria' (Patani e LaVoie 1996). In breve, una modificazione isosterica è quella che conduce a una variazione molecolare tale che la nuova molecola possa essere sempre riconosciuta dal bersaglio biologico di quella originale. Sono stati così individuati raggruppamenti vicendevolmente sostituibili sulla base delle caratteristiche steriche ed elettroniche, il che permette di prevedere con una certa sicurezza le conseguenze di manipolazioni molecolari fatte secondo questo principio.
La semplificazione molecolare è un metodo di modulazione della struttura che viene utilizzato soprattutto quando si debba operare su prodotti di origine naturale. In genere, tali prodotti ‒ che sono chimicamente complessi ‒ presentano tossicità rilevante e biodisponibilità non ideale. Inoltre, l'esperienza indica che spesso solo una parte della struttura molecolare è necessaria per l'azione biologica (farmacoforo). Il procedimento inverso, quello tendente a complicare la struttura del prototipo, è applicato in modo più esteso del precedente. In genere si basa sul concetto che la complicazione molecolare può condurre a un aumento della specificità di azione, ma anche all'inversione del tipo di azione: per esempio, da agonista ad antagonista. Uno dei modi concettualmente più semplici per aumentare la complessità molecolare, tra i molti disponibili, è quello della omologazione, termine con cui normalmente si intende l'aumento di un atomo di carbonio, ma che può indicare anche un generico incremento del numero di atomi di carbonio di una catena laterale o di un ciclo.
Un altro procedimento molto usato è quello che tende a modificare la libertà conformazionale del prototipo tramite la chiusura o, al contrario, l'apertura di strutture cicliche. La prima è utile per studiare le relazioni tra conformazione e attività biologica; infatti solo una tra le numerose conformazioni possibili di una molecola attiva interagisce con il bersaglio biologico e, pertanto, avere informazioni su di essa è della massima importanza per la progettazione di altri farmaci attivi sullo stesso sito. L'analisi conformazionale non è decisiva in proposito, in quanto non è detto che la conformazione più stabile sia quella attiva, poiché l'energia messa in gioco nel processo di legame può bastare a compensare la maggiore energia di un'altra conformazione meno stabile. Per affrontare questo problema, i chimici farmaceutici usano spesso il sistema di congelare, per via sterica o con l'introduzione di nuovi legami, una conformazione ritenuta importante, andando successivamente a verificare le variazioni nell'azione farmacologica.
L'ibridazione molecolare è un'altra metodologia che tende a riunire in un'unica molecola le caratteristiche strutturali e farmacologiche di due farmaci. Può essere utilizzata per coordinare dal punto di vista farmacocinetico l'azione di due farmaci, ovviando al fatto che questi abbiano farmacocinetiche differenti, non compatibili con la semplice associazione. In questo caso la nuova molecola, una volta giunta sul luogo di azione, è destinata a scindersi ripristinando i due principî attivi. L'ibridazione molecolare può essere utilizzata anche per produrre una nuova molecola non destinata ad alcuna scissione e con proprietà farmacologiche proprie. Questa metodologia è considerata un successo se la nuova molecola presenta, in modo bilanciato, le proprietà farmacologiche di entrambe le molecole ibridate.
Il raddoppiamento molecolare è un altro metodo che viene spesso utilizzato nella manipolazione di un prototipo, esso si basa sull'assunzione che possano venire coinvolti nell'interazione due siti di riconoscimento del bersaglio, anche se, alla luce della struttura spaziale della maggioranza delle molecole biologiche che costituiscono il bersaglio dei farmaci, questa assunzione è spesso errata e sembra più realistico ritenere che i successi ottenuti siano da ascrivere alla casuale intercettazione di siti con caratteristiche di interazione simili a quelle del sito di riconoscimento.
Una delle metodiche usate più frequentemente nell'ottimizzazione di un prototipo è quella della modulazione delle proprietà chimico-fisiche, soprattutto la distribuzione elettronica, la lipofilia e l'ingombro sterico. Modificazioni molecolari di questo tipo sono in grado di modulare sia l'interazione con il bersaglio biologico, sia la farmacocinetica e la tossicità. La modulazione chirale di un prototipo è anch'essa di grande importanza, poiché la struttura tridimensionale è senza dubbio uno dei fattori principali nell'interazione di un farmaco con il suo obiettivo. Infine, non si può trascurare un metodo di modulazione molecolare molto semplice dal punto di vista teorico, ma che alcune volte può risolvere problemi enormi nello sviluppo di un farmaco: si tratta della derivatizzazione molecolare, che consiste nel fare opportuni derivati di funzioni reattive presenti sulla molecola del prototipo, o su quella ottimizzata che presenti ancora problemi, per esempio di solubilità o stabilità chimica e metabolica. Inoltre, prima di concludere va ricordato che, una volta ottimizzata la molecola e iniziato il suo sviluppo, vanno affrontati problemi come la sintesi industriale, la messa a punto di saggi analitici sensibili e riproducibili, la ricerca di un'adatta formulazione e di un'accettabile via di somministrazione, che sono altrettanto impegnativi e importanti per l'esito finale: mettere a disposizione del paziente un farmaco efficace, potente e sicuro.
Bibliografia
Antonenko 2000: Antonenko, Valery V. e altri, Combinatorial chemistry, in: New trends in synthetic medicinal chemistry, edited by Fulvio Gualtieri, Weinheim-Chichester, Wiley-VCH, 2000, pp. 39-80.
Ehrlich 1913: Ehrlich, Paul, Address in pathology on chemotherapeutics, scientific principles, methods and results, "Lancet", 2, 1913, pp. 445-451.
Fernandes 2001: Fernandes, Prabhavathi B., Back to basic: from genes to medicines, "Medicinal chemistry research", 10, 2001, pp. 421-430.
Gualtieri 1996: Gualtieri, Fulvio - Romanelli, Maria Novella - Teodori, Elisabetta, The 'frozen analog' approach in medicinal chemistry, in: Progress in medicinal chemistry, edited by Muhammad Iqbal Choudhary, Amsterdam, Harwood Academic, 1996, pp. 271-318.
Gualtieri 1997: Gualtieri, Fulvio - Romanelli, Maria Novella - Teodori, Elisabetta, Disegno e sintesi di farmaci e mezzi di indagine farmacologica, Bologna, CLUEB, 1997.
Li 2001: Li, Albert P., Screening for human ADME/Tox drug properties in drug discovery, "Drug discovery today", 6, 2001, pp. 357-366.
Patani, LaVoie 1996: Patani, George A. - LaVoie, Edmond J., Bioisosterism: a rational approach in drug design, "Chemical reviews", 96, 1996, pp. 3147-3176.
Roberts 2000: Roberts, Gordon C.K., Applications of NMR in drug discovery, "Drug discovery today", 5, 2000, pp. 230-240.
Smith 2001: Smith, Dennis A. - Van de Waterbeemd, Han - Walker, Don K., Pharmacokinetics and metabolism in drug design, Weinheim-Chichester, Wiley-VCH, 2001.
Williams, Lemke 2002: Williams, David A. - Lemke, Thomas L., Foye's principles of medicinal chemistry, 5. ed., Philadelphia, Lippincot Williams & Wilkins, 2002.