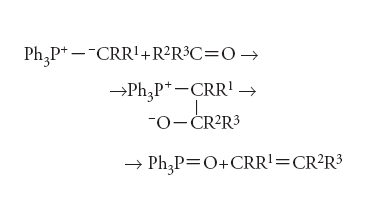reazione di Wittig
reazione di Wittig
Reazione organica che, con la sua successiva estensione che va sotto il nome di reazione di Wittig-Horner, rappresenta uno dei metodi più generali per preparare le olefine. Essa consiste nell’impiego di ilidi del fosforo, che possono essere preparate a partire da adatti sali di alchiltrifenilfosfonio, a loro volta facilmente ottenibili da trifenilfosfina e alogenuri alchilici. I sali di fosfonio vengono deprotonati mediante impiego di basi forti come il butillitio. I composti ilidici così ricavati reagiscono prontamente con aldeidi e chetoni per dare composti di addizione, che vengono deossigenati dal fosforo con formazione di ossido di trifenilfosfina e concomitante liberazione dell’olefina essenzialmente in forma cis:
Per ottenere la forma trans si può ricorrere alla variante di Schlosser, consistente nell’uso di fenillitio a bassa temperatura per trasformare l’intermedio betainico (contenente le due cariche separate) indicato nell’equazione, dalla forma eritro a quella treo. La reazione di Wittig-Corner rappresenta una semplificazione della Wittig originaria in quanto il gruppo trifenilfosfinico viene rimpiazzato da un estere fosforico più facilmente accessibile e l’ilide può essere generata anche con basi come gli alcolati alcalini. La stereochimica del doppio legame è trans. La reazione di Wittig (o di Wittig-Horner) è largamente usata nella sintesi organica per introdurre doppi legami e prolungare catene alifatiche, per es. nella vitamina A, e per introdurre il gruppo metilenico (da metilentrifenilfosforano) al posto di un gruppo carbonilico.