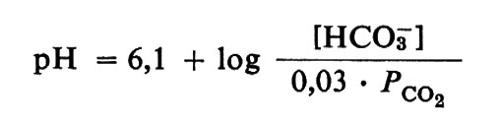Regolazione dell'equilibrio acido-base
Regolazione dell'equilibrio acido-base
di James R. Robinson
Regolazione dell'equilibrio acido-base
sommario: 1. Introduzione. 2. Definizioni preliminari. a) Acidi e basi. b) Il pH delle soluzioni. 3. Tamponi. a) Definizioni e funzionamento. b) Le equazioni di Henderson e di Henderson-Hasselbalch. 4. Il pH effettivo dei liquidi extracellulari dei Mammiferi. a) Il sistema tampone predominante. b) Importanza dei tamponi nell'evoluzione delle forme viventi. c) Il pH nel plasma sanguigno dei Mammiferi. 5. Controllo respiratorio della reazione. a) Regolazione neuronale della ventilazione polmonare. b) La reazione del liquido cerebrospinale. 6. Controllo renale della reazione. a) Produzione di acidi. b) Tamponamento. c) Escrezione renale degli acidi. d) Ripristino dei tamponi. 7. Il pH intracellulare. 8. Temperatura e regolazione della reazione. 9. Considerazioni conclusive. □ Bibliografia.
1. Introduzione
Uno dei grandi principi unificatori che la fisiologia ereditò dal XIX secolo fu il concetto, dovuto a Claude Bernard, di milieu intérieur, l'ambiente interno costante che protegge le cellule di un animale superiore dai mutamenti di un ambiente esterno variabile, in maniera da assicurare loro un costante rifornimento di sostanze nutritizie e di ossigeno e una temperatura costante e ottimale, anche se si verificano dei cambiamenti nell'attività dell'organismo, nell'assunzione (approvvigionamento) di cibo e nelle condizioni ambientali. Bernard (v., 1878-1879) intuì chiaramente che un ambiente costante, moderato, equilibrato e stabile, in cui le cellule potessero vivere, era la condizione essenziale per l'esistenza indipendente dei grandi animali multicellulari e, anzi, per la specializzazione e lo sviluppo che permisero il sorgere dell'umanità. Barcroft (v., 1934, p. 368), nella prima metà del XX secolo, espresse la dottrina di Bernard in modo pittoresco: "Cercare un elevato sviluppo intellettuale in un ambiente le cui proprietà non sono divenute stabili è come cercare la musica nel crepitio di una radio rudimentale oppure lo schema ritmico delle onde sulla superficie dell'Atlantico in tempesta".
Tra le proprietà necessariamente costanti dell'ambiente interno di Bernard, e la prima che Barcroft prese in esame, è la ‛reazione', o acidità, o concentrazione degli ioni idrogeno. Gli esseri viventi sono composti per la maggior parte di acqua. Essi ottengono l'energia necessaria ai numerosi processi che rendono possibile la loro vita da reazioni chimiche che avvengono o in soluzione acquosa o a livello di interfacie o membrane che sono zone di discontinuità tra le fasi acquosa e non acquosa. Per di più, la liberazione di energia in forme utilizzabili per sopperire alle necessità delle cellule e i processi chimici che sintetizzano o modificano le sostanze di cui sono composte le cellule, o che sono da queste utilizzate, dipendono da complicate sequenze di interazioni chimiche ordinate, che devono essere integrate e controllate con precisione. Queste reazioni chimiche possono avvenire a temperature ordinarie (cioè, temperature adatte agli animali e alle quali l'acqua è allo stato liquido, ma non tanto calda da denaturare le proteine) grazie all'azione catalitica degli enzimi, catalizzatori organici che sono essi stessi proteine specifiche. Le caratteristiche strutturali dalle quali dipendono le proprietà catalitiche degli enzimi, e spesso la loro capacità di combinarsi con le molecole di cui essi catalizzano le reazioni, dipendono a loro volta dalla distribuzione delle loro cariche ioniche. La maggior parte degli enzimi è sensibile alla reazione (acidità o alcalinità) della fase in cui sono disciolti o con la quale sono in contatto. Ogni enzima ha una sua concentrazione ottimale di ioni idrogeno alla quale presenta la massima attività; e poiché enzimi differenti hanno differenti concentrazioni idrogenioniche ottimali, le variazioni dell'acidità influenzano le velocità relative dei processi chimici catalizzati dalle centinaia di enzimi presenti in un organismo vivente (v. enzimi). Modificazioni delle velocità delle singole reazioni chimiche possono fino a un certo grado essere contrastate da variazioni nelle concentrazioni delle sostanze che reagiscono ma, per usare le parole di L. J. Henderson (v., 1913, p. 317), ‟l'influenza esercitata da acidità e alcalinità su molti processi chimici supera quella di tutte le altre condizioni, comprese la temperatura e la concentrazione dei reagenti". Sembrerebbe dunque che vi sia un notevole vantaggio nel rendere stabile l'acidità del contenuto delle cellule viventi.
Prima di procedere a un'analisi più dettagliata di questa proprietà e del modo in cui essa viene resa stabile, può essere utile mettere in evidenza il cambiamento di approccio che è forse la caratteristica essenziale della fisiologia del nostro secolo e in parte tende verso la fisiologia del XXI secolo. Bernard trattò e osservò gli organismi animali come un tutto unico. I suoi scritti appaiono ancora freschi alla lettura e, sotto molti aspetti, attuali, ma in generale egli dava per scontato il concetto che la cellula, con le sue proprietà, fosse l'unità elementare della materia vivente, un po' come i chimici del XIX secolo accettavano gli atomi come entità intere e indivisibili. Quando Bernard parlava di milieu intérieur, intendeva il mezzo liquido che si trova nell'organismo ma ‛al di fuori' delle cellule, che le bagna e che viene incontro alle loro necessità, portando loro sostanze nutritive e ossigeno, e allontanando i prodotti di rifiuto della loro attività. I fisici e i chimici di questo secolo hanno spezzato l'atomo e cercato la spiegazione delle sue proprietà nelle entità più piccole che lo compongono. Anche i fisiologi hanno osservato l'interno della cellula vivente e hanno cominciato a comprenderne le proprietà e le funzioni analizzandone l'anatomia submicroscopica e l'ultrastruttura degli organuli. I biochimici sono andati ancora oltre, osservando il comportamento delle strutture subcellulari a un livello molecolare, e la cosiddetta ‛biologia molecolare' è divenuta di moda nell'ultimo terzo del XX secolo. In termini attuali, il vero milieu intérieur non è tanto il liquido dell'organismo che bagna le cellule, quanto il liquido che si trova ‛dentro' le cellule e bagna gli organuli subcellulari, le macromolecole e gli enzimi che sono preposti alle trasformazioni di materia e di energia dalle quali in ultima analisi dipende la vita. Ci è nota non tanto la reazione del contenuto cellulare quanto quella del liquido extracellulare, ben più omogeneo. In effetti, il contenuto delle cellule è così eterogeneo che la sua reazione non può essere definita allo stesso modo di quella di un'unica soluzione. Tuttavia, sembra un'estensione pienamente ragionevole del concetto di Bernard dire che la stabilità del milieu intérieur - inteso in senso ottocentesco, cioè interno all'animale ma esterno alle sue cellule - acquista ora una nuova importanza, in quanto è alla base dei meccanismi, noti ancora in modo molto incompleto, che controllano la composizione di quell'ambiente interno più intimo, interno alla cellula, che è la vera matrice della vita. E. D. Robin (v. Robin e Bromberg, 1959) lo chiamò ‛ambiente interno interno', per contraddistinguerlo dall'‛ambiente interno esterno', che è il milieu intérieur di Bernard. In questo secolo sono state fatte molte scoperte riguardo ai meccanisini che mantengono costante la composizione dell'ambiente interno esterno. Questi meccanismi ‛omeostatici', come li chiamò W. B. Cannon (v., 1929), formano una parte sostanziale degli studi fisiologici. Ma stiamo appena cominciando ad apprendere qualcosa sui meccanismi che controllano il volume e la composizione dell'ambiente interno interno.
Gli sviluppi delle tecniche di misura hanno avuto un ruolo importante nel rapido progresso, nella seconda metà del XX secolo, delle conoscenze sulla regolazione del metabolismo acido-base. I pionieri che posero le fondamenta delle nostre conoscenze, al volgere del secolo, dovevano usare metodi lunghi e che richiedevano notevoli quantità di sangue. D. D. Van Slyke, uno dei pionieri, il cui metodo per l'analisi dei gas del sangue è stato usato in tutto il mondo, riassunse la storia di tali tecniche in una conferenza tenuta all'Accademia delle Scienze di New York nel 1964, cercando di stabilire un accordo sulle definizioni e sui metodi (v. Van Slyke, 1966). Durante il primo terzo del secolo furono messi a punto dei micrometodi, che resero possibile, negli anni trenta, misurare il pH, la concentrazione di CO2 e il volume delle cellule in un unico campione di sangue di 0,1 ml. Verso la metà degli anni cinquanta, T. A. Astrup in Danimarca (da dove provenivano anche S. P. L. Sørensen e J. N. Brønsted) mise a punto un micrometodo per dosare il pH e la concentrazione di CO2 nel sangue così rapido da poter essere eseguito al capezzale del paziente, e che è stato di grande aiuto nel trattamento clinico dei disturbi dell'equilibrio acido-base, particolarmente nei bambini.
2. Definizioni preliminari
a) Acidi e basi
L'acqua, come si è detto, è, in peso, il principale costituente dei sistemi viventi. Tutti, o quasi tutti, i processi essenziali della vita hanno luogo nell'acqua o a contatto con essa. Gli acidi e le basi possono essere trattati indipendentemente dall'acqua, ma la chimica acido-base dei sistemi non acquosi non ha grande importanza in biologia. Il concetto di acido e base nelle soluzioni acquose, che fu sviluppato nel 1923 da Th. M. Lowry in Inghilterra e da J. N. Brønsted in Danimarca, è ancora quello che meglio si adatta a una trattazione degli acidi e delle basi in fisiologia. Secondo questo concetto, un acido è una molecola o uno ione che ha tendenza a liberare un protone, o ione idrogeno (carico positivamente); una base è invece una molecola o uno ione che ha la tendenza complementare, cioè quella di catturare un protone. Dato che questo processo è reversibile e il protone può essere nuovamente liberato, la base che ha catturato un protone diviene un acido. Nell'equazione
HB ⇄ H+ + B-
HB è l'acido e B- è chiamata la sua ‛base coniugata', cioè la base formata da HB per perdita di un protone, o che, catturando un protone, diviene l'‛acido coniugato' HB. Quanto più prontamente HB libererà un protone, tanto meno prontamente B- ne catturerà uno: perciò, tanto più forte è un acido, tanto più debole sarà la sua base coniugata; le basi forti, cioè quelle che più avidamente catturano protoni, sono le basi coniugate di acidi deboli.
A rigore, la definizione data sopra è incompleta; un acido dovrebbe essere definito come una specie chimica che cederà un protone 'al solvente', nel nostro contesto l'acqua. La ionizzazione dell'acido HB in acqua dovrebbe essere allora descritta dall'equazione
HB + H2O ⇄ H3O+ + B-.
H3O+ rappresenta il protone idratato: questa rappresentazione è più aderente alla realtà, poiché i protoni non possono esistere liberi nell'acqua. Nel formare un protone idratato, detto ione idronio o idrossonio, l'acqua ha funzionato da base, quantunque debole, così che l'acido coniugato H3O+ agisce come un acido forte che cederà prontamente il suo protone a qualunque base più forte dell'acqua. Nella nostra esposizione tale precisazione sarà trascurata e, seguendo l'uso comune, il protone in soluzione, anche se idratato, verrà indicato semplicemente come uno ione idrogeno e rappresentato col simbolo H+.
L'acqua distillata si dissocia in proporzioni piccolissime per formare ioni idrogeno H+ e ioni idrossido OH-:
H2O ⇄ H+ + OH-.
Più rigorosamente si dovrebbe scrivere:
2H2O ⇄ H3O+ + OH-,
equazione che descrive quella che talvolta è chiamata ‛autoprotolisi dell'acqua'. Ancora una volta useremo la forma più semplice, notando che l'acqua si comporta come un acido molto debole che forma una piccolissima quantità della base forte coniugata OH-. L'acqua è effettivamente sia un acido debolissimo (con base forte coniugata OH-) sia una base debolissima (con acido forte coniugato H3O+ o H+). A 25 °C, circa una molecola su 550.000.000 è dissociata, dando concentrazioni di OH- H+ allo stesso tempo molto piccole (10-7 equivalenti ‧ 1-1 o moli ‧ 1-1) e uguali. Proprio il fatto che siano uguali fa si che l'acqua distillata abbia una reazione neutra. Le soluzioni acquose hanno reazione acida quando un dato volume contiene più ioni H+ che ioni OH-, e alcalina quando contiene più ioni OH- che ioni H+. Il prodotto [H+] [OH-] (le parentesi quadre indicano le concentrazioni) è costante a una data temperatura, per cui la reazione di una soluzione acquosa può essere specificata adeguatamente indicando solo una di queste concentrazioni, generalmente quella degli ioni idrogeno, [H+], talora indicata con c H: il c H nell'acqua distillata a 25 °C è pari a 10-7 mol ‧ 1-1. La maggior parte dei liquidi biologici sono pressoché neutri e talvolta si evita di scrivere numeri molto piccoli introducendo l'unità nanomol ‧ 1-1 = 10-9 mol ‧ 1-1. Usando tali unità, la concentrazione degli ioni idrogeno nell'acqua distillata a 25 °C è 100 nmol ‧ 1-1 o 100 nM.
b) Il pH delle soluzioni
L'acidità delle soluzioni viene spesso espressa nelle cosiddette unità di pH. Questa unità venne introdotta da Sørensen nel 1909 come il logaritmo (in base 10) del reciproco della concentrazione molare degli ioni idrogeno. Perciò l'acqua distillata a 25 °C, con c H = 10-7 mol ‧ 1-1, ha pH = 7,0; pH 6 corrisponde a una soluzione più acida, con c H dieci volte più grande, cioè 10-6 mol ‧ 1-1. Ci si può raffigurare il pH come il logaritmo della ‛diluizione' degli ioni idrogeno in una soluzione, cioè come il logaritmo del volume in litri che contiene 1 grammoione H+. Ma la relazione con la concentrazione non è rigorosa, perché il pH viene generalmente misurato per mezzo del potenziale sviluppato a un elettrodo sensibile agli ioni idrogeno, ed è perciò un indice dell'attività degli ioni idrogeno, aH+, piuttosto che della loro concentrazione. Tuttavia è usuale, e forse non troppo impreciso nel caso di soluzioni diluite come lo sono i liquidi dell'organismo, porre il coefficiente di attività eguale a 1,0 e tradurre i valori misurati di pH nei corrispondenti valori di cH, come se gli elettrodi sensibili agli ioni idrogeno misurassero effettivamente la concentrazione di questi. Negli ultimi anni c'è stata la tendenza ad abbandonare la notazione pH nel campo della fisiologia, poiché la relazione tra il pH e la concentrazione degli ioni idrogeno è inversa e non lineare. Rimane il fatto che è il pH a essere effettivamente misurato, che a rigore il c H non può essere dedotto dal pH misurato e che l'efficacia chimica degli ioni mostra comunque una relazione logaritmica anziché lineare con la loro concentrazione (v. Waddell e Bates, 1969). Il pH non è molto meno conveniente del cH, e ha basi termodinamiche più solide; talvolta può essere utile esprimere i risultati in entrambe le unità.
Il piccolo grado di dissociazione dell'acqua distillata cresce col crescere della temperatura, facendo così aumentare la concentrazione degli ioni idrogeno. Dal momento che la concentrazione degli ioni idrossido aumenta anch'essa nella stessa identica proporzione, l'acqua a temperatura più elevata ha ancora reazione neutra, sebbene la sua concentrazione di ioni idrogeno sia più alta che nell'acqua distillata a temperatura più bassa. Il pH corrispondente al punto neutro è pertanto influenzato dalla temperatura. Nelle soluzioni acquose a 38 °C, cioè alla temperatura corporea dei Mammiferi, il prodotto [H+] ‧ [OH-] aumenta da 10-14, che è il suo valore a 25 °C, fino a 10-13,6. Quindi, mentre nell'acqua distillata a 25 °C [H+] = [OH-] = 10-7, così che c H è 10-7 mol ‧ 1-1 o 100 nM e pH = 7,0, alla temperatura corporea [H+] = [OH-] = 10-6,8 e il punto neutro è pertanto indicato da pH = 6,8, corrispondente a un c H di 1,6 ‧ 10-7 mol ‧ 1-1 o 160 nM. A temperature vicine al punto di congelamento dell'acqua, alle quali [H+] ‧ [OH-] = 10-14.8, una soluzione a pH 7,4 non è alcalina ma neutra.
I liquidi dell'organismo dei Mammiferi vengono mantenuti a una reazione leggermente ma nettamente alcalina: con un pH molto vicino a 7,4, a 38 °C, che corrisponde a un valore di c H di 40 nM, cioè esattamente 1/4 della concentrazione di ioni idrogeno richiesta per la neutralità. Tale reazione ‟blandamente alcalina", come la definì il Pitts (v., 1952-1953), è essenziale per un normale funzionamento. Le variazioni compatibili con uno stato ottimale di salute, nell'uomo, sono tra circa 7,36 e 7,44 in unità di pH, tra 44 e 36 nM in cH, cioè entro un ambito del 10% da una parte e dall'altra del valore normale medio di cH. Il sistema neuromuscolare è particolarmente sensibile a tali variazioni. L'alcalinità aumenta l'irritabilità dei nervi periferici, il che può portare a crampi e a tremori tetanici o a convulsioni, mentre un aumento dell'acidità comporta una diminuzione dell'irritabilità dei nervi e dei muscoli e un obnubilamento della coscienza che può arrivare fino al coma. I limiti estremi per la sopravvivenza non sono precisamente definiti, ma probabilmente non sono lontani da pH 7,0 e 7,8, corrispondenti a c H pari a 100 e 16 nM, cioè 2 volte e mezzo e 2/5 della normale concentrazione degli ioni idrogeno. Questo ambito abbastanza ampio illustra come la scala del pH non evidenzi chiaramente il valore assoluto delle concentrazioni e faccia sì che le cellule sembrino più sensibili a variazioni della reazione di quanto, per fortuna, non siano in effetti.
3. Tamponi
a) Definizioni e funzionamento
La reazione di una soluzione dipende dall'equilibrio tra acidi e basi in essa contenuti. Gli acidi tendono a cedere protoni, aumentando la concentrazione degli ioni H+ e pertanto abbassando la concentrazione degli ioni OH- il pH. Le basi tendono ad acquistare ioni H+ e quindi ad abbassarne la concentrazione e ad alzare il pH. Pertanto, in animali a temperatura corporea costante, la reazione dei liquidi dell'organismo dev'essere controllata manipolando gli acidi e le basi che vi si trovano. La base più frequente nei liquidi extracellulari dell'organismo animale è il cloruro, Cl-, che è la base coniugata di un acido molto forte, HCl, e una base di gran lunga troppo debole per contribuire in qualche modo alla leggera alcalinità del plasma e dei liquidi extracellulari. Questa funzione è assolta da una serie di basi più forti, la più importante delle quali è lo ione idrogenocarbonato o bicarbonato, HCO3-, base coniugata di un acido relativamente debole, H2CO3. Le cellule contengono proteine ed esteri fosforici organici che funzionano anch'essi da basi. Nel sangue, l'emoglobina contenuta negli eritrociti è la base più importante dopo il bicarbonato; il plasma contiene le proteine plasmatiche e concentrazioni più piccole, quasi trascurabili, di altre basi, la più importante delle quali è lo ione idrogenofosfato HPO42-. Tutte queste basi catturano ioni H+ e aumentano il pH del sangue e degli altri liquidi dell'organismo secondo le equazioni:
HCO3- + H+ ⇄ H2CO3 (⇄ H2O + CO2)
protn- + H+ ⇄ Hprot(n-1)-
HPO42- + H+ ⇄ H2PO4-.
Queste e altre basi, che contribuiscono a rendere stabile la blanda alcalinità dei liquidi dell'organismo assorbendo ioni idrogeno, sono note come ‛basi-tampone'. La loro azione di tamponamento degli ioni H+ può essere riassunta nell'equazione schematica:
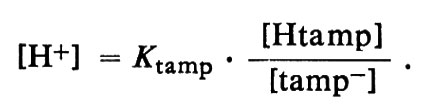
tamp- + H+ ⇄ Htamp.
È estremamente importante che questa equazione sia reversibile. La proprietà essenziale di una base-tampone fisiologica è che il suo acido coniugato sia così debole che la ionizzazione dell'acido possa essere impedita aumentando la concentrazione degli ioni idrogeno entro l'ambito in cui i liquidi dell'organismo devono essere stabilizzati. Pertanto, se per l'immissione di un acido forte i liquidi dell'organismo tendono a divenire acidi, le basi-tampone acquistano ioni H+ e l'acido forte è in effetti sostituito da acidi molto più deboli, coniugati delle basi-tampone. Se invece i liquidi dell'organismo tendono a divenire alcalini, la diminuita [H+] favorisce la dissociazione degli acidi-tampone che forniscono ioni H+ in modo da impedire un innalzamento del pH. Un sistema tampone è costituito da un acido piuttosto debole e dalla sua base coniugata relativamente forte, che dovrebbero preferibilmente essere presenti in concentrazioni non molto diverse. Il sistema tampone rende stabile il pH di una soluzione, perché l'acido-tampone può fornire ioni H+ se la soluzione tende a divenire alcalina, e la base-tampone può assumere ioni H+ da qualsiasi acido forte aggiunto. Naturalmente, la protezione più efficace contro i cambiamenti in entrambi i sensi si ha quando le concentrazioni della base-tampone e del suo acido coniugato sono uguali.
b) Le equazioni di Henderson e di Henderson-Hasselbalch
Il valore effettivo del c H o del pH al quale un sistema tampone può assicurare stabilità dipende dalla forza dell'acido-tampone. La relazione precisa fu ricavata da L. J. Henderson (v., 1909), professore di chimica biologica all'Università di Harvard, che la espresse nella forma di un'equazione semplificata, approssimata, nota tuttora come equazione di Henderson, che ora possiamo scrivere:
Per un acido-tampone, Htamp, essa diviene:
Ka è una costante caratteristica di ogni acido ed è una misura della sua forza, cioè della sua tendenza a dissociarsi in ioni H+ e nella base coniugata, come appare chiaro dalle seguenti considerazioni. Htamp si ionizza per formare quantità uguali di ioni H+ e tamp-, come descritto dallo schema di reazione reversibile:
Htamp ⇄ H+ + tamp-.
Secondo la legge dell'azione di massa, le velocità delle reazioni in un senso e nell'altro saranno
verso destra: kv. destra ‧ [Htamp],
verso sinistra: kv. sinistra ‧ [H+][tamp-],
dove le k sono costanti di velocità. All'equilibrio, le velocità delle reazioni verso destra e verso sinistra devono essere uguali, e si ha:
kv. destra ‧ [Htampl = kv. sinistra ‧ [H+][tamp-],
da cui
Si vede così che la Ka di Henderson è il rapporto delle costanti di velocità per la dissociazione dell'acido e per la ricombinazione degli ioni; e questo è chiaramente una misura della forza dell'acido.
I calcoli con l'equazione di Henderson erano un po' complessi; pertanto, dopo che Sørensen ebbe introdotto la notazione di pH, Hasselbalch (v., 1916) dette all'equazione di Henderson forma logaritmica, più facile da usare, definendo pKa, per analogia con pH, come il logaritmo del reciproco della costante di dissociazione dell'acido, Ka. La trasformazione si esegue facilmente attraverso i seguenti passaggi:
Questa formula è ben nota come equazione di Henderson-Hasselbalch. Sebbene, a rigore, si dovrebbero usare ovunque le attività invece delle concentrazioni, essa è una guida per prevedere l'azione dei tamponi e per comprendere la regolazione fisiologica della reazione nei liquidi dell'organismo. Ulteriori dettagli sulla sua storia e derivazione si trovano nell'Appendice 2 di Principles of renal physiology di H. W. Smith (v., 1956) e anche in una rassegna dettagliata e veramente chiarificatrice della regolazione dell'equilibrio acido-base di Winters e Dell (v., 1965).
Si può notare che il pK come misura della forza di un acido mostra una similitudine formale con il pH come misura dell'acidità di una soluzione. Entrambi sono correlati inversamente e logaritmicamente al valore delle grandezze che misurano. Più forte è l'acido, più piccolo il suo pKa. Un'interpretazione fisica del pKa si ottiene molto facilmente mescolando in concentrazioni uguali un acido e la sua base coniugata, oppure neutralizzando l'acido a metà con l'aggiunta della metà di una quantità equivalente di una base forte, come NaOH. Allora [tamp-]/[Htamp] = 1,0 e il suo logaritmo è zero, per cui pH = pKa; pKa è dunque il pH di una soluzione in cui l'acido sia per metà neutralizzato.
4. Il pH effettivo dei liquidi extracellulari dei Mammiferi
a) Il sistema tampone predominante
L'equazione di Henderson-Hasselbalch può essere usata sia per calcolare il valore effettivo della concentrazione degli ioni idrogeno nei liquidi extracellulari dell'organismo dei Mammiferi, sia per mostrare come tale valore può essere stabilizzato e regolato. Il sistema tampone predominante è la coppia coniugata bicarbonato/acido carbonico. L'acido carbonico, H2CO3, è un acido debole, ma non così debole come sembra, poiché il diossido di carbonio o anidride carbonica, CO2, in soluzione acquosa è così scarsamente idratato che la concentrazione effettiva di H2CO3 nella soluzione corrisponde a meno dell'1% della quantità di CO2 presente. Il valore preciso della frazione che si trova in combinazione con l'acqua non è del tutto certo ma, dal momento che tutto il diossido di carbonio rimanente si combina con l'acqua per sostituire l'acido carbonico che viene eliminato durante il processo di titolazione della soluzione, per esempio con NaOH, la quantità di acido carbonico determinato per titolazione corrisponderà al diossido di carbonio totale presente. Pertanto si suole trattare una soluzione di diossido di carbonio come se questo fosse tutto presente come acido carbonico, cioè come se si trattasse di una soluzione molto più concentrata di un acido molto più debole. Una soluzione di CO2 in acqua si comporta perciò come una soluzione di un acido con un pKa, apparente di 6,3 a 38 °C, mentre la concentrazione effettiva di H2CO3 è forse circa 300 volte inferiore; invece, il pKa della specie molecolare H2CO3 è 3,8, cioè inferiore di 2,5 unità, o log 300 (che rappresenta il pK di idratazione del CO2), al pKa apparente di 6,3 usato presumendo che tutto il CO2 sia presente come H2CO3. Il fatto che l'acido carbonico sia in effetti un acido relativamente forte, con un pKa inferiore a 4, spiega perché l'acetato di sodio ha odore di acido acetico; l'atmosfera contiene diossido di carbonio e acqua, ma se l'acido carbonico avesse un pKa superiore a 6, non riuscirebbe a spostare sensibilmente l'acido acetico (pKa, 4,8), mentre un acido con un pKa di 3,8 può facilmente decomporre l'acetato di sodio.
La solubilità del diossido di carbonio nel plasma umano a 38 °C è circa 0,03 mmol ‧ 1-1 per ogni torr di pressione parziale di CO2. Il meccanismo respiratorio mantiene una tensione di CO2 vicina a 40 torr in condizioni normali a riposo, a livello del mare, per cui il plasma contiene 40 ‧ 0,03 = 1,2 mmol ‧ 1-1 di diossido di carbonio, che viene considerato come un ‛acido carbonico' molto debole. Poiché il plasma non è acqua distillata ma contiene altri ioni in soluzione, il valore del pKa viene abbassato: il pKa dell'acido carbonico nel plasma a 38 °C è pertanto 6,1. Come verrà spiegato in seguito, i reni riforniscono continuamente il plasma di bicarbonato, oltre che di ioni sodio riassorbiti dal filtrato glomerulare. Essi mantengono normalmente la concentrazione totale degli anioni diversi dal bicarbonato (soprattutto Cl-) a un valore di circa 24 milliequivalenti per litro inferiore a quello della concentrazione totale dei cationi (Na+ + K+ + Ca2+ + Mg2+), di modo che la concentrazione del bicarbonato viene normalmente mantenuta intorno ai 24 meq ‧ 1-1. Date queste concentrazioni, l'equazione di Henderson-Hasselbalch scritta per la coppia bicarbonato/acido carbonico nel plasma a 38 °C, e cioè
prevede che sia pH = 6,1 + log (24/1,2) = 6,1 + log 20 = 6,1 + 1,3 = 7,4. Ovviamente esistono altre coppie tampone nel plasma oltre a quella bicarbonato/acido carbonico, ma questo non invalida l'uso, per i calcoli, della coppia tampone predominante. Una soluzione, per quante coppie tampone possa contenere, può avere una sola concentrazione di ioni idrogeno. Il rapporto di tamponamento di una qualunque coppia determina il rapporto di tutte le altre coppie tampone della soluzione in base a quello che è talvolta chiamato ‛principio isoidrico'. Tutte queste coppie devono infatti assumere rapporti di concentrazione che obbediscano all'equazione di Henderson-Hasselbalch per i loro singoli valori di pKa e per il pH prevalente. Se si indica con [tampi-/[Htampi] il rapporto fra concentrazione della base coniugata e concentrazione dell'acido coniugato (‛rapporto di tamponamento') di una qualunque coppia tampone che non sia il bicarbonato, si può vedere che, aggiungendo bicarbonato al plasma per renderlo più alcalino, tutti gli altri rapporti di tamponamento [tampi-/[Htampi] devono aumentare al pari di [HCO3-]/[H2CO3], e anzi devono aumentare nella stessa proporzione, poiché i loro logaritmi devono aumentare della stessa quantità. Parte del bicarbonato aggiunto alla soluzione contribuisce in effetti all'aumento dei rapporti di tamponamento di altre coppie per mezzo delle reazioni:
Htampi + HCO3- ⇄tampi- + H2CO3 (⇄ CO2 + H2O).
Il bicarbonato è pertanto il principale tampone del sangue e degli altri liquidi dell'organismo, non solo perché vi è presente in più alta concentrazione, ma anche perché può essere usato per rigenerare altre basi-tampone dai loro acidi coniugati. Per di più, il bicarbonato è disponibile in quantità pressoché illimitata, poiché deriva dalla ionizzazione dell'acido carbonico, formato per idratazione del diossido di carbonio prodotto dalle ossidazioni nelle cellule. Nello stesso modo dell'adenosintrifosfato (ATP), che sembra essere la moneta corrente universale per la maggior parte delle operazioni che implicano energia biologica, il bicarbonato è una moneta corrente universale per le operazioni che implicano i tamponi. Come si sia creata tale situazione è un problema interessante, riguardo al quale sono state avanzate in questo secolo diverse ipotesi, due delle quali saranno qui ricordate.
b) Importanza dei tamponi nell'evoluzione delle forme viventi
Nel secolo scorso Ch. Darwin concepì l'idoneità di un animale a vivere nel suo ambiente come uno dei principali fattori per la sopravvivenza degli individui e per la selezione di caratteri che portarono alla differenziazione di specie distinte. Nel 1913 L. J. Henderson pubblicò un importantissimo libro intitolato The fitness of the environment, in cui prese in considerazione tutto ciò che l'ambiente fisico-chimico aveva dovuto fornire per costituire il substrato adatto alla comparsa della vita e allo sviluppo e all'evoluzione dei sistemi viventi. Egli trattò ampiamente della particolare idoneità dell'acqua a divenire l'habitat e il componente principale, come massa, delle cellule viventi - la matrice di tutte le attività molecolari che caratterizzano la vita. Egli notò anche che il diossido di carbonio, che è l'anidride di un acido e quindi anche la sorgente di un'importantissima base-tampone, è quasi l'unico tra i gas ad avere una solubilità tale da essere distribuito uniformemente tra aria e acqua. ‟Perciò le acque non possono mai eliminare tutto l'acido carbonico dall'aria, né l'aria può sottrarlo alle acque. Esso è l'unica sostanza, pertanto, che accompagna sempre l'acqua in proporzioni considerevoli rispetto alla sua quantità totale. Nella terra, nell'aria, nel fuoco e nell'acqua in ugual modo queste due sostanze sono sempre associate".
Tuttavia, Robin, Bromberg e Cross (v., 1969), in un'indagine più recente, hanno fatto notare che il bicarbonato, sebbene attualmente sia il principale sistema tampone biologico, non può essere stato il primo. Si ritiene che l'atmosfera primitiva della Terra fosse a carattere riducente (si veda, per esempio, il libro di Bernal sulle origini della vita, 1967; v. anche biofisica), e che le forme primitive di vita dipendessero da fonti di energia a carattere anaerobico. Solo dopo lo sviluppo delle forme fotosintetiche in quantità sufficienti a produrre un'atmosfera ricca di ossigeno (forse a partire da 2,7 ‧ 109 anni fa) divennero di primaria importanza le vie metaboliche che utilizzano l'ossigeno e hanno il diossido di carbonio come prodotto terminale. Quando, parecchio tempo dopo, forse 600 ‧ 106 anni fa, cominciarono ad apparire i Vertebrati, le forme primitive vivevano nell'acqua, così che il CO2 che esse producevano veniva allontanato molto facilmente per diffusione, e la sua pressione parziale nei liquidi dell'organismo rimaneva bassa, forse meno di 5 torr. Essi non richiedevano dunque - anzi, non le potevano tollerare senza divenire troppo alcalini - concentrazioni apprezzabili di bicarbonato, per cui i loro tamponi principali erano probabilmente le proteine e altri anioni organici piuttosto che il bicarbonato. Le condizioni mutarono con la colonizzazione della terraferma e con la trasformazione delle branchie in polmoni. L'aria contiene molto più ossigeno dell'acqua, ma i polmoni rimuovono il diossido di carbonio meno efficacemente delle branchie. Di conseguenza, i liquidi dell'organismo dei Vertebrati terrestri si adattarono a pressioni parziali di CO2 più elevate ed ebbero bisogno di concentrazioni di bicarbonato più elevate per conservare la loro blanda alcalinità. Il pH, che si era stabilizzato su valori leggermente alcalini con l'aiuto dei tamponi proteici, venne tuttavia mantenuto a tali valori; ciò può in parte spiegare il paradosso apparente di un gruppo di animali altamente evoluto, come i Mammiferi attuali, che usano come loro principale sistema tampone una coppia che deve operare a distanza di più di 1 unità di pH dal suo pK. I tamponi nei quali la quantità totale dei due membri della coppia coniugata è fissa hanno la massima efficienza intorno al pK dell'acido; quando l'acido è neutralizzato per metà, si ha la massima quantità disponibile sia dell'acido-tampone per fornire ioni H+, sia della base-tampone per acquistare ioni H+. L'efficienza fisiologica del sistema del bicarbonato si basa, tuttavia, non sull'interconversione di due forme la cui quantità totale è fissa, ma sulla facilità con cui il bicarbonato può essere eliminato, per conversione in acido carbonico e quindi in acqua e diossido di carbonio (che viene allontanato dai polmoni), oppure rigenerato dall'acido carbonico ottenuto dall'idratazione del diossido di carbonio prodotto nel metabolismo (nell'organismo umano, a una velocità di circa 13 moli al giorno).
c) Il pH nel plasma sanguigno dei Mammiferi
Per tornare al controllo del pH nel plasma sanguigno dei Mammiferi attuali, l'equazione di Henderson-Hasselbalch nella forma
prevede che i due principali fattori che determinano il pH siano la concentrazione del bicarbonato e la pressione parziale del diossido di carbonio. Se il bicarbonato fosse il ‛solo' sistema tampone presente, come nel liquido cerebrospinale, raddoppiando la PCO2 dimezzando la concentrazione del bicarbonato si dovrebbe ottenere un abbassamento del pH di 0,3 unità; dimezzando la PCO2 raddoppiando [HCO3-] si dovrebbe ottenere un innalzamento del pH di 0,3 unità; e un cambiamento di una di queste due quantità in proporzione necessaria a preservare il rapporto di tamponamento dovrebbe compensare il cambiamento di pH che si produrrebbe in conseguenza della variazione dell'altra quantità. Oltre la coppia bicarbonato/acido carbonico, il sangue possiede altri tamponi, soprattutto proteici, che riducono il cambiamento di pH dovuto a un raddoppio o a un dimezzamento nella PCO2 o in [HCO3-] a circa 0,2 invece che 0,3 unità. L'equazione di Henderson-Hasselbalch prevede ancora correttamente il cambiamento di pH in funzione delle concentrazioni effettive di CO2 e di bicarbonato; ma quando, per esempio, la PCO2 è raddoppiata, l'acido carbonico che si forma reagisce con gli altri tamponi e, mentre questi assumono ioni H+, gli ioni bicarbonato che ne derivano aumentano la concentrazione del bicarbonato nel plasma ed eliminano l'effetto dell'innalzamento della PCO2 sul rapporto del tampone bicarbonato/acido carbonico. Il controllo fisiologico della reazione si riduce principalmente alla regolazione di tale rapporto e l'organismo possiede mezzi per manipolare separatamente sia il numeratore sia il denominatore; in effetti il controllo fisiologico del pH può essere riassunto in una sorta di trasposizione dell'equazione di Henderson-Hasselbalch:
Il controllo della respirazione è trattato in un altro articolo (v. respirazione, regolazione chimica della) e non richiede qui che un breve cenno. Il ruolo dei reni è strettamente correlato all'escrezione degli acidi nelle urine e verrà preso in considerazione più avanti, dopo una discussione sulla produzione e il tamponamento degli acidi nell'organismo.
5. Controllo respiratorio della reazione
a) Regolazione neuronale della ventilazione polmonare
L'entità della ventilazione polmonare è controllata dai neuroni del centro respiratorio midollare, di modo che la pressione parziale del diossido di carbonio nel sangue arterioso viene mantenuta intorno ai 40 torr in condizioni normali a livello del mare. Per mantenere la PCO2 a livello costante, i polmoni devono eliminare dall'organismo CO2 alla stessa velocità con cui viene prodotto dalle ossidazioni nei tessuti. Se l'eliminazione è più lenta della produzione, il diossido di carbonio si accumulerà e la PCO2 aumenterà sia nel sangue sia in tutti gli altri liquidi corporei, mentre un'eliminazione più rapida della produzione abbasserà la PCO2 in tutto l'organismo. La sensibilità dei neuroni che controllano la respirazione è tale che un aumento di 1 torr nella PCO2 del sangue arterioso fa aumentare nell'uomo la ventilazione di 2,5 l ‧ min-1; e un aumento di 10 torr la fa aumentare di 4 o 5 volte. Questa risposta dei centri respiratori alla PCO2 assicura che l'eliminazione del diossido di carbonio proceda di pari passo con la sua produzione e assicura anche l'approvvigionamento di ossigeno; infatti, dal momento che tanto diossido di carbonio viene prodotto per quanto ossigeno viene consumato, l'innalzarsi della PCO2 trasmette la richiesta di ossigeno e convoglia più ossigeno nei polmoni per venire incontro alle necessità dell'organismo. Contemporaneamente, secondo l'equazione di Henderson-Hasselbalch, il mantenimento della PCO2 al valore fisso di 40 torr ha l'effetto ulteriore di fissare il pH del plasma a 7,40, finché la concentrazione del bicarbonato resta a 24 mM. Per mantenere il pH a 7,4, tuttavia, occorre rimettere a punto la regolazione respiratoria della PCO2 se la concentrazione del bicarbonato cambia: a questo prov vede una sensibilità secondaria dei meccanismi neuronali, che controlla la respirazione in funzione della reazione del sangue. Se il sangue diviene più acido, l'entità della ventilazione polmonare aumenta e l'organismo elimina diossido di carbonio, in maniera che una caduta della concentrazione del bicarbonato nel plasma possa essere controbilanciata da un abbassamento compensatorio della PCO2 che riporterà il rapporto di tamponamento della coppia bicarbonato/acido carbonico al valore di 20 : 1. Questo meccanismo è anche correlato col rifornimento di ossigeno all'organismo, poiché quando i tessuti ricevono meno ossigeno del necessario si accumulano acidi organici che decompongono il bicarbonato e liberano diossido di carbonio. L'aumento della ventilazione, che si verifica in risposta a un'aumentata acidità e a un innalzamento della PCO2, al tempo stesso introduce più ossigeno e corregge l'abbassamento del pH eliminando CO2. Il fatto che tanto la necessità di ossigeno quanto la sua utilizzazione liberino diossido di carbonio come segnale della richiesta di ossigeno da parte dell'organismo e come stimolo della respirazione, è un notevole esempio di programmazione fisiologica.
b) La reazione del liquido cerebrospinale
Quando il plasma diviene alcalino, ci si aspetterebbe un rallentamento della respirazione con ritenzione di diossido di carbonio per compensare l'aumento della concentrazione del bicarbonato; la protezione respiratoria contro un aumento del pH, invece, è meno pronta ed efficace di quella contro l'acidità. Una possibile spiegazione per tale differenza è che un importante fattore che determina gli scambi respiratori è la reazione del liquido cerebrospinale, in cui il sistema del bicarbonato è il solo tampone efficace e la concentrazione del bicarbonato o è indipendente da quella nel sangue, oppure la segue solo con un certo ritardo. Il diossido di carbonio, invece, diffonde liberamente attraverso le membrane biologiche, in modo che la PCO2 è praticamente uniforme in tutto l'organismo; inoltre, una ritenzione di CO2 per compensare una più elevata concentrazione di bicarbonato nel plasma innalzerebbe la PCO2 del liquido cerebrospinale rendendolo acido, e stimolerebbe la respirazione, opponendosi pertanto all'aumento della PCO2 richiesto per impedire al pH del plasma di aumentare.
Nell'ultimo terzo di questo secolo è cominciato ad apparire chiaro che quella che era stata fino allora considerata una sensibilità diretta del centro respiratorio al diossido di carbonio poteva essere una risposta dei neuroni sensibili al pH, situati sulla superficie ventrolaterale del midollo allungato o vicino a essa, a livello delle radici del IX e del X paio di nervi cranici. Quando il liquido cerebrospinale diviene acido gli impulsi provenienti da questi neuroni provocano un aumento della ventilazione polmonare. Il liquido cerebrospinale, in effetti, viene mantenuto normalmente un poco meno alcalino del plasma, con un pH di 7,32 che viene controllato più attentamente del pH del plasma; l'ambito compatibile con la sopravvivenza può essere anche solo di ± 0,1 unità di pH. Data la facilità con la quale il diossido di carbonio diffonde attraverso le membrane, il liquido cerebrospinale e il suo contenuto possono funzionare come sistema chemosensibile che risponde alla pressione parziale del CO2 nel sangue. Per di più, la sensibilità di questo sistema recettore è determinata dalla concentrazione del bicarbonato nel liquido cerebrospinale, che sembra sottostare a un controllo indipendente, la cui natura, che può forse includere meccanismi di trasporto attivo del bicarbonato, non è ancora chiara. Alcune delle più utili indicazioni per la comprensione di questo problema sono derivate da studi sul controllo della respirazione ad altitudini elevate, alle quali i neuroni respiratori sono guidati da neuroni periferici chemosensibili del glomo carotideo, che sono stimolati da basse pressioni parziali di ossigeno. L'aumento della ventilazione dovuto alla ipossia abbassa la pressione parziale del diossido di carbonio sia nel sangue che nel liquido cerebrospinale determinando un conflitto tra i sistemi di controllo che normalmente cooperano per fornire ossigeno ed eliminare diossido di carbonio. Sembra che l'inibizione della respirazione causata dall'alcalinità del liquido cerebrospinale, quando la PCO2 abbassa, impedisca un'adeguata ossigenazione del sangue per alcune ore e che questo contribuisca ai fenomeni del mal di montagna. Uno dei cambiamenti che favoriscono l'acclimatazione è una riduzione della concentrazione del bicarbonato nel liquido cerebrospinale, di modo che sarà sufficiente una più bassa PCO2 per mantenerne la normale reazione, e si potrà così ottenere quell'aumento della ventilazione necessario per soddisfare la richiesta di ossigeno dell'organismo nell'aria rarefatta. Severinghaus e altri (v., 1963) si recarono per 8 giorni a un'altitudine di circa 3.800 metri e presero frequenti campioni del loro sangue arterioso e del liquido cerebrospinale. Dopo due giorni il pH del sangue si era stabilizzato a 0,04-0,08 unità al di sopra dei valori a livello del mare, ma la concentrazione del bicarbonato nel liquido cerebrospinale era diminuita tanto da determinare un aumento del pH di sole 0,02 unità, mentre era stato calcolato che, se il bicarbonato non fosse diminuito, il liquido cerebrospinale sarebbe divenuto più alcalino di 0,1 unità di pH. Un adattamento altrettanto lento della concentrazione del bicarbonato nel liquido cerebrospinale sembra finalmente offrire una spiegazione plausibile alla vecchia osservazione che, quando persone acclimatate ad altitudini elevate ritornano al livello del mare, la loro ventilazione polmonare rimane abnormemente elevata per un giorno o due: tali soggetti raggiungono il livello del mare con una bassa concentrazione di bicarbonato nel liquido cerebrospinale; al livello del mare l'impulso dei chemocettori alla respirazione, dovuto all'ipossia, cessa, ma se la ventilazione diminuisse e la pressione parziale del diossido di carbonio tornasse verso il suo valore normale a livello del mare, cioè verso 40 torr, il liquido cerebrospinale, povero di bicarbonato, diverrebbe troppo acido, stimolando la respirazione. L'entità della ventilazione non può ritornare normale fino a che non sia stata ristabilita la concentrazione normale del bicarbonato nel liquido cerebrospinale. Mitchell (v., 1966) pubblicò un'interessante disamina di questo problema dal punto di vista di Severinghaus e dei suoi collaboratori, che può venir letta insieme a un approccio un po' diverso di Pappenheimer (v., 1965-1966). L'argomento fu riesaminato da Kellogg (v., 1977) alla luce di più recenti lavori in cui le relazioni temporali non erano sempre uguali a quelle riportate da Severinghaus e altri.
6. Controllo renale della reazione
a) Produzione di acidi
L'acido prodotto in maggiore quantità nell'organismo è l'acido carbonico; un uomo adulto ne produce circa 9 millimoli al minuto, cioè 13 moli al giorno. Questo corrisponde a 13 moli al giorno di diossido di carbonio, che in teoria potrebbero produrre 26 equivalenti di ioni H+; ma nell'organismo, il cui pH rimane inferiore a 8, la dissociazione del secondo protone con liberazione dello ione carbonato, CO32-, può essere trascurata; 13 equivalenti di NaOH sarebbero sufficienti per trasformare in bicarbonato il diossido di carbonio giornaliero. Questa grande quantità di acido non minaccia la blanda alcalinità dei liquidi dell'organismo, a causa delle fortunate circostanze che l'acido è debole e che produce facilmente un'anidride volatile, il CO2, che viene eliminata dai polmoni. In effetti, anziché rappresentare un problema, l'acido carbonico è stato sfruttato come fonte della principale base-tampone dell'organismo e come fondamento del rapido controllo della reazione dei liquidi extracellulari, attraverso l'azione del meccanismo respiratorio e dei reni sui due componenti del sistema tampone bicarbonato/acido carbonico. Una grande quantità di acido carbonico deve essere trasportata dai tessuti, dove è prodotto, ai polmoni, che lo allontanano dall'organismo, ma le singolari proprietà del pigmento respiratorio, l'emoglobina, fanno sì che il diossido di carbonio sia trasportato nel sangue con una minima alterazione del pH. Infatti, nel momento stesso in cui il sangue riceve diossido di carbonio, cede ossigeno dall'emoglobina, e la desossiemoglobina è appunto una base più forte dell'ossiemoglobina quel tanto da acquistare quasi tutti gli ioni H+ dell'acido carbonico prodotto dall'idratazione del diossido di carbonio, senza grandi variazioni del pH. Anzi, se questi ioni H+ non fossero disponibili, il sangue diverrebbe alcalino in seguito alla cessione di ossigeno da parte dell'ossiemoglobina. Gli eritrociti contengono un'elevata concentrazione dell'enzima anidrasi carbonica, che accelera notevolmente la reazione tra diossido di carbonio e acqua, così che all'interno dei globuli rossi si forma acido carbonico, i cui ioni H+ vengono captati dalla desossiemoglobina, mentre gli ioni bicarbonato che si formano contemporaneamente migrano nel plasma:
CO2 + H2O − (anidrasi carbonica) → H2CO3 → H+ + HCO4-:
O2Hb- + H+ → HHb + O2:
sommando:
CO2 + H2O + O2Hb- → HCO3- + HHb + O2.
Pertanto, il diossido di carbonio preso dal sangue contemporaneamente alla cessione dell'ossigeno finisce nel plasma non come un acido in più, ma come bicarbonato.
Altri acidi, più forti e non volatili, vengono prodotti in quantità molto minori nel corso del metabolismo. Gli acidi organici vengono normalmente ossidati a diossido di carbonio e acqua, e contribuiscono così alla produzione di CO2, ma gli acidi inorganici non possono essere ulteriormente degradati dal metabolismo e devono alla fine venire eliminati in soluzione nell'urina. Un uomo che viva con una dieta mista ordinaria produce nel corso di una giornata qualcosa come 50-80 meq di questi acidi forti, metabolicamente indistruttibili. Il più importante è l'acido solforico, che deriva dall'ossidazione dello zolfo degli amminoacidi che lo contengono. Il secondo per importanza è l'acido fosforico, che deriva dalle fosfoproteine e dai fosfolipidi. Gli ioni idrogeno che provengono da questi acidi sono immediatamente trattenuti dall'azione dei tamponi nei vari liquidi dell'organismo, finché essi, o piuttosto una quantità equivalente di nuovi ioni idrogeno prodotti nel rene, vengono escreti con l'urina nell'ambito di un processo grazie al quale i reni rigenerano i tamponi che sono stati consumati per il blocco immediato degli ioni H+. Il processo di tamponamento, che limita la variazione del pH nel periodo in cui gli acidi che si sono formati nell'organismo attendono di essere escreti, dipende dai meccanismi tampone del sangue e dei liquidi interstiziali, delle cellule e dello scheletro, che saranno ora brevemente riassunti. (Per ulteriori particolari v. Winters e Dell, 1965).
b) Tamponamento
I principî teorici che regolano i processi di tamponamento nel sangue, nei liquidi interstiziali e dentro le cellule sono gli stessi. Variano tuttavia le modalità, in relazione alla diversa composizione dei tre ambienti.
Il sangue contiene bicarbonato, emoglobina (negli eritrociti), proteine plasmatiche e fosfato, in ordine decrescente di capacità tamponante. La loro importanza relativa è illustrata nella tabella.
I liquidi interstiziali sono privi di emoglobina e contengono meno proteine del plasma, cosicché il bicarbonato, che vi è presente all'incirca nella stessa concentrazione che nel plasma, è di gran lunga la loro base-tampone più importante.
Le cellule contengono più proteine del plasma; le loro proteine non hanno le speciali proprietà tamponanti dell'emoglobina, ma si può presumere che siano importanti per tamponare gli ioni H+ liberati dagli acidi nel luogo stesso della loro formazione nel corso dei processi metabolici. Presumibilmente, anche gli esteri fosforici organici, che costituiscono il grosso degli anioni intracellulari, contribuiscono alla capacità tamponante, ma i particolari del tamponamento all'interno delle cellule non sono ancora ben noti. Diversi esperimenti hanno mostrato, tuttavia, che una notevole frazione di acidi o basi introdotti nel corpo di animali vivi o di individui umani viene tamponata fuori dal sangue e dagli altri liquidi extracellulari facilmente accessibili. Una dimostrazione convincente dell'efficacia di questo ‟tamponamento da parte dell'intero organismo" (whole-body buffering), come lo chiamò Elkinton (v., 1956), fu data da Pitts (v., 1952-1953) in una Harvey lecture che costituisce un classico della metà del secolo, cui manca il sapore dell'attualità solo perché non è stato tradotto nel linguaggio di Lowry e Brønsted. Pitts descrive la ‛titolazione' con acido cloridrico 1N iniettato in vena di un cane vivo del peso di 19,7 kg: 156 ml di HCl 1N abbassarono il pH del sangue da 7,44 a 7,14. Pitts calcolò che il cane contenesse 11 kg di acqua, e per confronto aggiunse 156 ml di HCl 1N a 11 kg di acqua, che raggiunse un pH finale di 1,84; la maggior parte del calo fu prodotta dai primissimi ml di acido. La differenza tra i risultati per l'acqua e per il cane è una buona indicazione dell'efficacia del tamponamento da parte di tutto l'organismo.
Oltre al tamponamento normale degli ioni H+ per unione con le basi anioniche dei tamponi nelle cellule o nei liquidi extracellulari, esiste un processo quasi analogo di scambio ionico, tra i liquidi extracellulari e le strutture scheletriche che vi sono immerse, che aiuta l'organismo a bloccare gli ioni H+. Si tratta di uno scambio tra ioni H+ e cationi che si trovano sulla superficie dei cristalliti di minerale osseo, che può essere illustrato dallo schema seguente:
H+ + (Na+ o K+ o ½Ca2+ nell'osso)→ H+ (nell'osso) + (Na+ o K+ o ½Ca2+ liberati nel plasma o nel liquido extracellulare).
Questo è un processo più lento del normale tamponamento, che è virtualmente istantaneo, e ne differisce anche per il fatto che lo ione H+ che scompare è sostituito da un catione metallico nel plasma. Come il normale tamponamento, esso può funzionare in senso inverso, per aggiunta di bicarbonato al plasma:
H+ (nell'osso) + Na+ + HCO3- → Na+ (nell'osso) + H2CO3.
Uno scambio più complicato, ma non molto diverso, di H+ del liquido extracellulare con cationi provenienti dalle cellule può ugualmente essere di aiuto per l'eliminazione temporanea di ioni H+ all'interno dell'organismo. Non si può supporre che lo ione H+ rimanga libero nelle cellule: esso deve essere captato dalle basi dei tamponi intracellulari, con una riduzione delle cariche negative che provoca una liberazione di cationi da parte della cellula. Un fatto assai notevole, riportato da Pitts (v., 1952-1953), è che le cellule sembrano cedere prima al plasma un po' della loro piccola riserva di sodio intracellulare piuttosto che di potassio, che contengono in maggior quantità, ma la cui ritenzione è per esse più importante.
Data la presenza di questi vari meccanismi tampone, se un acido forte viene immesso nell'organismo o vi viene generato nel corso del metabolismo, si ottiene non una riduzione del pH ma quella della concentrazione totale delle basi-tampone dei liquidi organici. Se si aggiunge acido solforico, per esempio, il plasma diviene solo un poco più acido, ma diminuisce la concentrazione del bicarbonato e il suo posto è preso dal solfato. Il piccolo abbassamento di pH viene ulteriormente minimizzato dalla compensazione respiratoria, poiché l'aumento della ventilazione provocato dalla diminuzione del pH riduce la PCO2 arteriosa per controbilanciare la riduzione della concentrazione del bicarbonato nel plasma.
c) Escrezione renale degli acidi
Il compito di eliminare gli acidi dall'organismo e di ricostituire le riserve organiche di tamponi ricade sui reni. L'escrezione degli anioni indesiderati (come il solfato), che sono le basi coniugate degli acidi assorbiti o formati nell'organismo, è relativamente facile. Questi anioni esistono liberi nel plasma e passano nel filtrato glomerulare; i tubuli devono semplicemente astenersi dal riassorbirli. Questo, tuttavia, non ha niente a che fare con l'eliminazione degli ioni H+ che minacciano la neutralità dell'organismo, o con il ripristino dei tamponi che sono stati consumati per bloccarli. Gli ioni H+ non esistono più, in quanto si sono combinati con i tamponi e perciò il plasma non li può trasportare ai reni per l'escrezione. È necessario però ricostituire il bicarbonato che è scomparso dal plasma e dai liquidi interstiziali e rigenerare gli altri tamponi che sono stati consumati. Poiché il bicarbonato è la pietra angolare dei sistemi tampone dell'organismo e un uomo perde tra i 4.000 e i 5.000 meq di bicarbonato al giorno nel filtrato glomerulare, i tubuli renali hanno il compito, che è estremamente importante e urgente, di restituire al plasma, oltre al bicarbonato filtrato, anche altro bicarbonato in quantità sufficiente a sostituire quello che è stato consumato per tamponare gli ioni H+ e rigenerare altri tamponi diversi dal bicarbonato. A partire dagli anni sessanta divenne chiaro che il bicarbonato viene restituito al plasma soprattutto mediante un meccanismo indiretto strettamente collegato all'escrezione degli acidi, cioè degli ioni H+, nelle urine.
Il bicarbonato deve probabilmente essere riassorbito indirettamente, perché è un anione così voluminoso, molto più dello ione Cl- anche dello ione Na+ idratato, che non ci si può aspettare che attraversi facilmente la membrana luminale del tubulo renale. Pure, i primissimi esperimenti di micropuntura nei ratti, eseguiti da Walker e altri (v., 1941), indicarono che il bicarbonato veniva in realtà riassorbito dai tubuli prossimali preferenzialmente rispetto al cloruro, il che sembrava richiedere un meccanismo speciale; circa 20 anni dopo si dimostrò che il riassorbimento del bicarbonato era indiretto ed era una conseguenza del processo di secrezione di ioni H+ per acidificare le urine.
Già fin dal 1937 H. W. Smith aveva formulato l'ipotesi che gli ioni H+ venissero secreti nell'urina mediante un processo di scambio ionico con ioni sodio che venivano riassorbiti; Pitts e Alexander (v., 1945) dimostrarono che nessun altro processo, se non la secrezione di ioni H+, poteva giustificare la velocità alla quale cani in acidosi potevano eliminare acidi nelle urine. Ioni H+ possono essere escreti dal plasma a pH 7,4 in urine il cui grado di acidità può arrivare fino a circa un pH di 4,4, il che implica un trasporto contro un gradiente di concentrazione (o di attività) dell'ordine di 1 a 1.000. Pertanto, si deve presumere che la secrezione di ioni H+ sia attiva, nel senso che essa è un trasporto ‛in salita' che deve essere azionato dall'energia resa disponibile dalle cellule tubulari. Non è stato ancora dimostrato, tuttavia, che il processo attivo implichi il trasporto di ioni H+ come tali. È stata avanzata l'ipotesi alternativa che gli ioni H+ entrino nell'urina passivamente, in quanto il riassorbimento attivo di ioni Na+ carichi positivamente lascia il contenuto tubulare carico negativamente; tale ipotesi fu suggerita dagli studi di Schwartz e altri (v., 1955), i quali osservarono che soggetti umani che riassorbivano avidamente sodio, essendo stati in precedenza privati di sale, producevano urine sorprendentemente acide (anche fino a pH 4,0) quando veniva loro iniettato solfato di sodio, che sostituiva nel filtrato glomerulare l'anione Cl-, facilmente riassorbibile, con l'anione SO42-, non riassorbibile. Ma la differenza di potenziale necessaria per giustificare un'acidificazione così intensa sarebbe di oltre 180 mV. Gli esperimenti di Clapp e altri (v., 1962) sui ratti, in cui potevano essere misurati i potenziali elettrici, mostrarono che, sebbene la differenza di potenziale attraverso l'epitelio tubulare aumentasse sostituendo anioni non riassorbibili al Cl-, questo non era sufficiente per giustificare completamente l'acidificazione delle urine. Sembra pertanto necessario ammettere un trasporto attivo almeno di una parte degli ioni H+ che vengono secreti nel liquido tubulare, soprattutto dal momento che l'interno della cellula si mantiene negativo di circa 50 mV rispetto al lume, ma da 70 a 80 mV negativo rispetto al liquido peritubulare (v. Pitts, 19743; v. Windhager, 1968).
Riguardo alla fonte degli ioni H+ che vengono in qualche modo spinti nell'urina tubulare, vi sono due ipotesi. La prima è che essi possano essere liberati dalla ionizzazione dell'acido carbonico formato nelle cellule tubulari da diossido di carbonio e acqua. Le cellule sono ricche di anidrasi carbonica, che catalizzerebbe l'idratazione, altrimenti lenta, del diossido di carbonio, e vi sono buone prove che la capacità dei reni di secernere ioni H+ è grosso modo proporzionale alla pressione parziale del CO2 nel sangue che li irrora. Dal momento che gli ioni H+ provengono dall'acido carbonico, ogni H+ che passa nell'urina deve lasciare nella cellula uno ione bicarbonato
H2O + CO2 − (anidrasi carbonica) → H2CO3 → HCO3- + H+
Il meccanismo equivale a ottenere gli ioni H+ dall'acqua per mezzo del CO2.
L'ipotesi alternativa è che gli ioni H+ vengano ottenuti direttamente dall'acqua e fatti passare nel lume tubulare, forse mediante una sorta di accoppiamento con la catena di trasporto degli elettroni che promuove la respirazione. Questo processo, che è essenzialmente il meccanismo proposto da Davies (v., 1951) per spiegare la secrezione di acido da parte dello stomaco, lascia nelle cellule ioni OH-, che verrebbero neutralizzati mediante combinazione con il CO2 per formare bicarbonato, reazione catalizzata anch'essa dall'anidrasi carbonica:
H2O → OH- + H+;
OH- + CO2 − (anidrasi carbonica) → HCO3-.
È importante notare che tutti e due gli schemi dipendono dalla catalisi effettuata dall'anidrasi carbonica e che entrambi lasciano nella cellula uno ione bicarbonato per ogni ione H+ che viene fatto passare nelle urine. (Per ulteriori dettagli sulla secrezione renale di ioni H+ v. la rassegna di Malnic e Giebisch, 1972).
d) Ripristino dei tamponi
Sebbene la membrana della cellula luminale sia probabilmente impermeabile al bicarbonato, si è riscontrato che il bordo peritubulare del tubulo prossimale del ratto è facilmente permeabile a esso (v. Wick e Frömter, 1967), in modo che gli ioni bicarbonato che si sono formati nelle cellule possono passare facilmente nel plasma, soprattutto dal momento che l'interno delle cellule è di circa 70 mV negativo rispetto al liquido peritubulare. Gli ioni H+ che entrano nel liquido tubulare devono per prima cosa reagire col bicarbonato filtrato: ogni ione H+ eliminerà uno ione HCO3- nel tubulo, ma poiché esso si sarà lasciato dietro uno ione HCO3- destinato al plasma, il risultato finale sarà equivalente al riassorbimento di bicarbonato. L'impermeabilità al bicarbonato della membrana luminale viene in tal modo elegantemente evitata. Il bicarbonato filtrato può così essere sostituito quantitativamente nel plasma senza che neanche una molecola di bicarbonato debba in effetti attraversare la membrana luminale!
Dapprima si pensò che questo meccanismo di riassorbimento agisse solo sul bicarbonato residuo che era arrivato fino al tubulo distale. In seguito alle osservazioni di Berliner e altri (v., 1951), i quali rilevarono che quando l'anidrasi carbonica era inibita più della metà del bicarbonato del filtrato glomerulare veniva escreta in urine alcaline, venne avanzata l'ipotesi che tale fenomeno potesse avvenire anche nel tubulo prossimale, come è stato in seguito dimostrato direttamente mediante micropuntura. Se ioni H+ vengono secreti in un liquido contenente bicarbonato, il liquido sarà dapprima più acido di quanto non lo sarà dopo che l'acido carbonico formatosi immediatamente abbia avuto il tempo di decomporsi (alquanto lentamente) in diossido di carbonio e acqua, e di raggiungere l'equilibrio con la tensione di CO2 predominante. Rector e altri (v., 1965) scoprirono una simile variazione di pH ritardata (‛pH di squilibrio') di 0,85 unità nel tubulo distale del ratto e osservarono che essa veniva eliminata da una perfusione di anidrasi carbonica. Un tale pH di squilibrio normalmente non era riscontrabile nel tubulo prossimale, probabilmente perché l'anidrasi carbonica della membrana luminale delle cellule tubulari permetteva il raggiungimento dell'equilibrio entro il tempo richiesto dall'elettrodo per misurare il pH. Quando l'anidrasi carbonica era inibita, si riscontrava anche nel tubulo prossimale un pH di squilibrio simile a quello del tubulo distale.
Viene oggi generalmente accettata l'ipotesi, avanzata da Smith (v., 1937), che la secrezione di ioni H+ nel liquido tubulare, dovuta a uno scambio con ioni Na+, avvenga sia nei tubuli prossimali e distali sia nei dotti collettori del rene, e che gli ioni bicarbonato che si formano nelle cellule come prodotto collaterale della produzione di ioni H+ per la secrezione accompagnino il sodio riassorbito nel plasma (v. secrezione e assorbimento). La prima conseguenza dell'aggiunta di ioni H+ al liquido tubulare è pertanto il ‛riassorbimento' del bicarbonato filtrato. Gli ioni H+ usati in questo processo alla fine non compaiono affatto nelle urine, poiché scompaiono nella reazione
HCO3- + H+ →H2CO3 (→ H2O + CO2).
La quantità di ioni H+ necessaria per questo processo è grande, dai 4 ai 5 equivalenti per giorno nell'uomo, ma dal momento che il liquido tubulare non viene apprezzabilmente acidificato finché rimane bicarbonato filtrato, questi ioni H+ non vengono secreti contro un gradiente apprezzabile e la loro secrezione può essere per la maggior parte passiva, mossa in ultima analisi dalle pompe metaboliche che riassorbono attivamente gli ioni Na+.
Un grande vantaggio del ‛riassorbire' in questo modo indiretto il bicarbonato filtrato è che la quantità che può essere aggiunta al plasma non è limitata a quella disponibile nel filtrato glomerulare per essere riassorbita. Dopo che tutto o gran parte del bicarbonato filtrato è stato decomposto, le cellule tubulari possono continuare a secernere ioni H+ nell'urina: a) titolando i tamponi urinari (soprattutto il fosfato secondario, HPO42-, che assume uno ione H+ per divenire H2PO4-) in direzione del limite inferiore del pH urinario, e anche b) facendoli combinare con l'ammoniaca per formare lo ione ammonio (NH3 + H+ → NH4+), per cui altri ioni H+ possono essere trasportati nelle urine senza ulteriori abbassamenti del pH. L'ammoniaca viene formata, nelle cellule tubulari, soprattutto dalla glutammina e in un certo grado anche da altri amminoacidi, mediante sistemi enzimatici la cui attività è stata in gran parte messa in evidenza negli ultimi anni da Pitts e dai suoi collaboratori (v. Pitts, 19743).
Gli acidi-tampone prodotti nel processo a) costituiscono gli ‛acidi titolabili' delle urine e ammontano a 20-30 meq per giorno nell'uomo che viva con una dieta ordinaria mista. Insieme ai 30-50 meq di ione ammonio essi corrispondono ai 50-80 meq di acidi forti prodotti dal metabolismo. Questi ioni H+ vengono secreti contro un gradiente in un'urina acida, cosicché la loro secrezione, almeno, deve essere attiva. Gli ioni bicarbonato che arrivano al plasma quale prodotto collaterale della produzione di ioni H+ secreti come acidi titolabili e ione ammonio costituiscono bicarbonato addizionale, in aggiunta cioè a quello recuperato dal filtrato glomerulare. Questa quantità supplementare di bicarbonato va a sostituire il bicarbonato e a rigenerare gli altri tamponi che sono stati consumati per bloccare gli ioni H+ derivanti dai 50-80 meq di acidi prodotti dal metabolismo. La produzione di ioni HCO3- (introdotti nel plasma) e di ioni H+ (secreti nell'urina), che è simultanea e di uguale entità, spiega la vecchia affermazione che la somma degli acidi urinari titolabili e dello ione ammonio urinario e una misura dell'attività dei reni per mantenere l'equilibrio acidobase dell'organismo.
L'urina, ovviamente, non è sempre acida allo stesso modo e talvolta è alcalina, per cui si rende necessario un breve accenno alla regolazione dell'escrezione di acidi da parte dei reni. La dieta determina la miscela delle sostanze metabolizzate e pertanto l'urina degli erbivori, o di soggetti umani che vivono di diete strettamente vegetariane, è generalmente alcalina; Bernard (v., 1865) fece l'acuta osservazione che un normale coniglio produceva sul suo banco di laboratorio un'urina limpida e acida invece della normale urina torbida e alcalina, essendo stato trasformato dal digiuno in carnivoro, in quanto viveva della sua stessa carne. I cibi vegetali contengono cationi accompagnati da anioni organici che vengono ossidati a diossido di carbonio e acqua, lasciando l'organismo con un eccesso di bicarbonato; i cibi animali producono un eccesso di acidi. L'importanza primaria dello zolfo (proveniente dagli amminoacidi che lo contengono) come fonte di acido metabolico fu riconosciuta da Hunt (v., 1956) e definitivamente confermata nel laboratorio di Relman (v., 1968). Probabilmente la regolazione dell'attività dei reni è in gran parte automatica; ciò è dovuto all'effetto di eventi metabolici antecedenti sulla concentrazione del bicarbonato nel plasma. Se questa aumenta, viene filtrata una quantità maggiore di bicarbonato per minuto ed è necessario un maggior numero di ioni H+ per riassorbirlo, cosicché le urine divengono meno acide. Se la filtrazione di bicarbonato supera la secrezione di ioni H+ da parte dei tubuli renali, il riassorbimento del bicarbonato filtrato può essere incompleto, nel qual caso il bicarbonato residuo verrà escreto in un'urina alcalina. Gli acidi che vengono assorbiti o prodotti dall'organismo riducono la concentrazione del bicarbonato nel plasma, di modo che meno bicarbonato viene filtrato per minuto, e più ioni H+ vengono liberati per essere poi escreti come acidi titolabili e come ioni ammonio in un'urina che diviene sempre più acida.
Un altro fattore importante è la pressione parziale del diossido di carbonio nel sangue, poiché essa controlla la secrezione tubulare di ioni H+. La diminuita secrezione di ioni H+ che accompagna l'abbassamento della PCO2: arteriosa quando l'ipossia, a elevate temperature, fa aumentare la respirazione, spiega perché, durante l'acclimatazione, l'urina è alcalina e contiene bicarbonato, mentre la concentrazione del bicarbonato nel plasma diminuisce. La quantità di ioni H+ secreta è insufficiente a riassorbire tutto il bicarbonato filtrato, fintantoché l'escrezione di bicarbonato non riduce il carico filtrato e quindi la concentrazione di bicarbonato nel plasma. (Per una discussione più dettagliata, v. Robinson, 19755).
7. Il pH intracellulare
La reazione del liquido intracellulare è probabilmente più importante di quella del liquido extracellulare per molte attività biologiche, particolarmente a livello molecolare. Il medico che si trova a fronteggiare un'alterazione dell'equilibrio acido-base è ben consapevole del fatto che i liquidi extracellulari, che egli può controllare facilmente analizzando il sangue, costituiscono solo una piccola parte, e forse non completamente rappresentativa, dell'organismo del suo paziente, mentre le alterate funzioni che egli cerca di individuare, comprendere e correggere sono spesso celate nella massa cellulare, più grande e meno accessibile.
Il concetto di pH intracellulare è inevitabilmente ambiguo a causa della grande eterogeneità delle cellule. R. A. Peters (v., 1949), in una conferenza alla British Association for the Advancement of Science, sottolineava che i 550 milioni di molecole di acqua che accompagnano un singolo ione H+ a pH 7 occuperebbero lo spazio corrispondente a un cubo di 0,25 μm (0,25 ‧ 10-6 m) di lato. Quindi il microscopio elettronico evidenzia molte zone all'interno delle cellule che non possono contenere più di o 2 idrogenioni o talvolta nessuno. Se il pH va messo in relazione alla probabilità di trovare uno ione H+ (o un piccolo numero intero di ioni H+) in una regione così piccola, non può che essere una variabile continua; quindi parlare di frazioni di ioni H+ ha senso solo in termini di probabilità o di media temporale. Definire il pH intracellulare è difficile anche perché l'interno delle cellule non è un liquido uniforme, ma un mosaico di regioni che possono avere valori medi di pH affatto differenti: i mitocondri e altri organelli, per esempio, è probabile che abbiano un pH diverso da quello del liquido circostante.
Due sono i metodi impiegati dai ricercatori nel tentativo di misurare il pH intracellulare, e precisamente l'analisi chimica volta a determinare la distribuzione degli acidi e delle basi deboli all'interno e all'esterno delle cellule, oppure l'uso di microelettrodi sensibili al pH, abbastanza piccoli da essere inseriti nelle cellule. Impiegando il primo metodo si presume che la forma non ionizzata dell'acido o della base debole che entra in una cellula vi raggiunga la stessa concentrazione sia nell'acqua della cellula che nel liquido circostante e non sia legata, accumulata attivamente, o comunque sequestrata.
Le due concentrazioni, determinate chimicamente, al di qua e al di là della membrana, non saranno eguali, a meno che non siano eguali i valori di pH, in quanto la concentrazione della forma ionizzata in rapporto a una data concentrazione della forma non ionizzata dipende dal pH, secondo l'equazione di Henderson-Hasselbalch.
Una dettagliata discussione e la derivazione di equazioni per il calcolo del pH intracellulare si trovano nelle rassegne di Robson e altri (v., 1968) e di Waddell e Bates (v., 1969). La sostanza più usata è il dimetilossazolidindione (DMO), un acido debole con pKa 6,13, che indica valori di 6,9-7,2 per il pH intracellulare nei muscoli scheletrici e nel miocardio di Mammifero: le cellule in genere sembrano meno alcaline del plasma o dei liquidi interstiziali che le bagnano.
Una certa polemica si sviluppò nel 1968, in seguito agli studi di Carter e altri (v., 1967); questi ricercatori, usando un microelettrodo a vetro appositamente disegnato, affermarono che il pH intracellulare nel muscolo scheletrico è circa 6, cioè di un'intera unità inferiore a quanto determinato con altri metodi e, incidentalmente, proprio il valore previsto nel caso che gli ioni H+ fossero distribuiti secondo un equilibrio elettrochimico attraverso la membrana cellulare. Probabilmente si erano incontrate difficoltà nell'isolare le punte sensibili, piuttosto lunghe, di questi elettrodi, mentre misure più recenti con elettrodi a punte più corte o incassate, in pieno contatto con i liquidi cellulari, hanno confermato i risultati ottenuti con il DMO e sostanze simili (v. Walker e Brown, 1977).
Tale conferma è relativamente sorprendente, in quanto col metodo della distribuzione si ottiene il valore medio di tutte le fasi in un grandissimo numero di cellule, mentre l'elettrodo misura il pH della minuscola porzione di liquido che viene in contatto con la sua punta all'interno di una singola cellula.
L'importante conclusione che si può trarre da entrambi i metodi di misurazione è che gli ioni H+ non possono trovarsi in equilibrio elettrochimico attraverso la membrana cellulare: in qualche maniera l'attività degli ioni H+ all'interno della cellula è mantenuta inferiore di un fattore 10 rispetto al valore che risulterebbe dall'equilibrio passivo. Sorge il problema di sapere se gli ioni H+ siano espulsi dalla cellula o se le membrane siano impermeabili a essi: peraltro, sarebbe molto curioso che membrane, che sono sicuramente permeabili all'acqua, fossero impermeabili agli ioni H+. Il protone idratato, essendo più grande degli ioni Li+ e Na+ idratati, potrebbe incontrare difficoltà ad attraversare i pori delle membrane biologiche; tuttavia, l'acqua strutturalmente simile a ghiaccio che riempie i pori - di dimensioni molecolari - o ne riveste la superficie, non costituirebbe una barriera per i protoni, in quanto questi hanno una mobilità molto maggiore nel ghiaccio che nell'acqua. Izutsu (v., 1972) ha trovato che il muscolo di rospo è di gran lunga più permeabile all'H+ che al potassio, mentre Conway (v., 1957) ha rilevato che anche se le membrane cellulari fossero permeabili, la concentrazione assoluta di ioni H+ è così piccola a pH circa 7 che l'equilibrio può richiedere molto più tempo di quanto normalmente durano gli esperimenti per determinare la permeabilità.
Aickin e Thomas (v., 1977) hanno proposto cinque meccanismi con i quali le cellule muscolari scheletriche del topo potrebbero estrudere gli ioni H+ per rigenerare il pH intracellulare dopo un subitaneo spostamento verso una maggiore acidità. Essi poterono escludere uno scambio di H+ con K+ o con Ca2+ in entrata, come anche un ruolo della pompa Na+/K+ ouabaina-sensibile: le possibilità erano quindi ristrette a uno scambio di H+ con Na+ che entra passivamente nella cellula a causa del gradiente elettrochimico (il meccanismo principale) e a uno scambio del Cl- cellulare con il bicarbonato esterno, che sembra avvenire a spese del metabolismo. In neuroni di lumaca Thomas (v., 1977) trovò che questi due processi sono strettamente accoppiati, così che l'estrusione di H+ può essere dovuta esclusivamente al gradiente di Na+ verso l'interno.
Rahn e altri (v., 1975) hanno messo in evidenza i vantaggi di un pH intracellulare intorno alla neutralità. Infatti soltanto pochi composti intermedi delle centinaia coinvolti nelle serie di reazioni metaboliche hanno gruppi ionizzabili basici, mentre una gran parte ha gruppi carbossilici e i restanti sono fosforilati: una reazione neutra mantiene tutti questi importanti composti completamente ionizzati in modo da trattenerli all'interno delle cellule a causa della ridotta permeabilità delle membrane cellulari nei confronti di specie cariche, mentre i prodotti non carichi della fermentazione e i prodotti di rifiuto, come urea e diossido di carbonio, fuoriescono velocemente. Inoltre la maggiore alcalinità dei liquidi extracellulari li rende degli efficaci bacini di raccolta per l'acido carbonico e altri prodotti finali acidi del metabolismo.
8. Temperatura e regolazione della reazione
Nel 1962 Robin (v.; v. anche Robin e altri, 1969) notò che esemplari di tartarughe azzannatrici mantenevano il loro sangue a pH 7,72 in un laboratorio a Salisbury Cove, ma a pH 7,49 in un altro laboratorio a Pittsburgh. Robin chiari che ciò era dovuto al fatto che la temperatura era di 16-18 °C a Salisbury Cove e di 26-28 °C a Pittsburgh e trovò anche che il sangue isolato si comportava nello stesso modo in vitro. Si è riscontrato che questo fenomeno è molto comune: quando Anellidi, Molluschi, Crostacei, limuli, carpe, rane e tartarughe sono acclimatati a temperature diverse, il pH del loro sangue aumenta di circa 0,7 unità tra 40 e 0 °C (v. Rahn e altri, 1975). Il sangue di questi animali, però, non diviene più alcalino, perché il pH dell'acqua pura, che per definizione è neutro, aumenta nello stesso modo. Gli animali mantengono il loro sangue a 0,6-0,8 unità di pH al di sopra della neutralità, mantenendo così costante il rapporto tra le concentrazioni di ioni idrossido e ioni idrogeno (tra 16 e 40 a seconda delle specie) e quindi una costante ‛alcalinità relativa' (v. Rahn, PCO2 pH..., 1974) a tutte le temperature.
Anche i liquidi intracellulari mostrano un'analoga variazione della reazione con la temperatura; infatti rimangono circa 0,3 unità di pH al di sopra della neutralità e mantengono quindi la stessa differenza rispetto ai liquidi extracellulari, indipendentemente dalla temperatura (v. Rahn e altri, 1975).
È notevole il fatto che se si raffredda in vitro il sangue di poichilotermi tra 40 e 0 °C impedendo gli scambi di diossido di carbonio, si trova la stessa variazione del pH in funzione della temperatura osservata in vivo e questo è vero anche per i Mammiferi, compreso l'uomo. Quindi per mantenere costante quest'alcalinità relativa il sangue deve contenere un'adeguata quantità di un tampone che abbia lo stesso coefficiente termico di ionizzazione dell'acqua. L'unica base-tampone dei sistemi biologici che risponde a questa caratteristica è il gruppo imidazolico di proteine e peptidi, molto frequente nel sangue e nelle cellule. Siccome un'alcalinità relativa costante implica un costante grado di ionizzazione (α) dei gruppi imidazolici, Reeves (v., 1972) denominò il sistema che controlla la reazione ‛alfastato dell'imidazolo'.
Negli animali il pH del plasma è determinato dalla PCO2, che risulta dall'equilibrio tra la velocità della produzione metabolica di diossido di carbonio e la sua rimozione respiratoria. Ne deriva che nei poichilotermi la respirazione deve regolare la PCO2in modo da mantenere un'alcalinità relativa costante piuttosto che un pH costante. I muscoli respiratori dei poichilotermi che respirano aria non sono coinvolti nel generale rallentamento del metabolismo, del battito cardiaco e delle altre attività che accompagnano il raffreddamento: la velocità di ventilazione rimane costante in modo che la PCO2 diminuisce in proporzione alla velocità di produzione (v. Rahn, PCO2, pH..., 1974), il che mantiene il sangue costantemente alcalino. Poiché i Mammiferi hanno costante sia la temperatura corporea sia il pH dei tessuti e del sangue, non è chiaro se i meccanismi di regolazione operino sul pH come tale o piuttosto sul rapporto ioni OH-/ioni H+, in altri termini sull'alcalinità relativa di Rahn. La situazione negli altri animali, unita alla constatazione che il sangue dei Mammiferi si comporta allo stesso modo in vitro, suggerisce l'ipotesi che la costanza di tale rapporto sia risultata nel corso dell'evoluzione più importante della costanza del pH. Infatti i Mammiferi regolano la loro respirazione in modo da mantenere lo stesso pH che gli altri animali avrebbero a 37°, e lo stesso grado di ionizzazione dei gruppi imidazolici che gli altri animali presentano a tutte le temperature.
Anche nei Mammiferi la temperatura non è uniforme in tutte le parti del corpo: il fegato e i muscoli in attività sono più caldi, mentre la pelle delle estremità è spesso molto più fredda della parte centrale del corpo. Al cambiare della temperatura cambia il pH del sangue mantenuto in anaerobiosi nei grossi vasi; però nel sangue arterioso viene conservata dovunque la stessa alcalinità relativa (v. Rahn, Body temperature..., 1974).
Una respirazione regolata da recettori sensibili soprattutto al pH non potrebbe assicurare un'alcalinità relativa costante a tutte le temperature, però Reeves (v. , 1972 e 1977) ha suggerito l'ipotesi che recettori sensibili alla ionizzazione di gruppi imidazolici distribuiti strategicamente all'interno delle cellule dei recettori stessi regolino la PCO2 in modo tale da mantenere costante l'alcalinità relativa. Inoltre sarebbe assolutamente normale che i recettori che controllano la respirazione fossero attivati da variazioni all'interno delle proprie cellule, in quanto moltissimi gruppi ionizzabili, di cui è importante controllare la carica, sono localizzati all'interno di cellule nelle varie parti del corpo. Questi gruppi, nei sistemi enzimatici e negli organelli, non sono in contatto con il sangue o qualsiasi parte del milieu intérieur di Bernard, ma sono immersi nel ‛milieu intérieur interno' di Robin e Bromberg (v., 1959). La loro segregazione pone un problema di comunicazione: come possono miliardi di singole cellule esprimere i loro bisogni collettivi?
Robin e Bromberg (v., 1959) hanno mostrato che in genere le membrane cellulari sono liberamente permeabili al diossido di carbonio ma relativamente impermeabili agli ioni bicarbonato; significative variazioni della PCO2 causano pertanto cambiamenti del pH intracellulare, che persistono finché non avvengano cambiamenti compensatori nella concentrazione del bicarbonato intracellulare; contemporaneamente la reazione delle cellule e dei liquidi extracellulari può cambiare in direzione opposta. Per esempio, se un eccesso di acido non volatile riduce il bicarbonato del plasma rendendo il sangue più acido ma stimolando la respirazione, l'abbassamento della PCO2 che ne deriva rende di nuovo più alcalina la cellula. Similmente, se un eccesso di alcali fa aumentare il pH del sangue e fa diminuire la respirazione, il diossido di carbonio che viene trattenuto corregge il pH del sangue e le cellule divengono più acide. Ora, la permeabilità differenziale delle membrane cellulari ricorda quella della barriera emato-encefalica, così che il pH del liquido cerebrospinale varierà come il pH intracellulare; quindi, sebbene il liquido intracellulare sia distribuito in un numero immenso di microcompartimenti, cambiamenti di pH intracellulari si rifletteranno in simili variazioni nel liquido cerebrospinale. Inoltre, dal momento che il liquido cerebrospinale, a differenza delle cellule in cui vi sono altri tamponi, è tamponato solo dal bicarbonato, il suo pH dovrebbe risentire maggiormente di una variazione della PCO2; ne consegue che variazioni di pH del liquido cerebrospinale riflettono in modo amplificato variazioni intracellulari di pH e quindi una correzione di PCO2 che ripristini il pH del liquido cerebrospinale dovrebbe correggere anche il pH intracellulare. Quindi i chemocettori intracranici in contatto con il liquido cerebrospinale sono opportunamente collocati per permettere la regolazione del pH in tutte le cellule del corpo; inoltre, se questi recettori generano impulsi nervosi con velocità determinata dalla ionizzazione di specifici gruppi imidazolici all'interno delle loro cellule, essi saranno capaci di regolare la PCO2 per mantenere un'alcalinità relativa costante, il che si rifletterà in un pH costante solo se anche la temperatura è costante.
Infine si comincia a comprendere che i chemocettori centrali e quelli periferici (il glomo carotideo) hanno funzioni un po' diverse: la funzione primaria dei chemocettori periferici, che sono innanzittutto sensibili all'anossia, è quella di regolare l'approvvigionamento corporeo di ossigeno; secondariamente, essi controllano e regolano anche la reazione del sangue e degli altri liquidi extracellulari. I chemocettori intracranici, sensibili solo al pH e in contatto con il liquido cerebrospinale e con i liquidi interstiziali del cervello, sembrano esercitare un prevalente controllo della respirazione per regolare la reazione del liquido cerebrospinale nel cervello e probabilmente anche quella delle cellule in generale.
9. Considerazioni conclusive
Sono stati delineati in sintesi i meccanismi principali che stabilizzano la reazione dei liquidi extracellulari dei Mammiferi. Questi meccanismi hanno grande importanza biologica, perché molti tessuti funzionano normalmente solo se le loro cellule sono immerse in un mezzo leggermente alcalino. La stabilità della reazione dei liquidi all'interno delle cellule è probabilmente di importanza anche maggiore e la stabilità della reazione dei liquidi extracellulari può essere particolarmente importante come fondamento sulla base del quale viene resa stabile la reazione all'interno delle cellule. Vi sono senza dubbio altri meccanismi che conferiscono alle cellule una certa indipendenza ma, nonostante il risveglio di interesse nei confronti del pH del liquido intracellulare durante il penultimo quarto del XX secolo, non si sono ottenuti ancora molti dati sicuri sui meccanismi omeostatici che operano all'interno delle cellule. Pertanto, la discussione sul pH intracellulare, che avrebbe dovuto essere il punto centrale di questo saggio, ha avuto in definitiva uno scarso rilievo. Resta la speranza che, con l'avanzare sempre più incalzante del progresso scientifico, l'ultimo quarto di secolo possa trovare le risposte a molte delle domande che sono state ora poste.
bibliografia
Aickin, C. C., Thomas, R. C., An investigation of the mechanism of intracellular pH regulation in mouse soleus muscle fibres, in ‟Journal of physiology", 1977, CCLXXIII, pp. 295-316.
Barcroft, J., Features in the architecture of physiological function, London 1934.
Berliner, R. W., Kennedy, T. J. Jr., Orloff, J., Relationship between acidification of the urine and potassium metabolism, in ‟American journal of medicine", 1951, XI, pp. 274-282.
Bernal, J. D., The origin of life, London 1967.
Bernard, Cl., Introduction à l'étude de la médecine expérimentale, Paris 1865.
Bernard, Cl., Leçons sur les phénomènes de la vie communs aux animaux et aux végétaux, Paris 1878-1879.
Cannon, W. B., organisation for physiological homeostasis, in ‟Physiological reviews", 1929, IX, pp. 399-431.
Carter, N. W., Rector, F. C. Jr., Campion, D. S., Seldin, D. W., Measurement of intracellular pH of skeletal muscle with pH-sensitive glass microelectrodes, in ‟Journal of clinical investigation", 1967, XLVI, pp. 920-933.
Clapp, J. R., Rector, F. C. Jr., Seldin, D. W., Effect of unreabsorbed anions on proximal and distal tubular potentials in rats, in ‟American journal of physiology", 1962, CCII, pp. 781-786.
Conway, E. J., Nature and significance of concentration relations of potassium and sodium in skeletal muscle, in ‟Physiological reviews", 1957, XXXVII, pp. 84-132.
Davies, R. E., The mechanism of hydrochloric acid production by the stomach, in ‟Biological reviews", 1951, XXVI, pp. 87-120.
Elkinton, J. R., Whole body buffers in the regulation of acid-bse equilibrium, in ‟Yale journal of biology and medicine", 1956, XXIX, pp. 191-210.
Hasselbach, K. A., Die Berechnung der Wasserstoffzahl des Blutes aus der freien und gebundenen Kohlensäure desselben, und die Sauerstoffbindung des Blutes als Funktion der Wasserstoffzahl, in ‟Biochemische Zeitschrift", 1916, LXXVIII, pp. 112-144.
Henderson, L. J., Das Gleichge wicht zwischen Basen und Säuren im tierischen Organismus, in ‟Ergebnisse der Physiologie, biologischen Chemie und experimentellen Pharmakologie", 1909, VIII, pp. 254-325.
Henderson, L. J., The fitness of the environment, New York 1913.
Hunt, J. N., The influence of dietary sulphur on the urinary output of acid in man, in ‟Clinical science", 1956, XV, pp. 119-134.
Izutsu, K. T., Intracellular pH, H ion flux and H ion permeability coefficient in bullfrog toe muscle, in ‟Journal of physiology", 1972, CCXXI, pp. 15-27.
Kellogg, R. H., Oxygen and carbon dioxide in the regultion of breathing, in ‟Federation proceedings", 1977, XXXVI, pp. 1658-1663.
Malnic, G., Giebisch, G., Mechanism of renal hydrogen ion secretion, in ‟Kidney international", 1972, I, pp. 280-296.
Mitchell, R. A., Cerebrospinal fluid and the regulation of respiration, in Advances in respiratory physiology (a cura di C. C. Caro), London 1966, pp. 1-47.
Pappenheimer, J. R., The ionic composition of cerebral extracellular fluid and its relation to control of breathing, in ‟Harvey lectures", 1965-1966, LXI, pp. 71-94.
Peters, R. A., The cell, in ‟Advancement of science", 1949, VI, pp. 257-266.
Pitts, R. F., Mechanisms for stabilizing the alkaline reserves of the body, in ‟Harvey lectures", 1952-1953, XLVIII, pp. 172-209.
Pitts, R. F., Physiology of the kidney and body fluids, Chicago 19743.
Pitts, R. F., Alexander, R. S., The nature of the renal tubular mechanism for acidifying the urine, in ‟American journal of physiology", 1945, CXLIV, pp. 239-254.
Rahn, H., Body temperature and acid-base regulation, in ‟Pneumonologie", 1974, CLI, pp. 87-94.
Rahn, H., PCO2, pH and body temperature, in Carbon dioxide and metabolic regulations (a cura di G. Nahas e K. R. Schaefer), Berlin-Heidelberg-New York 1974, pp. 152-162.
Rahn, H., Reeves, R. B., Howell, B. J., Hydrogen ion regulation, temperature and evolution, in ‟American review of respiratory diseases", 1975, CXII, pp. 165-172.
Rector, F. C. Jr., Carter, N. W., Seldin, D. W., The mechanism of bicarbonate reabsorption in the proximal and distal tubules of the kidney, in ‟Journal of clinical investigation", 1965, XLIV, pp. 278-290.
Reeves, R. B., An imidazole alphastat hypothesis for Vertebrate acid-base regulation: tissue carbon dioxide content and body temperature in bullfrogs, in ‟Respiration physiology", 1972, XIV, pp. 219-236.
Reeves, R. B., The interaction of body temperature and acid-base balance in ectothermic vertebrates, in ‟Annual review of physiology", 1977, XXXIX, pp. 559-586.
Relman, A. S., The acidosis of renal disease, in ‟American journal of medicine", 1968, XLIV, pp. 706-713.
Robin, E. D., Relationship between temperature and plasma pH and carbon dioxide tension in the turtle, in ‟Nature", 1962, CXCV, pp. 249-251.
Robin, E. D., Bromberg, P. A., Editorial: Claude Bernard's milieu intérieur extended: intracellular acid-base relationships, in ‟American journal of medicine", 1959, XXVII, pp. 689-692.
Robin, E. D., Bromberg, P. A., Cross, C. E., Some aspects of the evolution of Vertebrate acid-base regulation, in ‟Yale journal of biology and medicine", 1969, XLI, pp. 448-467.
Robinson, J. R., Fundamentals of acid-base regulation, Oxford 19755.
Robson, J. S., Bone, J. M., Lambie, A. T., Intracellular pH, in Advances in clinical chemistry (a cura di O. Bodansky e C. P. Stewart), vol. XI, New York-London 1968, pp. 213-275.
Schwartz, W. B., Jenson, R. L., Relman, A. S., Acidification of the urine and increased ammonium excretion without change in acid-base equilibrium. Sodium reabsorption as a stimulus to the acidifying process, in ‟Journal of clinical investigation", 1955, XXXIV, pp. 673-680.
Severinghaus, J. W., Mitchell, R. A., Richardson, B. W., Singer, M. M., Respiratory control at high altitude suggesting active transport regulation of CSF pH, in ‟Journal of applied physiology", 1963, XVIII, pp. 1155-1166.
Smith, H. W., The physiology of the kidney, Oxford 1937.
Smith, H. W., Principles of renal physiology, New York 1956.
Thomas, R. C., The role of bicarbonate, chloride and sodium ions in the regulation of intracellular pH in smail neurones, in ‟Journal of physiology", 1977, CCLXXIII, pp. 317-338.
Van Slyke, D. D., Some points of acid-base history in physiology and medicine, in ‟Annals of the New York Academy of Sciences", 1966, CXXXIII, pp. 5-15.
Waddell, W. J., Bates, R. G., Intracellular pH, in ‟Physiological reviews", 1969, XLIX, pp. 285-329.
Walker, A. M., Bott, P. M., Oliver, J., MacDowell, M. C., The collection and analysis of fluid from single nephrons of the mammalian kidney, in ‟American journal of physiology", 1941, CXXXIV, pp. 580-595.
Walker, J. L., Brown, H. M., Intracellular ionic activity mesurements in nerve and muscle, in ‟Physiological reviews", 1977, LVII, pp. 729-778.
Wick, T., Frömter, E., Das Zellpotential des proximalen Konvoluts der Rattenniere in Abhängigkeit von der peritubulären Ionenkonzentration, in ‟Pflügers Archiv", 1967, CCXCIV, p. R 17.
Windhager, E. E., Micropuncture techniques and nephron function, London 1968.
Winters, R. W., Dell, R. B., Regulation of acid-base equilibrium, in Physiological controls and regulations (a cura di W. S. Yamamoto e J. R. Brobeck), Philadelphia 1965, pp. 362 ss.