retina
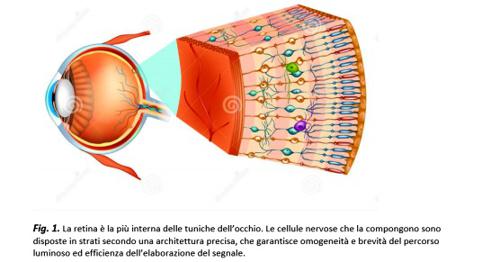
Membrana nervosa, sottile e trasparente, adagiata sulla superficie interna dell’occhio e interposta tra il corpo vitreo e la coroide; durante l’embriogenesi, si sviluppa dall’epitelio neurale della coppa ottica, una evaginazione del diencefalo e costituisce quindi una vera e propria porzione del Sistema Nervoso Centrale (SNC), collocata in posizione periferica. Al pari di altri organi centrali (quali l’encefalo o il midollo spinale), la retina è formata da neuroni, cellule nervose eccitabili che comunicano tramite sinapsi chimiche e giunzioni elettriche, e da cellule gliali (
); è servita da un sistema dedicato di vasi sanguigni e gode del cosiddetto privilegio immunologico, ossia può tollerare l’ingresso di antigeni esterni reagendo con una risposta infiammatoria e immunitaria contenuta.
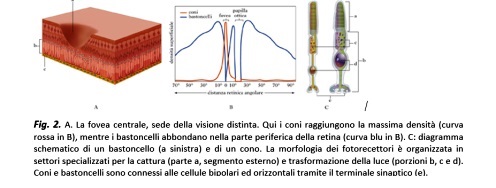
Le cellule più numerose della retina sono i fotorecettori, neuroni squisitamente sensibili alla radiazione luminosa. Posti sullo strato più esterno della retina, questi elementi sensoriali comprendono i bastoncelli, circa 120 milioni nella retina umana, molto sensibili alla luce e deputati alla visione in condizioni scotopiche (notturne); e i coni, circa 6.5 milioni di cellule nell’uomo, deputati alla visione fotopica (diurna), a cui gli esseri umani sono maggiormente adattati. I coni consentono di percepire i colori e di raggiungere una elevata capacità di discriminazione spaziale, quella che chiamiamo acuità visiva.
Grazie alla presenza di due tipi di fotorecettori, la retina dei Vertebrati, per questo detta duplice, è in grado di operare in un intervallo di intensità luminose che copre quasi 10 unità logaritmiche (o 10 miliardi di unità), permettendoci di percepire con uguale efficienza sia la debole luce delle stelle che la abbagliante brillantezza del sole di mezzogiorno. Rispetto a quella di altri organi di senso, la sensibilità del sistema visivo è insuperata; inoltre la vista contribuisce un enorme apporto di informazioni alla percezione sensoriale dell’uomo, biologicamente considerato “animale visivo”.
I fotorecettori non sono disposti in modo uniforme sul fondo dell’occhio. I bastoncelli sono localizzati principalmente nella periferia della retina e contengono un unico tipo di pigmento fotosensibile, la rodopsina. I coni, invece, possono contenere fotopigmenti sensibili al rosso, al verde o al blu; nei Mammiferi cosiddetti foveati (alcuni primati, uomo incluso) la densità dei coni aumenta progressivamente verso il centro della retina, per raggiungere il massimo in una depressione di 0.5 mm di diametro chiamata, appunto, fovea, situata internamente ad una zona pigmentata, denominata macula. Quest’area in cui i coni raggiungono la densità massima corrisponde alla sede retinica della “visione distinta” (
). La fovea, infatti, è posta sull’asse ottico in modo tale che la luce che attraversa perpendicolarmente l’occhio cada esattamente al centro di essa e, sebbene contenga meno dell’1% dei coni della retina, impegna funzionalmente almeno 1/4 di tutti i neuroni retinici posti a valle dei fotorecettori. L’immagine foveale è campionata quindi ad altissima frequenza e successivamente processata con altrettanta fedeltà, in quanto almeno il 40% delle aree visive del cervello sono dedicate ad elaborare i segnali provenienti dalla sola retina centrale. Vari centri cerebrali (come il collicolo superiore e i nuclei dei nervi oculomotori) coordinano il segnale retinico e quello motorio, in modo che i movimenti oculari portino l’immagine a formarsi simultaneamente sulle fovee di entrambi gli occhi, garantendo automaticamente una visione binoculare ad alta definizione per tutte le operazioni a distanza ravvicinata, come leggere, scrivere, riconoscere i volti. La degenerazione maculare e tutte le malattie che alterano l’efficienza di questo complesso meccanismo portano quindi ad una progressiva perdita della visione distinta, influendo negativamente sulla qualità della vita.
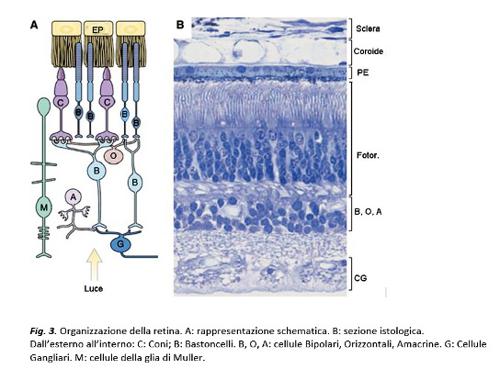
Quando le immagini del mondo esterno si formano sulla retina, le radiazione luminose interagiscono con i fotorecettori, attivando una cascata di reazioni biochimiche (la fototrasduzione) che determina la genesi di segnali elettrici; questi si propagano radialmente attraverso una catena di neuroni retinici cosiddetta “verticale”, che passa attraverso le cellule bipolari, per terminare con le cellule ganglionari, i cui assoni si aggregano in fasci a formare il nervo ottico, il secondo delle 12 paia di nervi cranici e l’unica via di uscita dalla retina. Nella retina sono presenti anche le cellule orizzontali e quelle amacrine (o neuroni senza assone), interposte tangenzialmente rispetto alla via di comunicazione verticale ed aventi un’importante funzione di regolazione della risposta elettrica (
). Infatti, se le prestazioni funzionali della retina si devono in primis alle cellule direttamente capaci di reagire allo stimolo luminoso, i coni e i bastoncelli, è noto che il segnale che in queste nasce arriva al cervello solo dopo una cascata di passaggi attraverso neuroni “dedicati”, che lo scompongono in modo parallelo isolandone parametri fondamentali, tra cui il contrasto, l’intensità, le caratteristiche temporali (veloci e lente) e cromatiche. Elementi chiave di questo processo analitico, che prende il nome di “parallel processing”, sono le cellule bipolari della retina, rappresentate in almeno una dozzina di tipi diversi. Tra questi, si distinguono cellule selettivamente dedicate ai bastoncelli, estremamente sensibili alla luce e appartenenti ad un unico tipo, e 11-13 varietà di cellule bipolari dei coni, distinguibili su base morfologica e funzionale e assegnate ad analizzare diverse componenti dello stimolo luminoso. Il segnale visivo, scisso in elementi paralleli, viene trasmesso alle cellule gangliari, dove viene ulteriormente elaborato, prima di lasciare la retina in forma di impulsi nervosi rapidi trasportati dal nervo ottico. Il messaggio originato nella retina attraversa quindi stazioni cerebrali intermedie, per giungere alla corteccia visiva primaria, situata nella parte occipitale del cervello. La corteccia è deputata ad elaborare l’informazione in modo da permettere la percezione dell’immagine, una trasformazione che richiede il corretto funzionamento dell’intera via ottica. In aggiunta alla corteccia visiva primaria, denominata V1, numerose altre aree cerebrali elaborano informazioni che riguardano la visione: si calcola che fino all’80% dei dati che raggiungono il cervello dell’uomo provenga, appunto, dal sistema visivo, che nella nostra specie domina la percezione sensoriale, la vita di relazione e anche la comunicazione. È solo nella corteccia cerebrale che si perviene a ciò che chiamiamo “visione”, ossia un processo di sintesi per cui i segnali nati nella retina diventano percezione sensoriale unificata. È grazie a questo processo che vediamo automaticamente i chiaro-scuri, i corpi fermi e quelli in movimento, le luci che aumentano o diminuiscono, i colori che facilitano l’identificazione degli oggetti, le tastiere del telefonino o del computer su cui digitiamo velocemente lettere sempre perfettamente a fuoco, adeguandoci con efficienza immediata a enormi cambiamenti di intensità luminosa, di contrasto, di sfumature cromatiche. Questa capacità di calcolo parallelo inizia nella retina, a livello della prima stazione sinaptica, dove i fotorecettori incontrano le cellule bipolari ma è solo nel cervello che una radiazione elettromagnetica diventa, effettivamente, “luce”.
Reti neurali retiniche: la via dei bastoncelli
La facilità con cui la retina può essere studiata, sia a livello sperimentale che clinico, e l’estrema regolarità della sua architettura, l’hanno resa una delle aree del SNC che conosciamo meglio. Siamo in grado di elencare i singoli tipi neuronali che la compongono e gran parte del loro “connettoma”, ossia la mappa delle connessioni sinaptiche che li uniscono. Una delle reti nervose che sono note da più tempo è la cosiddetta “via dei bastoncelli”, ossia l’insieme di neuroni responsabili del trasferimento del segnale originato in questi fotorecettori fino all’uscita della retina.
Le cellule bipolari che ricevono il segnale generato dai bastoncelli non si collegano direttamente alle cellule gangliari ma riversano gran parte del segnale su una cellula amacrina chiamata AII (A due), un piccolo neurone caratteristico della retina dei Mammiferi. A sua volta, la amacrina AII elabora e distribuisce il segnale su tipi diversi di cellule bipolari dei coni, che, finalmente, lo inviano alle cellule gangliari e quindi all’uscita della retina. Ognuno dei passaggi di comunicazione comporta elaborazione e arricchimento del segnale stesso. Ma perché separare coni e bastoncelli nella retina esterna per poi far confluire il segnale a valle di questi sensori?
La confluenza è in realtà parziale, perché coni e bastoncelli hanno ambiti operativi diversi, rispettivamente fotopico e scotopico, ossia alla luce e al crepuscolo, per cui le due vie di segnalazione godono di una separazione funzionale. Ma la particolare disposizione dei neuroni nella via dei bastoncelli ha anche una spiegazione evolutiva: il sistema dei coni, il più antico, ha scolpito l’architettura primordiale della retina, favorendo la selezione di numerosi tipi di bipolari, i canali paralleli già descritti. La successiva comparsa dei bastoncelli ha selezionato una cellula bipolare dedicata che si è “innestata” sulla architettura preesistente, reclutando la cellula amacrina AII per poi far convergere il segnale sulle bipolari dei coni. In questo modo, anche la via dei bastoncelli ha potuto attingere alle multiformi proprietà funzionali delle cellule bipolari dei coni (e del parallel processing) senza necessità di duplicare inutilmente, e a costi energetici elevati, tutti i tipi di neuroni già presenti nella retina e inizialmente dedicati ai coni stessi. Così l’elevata sensibilità garantita dalla duplicità delle cellule fotosensibili è stata trasportata anche nella parte interna della retina, conservandone la strabiliante capacità operativa e potenza di calcolo. D’altra parte, l’evoluzione di un sistema visivo sensibile alla luce crepuscolare ha permesso la conquista di nuovi habitat e risorse vitali.
Le cellule gangliari intrinsecamente fotosensibili
La retina è dotata di un secondo sistema di sensori luminosi, paralleli ai coni e ai bastoncelli e situati a valle di questi: si tratta di cellule gangliari, scoperte circa 20 anni fa e presenti nella retina di tutti i Vertebrati, che esprimono la melanopsina, un fotopigmento distinto da quello dei fotorecettori e che alimenta una serie di risposte fisiologiche riflesse alla base dei ritmi circadiani. Questi indicano l’oscillazione nelle 24 ore del giorno di numerose funzioni biologiche, quali la temperatura corporea, il sonno, la veglia, la produzione di ormoni ecc. Le cellule gangliari contenenti melanopsina si collegano al cervello in una parte dell’ipotalamo, il nucleo soprachiasmatico, definito il “master clock”, ossia il principale orologio biologico corporeo. La sensibilità della melanopsina alla luce ambientale conferisce alla retina una ancestrale abilità: quella di informare il cervello circa variazioni diurne e notturne della quantità di luce, consentendo l’adeguamento automatico della macchina biologica (e del suo metabolismo) all’habitat naturale. Ci sono quindi due sistemi fotosensibili: uno, situato nella parte più esterna della retina, è basato sui coni e sui bastoncelli ed è deputato alla visione in senso stretto, con abilità di discriminazione delle forme e dei colori; l’altro, basato sulle cellule gangliari intrinsecamente fotosensibili, è situato nella retina interna e veicola informazioni che riguardano variazioni globali della luminosità ambientale.
La luce ambientale mostra sia ritmicità circadiana che stagionale; pertanto, la retina riferisce al cervello anche variazioni temporali della luce che influenzano fenomeno biologici di importanza generale per la specie, come la migrazione e il cambiamento di fertilità caratteristico dei cicli riproduttivi.
Affacciarsi sul fondo dell’occhio
La retina è l’unica parte del SNC osservabile direttamente dall’esterno e con metodi non invasivi. Un notevole avanzamento dell’imaging diagnostico in oftalmologia è stato conseguito con l’introduzione della Tomografia Ottica Computerizzata (OCT), o a radiazione coerente. L’OCT è uno scanner che permette un esame oculare accuratissimo basandosi su una sorgente laser non invasiva, capace di generare immagini ad alta risoluzione che comprendono la regione centrale della retina e il punto di emergenza del nervo ottico. Le immagini possono essere ruotate su vari piani e osservate da diverse angolazioni, analizzate quantitativamente ed interpretate con algoritmi di Intelligenza Artificiale (AI), una metodica che in oftalmologia sta accelerando l’identificazione e il trattamento di numerose patologie. Gli OCT di ultima generazione permettono una analisi ad altissima risoluzione della retina, dei vasi sanguigni dell’occhio (angio-OCT) e dell’epitelio pigmentato, l’importante monostrato di cellule adeso ai fotorecettori, fondamentale per il loro corretto funzionamento.
L’introduzione in oftalmologia dell’Ottica Adattiva (AO) ha aperto la strada alla possibilità di esaminare addirittura le singole cellule della retina in vivo. La AO è basata su una tecnica in grado di correggere le aberrazioni (ossia le distorsioni) ottiche, ed è stata sviluppata in astronomia per osservare immagini di stelle e pianeti con telescopi terrestri, eliminando l’effetto di sfuocamento dovuto all’atmosfera. L’oftalmoscopia AO è in grado di generare immagini di altissima qualità, in cui i singoli fotorecettori retinici possono essere osservati in vivo e in modo non invasivo. Come le stelle lontane, queste cellule del diametro di pochi micron (millesimi di millimetro) sono assimilabili a sorgenti puntiformi di luce la cui visualizzazione è divenuta possibile grazie alla riduzione delle zone fuori fuoco generate dalle imperfezioni dell’occhio. Nel tempo, gli oftalmologi hanno imparato a riconoscere la morfologia AO dei fotorecettori normali, identificando ben presto anche le anomalie causate da patologie della retina. Pertanto, la AO sta diventando uno strumento diagnostico di crescente uso.
Di recente si sono ottenuti notevoli progressi nell’identificazione di marcatori biologici oculari per la diagnosi di varie malattie neurodegenerative, inclusa quella di Alzheimer, alla quale è stata frequentemente associata una anomalia delle fibre del nervo ottico, rivelabile tramite esame OCT. Interessante è notare che le placche amiloidi, caratteristiche deposizioni presenti nel cervello dei soggetti colpiti da questa malattia, risultano visibili nel fondo dell’occhio di roditori modello di Alzheimer esaminati con apparecchi simili agli OCT usati in oculistica, suggerendo prospettive di diagnosi tramite l’osservazione diretta della retina. Lo sviluppo di una metodica non invasiva per l’identificazione precoce dell’Alzheimer è particolarmente importante, data la natura progressiva di questa condizione e il fatto che, al momento, la diagnosi definitiva più attendibile viene effettuata solo postmortem.
Patologie ereditarie della retina
In quanto porzione del SNC, la retina è costituita da neuroni incapaci di rigenerare: una patologia che determini la morte di queste cellule ha pertanto un esito irreversibile. Nella Retinite Pigmentosa (RP), una mutazione (spesso in un gene espresso in modo specifico nei bastoncelli) porta alla graduale degenerazione dei fotorecettori con perdita progressiva della vista, fino alla cecità legale.
La RP è caratterizzata da grande eterogeneità: molti sono i geni (per funzione e modalità di trasmissione) che, mutati, conducono a uno stesso quadro clinico. E’ una patologia relativamente lenta, che si evolve in anni, e rara (l’incidenza stimata è di circa 1:4000) ma non per questo di minor impatto: l’aumento dell’aspettativa di vita nei paesi industrializzati e i costi sociali della patologia, sommati a quelli causati dall’invecchiamento e al ruolo fondamentale che il sistema visivo riveste per l’uomo, ne sollecitano la presa in carico per sviluppare nuove strategie di cura. E in effetti, se al momento non esiste una vera cura per la RP, si può affermare gli ultimi 20 anni hanno comportato un enorme progresso delle conoscenze, soprattutto nell’ambito della biologia molecolare e della genetica di questa famiglia di patologie.
In particolare, la terapia genica ha introdotto nel settore una vera e propria rivoluzione copernicana, permettendo in alcuni casi di correggere il difetto genetico responsabile della cecità. A questo scopo, si è sfruttata la capacità di alcuni virus di infettare le cellule nervose, caricandoli in laboratorio del materiale genetico necessario a correggere la mutazione e in seguito iniettandoli nell’occhio dei pazienti, in prossimità dei fotorecettori. Il virus è quindi penetrato nelle cellule bersaglio difettose, cedendo loro il materiale genetico e rendendole capaci di sintetizzare copie funzionanti della proteina mutata. La terapia genica è stata quindi in grado di restituire ai fotorecettori la capacità di funzionare, permettendo ai pazienti di recuperare la vista ormai perduta.
La retina è stata la prima area del SNC in cui si è effettuata la terapia genica con recupero della funzione. Il limite di questo approccio è rappresentato dal fatto che le molte mutazioni responsabili della RP richiedono prove cliniche separate per ognuna di esse, allungando i tempi di messa a punto di ciascun trattamento terapeutico. Ma la strada aperta ha rappresentato un enorme avanzamento nel trattamento di tutte le patologie genetiche.