Selezione sessuale
Selezione sessuale
La selezione sessuale deriva dalla competizione per il partner e influisce profondamente, dal punto di vista evolutivo, sulla morfologia, sul comportamento, sulla storia naturale e su altre caratteristiche di molti organismi. La scelta da parte della femmina favorisce lo sviluppo di cospicui ornamenti secondari e di display nei maschi che competono per essere scelti; tuttavia l'evoluzione della scelta del partner resta un argomento ancora dibattuto. L'evoluzione degli ornamenti può anche essere favorita da lotte o segnali di minaccia tra maschi; altre forme di selezione sessuale consistono nella capacità di accoppiarsi per primo, nella resistenza nel rimanere sessualmente attivi, nella coercizione e nella competizione spermatica. Tra i limiti che riguardano i caratteri governati dalla selezione sessuale vi sono i rischi di predazione e i costi energetici, ma non esiste ancora una dimostrazione quantitativa di un equilibrio tra selezione sessuale e altre pressioni selettive. Deve essere ancora chiarita anche la grande diversità di caratteri sessuali secondari presente nelle specie animali.
Introduzione
Perché i maschi si rendono più visibili delle femmine con il canto, i colori sgargianti, le pinne grandi, le piume o altri ornamenti appariscenti? Tali caratteri fanno correre il rischio di essere scoperti dai predatori e possono avere alti costi: la selezione naturale dovrebbe favorire quei tratti che aumentano la sopravvivenza, non quelli che la riducono. l caratteri sessuali esteriori dei maschi hanno, pertanto, rappresentato un problema rilevante per la teoria darwiniana dell'evoluzione per selezione naturale.
Charles Darwin (1871) propose un intervento della selezione naturale in favore di tali caratteri maschili, sotto forma di competizione sessuale per il partner. Egli ipotizzò una preferenza da parte delle femmine verso partner appariscenti, e ciò ha comportato l'evoluzione di caratteri maschili vistosi, nonostante questi riducano la probabilità di sopravvivenza; il costo viene infatti compensato da un maggior successo neII'accoppiamento.
La teoria di Darwin sulla selezione sessuale ha sollevato numerose critiche da parte degli scienziati evoluzionisti. Gran parte dello scetticismo si basava sul presupposto errato che gli individui di sesso femminile non sono in grado di effettuare le discrirninazioni necessarie e di scegliere tra i maschi. La teoria ha ricevuto un ampio consenso solo di recente, attraverso modelli matematici e prove empiriche.
La selezione sessuale
Perché vi è competizione per il partner? La selezione sessuale richiede l'accoppiamento e la riproduzione sessuata, condizione necessaria perché, nella progenie, vi sia la combinazione del materiale genetico dei due genitori. Le conseguenze più ovvie della selezione sessuale dipendono anche dalla presenza, nei due sessi, di cellule germinali di dimensioni differenti: i maschi producono una gran quantità di spermatozoi piccoli e mobili, mentre le femmine poche uova grandi e ricche di materiale nutritivo. Queste differenze tra i gameti sono alla base dell'evoluzione delle differenze sessuali nel comportamento e nella morfologia.
Indipendentemente da come si sono evoluti i sessi e dal dimorfismo dei gameti, argomento tuttora dibattuto, la loro esistenza costituisce di per sé il contesto per l'azione della selezione sessuale. l maschi, in grado di produrre molti più gameti delle femmine, competono per accoppiarsi con quante più femmine feconde possibili. D'altra parte le femmine, investendo le loro risorse in un minor numero di gameti, devono essere più caute nella scelta del partner.
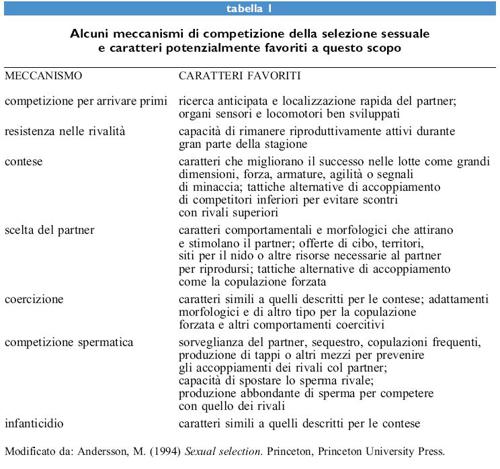
La selezione sessuale di un carattere costituisce una 'scorciatoia' per le differenze nel successo riproduttivo, le quali sono causate dalla competizione per il partner e per le fecondazioni, e sono correlate all'espressione del carattere. Tali differenze possono derivare da molte forme di competizione diretta o indiretta per il partner (tab. I). Possono riguardare la qualità del partner così come il numero di partner e possono essere la conseguenza della scelta del partner, di lotte, contese per arrivare primi, competizioni basate sulla resistenza o qualsiasi altra forma di rivalità tra partner (Andersson, 1994).
Occorre considerare come la scelta del partner da parte di un sesso è sufficiente per scatenare la competizione per il partner nell'altro sesso, anche nell'eventualità che i rivali non si incontrino mai direttamente. Quando una femmina accetta che un maschio fecondi le sue uova, queste non sono più disponibili per un altro maschio. La competizione per il partner e la fecondazione sono dunque gli aspetti fondamentali di tutta la selezione sessuale, anche di quella basata sulla scelta da parte della femmina, in quanto essa crea competizione tra i maschi sottoposti alla scelta. La distinzione spesso riportata tra la selezione sessuale effettuata attraverso la scelta della femmina e quella realizzata attraverso una competizione diretta tra maschi è dunque fuorviante, così come lo sono le locuzioni "selezione intersessuale" e "selezione intrasessuale". Qualsiasi forma di selezione sessuale è intrasessuale nel senso che è implicita la competizione tra membri dello stesso sesso. Vi è competizione tra maschi per essere scelti dalle femmine, per arrivare primi nelle lotte, per vincere gli scontri nei combattimenti e così via. Il lavoro pionieristico svolto da G. Parker negli anni Settanta mostra chiaramente che la selezione sessuale, sotto forma di competizione spermatica, può svolgere un ruolo importante anche dopo la copula, nel caso in cui la femmina si accoppi con diversi maschi. La competizione spermatica potrebbe essere combinata con la scelta degli spermatozoi; la femmina, per esempio, potrebbe esercitare un controllo sulla paternità tramite meccanismi interni, in seguito ad accoppiamenti con maschi diversi (Eberhard, 1996). Il fenomeno della competizione spermatica è stato ampiamente descritto e stanno crescendo le indicazioni a favore di una scelta tra spermatozoi, tuttavia una valutazione della sua relativa importanza richiede approfondimenti ulteriori (v. il saggio di M. Gomendio, Competizione spermatica).
l meccanismi di selezione sessuale che hanno richiamato maggiormente l'attenzione sono la scelta del partner, le contese e la competizione spermatica (v. tabella l); la gran parte delle ricerche ha dimostrato infatti l'importanza di questi tre meccanismi (Andersson, 1994). La scelta del partner e l'evoluzione di tale comportamento costituiscono uno dei problemi più complessi della biologia evolutiva, sollevando questioni che sono state affrontate ampiamente solo di recente.
Altre forme di selezione sessuale hanno ricevuto minore attenzione. Una di esse è la resistenza nelle rivalità (v. tabella l) in cui l'abilità a rimanere attivi in un lek (arena nuziale) o in un altro sito per l'accoppiamento è un fattore decisivo per il numero di accoppiamenti e di figli. Un altro meccanismo è costituito dalla capacità di trovare il partner prima dei rivali. Ciò si può ottenere tramite uno sviluppo o una maturazione precoce; infatti i maschi spesso diventano attivi prima delle femmine, fenomeno noto come proterandria, che si osserva sia in certe piante che in certi animali. Un altro metodo è la localizzazione rapida di potenziali partner, favorita da organi di senso ben sviluppati, motilità e memoria spaziale.
La selezione sessuale potrebbe dunque avere effetti a lungo termine che riguardano perfino il sistema neurosensoriale: essa ha probabilmente contribuito all'evoluzione di occhi grandi o antenne nei maschi di molte specie di insetti (Thornhill e Alcock, 1983). In certi mammiferi la ricerca delle femmine favorirebbe apparentemente maschi con una memoria spaziale migliore: questa è associata nei maschi a un più grande ippocampo, una struttura del cervello implicata nell'apprendimento spaziale e che si sviluppa maggiormente durante la stagione riproduttiva (Jacobs, 1996). Nelle piante le competizioni per l'impollinazione probabilmente favoriscono i tubi pollinici a crescita rapida e i caratteri che attirano gli impollinatori, come fiori appariscenti, odori e nettare (Andersson, 1994; Willson, 1994).
Un altro possibile meccanismo è la coercizione, in cui un maschio utilizza la minaccia o la forza per aumentare le probabilità che una femmina si accoppi con lui e non con altri maschi (Clutton-Brock e Parker, 1995). Sequestri, molestie, intimidazione e copulazione forzata appartengono a questa categoria. Altre tattiche adottate in fasi più tardive del ciclo riproduttivo sono l'aborto indotto o l'infanticidio, per rendere una femmina disponibile per un nuovo maschio.
A eccezione della competizione spermatica, tutti i meccanismi riportati nella tabella l sono validi anche per le femmine. La selezione sessuale è in genere più intensa nei maschi dato che questi hanno un tasso potenziale di riproduzione più elevato rispetto alle femmine (v. il saggio di J.D. Reynolds, Sistemi riproduttivi). Si verifica spesso che i diversi meccanismi di selezione sessuale agiscano insieme, e si pone così il problema, raramente affrontato, della stima dell'importanza relativa di ciascuno di essi; è necessario ancora molto lavoro per misurare i differenti meccanismi che operano contemporaneamente.
Scelta e preferenze del partner
Malgrado gran parte delle ricerche mostrino come spesso le femmine, e anche i maschi, scelgano il loro partner, le modalità con cui la scelta da parte della femmina favorirebbe l'evoluzione degli ornamenti maschili sono ancora dibattute e lo stesso vale per le modalità con cui si evolvono le preferenze femminili. A tale proposito sono stati suggeriti diversi meccanismi, che illustreremo brevemente.
Il processo di Fisher
La teoria di Darwin della selezione sessuale era incompleta dato che non spiegava perché le femmine dovrebbero scegliere. R. Fisher, agli inizi del 20° secolo, suggerì che "una preferenza sessuale di un particolare tipo potrebbe conferire un vantaggio selettivo e dunque divenire stabile nella specie".
Supponiamo che si origini una variazione genetica in un tratto maschile come la lunghezza della coda e che il maschio con una coda più lunga della media ottenga un leggero vantaggio di sopravvivenza, per esempio, una maggiore agilità. Assumiamo anche che le femmine scelgano il loro partner e che nelle loro preferenze vi sia variazione genetica: quelle che preferiscono maschi con la coda più lunga tendono ad avere una prole con un'elevata probabilità di sopravvivenza. Perciò i geni che codificano code più lunghe si diffondono nei maschi e lo stesso si verifica per i geni che rendono le femmine più attratte dai maschi con la coda più lunga, dato che i due tipi di geni sono associati nella loro prole. Andando avanti, i maschi con la coda più lunga sono favoriti non solo da una maggiore sopravvivenza, ma anche da un maggiore successo di accoppiamento, dato che la preferenza per le code più lunghe si diffonde tra le femmine. Il maggiore successo di accoppiamento dei maschi con la coda lunga aumenta la diffusione dei geni per la coda lunga e per la preferenza femminile a essi associata con frequenza sempre maggiore, generando un processo di feedback positivo 'al rialzo'. Il processo si interrompe, infine, quando la coda diviene così lunga da ridurre la sopravvivenza del maschio, contro bilanciando il vantaggio nelle possibilità di accoppiamento.
L'idea di Fisher presuppone l'esistenza di modificazioni nelle frequenze geniche oggi esplorate attraverso modelli matematici che le descrivono; è stata verificata così la logica della teoria (Pomiankowski et al., 1991). l modelli di selezione sessuale per la scelta del partner sono diventati sempre più sofisticati, e si deve ricorrere spesso alla genetica quantitativa o alla teoria dei giochi per analizzare le diverse possibilità.
Meccanismi indicatori
È possibile che i caratteri sessuali maschili esteriori e vistosi siano preferiti dalle femmine in quanto indicano un'elevata capacità di sopravvivenza, ereditabile. Se una femmina si accoppia con un maschio con molti ornamenti probabilmente produce prole che sopravvive con successo. l modelli mostrano che questi meccanismi indicatori, di tipo genetico, agiscono più efficacemente se gli ornamenti sono dipendenti dalla condizione generale del maschio e si sviluppano in proporzione al proprio fenotipo e al genotipo (1wasa et al., 1991). Diverse spiegazioni sono state addotte per motivare la possibile importanza dei meccanismi indicatori; una di esse è rappresentata dall'interazione tra parassita e ospite (Hamilton e Zuk, 1982). Il grado di resistenza ai parassiti o ai patogeni potrebbe riflettersi in caratteristiche, come colori brillanti, utilizzabili come segnali nella scelta del partner. Numerose evidenze sperimentali dimostrano l'importanza dei meccanismi indicatori (Andersson, 1994; Møller, 1994; Johnstone, 1995).
Riconoscimento specie-specifico
Non è necessario che un ornamento rifletta una maggiore probabilità di sopravvivenza per evolversi. Un'alternativa plausibile è costituita dal miglioramento del riconoscimento specie-specifico per ridurre il rischio di accoppiamenti ibridi. È stato dimostrato in diversi animali il ruolo svolto dalla selezione per il riconoscimento specie-specifico nell'evoluzione dei segnali o delle preferenze del partner. Le relazioni tra selezione sessuale, riconoscimento specie-specifico e speciazione costituiscono attualmente un attivo campo di ricerca. Tuttavia, anche se il riconoscimento specie-specifico gioca un ruolo nella selezione sessuale, tale spiegazione non appare in grado di rendere conto pienamente dei tratti sessuali più evidenti come la coda delle vedove codalunga. Esse si sono sviluppate molto più di quanto sarebbe necessario per il riconoscimento specie-specifico; probabilmente in questo caso sono coinvolti altri processi.
Benefici diretti sul fenotipo
Variazioni nell'abilità parentale potrebbero anche condurre all'evoluzione di tratti che pubblicizzano un'alta qualità parentale con benefici immediati per il partner e la prole. Per esempio, a causa di una correlazione con l'abbondanza di cibo nel territorio, il tasso di canto di un maschio potrebbe fornire un segnale della sua futura prestazione come genitore e della situazione alimentare per la femmina e la sua prole (Kirkpatrick e Ryan, 1991; Andersson, 1994). Non vi sono in genere ovvi benefici diretti della scelta del partner negli animali che utilizzano il sistema dei lek, in cui le femmine visitano i maschi solo per l'accoppiamento (Höglund e Alatalo, 1995).
Predisposizioni sensoriali e origini delle preferenze
Un nuovo tratto maschile potrebbe essere anche favorito da uno sfruttamento sensoriale in quanto coinciderebbe con una predisposizione già esistente nel sistema sensoriale femminile originatasi in qualche altro contesto (Ryan e Keddy-Hector, 1992). Tale meccanismo è certamente operante in diverse specie; un esempio è rappresentato dalla rana di Tungara (v. oltre).
Risultati empirici
È dovuto trascorrere un secolo dall'opera di Darwin affrnché negli anni Settanta, sotto lo stimolo di anticipazioni teoriche, la selezione sessuale divenisse un florido campo di ricerca fino a costituire parte essenziale della biologia evolutiva. I diversi tipi di approccio vanno dagli studi sul campo, condotti anche nelle parti più remote del mondo, agli studi di laboratorio, per analizzare la parentela genetica con i più recenti metodi di biologia molecolare, fino alla realizzazione di modelli matematici dei meccanismi di selezione sessuale. In conseguenza di ciò, oggi centinaia di studi descrivono l'azione della selezione sessuale in organismi che vanno dagli artropodi agli uccelli e ai mammiferi (Andersson, 1994); insetti, uccelli, anfibi e pesci predominano tra le specie studiate. Tra i caratteri maschili che più spesso appaiono controllati dalla selezione sessuale figurano il canto e il display (esibizione), la dimensione corporea, gli ornamenti esteriori, il territorio o altre risorse.
La scelta attiva da parte della femmina è stata riscontrata in più di 150 studi così che l'idea di Darwin, un tempo controversa, è stata avvalorata abbondantemente. Anche la scelta attiva da parte del maschio è diffusa, per esempio in specie a crescita indeterminata in cui i maschi preferiscono femmine grandi e feconde. Le contese maschili, in cui i maschi competono per le femmine con combattimenti o segnali di minaccia, sono state descritte in molti studi. Scontri diretti maschili o grado di resistenza nelle rivalità sono stati documentati assai più raramente, in parte forse per la scarsità di lavori dedicati a questi meccanismi.
L'applicazione del DNA fingerprinting ('impronte digitali' del DNA) e di tecniche affrni, hanno fortemente migliorato l'accuratezza della determinazione delle parentele genetiche, mostrando che la paternità spesso non corrisponde alla tipologia di accoppiamento sociale. In alcune specie i partner sociali sono quasi sempre i genitori genetici della prole; in altre specie sono comuni le fecondazioni extracoppia. Per esempio, uno studio sullo zigolo nero Emberiza schoeniclus, una specie socialmente monogama, ha mostrato come il 55% della prole avesse padri diversi da quello legato alla madre e che nutriva la prole; inoltre il contributo maschile alle cure parentali aumentava col suo grado di paternità (Dixon et al., 1994). Tra le possibili ragioni per cui le femmine cercano accoppiamenti con maschi esterni alla coppia vi sono i vantaggi trasmissibili alla prole genetica da parte di maschi di alta qualità (v. il saggio di M. Gomendio, Competizione spermatica). La grande variabilità che si osserva nel grado di paternità extracoppia tra specie diverse rimane tuttavia uno problema irrisolto.
Genetica delle caratteristiche selezionate sessualmente e delle preferenze
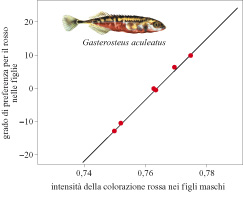
Correlazioni genetiche tra i caratteri preferiti e le preferenze (fig. 2) sono state scoperte recentemente nello spinarello Gasterosteus aculeatus (Bakker, 1993) e in poche altre specie (v. oltre). Questi risultati suggeriscono come la selezione sessuale attuata attraverso la scelta del partner abbia avuto conseguenze genetiche sostanziali. Una correlazione genetica da sola non rivela, tuttavia, quale meccanismo sia coinvolto. Una correlazione è predetta dal processo 'al rialzo' di Fisher, dagli indicatori e dai meccanismi di riconoscimento specie-specifici. Lo sviluppo di test critici per distinguere questi meccanismi e stimare la loro importanza relativa nei casi specifici rimane una delle sfide principali per i ricercatori.
Meccanismi indicatori sono stati descritti in diverse specie (Møller, 1994; Hasselquist et al., 1996). D'altra parte una rapida evoluzione divergente degli organi genitali maschili degli insetti e di altri animali sembra spiegata meglio dall'evoluzione 'al rialzo' fisheriana unita a predisposizioni sensoriali (Eberhard, 1996). Sebbene attualmente riceva meno attenzione rispetto ai meccanismi indicatori, la selezione fisheriana rimane una possibile spiegazione in molti casi.
Asimmetria fluttuante
Recentemente un crescente interesse ha indirizzato la ricerca sul fenomeno dell'asimmetria fluttuante dei caratteri sessuali secondari, intesa come deviazione casuale unilaterale dalla simmetria bilaterale perfetta. Dato che i lati del corpo sono entrambi il prodotto dello stesso genoma, il grado di asimmetria riflette la capacità del genoma stesso di contro bilanciare lo stress genetico e ambientale per produrre un fenotipo armonioso. Ciò apre la possibilità a un meccanismo indicatore di tipo genetico, che coinvolge una preferenza di accoppiamento che scelga la simmetria. Per esempio, l'asimmetria fluttuante nella lunga coda dei maschi della rondine Hirundo rustica diminuisce all'aumentare della lunghezza della coda (Møller, 1994). Una lunga coda dovrebbe dunque riflettere un elevato grado di omeostasi durante lo sviluppo, che potrebbe essere in parte ereditabile. Nella rondine l'asimmetria indotta, sia naturalmente che sperimentalmente, riduce le prestazioni di volo. l maschi con lunghe code tendono ad avere un'asimmetria minore rispetto a quelli con code più corte e hanno una prole meno affetta da parassiti. In un esperimento in cui venivano manipolate indipendentemente la lunghezza della coda e l'asimmetria, la scelta da parte della femmina ha favorito sia la simmetria, sia le code lunghe (Møller, 1994); il ruolo dell'asimmetria fluttuante nella selezione sessuale è tuttavia dibattuto e la sua analisi contiene molti punti non ancora chiariti.
Analisi di casi significativi
Gli studi che danno più informazioni sulla selezione sessuale spesso combinano differenti metodi. Gli esempi che seguono illustrano gli approcci di ricerca e i risultati ottenuti in alcune specie animali.
Colorazione del maschio e scelta della femmina nel guppy
L'habitat naturale del guppy Poecilia reticulata è costituito dai corsi d'acqua della parte nord-orientale dell'America Meridionale. Il comportamento, la colorazione sessuale maschile e le caratteristiche biologiche, come l'età della maturità sessuale, variano con la limpidezza dell'acqua e i tipi di predatori presenti (v. anche il saggio di S. Stearns, Storie naturali). Un importante studio sperimentale condotto in natura a Trinidad ha mostrato che la colorazione e le caratteristiche biologiche possono evolvere rapidamente in risposta a modificazioni delle pressioni selettive (Endler, 1980; Reznik et al., 1990). Il ciclide Crenicichla alta è uno dei principali predatori dei guppy adulti. I guppy che popolano i corsi d'acqua in cui è presente questo predatore sono stati trasferiti in un altro fiume in cui si trova un predatore diverso: il ciprinodontide Rivulus hartii, la cui preferenza è diretta soprattutto agli individui giovani. Come previsto dalla teoria della selezione sessuale, i guppy hanno sviluppato colorazioni maschili più evidenti nel nuovo corso d'acqua. In questi individui si è verificato uno spostamento verso l'alto dell'età riproduttiva e nel nuovo ambiente dopo due anni, equivalenti a 15÷30 generazioni, essi hanno generato un minor numero di figli, ma tutti di dimensioni maggiori. Dopo 30÷60 generazioni, corrispondenti a undici anni, le nuove caratteristiche biologiche della specie sono state chiaramente trasmesse e, quindi, genetiche, come dimostrato dall'allevamento in vasche di laboratorio, in assenza degli effetti ambientali, di guppy provenienti dai corsi d'acqua dove era stato effettuato l'esperimento (Reznik et al., 1990). Questo esempio mostra in maniera convincente come i caratteri sessuali secondari e la biologia della specie possano sorprendentemente andare incontro a una chiara evoluzione genetica nell'arco di poche generazioni. I guppy maschi sono fortemente polimorfici, variando in numero, dimensione, posizione e capacità di riflessione delle parti colorate. J. Endler (1980) vagliò l'ipotesi che il tipo di colorazione rappresentasse un equilibrio tra la selezione naturale per criptismo nei confronti di predatori che cacciano a vista e la selezione sessuale per brillantezza dei caratteri. Il numero di predatori e la pericolosità delle specie predatrici aumenta scendendo a valle nei corsi d'acqua abitati dai guppy. Una prima valutazione degli effetti della predazione è stata quella di osservare se il tipo di disposizione delle macchie colorate riflettesse la presenza locale dei predatori. Accadeva proprio questo: la dimensione e il numero delle macchie colorate diminuivano all'aumentare del rischio della predazione visiva. Anche quando gli animali sono stati spostati nell'altro fiume, la disposizione dei colori dopo due anni era nettamente cambiata nella direzione prevista. L'evoluzione delle tipologie di colorazione è stata esaminata anche in laboratorio per molte generazioni utilizzando popolazioni sperimentali derivate da 18 siti a Trinidad e in Venezuela. Anche in questo caso, la disposizione delle macchie nei sistemi di laboratorio con differenti predatori convergeva verso la tipologia caratteristica presente nei corsi d'acqua naturali con gli stessi predatori. Endler scoprì che le macchie di colore rosso e arancio dovute a carotenoidi conferivano ai maschi un vantaggio nella scelta del partner operata dalle femmine. Le macchie brillanti dei carotenoidi potevano rispecchiare un'adeguata alimentazione e un buono stato di salute generale, così la preferenza delle femmine si sarebbe evoluta attraverso un meccanismo indicatore di tipo genetico, una possibilità che resta da valutare in modo più approfondito.
Studi condotti in differenti popolazioni di guppy suggeriscono l'evoluzione parallela delle preferenze femminili e degli ornamenti maschili. Il grado di preferenza per le macchie colorate arancioni nelle femmine di sette popolazioni è stato correlato con la quantità di colore arancio nei maschi di quella popolazione (Roude e Endler, 1990). I risultati suggeriscono che le macchie dovute alla presenza di carotenoidi nei maschi e le preferenze delle femmine si siano evo Iute insieme e abbiano subito una divergenza genetica tra popolazioni. Non è noto se l'evoluzione parallela di caratteri sessuali e preferenze si sia verificata con un processo fisheriano, tramite indicatore di tipo genetico o di altro tipo. In conclusione, gli studi sperimentali e di laboratorio sui guppy mostrano che la colorazione cospicua dei maschi è favorita dalla scelta della femmina e contrastata dalla predazione. In accordo con le previsioni dei modelli genetici di selezione sessuale risulta evidente un'evoluzione genetica parallela delle preferenze femminili e delle macchie arancioni nei maschi.
Richiami dimostrativi nella rana di Tungara
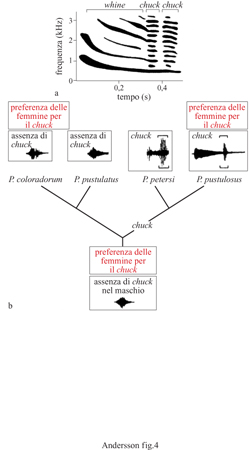
Alcuni degli studi più dettagliati sui segnali sessuali sono stati effettuati su rane e rospi. Un esempio è costituito dalla rana di Tungara, Physalaemus pustulosus, dell'America Meridionale (Ryan, 1985). I maschi si riuniscono ed emettono richiami da pozze d'acqua visitate dalle femmine che scelgono i propri partner. Questi possono essere di due tipi: uno lamentoso, whine, e uno schioccante, chuck (fig. 4). I maschi isolati emettono solo richiami lamentosi; in risposta alla competizione vocale dovuta ad altri maschi essi aggiungono richiami schioccanti più efficaci per attirare le femmine.
Si ritiene che il richiamo schioccante possa essersi evoluto per sfruttamento sensoriale in quanto la risposta caratteristica dell'orecchio della femmina si è originata per altre ragioni prima del richiamo favorito. Ciò è suffragato dall'esistenza di una sensibilità simile ai richiami schioccanti nella specie affine P. coloradorum, sebbene i maschi di questa specie non emettano richiami schioccanti. Una possibile spiegazione è che ambedue le specie abbiano ereditato la sensibilità da un antenato comune, ma solo quello della rana di Tungara e della sua specie sorella P. petersi avrebbero evoluto un richiamo schioccante che trae vantaggio dalle predisposizioni sensoriali delle femmine (Ryan e Keddy-Rector, 1992).
La proporzione delle uova non schiuse aumenta con la somiglianza nelle dimensioni tra maschi e femmine essendo, in genere, la femmina più grande. Dovrebbe perciò avere valore adattativo per gran parte delle femmine accoppiarsi con un maschio di dimensioni maggiori della media. Forse in parte per questo motivo le femmine discriminano tra canti schioccanti di differenti frequenze che riflettono differenze nella dimensione del maschio. Durante prove effettuate con altoparlanti, le fennnine si avvicinavano in genere a quelli che emettevano le frequenze fondamentali più basse, una risposta che dovrebbe favorire il più grande fra due maschi. In accordo con questa osservazione, in natura il successo di accoppiamento maschile aumenta con la dimensione corporea (Ryan, 1985).
Dato che i richiami schioccanti aiutano ad attirare le femmine, ci si potrebbe chiedere perché i maschi non li usino più spesso. Parte della risposta è contenuta nel rischio di predazione da parte dei pipistrelli della specie Trachops cirrhosus che catturano molte rane di Tungara nelle pozze dove vengono effettuati i cori. Gli esperimenti mostrano che i pipistrelli sono attratti maggiormente da richiami che contengono entrambi i tipi, anziché solo da quelli lamentosi (Ryan, 1985). Ciò probabilmente spiega perché i maschi singoli non emettono richiami schioccanti e perché questi non sono i più comuni tra i cori delle rane di Tungara. La predazione da parte dei pipistrelli dunque limita l'uso del segnale più efficace per attrarre il partner.
Code lunghe nei maschi degli uccelli
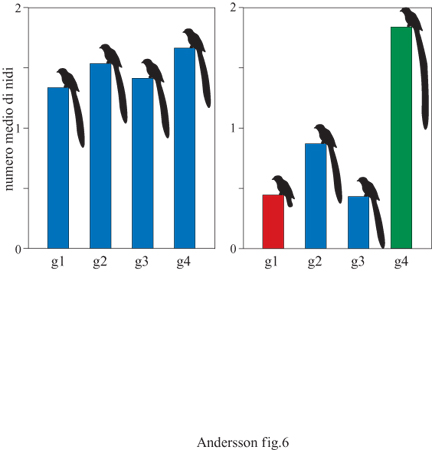
l maschi delle vedove codalunga Euplectes progne possiedono uno dei più sorprendenti ornamenti osservati negli uccelli: una coda lunga spesso più di mezzo metro la cui funzione è stata studiata modificando sperimentalmente la sua lunghezza (Andersson, 1982). All'inizio della stagione riproduttiva sono stati individuati i territori di 36 maschi e alloro interno sono state contate le femmine nidificanti. l maschi, marcati con anelli colorati, sono stati ripartiti in 9 gruppi, ciascuno costituito da 4 individui, simili per lunghezza della coda e qualità del territorio (fig. 6). La coda è stata ridotta a circa 14 cm in un maschio a caso di ciascun gruppo; ciascuna penna rimossa è stata attaccata alla corrispondente penna di un altro maschio producendo un allungamento della coda di 20÷ 30 cm. Gli altri due maschi costituivano i controlli; solo uno di questi è stato inanellato, mentre le penne della coda del quarto maschio sono state tagliate a metà e riattaccate. Si è proceduto, quindi, al conteggio dei nidi apparsi successivamente nel territorio. l risultati indicano che la coda lunga viene favorita dalla selezione sessuale attraverso la scelta del partner operata dalle femmine; queste preferiscono code supernormali dal momento che i maschi con coda allungata hanno un maggior successo nell'attirare nuove femmine. Sono state scartate due spiegazioni alternative: che i maschi con code accorciate sono meno attivi nei display di corteggiamento o che abbandonano i loro territori più spesso di altri maschi. Il comportamento di display della coda suggerisce anche che essa viene utilizzata per attirare le fennnine e non nelle contese tra conspecifici.
Esperimenti simili sono stati effettuati in diverse altre specie di uccelli. Uno studio particolarmente dettagliato è stato condotto sulla rondine Hirundo rustica da A.P. Møller (1994) il quale ha concluso che in questa specie la lunghezza della coda del maschio è un indicatore attendibile di vitalità e di buona condizione generale, riflettendo nel contempo una resistenza ereditabile ai parassiti.
Dimorfismo sessuale nella taglia degli elefanti marini
Gli elefanti marini sono tra i mammiferi in cui il dimorfismo sessuale è più accentuato. l maschi adulti della specie Mirounga angustirostris pesano più del triplo delle femmine (Deutsch et al., 1990). La risposta a un così marcato dimorfismo nella dimensione corporea è da ricercarsi nel sistema nuziale e nelle forme di competizione per il partner: lotte tra maschi e resistenza. Durante i tre mesi della stagione riproduttiva le femmine si riuniscono In spIagge per accoppIarsI e partorire; esse formano raggruppamenti compatti, i maschi combattono per le femmine e quelli dominanti possono difendere grandi gruppi. In questo sistema spiccatamente poliginico, in cui si raggiungono elevati livelli di aggressività tra i maschi, solo gli individui di dimensioni maggiori possono ottenere un rango sociale elevato e un successo di accoppiamento. Meno di un terzo dei maschi si accoppia durante una stagione riproduttiva e la gran parte degli accoppiamenti rappresenta una prerogativa esclusiva di pochi maschi. Dunque una grande dimensione corporea maschile è favorita dalla selezione sessuale nella contesa (Le Boeuf, 1974; Deutsch et al., 1990). Un altro fattore è costituito dalla lunghezza della stagione riproduttiva che favorisce la capacità di resistenza dei maschi. La capacità di immagazzinare energia aumenta con la dimensione corporea più rapidamente della crescita dei costi metabolici. Grandi dimensioni ed energia immagazzinata sotto forma di grasso dunque rendono un maschio in grado di rimanere per lungo tempo sulla spiaggia, in media 91 giorni, e inseminare molte femmine prima di tornare in mare e alimentarsi (Deutsch et al., 1990).
Le femmine hanno alcune opportunità di scelta. In genere, specialmente quando vengono montate da giovani maschi, protestano emettendo richiami a bassa frequenza e movimenti sfuggenti delle parti posteriori (v. il saggio di J.D. Reynolds, Sistemi riproduttivi). I richiami allertano i maschi presenti nelle vicinanze e quello dominante in genere se ne accorge, attacca e caccia via gli altri maschi che provano ad accoppiarsi. Le femmine protestano meno contro i maschi dominanti. Per queste ragioni il marcato dimorfismo sessuale nelle dimensioni degli elefanti marini è apparentemente una conseguenza della selezione sessuale che favorisce grandi dimensioni dei maschi nelle contese e la competizione nella resistenza; anche la scelta della femmina, però, può avere un ruolo. Gli scontri competitivi per le femmine non favoriscono nei maschi solo le grandi dimensioni. Essi spiegano anche la ragione per cui i maschi hanno sviluppato armamentari più grandi delle femmine come speroni, corni, palchi e zanne.
Canto del maschio, scelta della femmina e sopravvivenza della prole nel cannareccione
I maschi degli uccelli canori utilizzano il canto per attirare le femmine e difendere il territorio contro i rivali. In molte specie le femmine preferiscono i maschi con i più vasti repertori di tipologie canore (v. il saggio di M. Gomendio, Competizione spermatica). Per esempio, nel forapaglie Acrocephalus schoenobenus il maschio che possiede il repertorio canoro più vasto attira una femmina per primo. In laboratorio le femmine manifestano maggiormente comportamenti di sollecitazione alla copula quando sono esposte a riproduzioni di repertori canori vasti. I risultati sono simili per il cannareccione A. arundinaceus (Catchpole e Slater, 1995).
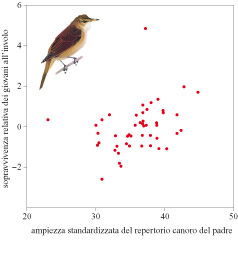
Perché le femmine preferiscono maschi con un vasto repertorio canoro? Uno studio decennale sul cannareccione è riuscito a rispondere in gran parte a questa domanda. D. Hasselquist e collaboratori (1996) hanno prelevato campioni di sangue dagli individui di una popolazione, compresi i giovani, che erano stati marcati individualmente, e hanno registrato i repertori canori dei maschi. Con accurate determinazioni della paternità, effettuate tramite DNA fingerprinting, sono riusciti a misurare la produzione di prole sopravvissuta nel corso della vita di ciascun maschio. È stata riscontrata una correlazione positiva tra l'ampiezza del repertorio canoro maschile e la sopravvivenza della propria prole dopo l'involo (fig. 8). La ricerca ha escluso variazioni tra i maschi dovute a effetti non genetici, come la qualità del territorio e il comportamento parentale maschile, in quanto la correlazione esiste anche per la prole proveniente da fecondazioni da parte di individui esterni alla coppia. Alcune femmine hanno visitato e si sono accoppiate con un maschio vicino che non ha partecipato all'allevamento della prole. In tutti e dieci i casi identificati il maschio estraneo alla coppia ha mostrato un repertorio canoro più vasto di quello del partner sociale della femmina. Sembrerebbe perciò che le femmine, cercando fecondazioni extracoppia da parte di maschi con ampi repertori canori, ottengano benefici di sopravvivenza ereditabili per la loro prole. Dunque nel cannareccione sembra entrare in gioco un meccanismo indicatore di tipo genetico, basato sul canto. La ragione per cui la prole di maschi con vasti repertori canori mostra un tasso di sopravvivenza più elevato non è chiara. Dato che la dimensione del repertorio canoro aumenta con l'età, con preferenze per repertori canori ampi, le femmine possono accoppiarsi con maschi con sopravvivenza più elevata della media, e in parte ereditabile, che si riflette nella loro età (Hasselquist et al., 1996).
Forse solo i maschi con la migliore costituzione genetica possono affrontare i costi di un vasto repertorio canoro. Il centro vocale degli uccelli costituisce uno dei pochi esempi in cui l'aggiunta di nuove cellule nel cervello si verifica anche in fase adulta (Jacobs, 1996). Il centro si accresce ogni primavera prima della stagione riproduttiva, quando i maschi cantano, e si restringe a stagione finita. Studi comparativi mostrano che le specie di uccelli canori con i repertori più vasti hanno i centri vocali più grandi. Sembra, quindi, che la selezione sessuale, tramite la scelta della femmina, abbia influito non solo sulla dimensione del repertorio canoro, ma anche sulla struttura del cervello deputata alla produzione del canto.
Costi della selezione sessuale
Darwin individuò nel rischio di predazione, in molte specie più elevato nei maschi che nelle femmine a causa della selezione sessuale, uno dei costi principali della selezione sessuale stessa. Tuttavia, diversi altri costi possono limitare l'espressione dei caratteri sessuali secondari (Andersson, 1994). Per esempio, le contese per i territori o per le femmine possono causare ferite o, addirittura, morte. Le maggiori dimensioni corporee evolutesi per selezione sessuale rendono i maschi più suscettibili delle femmine a morire per fame durante gli stadi di crescita giovanile di molti uccelli e mammiferi. I caratteri sessuali secondari possono imporre costi energetici e alimentari; diverse forme di selezione naturale potrebbero dunque limitare lo sviluppo di tali caratteri. La selezione sessuale può anche essere autolimitante; per esempio, nell'ittero alirosse Agelaius phoeniceus una grande dimensione corporea è vantaggiosa nelle contese maschili, ma i maschi più grandi trascorrono più tempo ad alimentar si e dedicano meno tempo a difendere il territorio e ad attirare le femmine (Searcy e Yasukawa, 1995).
Nessuno studio sui caratteri sessuali secondari ha finora fornito un quadro quantitativo che mostri l'equilibrio previsto tra i vantaggi della selezione sessuale e gli svantaggi della selezione naturale, o sessuale stessa. Comunque, salvo poche eccezioni, devono essere valutati anche i costi della scelta del partner.
Dimorfismo sessuale, ormoni, difesa immunitaria e scelta del partner
Lo sviluppo di ornamenti maschili in molte specie animali è un fenomeno che dipende dal testosterone (v. il saggio di J. Balthazart e L.V. Riters, in questo volume). La produzione di tale ormone è sensibile alla nutrizione e alla salute e può dunque agire come legame tra i caratteri sessuali secondari e le condizioni fisiche generali del maschio. l caratteri sessuali secondari, riflettendo la qualità fenotipica e genetica del maschio, possono dunque costituire indicatori delle stesse condizioni generali. L'espressione dei caratteri sessuali secondari in funzione delle condizioni fisiche è stata osservata in molte specie (Andersson, 1994; Møller, 1994; Johnstone, 1995). Inoltre, il testosterone può in parte sopprimere le funzioni del sistema immunitario. Una marcata espressione dei caratteri sessuali dipendente dal testosterone può dunque ridurre le capacità di difesa contro organismi patogeni e parassiti. Anche per questo motivo i caratteri sessuali secondari potrebbero essere dipendenti dalla condizione e dunque solo individui con un basso carico di agenti patogeni sarebbero in grado di permettere lo sviluppo di caratteri sessuali vistosi. L'importanza di questi meccanismi è dibattuta e le relazioni tra meccanismi ormonali, sistema di difesa immunitaria e selezione sessuale per la scelta del partner sono attualmente argomento di attiva ricerca (Svensson e Skarstein, 1997). T. von Schantz e collaboratori (1996) hanno trovato che il genotipo MHC (Major Histocompatibility Complex, complesso maggiore di istocompatibilità) nei maschi di fagiano Phasianus colchicus è associato a variazioni nella lunghezza dello sperone del maschio e alla sua condizione generale. Ciò suggerisce che le femmine potrebbero influenzare la sopravvivenza della loro prole scegliendo maschi con speroni lunghi.
Tattiche alternative di accoppiamento
In molte specie sono state osservate variazioni più o meno dimorfiche nella struttura e nel comportamento del maschio. Spesso la causa sembrerebbe essere la selezione sessuale sotto forma di competizione tra maschi nelle contese. Nei pesci e negli artropodi alcuni esempi sono forniti dai comportamenti aggressivi e di display, dalle grandi dimensioni corporee, dalle armature o da altri caratteri sessuali secondari in opposizione a taglie ridotte e a caratteri sessuali e comportamenti meno evidenti. Queste tattiche di accoppiamento alternative sono correlate a variazioni in età, taglia, condizione o altre differenze fenotipiche. Esse non conducono a un uguale successo riproduttivo, dal momento che derivano da situazioni ineguali e da limiti dovuti a differenze individuali (Gross, 1996).
Altri esempi di tattiche alternative favorite dalla selezione sessuale sono riscontrabili negli organismi che cambiano sesso, per esempio alcuni gamberi e altri crostacei, molluschi, pesci e piante (v. il saggio di J. Reynolds, in questo volume). Diventare maschi o femmine dipende in parte dalla natura e dall'intensità della competizione per il partner. Competizioni intense per le femmine in genere favoriscono lo sviluppo dapprima del sesso femminile, cambiando verso il sesso maschile quando l'individuo aumenta di dimensioni, come avviene in alcuni pesci. Nei casi in cui la competizione tra i maschi e il vantaggio di avere una grande dimensione sono più deboli, i vantaggi della fecondità conferiti dalle grosse dimensioni nelle femmine potrebbero prevalere favorendo prima lo sviluppo del sesso maschile, con inversione sessuale solo quando si raggiungono dimensioni maggiori (Charnov, 1982; Warner, 1988).
Selezione sessuale nelle piante
Una forma principale di selezione sessuale nelle piante superiori è costituita dalla competizione che insorge tra i pollini per raggiungere e fecondare gli ovuli. La competizione per l'impollinazione dovrebbe favorire un meccanismo di attrazione efficace, una ricompensa per gli impollinatori e una rapida germinazione e crescita dei tubi pollinici nello stilo. La selezione attraverso la funzione maschile spesso favorisce fiori in numero maggiore e più grandi negli ermafroditi di quanto necessario dal punto di vista di una femmina. L'evoluzione di cospicue esibizioni flore ali è stata tradizionalmente spiegata dai vantaggi ottenuti dalla fecondazione incrociata, realizzata per mezzo della capacità di attrarre impollinatori. Tuttavia anche la selezione sessuale potrebbe svolgere un ruolo importante (Andersson, 1994; Willson, 1994). La produzione di nettare e la fenologia della fioritura potrebbero essere soggette alla selezione sessuale, principalmente attraverso la funzione maschile. In certe specie, per esempio alcune orchidee, nella riproduzione femminile vi è limitazione nella produzione di polline. La selezione sessuale potrebbe poi favorire le esibizioni flore ali attraverso le funzioni femminili e maschili.
Salvo importanti eccezioni (Willson, 1994), raramente i botanici hanno considerato in dettaglio i parallelismi che si osservano tra piante e animali nei meccanismi di selezione sessuale. È probabile che emergano nuove scoperte poiché le similitudini e le differenze tra le piante e gli animali in questo contesto divengono più chiare se viste da una prospettiva esplicita di selezione sessuale.
Bibliografia citata
ANDERSSON, M. (1982) Female choice selects for extreme tail length in a widowbird. Nature, 299, 818-820.
ANDERSSON, M. (1994) Sexual selection. Princeton, Princeton University Press.
BAKKER, T.C.M. (1993) Positive genetic correlation between female preference and preferred male omament in sticklebacks. Nature, 363, 255-257.
CATCHPOLE, C.K., SLATER, P.J.B. (1995) Bird song. Cambridge, Cambridge University Press.
CHARNOV, E.L. (1982) The theory of sex allocation. Princeton, Princeton University Press.
CLUTTON-BROCK, T.H., PARKER, O.A. (1995) Sexual coercion in animaI societies. Anim. Behav., 49, 1345-1365.
DARWIN, CH. (1871) The descent of man, and selection in relation to sex. Londra, Murray.
DEUTSCH, C.J, HALEY, M.P., LE BOEUF, B.J. (1990) Reproductive effort of male elephant seal: estimates from mass loss. Can. J. Zool., 68, 2580-2593.
DIXON, A., Ross, D., O'MALLEY, S.L.C., BURKE, T. (1994) Paternal investment inversely related to degree of extra-pair paternity in the reed bunting (Emberiza schoeniclus). Nature, 371, 698-700.
EBERHARD, W.G. (1996) Female control: sexual selection by cryptic female choice. Princeton, Princeton University Press.
ENDLER, J.A. (1980) Natural selection on colour patterns in Poecilia reticulata. Evolution, 34, 76-91.
GROSS, M.R. (1996) Alternative reproductive strategies and tactics: diversity within sexes. TREE, Il, 92-98.
HAMILTON, W.D., ZUK, M. (1982) Heritable tme fitness and bright birds: a mIe for parasites? Science, 218, 384-387.
HASSELQUlST, D., BENSCH, S., SCHANTZ, T. VON (1996) Correlation between male song repertoire, extra-pair paternity and offspring survival in the great reed warbler. Nature, 381, 229-232.
HÖGLUND, J., ALATALO, R.V. (1995) Leks. Princeton, Princeton University Press.
HOUDE, A.E., ENDLER, J.A. (1990) Correlated evolution offemale mating preferences and male color patterns in the guppy Poecilia reticulata. Science, 248, 1405-1408.
IWAsA, Y., POMIANKOWSKI, A., NEE, S. (1991) The evolution of costly mate preferences. II. The 'handicap' principle. Evolution, 45, 1431-1442.
JACOBS, L.F. (1996) Sexual selectionand the brain. TREE, Il, 82-86.
JOHNSTONE, R. (1995) Sexual selection, honest advertisement and the handicap principle: reviewing the evidence. Biol. Rev., 70, 1-65.
KIRKPATRICK, M., RYAN, M.J. (1991) The evolution of mating preferences and the paradox of the lek. Nature, 350, 33-38.
LEBOEUF, B.I. (1974) Male-male competition and reproductive success in elephant seals. Am. Zool., 14, 163-176.
MØLLER, A.P. (1994) Sexual selection and the barn swallow. Oxford, Oxford University Press.
POMIANKOWSKI, A., IWAsA, Y., NEE, S. (1991) The evolution of costly mate preferences. 1. Fisher and biased mutation. Evolution, 45, 1422-1430.
REZNIK, D.A., BYGA, H., ENDLER, J.A. (1990). Experimentally induced life-history evo1ution in a natural population. Nature, 346, 357-359.
RYAN, M.l (1985) The Tungara frog: a study in sexual selection and communication. Chicago, Chicago University Press.
RYAN, M.J., KEDDY-HECTOR, A. (1992) Directional patterns of female mate choice and the mIe of sensory biases. Am. Nat., 139, 4-35.
SCHANTZ, T. VON, WITTZELL, H., GORANSSON, G., GRAHN, M., PERSSON, K. (1996) MHC genotype and male ornamentation: genetic evidence for the Hamilton-Zuk model. Proc. R. Soc. Lond. B Biol. Sci., 263, 265-271.
SEARCY, W.M., Y ASUKAWA, K. (1995) Polygyny and sexual seIection in red-winged bIackbirds. Princeton, Princeton University Press.
SVENSSON, E., SKARSTEIN, F. (1997) The meeting of two cultures: bridging the gap between ecology and immunology. TREE, 12, 92-93.
THORNHILL, R., ALCOCK, J. (1983) The evolution of insect mating systems. Cambridge, Mass., Harvard University Presso W ARNER, R.R. (1988) Sex change in fishes: hypotheses, evidence, and objections. Environ. Biol. Fishes, 22, 81-90.
WILLSON, M.F. (1994) Sexual selection in plants: perspectives and overview. Am. Nat., 144, 13-39.