sinapsi
sinapsi
I neuroni differiscono dalle altre cellule dell’organismo per la capacità di comunicare tra loro con estrema rapidità mediante sinapsi. La trasmissione sinaptica riveste quindi un ruolo chiave per comprendere il funzionamento del sistema nervoso in quanto la sua funzione fondamentale coincide con il trasferimento e l’integrazione di informazioni. La trasmissione sinaptica è operata da molecole chimiche, i neurotrasmettitori, il cui messaggio viene riconosciuto dalla cellula ricevente e tradotto in risposte biologiche in corrispondenza di una struttura specializzata, detta sinapsi. Tutte le attività nervose, dalle più semplici attività riflesse alle funzioni cognitive, dipendono dal trasferimento di informazioni tra cellule nervose e quindi dal numero di sinapsi e dall’efficienza di ciascuna di esse nel rilasciare il neurotrasmettitore. Numerose patologie neurologiche dipendono da alterazioni funzionali della trasmissione sinaptica e le sinapsi rappresentano il principale bersaglio dei farmaci attivi sul sistema nervoso. [➔ apprendimento; cervello, sviluppo del; funzioni cerebrali superiori; neurotrasmettitori; plasticità neurale; recettore nervoso] Dopo la dimostrazione, dovuta a Santiago Ramon y Cajal, che le cellule nervose sono entità individuali in grado di organizzarsi in contiguità, ma non in continuità, con altre cellule nervose a formare circuiti neurali, nel 1897 il fisiologo inglese Charles S. Sherrington coniò il termine sinapsi (dal gr. συνάπτειν, ≪mettere in contatto≫) per rappresentare la zona di contatto tra la terminazione di un assone di un neurone e la sua cellula bersaglio. Se si considera che un neurone riceve e forma una media di 1.000 connessioni sinaptiche e che nel cervello umano vi sono ca. 1011 neuroni, si può calcolare che nel sistema nervoso vi siano ca. 1014 sinapsi. Il complesso disegno delle connessioni sinaptiche e i meccanismi che sottendono al funzionamento di ogni singola s. sono alla base delle sorprendenti proprietà dell’SNC.
Struttura e funzione della sinapsi
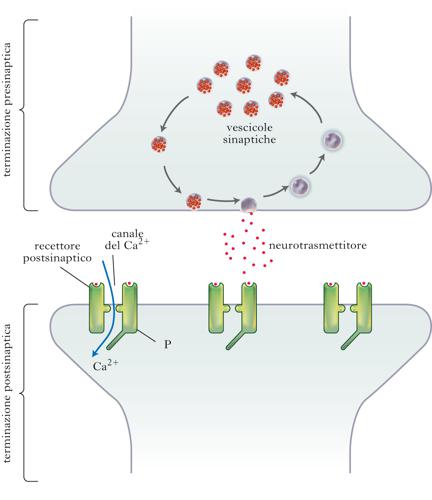
Nonostante la notevole eterogeneità sia strutturale sia funzionale, le s. possono essere suddivise in due grandi classi: s. elettriche e s. chimiche. Nelle s. elettriche la corrente ionica passa direttamente tra il lato pre- postsinaptico mediante canali (connessioni) che creano una continuità elettrica e metabolica tra la cellula presinaptica e quella postsinaptica. Tale continuità permette il rapido passaggio bidirezionale di correnti elettrotoniche in grado di determinare la generazione del potenziale d’azione nella cellula postsinaptica. Le s. elettriche, tuttavia, divengono sempre meno rappresentate negli organismi più complessi, nei quali ha preso il sopravvento la s. chimica, che rappresenta una fondamentale evoluzione della modalità elettrica di trasmissione dell’informazione tra reti nervose con caratteristiche di specializzazione, complessità e plasticità. La caratteristica fondamentale della s. chimica è quella di essere una struttura asimmetrica, in cui l’elemento presinaptico e quello postsinaptico, separati da un vallo sinaptico di circa 30-40 nm, hanno specializzazioni completamente diverse, essendo il primo specializzato nella trasduzione elettrico-chimica e nella secrezione di un messaggero chimico (neurotrasmettitore) e il secondo nella ricezione e nella successiva traduzione elettrica o metabolica del neurotrasmettitore. A livello presinaptico sono presenti piccoli organelli (le cosiddette vescicole sinaptiche), deputati all’immagazzinamento e alla liberazione del neurotrasmettitore, che sono in contatto con la membrana presinaptica in corrispondenza di ispessimenti, detti zone attive, per poi fondersi con essa all’arrivo del potenziale d’azione. A livello delle zone attive si hanno elevate concentrazioni di canali per il calcio voltaggio dipendenti, deputati alla trasduzione del segnale elettrico in un massiccio flusso di ioni Ca2+, che investe le vescicole ivi ancorate, raggiungendo concentrazioni submillimolari. Questo evento scatena l’esocitosi e il rilascio del contenuto delle vescicole (detto quanto e in genere corrispondente a un ‘pacchetto’ di 5.000-10.000 molecole di neurotrasmettitore) all’interno dello spazio sinaptico. A livello postsinaptico, il legame del neurotrasmettitore con il recettore ne determina l’attivazione, seguita da una vasta gamma di riposte postsinaptiche di tipo elettrico o di tipo metabolico che hanno conseguenze funzionali a breve, medio e lungo termine sull’efficienza, ed eventualmente anche sulla struttura stessa, della sinapsi.
Sinapsi periferiche e sinapsi centrali
Mentre nella s. neuromuscolare (➔ giunzione neuromuscolare) vengono rilasciate grandi quantità di neurotrasmettitore (acetilcolina), ampiamente sufficienti a generare, in condizioni fisiologiche, una depolarizzazione intensa della cellula muscolare che provoca lo sviluppo del potenziale d’azione, la maggior parte delle s. nel sistema nervoso centrale ha invece un comportamento diverso. I pochi quanti di neurotrasmettitore rilasciati in risposta all’arrivo del potenziale d’azione determinano singolarmente depolarizzazioni postsinaptiche inferiori al millivolt, assolutamente insufficienti a raggiungere la soglia per provocare l’insorgenza di un potenziale d’azione. È pertanto necessario sommare nel tempo e nello spazio numerosissimi potenziali postsinaptici affinché, a livello del segmento iniziale dell’assone (la zona del neurone più eccitabile), insorga il potenziale d’azione. Questo processo è indispensabile per permettere ai neuroni centrali, che ricevono tipicamente migliaia di contatti sinaptici, di scatenare un potenziale d’azione solo quando il complesso dei segnali in ingresso, opportunamente integrati in base alla loro influenza (eccitatoria o inibitoria), allo spazio e al tempo (secondo le caratteristiche geometriche ed elettrotoniche dell’albero dendritico), produce una depolarizzazione adeguata del segmento iniziale dell’assone. Questo processo di integrazione è essenziale per le complesse potenzialità computazionali del singolo neurone e dei circuiti neuronali.
Trasduzione analogico-digitale a livello sinaptico
Dal punto di vista del codice di trasmissione dell’informazione (➔ codice di comunicazione neuronale), a livello della s. chimica vengono operate importanti trasformazioni. L’eccitazione neuronale, che si esprime come un fenomeno elettrico ‘tutto o nulla’ (potenziale d’azione) di ampiezza costante e in grado di essere velocemente trasmesso a notevoli distanze, corrisponde a un codice binario in cui l’informazione viene codificata dalla frequenza degli eventi. A livello della s. chimica avvengono due trasformazioni: il segnale da elettrico diventa chimico, ossia viene convertito nel rilascio di molecole informazionali (i neurotrasmettitori), e il codice da digitale diviene analogico, caratterizzato quindi dal rilascio di quantità graduate di neurotrasmettitore (anche se sempre multiple dell’unità elementare, o quanto). Mentre il linguaggio elettrico dei neuroni può solo variare nella frequenza dei segnali, il linguaggio chimico possiede invece un repertorio più graduato e suscettibile di integrazione. In questa sinergia tra fenomeni elettrici e chimici e nell’incessante trasformazione dei segnali tra queste due modalità risiedono le formidabili capacità di percezione, elaborazione e risposta del sistema nervoso.
Linguaggio neuronale: i neurotrasmettitori
Ai nostri giorni sono conosciute diverse decine di neurotrasmettitori (➔), che sono utilizzati dai neuroni e presenti nel tessuto cerebrale in modo disomogeneo. I due principali tipi di neurotrasmettitore, neurotrasmettitori classici e neuropeptidi, sono distinti per struttura chimica, biosintesi, metabolismo e modalità di secrezione. I neurotrasmettitori classici sono piccole molecole (amminoacidi o ammine) sintetizzate in loco da enzimi citoplasmatici e immagazzinate in vescicole sinaptiche piccole (40÷50 nm di diametro) accumulate in corrispondenza delle zone attive della membrana presinaptica, dove avviene preferenzialmente la loro esocitosi. Una volta secreti, i neurotrasmettitori classici vengono ricaptati dallo spazio sinaptico e riutilizzati più volte durante l’attività neuronale. I neuropeptidi (➔), invece, vengono sintetizzati nel corpo cellulare come precursori ad alto peso molecolare che vengono immagazzinati, da soli o in presenza di neurotrasmettitori classici, in vescicole secretorie di maggiori ed eterogenee dimensioni (100÷300 nm di diametro) simili ai granuli di secrezione presenti nelle cellule endocrine. La frequenza dei potenziali d’azione e la natura chimica del neurotrasmettitore rappresentano i simboli dell’alfabeto utilizzato dai neuroni. È quindi possibile che la disponibilità di un maggior numero di neurotrasmettitori nell’alfabeto chimico utilizzato a livello sinaptico offra la possibilità di comporre messaggi più complessi ed elaborati. Inoltre, la complessità è aumentata ulteriormente dalla presenza di recettori multipli per le stesse molecole neurotrasmettitoriali e dal fatto che lo stesso neurone possa liberare più neurotrasmettitori. Come già accennato, il linguaggio elettrico di tipo binario può solo variare in frequenza, mentre quello rappresentato dal neurotrasmettitore possiede un repertorio di segnali molto più complesso e articolato: il numero pressoché infinito di combinazioni che si possono generare rende possibile, a livello di singola s., un’enorme potenzialità di regolazione e di trasmissione di informazioni in parallelo.
Rilascio dei neurotrasmettitori
Nel corso degli anni sono stati chiariti molti aspetti molecolari del ciclo eso-endocitotico delle vescicole sinaptiche, caratterizzando le principali proteine coinvolte e identificando le disfunzioni sinaptiche alla base di malattie del sistema nervoso e i possibili bersagli per la terapia farmacologica. Le vescicole sinaptiche piccole, organelli specifici per le s. del sistema nervoso, vanno incontro a rapida esocitosi in corrispondenza delle zone attive e vengono efficacemente e velocemente ricaptate mediante un processo di endocitosi rapida (detto kiss and run) o mediante un più complesso e lento processo di endocitosi dipendente dalla proteina clatrina, che avviene nelle aree adiacenti alle zone attive. Una volta ricaptate, le vescicole piccole vengono rapidamente ricaricate con neurotrasmettitore neosintetizzato o ricaptato dal vallo sinaptico e divengono così disponili per un nuovo ciclo secretorio. La liberazione dei neurotrasmettitori classici appare quindi un processo non solo molto efficiente, ma anche molto economico in termini energetici, basandosi in larga parte sul riciclaggio endocitotico sia del contenitore (vescicola sinaptica) sia del contenuto (ricaptazione del neurotrasmettitore). Questo processo implica il passaggio delle vescicole sinaptiche attraverso una serie di reazioni che comprendono, in primo luogo, il rilascio dal citoscheletro del terminale assonico, il direzionamento e l’ancoraggio alle zone attive della membrana presinaptica e la predisposizione alla fusione (detta priming o emifusione). A questo punto può verificarsi la fusione con la membrana presinaptica, spontanea o scatenata istantaneamente dall’ingresso di Ca2+. Il rilascio esocitotico di neurotrasmettitore può avvenire sia attraverso l’assemblaggio e l’apertura di un poro di fusione tra membrana vescicolare e membrana presinaptica, sia in seguito alla fusione completa delle due membrane con incorporazione della membrana vescicolare nell’assolemma (membrana citoplasmatica dell’assone). Infine, la membrana della vescicola deve essere recuperata dall’assolemma e la vescicola riacquisire la sua individualità (endocitosi), per essere poi nuovamente caricata con neurotrasmettitore. Le vescicole contenenti neuropeptidi non possono essere riciclate e ricaricate di peptidi localmente e in genere sono lontane dalle zone attive. Essendo quindi esposte a concentrazioni di calcio molto inferiori durante l’attività elettrica, hanno una bassa probabilità di rilascio e liberano neuropeptidi solo durante periodi di attività elettrica ad alta frequenza, che provoca un aumento diffuso della concentrazione di calcio nelle terminazioni.
Riconoscimento recettoriale e risposta postsinaptica
Il neurotrasmettitore liberato nel vallo sinaptico viene riconosciuto dai recettori postsinaptici e tradotto in una varietà di risposte biologiche. Il legame del neurotrasmettitore al suo recettore può generare una risposta elettrica immediata (recettori ionotropici) o innescare una cascata di reazioni metaboliche intracellulari (recettori metabotropici). Le risposte metaboliche generano effetti funzionali o strutturali che, con una cinetica temporale più lenta, sono in grado di modificare l’attività dei circuiti nervosi. Il trasferimento delle informazioni nelle reti nervose corrisponde quindi a un incessante numero di trasformazioni tra codice elettrico e codice chimico. Le risposte più rapide sono quelle risultanti dall’apertura di canali ionici che generano correnti ioniche transmembrana, con effetti eccitatori (depolarizzanti) o inibitori (iperpolarizzanti) sullo stato elettrico del neurone, che possono tramutarsi in una maggiore o minore probabilità di sviluppo di un potenziale d’azione. La stimolazione dei recettori metabotropici, invece, coinvolge l’attivazione di una proteina G di trasduzione che, a sua volta, è responsabile dell’attivazione di una serie di effettori cellulari che vanno da canali ionici ad attività enzimatiche in grado di generare messaggeri intracellulari, detti secondi messaggeri (come l’AMP ciclico o il calcio). Questi, a loro volta, innescano cascate enzimatiche di fosforilazione proteica (terzi messaggeri). Tali complesse reazioni modulano acutamente la risposta del neurone postsinaptico e ne influenzano non solo lo stato elettrico, ma anche e soprattutto i processi di trascrizione e traduzione genica con conseguenti modificazioni a lungo termine. La varietà dei recettori per i neurotrasmettitori aumenta ulteriormente la complessità dello scambio di segnali attraverso le sinapsi. Non solo infatti sono stati identificati recettori per ciascuno dei numerosi neurotrasmettitori utilizzati dai neuroni, ma in pressoché tutti i casi, per ciascun neurotrasmettitore sono stati identificati tipi multipli di recettori capaci di evocare risposte biologiche distinte in seguito al legame con la medesima molecola trasmettitrice. Pertanto si può pensare che l’informazione che viene trasferita a livello sinaptico non sia codificata esclusivamente nella struttura del neurotrasmettitore, ma dipenda anche dall’accoppiamento specifico tra trasmettitore e sottotipo di recettore e dall’espressione fenotipica di specifici effettori da parte della cellula bersaglio.
Forza e plasticità sinaptica
L’efficienza con cui la s. trasferisce l’informazione (forza sinaptica) non è una proprietà immutabile, ma può venire finemente regolata sulla base della storia recente del neurone e dell’ambiente biochimico intracellulare. Questa capacità di variare l’efficienza sinaptica su base puramente funzionale (variazione del ‘software’) è detta plasticità (➔ plasticità neurale) funzionale ed è in genere limitata a un breve periodo di tempo dopo l’evento che l’ha prodotta (plasticità a breve termine). A questa plasticità a breve termine si aggiunge, spesso indotta dagli stessi stimoli, una forma più complessa e duratura di plasticità che implica variazioni nell’espressione genica e la sintesi di nuove proteine. Oltre al rimaneggiamento di s. preesistenti, possono formarsi nuove connessioni sinaptiche che modificano permanentemente la connettività. Tale plasticità sinaptica a lungo termine può essere mantenuta per ore, mesi e anni. Questo fenomeno di plasticità strutturale è un elemento fondamentale dello sviluppo del sistema nervoso (➔ cervello, sviluppo del). Infatti, la geografia delle connessioni sinaptiche che si produce al termine dello sviluppo embrionale, rappresentante una sorta di hardware temporaneo costruito prevalentemente sotto la direzione dei geni, è destinata a venire rimaneggiata strutturalmente lungo il corso di tutta la vita sotto la guida dell’esperienza e della cultura (fattori epigenetici), anche se le variazioni più sorprendenti avvengono durante l’infanzia. Nell’ambito dei circuiti nervosi, variazioni permanenti nella forza sinaptica e nel volume di informazioni trasferite (conseguenti a variazioni nel numero di s. tra neurone pre- e postsinaptico) sono in grado di incanalare il flusso delle informazioni attraverso le connessioni ‘facilitate’ distogliendolo dalle connessioni inibite o ‘depresse’. Questi fenomeni, studiabili a livello cellulare e comportamentale, hanno mostrato una stretta correlazione tra apprendimento (➔) e fenomeni di plasticità sinaptica in aree circoscritte dell’SNC, tale da far ritenere con ragionevole sicurezza che la plasticità sinaptica a lungo termine sia la base cellulare delle funzioni cognitive superiori (➔ funzioni cerebrali superiori). Fabio Benfenati