Nervoso, sistema
Nervoso, sistema
(XXIV, p. 609; App. II, ii, p. 400; III, ii, p. 239; IV, ii, p. 567; V, iii, p. 644)
Il dolore
L'organizzazione anatomo-funzionale alla base dei meccanismi del dolore, primaria affezione umana che rimane un fondamentale obiettivo della ricerca medica, è di estrema complessità: infatti, i reperti sperimentali nell'animale spesso non sono trasferibili all'uomo, che non offre misure affidabili perché le sue sensazioni sono fortemente condizionate da fattori emotivi ed educazionali. La mancanza di chiarezza è riflessa nella definizione di dolore elaborata dall'Associazione internazionale per lo studio del dolore (IASP, International Association for the Study of Pain): "Il dolore è una esperienza sensitiva ed emozionale associata a danno tessutale effettivo o potenziale" (Merskey 1986). La stessa IASP ha provveduto a una ridefinizione terminologica del dolore ora accettata universalmente: allodinia, dolore provocato da stimoli che normalmente non provocano dolore; anestesia dolorosa, dolore in un'area anestetica; disestesia, sensazione spiacevole abnorme sia spontanea che provocata; iperestesia, aumentata sensibilità agli stimoli di qualunque natura; iperalgesia, aumentata risposta a stimoli normalmente dolorosi; iperpatia, sindrome dolorosa caratterizzata da eccessiva risposta a uno stimolo ripetitivo in territorio con soglia aumentata; parestesia, sensazione abnorme sia spontanea che provocata, ma non dolorosa (Merskey 1986).
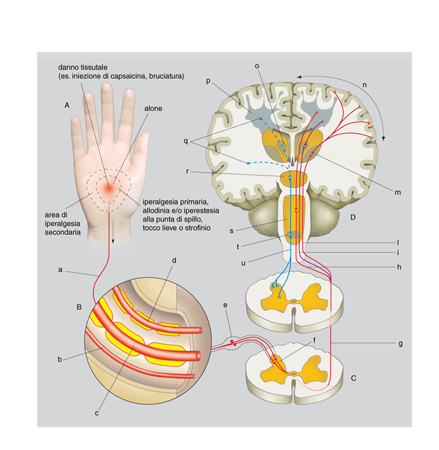
Il sistema nocicettivo. - Prima di trattarne gli aspetti patologici, è sempre utile ricordare che il dolore è innanzitutto una modalità sensoriale, filogeneticamente molto antica, indispensabile alla sopravvivenza. La funzione della sensibilità dolorifica è quella di riconoscere fonti esogene o endogene di potenziale danno ai tessuti e di mettere in moto risposte adeguate per sottrarsi alla sorgente lesiva o limitarne i danni. I soggetti con grave disfunzione della sensibilità dolorifica, com'è il caso dell'insensibilità congenita al dolore, vanno incontro a danni gravissimi, traumi, ustioni, sviluppo di infezioni, ed eventualmente a morte. La sensazione di dolore è trasmessa dal sistema nocicettivo (dal latino nocēre), analogo ad altri sistemi sensoriali, quali il visivo o l'acustico. Il sistema nocicettivo è costituito, schematicamente, dagli afferenti nocicettivi primari, da neuroni sensitivi midollari che danno luogo ai tratti ascendenti, da neuroni talamici e infine da neuroni della corteccia cerebrale (v. fig.).
Diversamente dalle altre modalità sensoriali, oltre alla componente sensorio-discriminativa, il dolore ha un'importante componente affettivo-motivazionale che utilizza sia il sistema ascendente di cui sopra, sia sistemi polisinaptici, filogeneticamente molto antichi, che proiettano in modo diffuso a tutti i lobi cerebrali e in particolare al sistema limbico. Analogamente alle altre modalità sensoriali, anche il dolore è sotto il controllo di vie centrifughe, i sistemi antinocicettivi discendenti, che filtrano il segnale in ascesa a vari livelli del sistema nervoso centrale (SNC).
I recettori del dolore (nocicettori) sono semplici terminazioni libere, cioè recettori privi di capsula e quindi tendenzialmente aspecifici, in teoria incapaci di selezionare lo stimolo adeguato nel modo raffinato proprio dei meccanocettori capsulati. Anche nell'uomo è stata confermata l'esistenza di nocicettori cutanei in relazione alle più sottili fibre mielinizzate (A-δ) e a fibre amieliniche (C) (Handwerker 1993; Torebjörk 1994).
La maggior parte dei nocicettori rispondono sia a stimolazioni meccaniche intense sia a temperature elevate e sono divisi in due classi: recettori meccanotermici in relazione a fibre A-δ (detti AMH), con velocità di conduzione di 2-30 m/s, e recettori meccanotermici in relazione a fibre C (detti CMH), con velocità di conduzione di 0,5-2 m/s. Sia le unità AMH che CMH rispondono anche agli algogeni chimici, comportandosi come polimodali. Le unità AMH mediano sensazioni di tipo puntorio (per stimolo sia meccanico sia termico), percepite in tempi molto brevi e proiettate su territori cutanei di dimensioni molto piccole. Le unità CMH mediano sensazioni brucianti nella cute pilifera, prevalentemente dolore sordo costrittivo nella cute glabra, e sensazioni crampiformi, mal localizzate, nel muscolo. Nell'insieme, l'attivazione CMH è percepita con notevole ritardo e proiettata su territori ampi e poco definiti. Questi reperti nell'uomo rendono ragione del fenomeno per cui, schiaffeggiando il dorso della mano, si avverte istantaneamente l'impatto meccanico (il tempo di conduzione dalla mano alla corteccia cerebrale è di soli 20 millesimi di secondo) e successivamente (la conduzione negli afferenti dolorifici CMH impiega oltre 1 secondo) una sensazione chiaramente bruciante, che tende a espandersi lievemente e persiste ben al di là dello stimolo.
Scarse e frammentarie sono le nuove acquisizioni circa i recettori viscerali (Cervero 1994). Al di là delle teorie, è certo che i visceri cavi (come il tubo gastroenterico) dispongono solo di recettori C polimodali e i visceri parenchimatosi (come il fegato) sono del tutto privi di nocicettori (il segnale dolorifico proviene dalle guaine e dalle arterie che li penetrano). I dolori viscerali, per quanto intensi e angoscianti, restano vaghi per qualità sensoriale e del tutto mal localizzabili.
I terminali centrali dei nocicettori raggiungono il corno posteriore del midollo (territorio spinale) o il subnucleo caudale del nervo trigemino nel bulbo (territorio facciale), sparpagliandosi su molteplici lamine (cosiddette lamine di Rexed; la sostanza grigia del midollo spinale è infatti suddivisa in lamine sovrapposte), anche se la maggior parte proietta sui neuroni più superficiali (lamina I e lamina II esterna) o sui neuroni della lamina V. Nelle lamine superficiali si trovano i neuroni nocicettivi specifici, che rispondono solo a stimoli dolorifici, e nella lamina V i neuroni ad 'ampio spettro dinamico' o neuroni multimodali, che ricevono segnali di vario tipo, anche innocui, ma che sono in grado di incanalare i segnali nella via dolorifica o meno, variando la frequenza dei potenziali d'azione.
Gli assoni dei neuroni del corno posteriore del midollo danno luogo ai fasci ascendenti diretti all'encefalo e classicamente divisi in spinotalamico diretto, originato prevalentemente dai neuroni nocicettivi specifici, e sistemi polisinaptici filogeneticamente più antichi (paleospinotalamico, spinoreticolare ecc.), originati prevalentemente dai neuroni multimodali. I due sistemi vengono anche chiamati laterale e mediale, perché a livello del midollo, del talamo e della corteccia cerebrale il sistema più recente mantiene sempre una posizione più laterale. Schematicamente lo spinotalamico diretto proietta ai nuclei talamici laterali (VPL, VPM, VPI, VMpo) e i sistemi polisinaptici ai nuclei talamici mediali e intralaminari (CL, MDvc, Pf). A loro volta i neuroni talamici laterali proiettano al lobo parietale, nelle aree somatosensoriali primaria (SI) e secondaria (SII), e quelli mediali all'insula e al lobo limbico (soprattutto la porzione anteriore del giro cingolato), che si trovano in posizione più profonda e centrale. La maggior parte dei ricercatori ritiene che l'attivazione dei fasci polisinaptici del midollo comporti sia aumento di attenzione o stato di allerta, attraverso un'attivazione diffusa reticolare e corticale, sia reazioni emotive e vegetative attraverso l'attivazione del talamo mediale, dell'ipotalamo e del sistema limbico. I fasci polisinaptici e il sistema mediale sarebbero cioè responsabili degli aspetti affettivi-motivazionali del dolore, mentre il fascio spinotalamico diretto e il sistema laterale sarebbero responsabili della funzione sensorio-discriminativa (Willis, Coggeshall 1978, 1991²; Willis 1995).
Le divisioni categoriche sono utili come traccia interpretativa, ma non esistono nella realtà biologica. In effetti il sistema laterale, a livello sia talamico sia corticale, riceve importanti proiezioni dai neuroni multimodali della lamina V e il sistema mediale dai neuroni nocicettivi specifici della lamina I. Nonostante le difficoltà, sono stati raggiunti alcuni punti fermi per mezzo di indagini direttamente nell'uomo. Esperimenti di registrazione microneurografica e di microstimolazione nel talamo umano (Lenz, Dougherty 1995) stanno confermando il ruolo essenziale del nucleo ventrocaudale (Vc), equivalente al complesso VPL-VPM della scimmia, nella nocicezione e nel dolore. Il nucleo ventrocaudale è il principale bersaglio dello spinotalamico diretto; la parte centrale riceve l'informazione tattile discriminativa e comunque non-nocicettiva, mentre la parte posteroinferiore riceve l'informazione termodolorifica. La microstimolazione dell'area posteroinferiore di Vc induce dolore (anche viscerale); nei pazienti con dolore centrale da lesione spinale, questi neuroni mostrano campi recettoriali alterati e attività spontanea in raffiche (sono anche stati identificati neuroni la cui stimolazione evoca dolore riferito ad aree altrimenti anestetiche). Per mezzo della tomografia a emissione di positroni (PET, Positron Emission Tomography) o singoli fotoni (SPECT, Single Photon Emission Computed Tomography) si è potuto dimostrare nell'uomo che la stimolazione nocicettiva termica attiva sia le aree somatosensoriali SI e SII sia la porzione anteriore del giro del cingolo (Jones 1991; Talbot, Marrett, Evans et al. 1991). Si trattava di stimolazioni fasiche di nocicettori A-δ, in cui gli effetti cerebrali della stimolazione a temperatura lievemente dolorosa erano sottratti a quelli della stimolazione non dolorosa. Non stupisce quindi l'attivazione, oltre che del cingolato anteriore, anche della SI controlaterale, considerata responsabile delle funzioni sensorio-discriminative e della codificazione di intensità. Una significativa attivazione di SI, però, è stata osservata anche con il cold water pressor test (Di Piero, Ferracuti, Sabatini et al. 1994). Si tratta di un classico modello di dolore tonico da immersione della mano in acqua a 0 ºC, che provoca il blocco da freddo delle fibre mieliniche e attiva i recettori polimodali C, evocando un dolore profondo, sordo e molto intenso. Le concomitanti attivazioni frontale controlaterale e bitemporale sono state attribuite rispettivamente ai meccanismi avversativi di preparazione all'evitamento e alla componente affettiva-ansiosa.
Allo stato attuale delle conoscenze le aree corticali attivate dagli stimoli dolorosi e i loro presunti ruoli si possono così riassumere: 1) SI, elaborazione sensorio-discriminativa, codifica di intensità, localizzazione spaziale; 2) SII, integrazione sensoriale dolorifica-tattile-visiva, attenzione spaziale; 3) insula, integrazione sensoriale dolorifica-tattile-gustativa-vestibolare e integrazione limbico-viscerale; 4) cingolato anteriore, selezione della risposta, preparazione motoria, attenzione, affettività; 5) corteccia prefrontale, partecipazione emotiva, memoria (Treede, Kenshalo, Gracely et al. 1999).
Controllo antinocicettivo discendente
Effetti analgesici sono prodotti dalla stimolazione di varie regioni troncoencefaliche. La più nota tra queste è la sostanza grigia periacqueduttale (PAG, Periaqueductal Gray [Matter]) del mesencefalo, in cui si trovano neuroni e terminali enkefalinergici. La PAG è attivata dall'ipotalamo e dalla corteccia cerebrale, sia da altre strutture troncoencefaliche (segnatamente il locus coeruleus) sia dalle afferenze dolorifiche (probabilmente attraverso lo spinoreticolare e le vie post-sinaptiche nei cordoni dorsali). La PAG proietta, con vie prevalentemente eccitatorie (neurotensina), a un gruppo di nuclei reticolari bulbari siti in un'area rostrale-ventrale-mediana (RVM), area che include il nucleo del rafe magno, posto esattamente sulla linea mediana, e i vicini nuclei reticolari magnocellulari. Gli assoni dei neuroni RVM discendono nel fascicolo dorso-laterale, i cui terminali, in larga misura serotoninergici, proiettano sulle lamine superficiali del corno posteriore. La stimolazione RVM determina una soppressione dell'attività dei neuroni nocicettivi specifici, forse tramite connessioni dirette, certamente tramite l'attivazione di interneuroni enkefalinergici e altri interneuroni inibitori (GABAergici), che possono agire sia presinapticamente sui terminali afferenti sia sui neuroni nocicettivi secondari. Sempre nel fascicolo dorso-laterale discendono fibre noradrenergiche provenienti dal locus coeruleus e da altri gruppi cellulari pontobulbari, con analogo effetto inibitorio sulla trasmissione nocicettiva nel corno posteriore.
Oltre ai noti sistemi antinocicettivi discendenti, endorfinergico e monoaminergici, esiste un ulteriore sistema di controllo, il DNIC (Diffuse Noxious Inhibitory Control). Mentre i primi sono attivati dal persistere di segnale dolorifico proveniente dallo stesso territorio e filtrano detto segnale (hanno lo scopo di lenire un dolore persistente non eliminabile con risposte di difesa), il DNIC inibisce in modo diffuso tutti i segnali dolorifici, in risposta a stimolazione dolorosa acuta eterologa. In altre parole il DNIC rappresenta il substrato anatomofunzionale del popolare 'chiodo scaccia chiodo' e della antinocicezione da stress: l'immersione della mano sinistra in acqua gelida, per es., produce una netta riduzione del dolore percepito e del riflesso di flessione evocati da stimolazione elettrica del piede destro. La teoria del DNIC è stata formulata dal gruppo francese di D. Le Bars e J.C. Willer. I meccanismi funzionali principali sono stati dimostrati nell'uomo, e si sta ora cercando di identificarne i centri sopraspinali responsabili. Le classiche aree del bulbo rostrale ventrale mediano (RVM) non sembrano coinvolte; si sta focalizzando l'attenzione su neuroni del nucleo reticolare dorsale, che ricevono significative proiezioni da fibre ascendenti nel cordone anterolaterale e a loro volta proiettano sul corno posteriore attraverso il fascicolo dorso-laterale (Willer, De Broucker, Le Bars 1990; Le Bars, Bouhassira, Villanueva 1995).
Fisiopatologia del dolore
Come si è già osservato, il dolore è di grande utilità, anzi è indispensabile alla sopravvivenza. Quando però il segnale nocicettivo persiste e non vi sono possibili manovre per evitarlo, il dolore cessa di essere utile e diventa controproducente, in alcuni casi anzi più inabilitante della malattia primitiva. Il segnale dolorifico può originare distalmente o prossimalmente al recettore periferico; nel primo caso la perturbazione si trova nei tessuti, e provoca l'attivazione dei nocicettori che adempiono al loro compito inviando al centro l'informazione (dolori somatici e viscerali, o meglio dolore nocicettivo nella dizione della letteratura anglosassone); nel secondo caso la perturbazione investe direttamente le vie nocicettive di trasmissione, nei nervi o nel SNC, con generazione di segnali abnormi che vengono percepiti come dolore e riferiti al corrispondente territorio di innervazione (dolori nevralgici, neuropatici e centrali, o con termine generale dolore neurogenico). La comprensione dei diversi meccanismi all'origine del dolore è indispensabile alla corretta impostazione terapeutica.
Nel caso del dolore nocicettivo, periferico, perturbazioni meccaniche, termiche o chimiche provocano la liberazione, da parte dei tessuti, vasi e terminali nervosi stessi, di sostanze algesiche, bradikinina, prostaglandine, istamina, serotonina, sostanza P, CGRP (Calcitonin Gene Related Peptide) e molte altre, che favoriscono il processo infiammatorio e sensibilizzano i nocicettori, abbassandone la soglia. I recettori danno luogo a scariche in alta frequenza, anche per stimoli normalmente innocui (Handwerker 1993; Torebjörk 1994).
Negli ultimi anni è stata identificata una varietà di nocicettori cosiddetti silenti che in condizioni normali restano muti a tutti gli stimoli, ma che una volta sensibilizzati dall'infiammazione diventano iperattivi. Probabilmente si tratta di chemocettori che sviluppano una sensibilità meccanica come risultato dell'attivazione di secondi messaggeri da parte degli agenti chimici liberati nel tessuto leso. Appartengono a questa categoria anche i recettori della polpa dentaria, che presumibilmente non hanno alcuna funzione sensitiva in condizioni normali, finché si presenta una patologia dentaria e questi recettori 'si svegliano', diventando una formidabile sorgente di dolore. A questi meccanismi di iperalgesia periferica si aggiungono meccanismi centrali. L'input (segnale di ingresso) nocicettivo - in particolare quello trasmesso dagli afferenti amielinici C - induce una serie di alterazioni in cascata nel SNC; quanto più a lungo dura la perturbazione periferica, tanto più rilevanti (e poi persistenti) diventano le alterazioni centrali. L'infiammazione periferica provoca nel corno posteriore del midollo l'aumento dei livelli della sostanza oppioide dinorfina e dei peptidi algesici CGRP e sostanza P, che aumentano la risposta dei recettori di membrana NMDA (N-metil-D-aspartato) per gli aminoacidi eccitatori, instaurando una condizione di ipereccitabilità dei neuroni midollari, che - se sostenuta - provoca fenomeni eccitotossici. Questi ultimi danneggiano soprattutto i circuiti inibitori locali. Il risultato è sia un aumento di attività che una ridotta inibizione (Dubner 1993).
Con il perdurare di sovrastimolazione o comunque di condizioni che squilibrano il segnale d'ingresso ai neuroni nocicettivi centrali (sia nel dolore nocicettico sia nel dolore neurogenico), attraverso la liberazione di secondi messaggeri si induce l'attivazione di protooncogeni, in particolare c-fos e c-jun nel nucleo cellulare, che alterano direttamente a livello del DNA i processi di trascrizione di altri geni. L'alterazione genica risulta nell'anomala produzione di neurotrasmettitori e recettori sinaptici proteici. L'espressione dei protooncogeni dopo stimolazioni dolorose o lesioni di nervo dura per giorni o settimane: ciò implica nella biochimica e nella funzione dei neuroni profonde alterazioni, che potrebbero essere alla base dei meccanismi centrali che contribuiscono alla cronicizzazione del dolore, anche nei casi di dolore originariamente periferico (Draisci, Iadarola 1989; Zimmermann 1993).
Vi è un sostanziale accordo che le fibre nocicettive siano direttamente coinvolte nella grande maggioranza dei casi di neuropatia dolorosa (Llewellyn, Gilbey, Thomas et al. 1991; Tsigos, White, Young et al. 1992). Il dolore può prodursi con due meccanismi principali, uno completamente periferico e l'altro periferico/centrale. Nel primo caso, la predominanza di meccanismi periferici è suggerita dall'osservazione che l'infiltrazione anestetica di un neuroma postraumatico o la decompressione di un nervo intrappolato possono abolire il dolore.
Perifericamente, le fibre nocicettive possono essere eccitate ectopicamente. L'eccitazione ectopica è la produzione di potenziali al di fuori delle fisiologiche sedi recettoriali o sinaptiche, in punti della fibra nervosa che presentano instabilità di membrana per qualche ragione: particolarmente a livello di nervi recisi, aree di demielinizzazione, neuriti in rigenerazione. L'eccitazione ectopica può essere scatenata da irritazione meccanica, da riduzione del calcio nel territorio perinodale o dalle correnti extracellulari durante il passaggio di impulsi nelle fibre adiacenti. Nelle fibre ipereccitabili, l'attività abnorme può nascere 'spontaneamente' dopo il passaggio di un singolo impulso lungo la stessa fibra (autoeccitazione), oppure gli impulsi possono passare da un assone all'altro: trasmissione efaptica, dal greco ἔφαψιϚ (Baumann, Burchiel 1997).
Il dolore da deafferentazione (perdita delle connessioni provenienti dai neuroni afferenti) può complicare virtualmente qualunque tipo di danno delle vie somatosensoriali in qualunque punto del percorso. In tutti questi casi il dolore è percepito in un territorio solitamente ipo- o anestetico e gli interventi volti a isolare la regione dolente (come i blocchi neurolitici o la cordotomia) non sono efficaci a lungo termine. Quest'osservazione clinica dimostra che la fisiopatogenesi di tali sindromi algiche è sempre riconducibile a una disfunzione dell'elaborazione sensoriale centrale, anche a grande distanza dalla lesione primitiva. Sono state dimostrate sia la degenerazione transgangliare di neuroni sensitivi primari lesi in periferia, sia la degenerazione transinaptica dei neuroni sensitivi centrali. La sezione completa del nervo in caso di amputazione traumatica o chirurgica può condurre a un particolare tipo di dolore da deafferentazione, percepito nel moncone o nell'arto amputato (arto fantasma; Davis, Kiss, Luo et al. 1997).
Nel dolore radicolare spondilogeno, le fibre nocicettive che decorrono nella radice nervosa infiammata si trovano in una condizione di instabilità. Spontaneamente o a seguito di perturbazione meccanica (colpi di tosse, movimenti che stirano le radici) le fibre possono andare incontro a fenomeni di eccitazione ectopica, dando luogo a improvvise raffiche di potenziali che vengono avvertite lungo il decorso del nervo (fibre dai nervi nervorum), nel dermatomero corrispondente (fibre cutanee) o nella profondità dell'arto (probabilmente fibre amieliniche dai tessuti muscolo-scheletrici). Nelle radicolopatie deficitarie (che possono anche essere prodotte dalle stesse cause che inizialmente danno luogo al dolore radicolare 'irritativo' su descritto), si può instaurare un dolore con qualità del dolore neuropatico, da deafferentazione.
La lesione lungo le vie afferenti centrali può determinare una sequenza di eventi che producono dolore neurogeno cronico, a vari livelli (Wiesenfeld-Hallin, Hao, Xu 1997). Quando il processo di degenerazione raggiunge i terminali presinaptici, il neurone postsinaptico va incontro a una serie di modificazioni funzionali e morfologiche, con sviluppo di ipersensibilità da denervazione. I siti sinaptici vacati possono manifestare ipersensibilità chimica ai trasmettitori dell'intorno. La potenza delle sinapsi residue può essere fortemente incrementata o possono diventare attive sinapsi precedentemente inefficaci. Il processo di reinnervazione può comportare la connessione con neuriti da assoni estranei (reinnervazione abnorme). La modificazione del campo recettoriale del neurone secondario dopo lesione del neurone primario può spiegare in parte la frequente osservazione che nel corso del tempo il territorio di dolore si estende.
Terapia farmacologica del dolore
Occorre premettere, anche se il concetto è intuitivo, che prima di instaurare procedure analgesiche, cioè terapie che riducono l'intensità del segnale dolorifico, è necessario identificare (e se possibile rimuovere) la perturbazione che provoca il dolore stesso. Nella maggior parte dei casi il dolore è affrontato clinicamente (e trattato nei testi di medicina) nell'ambito delle specifiche patologie d'organo. Quando le cause non sono aggredibili e il dolore è il principale problema del paziente, ci troviamo di fronte ad algie croniche che possono solo giovarsi di trattamenti antalgici sintomatici.
Gli analgesici-antinfiammatori ad azione prevalentementa periferica limitano il processo infiammatorio responsabile del dolore nocicettivo, cioè della maggior parte dei comuni dolori somatici o viscerali. Il più noto di quest'ampia categoria è l'aspirina, da cui il termine estensivo di farmaci aspirinosimili. Generalmente antagonizzano l'enzima ciclossigenasi, interferendo con la sintesi delle prostaglandine. Questi farmaci rappresentano la prima linea di terapia e prima di passare a farmaci narcotico-analgesici dovrebbe sempre essere compiuto un tentativo adeguato per dosaggi e durata. Tutti gli analgesici-antinfiammatori, peraltro, presentano un 'tetto di saturazione' oltre il quale ulteriori incrementi di dosaggio aumentano gli effetti collaterali senza aumentare l'effetto analgesico. Non ha senso provare molti farmaci di questa categoria, essendo poco dissimili nella sostanza del meccanismo d'azione. La scelta del preparato è fondamentalmente dettata da altre considerazioni, quali l'utilità di un'azione rapida, o di una lunga emivita, l'entità e il tipo di effetti collaterali, più o meno indesiderabili nello specifico paziente. Il paracetamolo, comune analgesico-antipiretico, è del tutto privo degli effetti gastrolesivi che, in misura variabile, comportano tutti gli analgesici-antinfiammatori (Bradley 1989; Sunshine, Olson 1989²).
I narcotico-analgesici, oppiacei o di sintesi, occupano i siti recettoriali dei peptidi oppioidi endogeni (endorfina, enkefaline) nel SNC, inibendo la trasmissione del segnale dolorifico sia direttamente sui terminali presinaptici degli afferenti dolorifici all'ingresso del midollo, sia indirettamente attraverso l'attivazione dei sistemi antinocicettivi discendenti a partenza dalla sostanza grigia periacqueduttale e dai nuclei del rafe nel troncoencefalo. Teoricamente dovrebbero funzionare in qualunque tipo di dolore, ma risultano inadeguati in alcune forme di dolore neurogenico. La morfina è il capostipite e lo standard di confronto di questi farmaci. Clinicamente l'analgesia morfinica non presenta tetto di saturazione, ma il dosaggio è limitato dagli effetti collaterali (depressione respiratoria, sedazione, vomito, stipsi). Nel trattamento cronico si sviluppano assuefazione e dipendenza fisica, molto più lentamente con la somministrazione orale anziché parenterale. È necessario iniziare con dosi minime per via orale. La dipendenza psicologica e l'abuso si presentano in pochi casi, per cui il rischio di tossicomania (sopravvalutato in particolare in Italia, dove la prescrizione di morfina, di solito limitata ai soli pazienti con cancro terminale, è ai livelli più bassi tra i paesi occidentali) è relativo. Fortunatamente la tolleranza all'effetto analgesico e quella agli effetti collaterali centrali non si sviluppano allo stesso ritmo, così che l'aumento del dosaggio per mantenere l'analgesia non comporta un parallelo intensificarsi della depressione di coscienza e del respiro (Portenoy 1997; Ventafridda 1998).
Nei dolori neurogenici si impiegano soprattutto farmaci nati come antiepilettici o come antidepressivi. Nei dolori parossistici in cui sia ipotizzabile un meccanismo di attivazione ectopica, con fenomeni di autoeccitazione o trasmissione efaptica, si impiegano i farmaci che attraverso un'azione diretta sulla fibra nervosa deprimono l'eccitabilità della membrana, quali alcuni anticonvulsivanti, anestetici locali e antiaritmici. Nei dolori subcontinui in cui sia ipotizzabile un'ipersensibilità da deafferentazione o una reinnervazione abnorme, si impiegano farmaci che potenziano i sistemi antinocicettivi discendenti, quali gli antidepressivi triciclici.
Tra gli antiepilettici, la carbamazepina è il farmaco di prima scelta nei dolori parossistici della nevralgia trigeminale, della sclerosi multipla, dei traumi midollari, delle neuropatie traumatiche e da intrappolamento, del neuroma da amputazione. La carbamazepina funziona come stabilizzatore di membrana, attraverso l'inattivazione dei canali del sodio. È importante tenere presente che i dosaggi richiesti nel trattamento del dolore sono inferiori a quelli impiegati nell'epilessia e in particolare che l'azione antalgica presenta un tetto di saturazione a circa 1 g/die. Nei casi di limitazione all'uso di carbamazepina per controindicazioni o per effetti collaterali (nel trattamento cronico soprattutto l'effetto tossico sull'emopoiesi), occorre provare gli altri farmaci con meccanismo d'azione analogo. Se invece la carbamazepina è insufficientemente efficace, difficilmente lo saranno altri farmaci, per cui è opportuno il ricorso a terapie non farmacologiche (v. oltre) (Bradley 1989; Trigeminal neuralgia, 1991).
Gli antidepressivi triciclici (e soprattutto l'amitriptilina) sono di documentata efficacia nella maggior parte dei dolori neurogenici, ma trovano indicazione principale nei casi di dolore subcontinuo - e in particolare di tipo urente - come la nevralgia posterpetica, la neuropatia diabetica, i dolori da sezione midollare e i dolori talamici post-ischemici (Bowsher, Cruccu 1997). L'azione antidepressiva può integrare quella analgesica, che è comunque indipendente, perché i triciclici si sono dimostrati efficaci nel dolore sperimentale nell'animale e nel dolore umano non neurogeno (per es. l'artrite) e perché l'effetto antalgico inizia a manifestarsi prima di quello antidepressivo (10 giorni contro 20 giorni, in media) o ad esplicarsi in assenza di effetto antidepressivo. L'effetto antalgico presunto è il potenziamento dei sistemi antinocicettivi discendenti, di tipo catecolaminico (Bradley 1989; Molina, Canaro, Dopico et al. 1990). Il blocco della ricaptazione della serotonina, considerato fino a poco tempo fa il meccanismo più importante, è stato successivamente posto in discussione perché i nuovi antidepressivi serotoninergici puri sembrano non possedere un effetto antalgico.
L'antidepressivo più impiegato è l'amitriptilina, a dosaggi di circa 1 mg/kg/die, inferiori a quelli impiegati nella depressione. È necessario iniziare con basse dosi (circa 20 mg/die) e quindi aumentare lentamente per minimizzare gli effetti collaterali, rappresentati da sonnolenza, secchezza delle fauci, stipsi, ipotensione. Le controindicazioni sono legate all'azione anticolinergica: glaucoma, ipertrofia prostatica, aritmie cardiache. Il paziente deve essere edotto che l'aumento graduale del dosaggio e i tempi lunghi di pieno sviluppo dell'effetto a livello del SNC impongono un programma di trattamento di due mesi al minimo, per consentire una valutazione adeguata. Per le stesse ragioni è impossibile adeguare prontamente il dosaggio in pazienti con frequenza o intensità del dolore molto variabili.
Altre terapie del dolore
Gli anestetici locali bloccano lo scambio ionico attraverso le membrane eccitabili. Il capostipite è la cocaina; in seguito sono stati ottenuti molti preparati di sintesi, privi del rischio di tossicodipendenza. Sono impiegati per applicazione topica con spray, tamponi, infiltrazioni sottocutanee, intramuscolari o intrarticolari, a seconda dei tessuti interessati. L'infiltrazione lungo il decorso di un nervo sensitivo comporta l'anestesia del territorio innervato a valle dell'infiltrazione. L'introduzione di anestetici locali nello spazio epidurale lombare produce l'anestesia nei territori sotto la linea ombelicale trasversa (Bromage 1989²). I blocchi anestetici in genere sono impiegati nel trattamento del dolore acuto, quando questo interessa un'area ben definita e aggredibile, oppure come elemento diagnostico per capire se il dolore, soprattutto quello neuropatico, origina a monte o a valle dell'infiltrazione.
Nel dolore cronico gli anestetici locali possono essere somministrati (in condizioni controllate per i rischi di depressione respiratoria, depressione del ritmo e della conduzione cardiaca, ipotensione) direttamente per via endovenosa. Questa via è stata impiegata in alcune forme di dolore neuropatico resistenti alla carbamazepina e all'amitriptilina. Meno rischiosa e assai più collaudata è la somministrazione per cateterismo spinale.
L'impianto cronico di cateteri spinali consiste nell'introduzione nello spazio epidurale o direttamente subaracnoideo di un sottile catetere, che viene poi collegato sottocute con un piccolo serbatoio dove si può introdurre il farmaco a domanda o mediante pompe per infusione continua. La procedura richiede competenza e attrezzature adeguate ma consente la somministrazione spinale in cronico di svariati farmaci per il controllo del dolore più severo, tra cui gli oppiacei. Il vantaggio è quello di poter ottenere effetti potenti con dosi bassissime, per effetto diretto sul midollo, evitando gli effetti collaterali centrali associati alla somministrazione sistemica (Bromage 1989²).
Tra le procedure analgesiche 'maggiori', che richiedono la sala di rianimazione od operatoria, ricordiamo le simpaticectomie, le rizotomie percutanee, la cordotomia, le microlesioni stereotassiche del talamo e dell'ipotalamo, la chirurgia demolitiva a cielo aperto. In generale hanno un impiego molto limitato. L'idea di risolvere il problema dolore tagliando via (letteralmente) le vie dolorifiche in qualche punto lungo il tragitto fino al cervello ha una sua logica ed è stata ampiamente applicata fino ai tempi recenti. Purtroppo si è dovuto constatare che dopo un variabile intervallo il dolore ricomincia, magari con caratteristiche diverse ma altrettanto severo: la lesione chirurgica lungo le vie sensitive determina la deafferentazione dei neuroni successivi nella catena sensitiva, con sviluppo di ipersensibilità da denervazione, reinnervazione abnorme o degli altri meccanismi del dolore neurogenico centrale, a livello di una stazione più rostrale. Questi interventi sono comunque ancora indicati nei pazienti con dolore da cancro terminale o con breve aspettativa di vita. Appare invece promettente lo sviluppo di tecniche di impianto stereotassico di elettrodi stimolanti nel SNC, in particolare nella sostanza grigia periacqueduttale, nel talamo e nella corteccia cerebrale. Si possono inibire iperattività indesiderate o attivare centri inibitori come anche variare i parametri di stimolazione o spostarne lievemente la sede, alla ricerca dei risultati ottimali. Il tutto senza arrecare danni irreversibili al tessuto nervoso (Tsubokawa, Katayama, Yamamoto et al. 1993; Lenz, Dougherty 1995). Come sempre di fronte alle nuove terapie, occorrerà qualche anno per validare le ottime premesse.
Le tecniche neurolesive trovano un campo applicativo di successo nella nevralgia trigeminale. Si tratta di lesioni parziali in cui singoli gruppi di fibre vengono selettivamente danneggiati, nel ganglio trigeminale. Il ganglio è raggiunto per via percutanea (non occorre una craniectomia) con una cannula, attraverso la quale si procede a lesione termica (termocoagulazione in radiofrequenza), meccanica (microcompressione) o chimica (glicerolizzazione). La procedura comporta spesso deficit sensitivi al volto, più o meno transitori, e un'immediata risoluzione della nevralgia. L'effetto non è definitivo e la ricaduta può intervenire dopo intervallo variabile, in media 2÷3 anni. La semplicità dell'intervento è tale che i pazienti non hanno difficoltà a ripeterlo. Si tratta, naturalmente, dei casi in cui la terapia farmacologica è insufficiente o impedita dalla gravità degli effetti collaterali (Trigeminal neuralgia, 1991).
Le terapie fisiche sono, nel caso del dolore, innumerevoli, certo in conseguenza della frequenza del sintomo dolore, ma anche per l'efficacia di manovre suggestive che agiscono attraverso un effetto placebo e per la difficoltà che presenta una valutazione oggettiva dei risultati. Sono comuni le pratiche della cosiddetta medicina popolare e della medicina orientale, manipolazioni, massaggi, ultrasuoni, onde corte, campi magnetici, laser.
Tra le terapie fisiche, è opportuno spiegare le tecniche di elettroanalgesia. È noto che la stimolazione meccanica del territorio dolente può intensificare o lenire il dolore, con effetto immediato. L'azione antalgica acuta è spiegabile con il fatto che aumentando l'input tattile dallo stesso territorio da cui proviene il dolore, si potenzia il meccanismo fisiologico di inibizione afferente, esercitato a livello segmentario dalle fibre di grande calibro (tattili) su quelle di piccolo calibro (termodolorifiche). Questo principio è alla base della elettrostimolazione transcutanea (TNS, Transcutaneous Nerve Stimulation) che impiega elettrodi di superficie posti sull'area dolente o lungo il decorso del nervo responsabile, e stimoli di bassa intensità e frequenza elevata. L'analgesia è immediata e totale (se si riesce a coinvolgere tutto il territorio dolente), ma non dura a lungo dopo la sospensione della stimolazione. È quindi indicata nel dolore acuto o nelle forme di dolore accessuale, avendo il paziente la disponibilità di uno stimolatore personale.
Un'altra tecnica di elettrostimolazione, detta anche elettroagopuntura, impiega aghi-elettrodi inseriti profondamente nel punto di massimo dolore e stimoli ad alta intensità e bassa frequenza (che attivano le fibre dolorifiche). Il paziente con dolore cronico non altrimenti trattabile trova sopportabile il dolore evocato strumentalmente se paragonato al proprio dolore spontaneo e impara, nel corso di sedute successive, ad aumentare progressivamente l'intensità di stimolazione, ottenendo un effetto analgesico di lunga durata, talvolta clamoroso. Il meccanismo d'azione non è chiarito; si ipotizza la sovrastimolazione dei sistemi antinocicettivi discendenti, a partenza troncoencefalica, con liberazione di oppioidi endogeni. Uno sviluppo crescente stanno avendo le tecniche di elettrostimolazione cronica delle colonne dorsali del midollo, con elettrodi inseriti per cateterismo subaracnoideo (Woolf 1989²).
Infine, va considerato che nei pazienti con dolore cronico intrattabile il dolore investe completamente la vita e diventa il centro dell'attenzione. Una concomitante sovrastruttura psicogena o lo sviluppo di depressione grave sono immancabili. L'impiego degli adeguati psicofarmaci diventa necessario e in ogni caso il paziente non deve essere abbandonato al proprio dolore 'intrattabile'. Sono utili programmi di psicoterapia e fisioterapia che comunque impegnino il paziente, e possibilmente lo portino gradualmente ad accettare la condizione di disagio cronico.
bibliografia
W.D. Willis, R.E. Coggeshall, Sensory mechanisms of the spinal cord, New York 1978, 1991².
H. Merskey, Classification of chronic pain, in Pain, 1986, 3° suppl., pp. 216-21.
Ph.B. Bradley, Introduction to neuropharmacology, London-Boston 1989, pp. 248-67.
G. Draisci, M.J. Iadarola, Temporal analysis of increases in c-fos, preprodynorphin, and preproenkephalin mRNAs in rat spinal cord, in Molecular brain research, 1989, 6, pp. 31-37.
Textbook of pain, ed. P.D. Wall, R. Melzack, Edinburgh-New York 1989² (in partic.: P.R. Bromage, Epidural anaesthetics and narcotics, pp. 744-52.
A. Sunshine, N.Z. Olson, Non-narcotic analgesics, pp. 670-85.
C.J. Woolf, Segmental afferent fibre-induced analgesia, pp. 884-95).
F.J. Molina, D. Canaro, A. Dopico et al., Antidepressant drugs, in The pain clinic, ed. S. Lipton, E. Tunks, M. Zoppi, New York 1990, pp. 337-48.
J.C. Willer, T. De Broucker, D. Le Bars, Diffuse noxious inhibitory controls (DNIC) in man. Involvement of an opioidergic link, in European journal of pharmacology, 1990, 182, pp. 347-55.
E. Jones, Transmitter chemistry in somatosensory thalamus, in Pain and central nervous system disease. The central pain syndromes. The Bristol-Myers Squibb symposium on pain research, ed. K.L. Casey, New York 1991, pp. 201-18.
J.G. Llewellyn, S.G. Gilbey, P.K. Thomas et al., Sural nerve morphometry in diabetic autonomic and painful sensory neuropathy. A clinicalpathological study, in Brain, 1991, 114, pp. 86-92.
J.D. Talbot, S. Marrett, A.C. Evans et al., Multiple representations of pain in human cerebral cortex, in Science, 1991, 251, pp. 1355-58.
Trigeminal neuralgia. Current concepts regarding pathogenesis and treatment, ed. G.H. Fromm, B.J. Sessle, Boston 1991.
C. Tsigos, A. White, R.J. Young, Discrimination between painful and painless diabetic neuropathy based on testing of large somatic nerve and sympathetic nerve function, in Diabetic medicine, 1992, 9, pp. 359-65.
New trends in referred pain and hyperalgesia, ed. L. Vecchiet, D.G. Albe-Fessard, U. Lindblom, Amsterdam-New York 1993 (in partic.: R. Dubner, Spinal cord neuronal plasticity. Mechanisms of persistent pain following tissue damage and nerve injury, pp. 109-17.
H.O. Handwerker, Mechanisms of cutaneous and subcutaneous hyperalgesia, pp. 13-23.
M. Zimmermann, Immediate-early genes in the nervous system. Molecular steps in hyperalgesia and chronic pain?, pp. 119-26).
T. Tsubokawa, Y. Katayama, T. Yamamoto et al., Chronic motor cortex stimulation in patients with thalamic pain, in Journal of neurosurgery, 1993, 78, pp. 393-401.
F. Cervero, Sensory innervation of the viscera. Peripheral basis of visceral pain, in Physiological reviews, 1994, 74, pp. 95-138.
V. Di Piero, S. Ferracuti, U. Sabatini et al., A cerebral blood flow study on tonic pain activation in man, in Pain, 1994, 56, pp. 167-73.
E. Torebjörk, Nociceptor dynamics in humans, in Proceedings of the 7th World Congress on pain, ed. G.F. Gebhart, D.L. Hammond, T.S. Jensen, Seattle 1994, pp. 277-84.
Pain and the brain. From nociception to cognition, ed. B. Bromm, J.E. Desmedt, New York 1995 (in partic.: D. Le Bars, D. Bouhassira, L. Villanueva, Opioids and diffuse noxious inhibitory control (DNIC) in the rat, pp. 517-39.
F.A. Lenz, P.M. Dougherty, Pain processing in the ventrocaudal nucleus of the human thalamus, pp. 175-85.
W.D. Willis, From nociceptor to cortical activity, pp. 1-19).
D. Bowsher, G. Cruccu, The treatment of central post-stroke pain, in Management of acute ischemic stroke, ed. J. Castillo, A. Davalos, D. Toni, Barcelona 1997, pp. 159-70.
Proceedings of the 8th World Congress on pain, 7° vol., ed. G.F. Gebhart, D.L. Hammond, T.S. Jensen, Seattle 1997 (in partic.: R.K. Portenoy, Opioid tolerance and responsiveness. Research findings and clinical observations, pp. 595-619).
Proceedings of the 8th World Congress on pain, 8° vol., ed. T.S. Jensen, J.A. Turner, Z. Wiesenfeld-Hallin, Seattle 1997 (in partic.: T.K. Baumann, K.J. Burchiel, Intraoperative microneurographic recordings in patients with trigeminal neuralgia, pp. 459-67; K.D. Davis, Z.H.T. Kiss, L. Luo et al., Phantom sensations elicited by stimulation in thalamus of amputees with phantom pain, pp. 625-33; Z. Wiesenfeld-Hallin, J.-X. Hao, X.-J. Xu, Mechanisms of central pain, pp. 575-89).
V. Ventafridda, Il controllo del dolore da cancro e disponibilità dei farmaci oppioidi. Le linee guida dell'OMS, in Quaderni di sanità pubblica, 1998, 21, pp. 5-43.
R.-D. Treede, D.R. Kenshalo, R.H. Gracely et al., The cortical representation of pain, in Pain, 1999, 79, pp. 105-11.