Somatoestesia
Somatoestesia
di Vernon B. Mountcastle
SOMMARIO: 1. Introduzione: a) generalità; b) sistema somatico afferente. □ 2. Definizioni e principî. □ 3. Capacità umane nella sfera della sensibilità meccanocettrice: a) tatto-pressione; b) senso di posizione e cinestesia; c) il senso di flutter-vibrazione. □ 4. Processo di trasduzione nelle afferenze somatiche. □ 5. Comunicazione e codificazione nel sistema nervoso centrale. □ 6. Analisi della somatoestesia attraverso lo studio delle fibre nervose afferenti: a) specificità di modalità delle fibre periferiche; b) morfologia delle terminazioni nervose e delle strutture annesse, in relazione alla sensazione. □ 7. Componenti pretalamiche del sistema somatico afferente: a) sistema lemniscale; b) sistema anterolaterale; c) sistema trigeminale. □ 8. Meccanismi somatosensitivi del talamo e della corteccia cerebrale: a) relé lemniscali del talamo e proprietà statiche dei neuroni ventrobasali; b) aree talamiche attivate dal sistema anterolaterale e proprietà funzionali dei neuroni anterolaterali; c) aree somatosensitive della corteccia cerebrale; d) connessioni talamo- e corticocorticali nel sistema nervoso. □ 9. Meccanismi di elaborazione nervosa delle modalità meccanocettive della somatoestesia: a) meccanismi nervosi della sensibilità tattile; b) meccanismi nervosi del senso di posizione e della cinestesia; c) meccanismi nervosi del senso di flutter-vibrazione. □ 10. Sistemi discendenti che influenzano la trasmissione afferente nelle vie somatoestetiche. □ 11. Deficit somatoestetici causati da lesioni del sistema nervoso, negli animali e nell'uomo: a) lesioni sottocorticali del sistema lemniscale; b) disturbi somatoestetici da lesioni corticali; c) integrazione interemisferica nella somatoestesia. □ 12. Meccanismi fisiologici del dolore: a) la percezione del dolore nell'uomo; b) teoria del rilevamento dei segnali e dolore; c) meccanismi periferici del dolore; d) meccanismi nervosi centrali del dolore; e) meccanismi nervosi centrali di controllo del dolore; f) dolore da strutture viscerali e somatiche profonde; g) disturbi della percezione del dolore e dolore di origine centrale. □ Bibliografia.
1. Introduzione.
a) Generalità.
Il termine ‛somatoestesia', o sensibilità somatica, serve a indicare le sensazioni prodotte dalla stimolazione di tutti i tessuti del corpo, a eccezione di quelle specifiche della vista, dell'udito, dell'olfatto e del gusto. Sembra inoltre che stimoli di una data natura, in seguito all'esperienza cosciente, provochino esperienze sensitive tali che, entro certi limiti di discriminazione e di risoluzione, possono essere definite con una certa precisione e riconosciute dall'uomo ogni qualvolta gli si presentano. Si usa chiamare ‛modalità sensitiva' ogni classe di sensazioni qualitativamente simili e facilmente distinguibili l'una dall'altra. Un normale osservatore è in grado di identificare molte di queste qualità primarie della somatoestesia: la meccanorecezione (tatto-pressione), la sensazione di caldo, di freddo, di dolore, della posizione e del movimento degli arti. Ci sono poi altre sensazioni somatiche che, pur apparendo all'esperienza soggettiva assolutamente diverse dalle altre, tuttavia sono evocate da variazioni quantitative o dinamiche degli stimoli appartenenti all'una o all'altra delle modalità primarie. Un esempio è la sensazione di vibrazione che, evocata da stimoli meccanici oscillanti periodicamente sulla superficie corporea, è soggettivamente inconfondibile; eppure gli stessi stimoli, applicati con ordine temporale diverso, danno origine solo alla sensazione di contatto meccanico. È certo che le nostre esperienze somatoestetiche di tutti i giorni sono comunemente indefinibili mescolanze di esperienze considerate di qualità primaria; tali miscugli, che producono quelle sensazioni che noi riconosciamo subito e ricordiamo con facilità, sono il risultato delle proprietà funzionali del sistema somatico afferente e del sistema nervoso in generale.
Il sistema nervoso riceve dal mondo esterno, per mezzo delle fibre nervose sensitive di primo ordine, informazioni astratte e codificate. L'immagine della realtà risulta distorta a causa delle trasformazioni che avvengono sia a livello delle fibre di primo ordine, sia a ogni stadio della catena di eventi nervosi che danno luogo alla percezione. Inoltre, questa immagine è condizionata dall'interazione fra l'informazione in arrivo e quella ricevuta in precedenza e conservata: infatti le percezioni dipendono in parte dall'esperienza precedente e in parte da quello che ci aspettiamo. Le nostre cognizioni dei meccanismi fisiologici della sensazione e della percezione sono molto più complete per gli eventi periferici che non per quelli del sistema nervoso centrale. Questo articolo ha lo scopo di chiarire, per quanto è al presente possibile, i meccanismi nervosi responsabili della somatoestesia. Inizieremo con uno schema del sistema somatico afferente, elencando una serie di principî e di definizioni necessari per capire i meccanismi sensitivi. Non saranno trattati invece gli aspetti filosofici del problema della relazione tra sensazione, percezione e meccanismi cerebrali, problema che ha appassionato così intensamente i filosofi fin dai tempi di Cartesio e prima ancora. Particolare rilevanza sarà data, d'altra parte, alle capacità somatoestetiche dell'uomo e al grande valore euristico della correlazione continua fra i risultati della psicofisica e quelli della neurofisiologia. Tratteremo quindi dei meccanismi periferici della trasduzione, della comunicazione e della codificazione nervosa, e analizzeremo certi aspetti della somatoestesia relativi alle fibre periferiche. Saranno poi presi in esame le aree pretalamiche e talamiche e i meccanismi dinamici della somatoestesia, compreso il ruolo dei sistemi discendenti che, presumibilmente, influenzano e controllano l'informazione afferente. Successivamente saranno discusse le correlazioni fra i deficit sensitivi e le lesioni cerebrali che li producono, e saranno esposte le ipotesi relative ai meccanismi nervosi che ne risultano. Infine, separatamente, sarà trattato l'argomento del dolore.
b) Sistema somatico afferente.
Il concetto di un ‛sistema sensitivo' all'interno del sistema nervoso è un'astrazione di buon senso utile al neurologo, sia sperimentale sia clinico, in quanto permette di classificare gli eventi e le osservazioni e di indicare delle cause. Un sistema sensitivo considerato sotto questo punto di vista è composto da vie afferenti, nuclei sottocorticali e aree corticali che ricevono il maggior contributo afferente da un canale sensitivo e che si ritiene fondatamente svolgano un ruolo importante in quella data sensazione. Il fatto che un osservatore sia in grado di separare le esperienze sensitive in classi facilmente differenziabili ci suggerisce che, almeno ai livelli iniziali dell'elaborazione del sistema nervoso centrale, esista parallelamente anche un certo grado di segregazione anatomica dei corrispondenti apparati nervosi.
Il sistema somatico afferente è composto di due parti. Una parte importante è costituita dalle fibre mieliniche di maggiore diametro (〈 di 4-6 μ) delle radici posteriori, che proiettano sia direttamente attraverso la colonna dorsale ipsilaterale, sia indirettamente, attraverso la colonna dorsolaterale, ai nuclei della colonna dorsale. Questi ultimi, a loro volta, proiettano al complesso nucleare ventrobasale del talamo controlaterale, le cui cellule mandano assoni al giro postcentrale della corteccia cerebrale. All'interno di questo sistema c'è una replica precisa di un'immagine distorta della forma del corpo, il mantenimento della specificità di modalità delle fibre mieliniche di primo ordine, e un grado di sicurezza sinaptica molto adatto a un'azione nervosa che si attui in breve tempo. Questo sottosistema è organizzato in modo tale da presiedere proprio agli aspetti discriminativi della sensibilità meccanica, e il termine ‛lemniscale' è usato per indicare sia il sistema anatomico sia le proprietà funzionali dei suoi neuroni.
A livello di entrata della radice posteriore c'è una massiccia diramazione fatta di piccole fibre mieliniche, che sono rami collaterali di fibre più grosse, e di fibre amieliniche. Queste terminano sugli interneuroni del corno posteriore e presiedono ai riflessi locali e multisegmentali. Da questo sistema di interneuroni origina la seconda suddivisione principale del sistema somatico afferente, che corre cranialmente nella colonna anterolaterale del midollo spinale, in gran parte controlateralmente. Questa proietta alla formazione reticolare centrale del tronco dell'encefalo e al mesencefalo, a certi nuclei intralaminari del talamo e al complesso nucleare ventrobasale del talamo. Questo sistema ‛anterolaterale' presiede a una forma di recezione meccanica più generale e meno precisa di quella del sistema lemniscale e anche alla sensibilità' dolorifica e a quella termica (v. sistema reticolare ascendente).
Queste due suddivisioni principali del sistema somatico, divergenti a livelli pretalamici, probabilmente convergono di nuovo, almeno parzialmente, a livello talamocorticale. Uno dei maggiori problemi per la comprensione dei meccanismi nervosi della somatoestesia è appunto stabilire come questi due sistemi riescano a lavorare in sinergia segnalando gli eventi meccanici periferici. Una duplicità simile è presente anche nella componente trigeminale di questo sistema.
2. Definizioni e principi.
1. I termini ‛recettore sensitivo', ‛terminazione' e ‛organo' sono usati scambievolmente dai fisiologi dei sensi, ma le vere terminazioni sensitive sono le terminazioni periferiche delle fibre nervose afferenti. Le terminazioni delle fibre afferenti meccanocettrici più grandi, che innervano la cute e i tessuti profondi, sono frequentemente incapsulate da gruppi di cellule non nervose, talvolta raggruppate in piccoli organi. Recentemente si è visto che questi organi svolgono un ruolo importante nella determinazione della sensibilità dinamica delle terminazioni nervose meccanocettrici, ma non sono responsabili della specificità meccanocettiva stessa. Le fibre afferenti meccanocettrici più piccole terminano liberamente fra le cellule dei tessuti che esse innervano.
2. Le terminazioni nervose sensitive possiedono una ‛soglia', cioè, fra gli stimoli della stessa qualità ma di diversa intensità, alcuni non eccitano mai, altri eccitano sempre la terminazione nervosa (v. elettrofisiologia). Nello stadio di transizione fra i due gruppi, che spesso comprende una ristretta gamma di intensità, vi sono stimoli che hanno una sempre maggiore probabilità di eccitare: la soglia è quindi un valore statistico. La soglia per la sensazione umana, al limite, si avvicina a quella delle fibre nervose di primo ordine del gruppo responsabile di quella sensazione.
3. Una ‛unità sensitiva' è costituita da una singola fibra nervosa afferente primaria e da tutte le sue diramazioni periferiche e terminazioni centrali. In senso lato, questa unità comprende anche gli elementi non nervosi che si trovano a essa associati. Quando è usato per i neuroni centrali, questo termine include tutte quelle unità sensitive periferiche che proiettano, direttamente o trans-sinapticamente, all'elemento centrale.
4. Un ‛campo recettivo periferico' è l'area del corpo entro la quale gli stimoli di intensità sufficiente e di qualità appropriata hanno effetto su un'unità sensitiva, cioè l'area di cute nella quale uno stimolo meccanico eccita una fibra nervosa periferica meccanocettrice.
5. Le diramazioni periferiche di unità sensitive adiacenti sono intrecciate fra loro; questa sovrapposizione si sposta gradualmente lungo una superficie sensitiva come quella della pelle. È improbabile che uno stimolo riesca normalmente a eccitare soltanto una singola fibra nervosa afferente. Questo principio di sovrapposizione parzialmente spostata delle terminazioni periferiche è importante per capire i meccanismi nervosi centrali responsabili della discriminazione spaziale.
6. I campi recettivi periferici delle fibre afferenti primarie che terminano in una data superficie sensitiva variano molto in grandezza, in genere in rapporto inverso al numero delle fibre che innervano in ciascuna unità di area la superficie sensitiva. Il volume del tessuto nervoso centrale che presiede alla rappresentazione delle varie parti di un campo sensitivo (cioè le parti del corpo) varia in proporzione diretta a questa ‛densità di innervazione periferica', proprio come avviene per la acuità sensitiva.
7. Le fibre nervose sensitive differiscono fra loro per la maniera in cui rispondono a uno stimolo continuo, cioè per la velocità di ‛adattamento'. Alcune rilevano gli stimoli transitori, perché scaricano brevi treni di impulsi non appena viene applicato lo stimolo ma non rispondono se questo viene applicato in modo continuo; esse inoltre possono scaricare di nuovo quando lo stimolo viene rimosso. Altre afferenze rispondono all'inizio dello stimolo con scariche ad alta frequenza, il cui andamento temporale e la frequenza massima sono in funzione della velocità di applicazione dello stimolo e della sua intensità finale. Queste afferenze, tuttavia, continuano a scaricare se lo stimolo viene mantenuto in modo costante; la frequenza di scarica è determinata dall'intensità dello stimolo stesso.
8. Differenti gruppi di fibre nervose, quando sono attivi, producono differenti sensazioni e ogni gruppo evoca sempre le stesse sensazioni indipendentemente dal modo in cui è stato attivato; tale specificità si ritiene sia dovuta alla differenza delle connessioni centrali. Inoltre, le terminazioni periferiche dei diversi gruppi di fibre sono sensibili in maniera selettiva alle varie forme di energia alle quali possono essere esposte. Il meccanismo di questa specificità qualitativa è sconosciuto; comunque è certo che esso esiste.
9. Il termine ‛proprietà funzionale' indica quelle caratteristiche di un neurone che lo differenziano dagli altri, oltre alle proprietà generali della cellula comuni a tutti i neuroni centrali. Queste proprietà determinano gli aspetti immediati della sensazione, e cioè se è trasmessa un'informazione che permette il riconoscimento della qualità e la localizzazione di uno stimolo, la capacità di valutare e di discriminare tra ritmi di stimoli, ecc. Per ogni dato neurone tali proprietà, determinate in gran parte dalle connessioni afferenti, sono di due classi. Le ‛proprietà statiche' sono quelle dovute ai legami sinaptici esistenti fra le fibre di primo ordine e i neuroni centrali. Esse sono costanti anche per variazioni notevoli di eccitabilità del proencefalo, o per influenza di sistemi convergenti, o per azioni di narcotici, e permettono la localizzazione dello stimolo e il riconoscimento della modalità. Le ‛proprietà dinamiche', d'altra parte, dipendono dalle capacità quantitative di trasmissione dei legami sinaptici, e sono sensibili ai cambiamenti dell'eccitabilità in generale, all'azione dei narcotici, ecc. Esse determinano le capacità quantitative in una determinata sfera sensitiva. Ovviamente alcune proprietà sono sia statiche sia dinamiche.
10. Nelle ultime decadi il metodo più produttivo e ampiamente usato per studiare i meccanismi nervosi della sensazione è stato quello dell'analisi di singole unità. Il metodo è usato in vari modi. Si possono isolare le singole fibre nervose periferiche o fisicamente con la microdissezione, oppure elettricamente facendovi penetrare un microelettrodo e registrando poi i segnali elettrici degli impulsi nervosi in esse propagati. In questo modo si può determinare la codificazione di certi aspetti dello stimolo periferico all'ingresso nel sistema nervoso. L'osservazione degli eventi cellulari per mezzo della registrazione intracellulare ha permesso il recente progresso della conoscenza della trasmissione sinaptica (v. elettrofisiologia; v. neurone e impulso nervoso; v. sinapsi: Fisiologia della sinapsi centrale e Fisiologia della sinapsi periferica). Per lo studio dei neuroni sensitivi centrali, la registrazione dei segnali elettrici dell'attività per mezzo di un microelettrodo la cui punta si trova in posizione extracellulare vicino a un neurone offre molti vantaggi; infatti, si possono studiare in tal modo per lunghi periodi di tempo sia elementi singoli sia un numero considerevole di cellule di una data popolazione, una dopo l'altra, in condizioni controllate. Questo metodo rende possibile ricostruire il profilo di attività di tutti i neuroni della popolazione influenzati da un dato stimolo periferico. Paragonando le proprietà della risposta di popolazioni nervose a differenti livelli di un sisteina sensitivo è possibile definire le trasformazioni che avvengono tra la periferia e il centro. Da esperimenti di questo tipo deriva gran parte delle conoscenze che tratteremo in seguito.
3. Capacità umane nella sfera della sensibilità meccanocettrice.
È importante quantificare la capacità sensitiva dell'uomo per determinare la soglia di rilevamento d'uno stimolo e la capacità di graduare e discriminare fra stimoli che evocano sensazioni della stessa qualità ma con diversa localizzazione periferica, intensità od ordine temporale (v. Stevens, 1970). Queste misurazioni indicano la gamma di parametri nella quale possono operare i relativi meccanismi nervosi e, quando sono effettuate negli animali da esperimento, ci permettono una valutazione simultanea del comportamento sensitivo e degli eventi nervosi.
a) Tatto-pressione.
La soglia si determina misurando la probabilità che un soggetto rilevi la presenza di uno stimolo, un problema affrontato spesso nel contesto della teoria della decisione. Per convenzione si designa come soglia il punto del 50% della funzione di probabilità; la soglia è più bassa nelle regioni del corpo a innervazione più densa, come la mano o la faccia (v. Weinstein, 1968). Le differenze regionali indicate nella fig. 1 riflettono le differenze numeriche delle afferenze meccanocettrici impegnate da uno stimolo meccanico, il che suggerisce che la soglia è funzione del grado di sommazione spaziale. Non è noto, tuttavia, se tutti i ‛punti del tatto' hanno una soglia simile e le differenze regionali possono essere dovute anche alle diverse caratteristiche fisiche. Le soglie inferiori si riscontrano a temperature cutanee di 37 °C, 4 o 5 °C in più della normale temperatura della cute del palmo della mano. Le soglie sono più basse quando si permette all'osservatore di muovere la superficie recettrice (per esempio, il dito in esplorazione) in modo da andare su e giù sull'oggetto da individuare. Per esempio, usando la punta dell'unghia di un dito, o tenendo in mano uno strumento affilato, un uomo può rilevare una scanalatura di 1 micron incisa in una superficie metallica liscia (v. Kesten, 1956). L'aumentata capacità di rilevamento ottenuta con il movimento attivo è dovuta soltanto in parte all'oscillazione indotta nei profili di attività nervosa periferica e centrale, perché si pensa che ‛l'atto di sentire' in sé contribuisca alla capacità sensitiva in un modo che non è ancora compreso in termini di meccanismi nervosi. Le soglie per la meccanorecezione sono virtualmente identiche nei due lati del corpo, sia nei destrimani sia nei mancini (v. Fennell e altri, 1967).
1. Discriminazione e valutazione dell'intensità. - Nell'uomo, per brevi stimoli meccanici applicati alla cute glabra della mano, la valutazione dell'intensità di stimolo è una funzione lineare del grado di inflessione della cute, o della forza (v. fig. 2). La soglia per la valutazione di un incremento per il tatto-pressione è il 10-15% al di sopra della gamma media di intensità di stimolazione, ma sale per gli stimoli molto deboli e per quelli molto forti, determinando quindi una funzione di Weber non lineare
2. Discriminazioni spaziali e temporali. - Una caratteristica importante della somatoestesia umana è la capacità di identificare il cambiamento dinamico dell'ordine spaziale degli stimoli applicati sulla superficie della cute. Per quanto riguarda il meccanismo, il problema è di come un apparato nervoso centrale sia in grado di specificare il luogo di aumentata attività in un campo nervoso e di discriminare tra attività differenti i cui contorni spesso cambiano rapidamente all'interno del campo stesso. Un test semplice per la discriminazione spaziale è quello di misurare la capacità di riconoscere la presenza di due stimoli, e non di uno solo, in funzione della distanza fra gli stimoli. Le funzioni psicometriche che indicano questa soglia sono mostrate nella fig. 3 (v. Carmon, 1968); la soglia per i due punti varia con la zona del corpo nello stesso modo della soglia tattile illustrata nella fig. 1. La soglia è minima per stimoli di intensità intermedia, e si abbassa decisamente se gli stimoli sono applicati uno dopo l'altro invece che simultaneamente; si pensa che in quest'ultimo caso la sovrapposizione delle due zone centrali di attività nervosa eccitate dai due stimoli sia indotta per l'effetto dei meccanismi di inibizione afferente (v. cap. 9, È a).
Nell'uomo un esempio di una molto più complessa capacità spazio-temporale nella sfera della meccanorecezione è dato dalle prestazioni dei ciechi nella lettura dei caratteri Braille (v. Critchley, 1953). Chi ha raggiunto un alto grado di abilità nella lettura del Braille è in grado di ricevere un intenso flusso di informazioni e può arrivare a leggere 100 parole al minuto. I ciechi non hanno capacità tattili superiori ai vedenti, ma raggiungono un così elevato livello di prestazione solo in virtù di un intenso allenamento. Il Braille codifica un sistema alfanumerico con combinazioni che arrivano fino a 6 punti in rilievo per ogni lettera o numero. I punti emisferici hanno un rilievo di circa i mm rispetto alla superficie della pagina e sono disposti in due gruppi verticali di 3; ogni punto dista 2,5 mm da quelli vicini, distanza appena superiore a quella della soglia per la discriminazione fra due punti dell'estremità delle dita. Di questi schemi alternativi ce ne sono 64. Il lettore esperto, che usa l'indice, più frequentemente il sinistro anche se destrimane, esplora la linea rapidamente. Ogni difficoltà che richieda un'attenzione più intensa si manifesta con rapidi movimenti oscillatori sulla lettera in questione. Come ogni altra discriminazione somatoestetica complessa, la lettura Braille dipende dal rilevamento di una mescolanza di segnali recanti l'informazione di spazio, intensità e tempo.
b) Senso di posizione e cinestesia.
Gli esseri umani sono in grado di percepire con grande precisione sia il movimento sia la posizione fissa delle articolazioni. Le soglie per la percezione del movimento passivo delle articolazioni prossimali, come la spalla e l'anca, sono dell'ampiezza di un grado di movimento alla velocità di un grado al secondo, mentre divengono sempre più elevate mano a mano che ci spostiamo verso le articolazioni più distali, fino a raggiungere valori 5, 10 volte più elevati nelle articolazioni interfalangee (v. Provins, 1958; v. Browne e altri, 1954). La posizione fissa degli arti è percepita con un'accuratezza tale da permettere la riproduzione della posizione di un arto nello spazio; per l'articolazione della spalla, ad esempio, questo avviene con un margine di errore di 2 gradi o anche meno (v. Cohen, 1958). La stima soggettiva del grado di deflessione fissa di una articolazione è funzione regolare, monotonica e ad accelerazione negativa dello spostamento angolare effettivo, ed è descritta da una funzione esponenziale con esponente 0,7-0,8 (v. Grigg e altri, 1972).
Questo senso del movimento e della posizione ‛passivi' di un arto dipende dai segnali provenienti dalle afferenze primarie che innervano le articolazioni. La percezione del movimento ‛attivo', tuttavia, può persistere anche in loro assenza. Per esempio, la deflessione angolare di un dito può essere riprodotta accuratamente da un soggetto senza l'aiuto della vista, dopo che tutte le afferenze provenienti dall'articolazione in movimento sono state bloccate. Merton (v., 1964) suggerisce che questo ‛senso di sforzo' dipenda dai messaggi che rientrano nel sistema nervoso e lo informano dell'attività nervosa efferente che ha prodotto il movimento. Goodwin e altri (v., 1972), d'altra parte, hanno dimostrato l'importanza delle afferenze provenienti dagli stessi muscoli in contrazione. Per adesso il problema rimane insoluto.
c) Il senso di flutter-vibrazione.
Uno stimolo che vibra sinusoidalmente applicato alla superficie del corpo evoca una sensazione che un soggetto identifica come qualitativamente diversa dal tatto o da quella evocata da stimoli di contatto ripetuti irregolarmente. A frequenze di 5-40 Hz la sensazione è quella di un'oscillazione cutanea facilmente localizzabile. Frequenze più alte suscitano una profonda e non ben localizzata ma molto caratteristica sensazione di vibrazione. La frequenza ottimale di vibrazione è di circa 250 Hz, mentre le sinusoidi di frequenze al di sopra di 5-600 Hz sono percepite come un contatto stabile. La flutter-vibrazione è una forma derivata di meccanorecezione che dipende, per le sue qualità speciali, dall'andamento temporale dell'attività delle afferenze meccanocettrici, che essendo attivate anche da brevi stimoli di contatto devono pure contribuire alla sensibilità di contatto. Proprio l'aspetto temporale e dinamico di questa sensibilità la rende particolarmente importante per gli studi neurofisiologici dei meccanismi di elaborazione centrale della somatoestesia. È stato dimostrato che la natura duplice della flutter-vibrazione dipende dall'attività di due distinti gruppi di fibre meccanocettrici, sensibili l'uno alle basse e l'altro alle alte frequenze (v. Talbot e altri, 1968).
Le funzioni psicometriche, che esprimono graficamente la probabilità che un soggetto riesca a rilevare la presenza di stimoli meccanici sinusoidali di differente ampiezza, a 30 Hz, sono illustrate nella fig. 4. Ripetendo l'esperimento per numerose frequenze si hanno le curve di frequenza di soglia del tipo mostrato nella fig. 5, che riporta anche curve dello stesso tipo ottenute su scimmie in condizioni sperimentali quasi identiche. Tali curve dimostrano che le soglie del rilevamento, e così pure il grado di sensibilità, sono identiche nei due primati (v. Mountcastle e altri, 1972). Questa identità rende ancor più interessante lo studio dei meccanismi nervosi che presiedono alla sensibilità vibratoria della scimmia, che verranno descritti in altro paragrafo (v. cap. 9, È c). Sia gli uomini sia le scimmie riescono a distinguere stimoli vibratori che differiscono in frequenza del 10-15%, cioè 2-3 cicli a 30 Hz (v. LaMotte e Mountcastle, 1979). Nell'uomo stimoli vibratori di ampiezza diversa sono classificati in una relazione quasi direttamente proporzionale all'effettiva ampiezza delle sinusoidi applicate (v. Talbot e altri, 1968; v. Verrillo e altri, 1969).
4. Processo di trasduzione nelle afferenze somatiche.
Nei rilevatori di condizioni transitorie. - In generale, l'eccitazione delle afferenze nervose somatiche segue questa sequenza (v. elettrofisiologia; v. neurone e impulso nervoso):
Le terminazioni nervose meccanocettrici dei Mammiferi sono generalmente così inglobate nei tessuti circostanti che il loro studio per mezzo di metodi microfisiologici è molto difficile.
Un'eccezione è costituita dai corpuscoli del Pacini, ad adattamento rapido, perché si trovano non solo nei tessuti somatici ma anche nel mesentere, dal quale possono essere isolati sia singoli corpuscoli sia le singole fibre che li innervano, nel modo illustrato nella fig. 6 (v. Loewenstein, 1971).
Il corpuscolo del Pacini è una formazione ellissoidale formata da un certo numero di lamelle concentriche, che sono l'estensione membranosa, sottile e appiattita, di una cellula specializzata non nervosa. La fibra nervosa mielinica entra a un'estremità del corpuscolo, e dopo aver perso la mielina e la guaina di Schwann, va a occupare tutta la parte centrale del corpuscolo con la terminazione nervosa nuda e quasi rettilinea. Gli spazi intralaminari sono riempiti di liquido extracellulare e contengono fibre collagene. Il corpuscolo è turgido e scarsamente compressibile, così che uno stimolo meccanico applicato sulla sua superficie può avere un effetto sulla terminazione nervosa solo per spostamento differenziale degli elementi corpuscolari.
Deboli stimoli meccanici applicati al corpuscolo isolato provocano un cambiamento locale del potenziale di membrana della sua terminazione nervosa che, se di ampiezza sufficiente, dà luogo a un impulso nervoso propagato. Questo processo locale, generato nella terminazione nervosa e non nel corpuscolo, non è propagato ma si diffonde elettrotonicamente e, non avendo periodo refrattario, può essere soggetto a sommazione spaziale e temporale. Esso è il risultato di un cambiamento non specifico della permeabilità ionica della terminazione nervosa; tale cambiamento ha un potenziale di equilibrio molto vicino al potenziale di membrana zero. È probabile che la terminazione nervosa possa dare origine sia al processo locale sia al cambiamento rigenerativo della permeabilità al Na+ che porta al potenziale di azione propagato, ma non si sa se i due processi avvengano in zone adiacenti o identiche della membrana. È probabile, tuttavia, che in condizioni normali gli impulsi abbiano inizio al primo nodo di Ranvier. Quindi il processo generatore locale ha molti punti in comune con le risposte locali postsinaptiche delle cellule nervose, e la funzione del primo nodo è, almeno in parte, analoga a quella del segmento iniziale del soma neuronico (v. elettrofisiologia; v. neurone e impulso nervoso; v. sinapsi: Fisiologia della sinapsi centrale).
Non vi sono prove che lo stimolo meccanico provochi il potenziale generatore nella terminazione nervosa per mezzo di uno speciale evento chimico. Il potenziale generatore può essere dovuto a un'alterazione delle proprietà fisiche della membrana, per esempio a un cambiamento della conformazione delle molecole più grandi (v. Teoreli, 1971). In confronto, la membrana del tronco dell'assone è notevolmente insensibile a stimoli meccanici e quindi la sensibilità della terminazione è un esempio di specializzazione per funzioni differenziali.
Sia il livello di depolarizzazione della membrana richiesto per iniziare un impulso nervoso propagato sia l'ampiezza dei potenziali di azione negli assoni sono insensibili ai cambiamenti di temperatura nell'ambito di valori compresi fra 12 e 40 °C. Il trasferimento di cariche attraverso la terminazione nervosa del Pacini, d'altra parte, è notevolmente modificato dalla temperatura: l'ampiezza e la velocità di salita del potenziale generatore aumentano con il coefficiente termico Q10 di 2,0-2,5. Tuttavia Loewenstein (v., 1961) ha dimostrato che ampie e rapide variazioni di temperatura non sono in grado di produrre nè potenziali generatori nè potenziali di azione. Quindi, nonostante che il processo di trasferimento della carica dipenda in modo sensibile dalla temperatura, la terminazione è un meccanocettore altamente specifico.
Nei rilevatori di condizioni sia transitorie sia continue. - Molte delle terminazioni nervose periferiche delle fibre somatiche afferenti rispondono a stimoli di lunga durata con potenziali generatori persistenti che a loro volta danno origine a scariche ripetitive di impulsi nei loro tronchi assonici. La scarica iniziale e transitoria è determinata dalla velocità di applicazione dello stimolo, dopo di che la frequenza di scarica si abbassa fino a raggiungere livelli più o meno costanti determinati dall'ampiezza dello stimolo. Molte di queste fibre di primo ordine innervano i tessuti cutanei e quelli profondi, ma solo raramente è possibile isolarle per uno studio microfisiologico. Per due di esse - il recettore da stiramento del fuso neuromuscolare della rana (v. Katz, 1950; v. Ottoson e Shepherd, 1971) e il recettore da stiramento scoperto nella coda dei Crostacei (v. Kuffler, 1958-1959) - tuttavia, ciò è possibile. I risultati ottenuti con studi intracellulari su quest'ultimo sono illustrati nella fig. 7.
Una distensione minima provoca solo un processo generatore che persiste per tutto il tempo che è applicato lo stiramento. Distensioni maggiori provocano una maggiore depolarizzazione della cellula e un treno di impulsi nervosi. Le relazioni tra distensione, potenziale generatore e frequenza di scarica sono lineari per una normale gamma di azione (v. Terzuolo e Washizu, 1962). Questa linearità persiste per una gamma di variazioni che arriva a 10 Hz, per piccole ampiezze di distensione (v. Terzuolo e Knox, 1971). Il cambiamento della permeabilità ionica che produce il trasferimento della carica del generatore attraverso la membrana cellulare è aspecifico per gli ioni univalenti, come avviene per il corpuscolo del Pacini.
Adattamento delle terminazioni nervose sensitive e accomodamento. - Due processi sensibili alla velocità di variazione determinano la frequenza di stimolazione alla quale i vari meccanocettori sono sensibili in modo diverso: le proprietà meccaniche dei tessuti che circondano la terminazione nervosa e l'accomodamento della membrana assonica alla corrente del generatore. Le lamelle del corpuscolo del Pacini agiscono come un filtro meccanico passa-alto (v. Hubbard, 1958; v. Loewenstein, 1969) sia con gli elementi viscosi sia con quelli elastici. Le forze rapide di compressione sono trasmesse direttamente alla parte centrale con un andamento temporale parallelo a quello del potenziale del recettore. La componente costante della forza applicata è accumulata negli elementi elastici distesi ed è trasmessa alla terminazione nervosa con un'attenuazione di almeno 100 a 1. In seguito alla cessazione improvvisa della compressione costante, questa forza accumulata è trasmessa dagli elementi elastici distesi a quelli viscosi producendo un secondo evento dinamico, una risposta off del potenziale generatore e un impulso propagato. Anche potenziali generatori quasi-stabili (prodotti sperimentalmente) di 5 volte la soglia, comunque, producono solo una scarica di inizio di 1 o 2 impulsi. Quindi la membrana del nodo del tronco assonico si accomoda rapidamente alla corrente del generatore e contribuisce alla selettività di frequenza dell'afferenza del corpuscolo del Pacini (v. Loewenstein e Mendelson, 1965). Questo, insieme alle caratteristiche meccaniche del filtro passa-alto del corpuscolo stesso, spiega perché le afferenze del Pacini siano sensibili selettivamente a stimoli meccanici sinusoidali, con frequenze ottimali di circa 250 Hz, alle quali stimoli di ampiezza picco-picco di solo 0,1-0,2 micron provocano un impulso in fase con ogni ciclo di onda sinusoidale (v. Sato, 1961).
Non esiste filtro passa-alto nelle terminazioni dei recettori muscolari da stiramento ad adattamento lento. Subito dopo la risposta transitoria c'è una riduzione sia del potènziale generatore sia della frequenza di scarica dei potenziali di azione; essa è dovuta, in parte, a una diminuzione della tensione meccanica che si verifica subito dopo l'applicazione e il mantenimento dello stimolo (v. Husmark e Ottoson, 1970 e 1971). La membrana del nodo di Ranvier del tronco assonico differisce da quella delle afferenze del corpuscolo del Pacini, perché si accomoda solo molto lentamente alla corrente del generatore (v. Lippold e altri, 1960). In altri meccanocettori a lento adattamento, tuttavia, le proprietà meccaniche e di membrana hanno un ruolo diverso nel determinare le velocità di adattamento a stimoli costanti.
I meccanocettori, ovunque essi si trovino, rientrano in queste due classi per quel che riguarda la velocità di adattamento. I meccanocettori ad adattamento rapido possono inviare solo scarse informazioni riguardo all'intensità dello stimolo. Essi sono giustamente considerati segnalatori di stati transitori, e una popolazione di queste afferenze può segnalare la direzione dello spostamento spaziale di uno stimolo, e così pure la sua evenienza. I meccanocettori ad adattamento lento sono in grado di segnalare sia la frequenza del cambiamento, sia una stimolazione costante.
In conclusione, tra l'applicazione di uno stimolo a un recettore sensitivo e la scarica di impulsi nel tronco assonico di questo, si produce un evento locale, e cioè un trasferimento di carica attraverso la membrana della terminazione nervosa che produce una depolarizzazione chiamata potenziale generatore. Questo evento generatore non è, di per sé, propagato, ma invade le regioni adiacenti dell'assone per diffusione elettrotonica. Può essere sommato sia temporalmente sia spazialmente, non ha periodo refrattario e, quando la depolarizzazione della membrana da cui ha origine l'impulso raggiunge il livello di soglia, dà origine a potenziali di azione propagati. Le differenze di velocità di adattamento dei recettori a stimoli costanti, così evidenti nei meccanocettori, sono dovute sia alle proprietà speciali degli elementi non nervosi dei recettori, che possono in certi casi funzionare come filtri passa-alto, sia, in proporzioni variabili, al fatto che le membrane che generano gli impulsi nel tronco assonico nei vari tipi di recettori differiscono nella velocità di accomodamento alla corrente del generatore.
5. Comunicazione e codificazione nel sistema nervoso centrale.
Le cellule del sistema nervoso sono connesse tra loro in raggruppamenti divergenti-convergenti di varia proporzione e complessità. Queste reti ricevono, trasformano, accumulano, recuperano e distribuiscono l'informazione, una funzione che è ottenuta con diversi processi successivi di codificazione, trasmissione, interpretazione e ricodificazione. Inoltre, qualcosa di simile al calcolo matematico avviene in tutte le regioni nucleari, nelle quali le influenze spesso diverse che arrivano da vari canali si combinano con le proprietà intrinseche delle reti nervose locali e determinano la natura della risposta finale: l'azione integrativa è così ottenuta.
Nella somatoestesia questo processo comprende sia la codificazione degli eventi sensitivi in modelli di scarica delle fibre di primo ordine, sia la trasmissione e la modificazione di quei segnali codificati tra le differenti popolazioni di cellule del sistema nervoso.
Non esiste un solo codice nervoso universale: il numero dei probabili codici non è elevato, ma certamente superiore a uno (v. Perkel e Bullock, 1969). I criteri in base ai quali si può stabilire la validità di un probabile codice sono: prima di tutto la dimostrazione che esso è presente nel cervello spontaneamente e/o che può essere evocato da stimoli naturali; in secondo luogo la dimostrazione dell'esistenza di un gruppo di neuroni che riceve i canali nervosi che trasportano i segnali in codice, neuroni la cui attività cambia in risposta a quei segnali. Per esempio, è possibile dimostrare che un'esperienza sensitiva ben identificabile è suscitata se e soltanto se si evocano certi modelli temporali di scarica di impulsi per mezzo di stimoli naturali in determinati gruppi di fibre afferenti (v. Mountcastle, 1967). Attualmente sono state individuate diverse classi di probabili codici.
1. Il codice determinato dal tipo di linea: cioè, l'informazione di un messaggio dipende almeno in parte dal particolare gruppo di fibre eccitate. Una volta che si conosca l'identità della linea attivata, l'informazione accumulata nel sistema fornisce il significato dell'attività. Questo è il codice più noto e forse più comune di tutti: esso comprende la specificità di modalità delle afferenze sensitive ed è così generalizzato da poter essere applicato a qualsiasi tipo di neurone, compresi quelli non sensitivi. In esso è compresa inoltre la nozione che a trasportare l'informazione sono il luogo di attività nel campo nervoso e la posizione del campo nel cervello. L'informazione trasportata da una data linea nervosa può essere inserita in più di un codice: ogni grado di attività di un determinato gruppo di fibre afferenti di modalità specifica evoca quasi sempre un tipo di esperienza sensitiva qualitativamente specifica; differenti frequenze o modelli temporali di tale attività sono in grado di specificare i vari parametri quantitativi di quella sensazione.
2. La frequenza come codice dell'intensità dello stimolo (o livello di un input presinaptico): cioè la frequenza di scarica nervosa in uscita mediata su un tempo breve compatibile con la costante di tempo di integrazione dei neuroni-bersaglio. Questo codice si può applicare alle afferenze di primo ordine ad adattamento lento ma non a quelle ad adattamento rapido, e lo stesso si può dire per i due gruppi di neuroni centrali sui quali proiettano queste due classi di fibre. La modulazione di frequenza di una scarica a frequenza quasi costante è una variante del codice di frequenza. Nei sistemi multistabili questo codice può fornire un segnale tutto-o-nulla, poiché la frequenza al di sopra o al di sotto di un certo livello aggiusta il sistema in uno stato o nell'altro.
3. Ordine di successione degli impulsi nervosi: questi treni di impulsi possono essere considerati come l'evento più significativo del processo; l'informazione è contenuta nella sequenza temporale (v. Perkel, 1970; v. Segundo, 1970). Ovviamente, la capacità di una linea è sensibilmente aumentata se il sistema può codificare e interpretare differenti micromodelli a ogni frequenza media. Per ora di questa classe si conoscono solo i casi limite. A un estremo v'è il semplice comando di un motoneurone ‛azione-inazione' e all'altro c'è l'attività quasi periodica suscitata in certe fibre afferenti meccanocettrici da stimoli meccanici oscillanti applicati sulla cute, nel qual caso il periodo segnala la frequenza di vibrazione.
4. Codici distribuiti o di insieme: in questi l'informazione è trasmessa da un profilo di attività all'interno di un campo nervoso. È probabile che i contorni spaziali di uno stimolo sensitivo siano codificati in questo modo. Questa classe include un numero di varianti come la combinazione di apertura di una cassaforte, cioè si ha una scarica postsinaptica solo se due specifiche afferenze sono attive entro un preciso periodo di tempo (v. Gerstein, 1970).
5. Codici costituiti da eventi elettrici lenti: i cambiamenti sia locali sia propagati della membrana dei neuroni centrali generano flussi di corrente extracellulare che, per breve estensione, possono penetrare le membrane cellulari di altri neuroni e quindi condizionare il loro livello di eccitabilità e la loro attività. È probabile che queste correnti extracellulari funzionino come vettori di informazioni, ma non ci sono prove convincenti che questo tipo di codice sia importante nel sistema nervoso.
6. Altri codici di attività non trasmessi per mezzo di impulsi: per esempio la trasmissione di segnali tra cellule dovuta a eventi locali de- o iperpolarizzanti che, per estensione passiva ad assoni ‛corti', controlla la trasmissione sinaptica ai neuroni-bersaglio. Questo si verifica nella retina e forse nelle cellule ad assone corto della corteccia cerebrale. In altri casi l'accoppiamento elettrotonico tra cellule permette una trasmissione molto rapida tra di esse, spesso con la modalità del feedback positivo. In scale di tempo più lente, è probabile che lo spostamento di molecole diverse da quelle dei trasmettitori dall'interno di un neurone all'interno di un altro serva a trasmettere l'informazione.
Riassumendo, certi codici nervosi rispondono ai criteri elencati qui sopra; altri, ancora in studio, sembrano rispondere anch'essi ai suddetti criteri. Altri ancora, che possono essere impressi artificialmente agli elementi nervosi o ricavati dall'attività nervosa con metodi statistici, è probabile che non abbiano importanza in condizioni naturali. Non si sa praticamente nulla su come i messaggi nervosi, codificati sia da neuroni singoli, sia da un insieme di neuroni, siano interpretati dai neuroni che li ricevono.
6. Analisi della somatoestesia attraverso lo studio delle fibre nervose afferenti.
a) Specificità di modalità delle fibre periferiche.
Si deve a Blix (v., 1884) la scoperta che le aree della pelle possiedono sensibilità differenziali alle quattro qualità elementari della sensibilità cutanea, così che si può parlare di piccole aree del tatto, del caldo, del freddo e del dolore, ognuna delle quali riceve le terminazioni di diverse fibre afferenti; ogni fibra può innervare molte di queste aree. Indipendentemente da come una di queste zone è stimolata, fintantoché l'eccitazione è localizzata a essa, dà origine a una sola esperienza sensitiva.
Le variazioni di questa esperienza possono essere determinate dal cambiamento dell'ordine temporale degli stimoli, per esempio aumentando la frequenza si passa dal tatto al flutter. Le variazioni temporali o di intensità dello stimolo locale non cambiano la qualità primaria della sensazione prodotta, cioè la sensazione di tatto non si trasforma in quella di calore, né quella di freddo in quella di tatto, ecc. Queste osservazioni concordano con la supposizione che le diverse fibre di primo ordine che innervano una singola area siano dello stesso tipo altamente specifico e che la sensazione prodotta da impulsi afferenti in una data classe di fibre sia identica comunque esse siano eccitate. Vi sono oggi prove, ottenute con metodi elettrofisiologici, che costituiscono un valido sostegno del concetto della specificità di azione delle fibre nervose sensitive.
Prove convincenti sono state fornite anche da esperimenti su soggetti umani nei quali si è stabilito un blocco differenziale delle fibre di diversa grandezza. Nei nervi periferici le fibre di diametro diverso non sono presenti in uguale numero; la distribuzione delle grandezze presenti in un nervo sensitivo umano è illustrata nella fig. 8. Nella figura non si vede, invece, che i nervi cutanei contengono un grande numero di fibre amieliniche (le fibre C), l'85-9o% delle quali sono afferenze delle radici dorsali. Un anestetico locale, infiltrato attorno a un nervo, blocca per prime queste fibre C, e poi le fibre A in ordine ascendente di grandezza, come si dimostra stimolando elettricamente da un lato del blocco e registrando dal lato opposto del blocco stesso. Quando le fibre C non conducono più, non si provoca più il dolore urente o secondario. Via via che il blocco raggiunge le fibre A più piccole, quelle del gruppo delta, vengono meno le sensazioni di dolore puntorio, di caldo e di freddo, ma restano quelle di tatto-pressione, vibrazione e sensibilità di posizione. Questi aspetti della meccanorecezione rimangono finché non sono anestetizzate le fibre mieliniche di più largo diametro (v. Lewis, 1942; v. Lewis e altri, 1931; v. Landau e Bishop, 1958). Il blocco di un nervo per asfissia interrompe le fibre A e le fibre C approssimativamente in direzione opposta, con un inversione dell'ordine in cui sono perdute le modalità sensitive nell'area della cute innervata dal nervo bloccato.
I primi studi degli effetti del blocco differenziale dei nervi periferici sulle capacità sensitive hanno fornito prove a favore dell'asserzione che le fibre nervose periferiche possiedono una specificità differente riguardo alla modalità, e dell'esistenza di una correlazione tra il diametro delle fibre nervose afferenti di primo ordine e le sensazioni che esse mediano. Nell'ultimo decennio questa teoria è stata oggetto di numerose ricerche, mediante lo studio elettrofisiologico delle proprietà di risposta di un gran numero di fibre di primo ordine, in una grande varietà di condizioni di stimolazione. Il risultato è che non ci sono più dubbi riguardo alla specificità delle fibre afferenti meccanocettive di tipo beta. Gruppi separati e di sensibilità diversa presiedono al tatto-pressione e ai suoi derivati, come la sensibilità vibratoria. Un gruppo completamente diverso provvede al senso di posizione e movimento degli arti. Dolore puntorio e senso del freddo sono dovuti a fibre con velocità di conduzione delta, e il dolore urente e il caldo alle fibre C e/o alle più piccole fibre delta (forse per il caldo). Nei mammiferi dotati di pelliccia altri gruppi di fibre delta e fibre C sono sensibili in maniera diversa a deboli stimoli meccanici, e si può quindi pensare che in questi animali presiedano ad alcuni aspetti della sensibilità da contatto. È incerto se queste fibre esistano nei Primati, ma non sono state riscontrate tra le molte fibre che innervano la pelle glabra della mano finora prese in esame.
È perciò sempre più evidente che la qualità specifica delle diverse sensazioni elementari che originano dai tessuti del corpo è dovuta all'azione di gruppi di fibre nervose le cui terminazioni periferiche differiscono sia per la sensibilità a stimoli di qualità diversa, sia per le connessioni centrali. Questi gruppi formano nella pelle un mosaico sovrapposto di terminazioni nervose con distribuzione comune, e funzionano come filtri diversi, ognuno dei quali segnala una particolare qualità di stimolo quando è eccitato isolatamente, il che avviene di rado, o contribuisce a sensazioni complesse quando è attivato insieme ad altri.
Questa generalizzazione ha sollevato dubbi quando si è visto che afferenze meccanocettrici di tipo beta ad adattamento lento, estremamente sensibili a stimoli meccanici, stentano a rispondere anche a un forte raffreddamento prodotto nei loro campi recettivi cutanei. Tuttavia recentemente è stato osservato che queste fibre sono almeno 20 volte meno sensibili al raffreddamento delle vere afferenze termocettrici, e non possono fornire quelle informazioni riguardanti lo stimolo del freddo comunicate dall'osservatore (v. Darian-Smith e altri, 1973). Questa ‛differenza di sensibilità' è l'essenza del concetto di specificità.
b) Morfologia delle terminazioni nervose e delle strutture annesse, in relazione alla sensazione.
La specificità della modalità delle fibre nervose mieliniche afferenti pone la questione se questa dipenda dalle proprietà speciali delle terminazioni nervose stesse oppure dalle strutture non nervose, ma specializzate, che in molte zone le incapsulano. Nel passato sono stati identificati numerosi organi terminali di fibre mieliniche afferenti, ritenuti completamente diversi; ognuno di essi è stato ritenuto responsabile di una modalità specifica. Adesso è chiaro che alcune note terminazioni come il follicolo del pelo, i corpuscoli del Meissner, i dischi di Merkel, le terminazioni del Ruffini del tessuto connettivo profondo e delle capsule articolari e i corpuscoli del Pacini sono connesse ad afferenze mieliniche meccanocettive, e che contribuiscono al processo di trasduzione meccanica determinando la risposta dinamica caratteristica di queste fibre, ma non la specificità qualitativa (v. recettori).
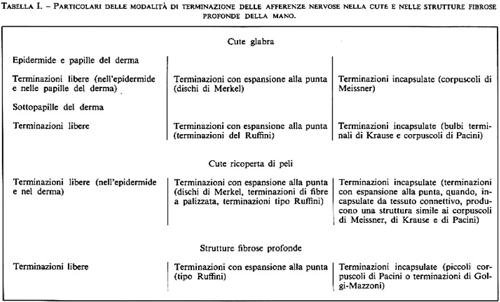
Nella cute e nei tessuti connettivi sottocutanei e profondi si trovano tre terminazioni sostanzialmente simili tra loro; varia, invece, da punto a punto la dettagliata morfologia degli organi terminali che formano la capsula (v. Miller e altri, 1960). Alcuni dettagli sul modo in cui queste afferenze terminano nella cute glabra della mano sono illustrati nella fig. 9 (v. anche tab. I). La forma, il numero e la distribuzione delle fibre mieliniche dotate di terminazioni incapsulate non sono state determinate precisamente, perché esse variano con l'età e la regione della superficie del corpo; per esempio, i corpuscoli di Meissner della cute glabra sono più rari alla nascita che nella fanciullezza, più abbondanti nelle mani che nei piedi, e diminuiscono di numero con l'avanzare degli anni. Si trovano anche molti organi terminali con forme atipiche e di transizione.
7. Componenti pretalamiche del sistema somatico afferente.
a) Sistema lemniscale.
La caratteristica più notevole del sistema lemniscale è quella di trasmettere con grande fedeltà a ogni stazione sinaptica, almeno al primo stadio di attivazione corticale, l'informazione sulla localizzazione, forma, qualità e sequenza temporale degli stimoli che raggiungono il corpo. Questa fedeltà è in parte dovuta al fatto che l'area di distribuzione periferica dei recettori è rappresentata centralmente in uno schema preciso e dettagliato che è mantenuto in stadi successivi, e ogni schema contiene le numerose modalità meccanocettive. Per essere definita come ‛neurone lemniscale' una cellula deve far parte di un sistema che presiede a un campo recettivo ristretto e controlaterale, essere attivata da un solo tipo di afferenze meccanocettive di primo ordine e possedere, grazie alle proprie connessioni sinaptiche, potenti capacità di trasmissione nel dominio temporale.
1. Sistema dorsale ascendente del midollo spinale e nuclei della colonna dorsale (NCD). - Il sistema più esteso è quello della colonna dorsale, composto dai tronchi di assoni ascendenti delle fibre mieliniche della radice posteriore aventi diametro superiore a 4-5 micron. Subito a monte dell'entrata di ogni radice posteriore, la colonna dorsale contiene una copia della composizione di grosse fibre della radice, ivi compresi i tipi di modalità indicati nella tab. II. Le fibre provenienti da ogni radice successiva sono stratificate nella successione indicata nella fig. 10. Lo studio dei campi recettivi e dei tipi di modalità delle fibre delle CD subito dopo l'ingresso nei NCD rivela che nel loro decorso ascendente dal livello di entrata della radice posteriore avviene un rimescolamento delle fibre che riguarda sia la topografia sia la modalità (v. Werner e Whitsel, 1967; v. Whitsel e altri, Modality representation..., 1969 e 1970). Questo assortimento è tale che le fibre di primo ordine della medesima radice posteriore, che hanno campi recettivi periferici contigui, sono esse stesse contigue al livello più alto della colonna dorsale. Le fibre che entrano separate e distanziate nelle radici posteriori non sono contigue nemmeno centralmente, anche se può accadere che siano contigui i loro campi recettivi periferici. La mappa centrale, anche se non è proprio completa topologicamente, mantiene il maggior numero di relazioni periferiche di vicinanza. Questa rappresentazione della forma del corpo, che si stabilisce a livello dell'entrata dei NCD, è mantenuta nelle successive repliche centrali nei NCD e nel talamo dorsale.
Quasi tutte le fibre della colonna dorsale che raggiungono i NCD sono afferenze cutanee ad adattamento rapido. Le fibre che innervano i tessuti profondi, come pure le afferenze cutanee ad adattamento lento, abbandonano le colonne dorsali dopo un breve tragitto ascendente per avere contatto sinaptico con cellule di secondo ordine, i cui assoni si ritiene proiettino verso l'alto nelle colonne dorsolaterali. Tuttavia molte di queste cellule riproiettano ai NCD insieme alle fibre della colonna dorsale stessa; infatti, studi sui NCD mostrano che a questo livello si ritrova lo spettro di modalità presente all'ingresso della radice posteriore, almeno per le modalità meccanocettive. Entro ogni lamina segmentale di cellule dei NCD, in direzione caudo-rostrale, c'è un cambiamento dalle modalità cutanee meccanocettive, situate posterodorsalmente, a quelle attivate dalla stimolazione dei tessuti profondi (per esempio rotazione di un'articolazione), che sono anteroventrali. Un'importante caratteristica delle relazioni sinaptiche nei NCD, presente pure ai livelli più elevati del sistema lemniscale, è quella che la specificità di modalità è ugualmente precisa per i neuroni centrali e per quelli periferici. Ciò implica che ogni cellula dei NCD, e anche a livelli più alti, riceve l'input presinaptico soltanto dalle fibre di primo ordine dello stesso tipo di modalità o, a livelli più elevati, da una popolazione presinaptica ugualmente uniforme situata al più vicino livello inferiore.
Gli assoni efferenti delle cellule dei NCD si incrociano nella decussazione del lemnisco mediale e proiettano nel complesso nucleare ventrale posteriore del talamo dorsale. L'incrociamento di tali assoni determina un'inversione della forma del corpo e questa, con la successiva applicazione mediale di elementi secondari ascendenti trigeminali, costituisce la riproduzione della forma totale del corpo rappresentata a livello talamico.
2. Organizzazione sinaptica nei NCD. - È questa un'organizzazione complessa, perche' nei NCD avvengono interazioni tra afferenze primarie (degli stessi tipi di modalità) e anche fra quest'ultime e i sistemi discendenti che originano nel proencefalo. I neuroni della porzione caudale dei NCD possiedono un'arborizzazione dendritica folta e a distribuzione concentrica, tipica dei neuroni sensitivi di relé (v. Kuypers e Tuerk, 1964), e sono organizzati in piccoli grappoli, ognuno dei quali riceve le sue afferenze da una o al massimo alcune fibre dei NCD, con terminazioni assodendritiche. I NCD sono attivati monosinapticamente dalla periferia, ricevono soltanto influenze diffuse e dirette attraverso i sistemi corticobulbari, e proiettano i loro assoni nel lemnisco mediale. Ventralmente, nella porzione cefalica dei NCD, queste cellule ‛a grappolo' sono rimpiazzate gradualmente da neuroni con ampie arborizzazioni dendritiche di tipo reticolare. Questi sottendono ampi campi recettivi periferici, sono attivati dalla periferia polisinapticamente, e ricevono una potente proiezione corticobulbare. Alcuni di questi neuroni inviano i loro assoni al lemnisco mediale, e sono quindi cellule di relé, altri invece proiettano su altre cellule dei NCD, e sono quindi implicate nelle operazioni interneuronali all'interno del nucleo (v. Andersen e altri, Identification of.., 1964).
3. Sistema cervicale laterale. - È una delle componenti delle colonne dorsolaterali, attivata da afferenze cutanee, che proietta al proencefalo attraverso il nucleo cervicale laterale e il lemnisco mediale. È bene sviluppato nei Carnivori, ed è stato studiato abbastanza estensivamente (v. Andersen e altri, 1966); se presente, è comunque rudimentale nell'uomo (v. Truex e altri, 1970).
b) Sistema anterolaterale.
La seconda fra le più importanti componenti ascendenti del sistema afferente somatico è costituita dal sistema anterolaterale. Questo sistema non è uniforme, perché contiene elementi destinati alla formazione reticolare pontobulbare, ai nuclei intralaminari del talamo dorsale, filogeneticamente più antichi, e al complesso nucleare ventrobasale; quest'ultimo riceve il tratto neospinotalamico, filogeneticamente il più recente sviluppo del sistema anterolaterale, e quello la cui grandezza relativa aumenta in modo così rilevante nella serie dei Primati. Una descrizione dettagliata del sistema anterolaterale si trova nella sezione dedicata ai meccanismi nervosi del dolore, nei quali esso giuoca un ruolo essenziale (v. cap. 12).
c) Sistema trigeminale.
La parte corrispondente al lemnisco mediale del sistema trigeminale comprende il nucleo sensitivo principale e il nucleus oralis, anche se quest'ultimo differisce dal lemnisco mediale, perché proietta alla formazione reticolare. Il nucleur caudalis, d'altra parte, rassomiglia al sistema anterolaterale per ciò che riguarda la citoarchitettura e le connessioni ascendenti. La faccia, ipsilateralmente, è rappresentata completamente in ambedue le componenti del sistema trigeminale. Come nei NCD, questa disposizione centrale dà un'immagine in certo qual modo distorta della forma periferica del corpo, a causa della densa innervazione periferica delle aree peri- e intraorali. Ogni singolo punto situato ipsilateralmente nella faccia o all'interno della bocca è rappresentato centralmente da una colonna di cellule che si estendono per tutta la lunghezza del complesso trigeminale con una distribuzione diversa per modalità all'interno della colonna.
8. Meccanismi somatosensitivi del talamo e della corteccia cerebrale.
a) Relé lemniscali del talamo e proprietà statiche dei neuroni ventrobasali.
La massa ventrale del talamo riceve in sequenza anteroposteriore la proiezione dentatotalamica dal cervelletto, il lemnisco mediale e il tratto neospinotalamico. Questi ultimi due si combinano con le proiezioni trigeminotalamiche per terminare in una regione con proprietà citoarchitettoniche e funzionali caratteristiche, il complesso ventrobasale (v. Mountcastle e Henneman, 1952). Le principali caratteristiche di questa regione sono 3: una rappresentazione topografica dettagliata della forma del corpo controlaterale, le proprietà statiche altamente specifiche riguardo a localizzazione e modalità dei suoi neuroni, e la notevole fedeltà di trasmissione sinaptica fra le fibre in arrivo e le cellule talamocorticali (v. Poggio e Mountcastle, 1963). Inoltre, essa riceve una grossa proiezione corticotalamica.
Per la scimmia lo schema di rappresentazione topografica è illustrato nella fig. 11, ma anche nell'uomo è stata osservata una disposizione simile. Il modello di rappresentazione è stabilito all'entrata dei NCD per effetto della localizzazione che avviene nelle colonne dorsali, e riflette la densità di innervazione periferica più che la geometria del corpo.
I neuroni ventrobasali (VB) sono altamente specifici per localizzazione e modalità. Sono attivati da stimoli meccanici applicati all'interno di campi recettivi controlaterali, discreti e continui, e rispondono preferenzialmente a stimoli di una sola qualità. La classificazione delle fibre di primo ordine data nella tab. Il è valida in uguale misura per i NCD, per i VB e per i neuroni postcentrali, il che implica un legame preferenziale tra elementi di ciascun tipo di modalità, a ogni livello. Non sappiamo quali fattori operano nel corso dell'ontogenesi per produrre questo ordinamento preciso di collegamenti nei sistemi sensitivi specifici.
All'interno dell'organizzazione topografica vi è una distribuzione differenziale di neuroni di differenti classi di modalità. I neuroni cutanei sono concentrati posteriormente, quelli attivati dalle fasce profonde, dal periostio e dalle afferenze articolari sono spostati anteriormente. Ancora più anteriormente, chiaramente davanti al complesso ventrobasale e quindi all'interno del nucleus ventralis lateralis, esiste una zona che si pensa sia collegata con l'attività che origina nelle fibre di bassa soglia dei nervi muscolari. Questa distribuzione diversificata diventa più marcata passando dal gatto alla scimmia e all'uomo.
Recentemente è divenuto possibile effettuare degli studi sul talamo umano grazie alla combinazione di registrazione con microelettrodi, procedure stereotassiche e anestesia locale. Questi interventi hanno lo scopo di individuare con metodo elettrofisiologico, e poi distruggere, piccole aree della massa talamica ventrolaterale; queste lesioni riducono sia il tremore sia la rigidità di alcuni pazienti affetti da morbo di Parkinson, o da altri disturbi del controllo motorio (v. Bertrand e altri, 1969; v. Hassler, 1966; v. Jasper e Bertrand, 1966). Studi degli autori sopra citati hanno reso possibile fornire le descrizioni che seguono; è stata usata la terminologia di Hassler per i nuclei talamici dell'uomo, procedendo dalle zone caudali verso quelle orali. Il nucleus ventralis caudalis riceve afferenze cutanee meccanocettrici e i suoi neuroni sottendono piccoli campi recettivi controlaterali che, insieme, compongono una rappresentazione topografica precisa della superficie controlaterale del corpo. Il nucleus ventralis intermedius, che è il successivo procedendo anteriormente, contiene cellule attivate dalla rotazione passiva sulle articolazioni degli arti controlaterali. Pertanto, questi due nuclei sono gli analoghi del complesso ventrobasale della scimmia. Il nucleus ventralis oralis posterior, il successivo anteriormente, riceve il sistema dentatotalamico e proietta alla corteccia motoria. Lesioni di questa zona sono talvolta efficaci nell'alleviare il tremore della malattia di Parkinson. Infine il nucleus ventralis oralis anterior che riceve il sistema pallidotalamico, una delle maggiori efferenze dei gangli della base, invia proiezioni all'area 6 di Brodmann. Piccole lesioni di questa zona possono diminuire l'ipertonia della malattia di Parkinson.
b) Aree talamiche attivate dal sistema anterolaterale e proprietà funzionali dei neuroni anterolaterali.
I sistemi spinobulbare e paleospinotalamico trasportano l'informazione somatica afferente alla reticolare ascendente e ai sistemi talamocorticali diffusi, e quindi hanno una funzione importante nella regolazione dei livelli di eccitabilità del proencefalo e dello stato di coscienza. Insieme al tratto neospinotalamico hanno importanza preminente per le sensibilità termica e dolorifica, e saranno discussi in dettaglio da questo punto di vista in un capitolo successivo (v. cap. 12, È a).
Sembra ora opportuno spendere qualche altra parola sul tratto neospinotalamico che, specialmente nei Primati e nell'uomo, presiede a una forma di meccanorecezione e inoltre contiene elementi che trasmettono il dolore puntorio. La sua proiezione sul complesso ventrobasale è in linea con l'organizzazione topografica del lemnisco mediale, ma si sa poco di questa proiezione, specie per quello che riguarda il grado di specificità di modalità, la capacità dinamica di trasmissione e se gli elementi spinotalamici e lemniscali convergano su neuroni ventrobasali identici. È noto che una forma grossolana di sensibilità tatto-pressoria rimane anche dopo sezione dei sistemi dorsali del midollo spinale, il che indica che almeno alcuni degli elementi del sistema neospinotalamico hanno una funzione meccanocettiva.
In conclusione, le proiezioni del sistema lemniscale e di quello anterolaterale sul talamo differiscono in maniera notevole. Il primo è organizzato in un sistema a larghe fibre a rapida trasmissione, e possiede quelle proprietà funzionali necessarie per gli aspetti discriminativi della sensibilità somatica: identificazione di luogo, contorno e qualità degli stimoli meccanici, percezione della posizione e del movimento degli arti, risoluzione dell'ordine seriale, ecc. Il sistema anterolaterale presiede a una varietà di funzioni più generali. La sua proiezione filogeneticamente più antica serve come funzione attivante non elaborativa, mettendo in azione il sistema talamico a proiezione diffusa. Il suo sviluppo più recente, il tratto neospinotalamico, proietta sul complesso talamico ventrobasale e manifesta rudimentali proprietà lemniscali. L'importanza di questi sistemi anterolaterali nella sensibilità dolorifica verrà discussa in seguito.
c) Aree somatosensitive della corteccia cerebrale.
1. Area somatosensitiva I, il giro postcentrale. - Le lesioni del giro postcentrale, area somatosensitiva I (S I), producono deficit della sensibilità somatica nell'uomo e in altri primati, e la stimolazione elettrica di questa regione della corteccia evoca sensazioni riferite ad aree localizzate del lato controlaterale del corpo. In realtà, la stimolazione elettrica della corteccia paracentrale, unita all'osservazione dei movimenti indotti e delle sensazioni evocate in pazienti sottoposti ad anestesia locale, risulta di grande valore per individuare le localizzazioni nelle operazioni neurochirugiche (v. Penfield e Jasper, 1954). È stato in tal modo possibile ottenere mappe generali della rappresentazione del corpo nel giro postcentrale. Queste mappe sono frequentemente rappresentate da figurine riproducenti la forma del corpo. In alcuni casi è possibile evocare sensazioni somatiche con la stimolazione elettrica di molte altre aree corticali, ma è proprio con la stimolazione dell'area postcentrale che tali sensazioni vengono evocate con maggiore regolarità e minore intensità di stimolo, possono essere sistematicamente riferite a zone controlaterali localizzate e, quando sono combinate in un ordine spaziale, rivelano uno schema topografico regolare. Tale schema generale è stato confermato e precisato più in dettaglio con l'applicazione nell'uomo del metodo dei potenziali evocati.
I diagrammi della fig. 12 mostrano le rappresentazioni motorie e sensitive nelle aree corticali cerebrali del ratto, del coniglio, del gatto e della scimmia (v. sistema piramidale: Fisiologia del sistema piramidale). Questi diagrammi sono stati ottenuti con il metodo della stimolazione elettrica della corteccia motoria e con il metodo dei potenziali evocati per le aree sensitive (v. Woolsey, 1958). Questi metodi non rivelano i dettagli di rappresentazione descritti più sotto, ma mostrano lo schema generale della rappresentazione delle varie parti del corpo nelle aree somatosensitive.
I fini dettagli del piano di rappresentazione delle varie parti del corpo nel giro postcentrale della scimmia sono stati studiati accuratamente registrando, tramite microelettrodi, l'attività elettrica di singoli neuroni corticali (v. Werner e Whitsel, 1973; v. Mountcastle e Powell, Central nervous..., e Neural mechanisms..., 1959; v. Powell e Mountcastle, 1959). In questi esperimenti si penetra con il microelettrodo ripetutamente attraverso la corteccia in punti uno vicino all'altro e si identifica il campo recettivo di ciascun neurone incontrato e la modalità a cui risponde. La rappresentazione indicata dai diagrammi della fig. 12 è stata confermata per quanto riguarda la relazione generale fra le varie parti del corpo. Tuttavia, gli studi recenti di Merzenich e Kaas (v. Merzenich e altri, 1978; v. Paul e altri, 1972; v. Sur e altri, 1978), eseguiti su scimmie e su scimmie antropomorfe, hanno rivelato un principio della rappresentazione finora del tutto ignoto. Vi è cioè una rappresentazione completa del corpo in ciascuna delle tre zone citoarchitettoniche dell'area somatica postcentrale, le aree 3-b, 1 e 2 secondo la classificazione di Brodmann, e alcuni dati suggeriscono l'esistenza di una quarta rappresentazione separata nell'area di transizione 3-a, anche se questa rappresentazione potrebbe essere un'estensione di quella della corteccia motoria precentrale. Gli schemi di rappresentazione nelle aree 3-b e 1 di una scimmia antropomorfa, Macaca fascicularis, sono mostrati nella fig. 13. Le rappresentazioni nelle aree 3-b e 1 , come quella nell'area 2 (non illustrata nella figura), sono organizzate in forma parallela, con i piedi e la coda rappresentati medialmente e la faccia lateralmente. Le parti centrali del corpo sono rappresentate ai confini fra le aree, mentre le rappresentazioni di parti più distali sono immagini grosso modo speculari le une delle altre.
Ciò che non è illustrato nella fig. 13, ma descritto più sotto, è il fatto che le diverse sottomodalità della sensibilità somatica sono rappresentate differenzialmente in ciascuno di questi campi citoarchitettonici. La conclusione generale di grande importanza, che si può trarre da questi esperimenti recenti, è che le x e y che definiscono i parametri per le unità maggiori di analisi del giro postcentrale sono disposte lungo l'asse mediolaterale, mentre la modalità è rappresentata lungo l'asse anteroposteriore.
Ciascuno dei neuroni lemniscali, dal livello delle fibre di primo ordine alle cellule postcentrali, è attivato preferenzialmente da un tipo particolare di stimolazione meccanica dei tessuti periferici. Le classi di modalità delle cellule postcentrali sono le stesse di quelle delle fibre mieliniche di primo ordine. Queste classi sono distribuite in maniera differenziale nel giro postcentrale quasi tutti i neuroni della zona più posteriore, l'area 2, sono attivati dalla rotazione di articolazioni o dalla stimolazione meccanica del periostio o delle fasce connettivali, mentre la maggioranza dei neuroni dell'area 3-b è collegata ad afferenze cutanee a lento adattamento, e la maggioranza di quelli dell'area 1 ad afferenze cutanee a rapido adattamento (v. Paul e altri, 1972; v. Powell e Mountcastle, 1959; v. Whitsel e Dreyer, 1976; v. Whitsel e altri, 1971). I neuroni dell'area 3-a, una regione che viene considerata come un'area di transizione fra la corteccia motoria e quella sensitiva o come una parte dell'area motoria (v. Jones e altri, 1978), sono attivati da afferenze in rapporto con lo stiramento dei muscoli (v. Lucier e altri, 1975; v. Phillips e altri, 1971).
2. Organizzazione colonnare della corteccia somatosensitiva. - Attualmente è ben accertato che l'unità funzionale fondamentale della neocorteccia è un gruppo di cellule organizzato verticalmente, esteso a tutti gli strati cellulari e avente ricche interconnessioni nella direzione verticale, ma scarse in quella orizzontale (v. fig. 14; v. Mountcastle, 1957 e 1978; v. Powell e Mountcastle, 1959). Questa unità è capace di complesse operazioni di input-output, indipendentemente dall'ampia propagazione tangenziale dell'attività nervosa nella sostanza grigia. I parametri che identificano tali unità di analisi nell'area somatica I sono quelli statici della posizione e della modalità, come è stato descritto precedentemente. Queste variabili sono determinate congruamente dalle proiezioni trans-sinaptiche segregate alla corteccia cerebrale di attività di piccoli gruppi di fibre nervose di senso di primo ordine caratterizzati da campi recettivi strettamente sovrapposti e dalla comune capacità di trasduzione sensitiva, cioè dalla modalità. Vi sono dati preliminari a favore del fatto che anche gli aspetti più dinamici dell'analisi intracorticale siano organizzati in maniera colonnare. Pertanto la corteccia somatosensitiva illustra una delle caratteristiche salienti del tipo colonnare di organizzazione, che permette di mappare - di rappresentare - un certo numero di variabili nella matrice bidimensionale della corteccia cerebrale, mantenendo una topologia ordinata.
L'organizzazione colonnare per la posizione e la modalità è stata osservata in ciascuna delle ripartizioni citoarchitettoniche dell'area S I in un gran numero di specie animali e in numerose condizioni sperimentali, come per esempio nella scimmia sveglia e libera di muoversi. Essa è stata osservata anche nell'area somatica seconda (S II).
3. Area somatosensitiva II (S II). - Il sistema somatico è rappresentato in una seconda area corticale che nei Primati è situata sul bordo superiore della scissura silviana. Una caratteristica tipica dell'area S Il è che in essa sono mappate sia la metà controlaterale sia quella ipsilaterale del corpo, in un'unica immagine sovrapposta della superficie corporea. Il campo recettivo di ogni neurone di S II consiste di coppie di aree della superficie corporea simmetriche e corrispondenti, separate nel caso che occupino gli apici degli arti (v. Whitsel e altri, Symmetry and..., 1969). In S II esiste una precisa organizzazione colonnare come in S I, ma per il resto le differenze sono notevoli. In S Il nessun neurone è attivato dalla rotazione articolare; i neuroni di S II appaiono invece particolarmente sensibili alla direzione del movimento dello stimolo. Per questa ragione Whitsel e altri (v., Symmetry and..., 1969) hanno suggerito che i neuroni di S II potrebbero ‟svolgere funzioni logiche per le categorie di stimolazione, della direzione del moto dello stimolo e della lateralità del corpo". Questa ipotesi si riallaccia alle modalità meccanocettive della somatoestesia; il ruolo che una parte separata di S Il potrebbe avere nel dolore sarà discusso in seguito (v. cap. 12, È c, 3).
d) Connessioni talamo- e corticocorticali nel sistema nervoso.
È chiaro che il complesso ventrobasale del talamo proietta sia su S I sia su S II, e questo spiega le proprietà lemniscali dei loro neuroni (v. Jones e Powell, Connexions of ... III, 1970). Nel gatto il gruppo nucleare posteriore proietta principalmente su S Il, ma anche su S I, dotando così di proprietà anterolaterali le cellule corticali alle quali proietta; è raro invece riscontrare proprietà di questo tipo in cellule S I di tutte le specie studiate. Nel gatto tale popolazione di cellule si trova in S II in colonne mescolate con quelle di natura lemniscale (v. Carreras e Andersson, 1963), mentre nella scimmia queste due suddivisioni di S II sono completamente separate.
Esistono proiezioni corticotalamiche esattamente reciproche: in S I esse sono molto forti verso VB e deboli verso il gruppo nucleare posteriore, e hanno comportamento inverso in S II. I dettagli di queste terminazioni sinaptiche sono importanti per il funzionamento intrinseco di questi nuclei talamici e delle aree corticali (v. Jones e Powell, Connexions of... II, 1969, e Connexions of... III, 1970). S I invia fibre interemisferiche che terminano nelle aree somatotopicamente omologhe di S I e di S II; questa proiezione origina soltanto dalle aree di rappresentazione corticale della testa, del corpo, del circolo scapolare e di quello pelvico, mentre le estremità dégli arti non hanno queste connessioni. S II proietta soltanto alla corrispondente S II controlaterale (v. Jones e Powell, Connexions of... II, 1969).
Per quello che riguarda le connessioni intraemisferiche, corticocorticali, la corteccia precentrale motoria (area 4) e quella postcentrale sensitiva (aree 3, 1 e 2) sono connesse reciprocamente. Inoltre v'è ‟una graduale progressione verso l'esterno dall'area sensitiva primaria ai lobi parietotemporale e frontale, con rapporti reciproci a ogni nuova stazione frontale e parietotemporale" (v. Jones e Powell, Connexions ..... I, 1969 e An anatomical..., 1970). In queste proiezioni successive la somatotopia è mantenuta nella prima stazione, cioè dal giro postcentrale all'area 5, ma nella successiva si ha una convergenza all'interno del sistema, dall'area 5 all'area 7. Quest'ultima, a sua volta, proietta alle aree della corteccia frontale, orbitofrontale e temporale, e in quella stazione converge con proiezioni dei sistemi visivo e uditivo elaborate in maniera simile. Dopo questa convergenza fra sistemi diversi v'è una proiezione dalle aree convergenti sulla corteccia entorinale, l'ippocampo e la corteccia limbica. Non c'è dubbio che questi dati anatomici costituiscono la base sulla quale potranno essere portati a termine esperimenti che siano allo stesso tempo comportamentali ed elettrofisiologici, con lo scopo di chiarire i meccanismi corticali della percezione.
Concludendo, si può dire che il significato della funzione somatoestetica della doppia rappresentazione corticale del sistema somatico afferente e dei sistemi pretalamici a proiezione multipla è ancora molto incerto. Il tipo di organizzazione suggerisce che il sistema lemniscale può render conto degli aspetti discriminativi della somatoestesia, presentando a livello corticale le trasformazioni nervose che segnalano le sensazioni di tatto-pressione, cinestesia e flutter-vibrazione. Nell'uomo lesioni di questo sistema producono notevoli deficit quantitativi di questi aspetti sensitivi. Il sistema anterolaterale rende conto di un aspetto più generale della meccanorecezione e del senso del dolore e della temperatura. Le sue fitte proiezioni alla formazione reticolare centrale ne indicano il ruolo preminente nel risveglio e nel controllo dell'eccitabilità del proencefalo.
Al livello corticale non è stato ancora possibile definire precisamente le funzioni di S I e S II, nè chiarire in quale misura ciascuna di esse contribuisca e come operi sinergicamente all'elaborazione corticale dell'attività afferente, il cui risultato è la percezione degli eventi somatosensitivi, con tutte le gradazioni e le sfumature di cui l'uomo è capace.
9. Meccanismi di elaborazione nervosa delle modalità meccanocettive della somatoestesia.
Negli ultimi anni i fisiologi dei sensi hanno dato una grande importanza alle misurazioni quantitative delle capacità dell'uomo e della scimmia in questa particolare sfera sensitiva. L'approccio classico della psicofisica ha avuto un grande valore euristico per la neurofisiologia; in base a esso lo sperimentatore può definire la scala dinamica sulla quale il soggetto può operare per una particolare modalità sensitiva, può determinare i limiti della soglia del rilevamento e stabilire sia le capacità discriminative per differenti livelli di intensità di stimolazione sia la relazione quantitativa tra l'intensità fisica di diversi stimoli della stessa qualità e la capacità del soggetto di valutare questi stimoli lungo le scale di grandezza sensitiva. Al di là di queste semplici misure, lo studio di aspetti più complessi della sensazione suggerisce che cosa si può ricercare a livelli più elevati dei sistemi sensitivi del sistema nervoso centrale (SNC), cioè le basi nervose del riconoscimento di modelli e di contorni, delle speciali caratteristiche del rilevamento, del contrasto figura-sfondo, della localizzazione spaziale, ecc. Le correlazioni tra le misure sensitive nell'uomo e gli eventi nervosi osservati nelle scimmie sono fatte nel presupposto che un'identità nelle prestazioni sensitive e nell'organizzazione anatomica e fisiologica periferica implichi una certa identità di meccanismi nervosi, almeno nei primi stadi di elaborazione centrale. In altri esperimenti le misurazioni psicofisiche delle prestazioni sensitive della scimmia sono state correlate con i risultati di esperimenti neurofisiologici separati. Più recentemente, lo sviluppo di nuovi metodi ha permesso l'osservazione simultanea, in scimmie sveglie e allenate in precedenza, delle prestazioni sensitive e degli eventi nervosi indotti dagli stimoli stessi che determinano la prestazione dell'animale, per esempio in un esperimento di rilevamento o di discriminazione. Forniremo quindi alcuni esempi di questo approccio ai problemi della somatoestesia.
a) Meccanismi nervosi della sensibilità tattile.
Il senso del tatto dipende dalle informazioni su posizione, intensità e forma degli stimoli meccanici applicati alla pelle. Per ciò che riguarda la forma sono necessarie informazioni anche sulla distribuzione spaziale dell'insieme delle intensità di stimolazione che compongono il contorno dello stimolo. Il rilevamento della direzione e della velocità del movimento di uno stimolo richiede un'analisi della traslazione sequenziale spaziale dei punti di attività in una popolazione nervosa, e così pure delle variazioni temporali e di intensità. Gli aspetti più fini del senso del tatto dipendono ugualmente dalla combinazione delle informazioni concernenti posizione, intensità e ordine di successione.
Le informazioni che arrivano al sistema lemniscale provengono da quei gruppi di afferenze mieliniche meccanocettrici che, per le loro proprietà funzionali, sono capaci di segnalare con precisione i parametri quantitativi degli eventi periferici. Il sistema stesso è organizzato in una serie di livelli in modo da preservare il segno locale dell'evento periferico, la sua intensità costante e i cambiamenti spaziali e temporali di tale intensità. È indubbio che molti tipi di fibre periferiche afferenti contribuiscano al senso di semplice contatto meccanico, perché sia le afferenze cutanee ad adattamento rapido e lento, sia le afferenze sottocutanee, come quelle che terminano nei corpuscoli del Pacini o innervano le fasce profonde o il periostio, hanno soglie così basse da essere eccitate da qualsiasi stimolo meccanico che non sia assolutamente insignificante. Quindi ha poca importanza separare le qualità del tatto da quelle della pressione; esse sono variazioni di intensità dello stesso senso, quello tattile.
Anche all'interno di un sistema piuttosto specifico come quello lemniscale la divergenza tra centro e periferia è tale che la capacità di localizzazione, o di discriminazione tra due punti, non può essere spiegata in termini di linee nervose dirette che collegano i due luoghi di applicazione dello stimolo periferico con due zone ben separate di attività nervosa, per esempio nel giro postcentrale. La stimolazione meccanica di un singolo punto della superficie corporea eccita l'attività corticale che, anche se mostra un picco locale, si estende a occupare, decrescendo spazialmente, una considerevole area di corteccia. La capacità di identificare due stimoli periferici come due e non uno solo, anche quando sono molto vicini fra loro, si può forse spiegare meglio in termini di sovrapposizione dei profili spaziali di attività indotta dai due stimoli a livelli nervosi successivamente più centrali. I problemi da risolvere sono pertanto: a) quali meccanismi esistono per preservare e precisare i due profili di attività; b) quali meccanismi nervosi sono in grado di leggere questi profili.
Non si sa praticamente niente di quest'ultimo meccanismo, anche se un tale strumento cerebrale di interpretazione deve pur esistere. Per quello che riguarda il primo problema, invece, il potente meccanismo che limita la diffusione spaziale di attività per divergenza esiste ed è noto: questo meccanismo è l'inibizione afferente. Il fenomeno è illustrato nella fig. 15, che mostra la distribuzione di eccitazione e inibizione centro-periferia prodotta sul neurone postcentrale della scimmia. Nei Mammiferi questa forma di ordinamento spaziale di eccitazione-inibizione è un evento nervoso centrale ed è stata osservata a ogni livello della componente lemniscale del sistema somatico afferente. La fig. 16 illustra una versione immaginaria di come si pensa che operi l'inibizione afferente nel delimitare e precisare il profilo nervoso (v. Mountcastle e Powell, Neural mechanisms..., 1959).
I meccanismi di inibizione afferente nel sistema somatico sono del tipo pre- o postsinaptico (v. sinapsi: Fisiologia della sinapsi centrale). In generale, l'inibizione avviene a ogni livello per effetto di neuroni intranucleari; nessuna delle fibre afferenti primarie o dei neuroni centrali dotati di assoni lunghi che collegano differenti livelli del sistema esercita inibizione mediante azione monosinaptica diretta. La definizione della forma per effetto dell'inibizione potrebbe avvenire con uno o con tutti e tre questi meccanismi: di potenziamento, di feedback intranucleare locale, o per attività discendente riflessa come quella che verrà descritta in seguito.
La valutazione nervosa dell'intensità dello stimolo è particolarmente importante nel caso della sensibilità tattile, per la quale i gradi di libertà sono costituiti soltanto da luogo, intensità e ordine temporale. Le afferenze mieliniche meccanocettrici ad adattamento lento, ad esempio quelle che innervano la pelle glabra della mano, sono sensibili, a differenza di quelle ad adattamento rapido, sia alla velocità di applicazione sia all'intensità dello stimolo. Si pensa che terminino alla periferia nei corpuscoli del Merkel: insieme ai neuroni centrali lemniscali, ai quali sono collegate queste fibre, ci danno ragione delle discriminazioni e delle valutazioni di intensità che un uomo può fare con le mani, come quelle illustrate nella fig. 2. Nella fig. 17 sono illustrate alcune registrazioni dell'attività di queste fibre evocata da stimoli di diversa intensità, mentre la fig. 18 mostra in forma di grafico la relazione stimolo-risposta che ne risulta.
Questa relazione è lineare; la variabilità tra le singole risposte è piccola e indipendente dal livello di risposta. Quindi, per questo gruppo di fibre afferenti la trasformazione iniziale che avviene a livello della pelle è lineare, presumendo che il codice nervoso operativo sia quello basato sulla frequenza. Le afferenze di questo tipo sono collegate esclusivamente ai gruppi di neuroni talamici e corticali, il cui studio in scimmie non anestetizzate ha dato funzioni stimolo-risposta simili. Ciò implica che la trasmissione attraverso le stazioni nucleari centrali dalla periferia alla corteccia non richiede alcuna trasformazione dei segnali di primo ordine, riguardo all'intensità: la relazione quantitativa tra stimolo periferico e attività nervosa è identica a tutti i livelli (v. Mountcastle e altri, 1966; v. Mountcastle, 1967).
È qui che intervengono i meccanismi percettivi e interpretativi cerebrali, cioè tra il giro postcentrale - la corteccia somatosensitiva primaria - e la manifestazione comportamentale eccitata da uno stimolo meccanico. Sebbene si sappia poco di questi meccanismi, tuttavia tali manifestazioni possono essere misurate, come è illustrato nella fig. 2. La correlazione dei risultati psicofisici ottenuti nell'uomo con quelli neurofisiologici ottenuti nella scimmia indica che, quali che siano le trasformazioni che si verificano tra input corticale ed evento comportamentale finale, esse sono in complesso lineari. I dati per altri tipi di afferenze, sia in questo sia in altri sistemi di senso, sono simili e ci portano alla conclusione generale che la relazione dell'uomo con l'ambiente esterno, per quanto riguarda la variabile dell'intensità dello stimolo, è stabilita dalle proprietà di trasferimento delle terminazioni periferiche delle fibre di primo ordine.
Harrington e Merzenich (v., 1970) hanno sottoposto a esame questa conclusione generale con lo studio della pelle pelosa della scimmia; essi hanno scoperto che se il punto di stimolazione viene spostato solo di pochi centimetri, dalla pelle glabra del palmo della mano a quella pelosa del polso, la funzione che nell'uomo esprime la valutazione soggettiva della grandezza dello stimolo diviene una funzione ad accelerazione negativa, descritta perfettamente da una funzione di potenza con un esponente di circa 0,5. Essi hanno, inoltre, osservato che nella scimmia le fibre ad adattamento lento che innervano la pelle dotata di peli sono molto diverse da quelle che innervano la pelle glabra, perché la relazione tra scarica e ampiezza di stimolazione è anch'essa ad accelerazione negativa, ed è descritta da una funzione simile (v. anche Werner e Mountcastle, 1965). In conclusione, nell'uomo la relazione con questi due tipi di stimoli meccanici, uno applicato alla cute glabra, l'altro a quella coperta di peli, è determinata nel primo caso dalle proprietà di risposta del tipo di fibre periferiche che rilevano lo stimolo.
b) Meccanismi nervosi del senso di posizione e della cinestesia.
L'informazione afferente nella sfera somatica svolge un ruolo importante nella percezione che l'uomo ha della posizione e dell'atteggiamento degli arti, come è stato in precedenza descritto. L'informazione sensitiva pertinente origina soprattutto nelle articolazioni, e infatti il senso di posizione è danneggiato seriamente in sua assenza. I legamenti e le capsule articolari sono innervati da afferenze mieliniche che forniscono segnali precisi sull'angolazione di un'articolazione immobile sulla velocità e sulla direzione del movimento di un arto, come è illustrato dai grafici della fig. 19, presa da un lavoro di Boyd e Roberts (v., 1953). Risultati simili sono stati ottenuti in studi delle fibre che innervano la capsula articolare del ginocchio della scimmia (v. Kidd e Oswaldo-Cruz, 1963). Le afferenze articolari entrano nella colonna dorsale da cui escono per transitare in un sistema ascendente dorsolaterale non identificato, e terminano nelle porzioni più cefaliche dei nuclei della colonna dorsale (v. Werner e Whitsel, 1973). Queste ultime sono collegate senza convergenza tra modalità diverse con i neuroni talamici e, attraverso di essi, con i neuroni corticali aventi proprietà simili (v. Mountcastle e altri, 1964; v. Mountcastle e Powell, Central nervous..., 1959). Questa serie di elementi nervosi fornisce a livello corticale una riproduzione del codice nervoso degli eventi cinestetici.
Lo studio condotto su scimmie non anestetizzate ha rivelato che i neuroni articolari talamici, similmente alle afferenze di primo ordine che proiettano su di loro, segnalano la posizione di un'articolazione con una frequenza di scarica relativamente costante, e la direzione e la velocità del movimento con variazioni transitorie della frequenza di scarica. Le funzioni appropriate per le risposte di un certo numero di neuroni articolari talamici sono illustrate nella fig. 20, ove sono presentati i risultati su scale normalizzate, per permettere una ricostruzione sintetica degli eventi nella popolazione pertinente di cellule talamiche, in seguito a movimento articolare da una posizione a un'altra, per tutta l'estensione possibile. La maggioranza delle cellule sottende angoli più ampi della metà dell'estensione totale della rotazione articolare, e tutte le curve hanno ‛un unico estremo'. Le funzioni di intensità di questi neuroni sono adeguatamente descritte da una funzione di potenza ad accelerazione negativa molto simile a quelle che descrivono la valutazione soggettiva dell'ampiezza del movimento articolare nell'uomo (v. Mountcastle e altri, 1963; v. Grigg e altri, 1972).
c) Meccanismi nervosi del senso di flutter-vibrazione.
Gli studi psicofisici del senso di flutter-vibrazione condotti nell'uomo e nei Primati sono stati riassunti nel cap. 3, È c, mentre l'identità della gamma di frequenza e della soglia di rilevamento per la scimmia e per l'uomo sono illustrate nella fig. 5. Nella figura non sono invece illustrate altre due identiche caratteristiche della prestazione sensitiva: l'uomo e la scimmia rispondono a questi stimoli con tempi di reazione virtualmente identici e hanno all'incirca la stessa capacità di discriminare la frequenza (2-3 Hz a 30 Hz). Inoltre, se l'incremento da discriminare è misurato come lunghezza del ciclo, esso è una frazione costante della lunghezza di base del ciclo per una considerevole gamma di frequenze. Questa forma derivata di meccanorecezione è di interesse generale perché la natura periodica dello stimolo e (come si vedrà in seguito) dell'attività nervosa periferica e centrale che esso evoca ci permette di studiare il codice nervoso nel dominio temporale, e così pure la gamma di frequenze dinamiche del sistema dei neuroni lemniscali che collegano la periferia alla corteccia cerebrale.
La duplicità soggettiva di questo senso è confermata da un esperimento molto semplice. L'anestesia locale della pelle glabra della mano fa salire di due o tre ordini di grandezza le soglie nella gamma di flutter di bassa frequenza, lasciando invariate quelle nella gamma di vibrazione da 80-400 Hz (v. Talbot e altri, 1968). Questo significa che la percezione della gamma completa delle frequenze degli stimoli applicati alla mano dipende da due gruppi di fibre di primo ordine, uno sintonizzato sulle basse frequenze e che termina nella pelle glabra, l'altro che termina sotto la pelle (e quindi non modificato dall'anestesia cutanea locale) sensibile in maniera selettiva a stimoli di alta frequenza. Il metodo di analisi di singole unità ha permesso un esame di tutti i singoli gruppi di fibre mieliniche che innervano la mano della scimmia e ha rivelato che rispondono a questi requisiti le fibre ad adattamento rapido che terminano nelle creste del derma (probabilmente nei corpuscoli di Meissner) e un altro gruppo che termina nei corpuscoli del Pacini. La fig. 21 mostra le registrazioni degli impulsi evocati in una fibra di ciascuno di questi due tipi da stimoli meccanici sinusoidali di appropriata frequenza. Tali studi rivelano che, aumentando poco a poco l'ampiezza di una sinusoide, v'è un punto preciso arrivati al quale la risposta è ‛in sintonia', cioè dà un impulso per ogni ciclo. Questi dati avvalorano l'ipotesi che sia la comparsa di queste scariche evocate con periodicità in un piccolo numero di fibre di primo ordine del tipo appropriato a fornire al SNC i segnali necessari al rilevamento degli stimoli oscillanti e alla discriminazione di frequenza. Le correlazioni tra i punti in sintonia per i due gruppi di fibre e le funzioni medie del rilevamento di frequenza per le scimmie, illustrate nella fig. 22, confermano questa ipotesi (v. Mountcastle e altri, 1972).
Si ritiene quindi probabile che la propagazione di questi segnali nervosi periodici codificanti la frequenza di stimolazione nel sistema somatico afferente sia un altro dei prerequisiti necessari per la prestazione sensitiva. Che questo sia vero è confermato dallo studio di cellule del giro postcentrale collegate alle fibre ad adattamento rapido della pelle glabra, effettuato sia in scimmie non anestetizzate ma paralizzate (v. Mountcastle e altri, 1969) sia in scimmie sveglie che eseguono un compito. L'analisi presentata nella fig. 23 dimostra che queste cellule rispondono replicando la frequenza di stimolazione: i segnali evocati in questo tipo di neuroni sono invece illustrati nella fig. 24. Tuttavia, lo studio dei neuroni corticali collegati con le afferenze di primo ordine del Pacini ha rivelato che per il sistema ad alta frequenza vi deve essere un cambiamento di codice tra la periferia e la corteccia, perché queste cellule aumentano la frequenza totale di scarica quando sono stimolate ad alta frequenza, ma non riproducono, nel comportamento temporale di scarica, la frequenza dello stimolo.
Le costanti di tempo dei neuroni centrali di collegamento pongono un limite superiore di 100-150 Hz alla capacità del sistema di trasporto della frequenza. Il codice per la vibrazione ad alta frequenza a livello corticale è quindi quello del limite definito. L'ipotesi della periodicità è quindi valida per il sistema a bassa frequenza responsabile del senso di flutter, che si può ritenere un derivato temporale del senso del tatto.
Recentemente è stata sottoposta a indagine la capacità delle scimmie a rilevare stimoli meccanici sinusoidali di bassa frequenza e a discriminare fra due di queste frequenze (per esempio fra 30 e 33 Hz) dopo ablazione completa del giro postcentrale. Questi animali mantenevano la capacità di rilevare gli stimoli sopra detti, anche se con soglie un pochino più elevate. I grafici della fig. 25 indicano, tuttavia, che esse avevano perduto completamente la capacità di discriminare la frequenza. Questo risultato fornisce qualche indicazione sul ruolo essenziale dei meccanismi di elaborazione nervosa della corteccia cerebrale nella sensazione: essi sono essenziali ogniqualvolta il compito sensitivo richieda elaborazione dell'informazione concernente gli aspetti quantitativi e temporali o spazialmente dinamici degli stimoli sensitivi.
10. Sistemi discendenti che influenzano la trasmissione afferente nelle vie somatoestetiche.
I sistemi sensitivi contengono elementi discendenti: i neuroni corticifughi che terminano, direttamente o dopo qualche sinapsi, nelle stazioni sottocorticali delle vie sensitive. È stata spesso prospettata l'ipotesi che questi sistemi discendenti intervengano nell'attenzione selettiva rivolta a un'entrata sensitiva a esclusione di altre; sembra più probabile, tuttavia, che ciò avvenga soprattutto nella corteccia cerebrale, dove la rappresentazione primaria degli eventi periferici è continuamente presente nel primo stadio di elaborazione corticale e disponibile a volontà all'ispezione. D'altra parte, i sistemi discendenti probabilmente contribuiscono a dar forma e direzione all'attività afferente, aggiungendo contrasto alla rappresentazione corticale. Gli elementi corticifughi del sistema somatico sono disposti in modo tale da contribuire, con feedback riflessi, a questo effetto di evidenziazione. Per la maggior parte essi raggiungono le loro terminazioni attraverso il fascio piramidale o i collegamenti corticobulbari (v. sistema piramidale: Fisiologia del sistema piramidale).
L'identificazione del significato funzionale di questi sistemi è difficile, perché possono essere attivati sperimentalmente soltanto con stimolazione elettrica all'origine. Questa permette la determinazione della direzione del loro effetto e della loro grossolana relazione topografica, ma non del modo con il quale la normale eccitazione della corteccia mette in azione i circuiti del feedback. L'effetto dominante dell'attivazione corticifuga nella trasmissione sinaptica sensitiva è l'inibizione (v. Andersen e altri, Depolarization of.., e Identification of.., 1964; v. Towe e Jabbur, 1961). Nei nuclei delle colonne dorsali questa inibizione è di tipo presinaptico e le scariche corticifughe mettono in azione molti degli interneuroni eccitati dalla stimolazione cutanea, che sembrano essere comuni alle vie presinaptiche inibitorie che presiedono sia all'inibizione corticale sia a quella presinaptica afferente osservata in questi nuclei. Questo feedback riflesso può essere sia negativo sia positivo, perché alcune cellule di collegamento dei NCD sono eccitate dalla stimolazione corticale. Indubbiamente, interazioni di simile complessità avvengono a livello talamico e spinale, ma per ora non sono state chiarite completamente.
Riassumendo, i sistemi efferenti hanno origine nelle aree motorie e sensitive della corteccia e proiettano verso il basso sulle stazioni sottocorticali dei sistemi lemniscale e anterolaterale. La proiezione avviene tramite le fibre del fascio piramidale, attraverso sistemi corticoreticolospinali, e le fibre corticotalamiche. L'azione che è stata più accuratamente studiata in questo sistema è quella esercitata sui nuclei delle colonne dorsali, dove una scarica discendente corticifuga può esercitare un effetto prevalentemente inibitorio sulla trasmissione sinaptica in avanti, nonostante che siano stati trovati anche effetti facilitatori. Benché sia possibile che questo sistema agisca come una valvola di apertura e chiusura per la facoltà di attenzione selettiva, si pensa che questo processo operi soprattutto a livello corticale. Il feedback riflesso dalla corteccia alle stazioni sensitive sottocorticali può contribuire alla formazione delle zone di scarica evocate dagli stimoli sensitivi, e quindi al contrasto spaziale.
11. Deficit somatoestetici causati da lesioni del sistema nervoso, negli animali e nell'uomo.
Lesioni del sistema lemniscale producono deficit negli aspetti discriminativi della somatoestesia. Sono perdute le capacità di localizzare esattamente, di determinare la qualità, di discriminare e di valutare stimoli di diversa intensità, di riconoscere lo schema temporale, di rilevare l'estensione spaziale e la forma, di apprezzare i movimenti e la posizione del corpo. Lesioni a più elevati livelli di elaborazione portano a disturbi complessi della consapevolezza della forma del corpo e dello spazio extrapersonale che, poiché dipendono dall'integrazione delle informazioni nelle diverse sfere sensitive, non possono più essere specificate come strettamente lemniscali o anterolaterali, e neppure esclusivamente di natura somatoestetica.
Lo studio di uomini e di animali con lesioni cerebrali presenta un certo numero di difficoltà: a) quello che si misura dopo una lesione è naturalmente molto più della capacità sensitiva: i resoconti dati dall'uomo dipendono dalla introspezione, dal ricordo e dall'espressione verbale; le informazioni fornite dall'animale dipendono dalla capacità di imparare e di rispondere con un atto motorio diretto; b) quello che si osserva in tali esperimenti sono le capacità residue della funzione sensitiva; da ogni deficit ‛si deduce' la funzione della parte lesa; c) il sistema nervoso, specialmente nei giovani, possiede una notevole capacità di compensare la perdita strutturale, con un meccanismo a noi sconosciuto; i deficit residui a lunga distanza di tempo da lesioni del SNC sono generalmente di gran lunga inferiori a quelli esistenti subito dopo la lesione.
Per tradizione veniva operata una netta distinzione fra sensazione e percezione. La prima comprendeva le esperienze ‛semplici' delle qualità sensitive primarie, e per la somatoestesia si pensava che dipendesse dalle vie sensitive primarie e che fosse elaborata nel giro postcentrale. La seconda comprendeva l'intera esperienza comportamentale di capire un oggetto nel suo insieme e si pensava dipendesse, oltre che dal giro postcentrale, da un'ulteriore integrazione ed elaborazione nervosa nelle aree parietali posteriori di associazione.
Le teorie moderne postulano un continuo, di complessità gradualmente crescente, fra sensazione e percezione. Si pensa che la percezione dipenda da un'elaborazione progressivamente più complessa dell'informazione sensitiva, dal suo confronto con le informazioni già possedute e dalla sua trasformazione in attività motoria efferente o in quel tipo di riflessione centrale soggetto ad analisi introspettiva e a descrizione pubblica.
a) Lesioni sottocorticali del sistema lemniscale.
I disturbi di conduzione delle fibre afferenti mieliniche meccanocettrici, nel loro percorso sia diretto sia intercalato da sinapsi nei sistemi dorsali del midollo, danno luogo a perdita del senso di posizione e cinestesia e a una netta diminuzione dell'accuratezza dei movimenti di proiezione degli arti nello spazio e della capacità di raggiungere e afferrare gli oggetti (v. Gilman e Denny-Brown, 1966). La discriminazione fra due punti e la sensibilità vibratoria sono notevolmente danneggiate, e così pure la discriminazione della forma. Quello che rimane è la capacità di percepire un contatto meccanico; non vi sono difetti della sensibilità dolorifica e termica, anche se possono apparire fenomeni dolorosi da ‛liberazione'.
La scoperta di traiettorie inizialmente divergenti e poi rientranti di afferenze lemniscali di differente modalità e proprietà di adattamento ci spiega perché si producano effetti tanto diversi con la sezione delle colonne dorsali (CD) effettuata a livelli segmentali diversi. Una sezione delle CD a livello cervicale medio nella scimmia, per esempio, produce tutta la sindrome descritta precedentemente nel braccio, con difetti sensitivi molto meno marcati nella gamba. Le lesioni toraciche producono tutta la gamma di deficit nella gamba solo se interessano oltre alle colonne dorsali anche quelle dorsolaterali nelle quali, a quel livello segmentale, ascendono le proiezioni che vanno verso l'alto di molti tipi di fibre di primo ordine. Sezioni trasversali delle CD a livello cervicale producono anch'esse una marcata incapacità nella sfera motoria, una ‛perdita del movimento proiettato nello spazio' (v. Gilman e Denny-Brown, 1966), che si pensa sia il risultato dell'interruzione del feedback afferente che dagli arti invia informazioni riguardanti la posizione e il movimento.
Lesioni che distruggono il nucleo ventrobasale senza altri danni sono rare; esse determinano una grave perdita della capacità discriminativa controlaterale nella sfera delle meccanorecezione, frequentemente associata alla sindrome talamica (v. cap. 12, È d, 3,1).
b) Disturbi somatoestetici da lesioni corticali.
L'ablazione dell'area S I nella scimmia produce un difetto della sensibilità di posizione che si manifesta come una mancanza di consapevolezza della posizione degli arti, che frequentemente, alla fine del movimento, vengono lasciati in posizione anomala. Le soglie del rilevamento dello stimolo tattile o vibratorio possono cambiare anche molto poco, ma v'è una profonda perdita di ogni aspetto della somatoestesia che richieda un'elaborazione nervosa quantitativa o l'identificazione di un ordine di successione. Per esempio, la normale capacità di una scimmia di discriminare tra stimoli vibratori che differiscano soltanto di 2-3 Hz, a 30 Hz, è completamente perduta, come si vede nella fig. 25 che fornisce inoltre un esempio dell'uso dei metodi psicofisici quantitativi per misurare i deficit sensitivi in animali con lesioni cerebrali (v. LaMotte e Mountcastle, 1979). Questo deficit si osserva nelle prime settimane seguenti a una lesione corticale. In seguito a un prolungato superaddestramento, alcuni animali con lesioni corticali possono recuperare la capacità della discriminazione di frequenza, ma con soglie elevate di 3-4 volte. Quali siano i fattori che determinano questa capacità di recupero in alcuni animali non è noto. Similmente v'è un danneggiamento o una perdita della discriminazione attraverso il tatto della forma, della grandezza e dell'intensità; tale capacità non viene più recuperata. Nell'uomo, lesioni corticali limitate a SI sono molto rare. In pazienti nei quali sono state operate ablazioni parziali per asportare foci epilettogeni, i difetti sensitivi che ne conseguono sono simili a quelli della scimmia (v. Corkin e altri, 1964). Ablazioni dell'area SII non producono alcuna perdita sensitiva nell'uomo o nella scimmia: la funzione di questa area nella somatoestesia rimane sconosciuta.
Le regioni dei lobi parietali e temporali, che si trovano tra le corteccie sensitive primarie, hanno a che fare con gli aspetti integrativi di ordine più elevato della sensazione e della percezione; certo, le loro connessioni fanno prevedere queste funzioni (v. Jones e Powell, An anatomical..., 1970). Lesioni delle aree 5 e 7 nella scimmia danneggiano la capacità di discriminare la forma o la grandezza (v. Moffett e altri, 1967; v. Ettlinger e Kalsbeck, 1962): aspetti più complessi, di difficile studio negli animali, sono invece ovvi nell'uomo con lesioni del lobo parietale. La sindrome comprende un'alterata percezione della forma del corpo e dello spazio immediatamente extrapersonale controlateralmente alla lesione (v. Denny-Brown e Banker, 1954; v. Hecaen e altri, 1956), e si nota inoltre rivalità percettiva e dominanza prossimale. Quando queste lesioni interessano l'emisfero dominante, il difetto di concettualizzazione dello spazio personale ed extrapersonale è unito a disturbi della formulazione e dell'uso di concetti e a confusione nel nominare gli oggetti, nel riconoscere i numeri, o nel seguire schemi topografici e piante, un insieme di disturbi che compongono le varie agnosie.
Riassumendo, i difetti somatoestetici che conseguono a lesioni corticali si manifestano a tre livelli progressivamente più complessi di organizzazione nervosa: a) lesioni del giro postcentrale producono difetti primari degli aspetti discriminativi della somatoestesia del lato controlaterale, frequentemente senza disturbi della capacità di rilevare il contatto meccanico; b) lesioni dell'uno o dell'altro lobo parietale producono un disturbo controlaterale dell'orientamento spaziale unito a deficit discriminativi e un disturbo nel concetto della forma del corpo; c) nell'uomo lesioni parietali dell'emisfero dominante producono, inoltre, disturbi agnosici.
c) Integrazione interemisferica nella somatoestesia.
Recentemente è stata studiata la funzione delle grandi commissure interemisferiche dopo la loro sezione, sia nell'uomo sia negli animali (v. Sperry, 1968; v. emisferi cerebrali: Interazioni interemisferiche cerebrali). Se scimmie o scimpanzé sono addestrati a risolvere compiti somastoestetici con una mano, l'apprendimento è immediatamente trasferito all'altra. Se le commissure sono sezionate prima dell'addestramento di uno dei due lati, il trasferimento non avviene. Se la sezione viene eseguita dopo l'addestramento di un lato, v'è una parziale conservazione della prestazione nei test postoperatori compiuti con la mano non addestrata in precedenza. Si ritiene che questo voglia dire che normalmente la ‛traccia mnesica' quando si forma si stabilisce bilateralmente, o che essa è ottenibile facilmente quando si saggia l'emisfero non allenato, ma che ogni residuo di capacità nell'emisfero non allenato è insufficiente a raggiungere il livello prefissato di prestazione quando l'esperimento viene effettuato usando la mano non allenata in precedenza. Un'ultima conclusione importante per la somatoestesia è che ogni proiezione che dalla mano o dal piede raggiunge l'emisfero ipsilaterale attraverso il sistema anterolaterale non fornisce un'informazione sufficiente nemmeno per la più semplice discriminazione sensitiva.
12. Meccanismi fisiologici del dolore.
Il dolore è un'esperienza sensitiva di facile riconoscimento provocata da stimoli di qualsiasi qualità che ledono o minacciano di distruggere le cellule dei tessuti. Un'esperienza dolorosa è composta dalla sensazione primaria e dalle reazioni a essa. Queste ultime sono una combinazione di una tonalità emotiva simile alla sofferenza e dell'attività evocata di riflesso negli effettori somatici e autonomici. Queste reazioni variano da persona a persona per grado e natura. Tuttavia, gli uomini sono in grado di dirigere la propria attenzione introspettiva sulla sensazione stessa, di descriverla accuratamente e di valutare e discriminare stimoli nocicettivi di diversa intensità. Gli studi psicofisici di questo tipo hanno aumentato le attuali cognizioni sulle sensazioni del dolore. Invece, i tentativi di quantificare le reazioni che accompagnano il dolore hanno avuto meno successo. Gli studi neurofisiologici condotti negli animali, intrapresi solo di recente, si basano sull'ipotesi che gli stimoli dolorosi per l'uomo provochino negli animali esperienze sensitive qualitativamente simili.
a) La percezione del dolore nell'uomo.
L'uomo è in grado di riconoscere tre tipi di dolore. Il primo, o dolore ‛rapido', è la sensazione netta di puntura evocata dalla punta di un ago. È ben localizzato, cessa rapidamente, si può sopportare senza reazioni marcate e dipende dall'attivazione di certe fibre delta dei nervi periferici. Il secondo è il dolore ‛urente', che ha inizio più lento, persistenza maggiore ed è accompagnato da forti reazioni. È prodotto dall'attivazione di un certo tipo di fibre amieliniche dei nervi periferici. Il terzo è il dolore viscerale o ‛profondo', che origina nelle strutture profonde e che è in genere descritto come un dolore persistente. Quest'ultimo tipo è di grande importanza per il medico, perché è comunemente prodotto da disturbi che minacciano gli organi vitali. I dolori spontanei di origine viscerale sono spesso localizzati in zone del corpo distanti dalla loro origine.
Lo stimolo adeguato per il dolore è la velocità di distruzione di un tessuto innervato da fibre dolorifiche, comprese le alterazioni che non arrivano alla rottura cellulare. Anche se il dolore è una sensazione altamente specifica, tuttavia può essere determinato da qualunque forma di energia purché abbastanza intensa da provocare, con velocità adeguata, lesione tessutale, che può essere meccanica, chimica, termica o elettrica. Il metodo della radiazione termica, fra tutti quelli usati sperimentalmente per produrre dolore, è quello che ha dato i risultati di maggior valore, specialmente nelle eleganti ricerche di Hardy e altri (v., 1952). La fig. 26 mostra la misurazione, effettuata da questi autori, della distribuzione delle soglie del dolore in un gruppo di soggetti non addestrati. Il grafico della fig. 27 mostra che la temperatura cutanea è un'importante variabile di queste misurazioni, e ci induce a concludere che la soglia del dolore puntorio prodotto termicamente è data dalla velocità di trasferimento alla cute di calore sufficiente per portare la temperatura cutanea a circa 45 °C entro un determinato periodo di tempo: infatti, il dolore compare spontaneamente alla temperatura di 44-45 °C. Questa temperatura provoca necrosi tessutale se mantenuta per un certo numero di ore. L'importanza biologica del dolore è quindi 0vvia, perché questo stimolo provoca un movimento riflesso di allontanamento e di fuga. Vi sono dati che mostrano che la soglia per la sensazione del dolore e quella per le azioni riflesse che questo provoca sono quasi identiche. La soglia per il dolore del secondo tipo o ‛urente', determinato da stimolazione termica, è leggermente inferiore a quella del dolore puntorio e presenta variazioni più ampie fra soggetto e soggetto.
Quando il dolore è determinato in queste condizioni, la soglia non presenta variazioni con l'età, il sesso, la fatica o i cambiamenti dell'umore. È modificata da condizioni locali dell'area di cute stimolata, specialmente dalle modificazioni immediatamente precedenti (si veda l'iperalgesia primaria, È c, 3). Anche in soggetti addestrati le soglie possono essere modificate dalla distrazione o dalla suggestione, dal dolore di altre parti del corpo, più drasticamente da stati psichici abnormi come l'ipnosi. Quando si possono controllare tutti questi fattori, tuttavia, la soglia per il dolore prodotto sperimentalmente mediante irradiazione termica può essere misurata con accuratezza. A ogni modo la soglia ha un valore statistico, come è illustrato nella fig. 28 che ci dà anche un esempio del fatto sconcertante che gli analgesici e i narcotici, che esercitano effetti profondi sull'esperienza globale del dolore, possono anche non produrre alcun cambiamento della soglia di percezione del dolore (v. Chapman e altri, 1965).
La comune osservazione che il dolore prodotto da uno stimolo nocicettivo continuato perdura finché gli si presta attenzione, suggerisce che non v'è adattamento né periferico nè centrale; alcune osservazioni sperimentali indicano che, durante la presenza continuata di uno stimolo nocicettivo, la soglia per il dolore può effettivamente abbassarsi, indicando così l'inizio dell'iperalgesia primaria (v. Green e Hardy, 1962). Al contrario del senso di caldo, per il dolore v'è poca sommazione spaziale. La sommazione temporale, d'altra parte, ha un ruolo importante nelle sensazioni dolorifiche. Per esempio nell'uomo cosciente una singola scarica prodotta elettricamente nelle fibre C nocicettive può anche non provocare una sensazione, mentre scariche ripetute danno luogo a un dolore insopportabile (v. Collins e altri, 1966).
La gamma di intensità che corre tra uno stimolo nocicettivo al livello di soglia e quelli che producono sensazioni massimali di dolore non è maggiore di 2 a 1; il dolore, quindi, differisce di molto da altri sensi, come la vista e l'udito. La fig. 29 mostra che la funzione che mette in relazione la valutazione soggettiva del dolore e i valori fisici degli stimoli che lo provocano è grosso modo lineare (v. Adair e altri, 1968). Le scale per il dolore stabilite in esperimenti di questo tipo non sono risultate utili per valutare l'intensità del dolore che patiscono i pazienti con malattie o con lesioni, soprattutto perché non si riesce a separare la sensazione del dolore dalle manifestazioni emotive. Per questo i medici di solito giudicano l'intensità del dolore in termini di qualità di analgesici richiesta per vincerlo, secondo la valutazione del paziente e del medico. L'azione principale degli analgesici si esercita sulla reazione al dolore.
b) Teoria del rilevamento dei segnali e dolore.
I risultati ottenuti con il metodo psicofisico dei limiti e degli stimoli costanti, usato fino a tempi recenti in studi psicofisici del dolore come quelli descritti sopra, sono piuttosto discordi, particolarmente negli studi di clinica del dolore. Molta di questa variabilità può essere attribuita a risposte viziate da parte dei soggetti, cioè alla loro tendenza a dire che sentono dolore, anziché a differenze nelle capacità sensitive. Recentemente la teoria del rilevamento dei segnali è stata usata per isolare e misurare indipendentemente due aspetti della sensibilità dolorifica (v. Clark, 1974) e cioè: 1) la ‛variabile sensitiva, d', cioè la capacità del soggetto di discriminare stimoli che differiscono lungo un continuo fisico; 2) la ‛componente psicologica, Lx', che specifica il criterio del soggetto nel riferire il dolore, cioè il punto lungo il continuo dell'intensità al di sopra del quale gli stimoli vengono definiti dolorosi e al di sotto non dolorosi. La variabile sensitiva, a differenza delle tradizionali misurazioni della soglia, rimane relativamente stabile in varie condizioni di stimolo e di comportamento. È l'intensità percepita o il livello del criterio Lx, che varia tanto fra individui stoici e individui che non lo sono affatto, ed è innalzato dal placebo, dalla suggestione, dall'ipnosi e dall'agopuntura (v. Clark e altri, 1976). Alcuni narcotici e analgesici apparentemente influenzano sia la capacità sensitiva sia il livello del criterio, altri solo quest'ultimo.
Più generalmente, gli studi utilizzanti la teoria del rilevamento dei segnali hanno permesso di descrivere esplicitamente questi due aspetti separabili delle esperienze dolorose e suggeriscono che i meccanismi nervosi responsabili di ciascuno di essi, sebbene interdipendenti e parzialmente congruenti, siano in qualche misura e a qualche livello separati. La capacità sensitiva è poco influenzata dalle reazioni affettive che frequentemente accompagnano alcuni dolori, particolarmente quelli causati da stati patologici, mentre il criterio di risposta è sensibile a queste reazioni e si modifica a seconda delle variazioni nell'esperienza soggettiva generale del dolore.
c) Meccanismi periferici del dolore.
1. Fibre nervose afferenti di primo ordine e dolore. - Diversi tipi di prove convergono nell'avvalorare la supposizione che il dolore sia dovuto a due gruppi specifici di fibre nervose periferiche che hanno una funzione nocicettiva diversa, cioè ‛specifica'. La duplice qualità del dolore cutaneo dipende dalla diversa sensibilità di queste fibre a stimoli lesivi: alcune piccole fibre mieliniche di diametro delta presiedono al dolore puntorio; altre fibre amieliniche C al dolore urente. Ne abbiamo le seguenti prove.
I. Uno stimolo nocicettivo produce prima il dolore puntorio e poi quello urente in un ordine temporale che non si inverte mai. Si può misurare l'intervallo di tempo tra i due tipi; esso aumenta con l'aumentare della distanza della conduzione periferica.
II. Esperimenti di blocco differenziale di nervi periferici nell'uomo dimostrano che ambedue i dolori permangono finché sono le fibre delta e quelle di più piccolo diametro a operare la conduzione; il dolore puntorio scompare quando sono bloccate le fibre delta, lasciando un persistente dolore urente in risposta a stimoli nocicettivi quando rimane soltanto la conduzione nelle fibre C.
III. Osservazioni dirette in uomini i cui nervi periferici erano stati esposti, sotto anestesia locale, per la stimolazione elettrica, confermano quanto affermato ai punti I e II. Quando si stimolano le fibre beta, variando frequenza e ordine temporale, si evocano solo esperienze sensitive non dolorose. Quando, con stimoli più forti, vengono indotte a condurre le scariche afferenti anche le fibre delta, si evocano acute sensazioni dolorose puntorie. Se si aumenta ancora l'intensità di stimolazione fino a comprendere le fibre amieliniche C, si manifesta un dolore urente insopportabile e con esso una forte manifestazione emotiva e un'azione riflessa (v. Collins e altri, 1960 e 1966).
IV. L'applicazione del metodo di analisi di singole unità ai nervi periferici dei Primati più vicini all'uomo ha permesso di scoprire un gran numero di fibre delta che innervano la cute, le quali sono eccitate solo da stimoli capaci di distruggere i tessuti, e producono dolore nell'uomo (v. Perl, 1968). Dati simili sono stati ottenuti per le fibre C (v. Bessou e Perl, 1969; v. Iggo, 1962).
È probabile inoltre che altre fibre, quando scaricano contemporaneamente alle fibre nocicettive, concorrano in maniera importante alla percezione globale del dolore: per esempio contribuendo alla sua localizzazione spaziale, o determinandone, almeno in parte, la speciale natura qualitativa.
2. Meccanismi periferici di trasduzione del dolore. - Non è noto come gli stimoli algogeni siano trasmessi a livello delle terminazioni periferiche delle fibre afferenti nocicettive. È possibile, ma non probabile, che le terminazioni siano attivate direttamente dagli stimoli algogeni, dando così inizio a una sequenza costituita da una modificazione di permeabilità, da una risposta locale e da impulsi nervosi propagati, a somiglianza di quanto è stato descritto sopra per le fibre afferenti meccanocettive. Vi sono dati che suggeriscono che uno stadio intermedio consista nella liberazione di una o più ‛sostanze algogene' da parte delle cellule dei tessuti lesi e/o da parte delle stesse terminazioni nervose, e che l'interazione di tale sostanza con molecole recettrici della membrana della terminazione nervosa causi l'eccitamento in maniera assai simile a quella tipica dei chemocettori, e analoga al processo d'eccitamento a livello delle sinapsi di natura chimica. I tentativi di identificare questa sostanza costituiscono una parte importante delle ricerche nel campo del dolore, dato che una tale identificazione della catena di eventi biochimici permetterebbe di preparare farmaci atti a bloccarla, arrestando così il processo del dolore al suo inizio, possibilmente senza effetti cospicui sul sistema nervoso centrale. Varie linee precedenti di ricerca suggeriscono che un processo chemocettivo sia importante per lo scatenamento del dolore (v. Lim, 1970; v. Chapman e altri, 1961).
3. Iperalgesia locale. - Subito dopo la lesione della cute appare un'intensa vasodilatazione locale, un edema con formazione di pomfo ed eritema da vasodilatazione, un insieme di dati riconosciuti per la prima volta da Lewis (v., 1942). All'interno dell'area lesa e nell'eritema circostante, una puntura di spillo produce un dolore più intenso del normale e la soglia del dolore è più bassa. Questa ‛iperalgesia primaria' si crede sia dovuta alla liberazione, da parte delle cellule lese, di sostanze che producono dolore e che abbassano le soglie delle terminazioni nervose nocicettive agli stimoli successivi. Entro poche ore si sviluppa ipersensibilità alla puntura di spillo senza abbassamento di soglia in una regione più ampia intorno all'eritema. Questa ‛iperalgesia secondaria' si pensa sia dovuta a un aumentato livello di eccitabilità dei gruppi di interneuroni delle corna posteriori, che ricevono afferenze sia dalla regione lesa sia dalla zona circostante di iperalgesia secondaria. Questo spiegherebbe l'aumentata sensibilità senza cambiamento di soglia.
Dopo la sezione di un nervo periferico, la risposta triplice è prodotta da una lesione nella zona da esso innervata finché i segmenti periferici delle fibre non degenerano. Da allora in poi una lesione locale è seguita soltanto da arrossamento locale e da edema. Il circostante eritema da vasodilatazione è quindi un ‛riflesso assonico'; gli impulsi che decorrono centralmente dalla zona di lesione sono condotti antidromicamente su altre branche delle afferenze nocicettive e invadono le terminazioni provocando modificazioni vasomotorie. Questo fenomeno è simile alla vasodilatazione prodotta da scariche antidromiche indotte con stimolazione elettrica nelle fibre C delle radici dorsali; si ritiene che il meccanismo di questi due fenomeni sia importante per capire le afferenze nocicettive di tipo chemocettivo. Foerster (v., 1927), per esempio, dimostrò che nell'uomo scariche antidromiche prodotte elettricamente nelle fibre di una radice dorsale sezionata provocano vasodilatazione e sensazione di dolore nella zona di distribuzione periferica sovrapposta di una radice dorsale adiacente. L'ipotesi che l'invasione antidromica delle terminazioni periferiche delle afferenze nocicettive liberi essa stessa o provochi la formazione, nel liquido intercellulare, di una sostanza che ha la proprietà di rilasciare la muscolatura liscia delle arteriole e di attivare le terminazioni di altre afferenze nocicettive, mentre dà una spiegazione all'osservazione di Foerster, suggerisce che l'eccitazione normale delle afferenze nocicettive dopo lesione cellulare sia della stessa natura.
4. Mediatori neuroumorali e dolore. - L'identificazione di una sostanza algogena (PPS, pain-producing substance), attivata o liberata in seguito a danno cellulare, non è stata possibile durante circa 50 anni di ricerca. Molte tossine e altre molecole naturali producono dolore quando sono iniettate nel derma. Fra queste sostanze vi sono l'istamina, gli ioni potassio, la serotonina, l'acetilcolina, l'adenosintrifosfato e i polipeptidi bradichinina e sostanza-P. Nessuna di queste o altre sostanze si è rivelata inequivocabilmente come l'unica sostanza algogena attiva in condizioni normali. Una semplice dimostrazione che una sostanza algogena sia la causa normale del dolore nei tessuti lesi fu ottenuta perfondendo lo spazio sottocutaneo di uomini e ricercando le PPS nel liquido di perfusione in varie condizioni. Quando la cute sovrastante l'area perfusa è intatta, il liquido di perfusione raccolto non è più efficace nel produrre dolore di quanto sia il cloruro di sodio in concentrazioni fisiologiche. Quando, tuttavia, la cute sovrastante la regione perfusa è lesa sino a produrre la triplice risposta (v. sopra), si trova che il liquido di perfusione contiene un polipeptide che, iniettato nel derma, causa vasodilatazione e dolore. Questo polipetide ha molte delle proprietà biologiche e biochimiche del nonapeptide bradichinina (Arg-ProPro-Gly-Phe-Ser-Pro-Phe-Arg), una delle più potenti PPS naturali. La bradichinina viene liberata nel liquido di perfusione dello spazio sottocutaneo anche durante la stimolazione del capo distale di una radice dorsale sezionata innervante la cute della regione perfusa, ed è presente nel liquido di vescicole e in altri essudati tessutali ad azione algogena. Queste osservazioni hanno portato all'ipotesi che le cellule, quando siano lese, immettano nel liquido interstiziale uno o più enzimi proteolitici, con il risultato che l'idrolisi delle proteine nel liquido interstiziale dà origine a vari polipeptidi. Fra questi è la bradichinina, che si lega a molecole recettrici nella membrana delle terminazioni afferenti delle fibre nocicettive causando in queste fibre una risposta locale e impulsi nervosi. Esperimenti più recenti hanno dimostrato che sia la bradichinina sia la serotonina, iniettate per via arteriosa, stimolano potentemente le terminazioni delle fibre amieliniche afferenti che innervano i muscoli, incluse le fibre nocicettive. Inoltre, si è trovato che non vi è liberazione di una PPS nel liquido di perfusione del tessuto sottocutaneo, in seguito a lesione della cute sovrastante, se quest'area cutanea era stata precedentemente denervata, con degenerazione di tutte le fibre nervose periferiche.
Quest'ultima osservazione suggerisce la possibilità che le stesse fibre afferenti nocicettive contengano una PPS che liberano quando un tessuto è leso e che le depolarizza insieme alle terminazioni delle fibre vicine. È assai probabile che tale sostanza sia la sostanza P (SP). Questo undecapeptide naturale, che fu isolato per la prima volta dal tessuto cerebrale da von Euler e Gaddum (v., 1931), si trova nelle corna posteriori del midollo spinale e la sua applicazione ionoforetica in questa regione depolarizza selettivamente sia le cellule di secondo ordine del corno posteriore, che sono attivate dalla stimolazione algogena della cute, sia le terminazioni centrali delle fibre afferenti nocicettive (v. Randic e Miletic, 1977). Se si lega una radice posteriore, la quantità di SP diminuisce nel corno posteriore ma aumenta nel segmento distale della radice legata. Questo polipeptide è presente in concentrazione massima nella sostanza gelatinosa e nel fascio del Lissauer, nelle fibre afferenti di piccolo diametro e nei gruppi di piccole cellule gangliari delle radici posteriori che presumibilmente danno origine a fibre amieliniche e mieliniche di piccolo diametro (v. Hökfelt e altri, 1977). La SP è presente anche nelle porzioni periferiche delle fibre di piccolo diametro che terminano nella polpa dentaria e nella pelle (v. Olgard e altri, 1977; v. Hökfelt e altri, 1975). Inoltre, questi stessi autori hanno dimostrato che un altro gruppo di piccole cellule gangliari delle radici dorsali contiene la somatostatina, il polipeptide a 14 amminoacidi che è sintetizzato e liberato da neuroni ipotalamici e sopprime la liberazione dell'ormone della crescita da parte dell'adenoipofisi. Non si sa se questo polipeptide intervenga nella trasmissione delle informazioni algogene.
In conclusione, il meccanismo specifico di trasduzione che agisce nei tessuti periferici trasformando il danno tessutale in impulsi nervosi nelle fibre afferenti nocicettive non è conosciuto con certezza, ma la base del processo è verosimilmente di natura chimica. L'identità delle sostanze algogene ‛trasmettitrici' è ancora incerta, ed egualmente oscuri sono la loro origine, il loro meccanismo di liberazione e il loro modo d'azione. Il complesso dei dati suggerisce che queste PPS periferiche siano uno o più di uno dei diversi polipeptidi noti come potenti sostanze algogene.
d) Meccanismi nervosi centrali del dolore.
Ipotesi sui meccanismi cerebrali del dolore possono essere desunte da dati anatomici e dalle alterazioni della sensibilità dolorifica in pazienti con lesioni patologiche o chirurgiche del sistema nervoso. Molte cognizioni sono state acquisite con la stimolazione elettrica cerebrale negli animali e nell'uomo e con gli esperimenti elettrofisiologici sugli animali.
Due fatti costituiscono i punti di partenza. Primo, il dolore è causato da impulsi lungo le fibre afferenti di uno dei due gruppi di fibre nocicettive descritti sopra, o dalla stimolazione elettrica dei sistemi ascendenti del quadrante anteriore del midollo spinale che ricevono le informazioni trasmesse dai detti gruppi di fibre primarie ed elaborate dai circuiti del corno posteriore. Secondo, una sezione chirurgica completa di tali sistemi ascendenti nel quadrante anteriore del midollo causa un marcato innalzamento delle soglie per il dolore e la sensibilità termica (e anche per il prurito) nella metà controlaterale del corpo a partire da pochi segmenti al di sotto della sezione. I gruppi di fibre nocicettive A-delta e C sono specifici per la modalità, ma altri gruppi in queste stesse classi di fibre servono altre modalità in maniera ugualmente specifica; un esempio è rappresentato dalle fibre afferenti meccanocettive a bassa soglia che sono particolarmente sensibili a stimoli in lento movimento.
1. Meccanismi segmentali locali. - Studi citoarchitettonici (v. Rexed, 1954) e ultrastrutturali (v. Ralston, 1968) nel gatto hanno dimostrato che il corno posteriore è divisibile in sei lamine orizzontali diverse per dimensioni e per distribuzione dei neuroni, per orientamento dei dendriti e per organizzazione sinaptica fra le lamine. La lamina I è la più dorsale e contiene le grandi cellule marginali di Waldeyer; la lamina II e la parte superiore della lamina III corrispondono alla sostanza gelatinosa (SO); la parte inferiore della lamina III e le lamine IV-VI costituiscono il nucleus proprius del corno posteriore e contengono grandi neuroni. Studi fisiologici successivi hanno dimostrato che questa organizzazione ha qualche significato funzionale. Utilizzerò in ciò che segue questa designazione laminare, con la riserva della improbabilità che il corno posteriore nei Primati sia una semplice copia di quello del gatto.
È stato ora dimostrato con vari metodi che cellule spinotalamiche (STT) sono distribuite diffusamente nella sostanza grigia spinale, che include i neuroni marginali della lamina I ma probabilmente nessuno dei piccoli neuroni della SO, un gran numero di neuroni nelle lamine IV, V e VI e un numero inferiore di neuroni in strati ancora più profondi (v. Kerr e Casey, 1978). Un problema fondamentale nell'identificazione dei meccanismi nervosi centrali del dolore riguarda i meccanismi segmentali di elaborazione nel corno posteriore, che sono interposti fra l'attività afferente nelle fibre nocicettive primarie e le combinazioni di impulsi nei sistemi ascendenti del midollo spinale che causano sensazioni dolorose o termiche.
Si sapeva da lungo tempo, ed è stato recentemente confermato, che le fibre afferenti nocicettive dei gruppi A-delta e C entrano nel midollo spinale nella porzione laterale di ciascuna radice posteriore, e terminano nella sostanza grigia del corno posteriore dopo un breve tragitto longitudinale nel settore estrinseco del fascio del Lissauer; alcune fibre possono raggiungere la SO direttamente. La funzione di questa proiezione è nocicettiva, come è dimostrato dal fatto che, sia negli animali sia nell'uomo, incisioni multiple superficiali del fascio del Lissauer producono una zona di ipoalgesia nei dermatomi ipsilaterali corrispondenti. Kumazawa e Perl (v., 1978) hanno scoperto, in esperimenti elettrofisiologici, che i due gruppi di fibre afferenti primarie hanno differenti zone di proiezione entro il corno posteriore. Nella scimmia ciascun neurone marginale della lamina I è attivato selettivamente da impulsi portati da una classe omogenea di fibre afferenti primarie del gruppo delta, che possono essere meccanocettori per il dolore, termocettori per il freddo o, se si considerano anche i neuroni nell'espansione laterale del collo del corno posteriore, meccanocettori a bassa soglia sensibili a stimoli meccanici in lento movimento che possono servire la sensibilità al prurito e al solletico. Le convergenze eccitatorie fra questi tipi di fibre sono rare, mentre le convergenze inibitorie sono più comuni. La lamina I del corno posteriore non dovrebbe tuttavia essere considerata come un semplice ripetitore dell'attività afferente delle fibre A-delta della radice posteriore nel sistema anterolaterale, poiché i neuroni marginali ricevono parecchie altre classi di afferenze sinaptiche (v. Narotzky e Kerr, 1978). I neuroni SG, per esempio, forniscono terminazioni ai corpi dei neuroni marginali e alle terminazioni presinaptiche delle fibre delta che terminano in contatto con tali neuroni. Anche le terminazioni degli elementi amminergici discendenti raggiungono i neuroni marginali. Pertanto, la trasmissione attraverso la lamina I dalle fibre delta ai neuroni marginali è soggetta alla regolazione da parte sia di meccanismi locali segmentali sia di sistemi di controllo discendenti.
Le cellule della sostanza gelatinosa sono attivate in prevalenza da impulsi in arrivo lungo le fibre C. Ciascuna cellula della SO è attivata o dalle fibre afferenti polimodali nocicettive o dalle fibre meccanocettive a bassa soglia del gruppo C, che sono sensibili agli stimoli in lento movimento e che innervano comunemente la pelle con peli ma non quella glabra. Molti neuroni SO ricevono afferenze convergenti dalle fibre A-delta e C della stessa classe funzionale. Gli assoni delle cellule della SO proiettano solo raramente a lunga distanza; tuttavia è chiaro che gli impulsi delle fibre afferenti nocicettive del gruppo C sono trasmessi nei sistemi anterolaterali che proiettano verso il proencefalo, e che questi impulsi evocano sensazioni di dolore intenso anche quando non sono preceduti da o associati ad attività delle fibre più grandi. Molti assoni della SO entrano nel fascio del Lissauer, vi decorrono per brevi tratti, e quindi rientrano o nella lamina I per terminare sui neuroni marginali, o sui neuroni SO delle lamine II o III, o sui bottoni sinaptici di altri assoni che terminano in tali regioni.
Le fibre mieliniche più grandi della porzione mediale della radice posteriore emettono collaterali assoniche segmentali prima di entrare nelle colonne dorsali. Queste collaterali passano anteriormente, medialmente al corno posteriore, quindi curvano dolcemente di lato e verso l'alto per terminare in ramificazioni assoniche estese in senso longitudinale che si alternano con file di neuroni della SO, formando così i raggruppamenti modulari di cellule del corno posteriore (v. Kerr, 1975). Le terminazioni bulbose di queste fibre formano gli elementi centrali dei glomeruli di questa regione e stabiliscono contatti sinaptici con i dendriti a direzione dorsale dei grandi neuroni di proiezione del nucleus proprius (lamine IV-VI), e anche con i presunti fini dendriti dei neuroni della SO e con terminazioni assoniche di origine ignota.
Queste connessioni formano indubbiamente una via di primaria importanza fra le grandi fibre afferenti mieliniche e i neuroni STT delle lamine IV-VI che, nella scimmia, contengono oltre la metà di tutti i neuroni spinali che proiettano al talamo controlaterale tramite il sistema anterolaterale, assieme a molti altri neuroni con diverse proiezioni. I neuroni STT del nucleus proprius comprendono un gruppo attivato solo da lievi stimolazioni meccaniche della pelle per mezzo di grandi fibre mieliniche, un altro gruppo che risponde sia a lievi stimoli meccanici sia a stimoli algogeni meccanici e termici per mezzo di proiezioni convergenti di fibre grandi e piccole, e un terzo gruppo sensibile solo a stimoli algogeni e attivato da impulsi portati da fibre delta e C. È stato dimostrato che l'interazione convergente fra le afferenze portate da grandi e piccole fibre avviene a questo livello segmentale, che queste fibre possono essere eccitatorie o inibitorie e che possono operare tramite meccanismi poste presinaptici. Diverse teorie sui meccanismi nervosi centrali del dolore sono basate su queste interazioni. Esse possono spiegare i seguenti fatti: 1) l'attivazione delle grandi fibre mieliniche può sopprimere il dolore proveniente dalla regione periferica da esse innervata e può sopprimere la risposta di cellule STT a impulsi in afferenze nocicettive (è questa la base di molti metodi di controllo del dolore); 2) un dolore spontaneo può insorgere in un area periferica privata dell'innervazione delle grandi fibre.
2. Sistemi nocicettivi ascendenti del midollo spinale e loro proiezioni proencefaliche. - Vi possono essere pochi dubbi sul fatto che i sistemi ascendenti importanti per le sensazioni del dolore, del prurito e della temperatura siano localizzati nella metà anteriore del midollo spinale e che le vie più importanti decorrano nel quadrante anterolaterale. Inoltre, nell'uomo la stimolazione elettrica per mezzo di microelettrodi localizzata al quadrante anterolaterale causa sensazioni dolorose e termiche (v. Sweet e altri, 1950), ma non sensazioni meccanocettive. Ciò è sorprendente, dato che: 1) fibre afferenti meccanocettive proiettano entro il sistema anterolaterale; 2) la sezione anterolaterale del midollo produce un lieve innalzamento delle soglie tattili controlaterali; 3) una rudimentale sensibilità al contatto persiste dopo la sezione dei sistemi della metà dorsale del midollo. Sweet e altri (v., 1950) hanno osservato in una serie di 200 stimolazioni locali del quadrante anterolaterale che si avevano sensazioni dolorose per il 54% delle posizioni stimolate, mentre per il 37% si avevano sensazioni di caldo e per il rimanente 9% si avevano sensazioni di freddo. Le sensazioni erano riferite al lato controlaterale nell'82% dei casi, al lato ipsilaterale solo nel 12% dei casi e a entrambi i lati nel 6% dei casi. E noto che la proiezione ipsilaterale di solito è piccola, ma essa può variare considerevolmente in alcuni individui ed eccezionalmente può essere la proiezione dominante.
È pertanto chiaro che riguardo alle fibre nervose periferiche e alle componenti spinali ascendenti del sistema nervoso è l'attività nervosa di certi gruppi specifici di fibre periferiche e di assoni centrali ascendenti che provoca dolore. Nessuna speciale configurazione ‛spazio-temporale' di impulsi in fibre altrimenti non specifiche per il dolore è necessaria o sufficiente per provocare dolore. L'attività imposta dalla stimolazione elettrica sia delle fibre periferiche sia dei fasci ascendenti non si esplica in alcuna circostanza naturale, eppure essa provoca dolore. La variazione dello schema o della frequenza della stimolazione elettrica può modificare l'intensità o la cadenza temporale ma non la qualità dell'esperienza sensitiva indotta. La distribuzione degli impulsi in molti altri sistemi afferenti o centrali può contribuire alla sensibilità dolorifica in generale regolandola o sopprimendola, ma il dolore in se stesso, quando è evocato, è indipendente da tale attività per quanto riguarda la sua qualità.
La sezione anterolaterale del midollo causa una degenerazione anterograda diffusa e ampiamente distribuita, mettendo così in evidenza ricche proiezioni ascendenti: 1) alla porzione reticolare centrale del tronco dell'encefalo e del mesencefalo; 2) a un componente del gruppo nucleare posteriore (PO) e al complesso ventrobasale (VB) del talamo (questa proiezione è talvolta chiamata fascio o sistema neospinotalamico); 3) ai nuclei del gruppo nucleare intralaminare del talamo, e particolarmente al nucleus centralis lateralis (questa proiezione è talvolta chiamata fascio o sistema paleospinotalamico; v. Mehler, 1962). Una sezione anterolaterale del midollo interrompe sistemi che originano nello stesso lato e sistemi che originano nel lato opposto del midollo, ed è noto che tali sistemi costituiscono la via essenziale per il dolore nell'uomo. Kerr è riuscito a isolare la proiezione controlaterale tagliando la commessura anteriore al livello di diversi segmenti spinali adiacenti e seguendo la conseguente degenerazione anterograda (v. Kerr e Casey, 1978). Il sistema a destinazione controlaterale contiene piccole fibre mieliniche, ma non fibre C (v. Lippman e Kerr, 1972). Esso proietta: 1) ai nuclei PO e VB del talamo; 2) ai nuclei intralaminari, in particolare al nucleus centralis lateralis; 3) alla sostanza grigia periacqueduttale e al nucleus cuneiformis del mesencefalo. Quest'ultimo nucleo proietta in senso ascendente ai nuclei intralaminari, al subtalamo e all'ipotalamo dorsale (v. Edwards e De Olmus, 1976). Queste vie costituiscono il fascio spinotalamico laterale. Un'importante osservazione è che nella scimmia, e presumibilmente nell'uomo, nessuna fibra ascendente di origine controlaterale termina nella formazione reticolare del bulbo o del ponte. Le proiezioni messe in evidenza in tal modo devono pertanto originare a livello segmentale nel lato ipsilaterale (v. Kerr e Casey, 1978). Queste osservazioni hanno indotto Kerr alla generalizzazione che le proiezioni spinoreticolari del quadrante anterolaterale hanno la funzione predominante o esclusiva di provocare reazioni somatiche e autonomiche agli stimoli algogeni, e non di evocare sensazioni dolorose. Studi sul trasporto assonico delle proiezioni controlaterali al mesencefalo e ai nuclei intralaminari suggeriscono che questi ultimi nuclei ricevono proiezioni soprattutto dalle cellule marginali della lamina I, mentre i gruppi PO e VCL (ventrale caudale laterale) ricevono proiezioni soprattutto dai neuroni STT delle lamine IV-VI. Kerr ha anche fornito una nuova prova anatomica che nella scimmia, e presumibilmente anche nell'uomo, esiste un fascio spinotalamico ventrale come entità separata dal fascio laterale e che i suoi assoni raggiungono le stesse aree di proiezione del fascio laterale (v. Kerr, 1975).
3. Meccanismi proencefalici e dolore. - Da molto tempo è noto che lesioni di alcune zone del sistema nervoso centrale, particolarmente del talamo o della corteccia, possono causare dolore spontaneo, il ‛dolore di origine centrale' che verrà discusso nel È g. Il dolore spontaneo può anche comparire dopo la perdita selettiva delle fibre più grandi nei nervi periferici, con conservazione delle fibre più piccole. Queste osservazioni portano a formulare l'ipotesi generale secondo la quale esiste nell'encefalo un sistema che controlla e regola la trasmissione delle afferenze nocicettive ai sistemi ascendenti e l'attività di quei meccanismi proencefalici implicati nella sensibilità dolorifica in genere. Il fatto che il dolore spontaneo possa manifestarsi a seguito della perdita specifica delle fibre afferenti periferiche più grandi suggerisce che l'attività tonica del sistema centrale di regolazione dipenda in parte dall'attività continua delle grandi fibre afferenti meccanocettive dei nervi periferici. L'ipotesi generale di una regolazione centrale dei meccanismi nervosi del dolore è stata molto rafforzata dalla scoperta che la stimolazione elettrica di vari punti del sistema nervoso centrale fa cessare il dolore sia nell'uomo sia negli animali da esperimento, e anche dalla scoperta, egualmente importante, dell'esistenza di un sistema endogeno di sostanze oppiacee nell'encefalo (v. neuroendocrinologia; v. neurosecrezione). Questi meccanismi di regolazione centrale saranno discussi nel È e. Descriverò qui ciò che si conosce sulle regioni talamiche e corticali attivate ‛direttamente' dai sistemi nocicettivi ascendenti del midollo spinale, regioni considerate importanti per la percezione del dolore.
Le aree di proiezione talamiche e mesencefaliche dei fasci spinotalamici laterale e mediale a direzione controlaterale (LSTT e MSTT) includono: 1) il complesso ventrobasale (VB); 2) porzioni del gruppo nucleare posteriore (PO); 3) il gruppo intralaminare, e principalmente il nucleus centralis lateralis; 4) la sostanza grigia periacqueduttale e il nucleus cuneiformis del mesencefalo, regioni che a loro volta mandano proiezioni ascendenti ai nuclei intralaminari, alla regione subtalamica e all'area ipotalamica dorsale.
I. Il complesso ventrobasale e il giro postcentrale. Il complesso VB riceve informazioni meccanocettive sia dal lemnisco mediale sia dai fasci spinotalamici. Parecchie migliaia di cellule del complesso VB (v. Loe e altri, 1977; v. Perl e Whitlock, 1961; v. Poggio e Mountcastle, 1963), del giro postcentrale (v. Mountcastle e Powell, Central nervous... e Neural mechanisms..., 1959; v. Whitsel e altri, 1971) e dell'area somatica seconda (v. Whitsel e altri, Symmetry and..., 1969) sono state studiate in esperimenti elettrofisiologici sulla scimmia in varie condizioni. Solo raramente si sono trovati neuroni con reattività differenziale alla stimolazione algogena dei tessuti periferici. Questi risultati suggeriscono l'ipotesi che il complesso VB riceva gli assoni STT specifici per la meccanorecezione e la termorecezione; non è ancora certo se esso riceva anche informazioni nocicettive, poiché queste regioni del talamo e della corteccia non sono ancora state studiate elettrofisiologicamente in scimmie sveglie e libere di muoversi, dopo addestramento a rilevare e a reagire a stimoli algogeni.
La stimolazione elettrica del complesso VB in soggetti umani svegli produce sensazioni meccanocettive ma solo raramente nocicettive, riferite al lato controlaterale del corpo; molto più comunemente questa stimolazione fa cessare sensazioni dolorose preesistenti. Lesioni del complesso VB possono produrre un'ipoalgesia controlaterale transitoria, presto seguita dall'insorgenza di dolore intenso di origine centrale - la sindrome talamica. La stimolazione del giro postcentrale in soggetti umani svegli produce sensazioni riferite al lato opposto, che solo occasionalmente sono descritte come dolorose. Lesioni o l'asportazione chirurgica del giro postcentrale causano un'ipoalgesia immediata del lato controlaterale accompagnata dalla perdita di alcuni degli aspetti discriminativi della sensibilità somatica. In alcuni pazienti l'ipoalgesia può persistere per lunghi periodi di tempo. Nella maggior parte dei casi, tuttavia, la scomparsa del dolore e l'ipoalgesia sono presto seguiti da iperalgesia. Questo risultato delle lesioni sia del complesso VB sia del giro postcentrale indica che questo sistema non è un componente principale della via centrale del dolore, nel senso usuale, ma che lesioni ivi localizzate eliminano una potente attività tonica da cui dipende il sistema centrale per la regolazione del dolore descritto più sotto; l'iperalgesia può essere considerata un fenomeno di ‛liberazione'.
II. Il nucleo posteriore e la corteccia retroinsulare. La porzione mediale del nucleo posteriore del talamo (POm, un componente del complesso nucleare posteriore) è una area di proiezione degli assoni STT, e proietta a sua volta a una regione corticale circoscritta, l'area retroinsulare, che è adiacente al limite posteriore dell'area somatica seconda ed è situata in profondità nella scissura di Silvio (v. Burton e Jones, 1976). Molti dei suoi neuroni sono sensibili selettivamente agli stimoli algogeni (v. Perl e Whitlock, 1961; v. Poggio e Mountcastle, 1960), mentre altri neuroni hanno proprietà che dimostrano una convergenza di afferenze meccanocettive e nocicettive. I neuroni della sua area di proiezione, la corteccia retroinsulare, possiedono proprietà simili (v. Carreras e Andersson, 1963; v. Whitsel e altri, Symmetry and..., 1969). Sulla base di esperimenti elettrofisiologici questo sistema può essere considerato come una parte di una via centrale del dolore. Nell'uomo la stimolazione elettrica della regione omologa del talamo produce intenso dolore in soggetti svegli, e questo dolore è riferito al lato controlaterale. Le lesioni elettrolitiche di questa regione talamica producono inizialmente un'analgesia controlaterale alla puntura e la scomparsa di dolori intrattabili di origine periferica. Questa scomparsa tuttavia può essere di breve durata, ed è frequentemente seguita, nel giro di giorni o settimane, dalla ricomparsa del dolore che aveva motivato la terapia chirurgica, e che può raggiungere uno stato di iperalgesia estrema. Una lesione dell'opercolo parietale, che nell'uomo contiene l'area somatica seconda e la corteccia retroinsulare, può produrre disturbi della sensibilità al dolore senza perdita apprezzabile degli aspetti discriminativi della sensibilità somatica (v. Biemond, 1956). Talairach e altri (v., 1960) hanno osservato che la stimolazione elettrica della sostanza bianca appena al di sotto di questa regione evoca sensazioni spesso dolorose, e che la distruzione di questi sistemi di fibre può alleviare un dolore intenso di origine patologica nel lato controlaterale del corpo.
III. Mesencefalo e sistema intralaminare del talamo. La stimolazione dei fasci spinotalamici o trigeminotalamici a livello del loro ingresso nel diencefalo produce intenso dolore controlaterale, al pari della stimolazione della sostanza grigia periacqueduttale e del tegmento mesencefalico (nucleus cuneiformis), che sono ambedue aree di proiezione dei neuroni STT (v. Nashold e altri, 1969). Per bloccare efficacemente il dolore, le lesioni alla giunzione mesodiencefalica devono interrompere sia i componenti STT che ascendono lateralmente, sia le proiezioni ascendenti del tegmento mesencefalico. L'estensione desiderata di tale lesione in senso mediale entro il tegmento è limitata da effetti negativi sulle funzioni vitali. La stimolazione dei nuclei intralaminari del talamo, che ricevono sia proiezioni STT dirette sia proiezioni ascendenti del tegmento mesencefalico, causa nell'uomo sveglio stati d'ansia anziché dolore intenso. Gli effetti sono descritti come spiacevoli ma non decisamente dolorosi, e sono talvolta accompagnati da alterazioni dello stato di coscienza. Le lesioni di questa regione bloccano, secondo alcune esperienze, il dolore cronico in alcuni casi; queste lesioni di solito includono il nucleus centralis lateralis, ma si estendono comunemente anche ad altri nuclei talamici.
In conclusione, i fasci ascendenti spinotalamici proiettano e si collegano a vari sistemi telencefalici, nessuno dei quali può essere singolarmente considerato come ‛la via' centrale del dolore. Indubbiamente ciascuno di essi ha una parte importante nel meccanismo centrale generale del dolore. È assolutamente necessario avere nuove informazioni sulle connessioni fra i componenti STT e i vari sistemi, sulle proprietà funzionali dei neuroni di ciascun sistema e sulle relazioni fra l'attività dei diversi sistemi e le sensazioni di dolore. Queste informazioni potrebbero essere ottenute attualmente con esperimenti elettrofisiologici su scimmie sveglie e libere di muoversi, addestrate a rilevare e a discriminare stimoli algogeni. Durante gli ultimi decenni i tentativi neurochirurgici di alleviare stati cronici di dolore intenso e persistente con lesioni di regioni corticali e talamiche ritenute appartenenti al ‛sistema del dolore' sono stati in genere deludenti, sia come misure terapeutiche sia per la comprensione dei meccanismi fisiologici. Ogni lesione che blocchi il dolore temporaneamente ha spesso come effetto successivo un'iperalgesia di origine centrale. Ciò suggerisce che ai livelli superiori del sistema nervoso centrale il ‛sistema sensitivo' per il dolore sia inestricabilmente intrecciato con un altro sistema attivo nella regolazione centrale del dolore, e che una lesione del sistema che riesca a bloccare la funzione sensitiva quasi certamente interferisce anche con la funzione di controllo.
e) Meccanismi nervosi centrali di controllo del dolore.
Due recenti scoperte hanno permesso di stabilire che l'encefalo contiene un elaborato sistema per il controllo e la regolazione delle afferenze nocicettive. La prima è che la stimolazione elettrica di punti localizzati precisamente nell'encefalo produce un'analgesia spesso potente, che può continuare per minuti od ore dopo la fine del periodo di stimolazione. La seconda è che l'encefalo contiene un sistema analgesico in cui la trasmissione sinaptica a qualche livello è mediata da sostanze endogene simili alla morfina, le encefaline, che sono presenti in condizioni naturali e si legano a molecole recettrici per gli oppiacei situate nelle membrane di gruppi di neuroni centrali distribuiti in regioni specifiche (v. neuroendocrinologia; v. neurosecrezione). Questi due ‛sistemi' coincidono in gran parte, ma non completamente, ai livelli troncoencefalico e talamico. In condizioni naturali questo sistema di controllo deriva in parte la sua attività di base da afferenze toniche portate dal sistema somatico afferente. Infatti, si suppone che le lesioni dei nervi somatici o delle vie centrali a cui tali nervi proiettano riducano l'attività del sistema di controllo e scatenino pertanto il ‛dolore spontaneo di origine centrale' che comunemente compare nell'uomo a seguito di lesioni del sistema somatico afferente.
1. Analgesia prodotta dalla stimolazione elettrica. - È noto da tempo che la stimolazione elettrica dei tessuti periferici, o più precisamente delle fibre nervose afferenti che li innervano, causa una riduzione della sensibilità dolorosa in questi tessuti, l'analgesia. Negli ultimi decenni il metodo della stimolazione elettrica dei nervi periferici, delle vie afferenti del midollo spinale e dello stesso encefalo è stato impiegato come un possibile modo di trattare gli stati dolorosi nell'uomo (v. Long e Hagfors, 1975) e come mezzo sperimentale nello studio dei meccanismi nervosi centrali del dolore negli animali (v. Mayer e Price, 1976). Le regioni del sistema somatico afferente la cui stimolazione è efficace per la produzione di analgesia includono la stessa cute, i tronchi nervosi periferici, le colonne dorsali (v. Long ed Erickson, 1975), le colonne ventrali, il complesso talamico ventrobasale e la capsula interna. Regioni centrali la cui stimolazione dà effetti potenti, ma che non fanno parte del sistema somatico afferente, includono la sostanza grigia periventricolare e periacqueduttale del talamo e del mesencefalo e alcuni dei nuclei della linea mediana del tronco dell'encefalo, in particolare il nucleus magnus del rafe (v. Fields e Basbaum, 1978). La stimolazione di punti del sistema limbico può influenzare la reazione generale al dolore, ma di solito non dà analgesia oggettiva.
L'analgesia prodotta dalla stimolazione elettrica ha le seguenti caratteristiche: 1) essa può essere rapida e completa, al punto da consentire interventi chirurgici negli animali; 2) la stimolazione delle vie afferenti di solito non è efficace nell'uomo se non produce parestesie proiettate; 3) quanto più periferico è il punto di stimolazione del sistema somatico efferente, tanto più probabile è la limitazione dell'analgesia al tessuto innervato dalla parte stimolata o in essa rappresentato; 4) quanto più centrale è il punto stimolato, tanto più probabile è la persistenza del periodo di analgesia dopo il periodo di stimolazione (talvolta per ore) e la distribuzione a gran parte, o addirittura a tutto il corpo, dell'analgesia. Ciò si verifica sovente con la stimolazione della sostanza grigia periventricolare e periacqueduttale, e dei nuclei del rafe; 5) l'analgesia può essere in gran parte, ma non completamente, interrotta o prevenuta dalla somministrazione di naloxone, un antagonista della morfina e delle encefaline (v. Adams, 1976); 6) l'analgesia indotta dalla stimolazione centrale può essere parzialmente interrotta o prevenuta dalla deplezione o dal blocco della serotonina.
2. Meccanismi dell'analgesia prodotta dalla stimolazione elettrica. - Vi sono prove che molti meccanismi possono partecipare a questo fenomeno: 1) la stimolazione elettrica dei nervi periferici o delle vie afferenti può produrre un blocco diretto della conduzione nelle fibre afferenti nocicettive o negli assoni ascendenti STT, ad esempio per polarizzazione elettrotonica; 2) gli impulsi afferenti nelle grandi fibre mieliniche dei nervi periferici e delle colonne dorsali inibiscono direttamente i neuroni STT; 3) la stimolazione elettrica dei nervi afferenti o di regioni encefaliche centrali attiva il sistema centrale di regolazione, producendo così analgesia per un blocco dall'alto della trasmissione sinaptica nella via afferente nocicettiva a livello segmentale; 4) la stimolazione di alcune strutture limbiche o di altre strutture proencefaliche può influenzare la reattività affettiva generale al dolore tramite altri meccanismi non ancora conosciuti.
Altri esperimenti hanno dimostrato che la stimolazione elettrica del nucleus magnus del rafe e delle regioni immediatamente adiacenti sopprime la risposta dei neuroni STT alle afferenze nocicettive a livello segmentale (v. Willis e altri, 1977). Le fibre rafospinali si proiettano a quelle lamine del corno posteriore che contengono le cellule di origine dei fasci spinotalamici a tutti i livelli segmentali, e la sezione del fascio rafospinale nella colonna dorsolaterale riduce ampiamente l'analgesia prodotta dalla stimolazione elettrica dell'encefalo. Un componente del sistema del rafe con proprietà simili proietta al nucleo spinale trigeminale. Questo nucleo è considerato una stazione principale di partenza del sistema discendente che controlla il sistema afferente nocicettivo. Il sistema utilizza la serotonina come trasmettitore per le fibre rafospinali lunghe, dato che sia l'analgesia da stimolazione sia l'inibizione dei riflessi flessori segmentali da decerebrazione sono marcatamente ridotte a seguito di deplezione o blocco della serotonina (v. Messing e Lytle, 1977).
3. Analgesia prodotta da iniezioni locali di oppiacei nell'encefalo. - Le iniezioni locali di piccole quantità di morfina nel corno posteriore del midollo spinale producono un blocco potente della trasmissione sinaptica dalle afferenze nocicettive ai neuroni STT del midollo spinale e agli interneuroni della sostanza gelatinosa (v. Yaksh e Rudy, 1978). Un'analgesia generale è prodotta dalla microiniezione locale di oppiacei in certe regioni del tronco dell'encefalo, particolarmente nella sostanza grigia periventricolare e periacqueduttale, regioni la cui stimolazione elettrica è efficace al massimo per l'induzione di analgesia. In generale, le distribuzioni dei punti in corrispondenza dei quali i due agenti sono efficaci sono simili. Questi effetti della morfina sono interrotti o bloccati dal naloxone, e l'analgesia generale prodotta dall'iniezione locale nel tronco dell'encefalo è bloccata o grandemente ridotta dalla sezione delle colonne dorsolaterali, che contengono il sistema discendente rafospinale sopra descritto, o dalle lesioni dello stesso nucleus magnus del rafe. Queste osservazioni rafforzano la conclusione che questo nucleo e i neuroni a esso immediatamente adiacenti costituiscono una stazione principale di partenza dei meccanismi discendenti del sistema nervoso centrale che controllano il dolore. La distribuzione precisa e circoscritta delle regioni sensibili agli oppiacei nell'encefalo e l'estrema piccolezza delle dosi di oppiacei sufficienti a dare analgesia generale, dopo iniezione locale nel tronco dell'encefalo, sono in accordo con due concetti generali. Primo, la morfina agisce legandosi specificamente a recettori per gli oppiacei presenti naturalmente nell'encefalo; secondo, i neuroni che possiedono tali recettori fanno parte del meccanismo essenziale per mezzo del quale il sistema nervoso centrale regola l'elaborazione centrale delle afferenze nocicettive (v. neuroendocrinologia; v. neurosecrezione).
4. I recettori per gli oppiacei e le sostanze naturali che si legano a essi, le encefaline. - Varie proprietà farmacologiche di oppiacei quali la morfina o l'etorfina suggeriscono che essi agiscano legandosi a molecole recettrici specifiche nella membrana delle cellule e dei neuroni in particolare. Gli oppiacei producono i loro effetti analgesici e di altro tipo quando sono presenti a bassa concentrazione: essi sono stereospecifici, e i loro effetti possono essere interrotti da farmaci antagonisti, come il naloxone, che hanno una struttura sterica simile, ma apparentemente agiscono bloccando, anziché ‛attivando', i recettori postsinaptici. I recettori per gli oppiacei sono stati localizzati nelle membrane di neuroni centrali, le sostanze che naturalmente si legano a essi sono state identificate, e le affinità di legame sia per i narcotici sia per dette sostanze naturali, le encefaline, sono state determinate. I recettori per gli oppiacei e le encefaline sono presenti nel sistema nervoso centrale di tutti i Vertebrati e assenti in tutti i numerosi invertebrati finora esaminati.
La scoperta dei recettori per gli oppiacei nell'encefalo ha immediatamente suggerito l'idea che molecole simili agli oppiacei siano naturalmente presenti nell'encefalo e funzionino come trasmettitori sinaptici o agenti modulatori delle sinapsi. Due pentapeptidi con proprietà oppioidi sono stati isolati dall'encefalo e identificati come met-encefalina (Tyr-Gly-Gly-Phe-Met-OH) e leu-encefalina (H-Tyr-Gly-Gly-Phe-Leu-OH) (v. Hughes, 1975; v. Hughes e altri, 1975). Queste molecole possiedono una struttura di configurazione all'estremità con la tirosina che ricorda quella di una porzione della molecola della morfina e quella di parecchi altri narcotici, il che suggerisce che tutte queste molecole abbiano in comune un'interazione non covalente con un sito complementare dal punto di vista geometrico, che si presume faccia parte della molecola recettrice per gli oppiacei. Le encefaline competono con i narcotici a livello dei recettori per gli oppiacei legandosi stereospecificamente a essi, e hanno la stessa potenza analgesica dei narcotici quando sono iniettati nelle strutture troncoencefaliche e talamiche in cui sono concentrati i recettori per gli oppiacei e la cui stimolazione elettrica produce analgesia. Le encefaline sono rapidamente distrutte da enzimi proteolitici e pertanto non sono efficaci quando sono iniettate per via endovenosa o nei ventricoli cerebrali (v. Iversen e altri, 1978).
5. La distribuzione regionale e la localizzazione cellulare del sistema dei recettori per le encefaline e gli oppiacei. - Secondo un'ipotesi generale corrente le encefaline funzionano come trasmettitori in sistemi specifici di neuroni encefalici e si trovano assieme ai loro recettori per gli oppiacei nelle strutture encefaliche che partecipano a tutti i processi fisiologici influenzati dalla somministrazione di farmaci oppiacei. Le encefaline e i recettori per gli oppiacei si trovano nella frazione sinaptosomica dopo centrifugazione selettiva di omogenizzati di encefalo. Un sinaptosoma è una terminazione di fibra nervosa separata con la centrifugazione, con il suo contenuto di vescicole e citoplasma, assieme all'area subsinaptica della membrana della cellula postsinaptica che le rimane saldamente attaccata. Dividendo ulteriormente la frazione sinaptosomica si trova che i recettori per gli oppiacei sono legati alle membrane cellulari, probabilmente a quelle postsinaptiche, e non alle vescicole. Studi con l'immunofluorescenza dimostrano che le encefaline sono localizzate nelle fibre nervose e nelle loro terminazioni, presumibilmente nelle vescicole sinaptiche. A livello spinale questo sistema di trasmettitori si trova in concentrazione massima nel corno posteriore, particolarmente nelle lamine I-III (e nella sostanza gelatinosa, - SG - del nucleo spinale del nervo trigemino). La concentrazione di recettori per gli oppiacei nel corno posteriore si riduce molto dopo sezione e degenerazione delle fibre delle radici posteriori (v. LaMotte e altri, 1976), ma i livelli di encefaline non sono influenzati da questa operazione nè da una sezione più alta del midollo spinale. Possiamo così concludere che la lamina I e la sostanza gelatinosa (lamine II e III) del corno posteriore contengono interneuroni encefalinergici, e che una gran parte di questi interneuroni mandano i loro assoni a terminare sulle terminazioni presinaptiche di qualche fibra afferente delle radici posteriori, presumibilmente, vista la loro terminazione nel midollo, nocicettive.
A livello troncoencefalico il sistema si ritrova nei nuclei vagali e nei nuclei e nei tratti a essi associati, il che è in accordo con i potenti effetti dei narcotici sui riflessi vagali e sulla regolazione del respiro. Il sistema di trasmettitori e recettori è concentrato nella sostanza grigia periacqueduttale e periventricolare del mesencefalo e del talamo, ed è proprio in queste regioni che sia la stimolazione elettrica sia le iniezioni locali di narcotici sono più efficaci nell'indurre analgesia generale. Nel proencefalo il sistema encefaline-recettori per gli oppiacei si trova in alte concentrazioni nell'ipotalamo e in strutture limbiche quali il complesso nucleare amigdaloideo. Si pensa che questa distribuzione sia in rapporto con i potenti effetti dei narcotici sul comportamento emozionale e con la loro capacità di indurre sensazioni di piacere e benessere. La neocorteccia contiene concentrazioni molto basse di encefaline e recettori per gli oppiacei.
6. Le endorfine. - Le endorfine (v. Klee, 1977) sono neuropeptidi a catena corta che derivano dalla β-lipotropina (v. Hughes e altri, 1975), un peptide lipolitico costituito da 91 residui di amminoacidi che si ritrova nell'ipofisi, particolarmente nella parte intermedia, e anche nell'encefalo, ma in concentrazioni assai basse. La sequenza degli amminoacidi 61...65 della β-lipotropina è uguale a quella della met-encefalina, e tutti i frammenti molecolari che contengono questa sequenza e sono più grandi delle stesse encefaline, cioè i frammenti 61...65 fino a 6...91, sono chiamati endorfine. Queste sostanze hanno un'alta affinità per i recettori per gli oppiacei dell'encefalo e dell'ipofisi, e provocano analgesia quando sono iniettati in appropriate regioni dell'encefalo o nel sistema dei ventricoli. Valutato in base alla concentrazione molare, tale effetto è molte volte superiore a quello della stessa morfina (v. Loh e altri, 1976). Questo effetto è bloccato dal naloxone. La distribuzione cerebrale delle endorfine coincide in generale con quella dei recettori per gli oppiacei, ma le concentrazioni nel caudato e nel globo pallido, nell'amigdala e nell'ipotalamo sono sproporzionatamente alte. Esse sono sempre localizzate nei neuroni, in particolare nelle terminazioni delle fibre. Alcune endorfine producono, oltre all'analgesia, rigidità muscolare, uno stato catatonico e modificazioni della termoregolazione quando sono iniettate nel sistema dei ventricoli. È stato suggerito che i sistemi che utilizzano le endorfine come trasmettitori o modulatori sinaptici siano importanti per le regolazioni omeostatiche, e che i disturbi nella sintesi o nell'azione di queste sostanze potrebbero portare ad alterazioni complesse del comportamento (v. Guillemin e altri, 1977).
f) Dolore da strutture viscerali e somatiche profonde.
Il dolore che origina nei visceri è importante per il medico, perché la conoscenza dei suoi meccanismi e soprattutto del fenomeno dell'eterotopia è essenziale per la diagnosi e la localizzazione dei processi morbosi, sia nella cavità toracica sia in quella addominale. Queste sono innervate da fibre viscerali afferenti i cui corpi cellulari si trovano nei gangli della radice posteriore o nei gangli di alcuni nervi cranici; nonostante ciò sono sotto ogni aspetto analoghi alle fibre afferenti dei nervi somatici.
1. Dolore viscerale. - Le afferenze nocicettive dalle basse vie urinarie e genitali raggiungono il SNC attraverso i nervi pelvici parasimpatici. Invece quelle che innervano le cavità toracica e addominale decorrono lungo le vie simpatiche, i nervi cardiaci e quelli splancnici. La pleura parietale, il peritoneo e i bordi esterni del diaframma sono innervati dalle branche dei nervi spinali toracici e lombari; il centro del diaframma è innervato dalle afferenze del nervo frenico. Quindi, sia le afferenze somatiche sia quelle viscerali possono segnalare processi morbosi che coinvolgono i visceri e le pareti del corpo. La pleura parietale e il peritoneo sono molto sensibili, tanto che in soggetti coscienti lievi stimoli meccanici su tali formazioni suscitano dolore. In condizioni normali una distensione eccessiva dell'intestino o della vescica provoca dolore, e così pure forti contrazioni delle loro pareti muscolari. Un intestino normale esposto è insensibile a stimoli nocivi leggeri, ma quando è iperemico o infiammato anche stimoli lievissimi sono sufficienti a evocare il dolore persistente profondo, caratteristico delle malattie intraddominali. È pertanto probabile che il processo infiammatorio alteri la soglia delle afferenze nocicettive.
2. Dolore eterotopico. - Il dolore che origina nei visceri può essere percepito nel luogo di origine, ma frequentemente è avvertito come se provenisse da un luogo distante sulla superficie di cute innervata dallo stesso segmento spinale del viscere da cui il dolore origina. Il dolore eterotopico può apparire sia simultaneamente sia in completa assenza di dolore percepito come derivante dalla zona dove avviene veramente la stimolazione nociva.
Quando l'intensità del processo morboso che dà origine a un dolore viscerale è lieve o appena all'inizio, il dolore può scomparire se il luogo di riferimento o le fibre afferenti che lo innervano sono anestetizzati localmente. Quando la gravità del processo che provoca il dolore aumenta, questa condizione può tuttavia non verificarsi più, e il dolore può essere riferito a un'area della pelle anche se questa è completamente anestetizzata. La prima osservazione suggerisce che scariche afferenti di bassa frequenza, prolungate nel tempo, in alcune afferenze cutanee nocicettive, che normalmente non sono sufficienti a mantenere una frequenza sopraliminare negli elementi ascendenti del sistema anterolaterale, si sommino con le informazioni convergenti provenienti dalle afferenze viscerali nocicettive per ottenerla. Ovviamente, la convergenza e la sommazione potrebbero avvenire ai livelli più elevati del sistema nervoso. La seconda osservazione, e cioè che l'anestesia locale dell'area di rispondenza può non modificare l'effetto di eterotopia stesso quando l'attività nocicettiva viscerale è intensa, suggerisce l'ipotesi che tale attività possa da sola eccitare gli elementi del sistema anterolaterale fino a frequenze sopraliminari.
3. Dolore somatico profondo. - Dolore di particolare intensità e continuo è causato da lesioni di strutture profonde del corpo diverse dai visceri - cioè muscoli, fasce, articolazioni, periostio e tendini; la cefalea è un caso speciale di dolore somatico profondo. Queste strutture profonde sono innervate dalle fibre nocicettive delta e C. Lo stimolo più efficace per produrre dolore nei muscoli è una contrazione continuata o ripetuta, specialmente se il muscolo lavora in condizioni di insufficiente apporto sanguigno. Si pensa che questo dolore sia dovuto a liberazione di sostanze algogene dalle cellule che si contraggono in anossia, probabilmente da uno o più polipeptidi simili alla bradichinina.
Sia il dolore viscerale sia quello somatico profondo provocano generalmente potenti contrazioni riflesse dei muscoli scheletrici, come la contrattura della muscolatura addominale provocata da dolore intraddominale. I muscoli in contrazione continua possono a loro volta divenire fonte di dolore, determinando quella ‛dolenzia' muscolare tipica in questi casi che può persistere per ore o giorni dopo che il dolore originale è scomparso.
Si ritiene che le proiezioni centrali delle afferenze nocicettive viscerali e somatiche profonde siano identiche a quelle descritte in precedenza per le afferenze nocicettive della cute.
g) Disturbi della percezione del dolore e dolore di origine centrale.
Molti disturbi del sistema nervoso periferico e centrale determinano un dolore spontaneo, o una condizione tale per cui stimoli normalmente innocui risultano dolorosi. Questi stati dolorosi sono tra i più penosi che si conoscano nell'uomo, e possono arrivare a influenzare completamente il comportamento del paziente. Prenderemo in considerazione quegli stati che contribuiscono a chiarire i meccanismi normali del dolore.
Quando un nervo periferico viene sezionato, come Henry Head fece sul proprio braccio (v. Henson, 1961), le sensazioni non cambiano in modo uniforme in tutta l'area interessata (v. fig. 30). Fra la zona prossimale, dove la sensazione è normale, e quella distale di completa anestesia, vi sono tre zone di alterata sensibilità caratterizzate dal fatto che l'applicazione di stimoli normalmente neutri produce sensazioni spiacevoli. Questi cambiamenti compaiono subito dopo la sezione del nervo (v. Denny-Brown, 1965). L'interpretazione che diamo oggi di questi fatti è che la sovrapposizione dei campi di distribuzione di nervi periferici vicini differisce per i diversi gruppi di fibre, essendo minima per le fibre mieliniche di diametro maggiore di 6 μ che proiettano nel sistema lemniscale, massima per le fibre delta e C, che proiettano nel sistema anterolaterale. La sezione di un nervo, quindi, espone una zona di tessuto periferico che centralmente viene a essere rappresentata solo nel sistema anterolaterale: questa rappresentazione è ora non più limitata dall'influenza dell'attività lemniscale, normalmente generata nell'innervazione che regola gli impulsi afferenti della zona periferica da parte di fibre più grandi. È chiaro da ciò che sappiamo dall'anatomia centrale che questa influenza frenante può esercitarsi a qualsiasi livello, dal corno posteriore alla corteccia cerebrale. Quindi ne risulta un concetto generale, che è probabile che ogni tessuto periferico privato della propria rappresentazione centrale operata dalle fibre periferiche mieliniche più grandi divenga un punto di riferimento per un'iperpatia di origine centrale.
La sindrome prototipo di questa natura è la sindrome talamica descritta originariamente da Déjerine e Roussy (v., 1906), che può far seguito a lesioni vascolari dei nuclei ventrali posterolaterali del talamo, che rappresentano le vie lemniscali e neospinotalamiche alla corteccia cerebrale. La sindrome è caratterizzata da dolore controlaterale, forte e persistente, che insorge spontaneamente e che è frequentemente così intollerabile da non essere controllabile neppure con gli anestetici. Paradossalmente, la soglia del dolore evocato da stimoli applicati può essere elevata; ma una volta che lo stimolo ha raggiunto la soglia, si manifesta immediatamente un dolore lancinante. In genere v'è anche perdita di qualche modalità meccanocettiva della somatoestesia, come ci si può aspettare a causa dell'interruzione della via lemniscale.
Queste caratteristiche generali possono comparire in seguito a lesioni a qualsiasi livello del sistema somatico afferente che privino dell'innervazione lemniscale i tessuti periferici. Esse possono conseguire a lesioni degenerative di grandi fibre nervose periferiche: più raramente appaiono in seguito a lesioni delle colonne dorsali e, occasionalmente, dopo lesioni della corteccia parietale. Alcuni dati suggeriscono che il tratto neospinotalamico, che nei Primati si è accresciuto in modo relativamente rapido, potrebbe esercitare un'influenza frenante sull'attività delle componenti mediali del sistema anterolaterale, che sono le più antiche, proprio come si pensa che faccia il sistema lemniscale.
Bibliografia.
Adair, E. R., Stevens, J. C., Marks, L. E., Thermally induced pain, the dol scale and the psychophysical power law, in ‟American journal of psychology", 1968, LXXXI, pp. 147-164.
Adams, J. E., Naloxone reversal of analgesia produced by brain stimulation in the human, in ‟Pain", 1976, II, pp. 161-166.
Andersen, P., Andersson, S. A., Landgren, S., Some properties of the thalamic relay cells in the spino-cervical-lemniscal path, in ‟Acta physiologica scandinavica", 1966, LXVIII, pp. 72-83.
Andersen, P., Eccles, J. C., Schmidt, R. F., Yokota, T., Depolarization of presynaptic fibers in the cuneate nucleus, in ‟Journal of neurophysiology", 1964, XXVII, pp. 92-106.
Andersen, P., Eccles, J. C., Schmidt, R. F., Yokota, T., Identification of relay cells, in ‟Journal of neurophysiology", 1964, XXVII, pp. 1080-1095.
Andersen, P., Eccles, J. C., Sears, T. A., Cortically evoked depolarization of primary afferent fibers in the spinal cord, in ‟Journal of neurophysiology", 1964, XXVII, pp. 63-77.
Bertrand, G., Jasper, H., Wong, A., Mathews, G., Microelectrode recording during stereotactic surgery, in ‟Clinical neurosugery", 1969, XVI, pp. 328-355.
Bessou, P., Perl, E. P., Response of cutaneous sensory units with unmyelinated fibers to noxious stimuli, in ‟Journal of neurophysiology", 1969, XXXII, pp. 1025-1043.
Biemond, A., The conduction of pain above the level of the thalasmus opticus, in ‟Archives of neurology and psychiatry", 1956, LXXV, pp. 231-244.
Blix, M., Experimentelle Beiträge zur Lösung der Frage über die specifische Energie der Hauptnerven, in ‟Zeitschrift für Biologie", 1884, XX, pp. 141-156.
Boyd, I. A., Roberts, T. D. M., Proprioceptive discharges from stretch-receptors in the knee joint of the cat, in ‟Journal of physiology", 1953, CXII, pp. 38-58.
Browne, K., Lee, J., Ring, P. A., The sensation of passive movement at the metatarso-phalangeal joint of the great toe in man, in ‟Journal of physiology", 1954, CXXVI, pp. 448-458.
Burton, H., Jones, E. G., The posterior thalamic region and its cortical projection in new world and old world monkeys, in ‟Journal of comparative neurology", 1976, CLXVIII, pp. 249-302.
Carmon, A., Stimulus contrast in tactile resolution, in ‟Perception & psychophysics", 1968, III, pp. 241-245.
Carreras, M., Andersson, S. A., Functional properties of neurons of the anterior ectosylvian gyrus of the cat, in ‟Journal of neurophysiology", 1963, XXVI, pp. 100-126.
Chapman, L. G., Dingman, H. F., Ginsberg, S. P., Failure of analgesic agents to alter the absolute sensory threshold for the simple detection of pain, in ‟Brain", 1965, LXXXVIII, pp. 1011-1022.
Chapman, L. F., Ramos, A.O., Goodell, H., Wolff, H. G., Neurohumoral features of afferent fibers in man. Their role in vasodilatation, inflammation and pain, in ‟Archives of neurology", 1961, IV, pp. 617-650.
Christensen, B. N., Perl, E. R., Spinal neurons specifically excited by noxious or thermal stimuli: marginal zone of the dorsal horn, in ‟Journal of neurophysiology", 1970, XXXIII, pp. 293-307.
Clark, W. C., Pain sensitivity and the report of pain: an introduction to sensory decision theory, in ‟Anesthesiology", 1974, XL, pp. 272-287.
Clark, W. C., Hall, W., Yang, J., Changes in pain discriminability and pain report criterion after acupunctural or transcutaneous electrical stimulation, in Advances in pain research and therapy (a cura di J. J. Bonica e D. Albe-Fessard), vol. I, New York 1976, pp. 769-773.
Cohen, L. A., Analysis of position sense in human shoulder, in ‟Journal of neurophysiology", 1958, XXI, pp. 550-562.
Collins, W. F. Jr., Nelsen, F. E., Randt, C. T., Relation of peripheral nerve fiber size and sensation in man, in ‟Archives of neurology", 1960, III, pp. 381-385.
Collins, W. F. Jr., Nelsen, F. E., Shealy, C. N., Electrophysiological studies of peripheral and central pathways conducting pain, in Pain (a cura di R. S. Knighton e P. R. Dumke), Boston 1966, pp. 33-46.
Colonnier, M. L., Structural design of the neocortex, in Brain and conscious experience (a cura di J. C. Eccles), New York 1966, pp. 1-23.
Corkin, S., Milner, B., Rasmussen, T., Effects of different cortical excisions on sensory thresholds in man, in ‟Transactions of the American Neurological Association", 1964, LXXXIX, pp. 112-116.
Critchley, M., Tactual thought with special reference to the blind, in ‟Brain", 1953, LXXVI, pp. 19-53.
Critchley, M., The parietal lobe, New York 1969.
Darian-Smith, I., Johnson, K. O., Dykes, R., The ‛cold' fiber population innervating palmar and digital skin of the monkey: responses to cooling pulses, in ‟Journal of neurophysiology", 1973, XXXVI, pp. 325-346.
Déjerine, J., Roussy, G., La syndrome thalamique, in ‟Revue neurologique", 1906, XIV, pp. 521-532.
Denny-Brown, D., The release of deep pain by nerve injury, in ‟Brain", 1965, LXXXVIII, pp. 725-738.
Denny-Brown, D., Banker, B., Amorphosynthesis from left parietal lesion, in ‟Archives of neurology and psychiatry", 1954, LXXI, pp. 302-313.
Edwards, S. B., De Olmus, J. S., Autoradiographic studies of the projections of the midbrain reticular formation: ascending projections of nucleus cuneiformis, in ‟Journal of comparative neurology", 1976, CLXV, pp. 417-432.
Ettlinger, G., Kalsbeck, E. J., Changes in tactile discrimination and in visual reaching after successive and simultaneous bilateral posterior parietal ablations in the monkey, in ‟Journal of neurology and psychiatry", 1962, XXV, pp. 256-268.
Euler, U. S. von, Gaddum, J. H., An unidentified depressor substance in certain tissue extracts, in ‟Journal of physiology", 1931, LXXII, pp. 74-87.
Eyzaguirre, C., Kuffler, S. W., Processes of excitation in the dendrites and in the soma of single isolated sensory nerve cells of the lobster and crayfish, in ‟Journal of general physiology", 1955, XXXIX, pp. 87-119.
Fennell, E., Paul, S., Rise, R., Laterality differences in the perception of pressure, in ‟Journal of neurology, neurosurgery and psychiatry", 1967, XXX, pp. 337-340.
Fields, H. L., Basbaum, A. I., Brainstem control of spinal pain transmission neurons, in ‟Annual review of physiology", 1978, XL, pp. 217-248.
Foerster, O., Die Leitungsbahnen des Schmerzegefühls und die chirurgische Behandlung der Schmerzzustande, Berlin 1927.
Gasser, H. S., Conduction in nerves in relation to fiber types, in ‟Research publications. Association for Research in Nervous and Mental Diseases", 1934, XV, pp. 35-59.
Gerstein, G. L., Functional association of neurons: detection and interpretation, in The neurosciences. Second study program (a cura di F. O. Schmitt), New York 1970.
Gilman, S., Denny-Brown, D., Disorders of movement and behavior following dorsal column lesions, in ‟Brain", 1966, LXXXIX, pp. 397-417.
Glees, P., Soler, J., Fibre content of the posterior column and synaptic connection of nucleus gracilis, in ‟Zeitschrift für Zellforschung und mikroskopische Anatomie", 1951, XXXVI, pp. 381-400.
Goodwin, G. M., McClosky, D. I., Matthews, P. B., The proprioceptive illusion induced by muscle vibration: contribution of muscle spindles to perception, in ‟Science", 1972,pp. 1382-1384.
Green, L.C., Hardy, J. C., Adaptation of thermal pain in the skin, in ‟Journal of applied physiology", 1962, XVII, pp. 693-696.
Grigg, P., Finerman, G. A., Riley, L. H., Joint position sense after total hip replacement, in ‟Orthopedic Research Society", gennaio 1972.
Guillemin, R., Ling, N., Burgus, R., Bloom, F. E., segal, D., Characterization of the endorphins,novel hypothalamic and neurohypophyseal peptides with opiate-like activity. Evidence that they induce profound behavioral changes, in ‟Psychoneuroendocrinology", 1977, II, pp. 59-62.
Hardy, J. D., Wolff, H. G., Goodell, H., Pain sensations and reactions, Baltimore 1952, cap. 11.
Harrington, R., Merzenich, M.M., Neural coding in the sense of touch: human sensations of skin indentation compared with the responses of slowly adapting mechanoreceptive afferents innervating the hairy skin of monkeys, in ‟Experimental brain research", 1970, X, pp. 251-264.
Hassler, R., Thalamic regulation of muscle tone and speed of movement, in The talamus (a cura di D.P. Purpura e M. D. Yahr), New York 1966, pp. 419-436.
Hecaen, H., Penfield, W., Bertrand, C., Malmo, R., The syndrome of apractognosia due to lesions of the minor cerebral hemisphere, in ‟Archives of neurology and psychiatry", 1956, LXXV, pp. 400-434.
Henson, R. A., Henry Head's work on sensation, in ‟Brain", 1961, LXXXIV, pp. 535-550.
Hökfelt, T., Ljungdahl, A., Terrenius, L., L. Elde, R., Nilsson, G., Immunohistochemical studies on the localiation and distribution of substance P in cat primary sensory neurons, in ‟Brain research", 1975, C, pp. 235-252.
Hökfelt, T., Ljungdahl, A., Terrenius, L., Elde, R., Nilsson, G., Immunohistochemical analysis of peptide pathways possibly related to pain and analgesia: enkephalin and substance P, in ‟Proceedings of the National Academy of Sciences", 1977, LXXIV, pp. 3081-3085.
Hubbard, S. J., A study of rapid mechanical, events in a mechanoreceptor, in ‟Journal of physiology", 1958, CXLI, pp. 198-218.
Hughes, J., Isolation of an endogenous compound from the brain with pharmacological properties similar to morphine, in ‟Brain research", 1975, LXXXVIII, pp. 295-308.
Hughes, J., Smith, R. W., Kosterlitz, H. W., Fothergill, L. A., Morgan, B. A., Morris, H. R., Identification of two related pentapeptides from the brain with potent opiate agonist activity, in ‟Nature", 1975, CCLVIII, pp. 577-579.
Husmark, I., Ottoson, D., Relation between tension and sensory response in the isolated frog muscle spindle during stretch, in ‟Acta physiologica scandinavica", 1970, LXXIX, pp. 321-334.
Husmark, I., Ottoson, D., The contribution of mechanical factors to the early adaptation of the spindle response, in ‟Journal of physiology", 1971, CCXII, pp. 577-592.
Iggo, A., Non-myelinated visceral muscular and cutaneous afferent fibres and pain, in The assessment of pain in man and animals (a cura di C. A. Keele e R. Smith), Edinburgh 1962, pp. 74-87.
Iversen, L. L., Nicoll, R. A., Vale, W. W., Neurobiology of peptides, in ‟Neuroscience research program. Bulletin", 1978, XVI, p. 2.
Jasper, H. H., Bertrand, G., Thalamic units involved in somatic sensation and voluntary and involuntury movements in man, in The thalamus (a cura di D. P. Purpura e M. D. Yahr), New York-London 1966, pp. 365-390.
Jones, E. G., Coulter, J. D., Hendry, S. H. C., Intracortical connectivity of architectonic fields in the somatic sensory, motor and parietal cortex of monkeys, in ‟Journal of comparative neurology", 1978, CLXXX, pp. 291-347.
Jones, E. G., Powell, T. P. S., An electron microscopic study of the mode of termination of cortico-thalamic fibres within the sensory relay nuclei of the thalamus, in ‟Proceedings of the Royal Society" (Series B), 1969, CLXXII, pp. 173-185.
Jones, E. G., Powell, T. P. S., Connexions of the somatic sensory cortex of the rhesus monkey. I. Ipsilateral connexions, in ‟Brain", 1969, XCII, pp. 477-502.
Jones, E. G., Powell, T. P. S., Connexions of the somatic sensory cortex of the rhesus monkey. II. Controlateral connexions, in ‟Brain", 1969, XCII, pp. 717-730.
Jones, E. G., Powell, T. P. S., Connexions of the somatic sensory cortex of the rhesus monkey. III. Thalamic connexions, in ‟Brain", 1970, XCIII, pp. 37-56.
Jones, E. G., Powell, T. P. S., An anatomical study of converging sensory pathways within the cerebral cortex of the monkey, in ‟Brain", 1970, XCIII, pp. 793-820.
Katz, B., Depolarization of sensory terminals and the initiation of impulses in the muscle spindle, in ‟Journal of physiology", 1950, CXI, pp. 261-282.
Kerr, F. W. L., Neuroanatomical substrates of nociception in the spinal cord, in ‟Pain", 1975, I, pp. 325-356.
Kerr, F. W. L., Casey, K., Pain, in ‟Neuroscience research program. Bulletin", 1978, XVI, p. 1.
Kesten, W., Die Grenzen der haptischen Leitungsfähigkeit, in ‟Zeitschrift für Biologie", 1956, CIX, pp. 24-40.
Kidd, C., Oswaldo-Cruz, E.,??? Unpublished observations, The Johns Hopkins University School of Medicine, 1963.
Klee, W. A., Endogenous opiate peptides, in Peptides in neurobiology (a cura di H. Gainer), New York 1977, pp. 375-396.
Kuffler, S. W., Excitation and inhibition in single nerve cells, in ‟The Harvey lectures", 1958-1959, pp. 176-219.
Kumazawa, T., Perl, E. R., Excitation of marginal and substantia gelatinosa neurons in the Primate spinal cord: indications of their place in dorsal horn functional organization, in ‟Journal of comparative neurology", 1978, CLXXVII, pp. 417-434.
Kuypers, H. G. J. M., Tuerk, J. D., The distribution of cortical fibres within the nuclei cuneatus and gracilis in the cat, in ‟Journal of anatomy", 1964, XCVIII, pp. 143-162.
LaMotte, R. H., Mountcastle, V. B., The effects of removal of postcentral cortex upon the monkey's capacity for detection and frequency discrimination of mechanical sinusoids delivered to the hand, 1979.
LaMotte, C., Pert, C. B., Snyder, S. H., Opiate receptor binding in Primate spinal cord: distribution and changes after dorsal root section, in ‟Brain research", 1976, CXII, pp. 407-412.
Landau, W., Bishop, G. H., Pain from dermal, periosteal and fascial endings and from inflammation, in ‟Archives of neurology and psychiatry", 1958, LXIX, pp. 490-504.
Lewis, T., Pain, New York-London 1942.
Lewis, T., Pickering, G. W., Rothschild, P., Centripetal paralysis arising out of arrested bloodflow to the limbs, in ‟Heart", 1931, XVI, p. 1.
Lim, R. J. S., Pain, in ‟Annual review of physiology", 1970, XXXII, pp. 269-288.
Lippman, H. H., Kerr, F. W. L., Light and electron microscopic study of crossed ascending pathways in the anterolateral funiculus in monkey, in ‟Brain research", 1972, XL, pp. 496-499.
Lippold, O. C. J., Nicholls, J. G., Redfearn, J. W. T., Electrical and mechanical factors in the adaptation of a mammalian muscle spindle, in ‟Journal of physiology", 1960, CLIII, pp. 209-217.
Loe, P. R., Whitsel, B. L., Dreyer, D. A., Metz, C. B., Body representation in ventrobasal thalamus of macaque: a single-unit analysis, in ‟Journal of neurophysiology", 1977, XL, pp. 1339-1355.
Loewenstein, W.R., On the ‛specificity' of a sensory receptor, in ‟Journal of neurophysiology", 1961, XXIV, pp. 150-158.
Loewenstein, W. R., Rate sensitivity of a biological transducer, in ‟Annals of the New York Academy of Sciences", 1969, CLVI, pp. 892-900.
Loewenstein, W. R., Mechano-electric transduction in the Pacinian corpuscle. Initiation of sensory impulses in mechanoreceptors, in handbook of sensory physiology, vol. I, Principles of receptor physiology (a cura di W. R. Loewenstein), New York 1971, pp. 269-290.
Loewenstein, W. R., Mendelson, M., Components of receptor adaptation in a Pacinian corpuscle, in ‟Journal of physiology", 1965, CLXXVII, pp. 377-397.
Loh, H. H., Tseng, L. F., Wei, E., Li, C. H., β-Endorphin is a potent analgesic agent, in ‟Proceedings of the National Academy of Sciences", 1976, LXXIII, pp. 2895-2898.
Long, D. M., Erickson, D. E., Stimulation of the posterior columns of the spinal cord for relief of intractable pain, in ‟Surgical neurology", 1975, I, pp. 134-141.
Long, D. M., Hagfors, N., Electrical stimulation in the nervous system: the currents tatus of electrical stimulation of the nervous system for the relief of pain, in ‟Pain", 1975, I, pp. 109-123.
Lorento de Nó, R., Cerebral cortex, architecture, intracortical connections, motor projections, in Physiology of the nervous system, New York-London 19493, cap. 15.
Lucier, G. E., Ruegg, D. C., Wiesendanger, M., Responses of neurones in motor cortex and in area 3 to controlled stretches of forelimb muscles in cebus monkeys, in ‟Journal of physiology", 1975, CCLI, pp. 833 ss.
Mayer, D. J., Price, D. D., Central nervous system mechanisms of analgesia, in ‟Pain", 1976, II, pp. 379-404.
Mehler, W. R., The anatomy of the so-called ‛pain tract' in man: an analysis of the course and distribution of the ascending fibers of the fasciculus anterolateralis, in Basic research in paraplegia (a cura di J. D. French e R.W. Porter), Springfield, Ill., 1962.
Merton, P. A., Human position sense and the sense of effort, in ‟Symposia of the Society for Experimental Biology", 1964, XVIII, pp. 387-400.
Merzenich, M. M., Kaas, J. H., Sur, M., Lin, C. S., Double representation of the body surface within cytoarchitectonic areas 3b and I in SI' in the owl monkey (Aotus trivirgatus), in ‟Journal of comparative neurology", 1978, CLXXXI, pp. 41-74.
Messing, R. B., Lytle, L. D., Serotonin-contaiing neurons: their possible role in pain and analgesia, in ‟Pain", 1977, IV, pp. 1-21.
Miller, M. R., Ralston, J. H., Kasahara, M., The pattern of cutaneous innervation of the human hand, foot and breast, in advances in the biology of the skin (a cura di W. Montagna), vol. I, Cutaneous innervation, London 1960, pp. 1-47.
Moffet, A., Ettlinger, G., Morton, H. B., Piercy, M. F., Tactile discrimination performance in the monkey: the effect of ablation of various subdivisions of posterior parietal cortex, in ‟Cortex", 1967, III, pp. 59-96.
Mountcastle, V. B., Modality and topographic properties of single neurons of cat's somatic sensory cortex, in ‟Journal of neurophysiology", 1957, XX, pp. 408-434.
Mountcastle, V. B., The problem of sensing and the neural coding of sensory events, in The neurosciences. A study program (a cura di G. C. Quarton, T. Melnechuck e F. O. Schmitt), New York 1967, pp. 393-407.
Mountcastle, V. B., An organizing principle for cerebral function: the unit module and the distributed system, in The mindful brain: cortical organization and the group-selective theory of higher brain function (a cura di G. M. Edelman e V. B. Mountcastle), Cambridge, Mass., 1978.
Mountcastle, V. B., Carli, G., LaMotte, R. H., Central neural mechanisms in the detection of peripheral events: simultaneous measurement of behavioral thresholds in monkeys and activity evoked in postcentral neurons by the stimuli detected, in ‟Journal of neurophysiology", 1972, XXXV, pp. 122-136.
Mountcastle, V. B., Henneman, E., The representation of tactile sensibility in the thalamus of the monkey, in ‟Journal of comaprative neurology", 1952, XCVII, pp. 409-431.
Mountcastle, V. B., Poggio, G. F., Werner, G., The relation of thalamic cell response to peripheral stimuli varied over an intensive continuum, in ‟Journal of neurophysiology", 1963, XXVI, pp. 807-834.
Mountcastle, V. B., Poggio, G. F., Werner, G., The neural transformation of the sensory stimulus at the cortical input level of the somatic afferent system, in Information processing in the nervous system (a cura di R. Gerard), Amsterdam 1964, pp. 196-217.
Mountcastle, V. B., Powell, T. P. S., Central nervous mechanisms subserving position sense and kinesthesis, in ‟Bulletin of the Johns Hopkins Hospital", 1959, CV, pp. 173-200.
Mountcastle, V. B., Powell, T. P. S., Neural mechanisms subserving cutaneous sensibility with special reference to the role of afferent inhibition in sensory perception and discrimination, in ‟Bulletin of the Johs Hopkins Hospital", 1959, CV, pp. 201-232.
Mountcastle, V. B., Talbot, W. H., Kornhuber, H. H., The neural transformation of mechanical stimuli delivered to the monkey's hand, in Ciba Foundation Symposium on touch, heat and pain (a cura di A. V. S. de Reuck e J. Knight), London 1966, pp. 325-351.
Mountcastle, V. B., Talbot, W. H., Sakata, H., Hyvarinen, J., Cortical neuronal mechanisms in flutter-vibration studied in unanesthetized monkeys. Neuronal periodicity and frequency discrimination, in ‟Journal of neurophysiology", 1969, XXXII, pp. 452-484.
Narotzky, R. A., Kerr, F. W. L., Marginal neurons of the spinal cord, in ‟Brain research", 1978, CXXXIX, pp. 1-20.
Nashold, B. S. Jr., Wilson, W. P., Slaughter, D. G., Sensations evoked by stimulation in the midbrain of man, in ‟Journal of neurosurgery", 1969, XXX, pp. 14-24.
Olgard, L., Hökfelt, T., Nilsson, G., Pernow", B., Localization of substance P-like immunoreactivity in enrves in the tooth pulp, in ‟Pain", 1977, IV, pp. 153-159.
Ottoson, D., Shepherd, G. M., Transducer properties and integrative mechanisms of the frog's muscle spindle, in Handbook of sensory physiology, vol. I, Principles of receptor physiology (a cura di W. R. Loewenstein), New York 1971, pp. 442-499.
Paul, R. L., Goodman, H., Merzenich, M. M., Alterations in mechanoreceptor input to Brodmann's areas 1 and 3 of the postcentral hand area of macaca mulatta after nerve section and regeneration, in ‟Brain research", 1972, XXXIX, pp. 1-19.
Penfield, W., Jasper, H., Epilepsy and the functional anatomy of the human brain, Boston 1954.
Perkel, D. H., Spike trains as carriers of information, in The neurosciences. Second study program (a cura di F. O. Schmitt), New York 1970.
Perkel, D. H., Bullock, T. H., Neural coding, in Neurosciences research symposium summaries, vol. III (a cura di F. O. Schmitt, T. Melnechuk, G. Adelman e F. G. Worden), Boston 1969, pp. 404-529.
Perl, E. R., Myelinated afferent fibres innervating the Primate skin and their response to noxious stimuli, in ‟Journal of physiology", 1968, CXCVII, pp. 593-615.
Perl, E. R., Whitlock, D. G., Somatic stimuli exciting spinothalamic projections to thalamic neurons in cat and monkeys, in ‟Experimental neurology", 1961, III, pp. 256-296.
Phillips, C. G., Powell, D. G., Somatic stimuli exciting spinothalamic projections to thalamic neurons in cat and monkey, in ‟Experimental neurology", 1961, pp. 256-296.
Phillips, C. G., Powell, T. P. S., Wiesendanger, M., Projection from low-threshold muscle afferents of hand and forearm to area 3a of baboon's cortex, in ‟Journal of physiology", 1971, CCXVII, pp. 419-447.
Poggio, G. F., Mountcastle, V. B., A study of the functional contributions of the lemniscal and spinothalamic systems to somatic sensibility. Central nervous mechanisms in pain, in ‟Bulletin of the Johns Hopkins Hospital", 1960, CVI, pp. 266-316.
Poggio, G. F., Mountcastle, V. B., The functional properties of ventrobasal thalamic neurons studied in unanesthetized monkeys, in ‟Journal of neurophysiology", 1963, XXVI, pp. 775-806.
Powell, T. P.S., Mountcastle, V. B., Some aspects of the functional organization of the cortex of the postcentral gyrus of the monkey: a correlation of findings obtained in a single unit analysis with cytoarchitecture, in ‟Bulletin of the Johns Hopkins Hospital", 1959, CV, pp. 133-162.
Provins, K. A., The effect of peripheral nerve block on the appreciation and execution of finger movements, in ‟Journal of physiology", 1958, CXLIII, pp. 55---67.
Ralston, H. J. III, The fine structure of neurons in the dorsal horn of the cat spinal cord, in ‟Journal of comparative neurology", 1968, CXXXII, pp. 275-302.
Randic, M., Miletic, V., Effect of substance P in cat dorsal horn neurones activated by noxious stimuli, in ‟Brain research", 1977, CXXVIII, pp. 164-169.
Rexed, B., The cytoarchitectonic atlas of the spinal cord of the cat, in ‟Journal of comparative neurology", 1954, C, pp. 297-380.
Sato, M., Response of Pacinian corpuscles to sinusoidal vibration, in ‟Journal of physiology", 1961, CLIX, pp. 391-409.
Segundo, J. P., Communication and coding by nerve cells, in The neurosciences. Second study program (a cura di F. O. Schmitt), New York 1970, pp. 569-587.
Sperry, R. W., Mental unity following surgical disconnection of the cerebral hemispheres, in ‟The Harvey lectures, 1968, LXII, pp. 293-323.
Stevens, S. S., Neural events and the psychophysical law, in ‟Science", 1970, CLXX, pp. 1043-1050.
Sur, M., Nelson, R. J., Kaas, J. H., Postcentral somatosensory cortex in macaque monkeys: multiple body representations and neuron properties, in ‟Neuroscience abstracts", 1978, VIII, pp. 559 ss.
Sweet, W. H., White, J. C., Selverston, B., Nilges, R. G., Sensory responses from anterior roots and from surface and interior of spinal cord in man, in ‟Transactions of the American Neurological Association", 1950, LXXV, pp. 165-169.
Szentághothai, J., Neuronal and synaptic arrangements in the substantia gelatinosa Rolandi, in ‟Journal of comparative neurology", 1964, CXXII, pp. 219-232.
Talairach, J., Tournaux, P., Bancaud, J., Chirurgie pariétale de la douleur, in ‟Acta neurochirurgica", 1960, VIII, pp. 153-250.
Talbot, W. H., Darian-Smith, I., Kornhuber, H. H., Mountcastle, V. B., The sense of flutter-vibration: comparison of the human capacity with response patterns of mechanoreceptive afferents from the monkey hand, in ‟Journal of neurophysiology", 1968, XXXI, pp. 301-334.
Teorell, R., A biophysical analysis of mechano-electrical transduction, in Handbook of sensory physiology, vol. I, Principles of receptor physiology (a cura di W. R. Loewenstein), New York 1971.
Terzuolo, C. A., Knox, C. K., Static and dynamic behavior of the stretch receptor organ of crustacea, in Handbook of sensory physiology, vol. I, Principles of receptor physiology (a cura di W. R. Loewenstein), New York 1971, pp. 500-522.
Terzuolo, C. A., Washizu, Y., Relation between stimulus strenght, generator potential and impulse frequency in stretch receptor of crustacea, in ‟Journal of neurophysiology", 1962, XXV, pp. 56-66.
Towe, A. L., Jabbur, S. J., Cortical inhibition of neurons in dorsal column nuclei of cat, in ‟Journal of neurophysiology", 1961, XXIV, pp. 488-498.
Truex, R. C., Taylor, M. J., Smythe, M. Q., Gildenberg, P. L., The lateral cervical nucleus of cat, dog and man, in ‟Journal of comparative neurology", 1970, CXXXIX, pp. 93-98.
Verrillo, R. T., Fraioli, A. J., Smith, R. L., Sensation magnitude of vibrotactile stimuli, in ‟Perception & psychophysics", 1969, VI, pp. 366-372.
Wagman, I. H., Price, D. B., Responses of dorsl horn cells of M. mulatta to cutaneous and sural nerve A and C fiber stimuli, in ‟Journal of neurophysiology", 1969, XXXII, pp. 803-817.
Weinstein, S., Intensive and extensive aspects of tactile sensitivty as a function of body part, sex and laterality, in The skin senses (a cura di D. R. Kenshalo), Springfield, Ill., 1968.
Werner, G., The topology of the body representation in the somatic afferent pathway, in The neurosciences. Second study program (a cura di F. O. Schmitt), New York 1970.
Werner, G., Mountcastle, V. B., Neural activity in mechanoreceptive afferents: stimulus-response relations, Weber functions and information transmission, in ‟Journal of neurophysiology", 1965, XXVIII, pp. 359-397.
Werner, G., Whitesel, B. L., The topology of dermatomal projection in the medial lemniscal system, in ‟Journal of physiology", 1967, CXCII, pp. 123-144.
Werner, G., Whitsel, B. L., The somatic sensory cortex: functional organization, in Handbook of sensory physiology, vol. II, The somatosensory system (a cura di A. Iggo), Berlin-New York 1973.
Werner, G., Whitsel, B. L., Petrucelli, L. M., Data structure and algorhythms in the Primate somatosensory cortex, in Brain and human behavior (a cura di J. Karczmer e J. C. Eccles), Heidelberg-New York 1971.
Whitsel, B. L., Dreyer, D. A., Comparison of single unit data obtained from the different topographic subdivisions of the postcentral gyrus of the macaque: implications for the organization of somatosensory pathways, in ‟Experimental brain research", 1976, suppl. 1, pp. 415-420.
Whitsel, B. L., Dreyer, D. A., Roppolo, J. R., Determinants of body representation in postcentral gyrus of macaques, in ‟Journal of neurophysiology", 1971, XXXIV, pp. 1018-1034.
Whitsel, B. l., Petrucelli, L. M., Ha, H., Dreyer, D. A., Modality representation and fibre sorting in the fasciculus gracilis of squirrel monkeys, in ‟Experimental neurology", 1970, XXIX, pp. 227-242.
Whitsel, B. L., Petrucelli, L. M., Sapiro, G., Modality representation in the lumbar and cervical fasciculus gracilis of squirrel monkeys, in ‟Brain research", 1969, XV, pp. 67-78.
Whitsel, B. L., Petrucelli, L. M., Werner, G., Syummetry and connectivity in the map of the body surface in somatosensory area II of Primates, in ‟Journal of neurophysiology", 1969, XXXII, pp. 170-183.
Willis, W. D., Haber, L. H., Martin, R. F., Inhibition of spinothalamic tract cells and interneurons by brainstem stimulation in the monkeys, in ‟Journal of neurophysiology", 1977, XL, pp. 968-981.
Woolsey, C. N., Organization of somatic sensory and motor areas of the cerebral cortex, in Biological and biochemical bases of behavior (a cura di H. F. Harlow e C. N. Woolsey), Madison 1958.
Yarsh, T. L., Rudy, T. A., Narcotic analgetics: CNS sites and mechanisms of action as revealed by intracerebral injection techniques, in ‟Pain", 1978, IV, pp. 299-359.