stress e adattamento
stress e adattamento
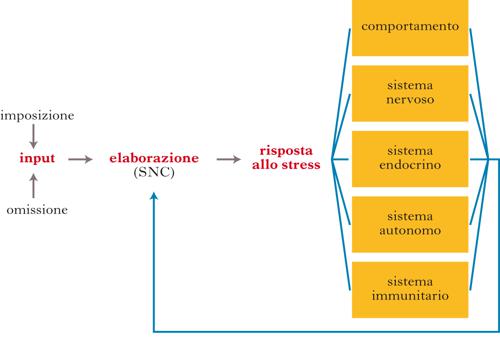
Numerose teorie sono state formulate negli anni per spiegare lo stress ma a tutt’oggi non esiste una definizione che sia universalmente valida e che riesca a descrivere appieno il fenomeno. L’elemento comune a tutti gli stimoli definiti stressanti è di natura psicologica o emozionale. La capacità di fronteggiare lo stress può variare da individuo a individuo sulla base delle esperienze e del patrimonio genetico, ed è definita coping. La risposta allo stress vede l’attivazione in parallelo di numerosi sistemi, quali quello endocrino, nervoso e immunitario. L’incapacità di fronteggiare eventi stressanti mediante adattamenti fisiologici può portare, nel tempo, a un carico allostatico, che rappresenta un fattore potenziale di rischio per molte patologie, incluse quelle psichiatriche. [➔ ambiente e cervello; emozioni; HPA; neurovegetativo, sistema; neurotrasmettitori; plasticità neurale] In termini generali, lo stress può essere definito come la risposta del sistema nervoso centrale a stimoli di natura ambigua, o che rappresentano una minaccia. Nonostante lo stress sia un concetto che fa parte dell’esperienza quotidiana della maggior parte degli individui, esso sfugge a una definizione universale. Una delle ragioni per cui è di difficile definizione è che la reazione allo stesso stimolo stressante può variare in base alle esperienze individuali e al patrimonio genetico. Lo stress è formato da tre componenti: uno stimolo (stressore), l’elaborazione dello stimolo da parte del cervello (stress vero e proprio) e il risultato dell’elaborazione (risposta allo stress). Quest’ultima vede l’attivazione in parallelo di numerosi sistemi, quali quello endocrino, nervoso e immunitario. L’incapacità a fronteggiare eventi stressanti mediante adattamenti fisiologici può rappresentare un fattore di rischio per molte patologie, incluse quelle psichiatriche.
Evoluzione del concetto di stress e adattamento
Hans Selye fu l’autore della prima e ormai famosa serie di esperimenti che hanno portato alla formulazione di una solida interpretazione dello stress, ossia la sindrome generale di adattamento. Egli descrisse una triade di risposte che implicava: coinvolgimento del sistema endocrino, con un aumento nella secrezione di adrenocorticotropina (ACTH, AdrenoCorticoTropic Hormone) dall’ipofisi e di corticosterone dalle ghiandole surrenali; aumento nell’attività del sistema nervoso autonomo, che si manifesta nelle ulcerazioni dello stomaco; attivazione del sistema immunitario (involuzione del timo). Inoltre, secondo Selye, queste risposte si manifestavano in maniera aspecifica in seguito a qualsiasi tipo di stimolazione, indipendentemente dalla natura dello stimolo stesso. Perciò, in accordo con quest’approccio lo stress venne identificato in base al tipo di risposta che è in grado di provocare. Un parziale superamento della teoria di Selye derivò dalle teorizzazioni di John W. Mason che enfatizzò il ruolo cruciale della componente emozionale provocata dallo stressore. È stato infatti successivamente dimostrato come la componente endocrina della risposta allo stress, l’asse ipotalamo- ipofisi-surrene (➔ HPA), rappresenti un indicatore sensibile dello stato di allerta dell’organismo e come perciò la sua risposta rifletta un’aumentata attivazione emozionale.
Stress e coping
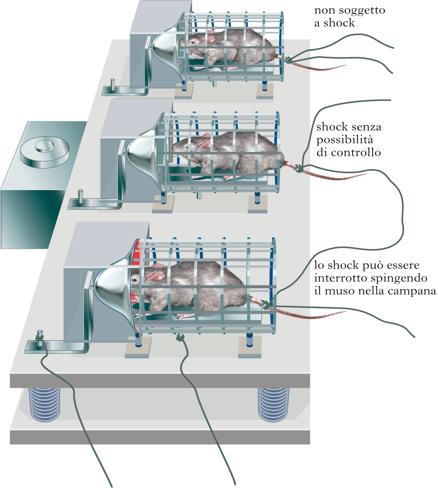
L’elenco degli stimoli potenzialmente stressanti, definiti appunto stressori, include sia quelli fisici (per es., la simulazione di un intervento chirurgico, l’emorragia, lo shock elettrico, il rumore intenso, l’iniezione di sostanze tossiche), sia quelli puramente psicologici (per es., la frustrazione, la separazione tra madre e prole, la separazione da gruppi di conspecifici, un aumento nella quantità di lavoro, la perdita degli affetti). John Mason e Seymour Levine, ampliando i concetti sviluppati in precedenza da Richard S. Lazarus, hanno affermato in diverse occasioni che l’elemento comune a tutti gli stimoli definiti stressanti è di natura psicologica o emozionale. Mason ha dimostrato che, se uno stimolo termico viene presentato improvvisamente, si ha un’attivazione dell’asse ipotalamo-ipofisi-surrene, mentre se il soggetto viene esposto allo stesso aumento di temperatura in maniera graduale non si assiste ad alcuna risposta. Da un punto di vista psicologico, si può ipotizzare che stimoli in grado di indurre stress mettano in evidenza l’assenza di quelle componenti critiche dell’ambiente che permettono all’organismo di ottenere una gratificazione o di evitare qualcosa di spiacevole. È dunque possibile classificare gli stimoli stressanti non solo in termini di manifestazione di un evento, ma anche di omissione o di assenza di componenti critiche dall’ambiente. Molti stimoli stressanti possono essere descritti in questo modo, per es. la frustrazione, la perdita della madre, la perdita del lavoro. Il concetto di coping deriva da evidenze sperimentali che dimostrano come tutto ciò che è in grado di ridurre l’incertezza determini la diminuzione o l’eliminazione di una o più risposte fisiologiche a un evento stressante. Il controllo fornisce all’organismo la capacità di eliminare, o almeno regolare, la durata e l’intensità dello stimolo. Il coping è definito dunque come una risposta con esito positivo, che si basa per lo più sulla riduzione degli indici patologici o fisiologici. L’incapacità al coping, e di conseguenza l’incapacità a registrare gli esiti positivi di una risposta, porta ad alti livelli di stress. Lo stabilirsi di risposte con esito positivo riduce l’attivazione fisiologica. Perciò, eventi puramente psicologici, quali l’assenza di informazione (novità), il non essere all’altezza delle aspettative, o l’omissione (frustrazione) di un rinforzo positivo precedentemente atteso, sembrano essere elementi critici in grado di provocare stress.
Risposta allo stress
La risposta allo stress dipende dall’elaborazione centrale dello stimolo operata dal cervello, che mette in moto una serie di eventi coordinati coinvolgendo il sistema nervoso, endocrino, immunitario, insieme ad adattamenti comportamentali. Tutte queste risposte hanno lo scopo di fronteggiare lo stimolo e riportare il sistema a un nuovo punto di equilibrio. Per fare solo alcuni esempi, i neuropeptidi, che rivestono un ruolo diretto nella regolazione del sistema ipotalamo-ipofisi-surrene, hanno anche la capacità di influenzare il sistema nervoso autonomo (SNA) o neurovegetativo e il comportamento. I principali neurotrasmettitori della famiglia delle catecolammine rispondono tutti agli stessi stimoli, sia pure ognuno in un modo diverso, e sono coinvolti in maniera diretta nella regolazione della secrezione endocrina. Ruolo dell’SNA nella riposta allo stress. Uno dei primi sistemi fisiologici di cui sia stato dimostrato il ruolo nella risposta allo stress è l’SNA, che ha il compito di regolare molte delle risposte periferiche associate allo stress. Il cervello modula l’azione dell’SNA tramite proiezioni neurali che dall’encefalo afferiscono al tronco encefalico, al midollo spinale e agli organi periferici. Il sistema nervoso autonomo è suddiviso in due sistemi apparentemente opposti: il sistema nervoso simpatico e quello parasimpatico. Il primo attiva molte delle risposte necessarie in una situazione di emergenza, quali i cambiamenti nella frequenza cardiaca, un incremento della sudorazione, variazioni nella conduttanza della pelle, un aumento della pressione sanguigna e della motilità gastrica, la secrezione di noradrenalina dalle terminazioni nervose simpatiche e di adrenalina dalla porzione midollare del surrene, funzionali a preparare il corpo a rispondere in modo appropriato a emergenze reali o percepite come tali. Queste risposte sono coinvolte nella reazione di combattimento o fuga (fight or flight) e, poiché vengono regolate da connessioni neuronali dirette, sono molto rapide e utilizzano come mediatori chimici la noradrenalina e l’adrenalina. Il sistema nervoso parasimpatico gioca in generale un ruolo opposto, mediando le attività vegetative. Per es., l’attivazione della componente parasimpatica del sistema nervoso autonomo, subito dopo un pasto abbondante, determina uno stato di calma e di letargia. L’ipofisi secerne la maggior parte degli ormoni peptidici che regolano la secrezione delle ghiandole periferiche. In partic., l’ormone ipofisario ACTH regola la secrezione di glucocorticoidi da parte della ghiandola surrenale. Il tipo di glucocorticoide che viene secreto da tale ghiandola varia nelle diverse specie: nei roditori, il glucocorticoide principale è il corticosterone, mentre nei canidi, nei primati e nell’uomo il più potente è il cortisolo. L’ACTH e i glucorticoidi surrenalici sono considerati i principali ormoni dello stress. Nel 1948 Geoffrey W. Harris presentò una teoria che avrebbe rivoluzionato il mondo dell’endocrinologia: egli postulò che l’attività dell’ipofisi fosse regolata da peptidi sintetizzati e immagazzinati nel cervello e rilasciati e trasportati attraverso i vasi portali, che mettono in connessione anatomica l’ipofisi con il cervello. Ricerche successive hanno effettivamente dimostrato che l’ipotalamo produce un insieme di fattori, sia di rilascio sia inibitori, che regolano l’attività dell’ipofisi, la quale, a sua volta, controlla la secrezione delle ghiandole periferiche. In alcuni casi il cervello blocca il rilascio di un ormone ipofisario mediante un singolo fattore inibitore; più spesso, gli ormoni ipofisari sono regolati dall’azione coordinata sia di fattori di rilascio sia di fattori inibitori. Inoltre, la secrezione dell’ormone di rilascio della corticotropina o CRH (Corticotropin Releasing Hormone), uno dei fattori di rilascio ipotalamici più critici coinvolto nella risposta allo stress, dipende da una vasta gamma di stimoli afferenti da altre strutture nervose. Gli impulsi nervosi che arrivano all’ipotalamo liberano il CRH nel sistema portale, via attraverso cui esso raggiunge l’ipofisi, dove agisce aumentando la sintesi e la secrezione di ACTH che, a sua volta, stimola le cellule della corteccia surrenale a sintetizzare e rilasciare i glucorticoidi nel circolo sanguigno. Questi ultimi, insieme alle secrezioni del sistema simpatico, sono responsabili della maggior parte degli eventi che si susseguono nel corpo in seguito a stress. Come nel caso di molti processi fisiologici, esistono alcuni meccanismi in grado di inibire questa cascata di eventi. Il meccanismo principale è costituito dalla capacità del corticosterone, o del cortisolo, di inibire la secrezione di CRH e di ACTH agendo con un meccanismo di feedback negativo su alcune strutture del sistema nervoso centrale, quali l’ippocampo, l’ipotalamo e l’ipofisi stessa. Sebbene gli ormoni precedentemente menzionati siano i maggiori responsabili della risposta allo stress, le dinamiche della risposta possono variare a seconda del tipo di stimolo o della sua intensità. Diversamente dall’attivazione acuta, infatti, la presentazione cronica di stimoli in grado di provocare stress modifica il pattern degli ormoni rilasciati. In altre parole, diversi stimoli producono una diversa ‘firma ormonale’, specifica per quello stimolo stesso, e che può anche differire in soggetti diversi. Stress e sistema immunitario. I prodotti del sistema immunitario possono, dalla periferia, attivare alcuni meccanismi nervosi. L’esempio più evidente di questo processo è rappresentato dalla relazione tra le citochine e il rilascio di ACTH. Le risposte allo stress da parte dei sistemi nervoso centrale, endocrino e immunitario forniscono un esempio di risposta integrata. Esiste una vasta letteratura clinica che documenta come lo stress cronico possa avere profonde ripercussioni sulla salute, ma nonostante alcuni risultati interessanti, rimane ancora poco chiaro quanto lo stress, e in partic. lo stress cronico, renda un individuo più vulnerabile a malattie che, in circostanze normali, sarebbero efficacemente combattute. In accordo alla concezione di Selye dell’’esaurimento nervoso’ (exhaustion) come disordine dell’adattamento, viene ora riconosciuto che l’incapacità a produrre risposte di coping, o il mantenimento della risposta allo stress nel tempo (giorni o settimane), può produrre una situazione di carico allostatico (condizione di alterata attività fisiologica) che può favorire l’insorgenza di alcune patologie, quali la sindrome metabolica.
Differenze individuali nelle risposte allo stress e predisposizione alle patologie psichiatriche
Eventi stressanti sperimentati dopo la nascita sono in grado di influenzare in maniera determinante le differenze individuali nella vulnerabilità allo sviluppo di malattie nell’arco della vita. L’aver subito abusi fisici o sessuali, che spesso si associano a condizioni persistenti di vuoto affettivo o di conflitto familiare, può compromettere l’accrescimento o lo sviluppo intellettivo del bambino e comportare da adulto un maggiore rischio di sviluppare patologie connesse con lo stress, quali l’obesità e i disturbi dell’umore. Durante i primi anni di vita il cervello è attivamente alla ricerca di esperienze, ed è provvisto di una considerevole plasticità. È stato ipotizzato che una condizione di stress precoce persistente possa influenzare negativamente la maturazione di quelle strutture o processi – come il sistema corticolimbico e la risposta ormonale allo stress – che sono alla base delle risposte emozionali e il cui sviluppo dipende dalle situazioni esperienziali. Il risultato finale è quello di un individuo che mostra una più elevata risposta a situazioni stressanti nella vita adulta. I pazienti depressi che hanno alle spalle una storia di abuso infantile sono effettivamente caratterizzati da un’iperattività dell’asse ipotalamo-ipofisisurrene. Inoltre, l’abuso o la mancanza di cure durante l’infanzia è stato messo in relazione con la presenza di varie anomalie nelle regioni cerebrali che risultano coinvolte nei disturbi emozionali, tra cui una riduzione generalizzata del volume dell’ippocampo, del corpo calloso e della corteccia prefrontale, un’alterazione della simmetria corticale in determinate aree, e una ridotta densità e integrità neuronale in altre. Al fine di spiegare l’insorgenza della psicopatologia in età adulta è stato proposto il modello diatesi-stress, secondo il quale è l’interazione tra una vulnerabilità o predisposizione genetica (diatesi) e l’ambiente, inclusi gli eventi avversi che si verificano nella vita dell’individuo (i cosiddetti stressori), a indurre determinati comportamenti o disturbi psicologici. Una delle teorie più accreditate per spiegare le patologie psichiatriche si basa su un modello per così dire ‘a due colpi’, in cui i fattori genetici e quelli ambientali interferiscono precocemente con lo sviluppo dell’SNC producendo in tal modo una vulnerabilità a lungo termine a causa della quale il sopraggiungere di un ‘secondo colpo’, sia esso un lutto, una separazione o una malattia cronica, può facilmente produrre sintomi di tipo psichiatrico. I meccanismi coinvolti nella differenziazione cellulare potrebbero costituire il principale bersaglio sia del primo colpo, quello che arriva nelle fasi precoci dello sviluppo, sia – dal momento che tali meccanismi intervengono anche più tardivamente nel mantenimento e nella plasticità neuronale – del secondo colpo, quello che viene inferto al cervello adolescente o adulto. In questo senso risultano perfettamente integrati i fattori genetici, evolutivi e ambientali, responsabili della vulnerabilità e dell’eziopatogenesi dei disturbi psichiatrici. Le differenze individuali nella risposta allo stress possono anche dipendere dal contesto in cui lo stimolo capace di indurre stress viene presentato. Nell’uomo, è stato dimostrato che la presenza di un supporto sociale può aumentare sostanzialmente la resilienza nei confronti di alcuni stressori.
Emozioni e sistema immunitario
Negli ultimi decenni si è assistito all’emergere di una disciplina interamente nuova, il cui nome è ancora in via di definizione, ma cui ci si può riferire come psiconeuroendocrinoimmunologia (➔). I primi passi che hanno contribuito a rompere le barriere che separavano l’immunologia dalla neuroendocrinologia e dalle neuroscienze sono stati compiuti dagli immunologi russi, seguiti poi da altri scienziati (tra cui Robert Ader e Hugo Besedovsky) appartenenti alle più diverse discipline, quali la psicologia sperimentale o l’endocrinologia. Alla fine degli anni Ottanta del 20° sec. un gran numero di ricerche ha avuto come obiettivo lo studio delle interazioni tra il sistema nervoso e quello immunitario. I risultati di questi studi hanno dimostrato che esiste una comunicazione bidirezionale tra questi due sistemi, di cui sono responsabili messaggeri chimici prodotti dalle cellule immunitarie (linfociti B, T e macrofagi), chiamati interleuchine o citochine. Le citochine, che hanno il compito di far maturare le cellule immunitarie, sono anche responsabili della capacità di queste ultime di comunicare con il sistema nervoso centrale e con porzioni periferiche del sistema nervoso, quali il nervo vago. L’esistenza di questo cross-talk tra sistema immunitario e sistema nervoso è ora ampiamente accettata dagli scienziati e fornisce le basi scientifiche per la comprensione dei meccanismi attraverso cui le emozioni possono influenzare l’inizio, la progressione e la remissione di un patologia.
Stress, emozioni e sistema immunitario
Le risposte agli stati emozionali che derivano dall’attivazione dei sistemi nervoso, endocrino e immunitario forniscono un esempio di risposta integrata. Nonostante la presenza di ormoni, neurotrasmettitori e recettori in comune tra tutti questi tre sistemi rafforzi l’ipotesi che tra essi esista una comunicazione bidirezionale, il funzionamento del sistema immunitario sembra essere molto diverso da quello dei sistemi neurovegetativo ed endocrino. Nel sistema nervoso autonomo e in quello endocrino l’attivazione dell’ormone periferico è mediata a livello del sistema nervoso centrale; al contrario, i prodotti del sistema immunitario possono, dalla periferia, attivare alcuni meccanismi nervosi. L’esempio più evidente di questo processo è rappresentato dalla relazione tra le citochine prodotte dal sistema immunitario e il fattore di rilascio della corticotropina o CRH (Corticotropine Releasing Hormone), l’ormone ipotalamico in grado di stimolare la produzione di adrenocorticotropina ipofisaria. La maggior parte delle evidenze sperimentali indica che i sistemi endocrino, nervoso e immunitario interagiscono e rispondono a stimoli farmacologici e fisiologici in maniera coordinata proprio grazie all’intermediazione dell’interleuchina-1 e del CRH. È stato dimostrato che l’interleuchina-1, prodotta dai macrofagi, agisce direttamente sulla regione ipotalamica per indurre la secrezione di CRH che, a sua volta, determina la secrezione ipofisaria dell’ormone adrenocorticotropo (ACTH) e di conseguenza un aumento della secrezione dei glucocorticoidi surrenalici, che possono tamponare attivamente molte delle funzioni del sistema immunitario. Un altro esempio delle interazioni che intercorrono tra sistema nervoso e immunitario, in relazione ad alterati stati emozionali, vede coinvolto l’NGF (Nerve Growth Factor). Tradizionalmente, questa molecola è stata descritta per la sua azione sulle cellule nervose; tuttavia, alcuni studi dimostrano che i livelli di questo fattore neurotrofico possono essere modificati in seguito a forti emozioni e attivare il sistema immunitario, per es. a livello delle cellule cutanee, che possiedono recettori specifici per questo fattore. Un’eccessiva produzione di NGF può indurre una iperproliferazione dei cheratinociti e una attivazione infiammatoria immunitaria (mediante degranulazione dei mastociti). La conseguenza può essere la comparsa delle placche infiammate tipiche della psoriasi.
Emozioni, sistema immunitario e salute umana
Esiste una vasta letteratura clinica che documenta come lo stress cronico possa avere profonde ripercussioni sulla salute. Recentemente è stata avanzata l’ipotesi che lo stress possa aumentare la predisposizione di un individuo all’insorgenza di malattie autoimmuni, infettive, neoplastiche. Nonostante alcuni risultati interessanti, rimane poco chiaro quanto lo stress, e in particolare lo stress cronico, renda un individuo più vulnerabile a malattie che, in circostanze normali, sarebbero efficacemente combattute dal sistema immunitario. La reazione di stress è avviata dall’ormone ipotalamico CRH che, attraverso l’ACTH, induce le ghiandole surrenali a produrre cortisolo. Sempre dall’ipotalamo partono segnali nervosi che attivano il locus coeruleus (nucleo situato nel ponte di Varolio), il quale, tramite il simpatico, determina l’aumento della produzione di adrenalina, noradrenalina e dopammina. Le cellule del sistema immunitario sono dotate di recettori per neurotrasmettitori e ormoni e possono rispondere a tali mediatori con diverse modalità. In generale, l’insieme delle sostanze prodotte sotto stress ha un effetto complessivo di riduzione dell’attività del sistema immunitario. Per tali ragioni, le emozioni prolungate, per es. uno stress cronico, potrebbero favorire tutta una serie di patologie, inclusa la crescita tumorale, che dipendono da un allentamento delle difese immunitarie. In individui che vivono in condizioni di stress cronico è stata infatti osservata una riduzione del numero e della funzione dei linfociti ad azione regolatoria (T-suppressor), di quelli con funzione helper (T-helper) e delle cellule NK (Natural Killer), ossia degli elementi che favoriscono l’attivazione delle difese immunitarie.
Ruolo delle neurotrofine nello stress
Le reazioni di adattamento allo stress coinvolgono numerosi mediatori, tra cui si possono annoverare le neurotrofine quali l’NGF (Nerve Growth Factor) e il BDNF (Brain-Derived Neurotrophic Factor), proteine ad alto peso molecolare coinvolte nel differenziamento e nella maturazione delle cellule nervose. Evidenze sperimentali suggeriscono che questi fattori possano giocare un ruolo importante negli adattamenti fisiologici che accompagnano la risposta a stimoli stressanti, particolarmente per quanto riguarda la riparazione degli effetti dovuti a un aumento in circolo degli ormoni dello stress, come il cortisolo. La presenza delle neurotrofine in cellule appartenenti ai sistemi nervoso, endocrino e immunitario suggerisce un ulteriore ruolo nel coordinamento degli adattamenti allo stress. In quanto trasduttori di eventi stressanti, NGF e BDNF sono stati anche indicati tra i principali mediatori coinvolti nell’insorgenza di patologie derivanti dall’esposizione a stress a carattere cronico, quali i disturbi dell’umore.
NGF e stress psicosociale
Il principale rappresentante delle neurotrofine è l’NGF, identificato da Rita Levi Montalcini negli anni Cinquanta del 20° sec. quale sostanza rilasciata dal tessuto bersaglio e in grado di regolare la sopravvivenza e la maturazione dei neuroni simpatici del sistema nervoso periferico. In modelli animali è stato dimostrato che lo stress psicosociale può indurre un aumento di NGF tanto nella circolazione periferica quanto nelle regioni del sistema limbico. Tale rilascio è correlato, nei roditori, con il grado di incertezza vissuto dal soggetto. Il maggiore target fisiologico dell’NGF rilasciato in circolo è rappresentato dalle ghiandole surrenali, a loro volta coinvolte nella secrezione degli ormoni dello stress (corticosterone nei roditori). Quindi, è possibile ipotizzare lo stabilirsi di un feedback positivo tra grado di incertezza − e dunque un coping meno efficace − e attivazione dell’asse ipotalamo-ipofisi-surrene. In questa ipotesi funzionale, l’NGF circolante potrebbe essere coinvolto nell’amplificazione della risposta neuroendocrina. Un aumento di NGF nel circolo sanguigno è stato riscontrato anche nella specie umana, associato a situazioni cariche di ansia e di stress, come dimostrato nei soldati di leva al primo lancio con il paracadute. Alti livelli di NGF sono stati anche riscontrati, nell’uomo, in situazione cariche di ansia, quali quelle sperimentate da chi si prende cura di un congiunto malato di Alzheimer. Anche lo stress di chi cerca di smettere di fumare può provocare un aumento dei livelli di NGF nel circolo periferico. Inoltre, un aumento di NGF è stato riportato come correlato neurobiologico della situazione d’innamoramento: questo dato suggerisce un coinvolgimento di tale neurotrofina nei meccanismi di attaccamento.
BDNF, stress e depressione
Il ruolo centrale svolto dal BDNF nella teoria neurotrofica della depressione è stato ampiamente dimostrato. Tale teoria prevede che la depressione e, più in generale, i disturbi dell’umore siano dovuti ad atrofia o morte di neuroni in determinati circuiti neuronali a seguito di una diminuita espressione di fattori neurotrofici, come per es. il BDNF, come conseguenza dell’esposizione a eventi stressanti. Tale ipotesi è suffragata, almeno in parte, dall’osservazione che in alcuni pazienti depressi si riscontra una piccola diminuzione nel volume dell’area ippocampale, una regione cerebrale coinvolta in processi cognitivi e affettivi. L’efficacia dei farmaci antidepressivi sembrerebbe dipendere dalla loro abilità nel promuovere un aumento nei livelli di BDNF, riscattando il suddetto trofismo neuronale. È stato anche ipotizzato che l’aumento nell’espressione di questa neurotrofina potrebbe innescare un meccanismo di reclutamento di popolazioni neuronali immature al fine di sostituire quelle degenerate in seguito a fenomeni di stress o a potenziare quelle rimaste.
Neurotrofine e stress neonatale
Nella specie umana, una riduzione nei livelli circolanti di BDNF è stata associata con una maggiore suscettibilità ai disturbi dell’umore, anche in dipendenza di stress precoci. È stato dunque ipotizzato che una modifica nei livelli delle neurotrofine, durante fasi precoci di sviluppo del sistema nervoso centrale (➔ cervello, sviluppo del), potrebbe riflettersi in modifiche di lungo termine nella suscettibilità di quelle stesse aree a eventi avversi anche nell’individuo adulto. Ricerche di base condotte nei roditori e nei primati non umani confermano che il cervello in sviluppo è sensibile a sollecitazioni esterne e che tale suscettibilità si manifesta sotto forma di cambiamenti nell’espressione dei fattori neurotrofici NGF e BDNF. La direzione e l’intensità degli effetti dipendono strettamente dall’età in cui l’insulto è subito e dal suo andamento (acuto o cronico). Durante lo sviluppo, l’espressione di NGF e BDNF è stata localizzata nella regione ippocampale e in quelle corticali, aree del sistema nervoso centrale implicate nella patologia mentale e in cui avvengono importanti fenomeni di plasticità neuronale. Cambiamenti sostanziali, come una riduzione o un aumento eccessivo, nell’espressione di questi fattori durante fasi critiche di sviluppo causate da input esterni, potrebbero incidere sulla maturazione del sistema limbico, con conseguenze di lungo termine sul funzionamento neuronale, e comportare un’alterata risposta allo stress nell’individuo adulto.