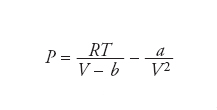teoria di van der Waals
teoria di van der Waals
Teoria formulata alla fine dell’Ottocento da Johannes Diderik van der Waals per interpretare il comportamento di stato dei fluidi reali tenendo conto delle interazioni fra le molecole. Fra di esse si manifestano, infatti, forze attrattive che sono più deboli rispetto alle forze di legame. La loro natura è stata interpretata da Fritz London ed è dovuta alle oscillazioni sincrone, o simpatetiche, degli elettroni esterni presenti nelle molecole stesse, per cui le fluttuazioni nella distribuzione delle cariche atomiche provocano, anche in molecole neutre, un’interazione elettrostatica. Tenendo conto delle interazioni intermolecolari il comportamento di stato dei fluidi viene descritto mediante la seguente equazione:
dove P è la pressione, T la temperatura in Kelvin e V il volume. I parametri a e b riflettono rispettivamente l’attrazione fra le molecole e il volume da loro occupato quando sono a stretto contatto. In un’ottica moderna la teoria di van der Waals costituisce un modello a campo medio poiché il comportamento di ogni singola molecola viene descritto assumendo che essa si trovi sotto l’azione di un campo di forze medio esercitato dalle molecole circostanti. L’intensità delle forze di van der Waals dipende dalla distanza fra i centri delle molecole, aumentando la quale l’attrazione diminuisce sino a spegnersi entro una distanza dell’ordine dei nanometri. A piccole distanze, però, intervengono forze repulsive dovute alla sovrapposizione delle nuvole elettroniche atomiche. Globalmente l’energia di interazione fra due molecole può essere descritta analiticamente mediante una relazione nota come potenziale di Lennard-Jones. Essa contiene due termini: uno inversamente proporzionale alla sesta potenza della distanza, relativo alle forze attrattive, e uno inversamente proporzionale alla dodicesima potenza della distanza, relativo alle forze repulsive. Maggiore è il numero di elettroni presenti in una molecola tanto più elevata risulta l’intensità delle forze attrattive. Oltre alle menzionate forze di London, nelle interazioni fra le molecole intervengono anche forze del tipo dipolo-dipolo indotto. Ciò si verifica quando una molecola polare si avvicina a una non polare inducendo in quest’ultima un dipolo elettrico che perdura fintanto che le due molecole restano vicine. Insieme alle forze dovute ai legami a idrogeno, le forze di van der Waals giocano un ruolo importante nel determinare le caratteristiche degli stati di aggregazione della materia.
→ Acqua