Tessuto muscolare
Tessuto muscolare
di Xavier Aubert, Jean Marie Gillis e Georges Maréchal
SOMMARIO: 1. Introduzione. □ 2. Biologia molecolare della contrazione: a) anatomia microscopica della fibra muscolare; b) le proteine che costituiscono l'apparato contrattile; c) meccanismi chimico-fisici della contrazione. □ 3. Il controllo della contrazione: a) la depolarizzazione della membrana; b) la penetrazione dell'eccitazione in profondità; c) l'intervento degli ioni calcio. □ 4. Le proprietà meccaniche: a) reologia della fibra muscolare; b) sviluppo della contrazione; c) la tensione tetanica; d) la contrazione isotonica: la relazione forza-velocità. □ 5. Energetica della contrazione: a) la produzione di calore (termogenesi); b) le reazioni chimiche della contrazione muscolare; c) bilancio energetico della contrazione. □ 6. I tipi di fibre muscolari. □ Bibliografia.
1. Introduzione.
Gli esseri viventi presentano forme molto diverse di movimento: anche negli esseri unicellulari esistono correnti protoplasmatiche, spostamenti di cromosomi durante la mitosi, movimenti ameboidi, movimenti ritmici di ciglia o di flagelli. Negli esseri pluricellulari compaiono alcune cellule allungate, specializzate nel movimento: le fibre muscolari.
Di tutti questi meccanismi motori, il meglio conosciuto è quello rappresentato dalle fibre muscolari striate dei muscoli scheletrici dei Vertebrati; tali fibre non costituiscono d'altronde un'eccezione, in quanto si trovano in tutti gli animali a partire dai Celenterati; negli Artropodi e nei Cordati i muscoli somatici e quello cardiaco sono quasi sempre striati. D'altra parte, quando la motilità è stata studiata in maggior dettaglio, si è scoperto che in quasi tutti i casi essa era il risultato dell'interazione di due tipi di proteine fibrose caratteristiche, reattive in presenza di alcuni composti fosforilati, con legami fosforici ad alto contenuto di energia, e di alcuni ioni di metalli alcalino-terrosi. La grande varietà delle forme di movimento non dipende dunque tanto dal sistema motorio propriamente detto, quanto piuttosto da meccanismi accessori che assicurano il controllo e la modalità di applicazione della forza prodotta. Per esempio, nei muscoli dello scheletro la forza si esplica per mezzo di leve ossee; nel cuore e nei visceri crea una pressione idrostatica; il flagello degli spermatozoi agisce invece come un'elica. Per quanto riguarda il controllo, esso varia da un'influenza umorale diffusa fino alla stretta dipendenza dal sistema nervoso centrale che è caratteristico dei muscoli del nostro scheletro.
2. Biologia molecolare della contrazione.
a) Anatomia microscopica della fibra muscolare.
Nei Vertebrati le fibre dei muscoli scheletrici e di quello cardiaco presentano all'esame microscopico una struttura trasversale dalla quale esse derivano il nome di fibre striate, mentre le fibre dei visceri hanno un aspetto liscio. La maggior parte di quest'analisi sarà dedicata alla fibra striata, che è quella meglio conosciuta.
Le fibre muscolari sono avvolte da una tipica membrana cellulare rinforzata da una trama di fibre connettivali; il tutto viene chiamato ‛sarcolemma'. La fibra muscolare è plurinucleata; i nuclei occupano una posizione periferica, che può modificarsi in alcune circostanze patologiche (degenerazione). Le altre strutture intracellulari importanti sono i mitocondri o sarcosomi, le miofibrille e il reticolo sarcoplasmatico.
I mitocondri, di forma allungata, si trovano tra le miofibrille in quantità dipendenti dal tipo di attività del muscolo: sono numerosi nei muscoli che svolgono attività contrattile per lunghi periodi (ad es. il diaframma) e quando i meccanismi di recupero dipendono principalmente dalle ossidazioni.
La maggior parte del volume delle fibre è occupata dall'apparato contrattile formato dalle miofibrille, allineate lungo il grande asse della fibra. Le miofibrille hanno una lunghezza identica a quella della fibra e un diametro da 2 a 3 μm.
Struttura delle miofibrille. - Nel muscolo striato le miofibrille presentano una struttura periodica molto regolare, che appare come un'alternanza di bande trasversali rispetto all'asse delle miofibrille, il cui aspetto dipende dalla tecnica di osservazione usata. Nelle sezioni istologiche fissate e colorate, si distingue un'alternanza di bande scure, lunghe all'incirca 1,5 μm, separate da bande chiare, la cui lunghezza dipende dal grado di stiramento del muscolo. La fig. 1 illustra questi dati e mostra alcuni dettagli supplementari: una zona meno densa al centro della banda scura, detta zona di Hensen (H), e una linea sottile assai marcata che divide in due parti eguali la banda chiara (linea Z). La parte della miofibrilla compresa tra due linee Z è l'unità morfologica della fibrilla ed è stata chiamata ‛sarcomero'. Vedremo più avanti che il sarcomero è anche l'‛unità funzionale' della fibrilla.
Quando le miofibrille sono esaminate in luce polarizzata, con nicol incrociati, l'alternanza delle bande è ancora presente, ma in questo caso, sul fondo nero del campo di osservazione, la banda densa diventa più chiara, rivelando così il suo carattere birifrangente o ‛anisotropo', per cui viene chiamata banda A (v. fig. 2). Viceversa, la banda che alla normale osservazione al microscopio risultava chiara è in questo caso praticamente invisibile, e viene perciò chiamata banda ‛isotropa' (I). Lo studio della birifrangenza della banda A ha mostrato che una parte di questa birifrangenza è dovuta alla giustapposizione di aggregati macromolecolari filamentosi disposti parallelamente gli uni agli altri e orientati lungo l'asse maggiore della miofibrilla (v. Weber, 1934).
L'ultrastruttura della miofibrilla è stata definitivamente chiarita solo con l'impiego del microscopio elettronico. Questo approccio sperimentale permette di rilevare dettagli di struttura dell'ordine di 2 nm. La miofibrilla appare composta essenzialmente di filamenti il cui asse è parallelo al grande asse della fibra (v. fig. 3).
I lavori di H. E. Huxley e J. Hanson (v., 1954) hanno dimostrato che la banda A è formata da grossi filamenti (i filamenti primari), del diametro di 15 nm, che la percorrono da un punto all'altro (1,5 μm). La banda I è anch'essa costituita da filamenti che, partendo da una parte e dall'altra della linea Z, raggiungono la banda A e vi penetrano: si tratta di filamenti molto più sottili (5 nm circa), detti ‛filamenti secondari', la cui lunghezza è dell'ordine di 1 μm. I filamenti secondari si attaccano alla linea Z, senza attraversarla da parte a parte, ma a questo livello si dividono in quattro sottofilamenti, ciascuno dei quali si unisce a quattro filamenti secondari del sarcomero successivo. Questo intreccio è in parte responsabile della struttura della linea Z (v. fig. 4). La parte della banda A dove i filamenti secondari non sono penetrati corrisponde alla zona H, la cui natura è così chiarita (v. fig. 3).
Esaminando le sezioni longitudinali sottili (15-20 nm), si osserva che esistono dei ponti che collegano i due tipi di filamenti nella regione della banda A dove essi si sovrappongono. Questi ponti sono formati da proiezioni trasversali che hanno origine dai filamenti primari. Esaminati nel piano di una sezione, questi ponti si ripetono regolarmente ogni 43,5 nm circa. Nella regione della zona H i ponti si proiettano liberamente nello spazio tra un filamento e l'altro. Infine, la regione centrale dei filamenti primari è priva di queste proiezioni per una distanza di circa 0,2 μm. Sempre su sezioni ultrasottili si sono potuti contare, lungo un filamento primario, 36 ponti (v. fig. 5).
Le relazioni spaziali esistenti tra i due tipi di filamenti sono chiaramente evidenziate in sezioni trasversali nelle quali il muscolo appare come una struttura quasi cristallina. I filamenti primari si trovano agli angoli di esagoni regolari a una distanza di 45 nm gli uni dagli altri (v. fig. 6). Ciascuno di questi filamenti primari è circondato da sei filamenti secondari, a loro volta situati a eguale distanza dai tre filamenti primari più vicini (v. fig. 7). Se la sezione passa attraverso la zona H, si osservano solo gli esagoni formati dai filamenti primari. In queste sezioni trasversali sono visibili anche i ponti che uniscono i due tipi di filamenti e, poiché esistono sei filamenti secondari per ogni filamento primario, sono presenti 36 × 6 = 216 proiezioni lungo un filamento primario. A livello della banda I, i filamenti secondari non presentano alcun ordine particolare, eccetto che in prossimità della stria, dove si organizzano secondo lo schema della fig. 4. Al centro della zona H la maggiore densità, nota come linea M, sembra dovuta all'esistenza di legami trasversali tra i filamenti primari.
Modificazioni della struttura in funzione della condizione fisiologica del muscolo: l'influenza dei mutamenti di lunghezza e della contrazione. - Esaminando al microscopio ottico una fibra muscolare striata, isolata per dissezione, si nota che lo stiramento del muscolo provoca un allungamento della banda I. Per ciascun sarcomero l'aumento delle due semibande I, che fiancheggiano la banda A, è identico. Si osserva pure un allargamento della zona H centrale, la cui entità è pari alla somma degli aumenti delle due semibande I. In caso di accorciamento, sia esso passivo o provocato dalla contrazione, succede l'inverso. La banda I si riduce progressivamente, come pure la zona H (v. fig. 8A). In ogni caso la lunghezza della banda A resta immutata (v. Huxley e Niedergerke, 1954).
Esaminando al microscopio elettronico muscoli fissati a lunghezze diverse, si è potuto dimostrare che le modificazioni della lunghezza sono dovute a una sovrapposizione più o meno accentuata dei filamenti primari e secondari e non alle modificazioni della loro lunghezza individuale (v. fig. 8B; v. Page e Huxley, 1963). A seguito dell'accorciamento, i filamenti secondari si insinuano fra quelli della banda A, fuoriuscendone, invece, in caso di stiramento.
A lunghezza molto breve, tuttavia, si vedono apparire due bande supplementari, dette bande di contrazione, delle quali una (CZ) è situata a ridosso della linea Z e l'altra (CM) al centro della banda A (v. fig. 8A). La prima è dovuta al fatto che, nel caso di un loro accorciamento molto accentuato, i filamenti primari vengono spinti contro la linea Z. La seconda è dovuta ai filamenti che, penetrati nella banda A, ne superano il centro e si sovrappongono.
L'osservazione al microscopio elettronico si effettua su sezioni di muscoli previamente fissati, disidratati, inclusi e colorati, che sono esaminati sotto vuoto. Tali condizioni sperimentali possono fare apparire degli artefatti e quindi non sono utili per seguire le modificazioni di struttura che si producono in un muscolo vivente. Per completare tali risultati ci si è valsi anche dell'ausilio dell'analisi della diffrazione dei raggi X attraverso il muscolo. Questo metodo permette di studiare in vivo le strutture periodiche aventi periodo da pochi a un centinaio di Å. Lo studio delle sezioni trasversali dei muscoli sopra descritte ha mostrato che i filamenti banno una disposizione spaziale estremamente regolare, quasi cristallina, come era stato prima ipotizzato e quindi confermato dall'analisi con i raggi X (v. Huxley, 1953). Nello schema della fig. 7 sono stati indicati i due piani di sezione che mostrano strutture periodiche. Il piano X è costituito dalla successione dei filamenti primari; nel piano Y la struttura, più complessa, è formata dalla ripetizione di un modulo che comprende un filamento primario seguito da due filamenti secondari.
È evidente che nella zona H è presente soltanto la periodicità del piano X; al contrario, nella regione della banda A dove si ritrovano i due tipi di filamenti, sono presenti le due periodicità (piano X e piano Y). Si è potuto osservare che, facendo variare la lunghezza di un muscolo vivo, il contributo della periodicità del piano Y diminuiva in proporzione allo stiramento del muscolo (v. Elliott e altri, 1963). Ciò dimostra che, in vivo, le variazioni di lunghezza del muscolo sono dovute allo scorrimento dei due tipi di filamenti gli uni rispetto agli altri. Questi studi hanno inoltre mostrato che la distanza tra i filamenti primari (la dimensione degli esagoni) varia in maniera notevole in funzione della lunghezza del muscolo: i filamenti si allontanano gli uni dagli altri a lunghezze brevi, e si riaccostano a grandi lunghezze, in modo che la superficie della sezione trasversale del sarcomero, moltiplicata per la sua lunghezza, resta costante. Il meccanismo responsabile di questa proprietà è ancora ignoto; forse l'infiltrarsi dei filamenti secondari nella rete dei filamenti primari al momento dell'accorciamento è responsabile di un loro allontanamento per repulsione elettrostatica.
L'analisi ai raggi X permette anche lo studio di un altro tipo di periodicità, cioè quella formata nel senso della lunghezza dei filamenti primari dalle proiezioni trasversali. In un muscolo a riposo, il diagramma di diffrazione dei raggi X permette agevolmente di riconoscere questa periodicità dei ponti trasversali, cosa che indica non solo che essi esistono in vivo, ma anche che hanno una disposizione regolare, condizione indispensabile per poterli esaminare con questo metodo di analisi. Al contrario, durante la contrazione del muscolo il diagramma di diffrazione non presenta più le riflessioni caratteristiche dei ponti. Questa scomparsa è stata interpretata come il risultato di movimenti in avanti e all'indietro dei ponti intorno ai loro punti d'inserimento sul filamento primario. L'asincronismo di tali movimenti sopprimerebbe momentaneamente la disposizione regolare delle proiezioni (v. H. E. Huxley e altri, 1965).
La scoperta dell'ultrastruttura del sarcomero, così come la descrizione dei cambiamenti di struttura che avvengono al momento delle variazioni di lunghezza, sono i fondamenti dell'ipotesi detta dei ‛filamenti slittanti', formulata contemporaneamente da H. E. Huxley e J. Hanson (v., 1954) e da A. F. Huxley e R. Niedergerke (v., 1954). In contrasto con le precedenti teorie sulla contrazione, secondo le quali i cambiamenti di lunghezza delle fibre avvenivano a causa dell'avviluppamento o del dispiegamento di catene proteiche, la nuova teoria propone che le lunghezze individuali dei filamenti proteici restino costanti e che sia invece il loro grado di reciproca sovrapposizione a determinare le variazioni di lunghezza macroscopicamente misurabili. Questa teoria è stata poi validamente confermata da numerose prove sperimentali di tipo sia morfologico sia fisiologico e può quindi essere considerata come la descrizione più adeguata dei fenomeni della contrazione a livello macromolecolare.
Il reticolo sarcoplasmatico. - Nella maggior parte dei muscoli striati si osserva fra le miofibrille una complessa rete di canalicoli intracellulari. Questi vennero dettagliatamente descritti da E. Veratti (v., 1902), che li mise in evidenza su sezioni di muscoli sottoposti a impregnazione metallica; ma fu necessario l'avvento della microscopia elettronica e l'utilizzazione di fissatori adeguati per conoscere l'organizzazione ultrastrutturale di questi canali (v. Bennett e Porter, 1953; v. figg. 3 e 9). L'elemento più importante di questo reticolo sarcoplasmatico è costituito da un viluppo di canalicoli allungati nel senso delle miofibrille, che essi circondano come bracciali. Questo reticolo presenta un'organizzazione periodica che è ‛in fase' con la striatura delle miofibrille. Partendo da un anello sacculare centrato sulla zona H, alcuni canalicoli si distendono longitudinalmente verso le due estremità del sarcomero. A livello della linea Z, in alcuni casi, o della giunzione tra le bande A e I, in altri casi (muscoli di Mammiferi), questi canali tortuosi s'anastomizzano in una dilatazione sacculare detta cisterna, che sta di fronte a una cisterna identica appartenente al sarcomero vicino. Tra le due cisterne adiacenti si trova un terzo elemento che forma con quelle una triade. Questo elemento centrale appartiene a un altro sistema di canali che si insinuano trasversalmente nella fibra a partire dalla membrana cellulare esterna. Tali invaginazioni, che hanno ricevuto il nome di sistema trasversale (v. Andersson-Cedergren, 1959), si riscontrano solo a livello delle linee Z o delle giunzioni A-I, dalla parte della formazione delle cisterne. I canali trasversali si insinuano tra due cisterne adiacenti, senza comunicare con queste; al contrario, lo spazio da essi delimitato è in comunicazione con il mezzo esterno. Essi formano un piccolo compartimento (circa 1/500 del volume della fibra), che scambia i suoi ioni molto più rapidamente del sarcoplasma, allorquando si cambia il mezzo che bagna il muscolo (v. Hodgkin e Horowicz, 1960), e nel quale possono penetrare rapidamente sostanze di peso molecolare elevato (v. Page, 1964).
La superficie della membrana che separa il sarcoplasma dal mezzo esterno è dunque molto più grande della superficie che avvolge la fibra. Si spiega così perché la capacità elettrica della membrana del muscolo striato sia notevolmente più elevata (5-10 μF/cm2) di quella del nervo (1-2 μF/cm2): infatti la superficie dei canalicoli, che non è trascurabile, costituisce una capacità in parallelo alla capacità della membrana propriamente detta.
Il reticolo sarcoplasmatico può essere isolato dagli altri costituenti della cellula per centrifugazione differenziale dopo triturazione del muscolo: esso in tal modo si frantuma in vescicole. Vedremo che il reticolo svolge una funzione importante nel controllo della concentrazione sarcoplasmatica in ioni calcio e anche nel controllo della contrazione e del rilasciamento (v. cap. 3).
b) Le proteine che costituiscono l'apparato contrattile.
In 100 grammi di muscolo sono contenuti circa 75-80 g d'acqua e 20-25 g di sostanze solide, che un incenerimento prolungato a 600 °C riduce a circa 1 g di sostanze minerali. La parte solida comprende quindi prevalentemente sostanze organiche: si tratta di sostanze importanti da un punto di vista energetico, soprattutto proteine che costituiscono quasi il 20% della massa muscolare (v. tab. I).
Le proteine del sarcoplasma. - Una soluzione con forza ionica molto debole (inferiore a 0,015) è sufficiente per estrarre quasi un quarto delle proteine totali, senza che si abbia un cambiamento apprezzabile nella struttura morfologica dei diversi tipi di fibra. Si tratta di proteine globulari che probabilmente esistono in soluzione concentrata nel succo cellulare chiamato sarcoplasma. Esse includono, oltre a un pigmento respiratorio (la mioglobina), una miscela di numerosi fermenti, tra i quali tutte le componenti del sistema glicolitico e diverse fosfochinasi. La loro funzione è quindi essenzialmente metabolica.
Il sarcoplasma dei muscoli dei Vertebrati inferiori contiene inoltre una grande quantità di proteine a basso peso molecolare (11.000), denominate da Hamoir (v., 1968) parvalbumine, che presentano una spiccata affinità per il calcio. È probabile che queste proteine, fissando una parte del calcio liberato dalla stimolazione, contribuiscano, col reticolo sarcoplasmatico, al rilasciamento del muscolo (v. Gillis e Gerday, 1977).
Le proteine dei granuli. - La centrifugazione differenziale d'un omogenato di muscolo permette di separare diversi tipi di granuli. I principali sono i nuclei, i sarcosomi (equivalenti ai mitocondri di altre cellule) e i microsomi, che sono frammenti inframicroscopici di strutture cellulari complesse. Ancora una volta, la funzione di questi granuli è prevalentemente metabolica.
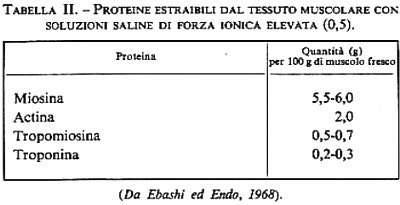
Le proteine delle miofibrille. - L'estrazione con soluzioni saline di notevole forza ionica (0,5) provoca nel tessuto muscolare una disorganizzazione delle fibre, con scomparsa della struttura striata. Le soluzioni che così si ottengono sono molto viscose: esse contengono proteine di peso molecolare elevato, di natura fibrillare, le quali hanno la tendenza ad associarsi fortemente le une alle altre. L'analisi di questi complessi proteici, eseguita con le tecniche classiche della precipitazione a forza ionica variabile e della cromatografia su supporti diversi, ha messo in evidenza che esistono 4 proteine principali (v. tab. II).
I due composti che sono presenti in maggiore quantità sono la miosina e l'actina, che si possono combinare per formare l'actomiosina; vedremo più avanti che queste proteine interagiscono in molti modi con l'ATP (adenosintrifosfato). Esse appaiono strettamente legate al meccanismo della contrazione. Le altre due proteine, la tropomiosina e la troponina, sono importanti per il controllo della contrazione.
L'organizzazione interna di queste diverse proteine è tutt'altro che semplice. Nella maggior parte dei casi la proteina è composta di subunità polipeptidiche in associazione stabile. Un notevole progresso nello studio delle proteine contrattili ha potuto essere realizzato con l'introduzione di tecniche elettroforetiche su gel di poliacrilammide in presenza di agenti, quali urea ad altissima concentrazione e dodecilsolfato di sodio (SDS), che dissociano le catene polipeptidiche le une dalle altre.
A. Miosina. La miosina fu isolata da W. Kühne (v., 1859), sebbene sotto forma molto impura, probabilmente assieme all'actina. Solo nel 1943-1944 la miosina e l'actina sono state purificate separatamente da F. B. Straub (v., 1943) e A. Szent-Györgyi (v., 1944). Oggi la miosina può essere preparata in forma altamente purificata e il grado di purificazione può essere rigorosamente controllato con l'elettroforesi su gel-SDS.
La miosina è una proteina fibrillare di peso molecolare 480.000. La sua molecola è lunga circa 160 nm. Con gli agenti dissocianti si separano due gruppi di catene polipeptidiche: le catene ‛pesanti' (peso molecolare intorno a 200.000) e le catene ‛leggere', con un peso molecolare vicino a 20.000. Le catene pesanti sono costituite principalmente da eliche α; questo fatto conferisce loro una configurazione allungata molto rigida. A partire dalla loro estremità C esse sono avvolte l'una sull'altra per formare un segmento rettilineo della lunghezza di circa 140 nm. Poi esse divergono per formare delle configurazioni globulari (le ‛teste' della miosina), che contengono l'estremità N (v. fig. 10). Le catene leggere, che sono in rapporto con le teste della miosina, sono state designate con il nome dell'agente chimico utilizzato per estrarre la miosina: due catene ‛alcaline' (estratte a pH elevato, peso molecolare 16.000 e 25.000) e una catena ‛DTNB' (estratta con il 5,5′-ditio-bis-2-nitrobenzoato, peso molecolare 18.000). Ciascuna testa della miosina contiene una catena alcalina e una catena DTNB.
L'azione controllata degli enzimi proteolitici ha permesso un altro tipo di dissociazione della miosina. La tripsina scinde la molecola in due frammenti: uno, avente peso molecolare 340.000 e contenente le due teste e una parte del segmento rettilineo comune, è la meromiosina pesante; l'altro è la meromiosina leggera, che contiene il resto del segmento rettilineo e l'estremità C delle catene pesanti (v. Szent-Györgyi, 1953).
Con un'azione proteolitica più marcata è possibile scindere la meromiosina pesante nel punto dove le catene pesanti danno origine alle teste della miosina; le teste così separate vengono chiamate sottoframmenti 1 (S1), mentre il resto della meromiosina pesante costituisce il sottoframmento 2 (S2) Le diverse componenti e i diversi prodotti dell'idrolisi della miosina sono rappresentati nella fig. 10. Si noti che la meromiosina pesante e i frammenti S1 ed S2 sono solubili alla forza ionica fisiologica (~ 0,1), contrariamente alla molecola della miosina intatta.
La miosina possiede tre proprietà biologiche importanti: 1) le sue molecole possono unirsi fra loro per formare delle strutture ordinate, le quali danno origine ai filamenti primari del sarcomero; 2) essa è dotata di attività ATP-asica, vale a dire della capacità di idrolizzare il gruppo fosforico terminale dell'acido adenosintrifosforico; 3) può combinarsi con l'actina per formare un complesso proteico, l'actomiosina; in questo caso l'attività ATP-asica della miosina risulta notevolmente potenziata. Queste due ultime proprietà sono localizzate a livello delle estremità globulari della molecola, come è stato dimostrato dallo studio separato delle frazioni proteolitiche della miosina.
La miosina è localizzata a livello dei filamenti primari della banda A, che scompaiono quando si prepara un estratto di muscolo con una soluzione che discioglie la miosina, ma non l'actina (v. Hanson e Huxley, 1957). Inoltre, gli anticorpi fluorescenti antimiosina si fissano a livello della banda anisotropa. Secondo i calcoli di H. E. Huxley (v., 1963) i filamenti primari conterrebbero tutta la miosina del muscolo.
I filamenti primari sono naturalmente molto più grandi e più lunghi delle molecole di miosina; ciascuno di essi è quindi costituito dall'aggregazione di numerose molecole di miosina. È da notare che partendo da una soluzione di miosina è possibile ricostituire dei filamenti che da molti punti di vista assomigliano ai filamenti primari. Se si abbassa progressivamente la forza ionica della soluzione, appaiono filamenti aventi un diametro di circa 15 nm e una lunghezza variabile che può arrivare a 1,5 μm, che possiedono brevi processi trasversali disposti regolarmente come i ‛ponti' dei filamenti primari e presentano anche una zona centrale spoglia.
Secondo Huxley (v., 1963), il corpo del filamento primario sarebbe formato dalle parti rettilinee (merorniosina leggera) delle molecole di miosina, mentre le meromiosine pesanti sporgerebbero dalla superficie del filamento e costituirebbero i ponti visibili al microscopio elettronico. L'accrescimento del filamento avverrebbe a partire dalla regione centrale verso le due estremità, per aggiunta simmetrica di nuove molecole di miosina (v. fig. 11). Le due metà del filamento sarebbero dunque l'immagine l'una dell'altra. Questo modello spiega l'assenza di ponti nella regione centrale. Bisogna notare che la lunghezza dei filamenti ricostituiti è variabile da 0,8 a 2,0 μm, contrariamente a quella dei filamenti primari del muscolo. I fattori che controllano la struttura precisa dei filamenti di miosina non sono dunque ancora noti.
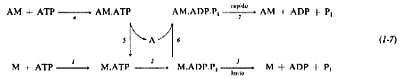
La miosina fu considerata per lungo tempo una proteina strutturale. Engelhardt e Ljubimova (v., 1939) dimostrarono che essa è dotata di attività ATP-asica. Questa scoperta modificò fondamentalmente l'orientamento delle ricerche sulla contrazione muscolare, perché stabilì il legame che unisce struttura e composizione proteica all'energetica muscolare. L'attività ATP-asica della miosina richiede la presenza di calcio a una concentrazione che si avvicina alla millimole per litro. Il magnesio ha un effetto inibitore. Recenti studi di cinetica enzimatica hanno permesso di descrivere le diverse tappe di questa attività; tali studi si basano sulle tecniche di combinazione ultrarapida (in qualche millisecondo) tra l'enzima e il substrato e sullo studio dei complessi formati, grazie a misurazioni fisiche istantanee, nella maggior parte dei casi di tipo ottico (fluorescenza, assorbimento, diffusione della luce). Come illustrato nello schema seguente
la combinazione di miosina (M) e di ATP dà luogo alla formazione della coppia enzima-substrato (M.ATP), il cui equilibrio è fortemente spostato in favore del complesso (reazione 1). In seguito avviene la fase idrolitica propriamente detta (reazione 2), che porta a un complesso nel quale i prodotti della reazione, ADP e fosfato inorganico (Pi), rimangono associati all'enzima (complesso M.ADP.Pi). Infine i prodotti delle reazioni si dissociano (reazione 3); questa reazione, che è molto lenta (la sua costante di velocità è 0,05 sec-1), limita la velocità globale della reazione di idrolisi, e pertanto in una soluzione e in presenza di ATP la miosina si trova principalmente sotto forma M-ADP-Pi, perché le reazioni (1) e (2) sono molto rapide.
Nei Mammiferi la miosina esiste sotto differenti forme isozimiche che differiscono per le loro attività ATP-asiche. La miosina dei muscoli lisci possiede una attività ATPasica molto debole, modulabile dalla fosforilazione della proteina operata da una chinasi specifica. La miosina del miocardio è dotata di un'attività ATP-asica media, simile a quella della miosina contenuta nelle fibre striate lente. La miosina delle fibre muscolari rapide, infine, possiede un'elevatissima attività ATP-asica.
B. Actina. L'actina, isolata da F. B. Straub (v., 1943), può esistere sotto due forme diverse, secondo il grado di associazione: una monomera e una polimera.
La monomera (actina G) è una proteina formata da una sola catena polipeptidica di forma globulare (diametro 5,5 nm), di peso molecolare circa 45.000. Questa forma è stabile solo in una soluzione a debole forza ionica. Non appena si aumenta la salinità del mezzo, aggiungendo per esempio KCl fino a una concentrazione finale 0,1 M, la soluzione di actina diviene molto viscosa e presenta birifrangenza di flusso: questi fenomeni indicano una trasformazione dell'actina globulare in actina filamentosa (F), costituita dall'associazione lineare di un gran numero di monomeri.
L'actina filamentosa isolata dal muscolo contiene una molecola di ATP e un atomo di metallo alcalino-terroso (Ca o Mg) per ogni monomero G. Queste due sostanze sono intimamente legate alla struttura dell'actina F e non possono esserne distaccate; il loro ruolo è sconosciuto. In vitro è tuttavia possibile ottenere la polimerizzazione dell'actina in assenza di nucleotidi.
Nelle condizioni presenti all'interno della fibrocellula muscolare, l'actina dovrebbe trovarsi sotto forma polimerizzata. Questo conferma le osservazioni di Hanson e Huxley (v., 1957), che permettono anche di localizzare l'actina. Miofibrille dalle quali è stata estratta la miosina, e che sono composte solo da una successione di bande I, perdono una gran parte del materiale deposto nei filamenti secondari non appena sono trattate con KI 0,6 M, una soluzione che, come è noto, depolimerizza ed estrae l'actina. D'altra parte, si possono isolare meccanicamente i filamenti secondari. Al microscopio elettronico questi appaiono formati da due catene di globuli che si avvolgono l'una all'altra (v. fig. 12); il diametro di questi globuli è di 5,5 nm, cioè esattamente il diametro di un globulo di actina (v. Hanson e Lowy, 1963).
Un giro di spirale di questa doppia catena si compie in circa 36,0 nm. Infine, come nel caso della miosina visto in precedenza, è possibile ricostruire filamenti secondari provocando la trasformazione G → F di una soluzione di actina G. I filamenti così ottenuti presentano la doppia elica formata da unità globulari, ma anche in questo caso la lunghezza dei filamenti ricostruiti è molto variabile, mentre quella dei filamenti secondari naturali è fissa. Tutte queste prove dimostrano che l'actina è localizzata nei filamenti secondari che, tuttavia, devono contenere anche altre sostanze oltre l'actina: infatti, i filamenti secondari contengono più del 20% delle proteine del muscolo, mentre l'actina rappresenta solo il 14% delle proteine totali.
C. Tropomiosina e troponina. K. Bailey (v., 1948) ha isolato dal muscolo striato una nuova proteina fibrosa, che rappresenta circa il 5% delle proteine miofibrillari. Denominata tropomiosina B, in contrapposizione alla tropomiosina A, scoperta in seguito negli Anellidi, la nuova proteina è rimasta per lungo tempo enigmatica. Tuttavia verso il 1963 S. Ebashi ha dimostrato che questa proteina è un complesso formato da due proteine distinte, con pesi molecolari vicini (~ 70.000): l'una fibrosa, la tropomiosina purificata, e l'altra globulare, la troponina. Tale complesso costituisce quella che la scuola di Ebashi chiama tropomiosina ‛nativa'. Queste molecole sarebbero strettamente legate nel muscolo ai filamenti di actina fibrosa (v. Ebashi ed Endo, 1968).
La tropomiosina è formata da due catene polipeptidiche con alto contenuto di eliche α; la sua molecola, molto allungata (~ 40 nm) e di piccolo diametro (~ 2 nm), si unisce spontaneamente all'actina F.
La troponina è un insieme di 3 sottounità dissociabili per mezzo dell'elettroforesi su gel-SDS. Una prima sottounità (peso molecolare 39.000) presenta una notevole affinità per la tropomiosina (donde la sua denominazione abbreviata TNT). La seconda sottounità (p.m. 18.000) possiede una forte affinità specifica per il calcio, per cui viene chiamata TNC; la TNC possiede 2 siti di fissazione specifici per il calcio, con una costante di affinità di 3,2 × 106 M-1. La terza (p.m. 24.000) possiede la proprietà di inibire l'interazione tra actina e miosina (TNI). La tropomiosina e le tre subunità della troponina sono associate nell'ordine seguente: tropomiosina-TNT-TNC-TNI. Le relazioni spaziali fra il filamento di actina e il complesso tropomiosinatroponina sono illustrate nella fig. 12. La tropomiosina è allogata nella scanalatura delimitata dalla doppia elica di actina, e le molecole si susseguono testa a testa lungo tutto il filamento. La tecnica degli anticorpi ha permesso di localizzare la troponina a livello dei filamenti secondari, dove si trova distribuita in maniera discontinua con una periodicità di circa 40 nm; essa è responsabile della finissima striatura trasversale della banda I che si può vedere al microscopio elettronico.
c) Meccanismi chimico-fisici della contrazione.
Actomiosina. - Una delle proprietà più notevoli della miosina, oltre alla sua attività ATP-asica, è la capacità di combinarsi con l'actina per formare un complesso chiamato actomiosina. L'affinità tra le due proteine è tale che la maggior parte dei vecchi preparati di ‛miosina' contenevano in realtà una miscela in proporzioni variabili di miosina pura e di actomiosina. Facendo una miscela di due soluzioni pure di miosina e di actina, la viscosità aumenta fortemente, mentre l'actomiosina si forma per una combinazione in proporzione definita: una molecola d'actina F (p.m. ~ 3.000.000) si combina con 25-30 molecole di miosina (v. Gergely e Kohler, 1957), fatto che suggerisce che ogni molecola di miosina si fissa a uno o due globuli di actina.
Abbiamo visto sopra che la tripsina scinde la miosina in due frammenti di morfologia molto diversa: le meromiosine. Studiando ciascun frammento separatamente si può dimostrare che la combinazione actina-miosina si attua tramite la meromiosina pesante. Huxley (v., 1963) ha studiato al microscopio elettronico la struttura ottenuta combinando meromiosina pesante e filamenti di actina ricostituita (actina F) e ha potuto osservare che una molecola di meromiosina si unisce a un globulo di actina secondo un orientamento geometrico particolare: il grande asse dell'ovoide allungato, che è la molecola di meromiosina, forma un angolo acuto con il filamento di actina, così che quest'ultimo assume la forma di una testa di freccia o di arpione (v. fig. 13).
Se si mette meromiosina pesante in presenza di una banda I, isolata meccanicamente, le molecole di meromiosina unite ai filamenti si orientano in direzioni opposte a seconda che esse si trovino da un lato o dall'altro della linea Z (v. fig. 14). Ciò indica che i filamenti secondari hanno una polarità e sono simmetrici rispetto alla linea Z. Ricordiamo a questo proposito la polarità delle due metà del filamento di miosina di cui si è parlato in precedenza.
Questi studi di fine struttura forniscono importanti delucidazioni sul meccanismo della contrazione: si è visto infatti che le modificazioni della struttura del sarcomero, per esempio nel caso dell'accorciamento, potevano spiegarsi come una compenetrazione dei filamenti secondari nella banda A in maniera simmetrica rispetto al centro del sarcomero. Ciò fa pensare a un comportamento speculare delle due metà del sarcomero: i filamenti secondari della metà destra protesi verso la parte sinistra, quelli della metà sinistra protesi verso la destra (v. fig. 8). La scoperta della polarità dei filamenti avvalora questa ipotesi.
Interazioni dell'ATP con l'actomiosina. - Si deve a Szent-Györgyi (v., 1951) la realizzazione di un esperimento che dimostra in maniera brillante che l'interazione dell'ATP con le proteine actina e miosina costituisce il meccanismo fondamentale della contrazione muscolare.
Se si mettono insieme actina e miosina in un mezzo a forza ionica debole (0,1), analoga a quella che prevale all'intemo della fibra muscolare, l'actomiosina precipita sotto forma di gel. L'aggiunta di ATP a questo gel porta a una ‛superprecipitazione' immediata: il gel si contrae ed espelle l'acqua che contiene. Inoltre la superprecipitazione si accompagna a un'idrolisi accelerata di ATP. Szent-Györgyi considera questo fenomeno come il substrato della contrazione fisiologica: un effetto meccanico macroscopico che attinge energia direttamente dall'idrolisi dell'ATP. Presentata nel 1941, l'ipotesi era veramente audace, ma le ricerche successive hanno potuto dimostrare che questa interpretazione era poggiata su solide basi.
Lo studio delle interazioni dell'ATP con l'actomiosina è ostacolato dal fatto che quest'ultima è insolubile a forza ionica debole. Cosi sono stati utilizzati complessi solubili con la meromiosina pesante o, più recentemente, con il frammento S1. In presenza di actina le proprietà ATP-asiche della miosina risultano profondamente modificate: 1) l'attività enzimatica massimale aumenta più di venti volte; 2) lo ione Mg2+, che era inibitore per la sola miosina, è ora necessario all'attività ATP-asica e il vero substrato della reazione è il complesso Mg-ATP; 3) l'attività enzimatica diventa indipendente dallo ione Ca2+.
Questi tre caratteri sono propri dell'actomiosina ‛sintetica', cioè ricostituita da preparati altamente purificati di actina e di miosina. La presenza del complesso (tropomiosina + troponina) esercita un'azione regolatrice sulle proprietà ATP-asiche dell'actomiosina, come si vedrà più avanti.
Sul piano della cinetica enzimatica, l'attività ATP-asica dell'actomiosina (AM) percorre le tappe (4), (5), (2), (6), (7) dello schema riportato in precedenza (v. Taylor, 1972). Come per la miosina, la prima tappa consiste in una fissazione del nucleotide sull'enzima. Questa fissazione ha come effetto primario quello di ‛dissociare' il complesso in actina e miosina-ATP. L'ATP viene poi idrolizzato secondo lo schema già presentato per la miosina. Dopo idrolisi, l'actina si riassocia alla miosina per formare il complesso AM.ADP.Pi. Questa volta il distacco dei prodotti della reazione (contrariamente a ciò che avviene per l'M.ADP.Pi) è un fenomeno rapido e l'actomiosina viene rigenerata per essere subito dissociata di nuovo attraverso l'ATP, e così per tutto il tempo in cui la concentrazione di ATP resta significativa.
Si vede dunque che il ciclo dell'ATP-asi dell'actomiosina comporta una fase in cui le proteine contrattili sono unite (riga superiore dello schema) e un'altra in cui esse sono dissociate (riga inferiore). L'effetto catalitico dell'actina sull'ATP-asi è dovuto alla rapidità della reazione (7) rispetto alla reazione (3). Semplificando si può dire che questo ciclo risulta dalla competizione tra actina e nucleotide per la miosina, la cui affinità per l'ATP è maggiore che per l'actina (dissociazione del complesso, reazione 5), ma la situazione è invertita in presenza di ADP (riassociazione, reazione 6).
Il ruolo delle proteine regolatrici tropomiosina e troponina. - L'idrolisi dell'ATP da parte del complesso purificato actina-miosina sfugge a tutti i controlli. In compenso la presenza di tropomiosina e di troponina rende l'attività ATP-asica dipendente dalla presenza di ioni Ca2+ (v. fig. 15). Quando la concentrazione di quest'ultimo è inferiore a 10-7 M, l'attività enzimatica viene profondamente inibita; al di sopra di questa soglia, l'attività aumenta con la concentrazione in Ca2+ per raggiungere il suo valore massimale intorno a 5 × 10-5 M. È da notare che questa attivazione della ATP-asi da parte del Ca2+ avviene a concentrazioni micromolari. Si tratta pertanto di un effetto del tutto diverso da quello del Ca2+ sull'ATP-asi miosinica pura, dove lo ione deve raggiungere concentrazioni da 100 a 1.000 volte più elevate.
In assenza di Ca2+, la situazione è dominata dall'unità inibitrice della troponina (TNI); tale inibizione viene rimossa quando il Ca2+ si fissa sulla TNC, l'unità della troponina che fissa il calcio.
Abbiamo visto sopra che le proteine regolatrici sono unite all'actina nel filamento secondario, secondo un'architettura macromolecolare ben precisa (v. fig. 12). Lo studio dell'ultrastruttura di questo ifiamento e dei cambiamenti di organizzazione che avvengono come conseguenza della fissazione di ioni Ca2+ sulla TNC ha permesso di comprendere il controllo dell'interazione actina-miosina esercitato congiuntamente dal calcio e dalle proteine regolatrici. Questi lavori sono basati da una parte sull'analisi dello spettro di diffrazione dei raggi X nel muscolo vivente, a riposo e in contrazione (specialmente nella regione dello spettro che deriva dai filamenti secondari: v. Huxley, 1953 e 1968; v. Haselgrove, 1972), e dall'altra parte sull'esame al microscopio elettronico di filamenti secondari isolati in un mezzo a concentrazione variabile di Ca2+ (v. Gillis e O'Brien, 1975).
Quando la concentrazione di ioni Ca2+ è inferiore a 10-7 M, oppure negli esperimenti in vivo, quando il muscolo è a riposo, la tropomiosina si trova spostata rispetto al centro della scanalatura che separa le due catene dei globuli di actina: essa occupa assieme alla troponina una posizione eccentrica. In questa posizione, la tropomiosina ricopre quella regione dell'actina che contiene il sito reattivo per la miosina, determinando così un impedimento sterico all'interazione actina-miosina. Questa situazione è dovuta alla TNI, che ha una forte affinità per l'actina e mantiene la tropomiosina in questa posizione eccentrica. Inoltre, siccome la molecola della tropomiosina ha una lunghezza di circa 40 nm, essa assicura l'inibizione di un segmento del filamento secondario della stessa lunghezza che comprende 7 molecole di actina. Quando si ha la fissazione del Ca2+ sulla TNI, il legame TNC-TNI si rinforza, quello TNI-actina diventa più debole, e ciò permette alla tropomiosina di occupare la sua posizione spontanea, al centro della scanalatura del filamento (v. fig. 16), scoprendo cosi il sito reattivo dell'actina per la miosina.
In questo modo l'attività ATP-asica dell'actomiosina viene controllata dal livello di calcio sarcoplasmatico attraverso le proteine regolatrici. Vedremo nel cap. 3 come tale livello vari in funzione dell'eccitazione del muscolo.
I sistemi contrattili semplificati. - L'analisi della composizione proteica del muscolo ha condotto rapidamente alla ricostituzione in vitro dei sistemi contrattili di cui si possono controllare adeguatamente tutti i parametri fisico-chimici. Abbiamo già parlato del più semplice di essi: il gel di actomiosina, la cui superprecipitazione in presenza di ATP viene considerata come la manifestazione più elementare della contrazione.
Sono stati introdotti altri modelli di composizione sempre più complessa che, rendendo possibili un gran numero di esperimenti, hanno contribuito notevolmente alle nostre conoscenze attuali sulla contrazione.
Weber (v., 1950) e la sua scuola introdussero, negli anni trenta, il modello del filo orientato di actomiosina, ottenuto a partire dall'actomiosina posta in soluzione in un mezzo a elevata forza ionica (0,6). Questa soluzione viene iniettata lentamente in un mezzo a forza ionica debole (0,1), dove l'actomiosina precipita sotto forma di un filamento. Nonostante la sua fragilità, il filamento di actomiosina posto in presenza di ATP sviluppa una forza orientata misurabile: esso, accorciandosi, può sollevare carichi di qualche milligrammo. L'analogia con la contrazione è dunque molto maggiore che nel caso della superprecipitazione. Recentemente questo modello è stato di nuovo utilizzato per dimostrare che un'actomiosina ottenuta a partire da una miosina contenente una sola estremità globulare (frammento S1), invece di due, si può contrarre normalmente. Il ruolo dei due frammenti S1 è probabilmente identico e non è né competitivo né cooperativo (v. Cooke e Franks, 1978).
Szent-Györgyi (v., 1951) introdusse nel 1949 un secondo tipo di modello, la fibra detta ‛glicerinata'. Alcuni fasci muscolari contenenti un'esigua quantità di tessuto connettivo sono trattati con una soluzione di glicerolo al 50%. Questo trattamento distrugge le membrane e i loro annessi (reticolo sarcoplasmatico, mitocondri), elimina gli ioni e la maggior parte dei metaboliti (ATP, glucosio, lattato), oltre a tutti gli enzimi solubili (in particolare gli enzimi del sistema glicolitico che si trovano nel sarcoplasma). Restano solo lo stroma e le miofibrille, praticamente normali, mentre la striatura rimane praticamente inalterata. La composizione proteica di questo preparato è molto più complessa di quella del gel di actomiosina, in particolare sono presenti le proteine regolatrici tropomiosina e troponina. Questi fasci possono allora essere divisi in fascicoli più sottili, e anche in fibre isolate, al fine di facilitare la diffusione degli agenti applicati dall'esterno. Si possono infine lacerare meccanicamente queste fibre in maniera da isolare frammenti di miofibrille, il cui comportamento può essere esaminato al microscopio in presenza di agenti attivi.
La fibra glicerinata ha permesso di definire i tre stati fondamentali della fibra muscolare (v. fig. 17).
A. Il rigor mortis. Può sembrare paradossale cominciare da questo stato, ma esso corrisponde a quello delle fibre glicerinate appena preparate: le fibre sono rigide e uno stiramento non produce cambiamenti nella lunghezza della banda isotropa (v. fig. 8). Tutto sembra indicare che i ponti fra i filamenti primari e secondari siano saldati nella posizione che essi occupano al momento della preparazione. Questa situazione è dovuta all'assenza di ATP.
B. La contrazione. In presenza di ATP e di Mg2+ (ambedue a concentrazioni dell'ordine di 1 mM) e di Ca2+ in concentrazione micromolare, le fibre glicerinate si contraggono sollevando pesi oppure sviluppano una tensione in condizione isometrica (v. cap. 4, È c). La tensione sviluppata a lunghezza costante è analoga a quella dei muscoli d'origine; essa dipende dalla lunghezza e dalla temperatura esattamente come nel caso del muscolo eccitato tetanicamente. Come in quest'ultimo, nel modello sottoposto a improvvisa distensione si ha una rapida diminuzione della tensione durante l'accorciamento e poi un rapido aumento sino al valore caratteristico della nuova lunghezza (quick release recovery di Gasser e Hill; v. cap. 4). Questa contrazione si accompagna a un'idrolisi continua di ATP; ciò dimostra che il mantenimento di una forza costante si basa su un rifornimento continuo di energia.
C. Il rilasciamento. Questo stato è caratterizzato sul piano meccanico dalla scomparsa della forza di contrazione e dal fatto che il preparato diventa più morbido e non offre resistenza allo stiramento che provoca un allungamento delle bande isotrope. In queste condizioni i filamenti scorrono liberamente gli uni sugli altri. Questo stato può essere riprodotto con fibre glicerinate, se si abbassa la concentrazione di Ca2+ del mezzo a valori inferiori a 10-7 M lasciando tuttavia inalterata la concentrazione di ATP e di Mg2+. Tale abbassamento di Ca2+ si ottiene tramite chelanti ad alta affinità e specificità per detto ione (per es. l'etileneglicol-bis [2-amminoetiltetracetato] di sodio, EGTA) oppure con preparati isolati di reticolo sarcoplasmatico. L'effetto rilasciante dell'abbassamento di Ca2+ si spiega con la presenza di proteine regolatrici il cui effetto inibitorio sull'interazione actina-miosina si esplica solamente in assenza di Ca2+.
La necessità della presenza di Mg-ATP al fine di ottenere il rilasciamento si spiega con l'effetto di dissociazione che produce l'ATP sull'actomiosina (v. reazione 5 dello schema). Questo effetto non richiede l'idrolisi di ATP.
Le fibre glicerinate hanno permesso innumerevoli esperimenti e costituiscono uno dei modelli semplificati più usati della contrazione.
Il preparato che si avvicina maggiormente alla fibra intatta si ottiene per dissezione della membrana esterna (fibra detta ‛pelata': v. Natori, 1954). Questo preparato offre il vantaggio di un accesso diretto al mezzo intracellulare, che può essere modificato a volontà, pur conservando non solo un apparato contrattile intatto, ma anche numerosi organuli intracellulari quali il reticolo sarcoplasmatico e i mitocondri.
I fattori di rilasciamento. - L'aggiunta di un estratto acquoso di polpa muscolare ad alcune fibre glicerinate in contrazione determina la contemporanea interruzione dell'idrolisi dell'ATP e della contrazione (v. Bendall, 1952; v. Marsh, 1952). L'aggiunta di ioni Ca2+ al mezzo è sufficiente per ripristinare la contrazione. La proprietà ‛rilassante' è legata a una frazione sedimentabile, costituita da organuli che presentano al microscopio elettronico l'aspetto di piccole vescicole dal contenuto mal differenziato (v. Ebashi, 1958). Si tratta senza dubbio di residui del reticolo sarcoplasmatico, distrutto dalla triturazione del muscolo, i cui tubuli lacerati si ricostituiscono sotto forma di vescicole: in questi preparati di vescicole si possono infatti mettere in evidenza delle tipiche triadi. Le vescicole possiedono l'importante proprietà di ridurre il tasso di calcio ionizzato del mezzo a un livello molto basso, inferiore a 10-8 M, mediante l'accumulo di Ca2+ con meccanismo attivo. Se si aggiunge al mezzo ossalato diluito, questo si ritrova sotto forma di un precipitato abbondante di ossalato di Ca all'interno delle vescicole (v. Hasselbach e Makinose, 1963). Come nel caso della contrazione, è l'idrolisi dell'ATP a fornire l'energia necessaria al trasporto attivo del Ca2+; ma essa è qui legata a un'attività ATP-asica diversa, propria delle vescicole, e strettamente accoppiata al trasporto del calcio: in assenza di ATP, l'accumulo di Ca2+ cessa; reciprocamente, l'idrolisi di ATP per mezzo delle vescicole è inibita in assenza di Ca2+ nel mezzo esterno. L'azione rilassante delle vescicole è il diretto risultato della loro azione sulla concentrazione in ioni calcio nel mezzo. Questa proprietà scompare sotto l'effetto di una serie di agenti che inibiscono l'accumulo del calcio: tioloprivi, che bloccano l'attività ATP-asica; lipasi batteriche o detergenti, che distruggono la membrana delle vescicole; caffeina, che inibisce l'idrolisi e il trasporto attivo di Ca2+ (da cui deriva l'azione contratturante di questo farmaco sul muscolo intatto).
L'origine della forza di contrazione. - Quando si confrontano i diagrammi di diffrazione ai raggi X di un muscolo a riposo e di uno allo stato di rigor, si notano differenze come se del materiale fosse passato dai filamenti primari a quelli secondari. Questa è stata una delle prime osservazioni di H. E. Huxley (v., 1953), che dovette però attendere 15 anni (v. Huxley, 1968) prima di poterla interpretare esattamente. L'ipotesi più semplice è illustrata nella fig. 18: la meromiosina pesante si stacca dall'asse del filamento primario, grazie alla mobilità del frammento S2 che funge da cerniera, e il frammento S1 si attacca a un globulo di actina del filamento secondario. Per spiegare l'accorciamento - e lo sviluppo di una tensione quando la lunghezza del muscolo è fissata - si pensa che in presenza di ATP il frammento S1 subisca una torsione dovuta al contatto con l'actina, esercitando una trazione sul frammento S2 e attirando da quella parte tutto il filamento primario. L'idrolisi dell'ATP permetterebbe la rottura del legamento, che si riformerebbe un po' più lontano (bisogna ricordare infatti che il periodo dell'actina e quello della miosina non sono identici).
È da rilevare che, in questa ipotesi, il vero sistema motore è costituito dal filamento di actina lungo il quale ‛scorre' una testa di molecola di miosina. Il sistema impone ben poche restrizioni alla disposizione del resto della molecola di miosina (il frammento S2 e la meromiosina leggera). Si possono dunque immaginare, a seconda delle circostanze, arrangiamenti diversi di queste molecole, che rendano conto, per esempio, della struttura dei muscoli lisci e che, al limite, possano spiegare le correnti citoplasmatiche, che in effetti si organizzano lungo microtubuli la cui natura chimica ricorda l'actina. Nel caso delle fibre muscolari striate, la contrazione deriva dalla disposizione speculare delle due metà di ciascun sarcomero (v. fig. 14), che permette di trarre statisticamente profitto dagli innumerevoli cicli di associazione e di dissociazione delle due proteine.
3. Il controllo della contrazione.
Un movimento è dovuto all'attività coordinata di un gran numero di fibre muscolari localizzate in una serie di muscoli: agonisti, antagonisti o sinergici. La configurazione spazio-temporale di questa attività è regolata dal sistema nervoso centrale, che dispone di due distinti meccanismi di gradazione fisiologica delle contrazioni: esso può reclutare un numero variabile di unità motrici, ciascuna delle quali può essere mobilizzata in grado crescente in funzione della frequenza degli impulsi nervosi (v. cap. 4).
Schematicamente si possono distinguere nel meccanismo di attivazione di ogni fibra quattro fasi: al suo arrivo alla giunzione neuromuscolare, l'impulso nervoso evoca un potenziale di azione che si propaga a tutta la superficie della membrana muscolare; l'eccitazione penetra indi profondamente verso il centro della fibra per mezzo del sistema dei canalicoli trasversi; ioni calcio vengono allora liberati nel sarcoplasma, dove attivano il sistema delle proteine contrattili; infine, quando gli ioni calcio scompaiono dal sarcoplasma, sopravviene il rilasciamento (v. fig. 19).
a) La depolarizzazione della membrana.
Come le cellule nervose, le fibre muscolari mantengono una differenza di potenziale da 60 a 100 mV tra una parte e l'altra della loro membrana (potenziale di riposo). L'esperienza dimostra che tutte le contrazioni fisiologiche sono precedute da una depolarizzazione.
In via sperimentale, si può abbassare il potenziale di membrana di una fibra isolata aumentando la concentrazione esterna di ioni potassio. Appena il potenziale di membrana raggiunge un certo livello critico, da −50 a −55 mV (la ‛soglia elettromeccanica'), la fibra sviluppa una certa tensione, che aumenta rapidamente se si accresce ancora la depolarizzazione, raggiungendo un valore massimo intorno a −25 mV (v. Hodgkin e Horowicz, 1960). È sufficiente rialzare localmente il potenziale di membrana per mezzo di una polarizzazione anodica per far scomparire in questo punto la contrattura da potassio. Sembra dunque che la risposta meccanica dipenda dalla depolarizzazione come tale (v. Kuffler, 1946); tuttavia anche se la depolarizzazione persiste, la contrattura si mantiene per un breve periodo di tempo che va da qualche secondo a qualche minuto: questa dissociazione tra il meccanismo contrattile e la depolarizzazione indica che quest'ultima non attiva direttamente le proteine contrattili, ma che vi è un meccanismo interposto tra i due fenomeni.
In condizioni fisiologiche, la depolarizzazione della membrana può essere provocata da agenti chimici, come ormoni, trasportati dal sangue e dai liquidi interstiziali. Così, per esempio, la tunica muscolare delle arteriole risponde direttamente all'adrenalina, all'istamina e ad altri metaboliti e le fibrocellule muscolari lisce dell'utero sono sensibili all'ossitocina. Un simile meccanismo potrebbe apparire del tutto eccezionale per i muscoli striati, che sono provvisti di un'innervazione più o meno abbondante; tuttavia la stimolazione nervosa agisce sempre in essi tramite un mediatore chimico, l'acetilcolina.
Le fibre muscolari scheletriche dei Vertebrati superiori sono per lo più innervate a livello di una, o in rari casi di alcune giunzioni neuromuscolari ben localizzate, abitualmente nella loro parte centrale. In condizioni normali, la membrana di queste placche motrici è sensibile al mediatore chimico, che è in questo caso l'acetilcolina; tutto il resto della membrana è eccitabile elettricamente. A livello della placca motrice, l'acetilcolina liberata dall'impulso nervoso provoca una depolarizzazione locale e graduata, il potenziale di placca motrice. Questo potenziale locale eccita la membrana muscolare che, con un meccanismo analogo alla conduzione nervosa, propaga l'onda di depolarizzazione fino alle due estremità della fibra sotto forma di un potenziale d'azione muscolare. Per questa ragione la risposta è del tipo tutto-o-nulla (fibre fasiche). (V. elettrofisiologia e sinapsi).
Il potenziale d'azione muscolare è caratterizzato da notevole ritardo nella ripolarizzazione completa della membrana. Nell'uomo la velocità di propagazione è di 4-5 metri al secondo che, vista la relativa lentezza dei fenomeni meccanici (v. fig. 20) e la posizione centrale delle placche motrici, è sufficiente ad assicurare un'attivazione immediata di tutta la membrana della fibra. Il potenziale d'azione si accompagna a un periodo refrattario compreso tra 2 e 5 millisecondi per i muscoli scheletrici degli arti. Esso impone evidentemente un limite superiore (dell'ordine di 200-500 per secondo) alla frequenza dell'attivazione elettrica del muscolo. Questo massimo non è mai raggiunto in condizioni fisiologiche.
Il valore della soglia elettromeccanica può essere abbassato sostituendo il cloruro del liquido extracellulare con anioni bromuro, ioduro o nitrato. Durante il potenziale d'azione, la membrana raggiunge allora più rapidamente il valore soglia e vi ritorna più tardivamente: il periodo efficace del potenziale di azione viene aumentato e così si spiega il potenziamento della scossa meccanica provocata da questi anioni di sostituzione (v. Sandow e altri, 1965). Un identico effetto può essere ottenuto con certi ioni, come Zn2+ e UO22+, che senza abbassare la soglia elettromeccanica ritardano la ripolarizzazione della membrana (v. fig. 21).
b) La penetrazione dell'eccitazione in profondità.
È suggestiva l'ipotesi che la depolanzzazione della membrana agisca in profondità, lasciando passare o liberando una sostanza in grado di diffondere sino alle proteine contrattili per attivarle. È stato specificamente proposto che tale effetto sia dovuto allo ione calcio (v. Heilbrunn e Wiercinsky, 1947). Tuttavia, salvo forse il caso dei muscoli lisci, la diffusione è un fenomeno troppo lento per giustificare la velocità con la quale l'eccitazione partita dalla membrana invade in alcuni millisecondi la totalità di una fibra muscolare, il cui diametro raggiunge talvolta 100 μm nei Vertebrati e anche 500 μm nei Crostacei.
Gli esperimenti di A. F. Huxley e Taylor (v., 1958) forniscono una base sperimentale all'ipotesi secondo la quale esisterebbe una conduzione radiale dell'eccitazione verso il centro della fibra lungo una delle strutture che compongono le triadi. Una micropipetta del diametro di 1 μm viene applicata alla superficie di una fibra muscolare isolata di rana; rendendo l'interno della pipetta elettricamente negativo rispetto alla soluzione in cui sta immersa la fibra, si può depolarizzare una piccolissima area della membrana muscolare. Non è stata osservata alcuna risposta al passaggio della corrente quando la micropipetta è rivolta verso una banda A; ma quando la micropipetta guarda verso una banda I, la stimolazione determina una contrazione limitata a questa banda. La risposta di una banda I dipende dalla posizione della pipetta: spostando la pipetta lungo il perimetro della fibra, si trovano posizioni, distanti 5 μm l'una dall'altra, da cui si può stimolare la fibra. La contrazione è sempre limitata alla sola banda I sottostante e alle bande I delle miofibrille vicine sistemate in linea, cosicché la contrazione si propaga profondamente verso il centro della fibra senza propagarsi longitudinalmente.
La linea Z resta sempre al centro della banda I e anche se la micropipetta non è esattamente centrata sulla linea Z, le due semibande I che vi si attaccano si raccorciano egualmente (v. fig. 22). Queste osservazioni mostrano che l'effetto attivatore di una depolarizzazione è trasmesso verso l'interno della fibra da strutture situate al centro della banda I e collegate alla membrana a intervalli di molti μm tra di loro: questa è esattamente la posizione dei canalicoli trasversi (sistema T; v. fig. 3). Una particolarità di alcuni muscoli, come quelli di lucertola, rende questa identificazione molto probabile. Questi muscoli possiedono due sistemi di triadi per sarcomero, a livello di ogni giunzione A-I; se si pone una micropipetta a fianco di una linea Z, la stimolazione provoca la contrazione della semibanda I sottostante, cosicché la linea Z è attirata verso la pipetta: la contrazione è anche in questo caso centrata sulla posizione della triade (v. fig. 22).
Non è ancora del tutto chiarito come il segnale elettrico si propaghi lungo i tubuli trasversali. Si distinguono due modalità di propagazione dei segnali elettrici lungo cellule quali quelle muscolari e quelle nervose. La prima è il potenziale di azione, fenomeno autorigenerativo che si propaga secondo la legge del tutto-o-nulla e che si manifesta solo se la depolarizzazione locale, che lo ha prodotto, raggiunge un valore soglia; la seconda è quella di alcune depolarizzazioni sottoliminari che si propagano in modo elettrotonico: questa seconda modalità presenta grandi analogie con la propagazione passiva dei segnali in un conduttore coassiale, come ad esempio un cavo telefonico sottomarino. Una differenza di potenziale costante, tra il mezzo esterno e il nucleo del cavo, applicata a una sua estremità, si attenua lungo il cavo in modo esponenziale. Si definisce come costante di lunghezza la distanza alla quale il segnale è ridotto al 37% della sua ampiezza iniziale. Questa costante è dell'ordine di centinaia di chilometri per i cavi transoceanici e dell'ordine del millimetro per la fibra muscolare.
Gli studi di Adrian e altri (v., 1969) hanno dimostrato che se il segnale elettrico si propagasse elettrotonicamente in profondità, la sua ampiezza al centro della fibra sarebbe ancora sufficiente per attivare le miofibrille centrali, ma mancherebbe quasi del tutto un margine di sicurezza. Se, per una ragione qualunque, l'ampiezza del potenziale d'azione venisse a diminuire, un certo numero di miofibrille profonde non sarebbe più attivato e la forza di contrazione ne sarebbe subito ridotta. D'altra parte, secondo Costantin (v., 1970), la propagazione in profondità presenta certe analogie con la propagazione del potenziale d'azione in superficie, in particolare essa richiede la presenza di ioni Na+.
Si è riusciti a misurare la velocità di propagazione radiale dell'eccitamento filmando a grande velocità l'irrigidimento delle miofibrille centrali di una fibra isolata di rana (v. Gonzales-Serratos, 1971). A 20 °C questa velocità raggiunge 8 cm/s, così che sono sufficienti 0,5 ms per attivare in profondità una fibra del diametro di 100 μm.
c) L'intervento degli ioni calcio.
Necessità del calcio. - Le ricerche di Ringer (v., 1883) hanno dimostrato che per mantenere l'eccitabilità e la contrattilità muscolare è necessaria la presenza nel mezzo circostante di tre cationi, Na+, K+ e Ca2+, ciascuno in opportuna concentrazione. In un mezzo povero di Ca2+, il cuore cessa di contrarsi anche se il potenziale d'azione cardiaco persiste (v. Mines, 1913); ciò indica che il Ca2+ interviene nella correlazione tra depolarizzazione della membrana e attivazione del meccanismo contrattile.
Nel caso del muscolo striato, l'eliminazione del calcio esterno rende il muscolo ineccitabile, dopo un breve periodo di ipereccitabilità. Non è più possibile evocare un potenziale d'azione, ma è ancora possibile depolarizzare la membrana aumentando la concentrazione extracellulare di potassio. Per ripristinare la contrazione da depolarizzazione, assente in queste condizioni, è sufficiente aggiungere calcio. Heilbrunn e Wiercinsky (v., 1947) hanno provocato una contrazione locale molto violenta iniettando con una microsiringa ioni calcio all'interno di una fibra muscolare. L'iniezione di altri ioni, Na+, K+ o Mg2+, non provoca tale contrazione.
Modo d'azione del calcio. - Ricordiamo che l'attività ATP-asica dei modelli glicerinati dipende dalla concentrazione di ioni calcio nel mezzo (v. fig. 15): assente a concentrazioni inferiori a 10-7 M, tale attività raggiunge il massimo a partire da concentrazioni 10-5 M. Lo stesso tipo di relazione si osserva nel caso della contrazione delle fibre muscolari. Hellam e Podolsky (v., 1969) tolsero per microdissezione la membrana ad alcune fibre muscolari che immersero in soluzioni a concentrazioni di Ca2+ varianti tra 10-9 M e 10-5 M. La fibra muscolare passava dal riposo all'attività meccanica massimale in modo reversibile quando la concentrazione sarcoplasmatica in Ca2+ variava tra 10-8 M e 10-5 M.
L'influenza del Ca2+ sulla tensione si estende dunque su una variazione di concentrazione di due-tre ordini di grandezza. La relazione illustrata nella fig. 23 suggerisce la possibilità di un meccanismo intracellulare di gradazione delle contrazioni. È infatti possibile che questo meccanismo svolga un ruolo nella contrazione del cuore e dei muscoli lisci: ma nel caso dei muscoli striati scheletrici, l'eccitazione provoca apparentemente un tale aumento della concentrazione sarcoplasmatica in Ca2+ che l'attivazione meccanica dovrebbe essere di colpo massimale: in tal caso l'influenza del calcio sulla contrazione è del tipo tutto-o-nulla.
Con l'aiuto di miscele tampone calciche, che mantengono il tasso del calcio ionizzato a livello costante, Portzehl e altri (v., 1964) hanno potuto osservare che fibre intatte di Crostacei (diametro 0,5 mm e quindi facilmente iniettabili) si contraggono se la concentrazione degli ioni calcio varia da 0,3 a 1,5 × 10-6 M, e si rilasciano se la concentrazione cade al di sotto di 10-7 M. La conclusione importante è che, a riposo, il livello di calcio ionizzato del sarcoplasma è sufficientemente basso per inibire l'actomiosina e provocare il rilasciamento.
Liberazione intracellulare del calcio. - Durante una scossa muscolare si producono scambi di Ca2+ tra il sarcoplasma e il mezzo extracellulare, che sono però di entità insufficiente a permettere un'attivazione completa della fibra (v. Bianchi e Shanes, 1959). Bisogna dunque che il calcio necessario provenga da una riserva intracellulare. Tali riserve esistono senza dubbio, perché 1 grammo di cellule muscolari contiene circa 2 μmoli di calcio.
Ricordiamo che alcuni frammenti isolati del reticolo sarcoplasmatico accumulano attivamente il calcio, per il quale presentano grande affinità. Podolsky (v., 1964) e i suoi collaboratori hanno potuto localizzare in vivo questa riserva di calcio iniettando in una fibra una esigua quantità di calcio: dopo una contrazione transitoria, il muscolo si rilascia, grazie alla captazione del calcio iniettato; iniettando allora nella stessa zona ossalato ed esaminando quindi al microscopio elettronico la fibra fissata, si può vedere che il precipitato denso d'ossalato di calcio si ritrova esclusivamente in una regione ben precisa del reticolo sarcoplasmatico longitudinale, e cioè nelle dilatazioni sacculari o cisterne che sono accollate ai tubuli trasversali e formano con essi le triadi a livello di ogni linea Z, o dei limiti tra le bande A e I (v. figg. 3 e 7).
Il calcio intracellulare, dunque, si accumula nelle immediate vicinanze delle strutture che portano l'eccitazione in profondità (per ciò che riguarda la funzione dei tubuli trasversali, v. A. F. Huxley e Taylor, 1958). Si pensa che la depolarizzazione delle membrane dei tubuli trasversali, durante il potenziale d'azione, aumenti la permeabilità al calcio delle cisterne e/o inibisca transitoriamente il sequestro del calcio, provocandone così l'improvvisa liberazione nel sarcoplasma.
Alcuni studi autoradiografici avevano già dimostrato che il 45Ca dei muscoli fissati durante contrazione si ritrovava distribuito in tutto il sarcomero, mentre a riposo esso era concentrato a livello della triade (v. Winegrad, 1965). Tuttavia la più chiara dimostrazione della liberazione fisiologica di calcio è stata data da Ashley e Ridgway (v., 1968). Questi autori iniettarono in una fibra gigante di Balanus (del diametro di 2 mm) una soluzione di equorina - una proteina isolata da alcune meduse della costa occidentale degli Stati Uniti - che reagisce in presenza di calcio ionizzato con emissione di luce, comportandosi come un indicatore ideale per studiare, misurando la luce emessa, la cinetica della liberazione di ioni Ca2+ nella fibra durante l'eccitazione (v. bioluminescenza). I risultati dei loro esperimenti sono riprodotti nella fig. 24, che permette di analizzare i rapporti temporali tra depolarizzazione della membrana, liberazione del Ca2+ e sviluppo della tensione meccanica. Si vede che l'emissione di luce, che denota l'aumento del tasso di Ca2+ sarcoplasmatico, segue la depolarizzazione, ma precede la comparsa della tensione. Prolungando la depolanzzazione si prolunga e aumenta l'emissione luminosa, come anche la forza sviluppata. Il massimo di emissione luminosa corrisponde alla velocità massimale di ascesa della tensione. Poco dopo l'inizio della ripolarizzazione, l'intensità luminosa comincia a decrescere; essa ritorna al livello di partenza quando la tensione raggiunge il massimo. Al momento della contrazione, il tasso di Ca2+ sarcoplasmatico è dunque ritornato molto basso, il che implica che il calcio è di nuovo legato, ora sulle molecole di troponina, lungo i filamenti secondari.
La liberazione di calcio nel sarcoplasma non è tuttavia sufficiente a provocare la contrazione; il calcio deve raggiungere, senza dubbio per diffusione, la regione del sarcomero dove i filamenti di actina e di miosina si sovrappongono (nella banda A). Questo è stato dimostrato iniettando con una micropipetta una quantità di Ca2+ assai piccola in diversi punti del sarcomero di una miofibrilla isolata; in tali condizioni, si ottiene contrazione solo se il Ca2+ è applicato nella zona di sovrapposizione (v. Gillis, 1969; v. fig. 25). Quest'ultima fase dell'attivazione si basa dunque sulla diffusione, che è un processo molto lento su scala macroscopica; nel caso del muscolo, tuttavia, la distanza da percorrere è ridotta agli 1-2 μm che separano le cisterne dalla zona di sovrapposizione, e viene percorsa in appena qualche millisecondo.
Il rilasciamento per mezzo della ricaptazione del calcio. - La liberazione di calcio dalle cisterne è un evento molto rapido, al pari dei fenomeni di depolarizzazione da cui dipende. Se non sopravviene un nuovo potenziale d'azione, il calcio liberato è rapidamente ‛ripompato' finché la sua concentrazione sarcoplasmatica diviene insufficiente a togliere l'inibizione che la tropomiosina nativa esercita sull'actomiosina. Si è potuto valutare che l'attività della pompa è tale che tutto il calcio liberato con un'eccitazione può essere ricaptato in 100 ms, ciò che spiega molto bene il tempo di rilasciamento della scossa (v. Ohnishi ed Ebashi, 1964).
4. Le proprietà meccaniche.
L'eccitazione trasforma una fibra flessibile in un corpo duro che tende a contrarsi. L'accorciamento e lo sviluppo di una forza costituiscono i due aspetti estremi della contrazione muscolare: essi sono generalmente associati ogni volta che la fibra cambia lunghezza effettuando un lavoro meccanico contro una forza o una resistenza esterna. Queste proprietà meccaniche si studiano con miografi di diverso tipo: quelli che permettono di valutare la forza del muscolo a lunghezza costante (condizioni isometriche) e quelli che misurano i cambiamenti di lunghezza (e la loro velocità) a forza costante (condizioni isotoniche); gli ergometri, infine, permettono di misurare il lavoro nelle condizioni più realistiche, quando la forza e la lunghezza variano nello stesso tempo.
a) Reologia della fibra muscolare.
Il modello a tre componenti. - Il meccanismo contrattile, costituito dal sistema dei filamenti a scorrimento descritti nel cap. 2, fa parte di una struttura complessa, ogni elemento della quale possiede certe proprietà meccaniche che interessano la funzione muscolare. Secondo Hill (v., 1949) si possono distinguere tre principali componenti (v. fig. 26): il meccanismo contrattile propriamente detto (C), alcuni elementi elastici (ES) con i quali il meccanismo è in serie, e altri elementi (EP) con i quali è in parallelo. L'esatta posizione e la natura di queste componenti elastiche non sono note. Tra gli elementi in serie, bisogna considerare non solo i tendini e gli eventuali sistemi di unione con gli apparecchi di misura, ma anche alcune parti dello stesso meccanismo contrattile, come le linee Z e, senza dubbio, i ponti che uniscono la miosina all'actina. Ai valori massimi di forza sviluppata durante la contrazione, queste strutture possono allungarsi per una quota pari al 3% della lunghezza della fibra a riposo; e a questa quota bisogna aggiungere dal 2 al 5% tenendo conto dei sistemi esterni di registrazione.
Tra gli elementi in parallelo devono essere considerati i viluppi fibrosi dei fasci muscolari e i sarcolemmi di ogni fibra, rinforzati dalla trama di fibre connettivali; ma questi elementi intervengono soltanto a partire da un allungamento pari al 2o-3o% della lunghezza a riposo. Non bisogna inoltre trascurare il sistema dei tubuli longitudinali del reticolo sarcoplasmatico.
Quanto al meccanismo contrattile, esso certamente svolge un'importante funzione nella contrazione; ma già a riposo, benché sia perfettamente estensibile grazie all'azione plastificante dell'ATP, lo scorrimento di milioni di miofilamenti contribuisce senza dubbio ai fenomeni viscosi e plastici che stiamo per descrivere, soprattutto ai grandi allungamenti durante i quali questi filamenti si accostano.
I fenomeni elastici a riposo. - La fibra a riposo presenta le proprietà elastiche molto imperfette di una gomma mal vulcanizzata. Lo stiramento genera una tensione passiva progressivamente crescente della quale sono responsabili soprattutto gli elementi in parallelo (tensione di riposo). W. O. Fenn ha paragonato a un tessuto di lana lavorato a maglia queste strutture, formate da fibrille intrecciate: per ogni grado di estensione, nuove fibrille si orientano nel senso della trazione e partecipano alla resistenza: da ciò deriva un andamento esponenziale del diagramma tensione-estensione a riposo (v. fig. 29, curva 1).
La tensione di riposo non dipende solo dallo stiramento, ma anche dalla sua velocità (viscosità) e dai trattamenti subiti in precedenza dalla fibra (plasticità). Se si sottopone bruscamente una fibra a un carico, essa si allunga in due fasi, l'una quasi istantanea, l'altra più o meno ritardata: è il fenomeno dello ‛scorrimento' (v. fig. 27A). Quando si toglie il carico, l'accorciamento elastico presenta due fasi corrispondenti e alla fine persiste una deformazione permanente. Reciprocamente, l'estensione rapida di una fibra determina un aumento immediato della tensione elastica, seguito da una lenta caduta verso un valore più basso: questo è il fenomeno del ‛rilasciamento della costrizione' (v. fig. 27B). La tensione finale non è una semplice funzione della lunghezza: per una medesima lunghezza finale della fibra, la tensione è sempre più elevata dopo un allungamento che dopo un accorciamento: questo è il fenomeno dell'‛isteresi elastica'.
Questi fenomeni hanno notevole importanza soprattutto nella fisiologia delle fibre muscolari lisce della parete dei visceri cavi, come l'intestino o la vescica, mentre svolgono un ruolo di minor rilievo nei muscoli striati.
b) Sviluppo della contrazione.
La scossa. - È una risposta meccanica a un eccitamento unico applicato al muscolo indirettamente, per mezzo del nervo, o direttamente: la fig. 28 (curva a) ne descrive la forma in condizioni isometriche di registrazione. Dopo un breve periodo di latenza, dovuto alla conduzione nervosa e ai fenomeni di accoppiamento tra eccitazione e contrazione, descritti in precedenza, si sviluppa la tensione attiva. In una prima fase, detta di contrazione, la tensione raggiunge un massimo: è seguita poi da una seconda fase, detta di rilasciamento, durante la quale la tensione riprende il suo valore di riposo. La fase di contrazione occupa pressappoco un terzo della durata totale della scossa, durata che dipende dal tipo di fibra muscolare. Nei Mammiferi, a 37 °C, si distinguono le fibre muscolari lente e le fibre muscolari rapide, le cui fasi di contrazione durano rispettivamente da 50 a 200 ms e da 5 a 30 ms.
La scossa costituisce la forma normale di attività del muscolo cardiaco, ma in condizioni fisiologiche si verifica eccezionalmente nei muscoli dello scheletro (riflessi tendinei o fascicolazioni della tetania). Infatti gli impulsi nervosi motori sono in generale costituiti da raffiche, e la ripetizione delle eccitazioni modifica la risposta meccanica.
Sommazione e tetani. - La durata del periodo refrattario che segue il potenziale d'azione della fibra muscolare è assai più breve della durata della risposta meccanica. È perciò possibile rieccitare la fibra prima della scomparsa della risposta al primo stimolo. La curva b della fig. 28 mostra come la nuova risposta si innesti sulla prima, con un processo di sommazione; l'entità della risposta combinata dipende dall'intervallo tra i due stimoli. La ripetizione di questo meccanismo può condurre a una risposta ancora più forte se molti stimoli si susseguono a intervalli sufficientemente ravvicinati. Questo tipo di risposta, del tutto fisiologica, è detta ‛tetano' (v. fig. 28, curva c). Il tetano è completo se la frequenza di eccitazione è sufficientemente elevata da far scomparire le oscillazioni visibili della tensione. La frequenza di fusione è compresa tra 50 e 500/s a 37 °C.
La ripetizione degli impulsi permette al sistema nervoso di prolungare la durata delle contrazioni e di mantenere una tensione stabile. Questa può raggiungere da due a quattro volte la tensione massimale della scossa se il tetano è completo: la variazione di frequenza dei potenziali d'azione costituisce dunque un meccanismo fisiologico di gradazione delle contrazioni. Se in condizioni naturali non si osservano oscillazioni della tensione paragonabili a quelle della fig. 28 (curve b e c), ciò è dovuto all'asincronismo dell'attività di numerose unità motrici che costituiscono il muscolo. Nell'eccitazione artificiale, al contrario, tutte le fibre sono eccitate simultaneamente.
Il concetto di stato di attività. - Può sembrare strano che la tensione non raggiunga i suoi valori massimi che dopo 0,1 s dall'inizio della scossa, e ancora più tardi durante il tetano, mentre la liberazione del calcio all'interno della fibra si verifica in alcuni millisecondi (v. cap. 3). Come può essere tanto ritardata l'attivazione delle proteine contrattili? Il modello della fig. 26 chiarisce il paradosso: l'evoluzione della tensione risulta dall'interazione tra il meccanismo contrattile e gli elementi elastici che lo collegano alle inserzioni ossee o agli strumenti di misura. A lunghezze fisiologiche, alle quali l'influenza degli elementi in parallelo è trascurabile, la tensione si manifesta all'esterno nella misura in cui gli elementi elastici in serie sono stirati dal meccanismo contrattile che si raccorcia (v. Hill, 1949); orbene, la velocità dell'accorciamento diminuisce quando la resistenza incontrata aumenta. Secondo Hill, assai prima del culmine della scossa il meccanismo contrattile passa rapidamente dallo stato di riposo, in cui è plastico, allo ‛stato di attività' completa, caratterizzato dai suoi due aspetti complementari: capacità di esercitare una forza o di resistervi e capacità di accorciarsi a una data velocità.
Numerosi dati convalidano questa ipotesi. Innanzitutto, nel caso della scossa isometrica è sufficiente stirare leggermente il muscolo verso la fine del periodo di latenza per vederlo sviluppare e mantenere, dopo meno del 10% del tempo normale di contrazione, una tensione vicina alla tensione tetanica: con tale manovra si è senza dubbio fatto economizzare al meccanismo contrattile lo stiramento degli elementi elastici in serie. Inoltre in condizioni isotoniche, subito dopo il periodo di latenza, l'accorciamento del muscolo sartorio di rana eccitato inizia alla velocità massimale; questa non è quasi aumentata dall'eccitazione tetanica, la quale prolunga solamente la durata dell'accorcianiento. Infine bisogna ricordare il fenomeno conosciuto sotto il nome di quick release recovery. Se durante il plateau di un tetano isometrico si accorcia bruscamente la fibra di una frazione della sua lunghezza iniziale, così da allentare gli elementi elastici in serie, la tensione si annulla per poi ristabilirsi seguendo una curva molto simile a quella dello sviluppo iniziale della tensione: nella misura in cui l'attivazione è completa durante il plateau tetanico, questa osservazione dimostra l'intervento degli elementi elastici in serie nel progressivo sviluppo della tensione misurata.
Lo stato di attività si stabilisce rapidamente ma non istantaneamente, e in molti tipi di fibra la ripetizione dell'eccitamento può aumentare la sua intensità. Secondo alcuni autori, questa intensità potrebbe essere influenzata dalle manovre di distensione o di stiramento con le quali si cerca di valutare lo stato di attività. Il concetto è nondimeno utile per interpretare le proprietà meccaniche dei muscoli.
c) La tensione tetanica.
Influenza della lunghezza della fibra. - La tensione sviluppata durante la contrazione isometrica dipende in modo caratteristico dalla lunghezza della fibra al momento dell'eccitazione (v. fig. 29): raggiunge un massimo, compreso tra 2 e 4 kg per cm2 di sezione, per lunghezze all'incirca corrispondenti alla lunghezza in situ (l0); per una lunghezza minore decresce in modo regolare, e tende a zero per lunghezze comprese tra 0,5 e 0,6 l0. A grandi lunghezze, la comparsa della tensione di riposo complica la forma del diagramma tensione-lunghezza (v. fig. 29, curva 1). Se gli elementi elastici in parallelo non sono troppo rigidi, la tensione totale inizia a diminuire a valori superiori a l0 come nella fig. 29 (curva 3) e passa per un minimo prima di raggiungere la tensione di riposo a grandi lunghezze. Il supplemento di tensione provocato con l'eccitazione (v. fig. 29, curva 2) diminuisce dunque a lunghezze crescenti e raggiunge lo zero verso 1,5-1,8 l0.
L'influenza determinata dalla lunghezza delle fibre non può quasi manifestarsi nel caso dei muscoli scheletrici, nei quali le disposizioni anatomiche limitano i movimenti intorno alla lunghezza ottimale, l0; al contrario essa ha un ruolo importante nella fisiologia del muscolo cardiaco, poiché è in parte responsabile della regolazione della gettata in funzione dell'apporto di sangue venoso (legge di Starling del cuore), la sola che sussista dopo trapianto cardiaco. L'interpretazione della forma del diagramma costituisce un grande successo della teoria dello scorrimento dei filamenti sviluppata nel cap. 3. Infatti, se si ammette che la tensione di riposo sia dovuta essenzialmente agli elementi elastici in parallelo con il meccanismo contrattile, il contributo di quest'ultimo si ottiene facendo la differenza tra le curve 3 e 1 della fig. 29. Il risultato è più evidente quando si può misurare la tensione attiva sviluppata da un solo sarcomero a differenti lunghezze (v. Gordon e altri, 1966). Le fratture della curva, nettamente osservate in queste condizioni (v. fig. 30, parte superiore), la dividono in quattro segmenti distinti, corrispondenti a quattro tipi di rapporto e di interazione tra i due sistemi dei miofilamenti. Il segmento di destra, il più semplice, esprime il disimpegno progressivo dei filamenti, poiché la tensione sviluppata attivamente è proporzionale al numero dei ponti formati. Il segmento orizzontale corrisponde alla regione nella quale questo numero di ponti resta costante, essendo la regione centrale dei filamenti primari sprovvista di meromiosina pesante. A una lunghezza minore la situazione è più complessa: i filamenti di actina penetrano inizialmente in una regione di miosina di polarità opposta; successivamente l'estremità dei filamenti primari viene a urtare contro le caratteristiche strutture della linea Z. La parte inferiore della fig. 30 illustra bene queste diverse situazioni, come pure le corrispondenti lunghezze del sarcomero.
Influenza del movimento. - Il movimento influenza in modo caratteristico la tensione sviluppata dalla fibra tetanizzata. Con un ergometro è facile imporre al muscolo un cambiamento della lunghezza durante il plateau tetanico misurando la tensione a ogni istante. La fig. 31 illustra schematicamente i risultati. Si inizia stimolando la fibra a una lunghezza media; la tensione si stabilizza al punto 1; senza arrestare la stimolazione, si accorcia la fibra a velocità costante. Dapprima la tensione decresce rapidamente (da 1 a 3′) durante la distensione degli elementi elastici in serie, successivamente in maniera più lenta (da 3′ a 4′). Alla fine del movimento la tensione tende verso il valore isometrico caratteristico della lunghezza breve (5′) e ciò è l'equivalente del quick release recovery. La caduta di tensione durante il movimento è tanto maggiore quanto più rapida è la velocità; se si riporta in grafico la tensione (3′) in funzione della velocità del movimento, si ottiene una relazione analoga al diagramma forza-velocità della fig. 32.
Durante l'accorciamento, la fibra produce lavoro spostando la forza elastica registrata con l'ergometro. Questo lavoro, detto lavoro motore o positivo, è proporzionale all'area compresa tra l'asse delle ascisse e la curva 1-3′-4′ della fig. 31: è massimo quando la velocità è molto bassa, poiché la tensione mantenuta è allora vicina alla curva delle tensioni isometriche 1-5′.
La parte destra della fig. 31 corrisponde al caso in cui la fibra viene stirata dall'ergometro nel corso della contrazione: la tensione meccanica (1-3-4) cresce in modo apprezzabile al di sopra della linea di equilibrio isometrico (1-5). In questo caso, sono le forze esterne che effettuano lavoro sulla fibra; tale lavoro, chiamato negativo o resistente, è molto superiore al lavoro positivo che si produrrebbe durante un corrispondente accorciamento. Ciò spiega la differenza di sforzo risentita da un soggetto a seconda che effettui un lavoro motore o resistente, per esempio a seconda che si inerpichi lungo una corda o che ridiscenda alla stessa velocità: poiché, a una determinata lunghezza, ogni fibra muscolare attivata sviluppa una forza più grande per l'allungamento che non per l'accorciamento, il sistema nervoso deve reclutare meno unità motrici durante il lavoro negativo che durante il lavoro positivo. A questo fattore meccanico si aggiunge peraltro una differenza nella quantità di energia erogata dalla fibra muscolare nei due casi (v. cap. 5).
d) La contrazione isotonica: la relazione forza-velocità.
I cambiamenti di lunghezza della fibra o del muscolo eccitati si studiano meglio in condizioni isotoniche. In generale si fa sì che a riposo i pesi collegati al muscolo non possano stirarne le fibre al di là della lunghezza in situ. In queste condizioni l'aumento del carico ha tre effetti sull'accorciamento: 1) l'inizio del movimento è ritardato, nella misura in cui il meccanismo contrattile deve inizialmente stirare gli elementi elastici in serie finché la loro tensione equilibri il carico; 2) l'entità dell'accorciamento diviene sempre più scarsa: infatti la parte sinistra del diagramma tensione-lunghezza isometrica (v. figg. 29 e 30) permette di prevedere la lunghezza finale in funzione del carico (v. Edman, 1966); 3) infine, dato ancor più importante, la velocità del movimento diminuisce in funzione del carico, secondo la caratteristica relazione illustrata nella fig. 32 (per il muscolo intero: v. Fenn e Marsh, 1935; v. Hill, 1938; per la fibra isolata, privata di membrana e stimolata con ioni calcio: v. Podolsky e Teicholz, 1970; v. Julian, 1971).
La relazione forza-velocità presenta la stessa forma generale per tutte le fibre muscolari, lisce o striate. La velocità (V) di accorciamento è massima quando il carico è nullo (V0), e in tali condizioni sembra indipendente dalla lunghezza dei sarcomeri (v. Gordon e altri, 1966); essa tende a zero quando il carico si avvicina alla forza isometrica (P0); tra questi due estremi, la relazione rappresentata da una curva ad andamento iperbolico è ben descritta dall'equazione di Hill: V = b(P0 − P)/(P + a), dove P è il carico o la forza, P0 la forza isometrica, a una costante di forza dell'ordine di (0,2 ÷ 0,3) P0, b una costante di velocità che determina la velocità massima; in effetti, V0 = bP0/a ≈ 4b.
Un tempo si attribuiva la forma di questa relazione alla viscosità interna delle fibre muscolari. Attualmente sembra più probabile che essa dipenda dall'accoppiamento tra le fonti di energia chimica e la struttura contrattile: il parametro b ha in effetti un coefficiente di temperatura elevato. È soprattutto per questo parametro che le fibre si differenziano: esso ha un valore all'incirca di 10 l0/s per le fibre del bicipite brachiale dell'uomo (v. Wilkie, 1950) e di solo 0,1 l0/s per il retrattore del pene della tartaruga a 20 °C.
La potenza meccanica, cioè la quantità di lavoro che la fibra può eseguire nell'unità di tempo, è uguale al prodotto P × V (forza sviluppata per velocità dell'accorciamento). La potenza meccanica può dunque dedursi direttamente dalla relazione forza-velocità (v. fig. 32, linea tratteggiata); raggiunge un massimo quando la forza e la velocità hanno ciascuna pressappoco un terzo del loro valore massimale, che rappresenta la condizione ottimale di lavoro per movimenti di breve durata. La maggior parte degli strumenti o dei dispositivi sul tipo del cambio di rapporto di una bicicletta tendono a realizzare queste condizioni.
5. Energetica della contrazione.
Nel senso fisico del termine, la fibra muscolare è una macchina che trasforma l'energia chimica in lavoro e in calore. Il primo principio della termodinamica permette di dare un'espressione quantitativa a questa asserzione (v. Wilkie, 1960). Se una certa reazione chimica (i) si accompagna a una variazione di entalpia molare ΔHi, il calore (Q) e il lavoro (W) prodotti dipenderanno dalle quantità dei substrati mi utilizzati nei diversi tipi di reazioni chimiche possibili secondo l'equazione
Q + W = − Σmi ΔHi. (8)
Lo studio dei differenti termini di questa equazione permette di stabilire il bilancio energetico delle entrate e delle uscite e di verificare così lo stato delle nostre conoscenze sul funzionamento della fibra.
a) La produzione di calore (termogenesi).
Il calore costituisce la quota principale delle uscite nel bilancio energetico della contrazione. Si sa che un intenso esercizio muscolare provoca un riscaldamento generale dell'organismo e in certe condizioni le fibre muscolari sono più importanti come mezzi di termoregolazione che come effettori meccanici: negli omeotermi l'incremento della termogenesi muscolare può compensare perdite di calore eccessive. Grazie alla sensibilità delle misure termometriche, l'analisi cinetica della termogenesi del muscolo isolato ha presto fornito importanti indicazioni sull'intervento in successione delle diverse possibili fonti di energia (v. fig. 36).
Calore iniziale e calore ritardato. - In condizioni di riposo, il muscolo sviluppa calore in misura molto modesta: questo metabolismo è senza dubbio espressione dell'attività di pompe ioniche che mantengono il gradiente Na-K ai due lati della membrana cellulare e che trattengono il calcio a livello del reticolo sarcoplasmatico (v. cap. 3).
L'eccitazione aumenta la termogenesi in modo esplosivo. Fin dal 1913, Hill ha dimostrato che si ha aumento della produzione di calore non solo durante la contrazione (calore iniziale), ma anche durante un lungo periodo di tempo successivo al rilasciamento, a un tasso progressivamente decrescente (calore ritardato). Quali che siano le condizioni della contrazione, il calore postcontrazione è in costante rapporto con la produzione di energia (lavoro + calore iniziale), ed è a questa alquanto superiore (v. A.V. Hill, The heat of..., 1939; v. Godfraind-De Becker, 1972). Ciò induce a ritenere che il calore ritardato sia il segno esterno di lente reazioni chimiche, capaci di ricaricare una riserva di energia immediatamente disponibile durante la contrazione; tale ipotesi è ampiamente verificata, perché in assenza di ossigeno (sostituito da azoto o reso inaccessibile a livello della catena respiratoria dal cianuro) non si alterano né la contrazione, né il calore iniziale (v. Weizsäcker, 1914), mentre il calore ritardato cade a meno di un quarto del suo valore normale (v. Hartree e Hill, 1922). È dunque evidente che la sorgente di energia iniziale è anaerobia e che l'utilizzazione dell'ossigeno è legata a reazioni tardive di ristoro. Questa ipotesi è stata ulteriormente confermata con la determinazione diretta del consumo di ossigeno del muscolo isolato (v. D. K. Hill, 1940). Il calore ritardato, che sussiste in assenza di ossigeno, scompare quasi completamente per effetto dello iodoacetato, veleno metabolico inibitore della glicolisi ma a sua volta non in grado di modificare il calore iniziale né la forma delle prime contrazioni (v. Lundsgaard, 1930; v. Hartree, 1931): la glicolisi può dunque essere considerata come uno dei processi di ristoro che hanno luogo dopo la contrazione.
L'analisi del calore iniziale. - Durante una scossa, il calore iniziale si manifesta in due fasi, corrispondenti rispettivamente all'inizio e alla fine della contrazione (v. fig. 33). La seconda fase, che accompagna il rilasciamento, sembra avere un'origine fisica (v. Hill, 1953); essa rappresenterebbe un effetto termoelastico e soprattutto la dispersione sotto forma di calore dell'energia potenziale meccanica accumulata negli elementi elastici messi sotto tensione (contrazione isometrica) durante il sollevamento di un carico (contrazione isotonica). Il significato della prima fase è più complesso: compare a metà del periodo di latenza, raggiunge il massimo all'inizio del periodo meccanico e termina in coincidenza con l'apice della scossa. Questa evoluzione ricorda la cinetica dell'emissione luminosa dell'equorina e fa pensare ai movimenti degli ioni Ca2+ e all'attivazione del meccanismo contrattile che essi provocano. Per dissociare queste due componenti, Smith (v., 1972) e Homsher e altri (v., 1972) hanno misurato il calore iniziale dei muscoli estesi a lunghezze superiori a l0, in modo da ridurre progressivamente la zona di sovrapposizione dei due sistemi di filamenti e di conseguenza il numero di ponti d'actomiosina capaci di idrolizzare l'ATP. (Ricordiamo che in queste condizioni la tensione meccanica sviluppata diviene sempre più debole: v. fig. 30). La fig. 34 mostra che il calore iniziale si può analizzare in due frazioni: l'una, dell'ordine di 1 mcal/g, è indipendente dalla tensione sviluppata, permane alla lunghezza maggiore e corrisponderebbe ai movimenti di ioni Ca2+; l'altra, funzione della tensione cioè del numero di ponti attivi, corrisponderebbe all'attività ATP-asica dell'actomiosina.
Durante il tetano il meccanismo contrattile è mantenuto in stato di attività dalle eccitazioni che si susseguono; compare allora una nuova componente, detta calore di mantenimento, funzione della durata dell'eccitazione (v. Hartree e Hill, 1921; v. Abbott, 1951). Questo flusso continuo di energia dipende dalla lunghezza del muscolo, o piuttosto dalla tensione sviluppata (v. Aubert, 1956), come il calore iniziale (v. fig. 34); si pensa che alla lunghezza in situ esso esprima in parte (circa il 25%) l'attività della pompa del calcio e in parte (circa il 75%) la ripetizione dei cicli di saldatura e di rottura dei ponti di actomiosina (v. Woledge, 1971; v. Homsher e altri, 1972). È interessante notare che il calore di mantenimento è più grande nelle fibre più rapide (v. A.V. Hill, 1939): in prima approssimazione, la sua intensità di regime è uguale al prodotto delle costanti a e b dell'equazione forza-velocità (v. fig. 32; v. cap. 4, È d).
L'effetto Fenn e il calore di accorciamento. - Fin dagli anni venti, Fenn (v., 1923) aveva osservato che se un muscolo poteva accorciarsi e compiere un lavoro durante la contrazione, la sua produzione di energia (calore + lavoro) era maggiore rispetto a una contrazione isometrica della stessa durata; quando invece il muscolo era stirato a forza e sottoposto a un lavoro negativo (v. fig. 31), la produzione di energia diminuiva. Questa osservazione fondamentale - alla quale rimane legato il nome del suo autore - dimostrava l'esistenza di uno stretto accoppiamento tra i fenomeni meccanici e la sorgente di energia chimica, che ora viene spiegato con l'intervento dell'ATP a livello dei ponti che uniscono i miofilamenti (v. A. F. Huxley, 1957). L'analisi cinetica ha rivelato che la termogenesi stessa era incrementata durante l'accorciamento, proporzionalmente alla velocità di quest'ultimo; il piccolo supplemento di calore così liberato si chiama calore di accorciamento (v. Hill, 1938 e 1964; v. Aubert e Lebacq, 1971). La fig. 35 illustra tale analisi; il contributo del calore di accorciamento e quello del lavoro meccanico all'effetto Fenn sono indicati dal tratteggio.
b) Le reazioni chimiche della contrazione muscolare.
La fig. 36, che riassume le principali reazioni che intervengono nella contrazione muscolare, mette in evidenza il ruolo centrale dell'adenosintrifosfato (ATP); a sinistra sono schematizzate le vie di utilizzazione dell'ATP, a opera della pompa del calcio da una parte (v. cap. 3) e del meccanismo contrattile dall'altra (v. capp. 2 e 4; v. cap. 5, È a); a destra sono riportate le modalità di rifosforilazione dell'ATP idrolizzato, con alcune importanti tappe storiche e gli inibitori più utilizzati nello studio del metabolismo muscolare. Tutte queste reazioni non si compiono però alla stessa velocità; è perciò conveniente esaminare separatamente le reazioni che sono fonte di energia immediata e i processi tardivi di ristoro.
La prima reazione fonte di energia prontamente utilizzabile è la cosiddetta reazione di Lohmann, che riguarda il sistema ATP-PC. Gli esperimenti in vitro sulle proteine contrattili e i modelli glicerinati, di cui abbiamo trattato in precedenza, hanno indotto da tempo a ritenere che la defosforilazione dell'ATP in ADP e fosfato inorganico a opera dell'attività enzimatica specifica dell'actomiosina è la reazione che fornisce l'energia necessaria al meccanismo contrattile. L'entalpia molare di questa reazione è elevata; essa viene valutata in −11 kcal/mole. Conoscendo il calore prodotto dal muscolo durante la contrazione, si può dunque calcolare la quantità di ATP che deve essere idrolizzata per produrlo. Il paradosso è che nel muscolo intatto isolato non si osservano variazioni apprezzabili del tasso di ATP, se non nel caso di contrazioni prolungate. Durante le scosse o i tetani brevi il tasso di ATP resta costante e si osserva soltanto una diminuzione della fosfocreatina (PC) muscolare (v. fig. 37). Nel 1934 Lohmann propose una spiegazione di tale paradosso: in base all'osservazione che un omogenato di fibre muscolari può idrolizzare la fosfocreatina in creatina e fosfato inorganico soltanto in presenza di ATP, svolgendo quindi il ruolo di cofattore, egli prospettò l'ipotesi che le proteine del muscolo non possano idrolizzare direttamente la PC, ma scindano l'ATP in ADP e fosfato inorganico (Pi):
ATP → ADP + Pi (9)
L'ADP formato è rifosforilato a spese della PC, con risintesi di ATP e liberazione di creatina, C:
ADP + PC ⇄ ATP + C. (10)
L'enzima responsabile di questa transfosforilazione, la creatinafosfochinasi (CPK) o ATP-PC-transfosforilasi, è abbondante nel muscolo e molto attiva. In base a questi processi metabolici è possibile spiegare la costanza del tasso di ATP nel corso della contrazione: l'ATP, defosforilato dalle proteine contrattili e dalla pompa del calcio del reticolo sarcoplasmatico, si riforma immediatamente a spese della fosfocreatina (v. bioenergetica e fosforilazione ossidativa).
La fosfocreatina appartiene a una classe di sostanze, chiamate fosfageni dagli Eggleton (v., 1927), la cui struttura è stata delucidata nello stesso periodo da Fiske e Subbarow (v., 1927): si tratta di composti fosforilati di un derivato della guanidina, che nei Vertebrati è sempre la creatina, ma può essere diverso in altri phyla (negli Insetti e Molluschi è l'arginina, nei Vermi la lombricina, nei Policheti la ofelina, ecc.). Senza essere specifici delle fibre muscolari, questi fosfageni vi si trovano in concentrazione maggiore che in tutti gli altri tessuti, specialmente nei muscoli striati dello scheletro (da 10 a 30 μmoli/g). La loro importante funzione è quella di costituire una riserva, in quanto il loro gruppo fosforico può essere trasferito senza perdita di energia apprezzabile all'ATP (v. Lipmann, 1941).
È stato difficile dimostrare l'esattezza dell'ipotesi di Lohmann. In un primo gruppo di esperimenti si è tentato di dimostrare che il tasso di rinnovamento dell'ATP aumentava durante la contrazione. Se la fibra è immersa in una soluzione artificiale (di Ringer) contenente fosfato radioattivo (32P), ci si può aspettare che l'attività specifica in 32P dell'ATP aumenti dopo il passaggio del 32Pi nella cellula, e che questa attività sia maggiore di quella della PC perché il fosfato deve passare obbligatoriamente per l'ATP prima di raggiungere la PC. Durante la contrazione si dovrebbe osservare una diminuzione dell'attività specifica in 32P dell'ATP, poiché l'ATP è risintetizzato a spese della PC, che è meno radioattiva. In realtà il fosfato attraversa così lentamente la membrana muscolare che tutte le sostanze fosforilate intracellulari sono in equilibrio isotopico: il problema non può dunque essere risolto in questo modo. Si è allora tentato di utilizzare H218O, che ha il vantaggio di penetrare nella fibra molto più rapidamente del fosfato. Anche in questo caso, però, quasi non vi è differenza tra le attività specifiche dell'ATP e della PC in 18O, differenza che del resto non è influenzata dalla contrazione (v. Fleckenstein e altri, 1960). Tali risultati si interpretano facilmente se si ammette che l'enzima di Lohmann, che catalizza la reazione (10), sia molto attivo, e che il gruppo fosforico venga scambiato rapidamente tra l'ATP e la PC.
È stata in definitiva l'analisi chimica diretta del muscolo che ha consentito di dimostrare, utilizzando due nuove tecniche d'indagine, la validità dell'ipotesi di Lohmann. La prima nuova tecnica consiste nel fissare ‛l'immagine chimica' del muscolo, a un dato momento della contrazione, mediante rapida immersione in un liquido refrigerante a temperatura molto bassa (isopentano a −160 °C; v. Mommaerts e Schilling, 1955). La seconda tecnica (v. Cain e altri, 1962) consiste nell'inibire selettivamente l'enzima di Lohmann mediante l'1-fluoro-2,4-dinitrobenzene o FDNB, un reattivo classico per i gruppi −NH2 terminali delle proteine. Il muscolo striato immerso in FDNB 0,4 mM conserva la propria contrattilità ed eccitabilità per 1-3 ore. L'FDNB blocca senza dubbio altri enzimi muscolari, come indicano una produzione spontanea di acido lattico e un'inibizione del consumo di ossigeno, ma non sembra interferire con il meccanismo fondamentale della contrazione. Un muscolo eccitato in queste condizioni idrolizza l'ATP, anche dopo una sola scossa, mentre il tasso di PC resta costante, anche dopo un tetano.
La reazione miochinasica è una seconda forma immediata di ricostruzione dell'ATP idrolizzato:
2 ADP ⇄ ATP + AMP. (11)
Questa reazione di transfosforilazione catalizzata dall'enzima miochinasi (v. Kalckar, 1944) permette l'utilizzazione del secondo gruppo fosforico dell'ATP nei casi estremi in cui gli altri sistemi di recupero dell'ATP non sono più sufficienti, come per esempio dopo intossicazione del muscolo con FDNB (v. Davies, 1965; v. Dydynska e Wilkie, 1966; v. Maréchal e Beckers-Bleukx, 1966), o dopo tetanizzazione prolungata (v. Canfield e altri, 1973). La reazione miochinasica è reversibile; ma l'AMP formato non si accumula mai, perché è subito deamminato a inosinmonofosfato, IMP (v. fig. 37), con formazione di ammoniaca secondo la reazione:
AMP → IMP + NH3. (12)
Nelle fibre muscolari striate i due enzimi miochinasi e AMP-deamminasi sono abbondanti, molto attivi e difficilmente separabili dalla miosina. Attualmente, la loro precisa funzione non è ben chiara. In particolare, è incerto il fatto che la deamminazione dell'adenosina possa svolgere una funzione essenziale nella contrazione, poiché le fibre muscolari lisce di Taenia coli della cavia sono prive di 5AMP-deamminasi.
La reazione di Lohmann spiega bene i fenomeni osservati durante una contrazione di breve durata: il tasso di ATP non cambia quasi, mentre il tasso di PC diminuisce. Resta da spiegare come le riserve di PC possano ricostituirsi dopo la contrazione, e perché durante una serie di contrazioni ripetute, dopo una caduta iniziale, il tasso di PC si stabilizzi a un livello pressappoco stazionario. La comune interpretazione di queste due osservazioni si basa sui meccanismi più lenti di ristoro, ricordati a proposito del calore ritardato, e capaci di rifosforilare l'ADP ad ATP. Per inversione della reazione (10), ogni sorgente di ATP è capace di ristabilire il tasso di PC. Queste tardive reazioni di ristoro, di importanza generale per tutte le cellule viventi, sono descritte in dettaglio in altri articoli di questa enciclopedia (v. metabolismo: Metabolismo dei carboidrati, fosforilazione ossidativa, bioenergetica); noi ci limiteremo a descriverle brevemente.
In presenza di ossigeno ogni frammento organico a due atomi di carbonio può subire l'ossidazione completa a livello dei mitocondri. Attraverso il ciclo degli acidi tricarbossilici (ciclo di Krebs) e la catena dei trasportatori di elettroni, l'ossidazione di ciascun frammento a due atomi di carbonio è accoppiata alla fosforilazione di 15 molecole di ATP. I mitocondri sono abbondanti nelle fibre muscolari, specialmente in quelle ‛rosse' (tipo 1), adattate alle attività fisiche prolungate, e in quelle di tipo ‛intermedio' (tipo 2A), adattate alle attività toniche (v. Close, 1972).
Tra le fonti di frammenti ossidabili figurano gli acidi grassi non esterificati; ma se l'attività delle fibre scheletriche è intensa, la fonte principale di frammenti bicarboniosi è il metabolismo dei glucidi. Ogni unità glucosidica è subito scissa in due molecole di piruvato attraverso il ciclo di Embden-Meyerhof; queste molecole subiscono successivamente l'ossidazione completa, dando complessivamente circa 39 molecole di ATP per unità di esosio. Grazie a questo elevato rendimento delle fosforilazioni ossidative, le riserve di glicogeno della fibra (da 10 a 20 g/kg di muscolo) possono assicurare molte migliaia di contrazioni a condizione che l'apporto di ossigeno sia sufficiente. Secondo Margaria e collaboratori è la capacità di trasporto della circolazione sanguigna, piuttosto che l'attività dei mitocondri, a costituire il fattore limitante delle ossidazioni in situ. Questo tuttavia non impedisce un certo recupero di ATP grazie alla glicolisi anaerobia. Infatti, in assenza di ossigeno, muscoli isolati si contraggono normalmente, ma accumulano acido lattico (v. Fletcher e Hopkins, 1907). La formazione di piruvato non è in linea di principio diversa in anaerobiosi, se non per il fatto che un coenzima indispensabile, il nicotinadenin-dinucleotide o NAD, è ridotto a un certo stadio a NADH e diventa indisponibile in assenza di una riossidazione che si compie attraverso le fosforilazioni ossidative. Esiste tuttavia una reazione reversibile che, sostitutivamente, può rigenerare il NAD:
piruvato + NADH ⇄ lattato + NAD. (13)
La reazione (13) permette di mantenere la glicolisi, ma in tali condizioni solo 3 ATP (invece di 39) sono rifosforilati per ciascuna unità di esosio consumato. Le riserve di glicogeno sono dunque utilizzate in modo molto meno efficace, soprattutto perché l'accumulo di lattato tende a frenare la glicolisi.
La glicolisi anaerobia permette alla fibra muscolare di sostenere punte di attività intensa, superiori alle possibilità del sistema di rifornimento in ossigeno. Essa ha luogo soprattutto nelle fibre a scossa rapida, di tipo ‛bianco' (tipo 2B), e la sua elevata velocità compensa in parte il suo debole rendimento energetico: infatti la velocità di formazione di ATP è dell'ordine di 300 moli di ATP per kg per ora mediante la glicolisi, rispetto alle 174 ottenibili con le ossidazioni complete (v. Jöbsis, 1963). È l'aumento locale del tasso di ADP che sembra controllare l'attivazione della glicolisi. Pare che la regolazione si realizzi a livello di tre enzimi chiave: l'esochinasi (che catalizza la fosforilazione del glucosio a glucosio-6-fosfato), la fosforilasi (che catalizza il distacco di un'unità glucosidica dal glicogeno), e la fosfofruttochinasi (che catalizza la fosforilazione del fruttosio-6-fosfato a fruttosio-1,6-difosfato; v. Helmreich e Cori, 1965). Quanto all'energia ancora disponibile nel lattato, essa non viene sprecata: una quota rilevante di questo abbandona la fibra muscolare, entra nel circolo sanguigno e verrà ossidata a livello del cuore e del fegato o ricombinata a glicogeno epatico (ciclo di Cori); la quota che rimane nella fibra può essere ossidata per inversione della reazione (13) appena l'ossigeno ritorna disponibile; infine è possibile che una quota venga posta in riserva sotto forma di glicogeno muscolare (v. Meyerhof, 1920; v. Bendall e Taylor, 1970).
La glicolisi anaerobia è considerata una reazione tardiva di ristoro dell'ATP, alla pari delle fosforilazioni ossidative, come hanno dimostrato le fondamentali ricerche di Lundsgaard (v., 1930): un muscolo senza ossigeno e avvelenato dallo iodoacetato (IAA) a debole concentrazione non forma più piruvato o lattato, ma può ancora sviluppare un centinaio di scosse praticamente normali o un tetano di molti secondi prima di passare allo stato di rigor per scomparsa dell'ATP.
c) Bilancio energetico della contrazione.
Il bilancio termodinamico completo conforme all'equazione (8), stabilito tenendo conto di ‛tutte' le reazioni biochimiche che accompagnano o seguono la contrazione, non è stato ancora calcolato, dato il grande numero delle reazioni e per la complessità della loro evoluzione temporale. Ma è possibile semplificare il problema, in primo luogo trascurando alcune reazioni che mobilizzano minime quantità di energia (potenziale di azione); in secondo luogo, bloccando le reazioni tardive di ristoro, glicolisi e ossidazioni, con i mezzi che abbiamo appena descritto (muscolo in ambiente di azoto e intossicato con l'IAA); infine rallentando la velocità delle reazioni iniziali: tale condizione si può ottenere scegliendo muscoli lenti (muscoli di tartaruga), o raffreddando il muscolo a 0 °C, o anche combinando le due cose.
In queste condizioni, la sola reazione importante che si osserva durante la contrazione è l'idrolisi della fosfocreatina, PC, a creatina, C, e fosfato inorganico, Pi:
PC → Pi + C. (14)
Questo risultato si interpreta facilmente alla luce delle reazioni (9) e (10): l'ATP idrolizzato dalle proteine contrattili è immediatamente rifosforilato a spese della fosfocreatina.
La quantità di PC idrolizzata dipende da un gran numero di fattori, e principalmente dalla durata e dal numero delle contrazioni, oltre che dalla produzione di lavoro. Durante una serie di scosse isometriche, il tasso di PC diminuisce proporzionalmente al numero di scosse (0,28 micromoli per grammo di sartorio di rana a 0 °C e per scossa: v. Carlson e Siger, 1960). Nel caso di tetani isometrici, l'idrolisi di PC è proporzionale al numero di tetani e alla loro durata totale, esattamente come nel caso della produzione di calore iniziale (v. Maréchal, 1964). Se il muscolo può accorciarsi, l'idrolisi aumenta proporzionalmente al supplemento di energia liberata: è l'equivalente chimico dell'effetto Fenn. Infine se il muscolo è stirato e subisce un lavoro negativo, l'idrolisi diminuisce. La fig. 38 mostra che in tutti questi casi l'idrolisi di PC, valutata almeno 30 secondi dopo la fine delle contrazioni, è proporzionale alla somma del lavoro e del calore, secondo l'equazione (8) che in questo caso si riduce a
Q + W = − mPCΔHPC. (15)
La pendenza della retta corrisponde a un'entalpia molare apparente di 11,1 kcal/mole.
Tale valore, che oscilla tra 9 e 14 secondo gli autori, non sembra a prima vista molto differente da quello ottenuto in vitro dai biochimici. Questo accordo potrebbe suggerire che non vi è possibilità di prospettare altre reazioni iniziali diverse dalla reazioni (9) e (10); ciò nonostante sono sopravvenute di recente alcune difficoltà. Anzitutto, secondo Woledge, tenuto conto di tutte le reazioni avventizie, l'entalpia di idrolisi della PC in vivo non dovrebbe superare le 7 kcal/mole. In secondo luogo, sembra che l'idrolisi di PC sia troppo debole durante le prime scosse di una serie, proprio quelle che liberano la maggior quantità di energia (v. Spronck, 1965).
Lo stesso sfasamento tra la produzione di calore e l'idrolisi di PC è stato osservato durante i primi secondi di un tetano (v. Gilbert e altri, 1971). Infine, su muscoli intossicati con FDNB, Kushmerick e altri (v., 1969) trovano sempre un'idrolisi di ATP insufficiente a spiegare la produzione di calore teorico. Per tutte queste ragioni, è necessario pensare alla possibilità di processi ancora sconosciuti, quali l'esistenza di una sorgente di energia labile legata alle proteine muscolari, oppure l'associazione di un effetto termico alla liberazione e alla fissazione del calcio sulla troponina.
6. I tipi di fibre muscolari.
Le analisi biochimiche ed energetiche dei muscoli striati hanno dimostrato che, nei Mammiferi, esistono almeno due grandi classi di fibre muscolari striate. Le fibre lente si contraggono in scosse di lunga durata (superiore a 50 ms), si raccorciano lentamente (con una costante di velocità dell'ordine di 0,5-1 lunghezza di muscolo per secondo) e possiedono un'actomiosina che idrolizza lentamente l'ATP. Queste fibre sono ricche di mitocondri, di enzimi ossidativi e di mioglobina, un pigmento rosso avido di ossigeno.
Le fibre muscolari rapide si contraggono in scosse brevi (inferiori a 50 ms), si raccorciano rapidamente (con una costante di velocità b dell'ordine di 2-4 lunghezze di muscolo per secondo) e possiedono un'elevata attività ATPasica. Esse sono ricche di enzimi glicolitici, e il loro contenuto in mitocondri e in enzimi ossidativi permette di distinguervi due sottoclassi, rispettivamente le fibre che ne sono ricche e quelle che ne sono povere. Inoltre le fibre ossidative, ricche in mitocondri, sono abbondantemente provviste di mioglobina, che conferisce loro un colore rosso; le fibre muscolari poco ossidative, povere in mitocondri, quasi non contengono mioglobina, e appaiono quindi di colorito quasi bianco.
Da quando è divenuto possibile distinguere le fibre muscolari mediante sicure reazioni istochimiche praticate su biopsie muscolari, le suddette classificazioni hanno assunto una notevole importanza in clinica. Di tali reazioni, la più importante è quella detta ‛ad ATP-asi' (v. Engel, 1962): le sezioni, praticate su una biopsia muscolare non fissata, in modo da conservare le attività enzimatiche, sono incubate in una soluzione di ATP contenente CaCl2; l'actomiosina presente nel tessuto idrolizza l'ATP in ADP e fosfato, e quest'ultimo precipita sotto forma di fosfato di calcio che si colora in nero con una reazione cui partecipano il cloruro di cobalto e il solfuro di ammonio. Le fibre rapide si colorano intensamente in nero, per l'elevata attività ATP-asica della loro miosina, mentre le fibre lente si colorano solo debolmente.
Brooke e Kaiser (v., 1970) hanno introdotto un'importante modificazione di questo metodo: facendo precedere alla colorazione secondo Engel l'incubazione delle sezioni in una soluzione alcalina (pH 9,2), l'attività ATP-asica dell'actomiosina di certe fibre, che sono state chiamate di tipo 1, ne risulta annullata, mentre quella di altre fibre, che sono state chiamate di tipo 2, è conservata. Accurati controlli istologici e biochimici hanno mostrato che le fibre di tipo 1 corrispondono alle fibre lente ossidative, mentre quelle di tipo 2 corrispondono alle fibre rapide. Se l'incubazione è effettuata a pH 4,65, si osserva che l'attività ATP-asica dell'actomiosina è conservata nelle fibre di tipo 1, ma abolita in alcune fibre di tipo 2: mediante questo secondo procedimento è quindi possibile individuare fibre di tipo 2 acido-labili, cui è stato dato il nome di fibre di tipo 2A, e fibre acido-resistenti, che sono state denominate di tipo 2B. Le fibre di tipo 2A corrispondono alle fibre rapide rosse e ossidative, quelle di tipo 2B alle fibre lente bianche e glicolitiche.
Queste reazioni istochimiche hanno consentito di accertare che esistono pochi muscoli omogenei, costituiti da un solo tipo di fibre muscolari, e che, soprattutto nell'uomo, la maggior parte dei muscoli è composta di tre tipi di fibre in proporzioni variabili. Queste fibre sono disposte nei muscoli ‛a mosaico', secondo un ordine che ricorda quello di una scacchiera: le fibre che si colorano con la reazione di Engel si alternano, infatti, con fibre non colorate. Tuttavia, tutte le fibre muscolari innervate da uno stesso assone (cioè l'insieme che costituisce una unità motrice) sono dello stesso tipo (v. Edström e Kugelberg, 1968).
Bibliografia.
Abbott, B. C., The heat production associated with the maintenance of a prolonged contraction and the extra heat produced during large shortening, in ‟Journal of physiology", 1951, CXII, pp. 438-445.
Adrian, R. H., Costantin, L. L., Peachey, L.D., Radial spread of contraction in frog muscle fibres, in ‟Journal of physiology", 1969, CCIV, pp. 231-257.
Andersson-Cedergren, E., Ultrastructure of motor endplate and sarcoplasmic components of mouse skeletal muscle fiber as revealed by three-dimensional reconstructions from serial sections, in ‟Journal of ultrastructure research", 1959, suppl. 1, pp. 1-191.
Ashley, C. C., Ridgway, E. B., Simultaneous recording of membrane potential, calcium transient and tension in single muscle fibres, in ‟Nature", 1968, CCXIX, pp. 1168-1169.
Aubert, X., Le couplage énergétique de la contraction musculaire, Bruxelles 1956.
Aubert, X., Lebacq, J., The heat of shortening during the plateau of tetanic contraction and at the end of relaxation, in ‟Journal of physiology", 1971, CCXVI, pp. 181-200.
Bailey, K., Tropomyosin: a new asymmetric component of the muscle fibril, in ‟Biochemical journal", 1948, XLIII, pp. 271-279.
Bendall, J. R., Effect of the ‛Marsh factor' on the shortening of muscle fibre models in the presence of adenosine triphosphate, in ‟Nature", 1952, CLXX, pp. 1058-1060.
Bendall, J. R., Taylor, A. A., The Meyerhof quotient and the synthesis of glycogen from lactate in frog and rabbit muscle, in ‟Biochemical journal", 1970, CXVIII, pp. 887-893.
Bennett, H. S., Porter, K. B., An electron microscope study of the sectioned breast muscle of the domestic fowl, in ‟American journal of anatomy", 1953, XCIII, pp. 61 ss.
Bianchi, C. P., Shanes, A. M., Calcium influx in skeletal muscle at rest, during activity and during potassium contracture, in ‟Journal of general physiology", 1959, XLII, pp. 803-815.
Brooke, M. H., Kaiser, K. K., Muscle fiber types: how many and what kind?, in ‟Archives of neurology", 1970, XXIII, pp. 369-379.
Buchthal, F., Sten-Knudsen, O., Impulse propagation in striated muscle fibers and the role of the internal currents in activation, in ‟Annals of the New York Academy of Sciences", 1959, LXXXI, pp. 422-445.
Cain, D. F., Infante, A. A., Davies, R. E., Adenosine triphosphate and phosphorylcreatine as energy supplies for single contraction of working muscle, in ‟Nature", 1962, CXCVI, pp. 214-217.
Canfield, P., Lebacq, J., Maréchal, G., Energy balance in frog sartorius muscle during an isometric tetanus at 20 °C, in ‟Journal of physiology", 1973, CCXXXII, pp. 467-484.
Carlson, F. D., Siger, A., The mechanochemistry of muscular contraction. I. The isometric twitch, in ‟Journal of general physiology", 1960, XLIV, pp. 33-70.
Close, R. I., Dynamic properties of mammalian skeletal muscle, in ‟Physiological reviews", 1972, LII, pp. 129-197.
Cooke, R., Franks, K. E., Generation of force by single-headed myosin, in ‟Journal of molecular biology", 1978, CCX, pp. 361-373.
Costantin, L. L., The role of sodium current in the radial spread of contraction in frog muscle fibres, in ‟Journal of general physiology", 1970, LV, pp. 703-715.
Davies, R. E., On the mechanism of muscular contraction, in Essays in biochemistry (a cura di P. N. Campbell e G. D. Greville), vol. I, New York 1965, pp. 20-55.
Dydynska, M., Wilkie, D. R., The chemical and energetic properties of muscle poisoned with fluorodinitrobenzene, in ‟Journal of physiology", 1966, CLXXXIV, pp. 751-769.
Ebashi, S., Kielly-Meyerhof granules and the relaxation of glycerinated muscle fibres, in Conference on the chemistry of muscular contraction, Tokyo 1958, pp. 89 ss.
Ebashi, S., Third component participating in the superprecipitation of ‛natural actomyosin', in ‟Nature", 1963, CC, p. 1010.
Ebashi, S., Endo, M., Calcium ion and muscle contraction, in ‟Progress in biophysics and biophysical chemistry", 1968, XVIII, pp. 125-183.
Ebashi, S., Endo, M., Ohtsuki, I., Control of muscle contraction, in ‟Quarterly reviews of biophysics", 1969, II, pp. 351-384.
Edman, K. A. P., The relation between sarcomere length and active tension in isolated semitendinous fibers of the frog, in ‟Journal of physiology", 1966, CLXXXIII, pp. 407-417.
Edström, L., Kugelberg, E., Histochemical composition, distribution of fibres and fatigability of single motor units, in ‟Journal of neurology, neurosurgery and psychiatry", 1968, XXXI, pp. 424-433.
Eggleton, P., Eggleton, G. P., The inorganic phosphate and a labile form of organic phosphate in the gastrocnemius of the frog, in ‟Biochemical journal", 1927, XXI, pp. 190-195.
Elliott, G. F., Lowy, J., Worthington, C. R., An X-ray and light diffraction study of the filament lattice of striated muscle in the living state and in rigor, in ‟Journal of molecular biology", 1963, VI, pp. 295-305.
Engel, W. K., The essentiality of histo- and cytochemical studies of skeletal muscle in the investigation of neuromuscular disease, in ‟Neurology", 1962, XII, pp. 778 ss.
Engelhardt, V. A., Ljubimova, M. N., Myosin and adenosine-triphosphatase, in ‟Nature", 1939, CXLIV, pp. 668-669.
Fenn, W. O., A quantitative comparison between the energy liberated and the work performed by the isolated sartorius muscle of the frog, in ‟Journal of physiology", 1923, LVIII, pp. 175-203.
Fenn, W. O., Marsh, B. S., Muscular force at different speeds of shortening, in ‟Journal of physiology", 1935, LXXXV, pp. 277-297.
Fiske, C. H., Subbarow, Y., The nature of the ‛inorganic phosphate' in voluntary muscle, in ‟Science", 1927, LXV, pp. 401-403.
Fleckenstein, A., Gerlach, E., Janke, J., Marmier, P., Die Inkorporation von markiertem Sauerstoff aus Wasser in die ATP-, Kreatinphosphat-, und Orthophosphat-Fraktion intakter Muskeln bei Ruhe, tetanischer Reizung und Erholung, in ‟Pflügers Archiv", 1960, CCLXXI, pp. 75-104.
Fletcher, W M., Hopkins, F. G., Lactic acid in amphibian muscle, in ‟Journal of physiology", 1907, XXXV, pp. 247-309.
Franzini-Armstrong, C., Porter, K. R., The sarcoplasmic reticulum, in ‟Scientific American", 1965, CCXII, 3, pp. 72-81.
Gergely, J., Kohler, H., Molecular parameters of cardiac myosin, in ‟Federation proceedings", 1957, XVI, p. 185.
Gilbert, C., Kretzschmar, K. M., Wilkie, D. R., Woledge, R. C., Chemical change ad energy output during muscular contraction, in ‟Journal of physiology", 1971, CCXVIII, pp. 163-193.
Gillis, J. M., The site of action of calcium in producing contraction in striated muscle, in ‟Journal of physiology", 1969, CC, pp. 849-864.
Gillis, J. M., Gerday, C., Calcium movements between myofibrils, parvalbumins and sarcoplasmic reticulum in muscle, in Second international symposium on calcium binding proteins and calcium function in health and disease (a cura di R. M. Wasserman, R. A. Corradino, E. Carafoli, R. M. Kretsinger, D. M. MacLennon e F. L. Siegel), Amsterdam 1977.
Gillis, J. M., O'Brien, E. J., The effects of calcium ions on the structure of reconstituted muscle thin filaments, in ‟Journal of molecular biology", 1975, XCIX, pp. 445-459.
Godfraind-De Becker, A., Heat production and fluorescence changes of toad sartorius muscle during aerobic recovery after a short tetanus, in ‟Journal of physiology", 1972, CCXXIII, pp. 719-734.
Gonzales-Serratos, H., Inward spread of activation in Vertebrate muscle fibres, in ‟Journal of physiology", 1971, CCXII, pp. 777-799.
Gordon, A. M., Huxley, A. F., Julian, F. J., The variation in isometric tension with sarcomere length in Vertebrate muscle fibres, in ‟Journal of physiology", 1966, CLXXXIV, pp. 170-192.
Hamoir, G., The comparative biochemistry of fish sarcoplasmic proteins, in ‟Acta zoologica et pathologica antwerpiensia", 1968, XLVI, pp. 69-76.
Hanson, J., Huxley, H. E., Quantitative studies on the structure of cross striated myofibrils. II. Investigations by biochemical techniques, in ‟Biochimica et biophysica acta", 1957, XXIII, pp. 250-260.
Hanson, J., Lowy, J., The structure of F-actin and of actin filaments isolated from muscle, in ‟Journal of molecular biology", 1963, VI, pp. 46-60.
Hartree, W., The analysis of the initial heat production of muscle, in ‟Journal of physiology", 1931, LXXII, pp. 1-26.
Hartree, W., Hill, A. V., The regulation of the supply of energy in muscular contraction, in ‟Journal of physiology", 1921, LV, pp. 133-158.
Hartree, W., Hill, A. V., The recovery heat production of muscle, in ‟Journal of physiology", 1922, LVI, pp. 367-381.
Haselgrove, J., X-ray evidence for a conformational change in the actin-containing filaments of Vertebrate striated muscle, in ‟Cold Spring Harbour symposia on quantitative biology", 1972, XXXVII, pp. 341-352.
Hasselbach, W., Makinose, M., Über den Mechanismus des Calciumtransportes durch die Membranen des sarkoplasmatischen Retikulums, in ‟Biochemische Zeitschrift", 1963, CCCXXXIX, pp. 94-111.
Heilbrunn, L.V., Wiercinsky, F. J., The action of various cations on muscle protoplasm, in ‟Journal of cellular and comparative physiology", 1947, XXIX, pp. 15-32.
Hellam, D. C., Podolsky, R. J., Force measurement in skinned muscle fibres, in ‟Journal of physiology", 1969, CC, pp. 807-819.
Helmreich, E., Cori, C. F., Regulation of glycolysis in muscle, in ‟Advances in enzyme regulation", 1965, III, pp. 91-107.
Hildebrand, H. F., Rhabdomyosarcomes et biomyosarcomes chimioinduits, Lille 1972.
Hill, A. V., The energy degraded in the recovery processes of stimulated muscles, in ‟Journal of physiology", 1913, XLVI, pp. 28-80.
Hill, A. V., The heat of shortening and the dynamic constants of muscle, in ‟Proceedings of the Royal Society" (Series B), 1938, CXXVI, pp. 136-195.
Hill, A. V., The heat of recovery, in ‟Proceedings of the Royal Society" (Series B), 1939, CXXVII, pp. 297-350.
Hill, A. V., The mechanical efficiency of frog's muscle, in ‟Proceedings of the Royal Society" (Seris B), 1939, CXXVII, pp. 434-451.
Hill, A. V., The abrupt transition from rest to activity in muscle, in ‟Proceedings of the Royal Society" (Series B), 1949, CXXXVI, pp. 399-420.
Hill, A. V., The ‛instantaneous' elasticity of active muscle, in ‟Proceedings of the Royal Society" (Series B), 1953, CXLI, pp. 161-178.
Hill, A. V., The effect of load on the heat of shortening of muscle, in ‟Proceedings of the Royal Society" (Series B), 1964, CLIX, pp. 297-318.
Hill, D. K., The time-course of the oxygen consumption of stimulated frog's muscle, in ‟Journal of physiology", 1940, XCVIII, pp. 207-227.
Hodgkin, A. L., Horowicz, P., Potassium contractures in single muscle fibres, in ‟Journal of physiology", 1960, CLIII, pp. 386-403.
Homsher, E., Mommaerts, W. F. H. M., Ricchiuti, N. V., Wallner, A., Activation heat, activation metabolism and tension-related heat in frog semitendinous muscles, in ‟Journal of physiology", 1972, CCXX, pp. 601-625.
Huxley, A. F., Muscle structure and theories of contraction, in ‟Progress in biophysics and biophysical chemistry", 1957, VII, pp. 257-318.
Huxley, A. F., Niedergerke, R., Interference microscopy of living muscle fibres, in ‟Nature", 1954, CLXXIII, pp. 971-972.
Huxley, A. F., Taylor, R. E., Local activation of striated muscle fibres, in ‟Journal of physiology", 1958, CXLIV, pp. 426-441.
Huxley, H. E., X-ray analysis and the problem of muscle, in ‟Proceedings of the Royal Society" (Series B), 1953, CXLI, pp. 59-62.
Huxley, H. E., La contraction musculaire, in ‟Endeavour", 1956, XV, pp. 177-188.
Huxley, H. E., Electron microscope studies on the structure of natural and synthetic protein filaments from striated muscle, in ‟Journal of molecular biology", 1963, VII, pp. 281-308.
Huxley, H. E., Structural difference between resting and rigor muscle; evidence from intensity changes in the low angle equatorial X-ray diagram, in ‟Journal of molecular biology", 1968, XXXVII, pp. 507-520.
Huxley, H. E., The structural basis of muscular contraction, in ‟Proceedings of the Royal Society" (Series B), 1971, CLXXVIII, pp. 131-149.
Huxley, H. E., Brown, W., Holmes, K. C., Constancy of axial spacings in frog sartorius muscle during contraction, in ‟Nature", 1965, CCVI, p. 1358.
Huxley, H. E., Hanson, J., Changes in the cross-striations of muscle during contraction and stretch and their structural interpretation, in ‟Nature", 1954, CLXXIII, pp. 973-976.
Huxley, H. E., Hanson, J., The molecular basis of contraction in crossstriated muscle, in Structure and function of muscle (a cura di G. H. Bourne), vol. I, New York 1960, cap. VII.
Jöbsis, F. F., Spectrophotometric studies on intact muscle. I. Components of the respiratory chain, in ‟Journal of general physiology", 1963, XLVI, pp. 905-928.
Jöbsis, F. F., Spectrophotometric studies on intact muscle. II. Recovery from contractile activity, in ‟Journal of general physiology", 1963, XLVI, pp. 929-969.
Julian, F. J., The effect of calcium on the force-velocity relation of briefly glycerinated frog muscle fibres, in ‟Journal of physiology", 1971, CCXVIII, pp. 117-145.
Kalckar, H. M., Adenylpyrophosphatase and myokinase, in ‟Journal of biological chemistry", 1944, CLIII, pp. 275-284.
Knappeis, G. G., Carlsen, F., The ultrastructure of the Z disc in skeletal muscle, in ‟Journal of cell biology", 1962, XIII, pp. 323-335.
Kuffler, S. W., The relation of electric potential changes to contracture in skeletal muscle, in ‟Journal of neurophysiology", 1946, IX, pp. 367-377.
Kühne, W., Untersuchungen über Bewegungen und Veränderungen der kontraktilen Substanzen, in ‟Archiv für Anatomie, Physiologie und wissenschaftliche Medizin", 1859, pp. 748-835.
Kushmerick, M. J., Larson, R. E., Davies, R. E., The chemical energetics of muscle. I. Activation heat, heat of shortening and ATP utilization for activation-relaxation processes, in ‟Proceedings of the Royal Society" (Series B), 1969, CLXXIV, pp. 293-313.
Lipmann, F., Metabolic generation and utilisation of phosphate bond energy, in Advances in enzymology (a cura di F. F. Nord), vol. I, New York 1941, pp. 99-162.
Lohmann, K., Über die enzymatische Aufspaltung der Kreatinphosphorsäure: zugleich ein Beitrag zum Chemismus der Muskelkontraktion, in ‟Biochemische Zeitschrift", 1934, CCLXXI, pp. 264-277.
Lundsgaard, E., Untersuchungen über Muskelkontraktionen ohne Milchsäurebildung, in ‟Biochemische Zeitschrift", 1930, CCXVII, pp. 162-177.
Maréchal, G., Le métabolisme de la phosphorylcréatine et de l'adénosine triphosphate durant la contraction musculaire, Bruxelles 1964.
Maréchal, G., Les sources d'énergie immédiate de la contraction musculaire, in ‟Journal de physiologie", 1972, LXV, pp. 5A-50A.
Maréchal, G., Beckers-Bleukx, G., Adenosine triphosphate and phosphorylcreatine breakdown in resting and stimulated muscles after treatment with I-fluoro-2,4-dinitrobenzene, in ‟Biochemische Zeitschrift", 1966, CCCXLV, pp. 286-299.
Marsh, B. B., The effects of ATP on the fibre volume of a muscle homogenate, in ‟Biochimica et biophysica acta", 1952, IX, pp. 247-260.
Meyerhof, O., Kohlehydrat- und Milchsäureumsatz im Froschmuskel, in ‟Pflügers Archiv", 1920, CLXXXV, pp. 11-32.
Mines, G.R., On functional analysis by the action of electrolytes, in ‟Journal of physiology", 1913, XLVI, pp. 188-235.
Mommaerts, W. F. H. M., Schilling, M. O., Interruption of muscular contraction by rapid cooling, in ‟American journal of physiology", 1955, CLXXXII, pp. 579-584.
Natori, R., The property and contraction process of isolated myofibrils, in ‟Jikeikai medical journal", 1954, I, pp. 119-126.
Ohnishi, T., Ebashi, S., The velocity of calcium binding of isolated sarcoplasmic reticulum, in ‟Journal of biochemistry (Tokyo)", 1964, LV, pp. 599-603.
Page, S. G., The organisation of the sarcoplasmic reticulum in frog muscle, in ‟Journal of physiology", 1964, CLXXV, pp. 10P-11P.
Page, S. G., Huxley, H. E., Filament lengths in striated muscle, in ‟Journal of cell biology", 1963, XIX, pp. 369-390.
Podolsky, R. J., Introduction to ‛Theories of muscle contraction', in Biochemistry of muscle contraction (a cura di J. Gergely), London 1964, pp. 477 ss.
Podolsky, R. J., Teicholz, L. E., The relation between calcium and contraction kinetics in skinned muscle fibres, in ‟Journal of physiology", 1970, CCXI, pp. 19-35.
Portzehl, H., Caldwell, P. C., Rüegg, J. C., The dependence of contraction and relaxation of muscle fibres from the crab Maia squinado on the internal concentration of free calcium ions, in ‟Biochimica et biophysica acta", 1964, LXXXIX, pp. 581-591.
Portzehl, H., Zaoralek, P., Caudin, J., The activation by Ca2+ of the ATPase of extracted muscle fibrils with varition of ionic strenght, pH and concentration of MgATP, in ‟Biochimica et biophysica acta", 1969, CLXXXIX, pp. 440-448.
Potter, J. D., Gergely, J., Troponin, tropomyosin and actin interaction in the Ca2+ regulation of muscle contraction, in ‟Biochemistry", 1974, XIII, pp. 2697-2703.
Ringer, S., A further contribution regarding the influence of the different constituents of the blood on the contraction of the heart, in ‟Journal of physiology", 1883, IV, pp. 29-42.
Sandow, A., Fundamental mechanics of skeletal muscle contraction (special review), in ‟American journal of physical medicine", 1952, XXXI, pp. 103-125.
Sandow, A. e altri, Role of the action potential in excitation-contraction coupling, in ‟Federation proceedings", 1965, XXIV, pp. 1118-1123.
Smith, I. C. H., Energetics of activation in frog and toad muscle, in ‟Journal of physiology", 1972, CCXX, pp. 583-599.
Spronck, A. C., Évolution temporelle de l'hydrolyse de la phosphocréatine et de la synthèse d'hexose diphosphate pendant et après 5 secousses simples à 0 °C, chez le sartorius de Rana temporaria intoxiqué par l'acide monoiodoacétique, in ‟Archives internationales de physiologie", 1965, LXXIII, pp. 241-259.
Straub, F. B., Actin, Szeged 1943.
Szent-Györgyi, A., Observations on actomyosin, Szeged 1944.
Szent-Györgyi, A., Chemistry of muscular contraction, New York 1951.
Szent-Györgyi, A. G., Meromyosins, the subunits of myosin, in ‟Archives of biochemistry and biophysics", 1953, XLII, pp. 305-329.
Taylor, E. W., Chemistry of muscle contraction, in ‟Annual review of biochemistry", 1972, XLI, pp. 577-616.
Veratti, E., Investigations on the fine structure of striated muscle fiber, in ‟Journal of biophysical and biochemical cytology", 1902, X, suppl. 1.
Weber, H. H., Der Feinbau und die mechanischen Eigenschaften des Myosinfadens, in ‟Pflügers Archiv", 1934, CCXXXV, pp. 205-233.
Weber, H. H., Muscle contraction and muscle proteins, in ‟Proceedings of the Royal Society" (Series B), 1950, CXXXVII, pp. 50-58.
Weber, S. M., Tension and extensibility changes in muscle suddenly stretched during tetanus, in ‟American journal of physiology", 1953, CLXXII, pp. 37-41.
Weizsäcker, V., Myothermic experiments in salt solutions in relation to the various stages of a muscular contraction, in ‟Journal of physiology", 1914, XLVIII, pp. 396-427.
Wilkie, D. R., The relation between force and velocity in human muscle, in ‟Journal of physiology", 1950, CX, pp. 249-250.
Wilkie, D. R., Thermodynamics and the interpretation of biological heat measurements, in ‟Progress in biophysics and biophysical chemistry", 1960, X, pp. 260-298.
Wilkie, D. R., Heat, work and phosphorylcreatine breakdown in muscle, in ‟Journal of physiology", 1968, CXCV, pp. 157-183.
Winegrad, S., Autoradiographic studies of intracellular calcium in frog skeletal muscle, in ‟Journal of general physiology", 1965, XLVIII, pp. 455-479.
Woledge, R. C., Heat production and chemical change in muscle, in ‟Progress in biophysics and molecular biology", 1971, XXII, pp. 37-74.