Trasduzione del segnale nei linfociti B
Trasduzione del segnale nei linfociti B
Lo sviluppo, l'attivazione e il differenziamento dei Iinfociti sono regolati da numerose coppie di membrana Iigando-recettore; le più importanti sono i recettori per l'antigene e le molecole MHC, espresse dalle cellule B e T. Questi recettori determinano la specificità della risposta trasducendo segnali di inizio in modo da attivare i precursori di effettori specifici per l'antigene o inattivare cellule autoreattive. In accordo con questa apparente dicotomia nell'esito della trasduzione del segnale, risultati recenti indicano che questi recettori non funzionano come commutatori binari, non obbediscono cioè a una legge del tutto o nulla. Il legame antigene-recettore può produrre numerosi effetti biologici immediati dipendenti dalla struttura, dall'antigene stesso e dal contesto in cui opera, oltre che dallo stadio di differenziamento della cellula che risponde alla stimolazione. In questo saggio vengono discusse le basi biochimiche della trasduzione del segnale a opera del recettore per l'antigene delle cellule B (BCR) e sono descritti numerosi meccanismi specifici attraverso cui questi recettori vengono modificati da corecettori e da molecole accessorie.
Introduzione
Lo sviluppo e la generazione di risposte immunitarie sono processi, orchestrati in modo estremamente preciso, che coinvolgono molteplici meccanismi di regolazione. La complessità di tale regolazione, che non ha paragone con quella di nessun altro sistema di organi, si è evo Iuta anche grazie alle fortissime pressioni selettive presenti nel sistema immunitario. Questo, infatti, deve mettere in atto risposte rapide, utilizzando una vasta gamma di strategie per eliminare tutti i potenziali patogeni che tentano di prendere il sopravvento sull' ospite, evitando però nel contempo che si verifichino reazioni potenzialmente devastanti contro componenti dello stesso ospite, cioè gli autoantigeni o antigeni self. Per soddisfare la prima esigenza, il sistema immunitario ha dovuto sviluppare e dispiegare una serie di meccanismi effettori specializzati, in grado di affrontare con successo i diversi pericoli portati dai patogeni. Per adempiere alla seconda esigenza, invece, si sono resi necessari dei meccanismi atti a eliminare dal sistema le cellule che portano recettori per l'antigene che reagiscono contro molecole self. È possibile infatti che questi linfociti autore attivi, anche se inizialmente tolleranti, vengano attivati da antigeni esogeni che in qualche modo mimano la struttura dell'autoantigene, ma ne differiscono quel tanto che basta per attivare illinfocita autoreattivo. Anche se l'alternativa più importante per il destino delle cellule del sistema immunitario è quella tra la generazione della tolleranza verso il self e l'immunità, molte piccole decisioni sotto stanno a questi processi. Per esempio, le cellule B autoreattive possono rispondere all'antigene facendo scattare il programma di suicidio cellulare, cioè l'apoptosi, oppure modificando i recettori per l'antigene allo scopo di alterarne la specificità. Al contrario, l'incontro con un antigene può indurre la proliferazione delle cellule B o incrementare la loro capacità di presentare l'antigene alle cellule T e, in tal modo, ricevere da queste i segnali che inducono un'ulteriore proliferazione e il differenziamento delle cellule B verso lo stadio di plasmacellule che secernono anticorpi.
Affinché la trasduzione dei segnali produca esiti diversi pur utilizzando recettori che non cambiano la propria specificità, è necessario che i segnali siano modulati e integrati in modo differente a seconda delle circostanze in cui questi sono ricevuti. Un numero sempre maggiore di evidenze sperimentali indica l'esistenza di tre meccanismi principali attraverso i quali i segnali provenienti dal recettore per l' antigene vengono modificati in modo da produrre risposte specializzate: l) l'uso di opportuni corecettori, cioè molecole di membrana che possono associarsi fisicamente o funzionalmente, o in entrambi i modi, a un certo recettore, contribuendo a modulame l'attività. Perciò, quando un certo corecettore viene costimolato con il recettore per l'antigene si generano segnali che modificano o complementano quelli trasdotti dal recettore; 2) la modulazione dell'espressione e dell'utilizzazione delle molecole coinvolte con la trasduzione del segnale all'interno della cellula. Da ciò deriva un cambiamento della risposta al legame del recettore con l'antigene che dipende dallo stadio di sviluppo o di differenziamento cellulare; 3) la forza del segnale, determinata dall'affrnità e dalla valenza dell'antigene, può modificare l'esito biologico, stabilendo quantità, qualità e durata del segnale stesso. Nella biologia dei linfociti (sia T sia B) esistono molteplici esempi di questi tipi di regolazione. Per quanto riguarda il primo meccanismo si può citare l'amplificazione e l'attenuazione del segnale prodotto dal recettore per l'antigene attraverso l'associazione di questo rispettivamente con il recettore per il complemento di tipo Il (CR2, Complement Receptor 2) e con il recettore per le regioni costanti delle immunoglobuline G (FcγRIlBl). Per quanto concerne il secondo meccanismo, la trasduzione del segnale a opera del recettore per l'antigene può essere modificata alterando l'espressione di molecole accessorie o effettrici, tra cui CD22, CD45 e CDI9, la quale aumenta man mano che le cellule B maturano. Queste molecole effettrici possono esercitare sia effetti negativi (CD22) che positivi (CD45 e CDI9) sulla trasduzione del segnale mediata dal recettore. Infine, gli effetti legati alla forza dei segnali sono esemplificati dai due più noti meccanismi di generazione della tolleranza: da un lato la delezione donale indotta da antigeni associati alle cellule e dall'altro l'anergia donale indotta da antigeni autologhi solubili. Le basi molecolari dei processi con cui i linfociti trasducono e integrano i numerosissimi segnali che regolano la loro funzione e i meccanismi attraverso cui questi segnali sono modificati per decidere tra i diversi possibili destini delle cellule rappresentano un'affascinate e importante area di studio. In questo saggio descriviamo alcuni degli esempi attualmente noti di tali processi, focalizzando l'attenzione sulla trasduzione del segnale da parte del recettore per l'antigene delle cellule B e sulla modificazione di questo a opera di corecettori e di molecole effettrici o accessorie, o di entrambe.
Le basi molecolari della trasduzione del segnale a opera di BCR
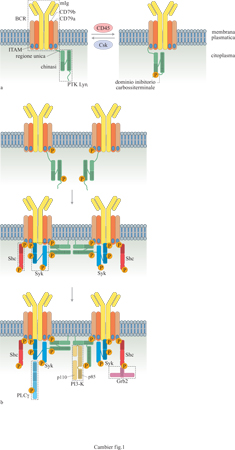
Quando ha inizio la transizione dallo stadio pre-B a quello di cellule B immature, queste cellule esprimono specifici recettori di superficie che hanno la funzione di internalizzare l' antigene per il successivo processamento e per la presentazione alle cellule T, e trasducono segnali che inducono diverse risposte, spesso addirittura tra loro alternative. Il recettore per l'antigene dei linfociti B (BCR, B Cell Receptor) è un complesso di molte subunità costituito da (fig. 1) un'immunoglobulina di membrana (mlg), associata in modo non covalente a eterodimeri di CD79a e CD79b legati tra loro da ponti disolfuro (Gold e DeFranco, 1994; Cambier, 1995; Pao et al., 1997b). Tutti gli isotipi di immunoglobuline possono partecipare alla formazione del BCR. Mentre le cellule B immature esprimono solamente recettori che contengono mlgM, le cellule B mature producono contemporaneamente mlgM e mlgD, e i linfociti B della memoria esprimono l'isotipo (per esempio IgG, IgA o IgE) che verrà secreto dalle plasmacellule derivate da essi.
l risultati ottenuti finora indicano che l'isotipo di immunoglobulina può influenzare il tipo di segnale trasmesso dal BCR. Per esempio, un gran numero di studi condotti a partire dagli anni Ottanta suggerisce che le mlgM e le mlgD trasducono segnali parzialmente diversi, ma le basi biochimiche di tale differenza non sono state definite. Le immunoglobuline di membrana differiscono dalle loro controparti secrete perché contengono una breve sequenza spaziatrice all'estremità carbossiterminale della catena pesante, una singola regione che attraversa la membrana, detta porzione transmembrana, e una corta estremità citoplasmatica di lunghezza variabile tra 3 residui (mlgM e mlgD) e 28 residui (mlgG). Anche se l'estremità citoplasmatica delle mlgM riveste un ruolo nella trasduzione del segnale a opera del recettore (Weiser et al., 1997), la funzione fondamentale è svolta da CD79a e CD79b (Gold e DeFranco, 1994; Cambier, 1995; Pao et al., 1997b). Queste molecole fanno parte della superfamiglia delle immunoglobuline, poiché contengono un singolo dominio extracellulare simile per struttura alle immunoglobuline, una singola regione transmembrana e un'estremità citoplasmatica di lunghezza compresa tra 48 (CD79b) e 61 residui amminoacidici (CD79a). I domini citoplasmatici sia di CD79a sia di CD79b contengono la sequenza YX₂LX₇ YX₂L, denominata ITAM (Immunoreceptor Tyrosin-based Activation Motif, sequenza attivatrice dell'immunorecettore basata su tirosina) che permette l'associazione del recettore con gli effettori citoplasmatici della trasduzione del segnale. Come verrà discusso in seguito, sia il contenuto amminoacidico sia i residui della sequenza spaziatrice sono di importanza cruciale per il legame del recettore e per l'attivazione delle molecole accessorie ed effettrici che contengono domini SH2 (v. figura 1).
In assenza dell'antigene, il recettore per l'antigene delle cellule B si associa a proteine tirosinchinasi (PTK) della famiglia Src mediante l'interazione tra la sequenza ITAM del recettore e un dominio presente all'estremità amminoterminale delle PTK (v. figura 1). Le chinasi legano in modo selettivo la sequenza ITAM di CD79a attraverso un sito che contiene una particolare sequenza amminoacidica, DCSM, che non è presente in CD79b. Il legame di motivi ITAM non fosforilati alla regione amminoterminale delle chinasi ha un'affinità bassa, ma viene stabilizzato in vivo dalla concomitante associazione delle chinasi con la vicina membrana plasmatica attraverso residui amminoterminali di mmstato e palmitato. La sequenza amminoterminale delle PTK di tipo Src, responsabile dell' associazione tra queste e il recettore inattivo, presenta notevoli differenze tra i membri della famiglia Src ed è perciò indicata come 'unica'. Oltre a questo dominio, i componenti della famiglia Src hanno in comune quattro domini SH (SrcHomology, omologia con Src) strutturalmente omologhi: il dominio catalitico SHl, il dominio SH2, quello SH3 e un'estremità carbossiterminale che contiene un residuo conservato di tirosina (Brown e Cooper, 1996). l domini SH2 e SH3 sono stati identificati in molte proteine e sono implicati nella regolazione delle interazioni proteina-proteina. l domini SH2 si legano ai residui tirosinici fosforilati della stessa o di altre proteine con una specificità che dipende dai residui fiancheggianti la fosfotirosina stessa. Il dominio SH3 interagisce con domini ricchi di prolina che si trovano in molte proteine con funzione di adattatore (Brown e Cooper, 1996). Si viene così delineando un complesso dinamico formato da numerose proteine, che interagiscono l'una con l'altra mediante meccanismi precisi, la maggior parte dei quali può essere modulata. Lo stato funzionale del complesso recettoriale dipende dall'equilibrio tra eventi attivatori (per esempio fosforilazione) e inibitori (defosforilazione) a loro volta controllati dalla stabilità di interazioni tra proteine. Qui di seguito discuteremo il ruolo o i ruoli di queste interazioni nella trasduzione del segnale mediata dal BCR.
Le PTK della famiglia Src associate al recettore BCR non legato all' antigene si trovano in un equilibrio dinamico tra uno stato inattivo e stati parzialmente attivi. È stato dimostrato che la transizione tra questi stati è in correlazione con la forforilazione di un singolo residuo di tirosina posto all'estremità carbossiterminale della chinasi (Songyang et al., 1995; Brown e Cooper, 1996; Pao et al., 1997b; Pao e Cambier, 1997). La fosforilazione di questo residuo, altamente conservato tra i membri della famiglia Src, è mediata da una PTK del citosol denominata Csk (C-terminai Src-family kinase) e fa si che l'enzima sia inattivo. La defosforilazione di questo residuo, mediata dalla proteina transmembrana tirosinfosfatasi CD45, attiva parzialmente la chinasi (v. figura 1a). Vari studi hanno suggerito che l'inattivazione della chinasi dovuta alla fosforilazione della tirosina carbossiterminale è il risultato della sua interazione intramolecolare con il suo stesso dominio SH2 (Brown e Cooper, 1996). La risoluzione della struttura tridimensionale mediante cristallo grafia a raggi X di due membri della famiglia Src, c-Src e Hck, ha fornito la dimostrazione definitiva che tale interazione si verifica realmente.
Questi studi hanno anche fatto luce su un altro aspetto della regolazione Src che implica il dominio SH3. È noto da qualche tempo che il dominio SH3 delle chinasi esercita un ruolo nella loro attività regolatrice. Ciononostante, il meccanismo d'azione è rimasto oscuro dal momento che le chinasi di tipo Src non possiedono un dominio ricco di proline che, legando si a quello SH3 all'interno della stessa molecola, potrebbe essere responsabile di tale effetto. Gli studi cristallografici rivelano, tuttavia, una interazione molecolare inattesa tra il dominio SH3 e la parte posteriore del dominio catalitico di Src, in gran parte mediata dal segmento di giunzione (linker) che unisce il dominio SH2 a quello catalitico (v. figura 1a). Il segmento di giunzione, anche se non contiene la sequenza di consenso PXXP che si lega al dominio SH3, assume la conformazione a elica sinistrorsa della poliprolina-ll che occupa il sito per illigando di SH3. Così, attraverso interazioni intramolecolari, sia il dominio SH2 sia quello SH3 contribuiscono alla stabilizzazione di una conformazione chiusa che non permette al dominio catalitico di assumere uno stato enzimaticamente attivo. La destabilizzazione di questa conformazione, dovuta a defosforilazione carbossiterminale oppure al legame competitivo di altre molecole, con uno solo o con entrambi i domini SH2 e SH3 delle chinasi Src, dovrebbe provocare un aumento dell' attività catalitica della chinasi.
In accordo con quest'ipotesi, uno studio recente ha mostrato un incremento dell' attività di Hck di cinquanta volte, in seguito alla sua interazione con la proteina Nef di HlV (Human lmmunodeficiency Virus, virus dell'immunodeficienza umana) la quale costituisce un ligando ad alta affinità per il dominio SH3 di Hck (Moarefi et al., 1997).
Una regolazione ulteriore dell'attività delle chinasi della famiglia Src si ottiene mediante la fosforilazione di un altro residuo conservato di tirosina (la Y 416 nel caso della c-Src), localizzato nel segmento di attivazione del dominio catalitico. Si ritiene che la fosforilazione di questa tirosina produca un cambiamento conformazionale nel dominio catalitico provocandone l'attivazione. Più in dettaglio, questo evento potrebbe implicare l'interazione del residuo di fosfotirosina con residui carichi positivamente, nascosti all'interno del dominio catalitico. Riducendo l'impedimento sterico, questa interazione potrebbe permettere a un residuo di glutammato presente nella parte amminoterminale del dominio catalitico di venire in contatto, riposizionandolo, con un residuo di lisina importante per la coordinazione di un gruppo fosfato dell'ATP (Yamaguchi e Hendrickson, 1996). È stato dimostrato che la fosforilazione del residuo Y 416 segue una cinetica di primo ordine in relazione alla chinasi, e si pensa che l'evento sia mediato dalle stesse PTK di tipo Src. Quindi, la stretta vicinanza di molecole della famiglia Src associate al recettore durante l' aggre gazione del recettore stesso dovrebbe permetterne l'efficiente transfosforilazione (Moarefi et al., 1997). In accordo con quanto appena proposto, l'aggregazione del BCR provoca una rapida fosforilazione in tirosina di parecchi membri PTK della famiglia Src, tra cui Lyn, Fyn, Lck, Blk e Fgr, per alcuni dei quali è stata dimostrata un'associazione con il recettore inattivo (Cambier, 1995; Pao et al., 1997b). Tale fosforilazione si potrebbe verificare a livello del segmento di attivazione di queste chinasi, spiegando in parte l'aumento di attività enzimatica riscontrato. Studi che hanno utilizzato cellule B provenienti da topi knock out per Lyn, cioè topi in cui il gene Lyn è stato distrutto, e linee di cellule T prive di Lck dimostrano che gli eventi di fosforilazione dei residui tirosinici mediati dal recettore sia di lTAM sia di moltissimi altri substrati cellulari dipendono dall'espressione di parte delle chinasi della famiglia Src (DeFranco, 1997 comunicazione personale). Ciò suggerisce che questa famiglia di PTK sia responsabile della fosforilazione in tirosina di lTAM e della trasduzione del segnale a valle, e che la famiglia di chinasi più vicina venga attivata in seguito all'aggregazione del recettore.
Per un'efficiente fosforilazione di residui tirosinici delle chinasi di tipo Src, indotta dall'aggregazione del recettore, è necessaria l'espressione della fosfatasi CD45. Questo risultato suggerisce che la transfosforilazione delle chinasi dipenda dalla defosforilazione del motivo inibitorio carbossiterminale (Pao e Cambier, 1997). Tuttavia, in cellule prive di CD45, la fosforilazione dei residui di tirosina di molti substrati intracellulari, tra cui le subunità del recettore, successiva all'aggregazione del BCR, non è compromessa. Quindi altre chinasi possono forse compensare l'attività della famiglia Src, oppure l'attività delle chinasi Src, verso la sequenza lTAM, rimane intatta anche quando sono fosforilate nella porzione carbossiterminale. Perfrno una chinasi fosforilata a livello della tirosina della regione carbossiterminale e, quindi inattiva, è capace di una limitata transfosforilazione in vitro, suggerendo che l'attività chinasica della famiglia Src non è completamente inibita da questa modificazione covaI ente (Moarefi et al., 1997).
La fosforilazione in tirosina delle PTK di tipo Src, conseguente all'aggregazione del BCR, si accompagna alla fosforilazione delle tirosine conservate di lTAM (Cambier, 1995; Pao et al., 1997b). Il contesto amminoacidico che fiancheggia queste tirosine è ottimale per permetterne la fosforilazione da parte delle chinasi di tipo Src (Songyang et al., 1995; Schmitz et al., 1996). Tuttavia, solamente il residuo di tirosina nella sequenza lTAM amminoterminale di CD79a (Y 182) soddisfa completamente le richieste di riconoscimento del substrato da parte delle chinasi Src, in base ai risultati ottenuti in vitro sia per Lyn che per Blk (Schmitz et al., 1996). In accordo con tali risultati, è stato dimostrato che la presenza di questo residuo nel BCR è di importanza cruciale per la fosforilazione in tirosina sia di CD79a che di CD79b, conseguente all'aggregazione del recettore, e include il principale sito di fosforilazione in tirosina del recettore BCR in vivo. Studi basati sull'espressione delle chinasi Src nei baculovirus, virus che infettano le cellule degli insetti, e su quella di CD79a e CD79b nei batteri, hanno confermato ulteriormente questo dato, dimostrando che in vitro la fosforilazione della posizione Y 182 di CD79a è quattro volte superiore alla Y 193 (Pao et al., 1997b). l risultati di questi studi suggeriscono che solo una piccola frazione dei recettori aggregati è fosforilata su tutte le tirosine di lT AM conservate. Le possibili implicazioni di queste osservazioni nella trasduzione del segnale da parte dei recettori BCR sono discusse qui di seguito.
Dopo la fosforilazione, le tirosine di lT AM agiscono come un ponte, attirando verso il recettore effettori come Shc, Syk e altre chinasi della famiglia Src attraverso i loro domini SH2 (Pao et al., 1997b). Il legame delle chinasi di tipo Src alla sequenza lTAM fosforilata a livello delle tirosine aumenta ulteriormente la loro attività specifica, spiegando così l'induzione della fosforilazione di substrati aggiuntivi come Syk (v. figura 1b). È stato dimostrato che l'associazione di Syk con il motivo lTAM fosforilato a livello di due tirosine (pplTAM) coinvolge entrambi i domini tandem SH2 di Syk che si legano ai due residui di fosfotirosina, adeguatamente distanziati, del pplTAM. Inoltre, questo legame aumenta l'attività specifica di Syk e provoca la fosforilazione delle sue tirosine (Kurosaki et al., 1994; Kurosaki et al., 1995). Tale fosforilazione può essere mediata dalle PTK della famiglia Src associate al recettore, dalla transfosforilazione di Syk, oppure da entrambi gli eventi, provocando un ulteriore incremento dell'attività di Syk e la creazione di siti di legame per altri effettori che contengono domini SH2. Quindi, entrambe le classi di tirosinchinasi Src e Syk sono attivate in seguito alla loro interazione con la sequenza lTAM fosforilata. È importante notare, tuttavia, che la natura asimmetrica della fosforilazione di lTAM fa in modo che solo una frazione dei recettori aggregati, probabilmente meno del 10%, possa legare e attivare Syk; la maggior parte di questi si legherà a molecole di trasduzione del segnale o anche a molecole adattatrici contenenti un solo dominio SH2. L'analisi dei requisiti necessari alle sequenze per il riconoscimento dei peptidi con tirosine fosforilate, da parte di proteine contenenti domini SH2 differenti, ha rivelato che queste ultime sono sensibili agli amminoacidi compresi tra la posizione -2 e la posizione +3 rispetto al residuo tirosinico fosforilato. Quindi, la fosforilazione della Y 182 di CD79a crea un sito di legame putativo per il dominio SH2 della proteina adattatrice Shc, mentre la fosforilazione della Y 193 è fondamentale per il legame al dominio SH2 delle chinasi di tipo Src (Songyang et al., 1994). In pieno accordo con questi dati, è stato anche dimostrato che Shc va incontro a fosforilazione in tirosina in risposta all'aggregazione del BCR e si lega in vitro, attraverso il proprio dominio SH2, al motivo pplTAM di CD79a e CD79b.
In base a studi di legame e di coprecipitazione in vitro, si sono accumulate diverse prove che indicano che il recettore BCR attivato, con le chinasi associate di tipo Src e Syk, è in grado di attirare un ulteriore 'strato' di effettori verso il recettore (Pleiman et al., 1994). Questi includono la fosfolipasi Cγ (PLCγ) che si lega alla proteina Syk fosforilata, attraverso il proprio dominio SH2, e la fosfatidilinositolo 3-chinasi (PI3-K) che si lega al dominio SH3 delle chinasi di tipo Src, attraverso una sequenza ricca di proline, presente nella sua subunità p85. Quest'ultima interazione può anche condurre a un'attivazione ulteriore delle PTK della famiglia Src, come discusso in precedenza. Viceversa, il legame di PI3-K ai domini SH3 della famiglia Src innesca la propria attività enzimatica (Pleiman et al., 1994), che consiste nella fosforilazione del fosfatidilinositolo nella posizione 3 dell'anello di inositolo. Dopo l'associazione con il recettore, PLCγ va incontro alla fosforilazione in tirosina che provoca la sua attivazione e l'idrolisi del fosfatidilinositolo 4,5-bisfosfato (PlP2) che produce due prodotti solubili, l'inositolo 1,4,5-trisfosfato (lP₃) e il diacilglicerolo. Questi secondi messaggeri solubili sono coinvolti nella mobilizzazione degli ioni Ca2+ e nell'attivazione della proteinchinasi C, rispettivamente. Inoltre l'osservazione che Shc viene attirato verso il recettore fosforilato a livello delle tirosine suggerisce l'esistenza di un nesso tra l'attivazione del BCR e la via di trasduzione del segnale di p2lras. È stato dimostrato in molti tipi cellulari, tra cui le cellule B, che Shc si lega alla molecola adattatrice Grb2, che media ulteriormente il legame con Sos e p2lras. Grazie alla sua attività enzimatica, la proteina Sos è in grado di favorire il rilascio di GDP e il legame di GTP da parte di p2lras. Quest'ultima viene così attivata e propaga il segnale.
L'apparente associazione di specifici residui tirosinici fosforilati di lTAM a determinate vie di trasduzione del segnale a valle, come per esempio il legame della Y 182 di CD79a con Shc, e l'asimmetria della fosforilazione delle tirosine di lT AM suggeriscono un meccanismo attraverso il quale la forza del segnale può influenzare le decisioni relative al destino cellulare. Quindi, le differenze di affinità o di avidità, o di entrambe, nell'interazione tra l'immunoglobulina di superficie delle cellule B e l'antigene possono determinare uno schema di fosforilazione delle tirosine nelle subunità del BCR che potrebbe a sua volta attivare vie di trasduzione del segnale diverse con esiti biologici differenti. Un esempio di tale regolazione è stato fornito da uno studio degli eventi biochimici che hanno inizio con la stimolazione del recettore delle cellule T (TCR, T Cell Receptor) da parte del complesso MHC-peptide (Major Histocompatibility Complex, complesso maggiore di istocompatibilità) che si trova sulle cellule presentanti l'antigene (Madrenas et al., 1995). Mentre molecole MHC, occupate da un peptide agonista, inducevano la normale fosforilazione dei residui tirosinici delle subunità del TCR e la conseguente fosforilazione e attivazione della ZAP- 70, la proteina associata alla catena Z (Zeta-Associated Protein), che condivide una certa omologia strutturale con Syk, si è visto che singoli cambiamenti di amminoacidi nella sequenza peptidica o delle molecole MHC conducevano a un parziale agonismo o antagonismo, tale da produrre un cambiamento nel modello di fosforilazione in tirosina delle subunità del TCR e una mancanza di fosforilazione e attivazione di ZAP-70. Quindi, minimi cambiamenti di affinità dell'interazione TCR (MHC-peptide) possono indurre tipi diversi di fosforilazione in tirosina nella sequenza lTAM del recettore, provocando una modificazione del reclutamento e dell' attivazione delle molecole di trasduzione del segnale e una diversa risposta biologica. A tale proposito, la densità dei recettori nell'aggregato o anche la durata dell'aggregazione stessa, che dipendono entrambe dalla percentuale di recettori associati al ligando rispetto a quelli non legati, possono determinare quale via biochimica sarà intrapresa da tale aggregato. Una possibile razionalizzazione di questa correlazione è rappresentata da un modello denominato correzione cinetica di bozze, secondo il quale la sequenza di eventi biochimici che ha inizio dopo l'aggregazione del recettore introduce uno sfasamento temporale tra la formazione iniziale dell'aggregato del recettore e la risposta biochimica completa. Quindi, l'esito biochimico dell'aggregazione del recettore, e di conseguenza la risposta cellulare indotta, dipenderebbero dal grado di propagazione del segnale prima della dissociazione dell'aggregato. È possibile che i residui tirosinici dei motivi lTAM presenti su CD79a e CD79b siano anche fosforilati in modo diverso a seconda della durata della vita del cluster, fornendo così segnali differenti in funzione del tempo trascorso dall'inizio dell'aggregazione del recettore. È stato inoltre dimostrato che la coaggregazione di specifici corecettori o di molecole accessorie, o di entrambi, con il recettore BCR può avere, in certi casi, un effetto marcato su alcuni particolari biochimici del processo di trasduzione del segnale e quindi sulla risposta cellulare. Nel paragrafo successivo descriveremo il caso meglio studiato tra questi.
Funzione accessoria di CD19 nella trasduzione del segnale mediata da BCR
CDl9 è una glicoproteina transmembrana, altamente conservata e specifica per i linfociti B, che viene espressa dallo stadio di cellule pro-B a quello di plasmacellule. La sua porzione extracellulare contiene due domini simili per struttura alle immunoglobuline, e la sua regione terminale citoplasmatica di 242 amminoacidi contiene nove siti potenziali di fosforilazione in tirosina. Mediante esperimenti di coimmunoprecipitazione è stato dimostrato che almeno in un linfoma umano (Daudi) CDl9 è associata alle 19M di membrana e si ridistribuisce, insieme a queste, in seguito al contatto con l'antigene (capping); le molecole proteiche, cioè, all'inizio distribuite su tutto il perimetro della cellula, si condensano in una zona ben precisa della superficie cellulare. Inoltre, le molecole CD19 vanno incontro a fosforilazione dei residui tirosinici, situati nella porzione citoplasmatica, in risposta all'aggregazione del BCR (Carter et al., 1997). Alcuni studi recenti indicano che la molecola CD19 si associa con il BCR attraverso la sequenza di 17 amminoacidi immediatamente sotto stante la membrana pIasmatica. Quindi, o la molecola CD19 è preventivamente associata al BCR oppure si associa a esso dopo l'aggregazione del recettore e funziona come substrato delle PTK attivate dal recettore. Come abbiamo già detto, la molecola CD19 è espressa sulle cellule pro-B e pre-B, che sono prive di mlg, e la sua aggregazione in questo contesto provoca anche la fosforilazione dei residui tirosinici e l'attivazione di alcune PTK di tipo Src. Alcune indicazioni suggeriscono che l'espressione di CD19 aumenta man mano che le cellule B evolvono dallo stadio immaturo a quello maturo. Questi e altri dati di coprecipitazione indicano che la molecola CD19 sia associata direttamente alle chinasi della famiglia Src. CDl9 è anche una componente del complesso del recettore per il complemento di tipo II e, come vedremo in seguito, è implicata nella trasduzione del segnale da parte di tale complesso. Infine, topi in cui la molecola CD19 è stata rimossa mediante ricombinazione omologa presentano difetti dell'attivazione, della proliferazione mediata dal BCR, della formazione di centri germinativi e della generazione di risposte anticorpali; questo indica che tale proteina esercita un ruolo positivo importante nell'attivazione e nel differenziamento delle cellule B.
Studi recenti hanno provato che l'attivazione mediata dal BCR di alcune vie a valle dipende dall'espressione di CDI9. La fosforilazione in tirosina della molecola CDI9, in risposta all'aggregazione del BCR, avviene prevalentemente a livello di due residui, Y 484 e Y 515, situati nella porzione distale dell'estremità citoplasmatica di CDl9 all'interno dei motivi YXXM (Buhl et al., 1997). I risultati ottenuti indicano che questi residui di fosfotirosina mediano l'associazione della subunità p85 di PI3-K con CD19 (Tuveson et al., 1993). Inoltre, la fosforilazione di questi residui tirosinici è critica per l'attivazione di PI3-K mediata dal BCR, ma non è richiesta per altri eventi di trasduzione del segnale come la fosforilazione di CD79a, CD79b, Lyn, Syk, PLCγl e PLCγ2 (Buhl et al., 1997). Anche se la fosforilazione in tirosina di PLCγ mediata dal BCR è indipendente da CDI9, l'idrolisi del fosfoinositolo in seguito all'aggregazione del BCR è molto ridotta, se CD19 non è espressa. La fosforilazione in tirosina di PLCγ in assenza di CD19 non è sufficiente a indurre un'idrolisi efficace di fosfoinositolo e la mobilizzazione del Ca²+ (Buhl et al., 1997; Pao e Cambier 1997). Studi condotti sugli inibitori di P13-K e sulle cellule B provenienti da topi knock out per CD19 indicano che l'attivazione di P13-K è necessaria per l'idrolisi del fosfoinositolo mediata dal recettore e per la mobilizzazione degli ioni Ca²+ (Buhl et al., 1997; Hippen et al., 1997).
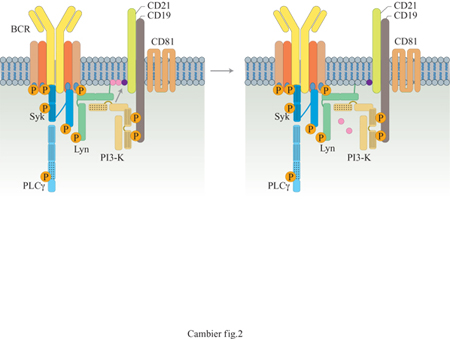
Anche se il meccanismo con cui P13-K è in grado di complementare l'attività di PLCγ non è ancora noto, numerose evidenze sperimentali suggeriscono che un ruolo chiave possa essere svolto dal fosfatidilinositolo-3,4,5-trisfosfato (Ptdlns3,4,5P3), il prodotto della fosforilazione del fosfatidilinositolo-4,5-bisfosfato (Ptdlns4,5P2) da parte di P13-K. È stato dimostrato che Ptdlns3,4,5P3 lega i domini SH2 e modula l'interazione di P13-K con le proteine fosforilate a livello di residui tirosinici. È inoltre risultato che il fosfoinositolo interagisce con un altro modulo proteico noto con il nome di dominio di omologia della plecstrina (PH, Plekstrin Homology). Questo dominio si trova nella sequenza della tirosinchinasi di Bruton (Btk), una PTK che è necessaria per la mobilizzazione di Ca²+ mediata dal BCR, in particolare per il flusso di questo verso l'interno della cellula. Un'osservazione interessante è che Btk interagisce selettivamente, mediante il dominio PH, con vescicole che trasportano il Ptdlns3,4,5P3. Btk può dunque essere l'effettore complementare necessario per l'idrolisi di fosfoinositolo mediata da PLCγ. lnfine, è possibile che nel complesso del recettore attivo, P13-K si leghi contemporaneamente sia al dominio SH3 delle chinasi di tipo Src sia ai residui tirosinici fosforilati di CD19, facendo da ponte tra questi effettori (fig. 2). Questa interazione a molteplici punti potrebbe essere necessaria per un'attivazione ottimale di P13-K (PIe iman et al., 1994; Buhl et al., 1997).
In sintesi, l'aggregazione del recettore BCR provoca la formazione di un grosso complesso costituito da CD19, CD79b, CD79a e da altri effettori, tra cui le componenti a monte di molteplici vie di segnalazione che sono attivate dall'aggregazione del BCR. Le interazioni dinamiche intere intraproteiche, che avvengono all'interno del complesso, promuovono probabilmente l'attivazione di vie che trasducono segnali dal BCR al nucleo: l'idrolisi del fosfoinositolo mediata da PLCγ e la conseguente mobilizzazione di Ca²+, la via Shc-Ras-MAPK e la via P13-K. Come vedremo in seguito, l'importanza del CD19 per l'amplificazione e la modulazione del segnale indotto dall'aggregazione del BCR è ulteriormente esemplificata dalla sua presenza in complessi proteici di membrana che agiscono da corecettori, come per esempio CR2.
CR2: un corecettore per l'amplificazione del segnale mediata da BCR
Uno dei più importanti modulatori del segnale indotto dal BCR è il recettore per i frammenti C3bi e C3dg della componente C3 del complemento. Questi frammenti sono prodotti in seguito alla fissazione del complemento da parte degli immunocomplessi e da certe superfici biologiche. l frammenti si legano covalentemente, attraverso un legame e sterico , al coniugato che promuove la fissazione e accoppiano il complesso con il recettore per il complemento CR2. Esperimenti classici condotti da M.B. Pepys hanno dimostrato che i topi privati del complemento, mediante somministrazione di veleno di cobra, rispondevano in modo ridotto all'antigene (Pepys, 1974; Fearon e Carter, 1995). In seguito, è stata messa in evidenza una correlazione tra deficit, indotti mediante modificazione genetica, di C3α, C4 e C2, i quali sono implicati nell'attivazione di C3, e ridotta capacità di risposta immunitaria. Studi recenti, che hanno utilizzato topi transgenici per Ig anti-HEL e quindi producenti anticorpi anti-HEL in grande quantità (Dempsey et al., 1996), hanno dimostrato in modo elegante il ruolo rivestito da C3dg e dal suo recettore nella risposta immunitaria. È risultato che l'antigene HEL (Hen Egg Lysozyme, lisozima di uovo di gallina), coniugato con C3dg in rapporto molare di 1:3 è 10.000 volte più immunogenico di HEL da solo. Le analisi condotte finora sulla cascata di trasduzione del segnale di CR2 hanno dimostrato che l'aumento di immunogenicità dei coniugati antigene-CD3dg è in correlazione con l'incremento dell'idrolisi di fosfoinositolo e della mobilizzazione di Ca²+ in cellule che rispondono all'antigene (Dempsey et al., 1996).
CR2 è un complesso di molte subunità composto da CD2l, CD19, Leu 13 e CD8l (Fearon e Carter, 1995; Tedder et al., 1997). La componente CD2l del complesso è responsabile del legame di C3dg; CD19 interagisce con CD8l, un membro della famiglia tetraspan (proteine che attraversano quattro volte il doppio strato lipidico della membrana), mediante il suo dominio extracellulare, e con CD2l, attraverso i suoi domini sia extracellulare sia transmembrana. CD2l contiene un dominio extracellulare composto da molteplici ripetizioni di brevi sequenze di consenso con unità di 60÷70 residui ripiegate in modo compatto, un singolo dominio transmembrana e una sequenza terminale citoplasmatica di 34 amminoacidi. Date le dimensioni relativamente ridotte di questa regione terminale, sembrerebbe che tutte le funzioni di trasduzione del segnale del complesso CR2 siano affidate al CD8l e al CD19. CD8l contiene tutte le informazioni strutturali necessarie per trasdurre i segnali che inducono l'aggregazione omotipica. Studi mediante recettori chimerici indicano che altre funzioni di trasduzione del segnale, soprattutto l'intensificazione della risposta di mobilizzazione di Ca²+ in seguito al legame del BCR, risiedono nella regione citoplasmatica terminale di CD19. La rimozione genetica di CD2l e quella di CD19 hanno effetti paragonabili sul sistema immunitario: l'attivazione delle cellule B è difettosa, le risposte anticorpali sono in larga misura inibite, e la formazione dei centri germinativi è molto ridotta.
Sembra che il CD19 svolga due ruoli distinti nella trasduzione del segnale: funzionando da un lato come una molecola accessoria (v. sopra) e dall'altro come corecettore, in seguito alla coaggregazione di CR2 e BCR mediante immunocomplessi contenenti C3dg. La natura del segnale (o dei segnali) aggiuntivo prodotto dalla formazione concomitante di legami crociati (co-crosslinking) del complesso BCRCR2 non è chiara. Ovviamente, l'aumento potrebbe essere semplicemente quantitativo; l'aggregazione del recettore BCR con CR2 potrebbe soltanto promuovere una fosforilazione più efficiente dei residui tirosinici di CDl9 presenti nei motivi YXXM e indurre, quindi, in maniera più efficace il reclutamento e l'attivazione di P13-K. In base a studi condotti in precedenza dal nostro laboratorio sulla funzione accessoria del CDI9, ci si potrebbe aspettare che questo aumento del reclutamento e dell'attivazione di P13-K provochi un'intensificazione dell'idrolisi di fosfoinositolo mediata dal BCR e della mobilizzazione di Ca²+ (Buhl et al., 1997; Hippen et al., 1997). Questo è esattamente ciò che si osserva empiricamente sia nella coaggregazione anti-HELC3dg sia nella coaggregazione CR2-BCR mediata dagli anticorpi. In alternativa, o in aggiunta, la coaggregazione CR2-BCR può promuovere la fosforilazione di altre tirosine di CD19 oltre alla Y 484 e alla Y 515. È stato riportato che Fyn si lega alla molecola CDl9 fosforilata attraverso il suo dominio SH2; è stato anche proposto che questa interazione avvenga attraverso le tirosine fosforilate in posizione 405 e 445 che si trovano nel contesto YEND/E. Inoltre, la tirosina 391 di CDl9 si trova nella sequenza YEEP che, probabilmente, dopo fosforilazione lega la molecola trasduttrice multifunzionale Vav (Songyang et al., 1993). La tirosina 391 di CDl9 è necessaria per l'attivazione ottimale di Vav, in seguito a coaggregazione con CR2 (Fearon, comunicazione personale). È però importante notare che non è stato possibile rilevare alcuna fosforilazione di questi residui dopo aggregazione del BCR in condizioni che inducono una potente fosforilazione di Y 484 e di Y 515 (Buhl, dati non pubblicati).
In conclusione, è chiaro che la coaggregazione di CR2 con il recettore BCR amplifica enormemente la risposta cellulare a basse dosi di antigene. Le basi molecolari di tale amplificazione sono probabilmente attribuibili a differenze quantitative o anche qualitative nella trasduzione del segnale promossa dalla regione terminale citoplasmatica del CD19, quando questo coaggrega con il BCR. I meccanismi di amplificazione prevedono probabilmente un aumento della fosforilazione di Y 484 e Y 515, incrementando l'attivazione di P13-K, cioè secondo un meccanismo quantitativo, o la fosforilazione di altre tirosine, non fosforilate in seguito alla sola aggregazione del BCR - che attivano nuove vie - cioè secondo un meccanismo qualitativo. Come vedremo in seguito, sembra che la regolazione selettiva dell'attivazione di queste vie a opera del BCR sia da attribuire a proteine tirosinfosfatasi (PTP) e fosfoinositolofosfatasi.
Ruolo di CD45 nella partecipazione delle chinasi Src alla trasduzione del segnale mediata da BCR
Le cellule della linea emopoietica esprimono forme diverse, prodotte da splicing alternativo, di CD45, una tirosinfosfatasi di membrana (Thomas, 1989). Le cellule della linea B esprimono le proteine CD45, B220 (CD45R), all'inizio dello stadio pre-pro-B (frazione A). L'espressione aumenta progressivamente man mano che le cellule B maturano, raggiungendo il massimo livello allo stadio di cellula B matura. Il differenziamento delle plasmacellule secernenti anticorpi si accompagna alla perdita dell'espressione di CD45, perciò la maggior parte dei mielomi, i tumori delle plasmacellule, è negativa per CD45. La proteina CD45 contiene due domini di tirosinfosfatasi nella sua estremità citoplasmatica. Anche se l'uso variabile di tre domini extracellulari, mediante splicing alternativo degli esoni corrispondenti, a seconda della linea cellulare e dello stadio differenziativo, suggerisce la possibilità che diversi ligandi siano in grado di interagire con CD45, non è stato finora descritto nessun ligando specifico di CD45.
Numerosi studi hanno indicato un coinvolgimento di CD45 nella regolazione della trasduzione del segnale mediata dal recettore per l'antigene. I primi studi sono stati condotti sulla linea cellulare di mieloma di topo J558Lflm3, che porta il recettore per l'antigene ed è negativa per CD45. I risultati ottenuti con questa linea cellulare hanno indicato che è necessario ripristinare l'espressione di CD45 mediante transfezione affinché si verifichi la mobilizzazione di Ca²+ indotta dall'antigene (Justement et al., 1991). L'analisi di cloni isolati, che esprimevano livelli variabili di CD45, ha rivelato una correlazione diretta tra il livello di espressione di CD45 e il grado di mobilizzazione di Ca²+ indotta dal BCR. In seguito, esperimenti condotti su topi knock out hanno dimostrato che l'espressione di CD45 è necessaria per lo sviluppo di cellule B mature nella milza (IgM-positive, IgD-positive). Infatti, il compartimento delle cellule B nella milza dei topi knock out era più grande di quasi due volte rispetto al normale, ma conteneva essenzialmente cellule immature (IgM-positive, IgD-negative). Queste cellule non riuscivano a proliferare normalmente in risposta alla stimolazione BCR e presentavano difetti nella capacità di risposta immunitaria. Studi condotti sulla funzione delle cellule B in topi knock out per CD45, che esprimevano transgeni di immunoglobulina anti-HEL, hanno indicato che CD45 ha la funzione di aumentare la sensibilità delle cellule Balla stimolazione antigenica. Quindi, la proteina CD45 gioca un ruolo positivo nella trasduzione del segnale mediata dal BCR.
Questa proteina defosforila in modo specifico un residuo di fosfotirosina con funzione di regolazione negativa situato nell' estremità carbossiterminale delle chinasi della famiglia Src, aumentando l'attività di fosforilazione di un gran numero di substrati. Studi recenti, condotti sempre sulla linea cellulare J558Lflm3 negativa per CD45, indicano che le chinasi di tipo Src, fosforilate nella porzione carbossiterminaIe, riescono ad associarsi al BCR attraverso le regioni 'uniche' amminoterminali (Pao e Cambier, 1997). Tuttavia, in questo sistema le chinasi di tipo Src associate al BCR non si attivano in risposta all'aggregazione di quest'ultimo e non si legano nemmeno alle sequenze ITAM fosforilate a livello delle tirosine. Questo comportamento è probabilmente la conseguenza di una competizione con i residui fosfotirosinici carbossiterminali per i loro domini SH2. È interessante notare che, nella linea cellulare J558Lflm3 negativa per CD45, nonostante la mancata attivazione delle chinasi Src, l'aggregazione del BCR provoca la fosforilazione delle tirosine di CD79a, CD79b e di molti effettori a valle (Pao e Cambier, 1997; Pao et al., 1997a).
La mancata attivazione delle chinasi Src in seguito all'aggregazione di BCR nelle cellule J558Lflm3 permette di attivare selettivamente questa o quella via di trasduzione del segnale. In tali cellule, l'aggregazione del BCR non induce la fosforilazione di Shc e nemmeno l'attivazione di p21ras (Pao et al., 1997a). Ciò è in accordo con la funzione precedentemente dimostrata di Shc che, legandosi ai complessi Grb2-Sos, agisce come linker verso la via di raso È importante notare che la fosforilazione mediata dal BCR di molti altri substrati, tra cui Syk, CD79a, CD79b, PLCγ, Vav, Cbl e HSl continua regolarmente nelle cellule J558Lflm3 negative per CD45 (Pao et al., 1997a). Anche se la fosforilazione dei residui tirosinici di PLCγl e PLCγ2 appare normale, la produzione di inositolo 1,4,5-trisfosfato (lP3) e la mobilizzazione di Ca²+ a essa collegata sono bloccate in cellule negative per CD45 (Pao et al., 1997a). Questo dato indica che l'idrolisi del fosfoinositolo mediata dal BCR dipende da qualche effettore regolato da CD45 in grado di complementare la funzione di PLCγ nella produzione di lP3. Anche se non esistono prove dirette indicanti il coinvolgimento di un particolare effettore, ovvi candidati per questa funzione includono il CDI9, la Btk, e il P13-K, tutti necessari per la mobilizzazione di Ca²+ indotta dall'antigene. Come discusso in precedenza, questi effettori possono agire in modo sequenziale. Così, l'idrolisi del fosfoinositolo da parte di PLCγ fosforilata può dipendere dalla traslocazione di Btk verso la membrana plasmatica e dalla sua azione a livello di questa. Non è ancora stato determinato se l'attivazione di Btk e di P13-K dipende dall'espressione di CD45. In conclusione, la proteina CD45 modula qualitativamente la trasduzione del segnale a opera del BCR, determinando la partecipazione delle chinasi di tipo Src e attivando, forse attraverso tali chinasi, alcune vie di segnalazione a valle, tra cui la cascata p21ras-MAPK, l'idrolisi del fosfoinositolo e la mobilizzazione di Ca²+. Modulando l'attivazione selettiva di queste vie, i cambiamenti di espressione di CD45, durante lo sviluppo delle cellule B, potrebbero fare in modo che la stimolazione mediata dal BCR riesca a indurre risultati biologici differenti.
FcγRIIB1, un corecettore inibitorio di BCR
FcγRIIB1 è un recettore a bassa affinità per le IgG che è espresso durante tutto lo sviluppo e la maturazione delle cellule B fino alla fase di plasmacellule (Ravetch e Anderson, 1990; Amigorena et al., 1992). Esperimenti iniziali hanno dimostrato la mancanza di immunogenicità degli immunocomplessi contenenti anticorpi di classe IgG, indicando il coinvolgimento di questo recettore nell'inibizione della trasduzione del segnale. Studi successivi hanno rivelato che la coaggregazione specifica di FcγRIIB1 con il BCR provoca l'inibizione delle risposte proliferative e di blastogenesi (Phillips e Parker, 1983). Perché si verifichi questa inibizione è necessaria una coaggregazione di BCR col recettore (per esempio, un'aggregazione indipendente FcγRIIB1 non inibisce la risposta di BCR). Queste osservazioni spiegano come il sistema immunitario possa mettere fine alla produzione di anticorpi quando i livelli di questi ultimi hanno raggiunto concentrazioni sufficienti a neutralizzare l' antigene. Infatti, la cooperatività negativa del complesso BCRFcyRllB l offre un meccanismo per impedire che cellule B antigene-specifiche di nuova produzione partecipino alla risposta immunitaria, una volta che questa è sufficientemente matura per produrre anticorpi IgG ad alta affinità. La convalida genetica di questo concetto è venuta da studi su topi knock out per FcγRIIB1 che mostravano una produzione di anticorpi dieci volte maggiore del normale nella risposta immunitaria tardiva.
Le modalità molecolari di azione di FcγRllBl sono state analizzate per la prima volta da M.K. Bijsterbosch e G.G.B. Klaus (1985) e da HA Wilson e collaboratori (1987). l primi hanno riscontrato che la coaggre gazione di FcγRllB l bloccava prima del tempo l'idrolisi dell'inositolo mediata da BCR. In accordo con questo effetto di FcγRIIB1 sull'attività PLCγ, Wilson e collaboratori hanno dimostrato che la coaggregazione di FcγRIIB1 inibisce in modo marcato la fase fmale della risposta di mobilizzazione di Ca²+ mediata da BCR. Questi risultati hanno messo in evidenza che il segnale trasmesso da FcγRllB l si inserisce nelle vie di trasduzione del segnale mediata dal BCR in un punto, o in punti vicini al recettore.
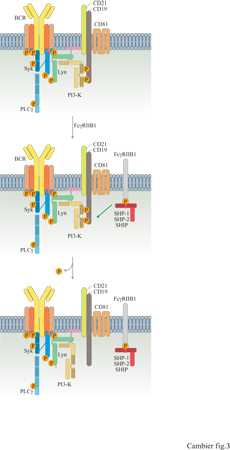
Studi recenti hanno cercato di defmire questi meccanismi in modo più preciso. È risultato che una sequenza specifica presente nella regione citoplasmatica di FcγRIIB1 è necessaria e sufficiente per esercitare la funzione inibitrice (Amigorena et al., 1992). Questa sequenza contiene un residuo tirosinico fosforilato a seguito della coaggregazione di FcγRllBl con BCR ed è essenziale per la funzione del recettore. Questo residuo tirosinico rientra nella sequenza di consenso lIVXYXXL, denominata ITlM (Immunoreceptor Tyrosine-based Inhibitory Motif, sequenza inibitrice dell'immunorecettore basata su tirosina), ed è coinvolto nella trasduzione di segnali negativi mediata da vari recettori (D'Ambrosio et al., 1995; Vivier e Daeron, 1997). Utilizzando fosfopeptidi sintetici, D. D' Ambrosio e collaboratori hanno dimostrato che la fosforilazione di questo residuo tirosinico è necessaria per il legame di tre potenziali proteine effettrici: le proteine tirosinfosfatasi SHP-l e SHP-2 e la fosfatidilinositolo 4,5-bisfosfato 5'-fosfatasi SHIP (D'Ambrosio et al., 1995; Ono et al., 1996). Quest'ultima proteina va incontro a una fosforilazione ulteriore in tirosina in seguito alla coaggregazione BCR-FcγRllBl. D'Ambrosio e collaboratori hanno inoltre dimostrato che la trasduzione di segnali inibitori da parte di FcyRllBl è deficitaria nei topi motheaten, che sono privi di SHP-l funzionale, dimostrando che SHP-l deve avere un ruolo essenziale come mediatore (D'Ambrosio et al., 1995). È degno di nota che, in alcune circostanze, SHP-l non è necessaria per la trasduzione di segnali inibitori da parte di FcγRllBl. Per esempio, l'inibizione dell'attivazione di FcγRI nei mastociti, mediata da FcγRllBl, continua normalmente nelle cellule ottenute dal midollo osseo di topi motheaten. Una conclusione inevitabile è che esistono alcuni gradi di ridondanza nella funzione effettrice di FcγRllBl. Si deve però tenere presente che non esiste alcuna prova diretta che attribuisca a SHP-2 o SHP-3 un ruolo nella trasduzione del segnale inibitorio. Sulla base dei primi risultati che coinvolgevano le PTK, P.A. Kiener e collaboratori (1997) e K.L. Hippen e collaboratori (1997) hanno analizzato gli effetti della coaggregazione di FcγRllB l sulla fosforilazione dei residui tirosinici mediata da BCR. Entrambi i gruppi hanno riscontrato che la fosforilazione delle tirosine della maggior parte dei substrati non è influenzata dalla coaggregazione tra FcyRllBl e BCR, con l'eccezione del CD19. La fosforilazione in tirosina del CD19, mediata da BCR, continua normalmente per i primi secondi successivi alla coaggregazione del recettore. Tuttavia, dopo 15 secondi, quando la fosforilazione di CD19 mediata dal recettore è in genere al suo massimo, viene rapidamente ridotta di oltre 1'80%; 45 secondi dopo la stimolazione, la fosforilazione di CD19 è tornata a livelli basali, mentre rimane massima nelle cellule stimolate a opera del solo BCR. Entrambi i gruppi hanno dimostrato che la defosforilazione di CD19 si accompagnava all'inibizione del reclutamento e dell'attivazione di PI3-K.
Questi risultati, considerati insieme a quelli provenienti dagli studi sulla funzione di CD19 discussi precedentemente, suggeriscono un modello di azione per il meccanismo con cui FcγRllBl inibisce la segnalazione mediata dal BCR (fig. 3). La coaggregazione di FcγRllB l con BCR provoca un'attivazione 'normale' della trasduzione del segnale mediante BCR. Tuttavia, le tirosinchinasi attivate attraverso BCR fosforilano il FcγRllB l localizzato nella loro stessa posizione, stimolando il reclutamento di SHP-l. A sua volta, SHP-l defosforila CD19, disattivando PI3-K. Ne consegue un'inibizione precoce dell'idrolisi del fosfoinositolo e della mobilizzazione di Ca²+. Questo modello illustra un meccanismo di regolazione fine del segnale mediato da BCR che, pur bloccando le vie PI3-K e PLCy, nello stesso tempo lascia intatte e funzionali le vie delle tirosinchinasi. SHlP potrebbe funzionare da mediatore della segnalazione inibitoria mediante degradazione di Insl,3,4,5P4, un potenziale mediatore del flusso di Ca²+ verso l'interno della cellilla dopo aggregazione del BCR. Questo potrebbe spiegare l'effetto selettivo osservato della coaggregazione tra FcγRllBl e BCR sulla risposta del flusso di Ca²+ in entrata. Alternativamente, SHlP potrebbe anche agire defosforilando Ptdlns3,4,5P3 e potrebbe dunque avere un effetto sulla disattivazione di PI3-K, cioè la riduzione dei livelli di Ptdlns3,4,5P3 al di sotto di quelli normali osservati in seguito alla trasduzione del segnale mediata dal BCR. Indipendentemente da quale sia il meccanismo realmente utilizzato, la conseguenza della coaggregazione tra FcyRllBl e BCR è un cambiamento qualitativo dell'esito biologico della trasduzione del segnale mediata dal BCR, quando è coinvolto FcγRllBl. In questo contesto, è stato dimostrato che la coaggregazione di FcyRllB l con BCR indirizza la cellula verso la via dell'apoptosi.
Anche se il modello descritto è affascinante, esistono alcuni dati pertinenti a cui non si adatta. Per esempio, in una serie di studi recenti è stato dimostrato che, in certe condizioni, la coaggregazione di FcγRllBl con il BCR blocca in parte la fosforilazione di PLCγ e l'attivazione di p2lras. Inoltre, non è chiaro il modo in cui viene mediato il segnale inibitorio nei modelli di mastociti negativi per SHP-l. In questo caso, l'inibizione della trasduzione del segnale è forse mediata da SHP-2 o da SHlP, o da entrambe le proteine. L'attivazione di SHlP, stimolando la via della tiro sinchinasi Akt, dovrebbe promuovere la sopravvivenza anziché la morte. Infine, la molecola CD19 è espressa solamente dalle cellule B, mentre FcγRllBl trasduce un segnale inibitorio nei mastociti, nelle cellule T e B. Vi è dunque la possibilità che i mastociti e le cellule T contengano un analogo della proteina CD19 che integra il P13-K e che funziona da bersaglio dell'FcγRllBl.
CD22 attenua la trasduzione del segnale mediata da BCR
CD22 è una proteina della superficie cellulare, specifica per la linea B, la quale agisce come una lectina, legando certe α-2,6-sialoglicoproteine mediante un sito di riconoscimento localizzato nei due domini extracellulari simili per struttura alle immunoglobuline più distali tra i sette che la compongono. Questa molecola contiene un singolo dominio transmembrana e una porzione citoplasmatica con sei tirosine. CD22 si associa al BCR, forse riconoscendo le molecole di acido α-2,6-sialico associate con la componente 19M del recettore. Questa ipotesi deriva dall' osservazione sperimentale che la proteina CD22 lega le 19M secretorie attraverso i suoi domini lectina-simili. Questa molecola, espressa a bassi livelli sulla superficie delle cellule B immature, aumenta rapidamente quando si verifica il passaggio da cellula immatura a matura e, da questo punto in poi, rimane a livelli alti. Di recente, diversi gruppi di ricercatori hanno ottenuto topi knock out per CD22 e ne hanno analizzato il fenotipo: le cellule B si sviluppano normalmente ma quando raggiungono lo stadio maturo presentano una maggiore mobilizzazione di Ca²+, in risposta al legame antigene-recettore BCR. Queste cellule B mostrano un aumento delle risposte proliferative mediate dal BCR con dosi subottimali di anticorpi anti-recettore e sono caratterizzate da una vita stranamente breve, come si verificherebbe nel caso di un'attivazione costitutiva. Infine, i topi knock out per CD22 esprimono livelli insolitamente elevati di immunoglobuline sieriche. Tutte queste caratteristiche sono in accordo con la iperstimolabilità, indicando che CD22 è un fattore di regolazione negativa della trasduzione del segnale mediata dal BCR.
L'analisi delle funzioni di trasduzione del segnale di CD22 ha dimostrato che questo è fosforilato a livello dei residui tirosinici in seguito all'aggregazione del BCR e che si associa con molteplici effettori di trasduzione del segnale, tra cui Lyn, Syk, isoforme di PLCγ, P13-K e SHP-l. L'osservazione che le cellule B provenienti da topi knock out per CD22 e da topi knock out per SHP-l presentavano un fenotipo simile, ossia un'aumentata capacità di risposta, ha indotto a ipotizzare che il segnale inibitorio di CD22 sia mediato da SHP-l (Cyster e Goodnow, 1995). SHP-l si lega con alta affrnità a tre sequenze contenenti fosfotirosina derivate da CD22 e sembra utilizzare questa proteina come substrato. Anche se questo modello non ha proposto CD19 come substrato di SHP-l, le prove che indicano la defosforilazione di CD19 a opera di SHP-l nel modello FcγRllBl, fanno di CD19 un candidato ovvio per tale ruolo. Bisogna però notare che nelle cellule NK (Natural Killer), SHP-l attivato dal recettore inibitorio killer (KlR, Killer Inhibitory Receptor) media il suo effetto attraverso la defosforilazione delle catene ζ del TCR, di ZAP-70 e di PLCy. La specificità per il substrato può dipendere dalla vicinanza e dall'orientamento della fosfatasi e dalla struttura che le permette di indirizzarsi verso potenziali substrati.
Concludendo, il CD22 sembrerebbe agire come un recettore inibitorio mediante il reclutamento di SHP-l. Il meccanismo attraverso cui SHP-l media tale effetto è ignoto. Probabilmente, la segnalazione a opera di CD22 è importante per determinare la sensibilità delle cellule B verso l'antigene. L'aumento dell'espressione di CD22 durante la maturazione suggerisce che questo eserciti un ruolo specifico in funzione del repertorio anticorpale dell' animale. L' espressione ridotta di CD22 da parte delle cellule B immature, invece, può rendere tali cellule ipersensibili all'antigene nella fase dello sviluppo in cui il legame con l'antigene induce tolleranza. Quindi, un'espressione ridotta di CD22 può assicurare l'eliminazione dal repertorio delle cellule autoreattive, perfino di quelle che portano recettori per l'antigene a bassa affinità. Dall'altro lato, un aumento dell'espressione da parte delle cellule mature può garantire il fatto che soltanto le cellule con recettori ad alta affrnità siano attivate per partecipare alla risposta immunitaria.
Bibliografia citata
AMIGORENA, S., BONNEROT, C., DRAKE, I.R., CHOQUET, D., HUNZIKER, W., GUiLLET, I.-G., WEBSTER, P., SAUTES, C., MELLMAN, I., FRIDMAN, W.H. (1992) Cytoplasmic domain heterogeneity, functions of IgG Fc receptors in B Iymphocytes. Science, 256, 1808-1812.
BUSTERBOSCH, M.K., KLAUS, G.G.B. (1985) Crosslinking of SUfface immunoglobulin, Fc receptors on B Iymphocytes inhibits stimulation of inositol phospholipid breakdown via the antigen receptors. J. Exp. Med., 162, 1825-1836.
BROWN, M.T., COOPER, J.A. (1996) Regulation, substrates, functions of Src. Biochim. Biophys. Acta, 1287, 121-149.
BUHL, A.M., PLEIMAN, C., RICKERT, R.C., CAMBIER, J.C. (1997) CDI9 is required for B cell antigen receptor mediated activation of PI3-kinase. lmmunity (in corso di stampa).
CAMBIER, J.C. (1995) Antigen, Fc receptor signaling. The awesome power of the immunoreceptor tyrosine-based activation motif (ITAM). J. lmmunol., 155, 3281-3285.
CARTER, R.H., DOODY, G.M., BOLEN, J.B., FEARON, D.T. (1997) Membrane IgM-induced tyrosine phosphorylation ofCDI9 requires a CDI9 domain that mediates association with components of the B cell antigen receptor complex. J. lmmunol., 158, 3062-3069.
CYSTER, lG., GOODNOW, C.C. (1995) Protein tyrosine phosphatase 1C negatively regulates antigen receptor signaling in B Iymphocytes, determines thresholds for negative selection. lmmunity, 2, 13-24.
D'AMBROSIO, D., HIPPEN, K.L., MINSKOFF, S.A., MELLMAN, I., PANI, G., SIMINOVITCH, K.A., CAMBIER, I.A. (1995) Recruitment, activation of PTPIC in negative regulation of antigen receptor signaling by FcγRIIBI. Science, 268, 293-297.
DEMPSEY, P.W., ALLISON, M.E., AKKARAJU, S., GOODNOW, C.C., FEARON, D.T. (1996) C3d of complement as a molecular adjuvant: bridging iunate, acquired immunity. Science, 271, 348-350.
FEARON, D.T., CARTER, R.H. (1995) The CDI9/CR2/TAPA-I complex of B Iymphocytes: Linking natural to acquired immunity. Annu. Rev. lmmunol., 13, 127-149.
GOLD, M.R., DEFRANCO, A.L. (1994) Biochemistry of B Iymphocyte activation. Adv. lmmunol., 55, 221-295.
HIPPEN, K.L., BUHL, A.M., D'AMBROSIO, D., NAKAMuRA, K., PERSIN, C., CAMBIER, J.C. (1997) FcγRIIB1 inhibition of BCR-mediated phosphoinositide hydrolysis, Ca²+ mobilization is integrated by CD19 dephosphorylation. lmmunity, 7, 49-58.
JUSTEMENT, L.B., CAMPBELL, K.S., CHIEN, N.C., CAMBIER, J.C. (1991) Regulation of B celI antigen receptor signal transduction, phosphorylation by CD45. Science, 252, 1839-1842.
KIENER, P.A., LIOUBIN, M.N., ROHRSCHNEIDER, L.R., LEDBETTER, J.A., NADLER, S.G., DIEGEL, M.L. (1997) Co-ligation of the antigen, Fc receptors gives rise to the selective modulation of intracelIular signaling in B celIs. Regulation of the association of phosphatidylinositol 3-kinase and inositol 5'-phosphatase with the antigen receptor comp1ex. J. Biol. Chem., 272, 3838-3844.
KUROSAKI, T., JOHNSON, S.A., PAO, L.I., SADA, K., YAMAMURA, H., CAMBIER, le. (1995) Role of the syk autophosphorylation site, SH2 domains in B celI antigen receptor sigualing. J. Exp. Med., 182, 1815-1823.
KUROSAKI, T., TAKATA, M., YAMANASHI, Y., INAZU, T., TANIGUCHI, T., Y AMAMOTO, T., Y AMAMURA, H. (1994) Syk activation by the src-family tyrosine kinase in the B celI receptor signaling. J. Exp. Med., 179, 1725-1729.
MADRENAS, J., WANGE, R.L., WANG, J.L., ISAKOV, N., SAMELSON, L.E., GERMAIN, R.N. (1995) Zeta phosphorylation without ZAP-70 activation induced by TCR antagonists and partial agonists. Science, 267, 515-518.
MOAREFI, I., LEFEVRE-BERNT, M., SICHERI, F., HUSE, M., LEE, C. H., KURIYAN, J., MILLER, W.T. (1997) Activation ofthe Srcfamily tyrosine kinase Hck by SH3 domain displacement. Nature, 385, 650-653.
ONO, M., BOLL, S., TEMPST, P., RAVETCH, J.V. (1996) Role of the inositol phosphatase SHIP in negative regulation of the immune system by the receptor Fc(ganuna)RIIB. Nature, 383, 263-266.
PAO, L.l., BEDZYCK, B.W., PERSIN, C., CAMBIER, J.C. (1997a) Molecular targets of CD45 in B celI antigen receptor signal transduction. J. lmmunol., 158, 1116-1124.
PAO, L.I., CAMBIER, J.C. (1997) Syk, but not Lyn, recruitrnent to B celI antigen receptor and activation folIowing stimulation of CD45-B celIs. J. lmmunol., 158, 2663-2669.
PAO, L.I., CARBONE, A.M., CAMBIER, J.C. (1997b). Antigen receptor structure, signaling in B celIs. New York, John Wiley & Sons Ltd.
PEPYS, M.B. (1974) Role of complement in induction of antibody production in vivo. Effect of cobra factor and other C3 reactive agents on thymus-dependent and thymus-independent antibody responses. J. Exp. Med., 140, 126-145.
PHILLIPS, N.E., PARKER, D.C. (1983) Fc-dependent inhibition of mouse B celI activation by whole anti-mu antibodies. J. lmmunol., 130, 602-606.
PLEIMAN, C.M., HERTZ, W.M., CAMBIER, J.C. (1994) Activation of phosphatidylinositol-3' kinase by Src-family kinase SH3 binding to the p85 subunit. Science, 263, 1609-1612.
RAVETCH, J.V., ANDERSON, C.L. (1990) FcγR family: Proteins, transcripts and genes. Washington, American Society for Microbiology.
SCHMITZ, R., BAUMANN, G., GRAM, H. (1996) Catalytic specificity of phosphotyrosine kinases Blk, Lyn, c-Src and Syk as assessed by phage display. J Mol. Biol., 260, 664-677.
SONGYANG, Z., BLECHNER, S., HOAGL, N., HOEKSTRA, M.F., PIWNICA-WORMS, H., CANTLEY, L.C. (1994) Use of an oriented peptide library to determine the optimal substrates of protein kinases. Curr. Biol., 4, 973-982.
SONGYANG, Z. et al. (1993) SH2 domains recognize specific phosphopeptide sequences. CelI, 72, 767-778.
SONGYANG, Z. et al. (1995) Catalytic specificity ofprotein-tyrosine kinases is criticaI for selective signalling. Nature, 373, 536-539.
TEDDER, T.F., INAOKI, M., SATO, S. (1997) The CD19-CD21 complex regulates signal transduction thresholds goveruing humoral immunity and autoimmunity. lmmunity, 6, 107-118.
THOMAS, M.L. (1989) The leukocyte common antigen family. Annu. Rev. lmmunol., 7, 339-369.
TUVESON, D.A., CARTER, R.H., SOLTOFF, S.P., FEARON, D.T. (1993) CD19 of B celIs as a surrogate kinase insert region to bind phosphatidylinositol 3-kinase. Science, 260, 986-989.
VIVIER, E., DAERON, M. (1997) Immunoreceptor tyrosine-based inhibition motifs. lmmunol. Today, 18, 286-291.
WEISER, P., MULLER, R., BRAUN, R., RETH, M. (1997) Endosomal targeting by the cytoplasmic tail of membrane immunoglobulin. Science, 276, 407-409.
WILSON, H.A., GREENBLATT, D., TAYLOR, C.W., PUTNEY, J.W., TSIEN, R.Y., FINKELMAN, F.D., CHUSED, T.M. (1987) The B lymphocyte calcium response to anti-Ig is diminished by membrane immunoglobulin cross-liukage to the Fcy receptor. J. lmmunol., 138, 1712-1718.
YAMAGUCHI, H., HENDRICKSON, W.A. (1996) Structural basis for the activation of human lymphocyte kinase Lck upon tyrosine phosphorylation. Nature, 384, 484-489.
Bibliografia generale
COHEN, G.B., BALTIMORE, D. (1995) Modular binding domains in signal transduction proteins. CelI, 80, 237-248.
FRANKE, T.F., KAPLAN, D.R., CANTLEY, L.C. (1997) PI3K: downstream AKTion b10cks apoptosis. CelI, 88, 435-437.
PAWSON, T. (1995) Protein modules and signalling networks. Nature, 373, 573-579.