tumore
tumore
Neoformazione di tessuto patologico formato da cellule richiamanti le caratteristiche delle cellule normali presenti nei vari distretti dell’organismo, ma modificate in senso atipico.
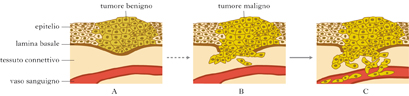
Tumori benigni e maligni
Si distinguono t. benigni e t. maligni in base alle caratteristiche morfologiche e al comportamento biologico nella assenza/presenza di aggressività verso l’organismo; più modernamente si ritiene che il processo tumorale sia un continuum, per cui nel t. benigno la trasformazione si è fermata a stadi iniziali e può comunque riprendere fino allo stadio finale di totale mancanza di differenziazione cellulare, sinonimo di elevata malignità. In molti casi di t., la differenziazione non è perduta ma è anomala, in quanto si verifica un arresto nella maturazione verso l’elemento terminale.
Il tessuto tumorale
Le differenze tra tessuto tumorale e tessuto normale consistono in alterazioni morfologiche tissutali e cellulari. Le alterazioni funzionali consistono nella diminuzione e talora nella perdita delle funzioni specializzate e nella accentuazione di funzioni più tipicamente proliferative. Le alterazioni di comportamento sono rappresentate dalla capacità delle cellule tumorali di accrescersi autonomamente rispetto all’omeostasi dell’organismo, di invadere i tessuti circostanti, di colonizzare parti distanti dell’organismo (metastasi) e infine di svolgere un’azione tossica nei confronti dell’ospite, il quale va incontro a un progressivo decadimento sino alla cachessia (deperimento organico non reversibile).
Atipie tumorali
Nel tessuto tumorale vi sono atipie tissutali e cellulari. Le prime consistono nel disordine strutturale nei rapporti tra cellule e cellule e tra cellule parenchimali ed elementi dello stroma, per cui spesso l’organo di origine non è facilmente riconoscibile: per es., molti t. sono apparentemente uguali tra loro indipendentemente dall’organo di origine (intestino o mammella o endometrio, ecc.). Le atipie a livello cellulare sono di vario grado fino ad arrivare a cellule totalmente diverse rispetto a quelle normali. Al microscopio si evidenziano: un polimorfismo nucleare, un’alterata colorabilità, soprattutto dei nuclei (ipercromasia ), e mitosi asimmetriche o pluripolari. Negli stadi estremi di alterazione cellulare si parla di anaplasia, attestante una regressione verso forme immature, che riacquistano caratteri tipici di cellule embrionali, votate alla proliferazione.
La proliferazione cellulare
Per definizione un tessuto tumorale è un tessuto proliferante in cui la percentuale di cellule in mitosi nell’unità di tempo è superiore a quella del tessuto d’origine: il t. differisce dalla proliferazione normale (riparazione di ferite cutanee, rigenerazione di parti di organo come il fegato) per il fatto che la sua crescita non raggiunge mai un equilibrio tra perdita cellulare e proliferazione: esso continua a crescere senza altri limiti che quelli imposti dalla morte dell’organismo. Da notare che il t. maligno ha proprietà neo-angiogenetiche, cioè quelle di stimolare la produzione di nuovi vasi sanguigni per far giungere ossigeno e nutrienti alle cellule tumorali neoformate. Le moderne acquisizioni genetiche relative alla progressione tumorale ( la presenza nel t. di cellule staminali tumorali) e quelle biologiche riguardanti l’espressione di un nuovo assetto antigenico e recettoriale a livello cellulare portano a riconoscere nella storia naturale di un t. un processo dinamico a più tappe, non sempre tutte espresse; le alterazioni qualitative, ad es. l’acquisizione di un fenotipo completamente trasformato, possono talora comportare una ‘esplosione’ del t. in tempi assai rapidi, oppure il t. può convivere con l’organismo ospite per lungo tempo, senza compromettere se non in parte la funzionalità degli organi.
Meccanismi della trasformazione neoplastica
Il processo di trasformazione neoplastica avviene attraverso l’accumulo successivo di mutazioni a carico dei geni che governano la proliferazione cellulare e la morte cellulare programmata (apoptosi). Le alterazioni che portano alla trasformazione maligna possono essere raggruppate secondo alcune caratteristiche essenziali: la capacità di proliferare indipendentemente dalla presenza di fattori di crescita (attivazione di oncogeni); l’insensibilità ai segnali antiproliferativi (inattivazione degli antioncogeni); la capacità di sfuggire ai segnali apoptotici, favorenti la morte cellulare; la capacità di divisioni cellulari illimitate; la capacità di stimolare la produzione di nuovi vasi sanguigni (neoangiogenesi); la potenzialità di colonizzare sedi distanti dall’insorgenza (metastasi). L’acquisizione di queste caratteristiche, ciascuna capace di conferire alla cellula un vantaggio selettivo di crescita, procede sia attraverso tappe concatenate sia secondo sequenze cronologiche alternative, e ciò non solo nei diversi tipi di tumore, ma all’interno dello stesso tipo tumorale.
‘Inefficienza’ della trasformazione tumorale
La trasformazione neoplastica è nel complesso un processo inefficiente, in quanto contrastato da numerosi meccanismi che garantiscono il mantenimento dell’integrità del genoma: ciò vale sia per la duplicazione del DNA, con il riconoscimento del danno del DNA e l’intervento degli enzimi di riparazione, sia per quanto riguarda il controllo della distribuzione del contenuto cromosomico durante la divisione cellulare (mitosi): la perdita di questi sistemi di controllo, garantiti da molecole chiave che agiscono come sentinelle in momenti specifici del ciclo cellulare (il prototipo di queste molecole è la proteina p53), provoca instabilità genomica, condizione permissiva fondamentale per la trasformazione cellulare, in quanto favorisce l’acquisizione progressiva da parte delle cellule preneoplastiche di nuove mutazioni.
Gli oncogeni come marcatori genetici di trasformazione
Il processo di divisione cellulare dipende da una serie di eventi rigorosamente controllati. Questi derivano da un appropriato livello di trascrizione e traduzione di particolari geni. Fra i circa 30.000 geni che costituiscono il genoma umano esiste un piccolo sottoinsieme di geni che giocano un ruolo molto importante nella prevenzione, sviluppo ed evoluzione dei sistemi tumorali. I geni sinora identificati sono stati suddivisi in due grandi categorie, in funzione delle loro normali funzioni nelle cellule sane: geni i cui prodotti proteici stimolano la divisione e la vitalità cellulare, le cui versioni normali sono dette protooncogeni, mentre quelle mutate o comunque danneggiate sono dette oncogeni; geni i cui prodotti proteici regolano direttamente o indirettamente la morte cellulare: questi geni sono detti geni soppressori tumorali (oncosoppressori) e, se subiscono mutazione o danneggiamento, perdono la loro importante funzione protettiva. Gli oncogeni possono indurre la cellula a replicarsi in modo sregolato e tale sviluppo può avvenire anche in assenza di normali segnali proliferativi, per es. quelli forniti dai fattori di crescita. Una caratteristica chiave nella attività degli oncogeni è quella per cui è sufficiente una singola copia alterata a indurre una crescita non controllata mentre per i geni soppressori tumorali è necessario che entrambe le copie del gene siano difettose per innescare un processo di divisione cellulare anomalo. Alcuni esempi di oncogeni sono: c-erb2, che codifica una molecola di membrana coinvolta nel recettore per il fattore di crescita dell’epidermide (EGF), la cui scoperta ha avuto importanti riflessi nella terapia del tumore mammario; c-mos, c-myc e c-abl, localizzati ai punti di rottura delle traslocazioni (spostamento di frammenti di genoma da un cromosoma all’altro) associate rispettivamente alla leucemia acuta mieloblastica, al linfoma di Burkitt, alla leucemia mieloide cronica; bcl-2, associato a una proteina della membrana mitocondriale coinvolta nel blocco dell’apoptosi, causa frequente dei linfomi a cellule B.
Meccanismi molecolari della trasformazione neoplastica
A geni mutati corrispondono proteine mutate, che non sempre perdono del tutto le loro specifiche funzioni, ma non risultano più sensibili ai sistemi di regolazione che controllano la forma normale della proteina stessa. Le proteine codificate dagli oncogeni si raggruppano in varie famiglie:
• proteine ad attività tirosinchinasica, che trasferiscono una molecola di fosfato dall’ATP, la molecola chiave nel metabolismo energetico della cellula, alla tirosina: la fosforilazione della tirosina è stata osservata nella risposta cellulare ai fattori di crescita quali l’EGF e il PDGF (fattore di crescita di derivazione piastrinica);
• proteine correlate con fattori di crescita: ad es., la proteina codificata dall’oncogene c-sis, strettamente coinvolto in alcuni sarcomi, è assai simile al PDGF;
• proteine che legano il GTP, un nucleoside che si trova nell’RNA: per es., la proteina p21 codificata da k-ras; nelle cellule normali le proteine capaci di legare il GTP funzionano come fattori di accoppiamento nei sistemi che trasferiscono all’interno della cellula segnali mediati da ormoni; la p21 codificata dall’oncogene mutato si fosforila in maniera irreversibile e trasmette un segnale continuo anziché un segnale regolato;
• proteine a sede nucleare: ad es., i prodotti dei geni c-myc, c-myb, c-fos che si legano al DNA e sono localizzati nella matrice nucleare; nel linfoma di Burkitt la traslocazione su un altro cromosoma (da 8 a 14) del c-myc comporta la sua deregolazione e un aumento della sua trascrizione.