Verso un sistema immunitario artificiale: le immunotecnologie
Verso un sistema immunitario artificiale: le immunotecnologie
Le immunotecnologie sfruttano il repertorio virtualmente illimitato fornito dagli anticorpi per costruire molecole modificate, capaci di riconoscimento chimico specifico da utilizzare nei contesti più differenti. Lo sfruttamento di questo repertorio è stato facilitato dallo sviluppo delle 'librerie' di anticorpi esposti sulla superficie di fagi, che ha portato alla costruzione di sistemi immunitari artificiali. Tali sistemi sono ispirati ai principi di funzionamento fondamentali del sistema immunitario come la diversità, la selezione e l'amplificazione. In questo saggio si descrivono gli sviluppi dei sistemi immunitari in vitro, nonché la utilizzazione degli anticorpi ricombinanti come proteine ad attività terapeutica, diagnostica catalitica o nel campo dei biosensori. Gli anticorpi ricombinanti sono anche utilizzati come geni ectopicamente espressi per conferire un fenotipo di interesse in vari sistemi biologici con potenzialità che spaziano dalla biotecno/ogia vegetale alla genomica funzionale e alla terapia genica.
" ... L'universo (che altri chiama la Biblioteca) si compone d'un numero indefinito, e forse infinito, di gallerie esagonali, con vasti pozzi di ventilazione nel mezzo, bordati di basse ringhiere ... a ciascuna parete di ciascun esagono corrispondono cinque scaffali; ciascuno scaffale contiene trentadue libri di formato uniforme; ciascun libro è di quattrocentodieci pagine; ciascuna pagina, di quaranta righe; ciascuna riga, di quaranta lettere di color nero ... ".
Jorge Luis Borges, leggendo La Biblioteca di Babele
Tra le proprietà più straordinarie del sistema immunitario vi è quella di generare un repertorio virtualmente illimitato di molecole anticorpali capaci di riconoscere un universo chimico molto vasto, costituito da epitopi naturali o artificiali. La base chimica della specificità biologica della risposta immunitaria risale agli studi pionieristici di P. Ehrlich agli inizi del 20° secolo, prima di arrivare ai fondamentali lavori di K. Landsteiner negli anni Trenta. Gli anticorpi sono dotati di una struttura di base in cui il dominio di riconoscimento e specificità (regioni variabili) è indipendente e separato dai domini coinvolti in altre interazioni e in funzioni effettrici (domini costanti). La diversità del sistema immunitario è il risultato di riarrangiamenti combinatoriali di un ristretto numero di moduli, che dà luogo al cosiddetto repertorio primario di anticorpi espressi in membrana, sulla superficie dei linfociti B corrispondenti. L'associazione tra anticorpo e cellula è fondamentale per il processo di selezione e maturazione somatica innescato dal legame con l'antigene. L'affinità del riconoscimento primario non è necessariamente elevata, tuttavia è sufficiente a innescare i processi di selezione delle cellule portatrici di quella specificità e quelli di ipermutazione somatica. Il processo di mutazione somatica contribuisce ad aumentare la potenziale diversità del repertorio anticorpale e porta alla cosiddetta maturazione di affinità degli anticorpi.
Gli ingredienti principali della risposta anticorpale sono costituiti da meccanismi tipicamente darwiniani, come la generazione di una elevata diversità sia germinale che somatica, la selezione e l'amplificazione dei doni appropriati mediata da meccanismi di sopravvivenza dipendenti dall'antigene e infine l'ereditabilità, legata al fatto che gli anticorpi vengono selezionati insieme ai geni riarrangiati che li codificano.
Le immunotecnologie costituiscono l'insieme delle tecnologie che utilizzano le proprietà di universalità e specificità del riconoscimento chimico da parte delle regioni variabili, accoppiate a uno spettro di funzioni effettrici più ampio di quello presente nel sistema immunitario, e che sfruttano molti principi di funzionamento del sistema immunitario stesso. Tutti i campi in cui è necessaria o conveniente una qualche forma di riconoscimento chimico specifico costituiscono potenziali aree di applicazione delle immunotecnologie.
Dagli anticorpi monoclonali alle librerie fagiche
Per molti anni gli anticorpi sono stati utilizzati come misture di proteine anticorpali, in grado di riconoscere parti diverse di un medesimo antigene, che non erano facilmente separabili tra di loro. Solo avendo a disposizione un antigene puro si poteva isolare, per affrnità, quella popolazione di proteine anticorpali denominata policlonale, in quanto risultato della secrezione di molti cloni linfocitari differenti. Le immunotecnologie contemporanee nascono con la descrizione del metodo degli anticorpi monoclonali (Koehler e Milstein, 1975), che permette di isolare linee cellulari che secernono una singola specie anticorpale di specificità predeterminata, anche a partire da misture complesse di antigeni. La tecnologia degli ibrido mi ha avuto un enorme successo e ha inoltre permesso di isolare una vasta gamma di anticorpi monoclonali, utilizzati oggi in moltissimi campi differenti, come per esempio quello diagnostico, terapeutico e biotecnologico. La tecnologia del DNA ricombinante, unitamente a tecniche di trasferimento genico, ha reso possibile utilizzare gli anticorpi monoclonali per un ulteriore sviluppo significativo delle immunotecnologie. Infatti, dalle linee di ibridomi si possono isolare anche i geni riarrangiati che codificano l'anticorpo monoclonale prodotto, permettendo in questo modo la costruzione di reagenti anticorpali, modificati su misura, in forme limitate solo dalla fantasia (Winter e Milstein, 1991).
Ingegneria degli anticorpi
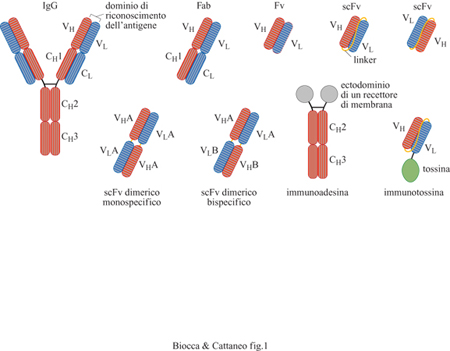
L'organizzazione strutturale degli anticorpi in domini funzionali separati e indipendenti tra loro li rende particolarmente accessibili alle modifiche realizzabili mediante l'ingegneria proteica. In particolare, i domini funzionali che legano l'antigene, se separati dai domini che mediano le funzioni effettrici, possono essere combinati artificialmente in vario modo tra loro o fusi a domini proteici eterologhi di varia natura, per formare nuove molecole con proprietà di riconoscimento accoppiate a funzioni effettrici nuove (Neuberger et al., 1984). L'ingegneria degli anticorpi, in generale, fornisce nuove molecole adattatrici che associano a un evento di riconoscimento una proprietà effettrice di interesse. Queste possono includere nuove regioni costanti, attività enzimatiche, tossine e peptidi. È anche possibile l'inverso, ovvero unire frammenti Fc a domini di riconoscimento non anticorpali, provenienti per esempio da recettori di membrana, come nel caso delle immunoadesine. In un anticorpo 'classico' la funzione di riconoscimento è distribuita nei segmenti ipervariabili (CDR, Complementarity-Determining Regions, regioni che determinano la complementarità) delle regioni variabili pesante (VH) e leggera (VL). Le due regioni variabili VH e VL si possono associare tra loro in modo non covalente anche in assenza delle regioni costanti per formare i cosiddetti frammenti Fv (v. figura 1). Tale associazione può essere stabilizzata dall'introduzione di un peptide di collegamento che unisce i domini VH e VL in una singola catena polipeptidica per formare i cosiddetti frammenti a singola catena scFv (Bird et al.,1988). Tali frammenti presentano vantaggi, legati alla stabilità, alle dimensioni ridotte, alla semplicità di espressione e alla versatilità per la costruzione di proteine chimeriche. Per questi motivi, i frammenti scFv rappresentano tutt'oggi il formato di base per molte applicazioni e in particolare per l'espressione sulla superficie di fagi filamentosi. Questo formato si presta anche per costruire unità di riconoscimento bivalenti o bispecifiche (fig. 1). Se il peptide di collegamento tra le due regioni variabili è più corto, i due domini anticorpali non si associano in modo intramolecolare, mentre riescono ad associarsi con il dominio complementare di un'altra molecola, formando così un dimero bivalente monospecifico detto scFv dimerico (Holliger et al., 1993). Un dimero bispecifico contro due antigeni, A e B, si può invece ottenere dalla dimerizzazione di due scFv dimerici differenti in uno dei seguenti formati: VHA-VLB/NHB-VLA, o VLA-VHB/NLB-VHA. Anticorpi bivalenti o bispecifici, o entrambi, cioè minianticorpi, possono anche essere costruiti utilizzando domini di dimerizzazione, come per esempio cerniere di leucina o domini CH3. Ancora, anticorpi bispecifici diretti contro epitopi adiacenti di una stessa proteina possono essere prodotti unendo due scFv con un opportuno peptide di collegamento. In tal modo si ottengono anticorpi ricombinanti chelanti, cioè anticorpi con affinità maggiore di quella di ciascuno dei due singolarmente, per un effetto di 'avidità'.
In alcuni casi, singoli domini VH mantengono la proprietà di riconoscimento dell'antigene. Questa proprietà rappresenta, tuttavia, l'eccezione e non la regola; tali domini, inoltre, espongono al solvente una superficie idrofobica che normalmente fa parte dell'interfaccia con il dominio VL, causa di potenziali interazioni non specifiche. In alcune specie animali invece, come nel cammello e nel lama, esiste una forma anticorpale funzionale, naturalmente espressa e secreta come catena pesante isolata, di natura meno idrofobica. Domini VH di questo tipo costituiscono una sorgente potenzialmente versatile di domini di riconoscimento più piccoli (Davies e Riechmann, 1995). Ulteriori possibilità di miniaturizzazione sono offerte dalla utilizzazione di peptidi derivati da CDR, che costituiscono un punto di partenza per la sintesi di molecole mimetiche. Le sei CDR di un anticorpo possono essere trapiantate molecolarmente da un anticorpo 'donatore' a un anticorpo 'accettore', trasferendo con sé la specificità di riconoscimento dell' anticorpo di partenza (Jones et al., 1986). Questa procedura, detta trapianto di CDR, permette di trasferire la specificità antigenica di un anticorpo monoclonale di origine murina nel contesto di un'impalcatura anticorpale più adatta alla particolare applicazione di interesse.
Librerie di anticorpi
" ... Questo pensatore osservò che tutti i libri, per diversi che fossero, constavano di elementi eguali: lo spazio, il punto, la virgola, le ventidue lettere dell'alfabeto. Stabilì, inoltre, un fatto che tutti i viaggiatori hanno confermato: non vi sono, nella vasta Biblioteca, due soli libri identici. Da queste premesse incontrovertibili dedusse che la Biblioteca è totale, che i suoi scaffali registrano tutte le possibili combinazioni dei venticinque simboli ortografici (numero, anche se vastissimo, non infinito) cioè tutto ciò ch'è dato di esprimere, in tutte le lingue. Tutto: la storia minuziosa dell'avvenire, le autobiografie degli arcangeli, il catalogo fedele della Biblioteca, migliaia e migliaia di cataloghi falsi, la dimostrazione della falsità di questi cataloghi, la dimostrazione della falsità del catalogo autentico ... ".
Jorge Luis Borges, leggendo La Biblioteca di Babele
Nell'ingegneria anticorpale classica, il materiale di partenza per il clonaggio di anticorpi è costituito da linee di ibridoma a specificità antigenica nota. Con l'avvento della reazione a catena della polimerasi (PCR, Polymerase Chain Reaction) e la sintesi di oligonucleotidi universali è stato possibile amplificare intere famiglie di geni per regioni variabili, utilizzando come sorgenti non solo linee di ibridomi, ma anche linfociti primari isolati da milze di topi immunizzati o meno (Orlandi et al., 1989). La successiva espressione di tali regioni variabili in sistemi alternativi ai mielomi (inizialmente cellule batteriche di Escherichia coli e successivamente batteriofagi filamentosi) ha permesso di esprimere una mistura di anticorpi policlonali, di cui attualmente si dispongono i geni corrispondenti, detta 'libreria' di anticorpi (questo termine, pur rappresentando una cattiva traduzione del termine library, ovvero biblioteca, verrà utilizzato in tutto il saggio perché ormai diffuso nella comunità scientifica). Si tratta di un esempio di sistema immunitario in provetta (Winter e Milstein, 1991), nel quale insieme alle specificità anticorpali derivanti dagli appaiamenti VH/VL originari, ve ne sono altre derivanti da nuove combinazioni VH/VL. Quindi la libreria ottenuta è più complessa della libreria di partenza, poiché contiene nuove combinazioni e quindi nuove specificità. L'espressione di librerie di regioni variabili ha rappresentato un aspetto fondamentale nello sviluppo delle immunotecnologie. Per sfruttare le potenzialità di una libreria di anticorpi, occorre mantenere la corrispondenza fisica tra l'anticorpo e il suo gene, come avviene nei linfociti B. Questa corrispondenza tra genotipo e fenotipo anticorpale è mantenuta nel caso in cui l' anticorpo sia espresso sulla superficie di fagi filamentosi. Tale tecnologia, inizialmente sviluppata per l'espressione di librerie di milioni di differenti proteine o peptidi (Smith, 1985), si è rivelata molto potente per l'espressione di librerie di anticorpi (McCafferty et al., 1990).
La possibilità di esprimere frammenti anticorpali sulla superficie di un virus che infetta un batterio (in generale il fago filamentoso Ft) rende possibile l'isolamento di un singolo frammento anticorpale, con una specificità di legame prefissata, da una libreria complessa contenente un vasto eccesso di frammenti non leganti. I fagi filamentosi hanno un genoma a DNA a singola elica e infettano E. coli attraverso il pilo F. Il riconoscimento del pilo F da parte della proteina fagica p3 determina l'ingresso del DNA virale nella cellula di E. coli dove viene replicato, passando per una fase a doppia elica. A differenza di altri fagi che si propagano per lisi della cellula batterica ospite, il fago filamentoso viene esportato dalla cellula mediante un processo di secrezione attiva, processo che, anziché uccidere la cellula, ne rallenta la crescita.
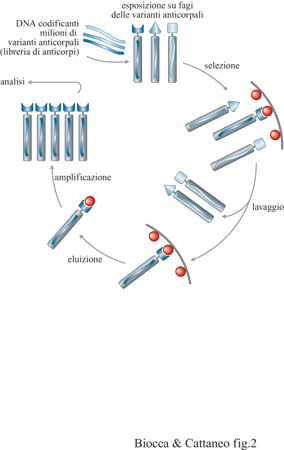
La proteina fagica maggiormente utilizzata per l' espressione di anticorpi è la p3. Questa proteina, presente in 3 ÷ 5 copie per fago, ha una struttura tripartita con tre domini funzionali; due sono importanti per la penetrazione nella cellula batterica, mentre il terzo, che occupa una porzione centrale, costituisce il dominio di riconoscimento del pilo F. I frammenti anticorpali sono fusi all'estremità amminoterminale della proteina p3. Nella fusione risultante, il dominio anticorpale è esposto all'esterno del fago senza peraltro inibirne la capacità di infettare la cellula batterica bersaglio. Nella figura (fig. 2) sono illustrati i principi della tecnologia basata sull'esposizione di anticorpi su fagi.
Il DNA che codifica milioni di domini anticorpali differenti viene inserito nel genoma di un batteriofago filamentoso, come fusione del gene per la proteina p3. La proteina di fusione, una volta espressa, è incorporata nella particella fagica matura che viene secreta da ciascuna cellula ed esposta sulla sua superficie. Si genera così una libreria di fagi in cui ciascuna particella fagica espone un dominio anticorpale differente e possiede al suo interno il corrispondente genotipo. Solo fagi che espongono un dominio anticorpale in grado di legare l'antigene selettore vengono trattenuti e utilizzati per un nuovo ciclo. In questo modo è possibile selezionare domini anticorpali diretti contro gli antigeni di interesse, da librerie che raggiungono un grado di diversità fino a 10¹⁰ ÷10¹¹.
La selezione di librerie di domini anticorpali sulla superficie di fagi, contro un dato antigene, fornisce l'equivalente di un antisiero policlonale purificato per affinità, con la proprietà aggiuntiva di essere collegato intrinsecamente ai geni corrispondenti. Dato che le immunotecnologie consistono, essenzialmente, nella manipolazione dei geni che codificano un anticorpo di interesse, si comprende come la tecnologia delle librerie di anticorpi espressi su fagi rappresenti un elemento chiave per garantire il successo e le potenzialità di tale tecnologia.
L'analogia tra una libreria di anticorpi espressi su fago e un sistema immunitario in provetta appare così molto calzante, in quanto un fago che esprime sulla superficie un anticorpo diretto contro un antigene X è concettualmente analogo a un linfocita B che esprime la forma di membrana dell'anticorpo anti X. In entrambi i casi, il sistema è tale che la reazione specifica antigene-anticorpo è seguita dalla amplificazione o dalla selezione del clone corrispondente.
Le librerie di anticorpi possono essere di varia natura e qualità, a seconda della sorgente di regioni variabili utilizzate per la loro costruzione. Da questo punto di vista, le librerie possono essere costruite da regioni variabili provenienti da donatori immunizzati o meno, oppure per sintesi. Nel primo caso, il repertorio è costruito a partire dai geni IgG clonati da milze di animali immunizzati con l'antigene (Clackson et al., 1991), come per l'isolamento di anticorpi monoclonali, o da donatori umani (Burton et al., 1991) in differenti situazioni patologiche in cui le sorgenti sono midollo osseo, tonsille o linfociti circolanti. I repertori da linfociti immunizzati risultano arricchiti in anticorpi specifici per l'antigene immunizzante, anche se la libreria combinatoria contiene, oltre alle combinazioni VH/VL presenti in origine, un gran numero di combinazioni nuove. La costruzione di librerie da pazienti è utile per l'analisi delle risposte immunitarie naturali, come per esempio in pazienti con malattie autoimmuni, infezioni virali o malattie neoplastiche. In ogni caso, queste non sono librerie universali, bensì librerie costruite ad hoc.
In analogia con il repertorio primario del sistema immunitario, si possono costruire repertori universali da cui isolare anticorpi ad alta affinità, diretti contro qualsivoglia antigene, indipendentemente dalla storia immunitaria (Marks et al., 1991). La costruzione di queste librerie universali può essere fatta a partire dal repertorio di regioni variabili IgM o IgG isolate da tessuti linfoidi di donatori non esplicitamente immunizzati. In alternativa, librerie universali possono essere costruite artificialmente utilizzando un piccolo numero di regioni variabili di base e modificandole in modo causale in una o più CDR (in genere CDR3), in modo da creare un vasto numero di strutture tridimensionali differenti. Oltre alla diversità combinatoria, in tal caso si generano anticorpi con un repertorio di CDR non limitato alle CDR che si trovano nella linea germinale dei geni delle immunoglobuline. Per queste librerie universali, la diversità rappresenta un parametro fondamentale. Infatti, la probabilità che la libreria contenga un anticorpo che riconosca un antigene qualsiasi con una affinità sufficientemente alta è strettamente legata alla dimensione o diversità della libreria. La probabilità P che un epitopo sia riconosciuto con una affinità superiore a un valore soglia p, da almeno un anticorpo, in un repertorio di N anticorpi differenti è data da: P= l-e-Np.
Da questa relazione si deduce che quanto maggiore è la diversità della libreria, tanto maggiore è la probabilità di trovare un anticorpo ad alta affrnità contro qualsivoglia antigene. Tipicamente, diversità dell'ordine di 1010 anticorpi differenti permettono l'isolamento di anticorpi con affinità comprese tra 10-⁸ e 10-¹⁰M. Allo stato attuale, anziché aumentare significativamente la diversità al di sopra dei valori già raggiunti, appare più importante migliorare la qualità delle librerie, ovvero la frazione di fagi che esprimono anticorpi funzionali, o scegliere impalcature molecolari adatte alla particolare applicazione e, successivamente, migliorare le procedure di selezione degli anticorpi stessi. Inoltre, dato che la tecnologia dei fagi permette di migliorare l'affinità di un anticorpo isolato dalla libreria stessa (v. oltre), la diversità non sembra essere il fattore limitante per ottenere anticorpi ad alta affrnità con questa tecnologia.
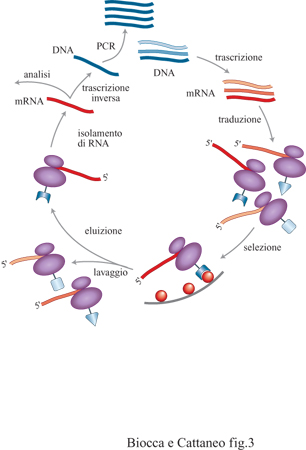
Il repertorio primario del sistema immunitario si è evoluto per non mantenere specificità anticorpali eventualmente dannose per l'organismo (tolleranza immunitaria), o tossiche per le cellule che producono gli anticorpi stessi. Queste specificità sono invece presenti nelle librerie sintetiche, che non hanno subito questo processo di selezione, e quindi non presentano il fenomeno della tolleranza. Il sistema immunitario artificiale permette di ottenere un repertorio completo di specificità anticorpali, da cui isolare anticorpi contro qualsivoglia antigene, senza l'uso di animali e quindi del sistema immunitario biologico. Riducendo ancora la complessità del sistema, ma mantenendone gli ingredienti essenziali (diversità genetica, sistema di espressione in cui genotipo e fenotipo sono fisicamente associati, amplificazione e selezione), è stato recentemente descritto un sistema di espressione di librerie anticorpali interamente in vitro con esposizione su ribosomi (fig. 3), senza l'uso di cellule viventi (Ranes e Plueckthun, 1997; Re e Taussig, 1997). La libreria di anticorpi, nella forma di libreria di molecole di mRNA, viene tradotta in vitro. L'assenza di codoni di stop, artificialmente rimossi dagli mRNA, fa sì che le catene nascenti degli anticorpi restino fisicamente associate al proprio mRNA e ai ribosomi. La selezione degli anticorpi diretti contro un antigene di interesse viene effettuata mediante cicli di adsorbimento su fase solida identici a quelli già descritti (v. figura 2), mentre l'amplificazione dell'mRNA per gli anticorpi via via arricchiti viene effettuata mediante PCR. Il sistema dell'esposizione su ribosomi si basa quindi su cicli successivi di trascrizione e traduzione in vitro, selezione e amplificazione. In teoria, con questo sistema la diversità raggiungibile non è limitata dal ciclo di vita del sistema fago-batterio, né da problemi tecnici legati all'efficienza di trasformazione. Nella pratica, queste potenzialità restano da verificare.
Metodi per selezionare gli anticorpi: trovare il libro nella biblioteca di Babele
" ... La certezza che un qualche scaffale d'un qualche esagono celava libri preziosi e che questi libri preziosi erano inaccessibili, parve quasi intollerabile ... ".
Jorge Luis Borges, leggendo La Biblioteca di Babele
La dimensione delle librerie di anticorpi espressi su fagi è tale che l'isolamento dei rari anticorpi di specificità di interesse sembrerebbe equivalente al problema di trovare un libro nella biblioteca di Babele. In realtà, la natura stessa del sistema di espressione della libreria fornisce la soluzione del problema, unendo in modo sequenziale il processo di riconoscimento con l'amplificazione delle specie riconosciute. Tutti i metodi di selezione prevedono cicli sequenziali di legame all'antigene, separazione dai fagi non specifici, eluizione e amplificazione dei fagi eluiti (v. figura 2). Quello che differenzia le diverse procedure è la presentazione dell'antigene. In particolare, oltre a essere immobilizzato su fase solida, l'antigene può essere solubile e accoppiato alla biotina, una piccola molecola che lega molto tenacemente l' avi dina. l fagi così modificati possono quindi essere facilmente recuperati mediante microsfere magnetiche ricoperte di avidina. Questo metodo permette di controllare in modo fine la concentrazione dell'antigene, e quindi si presta a procedure per la selezione di anticorpi con affinità crescente (v. oltre). Nel caso di antigeni di membrana, le librerie possono essere selezionate su cellule vive o trattate chimicamente con paraformaldeide. Come nel caso degli anticorpi monoclonali, questo permette di trovare nuovi antigeni. Nel caso frequente in cui l'antigene non sia disponibile in forma purificata, ma sia disponibile il gene corrispondente, esso può essere espresso per via ricombinante sulla superficie di cellule batteriche o di mammifero, e le cellule modificate possono essere utilizzate come selettori.
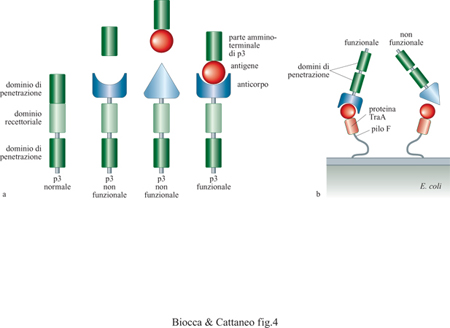
Nei metodi di selezione descritti, il riconoscimento dell'antigene e la successiva amplificazione dei fagi sono eventi separati e distinti. Recentemente sono stati descritti due nuovi metodi di selezione in cui l'evento di riconoscimento determina in modo diretto e immediato l'amplificazione dei fagi leganti (fig. 4). In una prima realizzazione (Krebber et al., 1995), la proteina p3 viene suddivisa in due parti: la parte amminoterminale è fusa all' antigene di interesse e viene espressa nello spazio periplasmico di E. coli, mentre la parte carbossiterminale è fusa a un anticorpo, o a una libreria di anticorpi, ed è espressa sul fago (v. figura 4a). l fagi che contengono la parte carbossiterminale della p3 fusa con l'anticorpo non sono infettivi, a meno che non incontrino, nello spazio periplasmico, la parte mancante di p3, ricostituendo così una proteina p3 infettiva in conseguenza dell'interazione antigene-anticorpo. Nel secondo metodo (v. figura4b), l'antigene viene esposto sulla superficie batterica fuso alla proteina TraA del pilo F, responsabile dell'infezione fagica (Malmborg et al., 1997). Questi batteri possono essere infettati esclusivamente da quei fagi che esprimono l'anticorpo diretto contro l'antigene esposto sul pilo F. In questo caso, è il processo stesso di infezione a essere mediato dalla interazione fra antigene e anticorpo.
l metodi di selezione biologica permettono, in linea di principio, di confrontare una libreria di anticorpi espressa su fago con una libreria di epitopi antigenici derivante, per esempio, dai geni espressi in un dato tessuto. Il risultato del processo di infezione selettiva produrrà un insieme di coppie antigene-anticorpo, un fatto di grande interesse per progetti di genomica funzionale.
In prospettiva, si possono realizzare metodi di selezione di anticorpi che superino la semplice interazione antigeneanticorpo in vitro, per isolare anticorpi sulla base di proprietà funzionali in differenti contesti. Tra questi, possiamo considerare metodi di selezione funzionale basati su attività enzimatiche tramite gli anticorpi catalitici o su espressione intracellulare tramite gli anticorpi intracellulari (v. oltre).
Evoluzione molecolare degli anticorpi
" ... parlano della Biblioteca febbrile, i cui casuali volumi corrono il rischio incessante di mutarsi in altri ... ".
Jorge Luis Borges, leggendo La Biblioteca di Babele
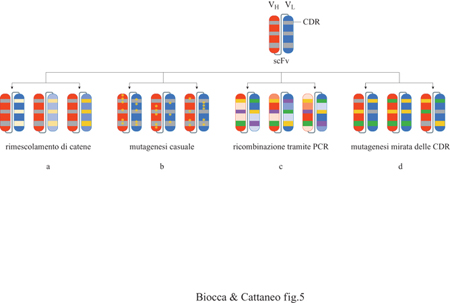
L'affinità di anticorpi selezionati da librerie fagiche è in genere sufficiente per usi generali, ma talvolta è troppo bassa per applicazioni specifiche, che richiedono idealmente affrnità nell' ordine della picomolarità. Metodi di selezione che utilizzano l' antigene in soluzione, a concentrazioni decrescenti o limitanti, con il procedere dei cicli possono essere utilizzati per isolare, tra gli anticorpi con la specificità desiderata presenti nella libreria, quelli con maggiore affinità, quelli con costante di dissociazione più lenta o entrambi. Accoppiando tali procedure di selezione a metodi per costruire varianti di un dato anticorpo, si possono isolare anticorpi con affrnità maggiore. Nel sistema immunitario, la maturazione degli anticorpi mediante mutazioni somatiche avviene per gradi, tramite piccoli incrementi di affinità che comportano un vantaggio selettivo. La maturazione della affinità comporta mutazioni che modificano residui nel sito di legame con l'antigene, ottimizzandone l'interazione, oppure creando regioni di contatto aggiuntive o eliminando residui con interazioni energeticamente sfavorevoli. L'esposizione di anticorpi su fagi offre la possibilità di migliorare l'affinità degli anticorpi mediante differenti strategie di evoluzione molecolare. Ciascun metodo richiede una sorgente di diversità, creando così una libreria secondaria basata sull'anticorpo o su un miscuglio di anticorpi diretti contro un antigene di interesse da migliorare. Tra i metodi usati con più successo a questo scopo vi sono (fig. 5): il rimescolamento di catene; la mutagenesi casuale in ceppi mutageni; la mutagenesi mediante PCR a bassa fedeltà; la PCR sessuale e il rimescolamento di DNA; la mutagenesi mirata delle CDR.
Il rimescolamento delle catene prevede che una delle due catene dell'anticorpo di partenza, per esempio VH, sia espressa in associazione con una libreria di VL. Nel secondo metodo la diversità viene creata sfruttando ceppi di E. coli altamente mutageni, in cui i fagi, che esprimono l'anticorpo da migliorare, vengono propagati. Le mutazioni sono casuali, generando così un insieme di varianti dell' anticorpo di partenza che debbono poi essere selezionate e analizzate nelle loro proprietà di legame specifico e di affrnità. Un'alternativa all'impiego di ceppi mutageni consiste nell'uso di protocolli di PCR con cui amplificare le regioni variabili in condizioni di bassa fedeltà e di assenza di attività di correzione degli errori. Rispetto al metodo precedente, in cui le mutazioni vengono inserite in tutto il plasmide, questo metodo limita le mutazioni alle sole regioni variabili che vengono amplificate.
Nei metodi precedenti le mutazioni sono strettamente gerarchiche, ovvero, mutazioni prodotte in molecole separate non si combinano tra di loro, a meno che, evento molto raro, non si presentino nuovamente in modo indipendente. Il metodo della PCR sessuale, o del rimescolamento di frammenti di DNA in vitro, permette di riunire in una singola molecola mutazioni avvenute indipendentemente in molecole differenti, dando luogo così a molecole radicalmente diverse rispetto alla popolazione di partenza.
In generale, tutti i metodi menzionati permettono di arrivare ad anticorpi con affinità nanomolare, partendo da un generico anticorpo isolato dalla grande libreria. Per migliorare ulteriormente l'affinità di questi anticorpi, l' introduzione di mutazioni dirette alle CDR ha dimostrato di essere il metodo più efficiente, permettendo di migliorare l'affinità degli anticorpi di partenza di altri 3 o 4 ordini di grandezza. In questo caso, vengono generate più librerie in parallelo e indipendenti, in ciascuna delle quali viene determinata la mutagenesi di una singola CDR. Successivamente, gruppi di mutazioni ottimali nelle varie CDR vengono combinati in modo mirato e l' additività delle mutazioni combinate viene verificata con nuove selezioni in un processo iterativo, che riunisce elementi di strategie parallele e gerarchiche.
La maturazione della affinità degli anticorpi isolati da librerie fagiche mostra come, in analogia con il sistema immunitario, il problema non sia tanto la generazione della diversità quanto la continua selezione di varianti migliori contro un numero sempre maggiore di mutazioni irrilevanti. La selezione di anticorpi con migliore affrnità per un dato antigene è solo un esempio di una strategia più generale, resa possibile dalla tecnologia delle librerie di anticorpi espressi su fagi. In generale, si possono concepire schemi di evoluzione molecolare con cui selezionare anticorpi ottimizzati per altre proprietà, quali per esempio la stabilità, la resistenza alla proteolisi o la tolleranza all'assenza di ponti disolfuro.
Espressione di anticorpi in ambienti artificiali
Tutte le applicazioni degli anticorpi ricombinanti coinvolgono la loro espressione in ambienti differenti dal contesto della cellula linfoide. Per questo motivo, la progettazione delle differenti applicazioni è connessa intimamente con un miglioramento della nostra comprensione scientifica dei fattori che regolano la biosintesi degli anticorpi in condizioni artificiali. A seconda della particolare applicazione, sono utilizzati sistemi cellulari differenti per l'espressione e la purificazione degli anticorpi ricombinanti. Nel caso di molecole di immunoglobuline complete, si preferiscono cellule di mammifero o, per alcune applicazioni, anche piante transgeniche. Nel caso, invece, di domini anticorpali più semplici, quali i frammenti scFv, le cellule procariotiche, come per esempio E. coli, restano il sistema di elezione.
Espressione in cellule di mammifero linfoidi e non linfoidi
La biosintesi degli anticorpi, nelle cellule linfoidi, è un processo complesso che coinvolge molti eventi regolativi a vari livelli: trascrizionale, traduzionale e postraduzionale. In particolare, la corretta glicosilazione rappresenta un aspetto molto importante per gli anticorpi di uso terapeutico o diagnostico in vivo, poiché ne influenza la vita media in circolo e la immunogenicità. Molti di questi eventi regolatori sono specifici per le cellule linfoidi, mentre altri sono in comune con cellule di mammifero di altra natura e sono parte di un sistema più generale di controllo della qualità delle proteine espresse nella via secretoria. L'efficienza di secrezione degli anticorpi ricombinanti in linee cellulari differenti è molto variabile; essa è alta non solo in mielomi, ma anche in cellule secretorie di altra natura, come per esempio quelle del sistema nervoso. In generale, nella via secretoria di cellule di mammifero di varia origine, gli anticorpi si esprimono senza particolari problemi.
Espressione in cellule procariotiche
Per l'espressione di domini anticorpali si utilizzano sistemi batterici, non solo per la produzione, ma anche per la selezione di nuove varianti, l'ingegneria di nuove proteine chimeriche e la costruzione di librerie fagiche di anticorpi. L' espressione in E. coli fornisce inoltre importanti informazioni sul ripiegamento degli anticorpi in condizioni artificiali.
Lo spazio periplasmico di E. coli, per molti aspetti, corrisponde all'apparato secretorio delle cellule eucariotiche e per questo motivo è il compartimento cellulare più frequentemente utilizzato per esprimere domini anticorpali. Infatti, nello spazio periplasmico si trovano molte proteine che assistono il ripiegamento (chaperonine), e in particolare proteine che catalizzano la formazione di ponti disolfuro. Tuttavia, il ripiegamento dei frammenti anticorpali nel periplasma non procede in modo quantitativo ma, per molti anticorpi, una parte consistente di molecole tende ad aggregare, fenomeno che dipende in maniera cruciale dalla sequenza primaria delle regioni variabili. Questo è ancora più vero quando tali domini sono espressi in contesti cellulari differenti, quali il citoplasma (v. oltre).
L'aggregazione delle proteine durante la loro biosintesi è, comunque, un fenomeno naturale e costituisce una via collaterale nel processo di ripiegamento, che limita anche la resa di proteine native. Lo studio di strategie in grado di prevenire l'aggregazione, per l'espressione di anticorpi nei vari sistemi e compartimenti cellulari è quindi un obiettivo tecnologico di fondamentale importanza. l risultati di un gran numero di studi sulle proprietà bio fisiche del ripiegamento di domini anticorpali in condizioni artificiali hanno mostrato che le proprietà di solubilità, di vita media e di stabilità di un anticorpo possono essere notevolmente migliorate dall'introduzione di mutazioni puntiformi, generalmente localizzate nelle impalcature delle regioni variabili. Questo ha permesso di concludere che esistono impalcature anticorpali, più adatte di altre all'espressione in differenti contesti artificiali, che possono essere utilizzate come strutture base su cui impiantare le CDR di anticorpi di interesse o anche librerie di CDR (Jung e Plueckthun, 1997).
Anticorpi catalitici
Gli anticorpi possono essere utilizzati come enzimi. La specificità di legame degli anticorpi per i loro ligandi può essere superiore a quella degli enzimi per i loro substrati. In realtà, come L. Pauling osservò alla fine degli anni Quaranta, gli enzimi legano con maggiore selettività gli stati di transizione di una reazione chimica, rispetto al substrato o al prodotto; viceversa gli anticorpi legano in genere molecole nello stato fondamentale. Nel 1969 W. Jencks suggerì che gli anticorpi potessero essere prodotti artificialmente e usati per stabilizzare selettivamente lo stato di transizione di una reazione. Solo con l'avvento degli anticorpi monoclonali, la potenzialità del sistema immunitario come sorgente di anticorpi con attività catalitica fu sfruttata, nel 1986, dai gruppi di P.G. Schulz e R.A. Lerner (Lerner et al., 1991). Il loro approccio si basava sulla progettazione di apteni analoghi a stati di transizione di una reazione di interesse, per la produzione di anticorpi diretti contro lo stato di transizione della reazione. Gli anticorpi così isolati, detti anticorpi catalitici o abzimi, funzionano da enzimi per il substrato della reazione. Le prime dimostrazioni sperimentali di questo approccio sono venute da reazioni di trasferimento di gruppi acilici e di formazione o rottura di legami carboniocarbonio. Da allora, sono stati ottenuti molti altri anticorpi catalitici, capaci di accelerare le reazioni 10³ ÷ 10⁶ volte rispetto alle reazioni non catalizzate. Gli anticorpi catalitici seguono una cinetica di Michaelis-Menten, mostrano specificità di substrato e legano gli analoghi dello stato di transizione con affinità molto maggiore di quanto avviene per il substrato.
L'esame dei valori termodinamici, che guidano i processi di legame e di catalisi, conferma che le interazioni di legame sono fortemente differenti tra anticorpi ed enzimi: in generale, il legame antigene-anticorpo è determinato da una variazione di entalpia, mentre l'interazione enzima-substrato da una variazione favorevole di entropia. Il forte contributo entalpico al legame antigene-anticorpo dimostra che la tasca dell'anticorpo è relativamente rigida. Nei casi studiati, appare che anche per gli anticorpi catalitici vi sia una predominanza di contributo entalpico. Tuttavia, la grande importanza degli effetti entropici sulla catalisi enzimatica si è dimostrata vera anche per alcuni anticorpi catalitici.
La grande varietà di anticorpi catalitici isolati include quelli capaci di catalizzare reazioni per cui non esisteva ancora alcun esempio documentato di catalisi enzimatica. In tutti i casi il punto di partenza è una buona conoscenza del meccanismo della reazione e dello stato di transizione coinvolti, seguito dalla sintesi o dalla scelta di analoghi dello stato di transizione sufficientemente stabili per indurre una risposta immunitaria. Sebbene, in generale, il meccanismo degli anticorpi catalitici coinvolga la stabilizzazione dello stato di transizione, in alcuni casi sono stati isolati anticorpi con meccanismi di reazione differenti, mostrando che la diversità del sistema immunitario può fornire proprietà catalitiche utili non previste a priori. Schemi sperimentali differenti per selezionare direttamente la funzione catalitica sono stati recentemente messi a punto (Smithrud e Benkovic, 1997), tra cui un esempio significativo è costituito dalla cosiddetta immunizzazione reattiva. Mentre nella usuale procedura di immunizzazione si ha cura che l'antigene sia inerte, nel processo di immunizzazione reattiva si utilizza un antigene reattivo, tale che un legame chimico opportuno si formi nel sito di combinazione dell'anticorpo, nel corso del riconoscimento antigene-anticorpo sulla superficie del linfocita. Sono state descritte altre strategie per l'isolamento di anticorpi con meccanismi catalitici differenti. In particolare, sono stati isolati anticorpi con gruppi funzionali specifici posizionati in modo da ottenere una catalisi acidobase efficiente. L'importanza dei cofattori in diverse reazioni enzimatiche ha stimolato molti tentativi di incorporare cofattori nei siti di combinazione degli anticorpi, riuscendo a espandere il campo di attività degli anticorpi catalitici.
L'utilizzazione delle librerie di anticorpi espressi sulla superficie di fagi permette di estendere il principio della selezione sulla base della efficienza catalitica. Un metodo recentemente descritto permette la selezione diretta di anticorpi agendo sulla loro capacità di idrolizzare un legame chimico. Una libreria fagica, arricchita in anticorpi diretti contro lo stato di transizione della reazione, viene sottoposta a cicli di adsorbimento su fase solida, utilizzando un substrato multifunzionale che, se riconosciuto e trasformato in prodotto da un anticorpo catalitico, determina una interazione covalente tra quel particolare fago e la fase solida. Così quegli elementi della libreria, che catalizzano la reazione richiesta, vengono intrappolati, selezionati e recuperati in modo opportuno. Schemi di selezione di anticorpi da librerie fagiche, sulla base della attività catalitica, permetteranno di ottenere, con metodi di evoluzione molecolare simili a quelli messi a punto per migliorare l'affrnità, anticorpi con proprietà catalitiche più efficienti.
Applicazioni degli anticorpi
Gli sviluppi delle immunotecnologie descritti hanno creato un campo di ricerca nuovo e in continua evoluzione per la produzione di anticorpi con molteplici scopi più propriamente applicativi.
Anticorpi terapeutici e diagnostici in vivo
Dopo una fase di grande speranza, circa le potenzialità terapeutiche degli anticorpi, in seguito alla scoperta degli anticorpi monoclonali, i risultati delle prime sperimentazioni hanno mostrato con chiarezza i principali problemi associati alle immunoterapie e all'immunodiagnostica in vivo. Tra questi, menzioniamo la immunogenicità delle molecole ricombinanti, la specificità degli antigeni bersaglio e la accessibilità fisica delle cellule da raggiungere. La comprensione e l'individuazione di questi problemi, insieme alla possibilità di generare nuove forme anticorpali e nuove strategie per superare tali ostacoli, hanno portato a un rinnovato ma cauto ottimismo (Scott e Welt, 1997).
Anticorpi umani e umanizzati. - L'utilità clinica degli anticorpi monoclonali di origine murina è limitata dalla loro immunogenicità. Un metodo largamente usato per evitare questo problema è la 'umanizzazione' degli anticorpi (Riechmann et al., 1988). Generalmente questa si ottiene trapiantando le CDR degli anticorpi murini in regioni variabili di origine umana. In molti casi il trapianto delle sole CDR non è sufficiente per ripristinare il legame con l'antigene ed è necessario ricostituire parte dell'impalcatura originale. Sono più di un centinaio gli anticorpi murini resi 'umani' con il trapianto delle CDR, alcune decine dei quali sono in corso di valutazione clinica, con alcuni significativi successi terapeutici.
La produzione di anticorpi monoclonali umani ab initio. rappresenterebbe la soluzione migliore, tuttavia l'impossibilità di immunizzare l'uomo e la mancanza di procedure generali di immunizzazione dei linfociti in vitro rendono questo traguardo non praticabile. Una via alternativa di notevole interesse è rappresentata dalla possibilità di produrre anticorpi umani in topi (Brueggemann e Neuberger, 1996), utilizzando una combinazione di tecnologie transgeniche e cromosomi artificiali di lievito, contenenti una vasta regione (maggiore di 10³ kb) del locus dei geni non riarrangiati delle immunoglobuline umane. Una linea di topi transgenici, contenente questo minicromosoma, viene incrociata con topi nei quali i loci IgH e Igk endogeni sono stati resi silenti, dal punto di vista trascrizionale, mediante ricombinazione omologa. Questa tecnica ha permesso l'isolamento di linee di topi in cui la produzione di repertori di anticorpi umani avviene con buona efficienza con le classiche procedure per la produzione di anticorpi monoclonali, senza interferenze da parte di Ig murine.
Nonostante i successi, queste procedure sono ancora laboriose e la tecnologia di elezione per l'isolamento di anticorpi umani è oggi rappresentata dalle librerie di anticorpi umani esposti su fagi filamentosi. Anticorpi umani isolati da librerie fagiche sono già in corso di sperimentazione clinica, sia nella prospettiva terapeutica che diagnostica in vivo.
Gli anticorpi umani sono in genere selezionati dalle librerie, nella forma di frammenti scFv o Fab, e possono essere ulteriormente migliorati nelle loro proprietà che riguardano l'affinità, la specificità o la forma di espressione. La forma di espressione può essere adattata per la particolare indicazione terapeutica o di visualizzazione, ottimizzando le proprietà farmaco cinetiche e farmacodinamiche oppure inserendo nuove proprietà effettrici (Carter e Merchant, 1997). In particolare, tra le proprietà effettrici di interesse per usi terapeutici vi sono la fusione con molecole tossiche o con enzimi in grado di attivare forme inattive di un farmaco, oppure funzioni effettrici immunitarie in senso stretto o funzioni di legame bispecifico per il reclutamento di cellule o molecole. Per ciò che concerne le applicazioni nel campo della visualizzazione di cellule o tessuti in vivo, come per esempio i tumori, le funzioni effettrici includono sequenze peptidiche chelanti per il legame con l'isotopo 99 del tecnezio (il radionuclide di elezione per la visualizzazione in vivo), sequenze di fosforilazione da parte di chinasi specifiche o, più in generale, domini leganti molecole fotoattive. Immunotossine e immunoconiugati. - Le immunotossine sono forme anticorpali potenzialmente utili nella terapia dei tumori, che riecheggiano l'originale concetto di 'proiettile magico'. Si tratta di molecole chimeriche composte da un dominio anticorpale legante associato covalentemente a una tossina (Ghetie e Vitetta, 1994). In questo caso si sfrutta la specificità di riconoscimento degli anticorpi verso particolari antigeni di membrana per associarli a un'azione tossica selettiva sulle cellule bersaglio riconosciute dall'anticorpo. In genere, si usano le subunità tossiche di molecole proteiche quali la ricina, la tossina difterica o la esotossina prodotta da Pseudomonas. l primi risultati sperimentali in vivo hanno sottolineato problemi di immunogenicità e di tossicità aspecifica. Per ridurre la immunogenicità della componente anticorpale sono stati utilizzati frammenti scFv derivati da librerie umane, mentre altre forme di tossine proteiche, come le nucleasi umane, o non proteiche si sono rivelate meno immunogeniche.
Un'applicazione particolarmente promettente, per risolvere la mancanza di antigeni realmente specifici di un tumore, è quella di indirizzare le immunotossine verso le cellule endoteliali dei vasi che irrorano il tumore (antigeni di neovascolatura). Questo approccio presenta due vantaggi importanti: le cellule dei vasi sono più facilmente accessibili alle immunotossine e, inoltre, un danno vascolare controllato si riflette in una morte generalizzata di molte cellule tumorali non più rifornite di nutrienti fondamentali per la loro sopravvivenza e proliferazione (Huang et al., 1997). Immunoliposomi. - l liposomi sono vescicole lipidiche potenzialmente utili in terapia come veicoli di trasporto di farmaci, molecole tossiche o DNA. Nella pratica clinica si è visto che i liposomi sono instabili e vengono rapidamente espulsi dal circolo sanguigno. Se opportunamente coniugati a una molecola anticorpale possono essere stabilizzati e indirizzati verso tessuti specifici, come nel caso degli anticorpi diretti contro il recettore della transferrina che permettono il passaggio selettivo di immunoconiugati attraverso la barriera ematoencefalica.
Anticorpi bispecifici. - Sono molecole (v. figura 1) molto promettenti per essere utilizzate sia in diagnostica che in terapia. Infatti, la bispecificità permette di ampliare lo spettro delle strategie sperimentali, sfruttando una delle due specificità per il reclutamento di nuove funzioni effettrici o per fare da ponte tra cellule differenti. Anticorpi bispecifici sono utilizzati con successo per formare un ponte molecolare tra cellule citotossiche T e cellule tumorali di varia origine con lo scopo di indurre una risposta citotossica cellulo-mediata. La piccola dimensione di queste molecole ne facilita la penetrazione nei tessuti e il loro potenziale immunogenico appare limitato. Molecole bispecifiche che riconoscono, da un lato, un recettore specifico per un tipo cellulare e, dall'altro, un opportuno antigene virale (per esempio, la proteina del capside degli adenovirus) sono state utilizzate con successo per indirizzare specificamente l'infezione virale su una cellula bersaglio; è questo un risultato di notevole potenzialità nella prospettiva dell'uso di vettori virali per la terapia genica.
Anticorpi intracellulari
L'espressione ectopica di anticorpi (Cattaneo e Biocca, 1998) in cellule, tessuti o compartimenti intracellulari differenti rappresenta un nuovo tipo di approccio in cui l'anticorpo è fornito al sistema di interesse come gene, anziché come proteina, aumentando enormemente l'universo degli antigeni modulabili (immunizzazione inter- o intracellulare). Gli anticorpi sono normalmente molecole secrete dalle cellule linfoidi. La dimostrazione che anche cellule non linfoidi possono efficientemente sintetizzare e secernere anticorpi (Cattaneo e Neuberger, 1987) ha aperto un nuovo campo di indagine che si basa fondamentalmente sulla espressione ectopica di anticorpi per interferire specificamente con le funzioni delle proteine extracellulari in sistemi altrimenti poco attaccabili quali il sistema nervoso (neuroanticorpi) o le piante (fitoanticorpi).
Immunizzazione intercellulare. - L'efficiente secrezione di anticorpi espressi artificialmente in cellule del sistema nervoso viene sfruttata nella strategia sperimentale dei neuroanticorpi (Cattaneo e Biocca, 1998). Questa si basa sulla espressione, nel sistema nervoso di topi transgenici, di anticorpi diretti contro molecole attive nell'ambiente extracellulare, quali fattori di crescita, neuropeptidi o recettori. La possibilità di utilizzare un controllo trascrizionale fine con promotori differenti rende questo approccio un complemento utile per studi funzionali sul sistema nervoso, ma anche di altri tessuti od organi.
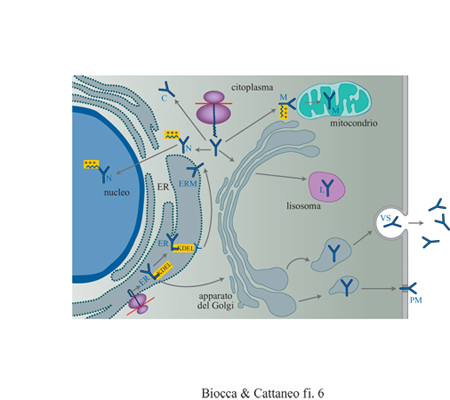
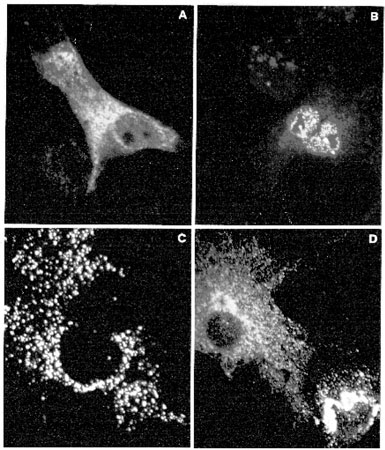
Immunizzazione intracellulare. - La sostituzione del segnale di localizzazione responsabile della secrezione degli anticorpi con segnali specifici per altri compartimenti intracellulari (anticorpi intracellulari) permette di allargare lo spettro di antigeni neutralizzabili anche a proteine intracellulari (Biocca et al., 1990; Biocca et al., 1994; Cattaneo e Biocca, 1998). Questo approccio si basa sul fatto che, nella normale fisiologia di una cellula, ogni proteina trova la sua corretta e naturale localizzazione grazie alla presenza di segmenti peptidici che agiscono come segnali specifici di indirizzamento e di localizzazione. La presenza di una cosiddetta sequenza segnale di secrezione determina se una proteina viene sintetizzata su poliribosomi associati alle membrane intracellulari e, quindi, espressa in modo cotraduzionale nel reticolo endoplasmatico, oppure se viene sintetizzata su ribosomi liberi, rimanendo nel citoplasma. Ulteriori segnali di localizzazione, alcuni dei quali già identificati, determinano il successivo indirizzamento lungo la via secretoria; le proteine possono essere secrete per la via regolata o costitutiva, trasportate sulla membrana pIasmatica, indirizzate ai lisosomi o ai vari compartimenti del Golgi, del reticolo endoplasmatico o a vescicole di varia natura. In modo analogo, le proteine sintetizzate sui ribosomi liberi possono rimanere diffuse nel citoplasma oppure, se dotate di opportuni segnali, essere indirizzate al nucleo, ai mitocondri o sulla faccia interna della membrana plasmatica. Molti di questi segnali sono autonomi e dominanti, nel senso che, se vengono trapiantati molecolarmente nel contesto di un'altra proteina, conferiscono a essa la localizzazione cellulare che compete a quel particolare segnale. Le proprietà di questi segnali sono state sfruttate per reindirizzare anticorpi o frammenti anticorpali in compartimenti intracellulari differenti (fig. 6), incorporando le suddette sequenze segnale all'estremità ammino- o carbossiterminale di anticorpi o di frammenti anticorpali. La figura (fig. 7) mostra frammenti scFv con segnali di localizzazione per compartimenti intracellulari differenti rivelati mediante immunofluorescenza indiretta e microscopia confocale. I domini anticorpali reindirizzati in compartimenti differenti sono in grado di interagire con la proteina corrispondente, neutralizzando ne l'attività biologica. Questo approccio è stato applicato con successo in sistemi biologici differenti, dalle cellule di lievito a quelle umane, e per proteine localizzate in compartimenti cellulari differenti. In particolare, è stato usato per bloccare l'attività di proteine citoplasmatiche coinvolte nella trasduzione del segnale, di proteine citoplasmatiche o nucleari necessarie alla replicazione di retro virus patogeni o di recettori di membrana.
Gli anticorpi intracellulari possono agire neutralizzando direttamente un epitopo attivo della proteina bersaglio. In un altro meccanismo d'azione, essi possono agire in modo più indiretto, fuorviando il normale traffico intracellulare dell'antigene intracellulare. È questo il caso dei recettori di membrana, la cui esposizione sulla superficie cellulare può essere bloccata dalla interazione con un anticorpo intracellulare (àncora intracellulare) trattenuto nel reticolo endoplasmatico con un segnale di ritenzione costituito dal tetrapeptide carbossiterminale KDEL (v. figura 6). In prospettiva, si può ipotizzare di equipaggiare gli anticorpi con funzioni effettrici particolari, adattate alle condizioni intracellulari. Tra queste, l'introduzione di sequenze segnale per la degradazione proteolitica potrebbe indirizzare il complesso antigene-anticorpo verso compartimenti di degradazione intracellulare (anticorpi suicidi). Nelle applicazioni finora descritte, gli anticorpi intracellulari agiscono stechiometricamente. L'utilizzazione intracellulare di anticorpi con attività catalitica, intrinseca o introdotta mediante fusione dei domini anticorpali con enzimi, rappresenta una prospettiva di notevole interesse, soprattutto se accoppiata a metodi di selezione metabolica, sulla base dell'attività catalitica degli anticorpi intracellulari.
La tecnologia degli anticorpi intracellulari ha trovato molteplici campi di applicazione che vanno dalla terapia genica somatica di patologie virali e tumorali alle biotecnologie vegetali, fino alla ricerca di base.
L'applicazione con potenzialità terapeutica di maggiore successo è stata finora la creazione di cellule umane resistenti all'infezione e alla replicazione del virus HIV (Marasco, 1997). Tali cellule sono state prodotte mediante l'espressione di frammenti anticorpali, diretti contro proteine virali nella via secretoria, come gp120, o nel citoplasma e nel nucleo, come la trascrittasi inversa, l'integrasi e le proteine regolatrici rev e tat. La valutazione clinica della efficacia terapeutica effettiva di questo approccio è tuttora in corso e prevede l'introduzione ex vivo dei geni che codificano anticorpi intracellulari in cellule staminali del sistema ematopoietico o in linfociti periferici e la re introduzione delle cellule modificate nei pazienti. È prevedibile che la coespressione di più di un anticorpo in compartimenti differenti possa in futuro costituire un ulteriore elemento di efficacia.
Il successo della tecnologia degli anticorpi intracellulari dipende in modo cruciale, ma non ancora del tutto prevedibile, dalle proprietà di ripiegamento dei singoli domini anticorpali in contesti cellulari differenti. L'assenza delle proteine che assistono il ripiegamento degli anticorpi e l'ambiente riducente del citoplasma, per esempio, inibiscono la formazione dei ponti disolfuro intramolecolari e rendono non ottimali le condizioni di ripiegamento di ciascun anticorpo in questo compartimento. l ponti disolfuro intramolecolari sono fondamentali per determinare la struttura dei domini anticorpali; infatti i residui di cisteina sono quasi perfettamente conservati in tutte le regioni variabili conosciute. Lo studio del contributo dei ponti disolfuro alla stabilità e al ripiegamento delle regioni variabili ha mostrato che domini intrinsecamente stabili possono tollerare l'assenza di questi legami e, inversamente, sono più stabili quei domini anticorpali in grado di tollerare la rimozione delle cisteine. Identificare quelle modificazioni che rendono un anticorpo stabile e in grado di ripiegarsi correttamente, anche in assenza di ponti disolfuro, rappresenta un traguardo importante per le applicazioni future (Cattaneo e Biocca, 1998). Questo obiettivo sarà raggiunto più facilmente mediante l'implementazione di metodi di selezione di anticorpi, sulla base della loro capacità di essere espressi in modo funzionale nell' ambiente intracellulare o sulla base di un fenotipo selezionabile indotto dalla loro espressione. Infezione virale mediata da anticorpi. - Anticorpi diretti contro opportuni recettori di membrana sono stati espressi con successo sulla superficie di virus e retrovirus, determinando l'infezione di cellule bersaglio mediata specificamente dal riconoscimento antigene-anticorpo. Questo meccanismo permetterebbe di conferire una specificità cellulare o tissutale alla infezione da parte di vettori virali o retrovirali, in applicazioni di terapia genica. Inoltre, gli anticorpi vengono usati in configurazioni di immunoconiugati opportuni (immunoliposomi, oppure anticorpi fusi a proteine che legano il DNA) per ottenere l'introduzione di geni in cellule bersaglio in modo antigene-dipendente.
Fitoanticorpi
Le piante sono un sistema di espressione di anticorpi ricombinanti particolarmente versatile, in grado di sintetizzare e produrre qualsiasi tipo di variante anticorpale, dai più piccoli frammenti agli anticorpi interi. Le principali applicazioni dell' espressione anticorpale nelle piante riguardano piante transgeniche come bioreattori di anticorpi e protocolli di immunizzazione passiva e di immunizzazione intracellulare.
Piante come bioreattori. - L'espressione di anticorpi nelle piante ha una notevole potenzialità tecnologica perché permette la produzione di anticorpi di interesse commerciale in quantità industriali e a costi altamente competitivi (Hiatt et al., 1989). In particolare, le piante transgeniche si sono rivelate particolarmente adatte per l'espressione di proteine anticorpali multimeriche, sia IgG che IgA, sfruttando l'incrocio sessuale di piante transgeniche che esprimono le singole catene. Per questo motivo, l'espressione in piante a scopo preparativo prospetta l'uso delle piante stesse come bioreattori su scala agricola.
Un punto che richiede ulteriori approfondimenti, in vista della utilizzazione terapeutica degli anticorpi prodotti dalle piante, riguarda l'influenza che una glicosilazione differente delle cellule vegetali può avere sulla immunogenicità dell'anticorpo. Questo renderebbe necessaria la rimozione dei glicani per via chimica o ricombinante.
Immunizzazione passiva con piante transgeniche. - l protocolli di immunizzazione passiva prevedono l'utilizzazione di grandi quantità di anticorpi specifici da somministrare a scopo terapeutico. L'efficienza delle piante come sistemi di espressione di anticorpi, unitamente alla tecnologia transgenica per un numero crescente di specie, incluse quelle edibili, ha aperto la possibilità di utilizzare le piante transgeniche come vettori di anticorpi per l'immunoterapia topica o per l'immunizzazione passiva per via orale (Ma e Hein, 1995). In questo caso l'isotipo più adatto è la IgA secretoria (slgA), la forma di anticorpo prevalente nella cavità orale e nelle mucose umane e quella particolarmente resistente alla proteolisi. Un anticorpo slgA con potenzialità immunoterapeutica è stato espresso con ottima efficienza in piante transgeniche, mediante la coespressione non solo delle catene leggere e pesanti, ma anche della proteina J associata e della cosiddetta componente secretoria. Nel caso in cui la pianta che produce la slgA sia commestibile, non è necessario purificare l'anticorpo. La pianta può essere utilizzata per la somministrazione locale di anticorpi, una tecnologia in rapido sviluppo e in corso di sperimentazione per le infezioni che interessano la cavità orale e il tratto gastrointestinale.
Immunizzazione intracellulare in piante. - L'espressione di anticorpi intracellulari in piante transgeniche è stata usata con successo per conferire alle piante stesse un fenotipo di interesse, come la resistenza ai virus patogeni (Tavladoraki et al., 1993) o ad altri organismi patogeni. L'uso degli anticorpi intracellulari per la produzione di piante transgeniche con proprietà modificate a scopo applicativo o di ricerca è un campo particolarmente vivace, in quanto rappresenta un punto d'incontro delle immunotecnologie con le biotecnologie vegetali.
Biosensori
l biosensori sono dispositivi analitici che, sfruttando la specificità dei processi di riconoscimento chimico, rivelano la presenza di una singola specie molecolare di interesse a concentrazioni molto diluite in una mistura complessa. Un biosensore è costituito da un elemento di riconoscimento molecolare accoppiato a un elemento che trasduce l'evento di legame nella variazione di una grandezza fisica macroscopica misurabile. Idealmente, un biosensore generale dovrebbe essere costituito da una collezione di siti leganti modulari ad alta diversità e da una funzione di trasduzione del segnale che sia facilmente misurabile e, possibilmente, miniaturizzabile (Hellinga e Marvin 1998).
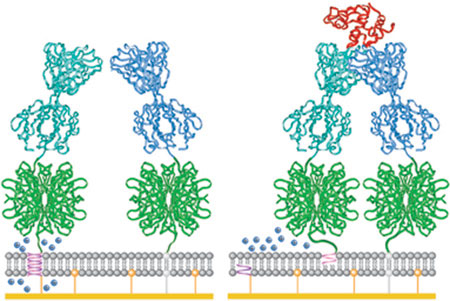
Il repertorio degli anticorpi fornisce una sorgente naturale, ricca e specifica di elementi di riconoscimento, utile per la costruzione di biosensori. Tuttavia, il riconoscimento antigene-anticorpo non è, di per sé, accoppiato alla trasduzione dell' evento. Nella risposta immunitaria, la trasduzione è fornita dal contesto cellulare. In un biosensore basato sugli anticorpi, l'elemento di trasduzione del segnale deve essere introdotto in modo artificiale; un esempio di biosensore basato su anticorpi è quello che sfrutta il fenomeno della risonanza plasmonica di superficie per misurare eventi di legame tra molecole. Recentemente è stato sviluppato un biosensore in cui un anticorpo è stato accoppiato a una funzione macromolecolare elettro chimica, costituendo un interruttore ionico (Cornell et al., 1997) basato sull'opportuno accoppiamento di anticorpi con la gramicidina, un piccolo peptide che attraversa metà di un doppio strato lipidico (fig. 8). Quando due peptidi posti sulle due facce opposte della membrana si sovrappongono, formano un canale ionico transmembrana. Il sistema è costruito in modo tale che quando singole molecole leganti di interesse vengono riconosciute dagli anticorpi accoppiati alla gramicidina, si determina una variazione macroscopica di corrente dell' ordine di milioni di ioni per secondo, per una singola interazione molecolare (v. figura 8). Questo biosensore si presta anche a misurazioni di corrente attraverso singoli canali.
In prospettiva, è chiaro che la tecnologia delle librerie di anticorpi offre un repertorio virtualmente illimitato di domini leganti e ciò è cruciale per lo sviluppo di biosensori modulari.
Conclusioni
Nel corso degli anni, l'utilizzazione degli anticorpi è passata da collezioni complesse e poco controllabili di immunoglobuline, cioè gli antisieri policlonali, a reagenti individuali ben caratterizzati come gli anticorpi monoclonali. Questi ultimi hanno permesso lo sviluppo delle immunotecnologie moderne, basate sulla modificazione e sull'ingegneria proteica di singoli anticorpi, in forme e modi limitati solo dalla fantasia. Oggi, la tecnologia dei repertori anticorpali esposti su fagi permette non solo di isolare singoli anticorpi ricombinanti, ma anche di manipolare in modo parallelo collezioni complesse di anticorpi, insieme ai geni corrispondenti nei cosiddetti antisieri policlonali ricombinanti. In questo senso, la tecnologia delle librerie fagiche è il cuore delle immunotecnologie moderne, poiché permette di sfruttare sistemi immunitari artificiali costruiti su misura. In prospettiva, questa tecnologia ha importanti implicazioni per i progetti di sequenziamento del genoma umano. Infatti, la velocità con cui si generano dati di sequenza è molto più grande della velocità con cui si possono generare informazioni di localizzazione e di funzione delle proteine corrispondenti. Il successo del progetto di sequenziamento del genoma dipenderà dal raggiungimento dell'obiettivo finale della comprensione della funzione delle proteine codificate dal genoma, la cosiddetta genomica funzionale. È chiaro pertanto che un sistema intrinsecamente parallelo come quello delle librerie si presta a sviluppare schemi di selezione di anticorpi diretti contro librerie di proteine o di peptidi (librerie contro librerie), anziché contro singole proteine, per studiare le funzioni di classi di proteine in cellule di interesse. Questo porterà un importante contributo tecnologico alla genomica funzionale.
" ... Quando si proclamò che la Biblioteca comprendeva tutti i libri, la prima impressione fu di straordinaria felicità. Tutti gli uomini si sentirono padroni di un tesoro intatto e segreto. Non v'era problema personale o mondiale la cui eloquente soluzione non esistesse ... ".
Jorge Luis Borges, leggendo La Biblioteca di Babele
Bibliografia citata
BlOCCA, S., NEUBERGER, M.S., CATTANEO, A. (1990) Expression and targeting of intracellular antibodies in manunalian cells. EMBO J., 9, 101-108.
BlOCCA, S., PIERANDREI-AMALDI, P., CAMPIONI, N., CATTANEO, A. (1994) Intracellular inunuruzation with cytosolic recombinant antibodies. Biotechnology, 12, 396-399.
BIRD, R.E., HARDMAN, K.D., JACOBSON, J.W., JOHNSON, S., KAUFMAN, B.M., LEE, S.M., LEE, T., POPE, S.H., RIORDAN, G.S., WHITLOW, M. (1988) Single-chain antigen-binding proteins. Science, 242, 423-426.
BRUEGGEMANN, M., NEUBERGER, M.S. (1996) Strategies for expressing human antibody repertoires in transgenic mice. Immunol. Today, 17, 391-397.
BURTON, D.R., BARBAS, C.F., PERSSON, M.A., KOENIG, S., CHANOCK, R.M., LERNER, R.A. (1991) A large array of human monoclonal antibodies to HIV-I from combinatoriallibraries from asymptomatic seropositive individuals. Proc. Natl. Acad. Sci. USA, 88, 10134-10137.
CARTER, P., MERCHANT, A.M. (1997) Engineering antibodies for imaging and therapy. Curr. Opin. Biotechnol., 8, 449-454.
CATTANEO, A., BlOCCA, S. (1998) Selection of intracellular antibodies. Trends Biotechnol., in corso di stampa.
CATTANEO, A., NEUBERGER, M.S. (1987) Polymeric inununoglobulin M is secreted by transfectants of non-Iymphoid cells in the absence of immunoglobulin J chain. EMBO J., 6, 2753-2758.
CLACKSON, T., HOOGEBOOM, H.R., GRIFFITHS, A.D., WINTER, G. (1991) Making antibody fragments using phage display libraries. Nature, 352, 624-628.
CORNELL, B.A., BRAACH-MAKSVYTIS, V.L., KING, L.G., OSMAN, P.D., RAGUSE, B., WIECZOREK, L., PACE, R.J. (1997) A biosensor that uses ion-chaunel switches. Nature, 387, 580-583.
DAVIES, J., RIECHMANN, L. (1995) Antibody VH domains as small recognition uruts. Biotechnology, 13, 475-479.
GHETIE, M.A., VITETTA, E.S., (1994) Recent developments in immunotoxin therapy. Curr. Opin. Immunol., 6, 707-714.
HANES, J., PLUECKTHUN, A. (1997) In vitro selection and evolution of functional proteins using ribosome display. Proc. Natl. Acad. Sci. USA, 94, 4937-4942.
HE, M., TAUSSIG, M. J. (1997) Antibody-ribosome-mRNA (ARM) complexes as efficient selection parti cles for in vitro display and evolution of antibody combining sites. Nucleic Acids Res., 25, 5132-5134.
HELLINGA, H.W., MARVIN, J.S. (1998) Protein engineering and the development of generic biosensors. Trends Biotechnol., 16, 183-189.
HIATT, A., CAFFERKEY, R., BOWDISH, K. (1989) Production of antibodies in transgenic plants. Nature, 342, 76-78.
HOLLIGER, P., PROSPERO, T., WINTER, G. (1993) 'Diabodies': small bivalent and bispecific antibody fragments. Proc. Natl. Acad. Sci. USA, 90, 6444-6448.
HUANG, X., MOLEMA, G., KING, S., WATKINS, L., EDGINGTON, T.S., THORPE, P.E. (1997) Tumor infarction in mice by antibody-directed targeting of tissue factor to tumor vasculature. Science, 275, 547-550.
JONES, P.T., DEAR, P.H., FOOTE, J., NEUBERGER, M.S., WINTER, G. (1986) Replacing the complementarity-deterrnining regions in a human antibody with those from a mouse. Nature, 321, 522-524.
JUNG, S., PLUECKTHUN, A. (1997) Improving in vivo folding and stability of a scFv antibody fragment by loop grafting. Protein Eng., 10, 959-966.
KOEHLER, G., MILSTEIN, C. (1975) Continuous cultures of fused cells secreting antibody of predefined specificity. Nature, 256, 495-497.
KREBBER, C., SPADA, S., DESPLANCQ, D., PLUECKTHUN, A. (1995) Co-selection of cognate antibody-antigen pairs by selectively-infective phages. FEBS Lett., 377, 227-231.
LERNER, R.A., BENKOVIC, S.J., SCHULTZ, P.G. (1991) At the crossroads of chemistry and inununology: catalytic antibodies. Science, 252, 659-667.
MA, J.K., HEIN, M.B. (1995) lnununotherapeutic potential of antibodies produced in plants. Trends Biotechnol., 13, 522-527.
MCCAFFERTY, J., GRIFFITHS, A.D., WINTER, G., CHISWELL, D.J. (1990) Phage antibodies: filamentous phage displaying antibody variable domains. Nature, 348, 552-554.
MALMBORG, A.C., SOEDERLIND, E., FROST, L., BORREBAECK, C.A. (1997) Selective phage infection mediated by epitope expression on F pilus. J. Mol. Biol., 273, 544-551.
MARASCO, W.A. (1997) Intrabodies: turning the humoral immune system outside in for intracellular inununization. Gene Ther., 4, 11-15.
MARKS, J.D., HOOGENBOOM, H.R., BONNERT, T.P., MCCAFFERTY, J., GRIFFITHS, A.D., WINTER, G. (1991) By-passing immunization: human antibodies from V-gene libraries displayed on phage. J. Mol. Biol., 222, 581-597.
NEUBERGER, M.S., WILLIAMS, G.T., FOX, R.O. (1984) Recombinant antibodies possessing novel effector functions. Nature, 312, 604-608.
ORLANDI, R., GUSSOW, D.H., JONES, P.T., WINTER, G. (1989) Cloning inununoglobulin variable domainsfor expression by the polymerase chain reaction. Proc. Natl. Acad. Sci. USA, 86, 3833-3837.
RIECHMANN, L., CLARK, M., WALDMANN, H., WINTER, G. (1988) Reshaping human antibodies for therapy. Nature, 332, 323-327.
SCOTT, A.M., WELT, S. (1997) Antibody-based inununological therapies. Curr. Opin. Immunol., 9, 717-722.
SMITH, G.P. (1985) Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science, 228, 1315-1317.
SMITHRUD, D.B., BENKOVIC, S.I. (1997) The state of antibody catalysis. Curr. Opin. Biotechnol., 8, 459-466.
TAVLADORAKI, P., BENVENUTO, E., TRINCA, S., DE MARTINIS, D., CATTANEO, A., GALEFFI, P. (1993) Transgenic plants expressing a functional scFv antibody are specifically protected from virus attack. Nature, 366, 469-472.
WINTER, G., MILSTEIN, C. (1991) Man-made antibodies. Nature, 349, 293-299.
Bibliografia generale
CARTER, P., MERCHANT, A.M. (1997) Engineering antibodies for imaging and therapy. Curr. Opin. Biotechnol., 8, 449-454.
CATTANEO, A., BlOCCA, S. Intracellular antibodies: deveIopments and applications. Austin, Laudes Bioscience, 1997.
MILSTEIN, C. (1990) The Croonian Lecture 1989. Antibodies: a paradigm for the biology of molecular recognition. Proc. R. Soc. Lond. Biol. Sci., 239, 1-16.
SMITHRUD, D.B., BENKOVIC, S.I. (1997) The state of antibody catalysis. Curr. Opin. Biotechnol., 8, 459-466.
WINTER, G., GRIFFITHS, A.D., HAWKINS, R.E., HOOGENBOOM, H.R. (1994) Making antibodies by phage display technology. Annu. Rev. Immunol., 12, 433-455.