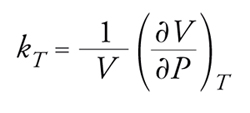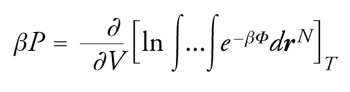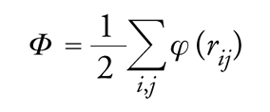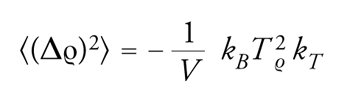Acqua
Acqua
La composizione chimica delle molecole dell'acqua è molto semplice: esse sono formate da 1 atomo di ossigeno legato a 2 atomi di idrogeno. Tuttavia, il comportamento fisico e chimico di un insieme numeroso di tali molecole presenta aspetti peculiari, al punto da indurre il biofisico Felix Franks ad affermare che "di tutti i liquidi conosciuti l'acqua è probabilmente il più studiato e il meno compreso". Questo comportamento ha talvolta alimentato stravaganti fantasie anche da parte di autorevoli protagonisti della cultura scientifica ortodossa. A tale proposito è sufficiente ricordare che, negli anni Sessanta dello scorso secolo, il mondo della scienza è stato scosso da un dibattito incentrato sulla possibilità di trasformare l'acqua in un polimero solido chiamato 'poliacqua'. Responsabili di tale trasformazione sarebbero state le superfici solide, che avrebbero potuto conferire all'insieme delle molecole a esse adiacenti una struttura ordinata in grado di propagarsi in tutta la compagine liquida, la quale avrebbe conservato, o meglio ricordato, tale configurazione. Alcuni scienziati furono indotti a ritenere che la comune acqua liquida non fosse altro che una forma metastabile, ovvero suscettibile di subire una catastrofica trasformazione nella più stabile poliacqua, con conseguenze nefaste per tutti gli organismi viventi, inclusi gli uomini. Fortunatamente, si riuscì però a evidenziare che la cosiddetta poliacqua era semplicemente acqua sporca, chiudendo così definitivamente una vicenda che aveva ormai assunto aspetti tragicomici.
Tuttavia, l'ipotesi di una memoria dell'acqua, capace di conservare l'impronta di molecole da essa allontanate, riemerse alla fine degli anni Ottanta per interpretare i risultati ottenuti da Jacques Benveniste sull'azione di particolari anticorpi, le immunoglobuline IgE o reagine allergiche, che si riteneva fossero in grado di agire anche quando la loro diluizione, nel solvente acquoso, aveva ormai raggiunto il limite dell'acqua pura. Ma anche questi risultati, che tra l'altro davano un gratificante supporto alle medicine alternative, quali l'omeopatia, si rivelarono illusori, come fu dimostrato in modo forse un po' pittoresco da un gruppo che operava per conto della rivista "Nature", gruppo al quale apparteneva, oltre al direttore della stessa rivista, anche un noto illusionista. Episodi come quelli menzionati evidenziano il ruolo che il conformismo intellettuale assume nel comportamento dei ricercatori.
In realtà, l'acqua è sicuramente un composto atipico, come viene confermato dalle sue proprietà chimico-fisiche. Se si esaminano i valori delle temperature di fusione e di ebollizione dei composti formati dagli elementi del 6° Gruppo del sistema periodico degli elementi, cui appartiene l'ossigeno, mentre l'idrogeno appartiene al 1° Gruppo, si osserva che, nel caso dell'acqua, entrambi i valori si impennano, cioè le due temperature sono molto più elevate di quelle che si potrebbero prevedere da una semplice estrapolazione. Data l'importanza che l'acqua liquida riveste per i fenomeni vitali, che, come è noto, possono svolgersi in un modesto intervallo di temperatura intorno ai 20 °C, la rilevanza di tale anomalia appare del tutto ovvia. Inoltre, il fatto che la densità dell'acqua allo stato liquido sia maggiore di quella del ghiaccio ha importanti conseguenze; infatti, poiché il congelamento dei laghi inizia dalla superficie e procede verso il fondo, la sopravvivenza della vita lacustre è permessa anche a basse temperature.
In sostanza le strane proprietà dell'acqua liquida la rendono un mezzo unico e particolarmente efficace nel promuovere processi singolari, che possono avere profonda rilevanza sulle caratteristiche del mondo fisico. Tanto da rendere difficile concepire che qualunque forma di vita possa emergere spontaneamente ed evolvere sino alla complessità di una cellula vivente, senza coinvolgere una soluzione acquosa.
Il comportamento dell'acqua
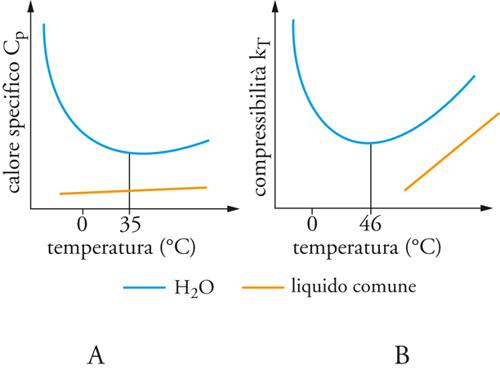
Un significativo indizio sul comportamento della materia ci viene offerto dalle cosiddette funzioni di risposta, che costituiscono una misura della risposta fornita da una sostanza sottoposta a una sollecitazione esterna, quale, per esempio, una compressione o un riscaldamento. In quest'ultimo caso, la grandezza in esame, espressa dal rapporto fra l'energia termica accumulata dalla sostanza e la corrispondente variazione di temperatura, è il calore specifico, che per l'acqua risulta molto più elevato di quello di liquidi analoghi, come gli alcoli. Questa situazione è illustrata nella fig. 2A, nella quale la dipendenza dalla temperatura del calore specifico a pressione costante (Cp) dell'acqua liquida viene confrontata con quella tipica di un altro liquido. Questa capacità dell'acqua di accumulare energia termica ha implicazioni ecologiche stupefacenti; infatti, le correnti calde degli oceani, come la Corrente del Golfo, nel loro lento percorso tra l'Artico e l'Antartico, liberano nell'atmosfera enormi quantità di calore che contribuiscono a mantenere un clima temperato adatto allo sviluppo e al mantenimento della vita.
Un'altra tipica funzione di risposta è la compressibilità isoterma, definita dalla relazione
[1] formula
che riflette la risposta di un sistema fisico a una variazione di pressione. Il suo andamento per l'acqua liquida, sempre in funzione della temperatura, viene confrontato con quello di un liquido tipico nella fig. 2B: anche in questo caso risulta evidente come l'acqua si distingua per i valori nettamente più elevati della sua compressibilità. È interessante osservare che le menzionate anomalie sembrerebbero conferire all'acqua un ruolo particolare nell'ambito del principio antropico, in base al quale le proprietà dell'Universo sono tali affinché esso possa essere osservato da esseri intelligenti la cui esistenza dipende proprio dai valori, apparentemente anomali, di tali proprietà.
Teoria statistica dei fluidi semplici
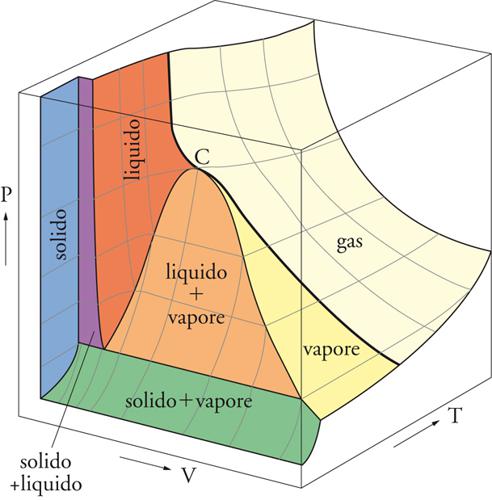
È opportuno far riferimento ai concetti generali che vengono utilizzati per descrivere la materia nei suoi diversi stati ‒ gassoso, liquido e solido ‒ partendo da un approccio che potremmo definire fenomenologico, perché si limita a cogliere l'esistenza della materia in funzione di tre variabili caratteristiche, ovvero la temperatura T, la pressione P e il volume V. Se si fissano arbitrariamente i valori di due di esse, resta automaticamente stabilito anche il valore della terza. In termini matematici, ciò sta a indicare che esiste un'equazione di stato che lega fra di loro tali variabili. Tutto ciò può essere rappresentato graficamente con una superficie in uno spazio a tre dimensioni, ciascuna delle quali corrisponde a una delle tre variabili di stato. La sua forma tipica è illustrata nella fig. 3, dove ogni punto della superficie riflette il legame tra le variabili di stato e caratterizza lo stato del sistema, poiché individua un solido, un liquido, un vapore condensabile, un gas incoercibile (cioè non condensabile anche se sottoposto a pressioni molto elevate), oppure una coesistenza fra due o tre di questi stati.
Le due curve riportate nella figura descrivono due possibili trasformazioni isoterme, che avvengono cioè a temperatura costante. La prima passa per il punto critico C, e definisce la separazione fra gas incoercibile e vapore condensabile. Infatti, al di sopra della temperatura critica non possono coesistere la fase liquida e quella vapore in equilibrio. La seconda comporta una transizione di fase, ovvero il passaggio da vapore a liquido (o viceversa); tale transizione avviene catastroficamente lungo il segmento che giace sulla zona piatta della superficie di stato, che separa la zona di esistenza del vapore da quella del liquido. La descrizione della superficie di stato mediante un'equazione matematica che includa sia la fase liquida sia quella gassosa costituisce un problema di notevole difficoltà. Per interpretare tale comportamento, sulla base delle conoscenze che si sono accumulate sulla struttura delle molecole di cui sono costituiti i fluidi stessi, è stato necessario dedicare molti sforzi alla costruzione di adeguati modelli che tengano conto sia della disposizione delle particelle nello spazio, sia delle interazioni tra di esse. In questo quadro è emersa la chiara consapevolezza che, fra i diversi stati della materia, il più difficile da comprendere è quello liquido. Infatti, mentre nei gas le molecole, essendo lontane fra loro, conservano piena individualità anche se sono soggette a interazioni reciproche, nei liquidi esse sono molto addensate, a contatto l'una con l'altra, e interagiscono in gruppo.
Inoltre, poiché le molecole di un liquido sono distribuite disordinatamente nello spazio ‒ diversamente da ciò che avviene nei solidi, nei quali gli atomi si trovano nei nodi di reticoli con caratteristiche geometriche ben definite ‒ il calcolo delle proprietà termodinamiche, come l'energia interna, del liquido a partire da quelle delle molecole che lo costituiscono, risulta estremamente difficile. La meccanica statistica ci offre una ricetta apparentemente semplice per perseguire tale scopo. Si procede impiegando l'energia libera del sistema, espressa attraverso l'integrale delle configurazioni; essa viene poi derivata rispetto al volume a temperatura costante fornendo così l'equazione di stato. Si ottiene:
[2] formula
essendo drN = dr1r2…drN (dove dr = dxdydz indica un elemento di volume), N il numero di molecole, e β=1/kBT (dove kB è la costante di Boltzmann), Φ l'energia potenziale del sistema. Indichiamo inoltre con φ(rij) l'energia di interazione delle molecole i e j dipendente dalla distanza fra i centri delle molecole stesse. A piccole distanze prevalgono le interazioni repulsive, essendo il potenziale positivo, mentre a distanze elevate prevalgono le interazioni attrattive. Dalla φ(rij) si risale all'energia potenziale totale del sistema, che può essere valutata sommando le energie di interazione di ciascuna coppia di molecole:
[3] formula.
Per diversi sistemi sono note espressioni, approssimate ma ragionevoli, dell'energia potenziale di interazione fra le molecole e, pertanto, in teoria sarebbe possibile arrivare a descrivere il comportamento di stato dei fluidi attraverso la valutazione dell'integrale presente nella formula precedente. Purtroppo, nel caso in cui il comportamento del sistema ricada nell'area dei liquidi, il calcolo di tale integrale risulta impossibile anche facendo ricorso alle più sofisticate tecniche matematiche. Fino a una cinquantina di anni fa, era diffusa la convinzione che, se nell'Ottocento era stato compreso lo stato gassoso e nel Novecento quello solido, per la comprensione dello stato liquido sarebbero occorse ancora diverse decine di anni, e che questo obiettivo sarebbe dovuto essere differito al XXI secolo. In realtà, si trattava di un atteggiamento ingiustificato, poiché le idee fondamentali per la comprensione dello stato liquido erano già state formulate nel 1873 da uno scienziato olandese, Johannes D. van der Waals, attraverso l'impiego di un modello dei fluidi nel quale le molecole vengono assimilate a sfere dure impenetrabili ma soggette a una debole forza attrattiva. Malgrado le approssimazioni insite nel modello, van der Waals riuscì a ricavare un'equazione di stato relativamente semplice in grado di giustificare l'esistenza del punto critico e la presenza di una transizione di fase liquido-vapore.
Riesaminata secondo un'impostazione moderna, la teoria di van der Waals deve il suo successo all'introduzione dell'idea che nella descrizione termodinamica dei fluidi è legittimo separare l'effetto delle forze intermolecolari repulsive, le quali condizionano essenzialmente la distribuzione delle molecole nello spazio, da quelle attrattive, che ne determinano invece il contenuto di energia. Nella seconda metà del secolo scorso, pertanto, la teoria di van der Waals è stata rivalutata attraverso la formulazione di un approccio, detto perturbativo, nel quale le proprietà di un generico fluido venivano valutate a partire da quelle di un opportuno sistema di riferimento, che nel caso più semplice risultava essere lo stesso fluido di sfere dure di van der Waals. Il successo dei risultati così ottenuti, quindi, sembrava indicare che anche l'impenetrabile stato liquido era suscettibile di una descrizione, nella quale gli aspetti molecolari si integrano con il comportamento termodinamico macroscopico. Purtroppo, però, il comportamento dell'acqua non risulta del tutto compatibile con tale modello, poiché le sue peculiari proprietà sembrano sfuggire alla semplice, ma chiara, logica fisica contemplata dalla teoria di van der Waals; l'applicazione di tale teoria sembrava così limitata allo studio dei cosiddetti fluidi semplici, costituiti da molecole aventi configurazione quasi sferica e le cui interazioni reciproche non dipendono dalla loro orientazione relativa. Successivamente, il modello è stato applicato a fluidi costituiti da molecole relativamente complicate, scegliendo un opportuno sistema di riferimento ‒ rappresentato, per esempio, da oggetti duri aventi la forma di dischi, di cilindri, di sigari, ecc. ‒ così da simulare nel modo più adeguato la struttura del sistema molecolare in esame.
Proprietà termodinamiche dell'acqua
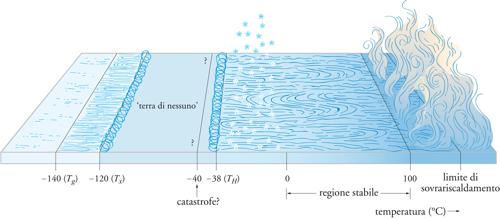
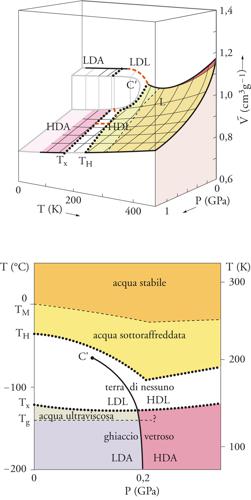
Il comportamento anomalo, e per certi versi misterioso, dell'acqua risulta evidente dall'esame del diagramma di stato illustrato nella fig. 4, ottenuto attraverso una lunga, puntigliosa e accurata sperimentazione. Esso si riferisce alla pressione di 1 atm e mostra l'esistenza di altre fasi liquide, alcune anche a temperature inferiori a quelle di formazione del ghiaccio. Infatti, al di sotto di Tg= −140 °C = 133 K, il ghiaccio è presente in una forma amorfa, o vetrosa, riscaldando la quale si ottiene un liquido ultraviscoso; se portato a una temperatura superiore a −120 °C, tale liquido forma il comune ghiaccio cristallino. La zona compresa fra Tx = −120 °C = 153 K e TH = −38 °C = 235 K, nella quale l'acqua è presente solo sotto forma di ghiaccio cristallino, viene chiamata terra di nessuno perché difficilmente esplorabile sperimentalmente; in tale zona si dovrebbe trovare un secondo punto critico C′, dove termina la linea di separazione tra le fasi di alta e di bassa densità (fig. 5). La temperatura TH rappresenta il limite al di sotto del quale l'acqua liquida, anche sottoraffreddata, non può esistere perché subisce una transizione di fase per nucleazione omogenea, divenendo ghiaccio cristallino.
In realtà, la situazione è ancora più complessa se si prende in considerazione l'effetto della pressione (fig. 5), poiché il ghiaccio vetroso può esistere in almeno due fasi, chiamate rispettivamente LDA (Low density amorphous) e HDA (High density amorphous). La prima si produce raffreddando con grande rapidità gocce micrometriche di liquido; viceversa, l'HDA si ottiene comprimendo il ghiaccio cristallino al di sotto di 150 K o, in modo alternativo, bombardandolo con un fascio di elettroni. Il passaggio da una all'altra di tali fasi amorfe, o vetrose, è indotto da variazioni di pressione, per cui esiste una linea di confine in corrispondenza della quale ha luogo una transizione di fase del primo ordine, ovvero associata a una variazione discontinua del volume specifico per unità di massa V. È interessante osservare che il punto critico C′, che individua il limite di esistenza di entrambe le fasi in equilibrio, dovrebbe trovarsi a circa −40 °C, ovvero nella zona di esistenza del ghiaccio cristallino. In sostanza, si tratta di un punto critico virtuale, e quindi non individuabile sperimentalmente, la cui influenza si manifesta generando una vasta zona critica che investe anche l'acqua ordinaria e dà luogo ad ampie fluttuazioni delle sue proprietà.
Per approfondire questi aspetti è necessario ricordare che, anche in condizioni di equilibrio, un sistema termodinamico è soggetto a fluttuazioni delle sue proprietà, fra le quali la densità risulta di particolare interesse. Il calcolo dell'entità di tali fluttuazioni può essere effettuato fruendo ancora una volta dei metodi della termodinamica statistica. Se si considera un fluido in equilibrio termico contenuto in un volume V, la sua densità ϱ fluttua attorno a un valore medio 〈ϱ〉 e si dimostra che la media del quadrato della deviazione risulta espressa dalla relazione
[4] formula.
Il valore di 〈(Δϱ)2〉 aumenta al crescere della temperatura, poiché con essa aumenta il contenuto energetico del sistema, e al diminuire del volume, poiché diminuiscono le dimensioni del sistema stesso. Di particolare interesse, allora, risulta il suo comportamento in prossimità di un punto critico dove (∂P/∂V)T = (1/kTV) → 0, per cui il valore al secondo membro dell'espressione precedente diverge dando luogo a enormi fluttuazioni. L'osservazione sperimentale che tali fluttuazioni nell'acqua si verificano in prossimità del punto critico corrispondente al passaggio da acqua liquida a gas fu fatta da Thomas Andrews nel 1869. Il fenomeno è stato chiamato opalescenza critica, perché l'effetto di dispersione della luce dovuto alle fluttuazioni conferisce all'acqua un aspetto lattiginoso.
Osservando la fig. 2B, si può notare che la compressibilità dell'acqua non è semplicemente più elevata di quella degli altri liquidi, ma ha un andamento del tutto anomalo, in quanto, per temperature al di sotto dei 46 °C, essa aumenta in modo significativo raggiungendo valori molto elevati nell'intorno di −40 °C. Questo fatto indica l'esistenza di un tipico comportamento critico caratterizzato da ampie fluttuazioni e condiviso anche dalle altre funzioni di risposta, in particolare CV, il calore specifico a volume costante (che per un liquido è molto prossimo a Cp), il cui valore è legato a quello medio delle fluttuazioni dell'entropia S mediante la relazione:
[5] 〈(Δϱ)2〉 ≈ kBCV .
Anche in questo caso, dall'esame della fig. 2A risulta che la capacità termica dell'acqua, a differenza degli altri liquidi, aumenta al diminuire della temperatura, confermando la presenza di un punto critico nell'intorno di −40 °C.
Questi interessanti risultati permettono di completare il quadro precedentemente presentato delle proprietà fisiche dell'acqua. Nella fig. 5 in alto è riportata la superficie di stato in un vasto intervallo della temperatura assoluta T e per valori della pressione P che vanno da zero sino a oltre 1 GPa. Nella zona rossa, a elevata temperatura e bassa pressione, l'acqua è presente sotto forma di gas, mentre a temperature basse sono presenti le due fasi condensate vetrose LDA e HDA. Queste fasi ‒ la cui esistenza è stata verificata sperimentalmente ‒ danno luogo a una transizione di fase del primo ordine, in corrispondenza della quale si manifesta una discontinuità nel volume specifico. L'unica zona incerta è quella compresa fra le due curve tratteggiate presenti nella terra di nessuno, nella quale all'aumentare della temperatura si può ipotizzare che siano presenti due ulteriori fasi liquide, indicate rispettivamente con LDL (Low density liquid) e HDL (High density liquid). L'esistenza di tali fasi viene illustrata anche nella fig. 5 in basso, che costituisce una proiezione della fig. 5 in alto e una generalizzazione, per pressioni fino a oltre 0,3 GPa, della fig. 4.
Struttura della molecola dell'acqua
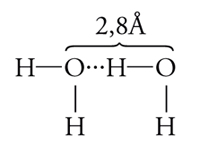
Platone, pur non respingendo l'immagine atomistica della materia attribuita a Leucippo e Democrito, non accettava che esistesse un vuoto fra le particelle che costituivano la materia stessa. Pertanto, attribuiva loro forme geometriche ben definite, che per i quattro elementi di cui si riteneva formata la Natura erano i ben noti poliedri regolari, il più complesso dei quali (un icosaedro regolare) era da lui riservato alle particelle, o atomi, di acqua. Attualmente sappiamo che una molecola isolata di acqua è in realtà formata da 1 atomo di ossigeno legato a 2 atomi di idrogeno e ha la struttura illustrata nella fig. 6, dalla quale risulta evidente che si tratta di una molecola piegata, poiché l'angolo fra i due legami O−H è uguale a 104,5°. Una caratteristica peculiare è data dalla presenza di due coppie solitarie di elettroni che, come illustrato nella figura, si trovano in corrispondenza di due vertici di un tetraedro (gli altri due vertici sono occupati dagli atomi di idrogeno). Queste coppie di elettroni conferiscono all'atomo di ossigeno un'elevata elettronegatività, permettendogli di interagire con gli atomi di idrogeno di altre 2 molecole d'acqua. Si forma, così, un particolare legame, chiamato legame a idrogeno, di natura essenzialmente elettrostatica:
[6] formula.
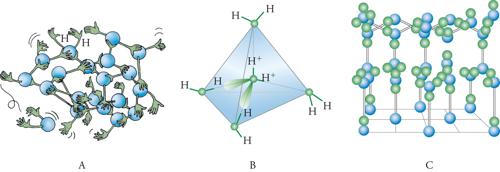
L'energia coinvolta nell'interazione del protone con l'ossigeno di un'altra molecola d'acqua dipende, ovviamente, dalla sua posizione lungo la linea che unisce i 2 atomi di ossigeno e presenta un tipico andamento con due minimi corrispondenti a due possibili posizioni di equilibrio del protone. Per quanto l'energia del legame sia relativamente piccola (5 kcal/mole, ovvero all'incirca un decimo di quella di un normale legame chimico), tuttavia esso è in grado di condizionare la struttura delle fasi dell'acqua condensata. In sostanza, è come se ciascuna molecola avesse due braccia, corrispondenti ai protoni, e due centri di attrazione, corrispondenti alle coppie di elettroni solitari (fig. 7A).
Struttura del ghiaccio e dell'acqua
La formazione dei legami a idrogeno condiziona in modo essenziale la struttura dell'acqua liquida e del ghiaccio. È importante osservare che le direzioni lungo le quali si collocano i 4 legami partono dal centro dell'atomo di ossigeno e vanno verso i vertici di un tetraedro (fig. 7B). La struttura del ghiaccio, ottenuta dalla cristallografia con i raggi X, è illustrata nella fig. 7C, mentre per l'acqua liquida se ne può ipotizzare una come quella riportata nella fig. 7A.
Nel ghiaccio, ogni atomo di ossigeno è legato mediante ponti a idrogeno ad altre 4 molecole, che formano configurazioni esagonali aperte e giustificano il valore relativamente basso della densità. L'acqua liquida è costituita invece da un reticolo dinamico soggetto a deformazioni e difetti, con spazi interstiziali occupati da molecole che contribuiscono ad aumentarne la densità rispetto al ghiaccio. Inoltre, la presenza dei legami a idrogeno contribuisce a stabilizzare il sistema, aumentando sensibilmente le entalpie di fusione e di ebollizione e, di conseguenza, le temperature delle corrispondenti transizioni di fase.
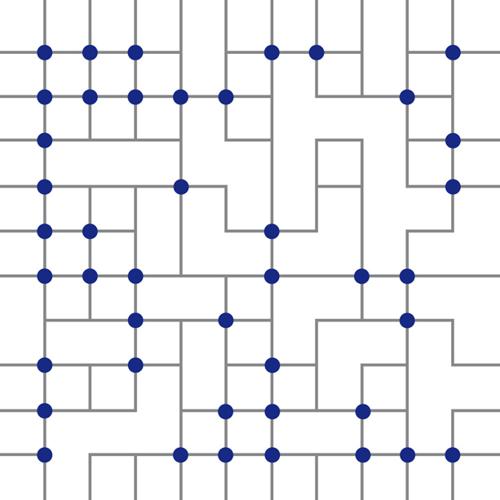
La connettività fra i diversi legami a idrogeno presenti nell'acqua liquida può essere illustrata mediante il reticolo bidimensionale mostrato nella fig. 8. In ciascun vertice è posta 1 molecola d'acqua, mentre i tratti indicano i legami O−H…O. Nell'acqua liquida, il primo calcolo della distribuzione dei legami compatibili con una configurazione tridimensionale corrispondente a quella piana illustrata nella fig. 8, è stato effettuato da Linus Pauling nel 1935. Sulla base di un confronto fra i valori delle entropie del ghiaccio e dell'acqua, Pauling ha dimostrato che il numero di legami intatti presenti nel liquido è all'incirca l'80% del totale, e che pertanto manca una frazione dell'ordine di 0,2 di tutti i possibili legami. Ne consegue che una frazione pari a (0,8)4 ≈ 0,41 delle molecole di acqua ha 4 legami intatti. Esse tendono a raggrupparsi in piccoli grappoli, nei quali tutti i possibili legami a idrogeno restano inalterati. Non solo, ma la configurazione geometrica locale della struttura è simile a quella del ghiaccio, anche se in realtà la presenza di tali grappoli si deve unicamente considerare come una eterogeneità strutturale presente in un liquido. I grappoli sono soggetti a fluttuazioni dinamiche che giustificano la sensibilità alle sollecitazioni esterne, che si manifesta, per esempio, attraverso gli elevati valori del calore specifico e della compressibilità isoterma riscontrati sperimentalmente. Un'ulteriore conferma è fornita dal fatto che, se si diluisce l'acqua con una sostanza, quale un alcol, che pur formando legami a idrogeno non può dar luogo a reticoli tetraedrici, i grappoli vengono distrutti e di conseguenza diminuiscono i valori delle menzionate funzioni di risposta.
Acqua virtuale: simulazioni mediante calcolatori
Interessanti ricerche sul comportamento dell'acqua sono state effettuate anche mediante la dinamica molecolare, grazie alla quale è possibile simulare, con un calcolatore, il comportamento di una popolazione di molecole sotto l'influenza dei loro potenziali di interazione. In questa direzione, risultano di particolare interesse le indagini sul comportamento di un'acqua virtuale che dovrebbe essere stabile a bassa temperatura e alta pressione. In realtà, l'acqua è un sistema chimico-fisico che risulta particolarmente difficile da simulare, poiché non esiste ancora un accordo generale sulla forma precisa del suo potenziale intermolecolare. Tuttavia, le ricerche in queste direzioni hanno il vantaggio di poter confermare la struttura e le caratteristiche dinamiche dell'acqua al di sotto della temperatura TH. In particolare, queste indagini sembrano confermare l'esistenza di una transizione di fase liquido-liquido, con difficoltà di individuazione del punto critico, poiché si tratta di una regione di elevata compressibilità. Le simulazioni al calcolatore sono state utilizzate anche per confermare che alle basse temperature tendono a costituirsi, localmente, gruppi di molecole aventi due diversi tipi di struttura, LDL e HDL, simili, rispettivamente, a quelle delle due fasi LDA e HDA.
L'insieme dei dati sperimentali e dei risultati ottenuti mediante le simulazioni al calcolatore, dunque, sembrano essere mutuamente compatibili, come emerge dai seguenti punti:
(a) a temperature elevate nell'acqua liquida sono presenti due strutture locali, che differiscono per il valore della densità, sono soggette a fluttuazioni dinamiche, ma tendono a separarsi gradualmente al diminuire della temperatura;
(b) a temperature sufficientemente basse la struttura del liquido si avvicina sempre più, a seconda della pressione, a una delle strutture attribuite all'LDA e all'HDA;
(c) a temperature estremamente basse, le fasi LDL e HDL sembrano subire una trasformazione continua verso le fasi LDA e HDA. Tali riscontri parrebbero pertanto giustificare la superficie di stato descritta nella fig. 5.
Implicazioni biologiche
Sulla base dell'analisi precedente si può concludere che, mentre la struttura dei liquidi tipici è essenzialmente determinata dalle forze di repulsione fra le molecole, quella dell'acqua è invece determinata dai legami a idrogeno, responsabili della formazione di un reticolo dinamico soggetto a deformazioni e difetti, con spazi interstiziali occupati da molecole che contribuiscono ad aumentare la densità del liquido rispetto a quella del ghiaccio. La presenza di legami a idrogeno aumenta sensibilmente le entalpie di fusione e di ebollizione, con conseguente aumento delle temperature delle transizioni di fase. È importante ricordare che l'acqua liquida, quando viene impiegata come solvente, condiziona in modo significativo il comportamento delle sostanze in essa disciolte. Nei sistemi biologici, essa gioca un ruolo di fondamentale importanza, poiché contribuisce al controllo delle proprietà delle macromolecole biologiche, per esempio nel ripiegamento delle proteine, nel riconoscimento molecolare e nella funzionalità dei centri enzimatici.
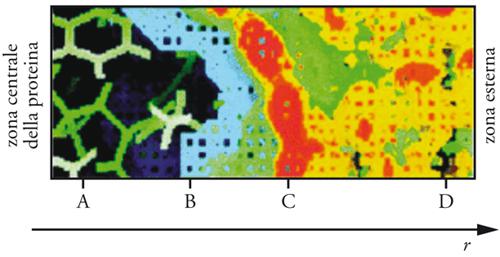
Infatti, una minima quantità di acqua è richiesta per attivare la funzionalità delle proteine, probabilmente attraverso la formazione di un reticolo di legami a idrogeno attorno alla loro superficie, come parrebbe dimostrare il fatto che la presenza di un soluto macromolecolare produce effetti significativi sia sulla distribuzione delle molecole di acqua sia sulla loro mobilità. Questi aspetti vengono illustrati nella fig. 9, nella quale viene riportata una mappa dell'andamento della densità del solvente nel passaggio dall'interno di una molecola proteica al suo esterno, dove è presente il solo solvente. I risultati riassunti nella figura, ottenuti mediante simulazione al calcolatore, ci permettono di distinguere quattro zone: la zona A, nel cuore della proteina, che è libera da solvente; la zona B, nella quale esiste una compenetrazione fra proteina e solvente; la zona C, in corrispondenza della superficie della macromolecola, dove esistono massimi locali di densità del solvente, detti anche zone di idratazione; e infine la zona remota D, nella quale la densità del solvente è uniforme, anche se i processi di diffusione risultano perturbati. L'acqua superficiale manifesta un comportamento dinamico ed eterogeneo, dovuto sia alle interazioni con i diversi atomi della proteina, sia al disordine topologico e alla rugosità della superficie. Nella fig. 10 viene illustrata la struttura di una proteina dispersa in acqua. Le molecole d'acqua, che ‒ come evidenziato nella figura ‒ circondano la proteina, intervengono nei movimenti cui sono soggette le molecole delle proteine e assumono indiscutibile importanza nei fenomeni vitali, le cui caratteristiche non sono ancora del tutto comprese. Pertanto, l'approfondimento di questi aspetti costituisce un settore di ricerca di frontiera. In conclusione si può quindi affermare che il comportamento atipico dell'acqua si deve ascrivere alla sua costituzione molecolare, la quale sicuramente custodisce misteri e sorprese non ancora chiariti.
Bibliografia
Ball 1999: H2O, a biography of water, London, Weidenfeld & Nicolson, 1999 (trad. it.: H2O, una biografia dell'acqua, Milano, Rizzoli, 2000).
Bizzarri, Cannistraro 2002: Bizzarro, Anna Rita - Canni-straro, Salvatore, Molecular dynamics of water at the protein-solvent interface, "Journal of physical chemistry B", 106, 2002, pp. 6617-6633.
Carrà 1998: Carrà, Sergio, Termodinamica molecolare, in: Enciclopedia del Novecento, Roma, Istituto della Enciclopedia Italiana, 1998, XI, pp. 786-800.
Franks 1981: Franks, Felix, Polywater, Cambridge (Mass.), MIT Press, 1981 (trad. it.: Poliacqua: storia di una falsa scoperta scientifica, Milano, Il Saggiatore, 1983).
Makarov 2002: Makarov, Vladimir - Pettitt, B. Montgomery - Feig, Michael, Solvation and hydration of proteins and nucleic acids: a theoretical view of simulation and experiment, "Accounts of chemical research", 35, 2002, pp. 376-384.
Mishima, Stanley 1998: Mishima, Osamu - Stanley, H. Eugene, The relationship between liquid, supercooled and glassy water, "Nature", 394, 1998, pp. 329-335.
Pauling 1935: Pauling, Linus, The structure and entropy of ice and of other crystals with some randomness of atomic arrangement, "Journal of the American Chemical Society", 57, 1935, pp. 2680-2684.
Rowlinson 1969: Rowlinson, John S., Liquids and liquid mixtures, London, Butterworths, 1969.
Stanley 1999: Stanley, H. Eugene, Unsolved mysteries of water in its liquid and glass states, "Materials Research Society bulletin", 24, 1999, pp. 22-30.