alluminio
alluminio
Il metallo per tutte le occasioni
Di colore argenteo, inalterabile all'aria, l'alluminio è molto diffuso in natura. Isolato nel 1825, è ottenuto dai minerali, in genere bauxite, ed è classificato come alluminio primario per distinguerlo da quello prodotto per riciclaggio denominato come alluminio secondario. Trova applicazioni sia allo stato puro sia nelle leghe ed è riutilizzabile all'infinito. La produzione dell'alluminio richiede una grande quantità di energia con immissione nell'atmosfera di composti dannosi per l'uomo e per l'ambiente
Un metallo insostituibile
L'alluminio è un metallo molto abbondante sulla crosta terrestre. È il terzo elemento dopo l'ossigeno e il silicio; il suo simbolo chimico è Al. Date le sue caratteristiche è il metallo più utilizzato, dopo il ferro, per la fabbricazione di milioni di prodotti. Uno dei suoi pregi maggiori è l'inalterabilità dovuta al sottile strato di ossido insolubile di cui il metallo si ricopre e che lo protegge da ulteriori ossidazioni. Le sue proprietà meravigliarono già nel 1857 lo scrittore Charles Dickens che scriveva: "Cosa ne pensate di un metallo bianco come l'argento, inalterabile come l'oro, di facile fusione come il rame, duro come l'acciaio, che è malleabile, duttile e che ha la singolare proprietà di essere più luminoso del vetro? Tale metallo esiste e in considerevoli quantità sulla superficie terrestre". Se vi guardate intorno scoprirete che l'alluminio è un metallo molto comune. Eppure, nell'Ottocento, Napoleone III, imperatore di Francia, per strabiliare il re del Siam fece imbandire la tavola con piatti e posate in alluminio. Gli stessi bottoni della sua divisa erano in alluminio, all'epoca più costoso e raro dell'oro e del platino. Oggi è molto più economico, ma paradossalmente è ancora più prezioso e insostituibile di allora quando era un prodotto curioso e di lusso.
Come spiegare i motivi di questa irresistibile irruzione dell'alluminio nella nostra vita quotidiana e di conseguenza nell'economia mondiale?
Dall'allume all'alluminio
I composti di alluminio sono stati usati fin dai tempi più antichi ma le prime ricerche per ricavare il metallo sono di Sir Humphrey Davy che all'inizio dell'Ottocento ne individua l'esistenza e gli attribuisce il nome aluminium, da alumen o alum, il nostro allume. Isolato nel 1825 dal chimico e fisico danese Hans Christian Ørsted, l'alluminio è ottenuto in piccole particelle nel 1827 da Friedrich Wöhler. Ma passano ben 27 anni prima che il francese Henri Sainte Claire Deville trovi la strada giusta per trasformare le intuizioni di Ørsted e Wöhler in un processo commerciale. Per quanto le migliorie apportate siano tali da avviare una piccola produzione, il costo dell'alluminio ottenuto supera quello dell'oro e ciò lo rende ancora più esclusivo. È solo nel 1886, quando l'elettricità è resa più accessibile con la dinamo, che un altro francese, Paul-Louis Toussaint Héroult, e l'americano Charles Martin Hall brevettano, all'insaputa l'uno dell'altro, un processo di produzione, ancora attuale, che sfrutta l'elettrolisi e utilizza l'ossido noto come allumina. Nel giro di soli dieci anni il costo dell'alluminio diminuì del 90%!
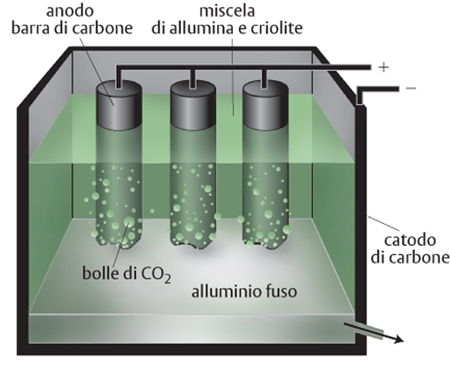
IL PROCESSO PRODUTTIVO
Il procedimento elettrolitico che consente di ridurre gli ossidi a metallo era noto ma richiedeva che l'ossido insolubile in acqua venisse fuso per consentire agli ioni positivi (cationi) e a quelli negativi (anioni) di muoversi verso l'elettrodo negativo (catodo) e quello positivo (anodo) dove avviene la reazione. In questo caso il problema nasceva dall'alta temperatura di fusione dell'allumina, intorno ai 2.050 °C, che comportava elevati costi e complicazioni tecnologiche. La novità introdotta nel processo di Hall e Héroult sta nel miscelare la polvere di allumina con criolite (fluoruro doppio di sodio e di alluminio) già allo stato fuso. Con tale procedimento si ottiene una miscela liquida omogenea fin da 940÷980 °C. Il catodo (negativo) è costituito da uno strato uniforme di carbone che ricopre il fondo della cella, l'anodo (positivo) da barre di carbone immerse nella miscela liquida. Al passaggio della corrente continua, al catodo avviene la formazione di alluminio metallico. Il metallo è poi solidificato in pani con impresso il grado di purezza, cioè il titolo, che è compreso tra il 99,0% e il 99,7%. Al polo positivo si forma ossigeno gassoso che reagisce con il carbone delle barre, consumandole. Si sviluppano ossido, anidride carbonica e calore che contribuisce a mantenere alta la temperatura della miscela. L'alluminio ottenuto dal minerale è classificato come alluminio primario per distinguerlo da quello prodotto per riciclaggio, classificato come alluminio secondario.
La materia prima
Fin dalla metà dell'Ottocento l'allumina viene estratta dalla bauxite, minerale che deve il suo nome al primo giacimento scoperto nel 1822, nei pressi di Les Baux, paesino francese della Provenza. La bauxite è composta in prevalenza da idrato di alluminio, ossido di ferro e altre impurezze tra cui ossido di silicio e di titanio. Da una tonnellata di bauxite commerciale si possono estrarre nel migliore dei casi 0,5 t di allumina. L'Italia ha ridotto negli ultimi anni la produzione di alluminio primario, che viene in prevalenza importato, ma ha incrementato la produzione di alluminio secondario. La produzione mondiale di alluminio nel 2003 è stata di circa 31 milioni di tonnellate, di cui 24 milioni di alluminio primario e 7 milioni di alluminio secondario.
Il riciclaggio
Nel film Ritorno al futuro 2 la macchina del tempo, alimentata da rifiuti, fa il pieno di energia con una lattina vuota. In effetti l'alluminio è una vera e propria riserva di energia accumulata nel processo produttivo ed è riutilizzabile all'infinito. Bastano 70÷75 lattine per riottenere un chilogrammo di alluminio fuso. Se la produzione di un chilogrammo di alluminio primario richiede non meno di 13÷16 chilowattora, un chilogrammo di alluminio secondario ne richiede solo il 5÷10%.
Le applicazioni: dai motori ai compact disc
L'alluminio trova applicazioni sia allo stato puro sia nelle leghe che forma con basse percentuali di rame, manganese, magnesio, silicio e altri componenti. Ciascuna lega presenta proprietà specifiche che la rendono adatta per le testate dei motori, le biciclette, gli aerei, le imbarcazioni, le linee elettriche, gli imballaggi, le costruzioni, i radiatori, gli isolanti termici, gli elettrodomestici, i beni di consumo e cosi via fino ai computer, ai CD, alla produzione di fuochi d'artificio e proiettili. Un'importante applicazione dell'alluminio puro è il processo di riduzione a metallo dei relativi ossidi, noto come alluminotermia per l'elevata temperatura di reazione, di circa 2.500÷2.800 °C.
I rischi
La produzione dell'alluminio richiede, oltre all'estrazione del minerale, anche una grande quantità di energia. L'elevata temperatura necessaria, inoltre, porta alla decomposizione di una minima parte dei fluoruri, componenti il bagno elettrolitico, con immissione nell'atmosfera di composti fluorurati, gassosi dannosi per l'uomo e per l'ambiente pari a 0,5÷1 kg per ogni tonnellata di alluminio prodotto. Anche la quantità di ossidi di carbonio immessi nell'aria è notevole, visto che per ottenere una tonnellata di alluminio si consumano circa 0,5 t di carbone. Sull'uomo, e in particolare su coloro che soffrono di allergie, l'alluminio non sembra avere effetti positivi. Dermatiti, problemi digestivi e neurologici sono fenomeni in aumento in relazione al maggior uso del metallo, in particolare nelle medicine, nel pentolame e negli imballaggi di prodotti alimentari. A tale proposito è bene ricordare che se in generale l'alluminio è chimicamente neutro e resistente alla corrosione, viene invece attaccato e in parte solubilizzato da sostanze acide e da soluzioni saline.
Un metallo prezioso
Lo scrittore francese Jules Verne nel romanzo Dalla Terra alla Luna (1865) esalta le proprietà dell'alluminio e conclude: "Questo prezioso metallo [...] è facilmente modellabile, è molto ben distribuito, in quanto forma la base di molte rocce, è tre volte più leggero dell'acciaio, e sembra essere stato creato espressamente per fornirci il materiale per il nostro proiettile".