Bioenergetica
Bioenergetica
sommario: 1. Introduzione. 2. Forme chimiche di energia: a) introduzione; b) potenziale di riduzione; c) potenziale di idrolisi. 3. Fotosintesi: a) introduzione; b) stati eccitati; c) fotofosforilazione ciclica e non ciclica; d) fotosistemi I e II; e) reazioni in assenza di luce. 4. Ossidazione degli alimenti: a) adeguatezza dell'ossigeno; b) respirazione; c) glicolisi; d) demolizione degli acidi grassi; e) ciclo di Krebs; f) trasporto degli elettroni. 5. Utilizzazione dell'energia: a) sintesi di composti; b) fenomeni di trasporto; c) energia meccanica. 6. Considerazioni finali. □ Bibliografia.
Introduzione
La trasformazione dell'energia è una delle più essenziali funzioni degli organismi viventi. L'energia è necessaria non solo per il movimento, ma per la crescita, per la formazione delle cellule e anche per pensare. L'energia libera è utilizzata per diminuire l'entropia degli organismi viventi: essi sono caratterizzati da una rigorosa organizzazione ed è proprio quest'ultima che, riflessa in una bassa entropia, differenzia la vita dalla morte. L'ordine richiesto per la vita deve essere compensato da disordine a carico di altri sistemi e poiché tutti i sistemi nel tempo si degradano, gli organismi per rimanere ‛organizzati' richiedono un costante apporto di energia libera accoppiata a un efflusso di ‛disordine' rappresentato dall'entropia di piccole molecole come diossido di carbonio e acqua, escrete o evaporate nell'ambiente circostante. Questi due composti (come tutti i composti a basso peso molecolare, e in particolare quelli gassosi) hanno una grande entropia in rapporto al peso perché vi sono più particelle in un grammo con più gradi di libertà traslazionale rispetto agli alimenti (carboidrati, grassi, proteine) da cui originano. L'entropia traslazionale per mole di composto è pari a ²3-R ln M, in cui R è la costante dei gas ed M è il peso molecolare. Ne risulta che grosse molecole hanno più entropia per mole rispetto a molecole più piccole; tuttavia poiché (R ln M + R ln M) > R ln 2M (per M > 2), una mole di una piccola molecola avrà più entropia di una mole di una molecola con peso molecolare doppio. Per di più il CO2 e parte dell'acqua sono escreti come gas, i quali hanno entropia maggiore rispetto ai solidi o ai liquidi.
Quindi la quantità di energia libera richiesta da un organismo dipende non solo dalle esigenze di energia entalpica, ma anche dal grado di organizzazione dello stesso. L'energia libera può essere usata per l'organizzazione di un sistema o per compiere un lavoro: per un dato apporto di energia libera tanto maggiori sono le esigenze di organizzazione, tanto minore il lavoro che può essere compiuto.
Gli organismi possono essere classificati in base alla sorgente di energia che utilizzano: quelli che hanno come sorgente di energia la luce solare sono detti ‛fototrofi' e comprendono la maggior parte delle piante e alcuni Batteri; quelli che utilizzano come sorgente di energia l'ossidazione chimica di combustibili sono detti ‛chemiotrofi'. Questi ultimi possono ulteriormente essere divisi in ‛chemioorganotrofi' quando il ‛combustibile' è di natura organica e ‛chemiolitotrofi' se utilizzano composti inorganici, come idrogeno, zolfo, solfuro di idrogeno o ammoniaca.
Quasi tutta l'energia biologica è in principio ottenuta a spese della luce solare dai ‛fototrofi' tramite i processi di fotosintesi. La fotosintesi produce energia chimica sotto forma di carboidrati e altro materiale organico a partire dal diossido di carbonio e dall'acqua. Solo una piccola percentuale dell'energia proveniente dal Sole è usata per la fotosintesi: sull'intera superficie della Terra solo l'un per mille è sfruttato a scopo fotosintetico, benché tale percentuale possa arrivare al 3% in una fitta foresta. Ciò nondimeno la fotosintesi avviene in grandissima scala sulla Terra: qualcosa come 30-60 miliardi di tonnellate di CO2 sono organicate in un anno dalle piante. Un'alta percentuale, circa la metà, è utilizzata da organismi marini. Quindi negli oceani il processo fotosintetico è meno attivo che altrove.
La fissazione di CO2 per unità di superficie della Terra equivale a circa 1-2 kg di peso secco per anno e per metro quadrato, sia che si tratti di terreno coltivato che di foresta. Per alcuni prodotti, come la canna da zucchero, la fotosintesi produce fino a 9 kg di peso secco per metro quadrato e per anno.
Il materiale organico prodotto nella fotosintesi da un ‛fototrofo' può essere in seguito ossidato dallo stesso organismo o da un organismo ‛chemiotrofo' che si nutre del ‛fototrofo', per produrre energia per il movimento, per il trasporto di ioni contro un gradiente di pressione osmotica, per la sintesi di altri composti e altri usi ancora. Il trasferimento di energia da un organismo fototrofo a uno chemiotrofo è un processo assai poco efficiente. Vi sono due esempi comuni di questo trasferimento: uno è il consumo di materiale vegetale da parte di Batteri o Funghi e l'altro è la digestione degli erbivori, che si nutrono di vegetali.
Circa il 10-20% dell'energia fissata mediante fotosintesi nelle piante viene trasferita agli erbivori. Benché i trasferimenti biologici di energia all'interno dello stesso organismo possano essere estremamente efficienti, il trasporto di energia da un organismo all'altro con l'alimentazione può essere del tutto inefficiente.
Anche l'uomo è ancora strettamente legato alle sorgenti biologiche di energia. Egli può utilizzare la luce del sole per mezzo di macchine solari e sfruttare l'energia nucleare, ma tuttora dipende in gran parte da altri organismi per le trasformazioni energetiche attraverso cui ottiene il suo cibo e i suoi combustibili. Esempi di questa dipendenza sono l'agricoltura e le industrie del petrolio e del carbon fossile.
Possiamo imparare molto osservando le interconversioni biologiche dell'energia, in quanto esse sono efficienti benché avvengano in condizioni molto più blande di quanto l'uomo sia riuscito a produrre. Le cellule possono trasformare l'energia da una forma all'altra in modo estremamente efficiente in soluzioni neutre, alla temperatura corporea e a basse pressioni. Ciò contrasta nettamente con i motori a turbina o a combustione interna, con le batterie elettriche o altri convertitori di energia inventati dall'uomo, che richiedono alte temperature o la presenza di soluzioni fortemente acide o alcaline.
Le trasformazioni biologiche dell'energia differiscono da quelle sperimentate dall'uomo per un altro aspetto. Le cellule conservano l'energia sotto forma di energia chimica e questa viene trasformata direttamente in energia elettrica, in lavoro osmotico e in energia meccanica. L'uomo del XX secolo comincia ora a comprendere come sviluppare energia elettrica direttamente dall'energia chimica sotto forma di celle a combustione, ma non è ancora capace di convertire direttamente l'energia chimica. in energia osmotica, il che gli potrebbe permettere la dissalazione dell'acqua del mare, o in energia meccanica. È sorprendente come non si sia cercato di mettere a punto un convertitore di energia chimica in energia meccanica, processo efficientissimo nei muscoli o nei flagelli dei Batteri. In tutte le macchine da noi costruite l'energia chimica è prima convertita in energia elettrica o termica e, successivamente, in energia meccanica.
Gli organismi non possono lavorare come i motori termici perché questi ultimi richiedono un flusso di calore da un serbatoio a temperatura maggiore a uno a temperatura minore e generalmente gli organismi non hanno compartimenti a differenti temperature. Gli animali a sangue caldo potrebbero eliminare calore nell'ambiente circostante e operare come motori termici in un giorno freddo, ma ciò non sarebbe possibile in un giorno caldo e in ogni caso sarebbe un processo del tutto inefficiente. Per esempio se la temperatura ambiente è 20 °C (293 °K) e l'organismo è a 37°C (310°K)la resa sarebbe solo [(310-293)/310] × 100 = 5,5%, cioè si tratterebbe di un motore termico piuttosto inefficiente.
Forme chimiche di energia
Introduzione
L'energia chimica prontamente disponibile è accumulata nella cellula in due modi principali. I reagenti semplici, ossigeno e acqua, sono sempre disponibili per una cellula aerobica e determinano il modo di accumulo dell'energia. A causa del primo di essi, l'ossigeno, una cellula aerobica può conservare energia sotto forma di composti riducenti; l'ossigeno è un potente ossidante e quindi un forte riducente all'interno di una cellula è potenzialmente una grossa sorgente di energia chimica per la cellula.
Per sfruttare l'altro reagente facilmente disponibile, l'acqua, la cellula può conservare energia, rapidamente impiegabile, in ogni composto che presenti un'elevata energia libera di idrolisi: la forma usuale per l'accumulo di questo tipo di energia è una anidride, particolarmente dell'acido fosforico. Questi due modi di conservare l'energia, come potere riducente e come energia di idrolisi, saranno discussi separatamente.
Potenziale di riduzione
Ogni agente riducente è una sorgente potenziale di energia per una cellula che viva in aerobiosi. In generale questo potrebbe essere il caso dei carboidrati, dei grassi e delle proteine, e in pratica di ogni composto organico. Tuttavia le cellule non sempre dispongono di meccanismi semplici per ossidare le molecole organiche. Per molte molecole l'ossidazione comporta una serie di reazioni, cosicché l'energia non è rapidamente ricavabile da tutti i composti ridotti. Nel caso che gli organismi agissero come macchine termiche e consumassero carburante in una combustione incontrollata, il meccanismo di ossidazione non sarebbe un fattore limitante e gli organismi stessi potrebbero servirsi di qualsiasi composto organico.
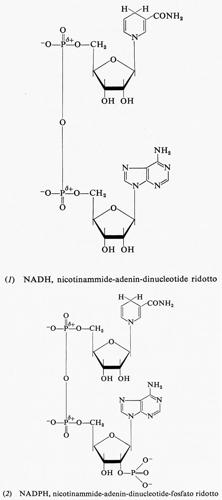
Il potere riducente delle cellule si trova in una forma facilmente utilizzabile: il nicotinammide-adenin-dinucleotide ridotto (NADH) e il nicotinammide-adenin-dinucleotide-fosfato ridotto (NADPH). Entrambi sono derivati ridotti della piridina, che rispondono alle formule (1) e (2) rispettivamente.
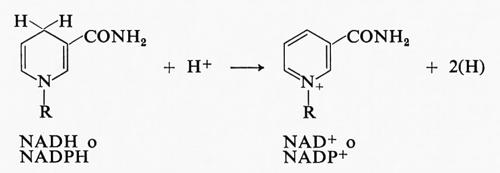
Entrambi sono abbastanza buoni riducenti, con un potenziale di -0,32 V. Quando cedono uno ione idruro nel processo ossidoriduttivo, si trasformano nelle rispettive forme ossidate secondo lo schema:
I composti ossidati sono sinteticamente indicati con NAD+ e NADP+ rispettivamente.
I coenzimi piridinici ridotti possono essere usati come sorgente di equivalenti di riduzione sia nei processi di biosintesi, sia nella produzione di energia. Un esempio di reazione di sintesi operata dai piridin-nucleotidi è la riduzione di composti carbonilici ad alcool. Quando sono utilizzati per produrre energia, essi sono ossidati dall'ossigeno attraverso una serie di reazioni che convertono il potere riducente in energia di idrolisi racchiusa nell'ATP, un composto che sarà esaminato nella sezione seguente. Queste serie di reazioni sono comunemente indicate col nome di ‛catena respiratoria' e saranno discusse in seguito (v. capitolo 4, § f). La variazione complessiva di energia libera per l'ossidazione di un piridin-nucleotide ridotto da parte di un atomo di ossigeno con produzione di acqua è pari al considerevole valore di 40 kcal per mole. La variazione di energia libera in una reazione chimica è data dalla differenza fra l'energia libera dei reagenti e quella dei prodotti. Quindi 40 kcal è l'energia libera di una mole di acqua e di una di NAD+ (ossidato) dopo averne sottratto il valore di 1/2 mole di O2, di una mole di NADH (ridotto) e anche di un grammoione H+, come richiesto dalla stechiometria.
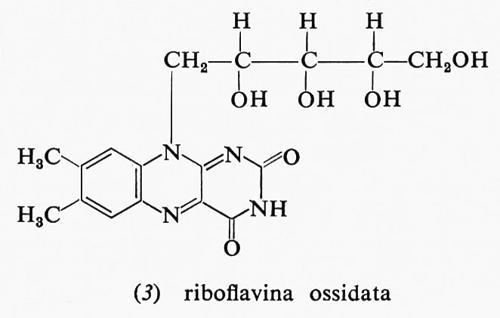
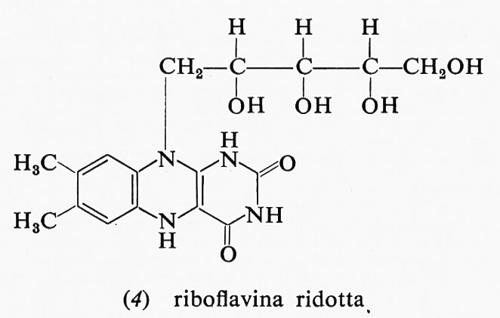
Anche le flavine sono utilizzate come composti di accumulo dell'energia riducente: esse derivano dalla vitamina B2 o riboflavina, le cui forme, ossidata e ridotta, hanno, rispettivamente, le formule (3) e (4).
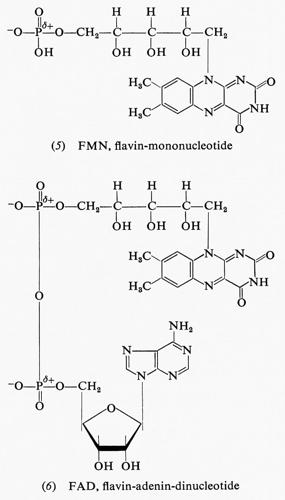
Nelle cellule, in effetti, vi sono derivati della riboflavina: uno è il flavin-mononucleotide o FMN (FMNH2 nella forma ridotta); è formato da una molecola di riboflavina esterificata con acido ortofosforico. L'altro importante derivato flavinico presente nelle cellule è il flavin-adenin-dinucleotide o FAD (FADH2 nella forma ridotta): esso è formato dall'unione di una molecola di FMN con una di acido adenilico. I due composti flavinici hanno le formule (5) e (6), che diamo qui di seguito.
Essi appaiono colorati in giallo brillante nello stato ossidato, ma sono quasi incolori nello stato ridotto. Molti enzimi contenenti flavine sono fortemente colorati: possono apparire rossi, marroni o verdi. I composti flavinici differiscono da quelli piridinici in quanto, mentre qùesti ultimi sono ridotti con meccanismi ionici, i primi possono essere ridotti con la formazione intermedia di radicali. Esiste un prodotto di riduzione parziale con un solo elettrone, a metà strada tra flavina ossidata e ridotta, detto ‛semichinone'. Un substrato può ridurre la fiavina mediante un solo elettrone dando luogo al semichinone; subito dopo un secondo elettrone proveniente dalla stessa molecola di substrato, o da un'altra, porta a termine il processo riduttivo della flavina.
Le flavine ridotte possono essere usate nella sintesi di grosse molecole organiche o possono reagire con l'ossigeno attraverso la stessa serie di reazioni già citata a proposito del NADH, producendo energia di idrolisi sotto forma di ATP. Sia flavine sia derivati piridinici sono presenti in piccole concentrazioni nelle cellule; essi cambiano rapidamente stato di ossidazione per facilitare le interconversioni dell'energia, ma, essendo presenti in concentrazioni basse, non possono rappresentare veri depositi di energia. Il maggior deposito di potere riducente è rappresentato dai grassi e dal glicogeno.
Potenziale di idrolisi
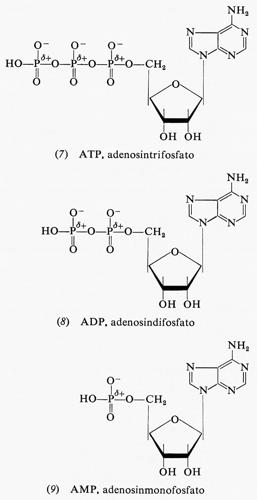
La più importante sorgente di energia immediatamente disponibile da parte della cellula è rappresentata, come riconosciuto dal premio Nobel F. Lipmann, dall'energia libera di idrolisi dell'adenosintrifosfato (ATP), presente nelle cellule in considerevoli quantità (la sua concentrazione varia tra 2 e 15 millimolare). All'ATP e a due dei suoi prodotti di idrolisi corrispondono, rispettivamente, le formule (7), (8) e (9).
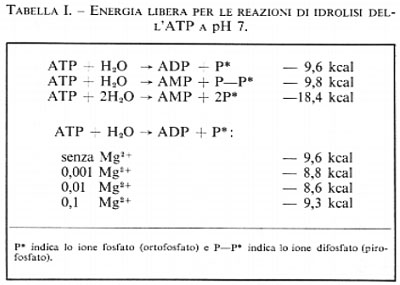
Vi sono, nell'ATP, due legami anidridici, che possono ambedue essere idrolizzati dando luogo all'adenosindifosfato (ADP) più uno ione ortofosfato, o all'adenosinmonofosfato (AMP) più due ioni ortofosfato o, infine, ad AMP più uno ione difosfato. La prima di queste reazioni libera, a pH 7, −9,6 kcal per mole; questa energia può essere adoperata nella fosforilazione di altri composti. L'ATP è un composto abbastanza versatile in quanto, se è richiesta una maggiore energia per una reazione o per ogni altro uso, esso può subire l'idrolisi anche nel secondo legame fosforico, dando luogo ad AMP e difosfato con una liberazione di -9,8 kcal per mole. Tuttavia la susseguente idrolisi del difosfato a pH 7 produce ulteriori −8,6 kcal per mole di energia; quindi l'energia liberata in totale dall'idrolisi dell'ATP ad AMP e due molecole di ortofosfato ammonta a −18,4 kcal per mole a pH 7. Alcune reazioni sfruttano il primo tipo di idrolisi dell'ATP, altre il secondo tipo. Nelle cellule sono sempre presenti ioni magnesio, spesso in concentrazioni relativamente elevate, cosicché la misura dell'energia libera di idrolisi in presenza degli ioni suddetti può dare valori che risultano più rispondenti alla realtà intracellulare.
Questo valore varia in modo complesso in funzione della concentrazione degli ioni magnesio, in quanto questi possono formare complessi sia con i reagenti sia con i prodotti dell'idrolisi. Il valore di -9,6 kcal per la idrolisi dell'ATP a pH 7, a 250 e con una forza ionica di 0,2, diminuisce a −8,8 kcal in presenza di Mg2+ in concentrazione millimolare e ulteriormente a −8,6 kcal se la concentrazione è aumentata di un fattore dieci (0,01M), ma torna ad aumentare fino a −9,3 kcal se la concentrazione di Mg2+ è portata a 0,1M. Inoltre l'ATP può essere idrolizzato in due fasi, prima ad ADP e quindi ad AMP, con produzione di −9,6 kcal e −9,8 kcal rispettivamente. Questi dati sono riassunti nella tab. I.
Vi sono fondati argomenti basati sulla repulsione elettrostatica per spiegare la grande energia libera di idrolisi dell'ATP e dell'ADP. Gli atomi di ossigeno non impegnati tra due atomi di fosforo tendono ad assumere carica negativa a causa del carattere semipolare del doppio legame tra ossigeno e fosforo; queste cariche negative si respingono e conferiscono instabilità all'ATP. Inoltre gli atomi di fosforo carichi positivamente competono per gli elettroni dell'ossigeno interposto. Calcoli teorici indicano che questi atomi di ossigeno sono ancora parzialmente negativi, ma la repulsione tra gli atomi di fosforo positivi è solo debolmente controbilanciata dalla piccola carica negativa sugli atomi di ossigeno.
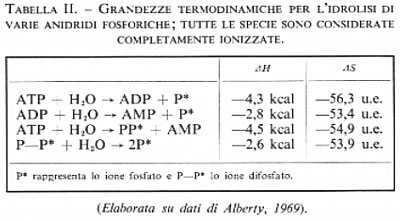
Due fattori influenzano le interazioni elettrostatiche: se gli atomi di fosforo uniti insieme sono tre, ci sarà più repulsione di quando ve ne sono due e ci si può aspettare un'energia libera di idrolisi più negativa. L'altro fattore è la protonazione o l'esterificazione; è difficile valutare a priori questo fattore: si potrebbe ipotizzare che la protonazione o l'esterificazione dovrebbero eliminare una carica negativa e quindi rendere il composto più stabile. D'altro canto si potrebbe pensare che la catena formata dagli atomi di fosforo diventi più positiva in quanto vi è minore donazione di elettroni da parte di un ossigeno neutro rispetto a un ossigeno carico negativamente, cosa che viene confermata dai calcoli, e che una maggiore positività degli atomi di fosforo aumenti la instabilità dell'anidride. Sperimentalmente si è visto che quest'ultimo fattore è preponderante e che l'esterificazione rende l'anidride più instabile. L'effetto elettrostatico è facilmente dimostrabile prendendo in considerazione i valori termodinamici, che sono riportati nella tab. II, di tutte le forme presenti, completamente ionizzate.
In queste Condizioni l'idrolisi di ogni anidride fosforica avviene nello stesso stato di ionizzazione. L'idrolisi produce due protoni e quindi l'entropia della reazione, che dipende fortemente dalla solvatazione dei protoni, è relativamente indipendente dal tipo di legame anidridico idrolizzato. Ciò nondimeno il modo più semplice di eliminare anche questa piccola differenza di entropia è di concentrare la nostra attenzione sull'entalpia, piuttosto che sull'energia libera, di idrolisi. L'entalpia di idrolisi di uno ione difosfato in queste condizioni è −2,6 kcal per mole, che diminuiscono a -2,8 quando una delle cariche negative è neutralizzata tramite l'esterificazione ad ADP. Il fosforo è più positivo quando è esterificato perché esso non può attirare elettroni da un ossigeno esterificato come da un ossigeno carico negativamente. Quando agiscono le repulsioni di tre atomi di fosforo come nell'ATP, l'entalpia di idrolisi decresce a −4,3 e −1,5. Anche in questo caso il valore più basso è quello del legame adiacente all'atomo di fosforo impegnato nel legame estere. Benché le entropie di queste reazioni siano relativamente costanti, c'è una piccola compensazione entropica degli effetti sopra descritti perché è più difficile solvatare nello stesso modo ogni gruppo fosforico in un trifosfato che in un difosfato.
Le reazioni sopra riportate mostrano gli effetti primari che portano all'instabilità delle fosfoanidridi nei confronti dell'idrolisi, ma non sono realistiche per quanto concerne le condizioni sperimentali. Per esempio l'entalpia e l'entropia dell'ultima reazione della tab. II corrispondono alla idrolisi di uno ione difosfato completamente ionizzato in ioni ortofosfato anch'essi completamente ionizzati, in presenza di acido in concentrazione 1 normale. In condizioni sperimentali reali questi valori termodinamici sono complicati dal fatto che spesso reagenti e prodotti sono presenti in più di una forma di ionizzazione.
Un altro fattore che contribuisce notevolmente all'alto valore di energia libera di idrolisi è il calore di neutralizzazione dei protoni che si formano nel corso della reazione. I protoni liberati nel corso di una reazione hanno due effetti: il primo e più importante è di rendere l'entalpia della reazione più negativa, in quanto essi sono parzialmente neutralizzati e le entalpie di neutralizzazione sono elevate; il secondo effetto, che tende a compensare il primo, è di rendere l'entropia della reazione più negativa a causa dell'orientarsi delle molecole del solvente intorno ai piccoli protoni carichi positivamente.
Questo effetto tenderebbe a rendere positiva l'energia libera, ma è minore dell'effetto del calore di neutralizzazione: l'effetto risultante è che l'energia libera di idrolisi diviene più negativa. Ciò è dimostrato dal seguente esempio. A pH 5,0 (forza ionica = 0; 25 °C), l'energia libera per l'idrolisi dell'ATP in ADP e ortofosfato è −8,2 kcal, con un aumento di entropia di +9 u.e. In queste condizioni la reazione non libera protoni. A pH 7,5 invece, mantenendo costanti le altre condizioni sperimentali, si produce un protone e la differenza di entropia diventa negativa (−17,0 u.e.); ciò nondimeno l'energia libera è salita a −9,2 kcal, cioè è più negativa che a pH 5,0. Lo stesso fenomeno si verifica man mano che il numero dei protoni prodotti, all'aumentare del pH, aumenta: l'energia libera di idrolisi diviene più negativa all'aumentare del pH.
Vi sono molte altre molecole capaci di accumulare energia in virtù della loro elevata energia libera di idrolisi e di agire come depositi temporanei di energia o come intermediari reattivi.
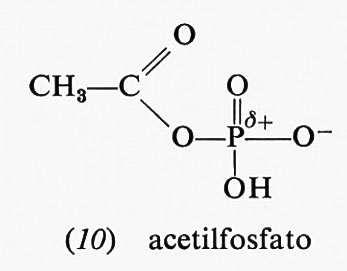
L'acetilfosfato (10), anidride formata da acido acetico e acido fosforico, ha un'alta energia libera di idrolisi
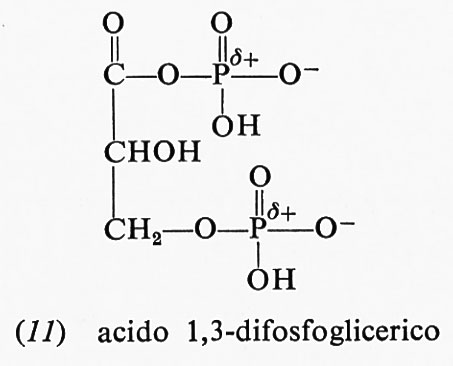
(−10,10 kcal a pH 7,0); uno dei prodotti di idrolisi, lo ione acetato, è stabilizzato dalla risonanza. Tuttavia, la stessa risonanza nell'acetilfosfato forma una carica positiva in vicinanza dell'atomo di fosforo già positivo, cosicché la risonanza stessa diviene molto meno accentuata. Scarsa stabilizzazione da risonanza nei reagenti e grande stabilizzazione da risonanza nei prodotti danno luogo a elevate energie libere di idrolisi. Analogamente anche l'acido 1,3-difosfoglicerico (11), anidride dell'acido fosforico e dell'acido 3-fosfoglicerico, ha un'elevata energia libera
negativa di idrolisi; gli argomenti sopra riportati per spiegare la grande energia libera di idrolisi dell'acetilfosfato sono validi anche per questo composto: la sua energia libera di idrolisi ammonta a −11,80 kcal a pH 7,0 e 25 oC.
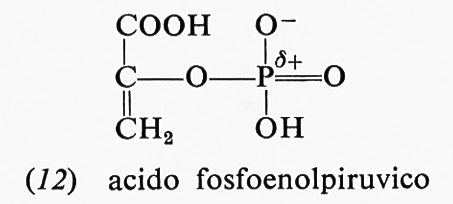
L'acido fosfoenolpiruvico (12) presenta una ancor maggiore energia libera di idrolisi: −14,8 kcal; la maggior
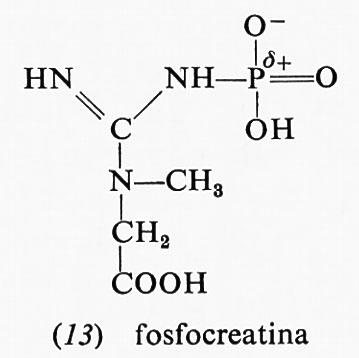
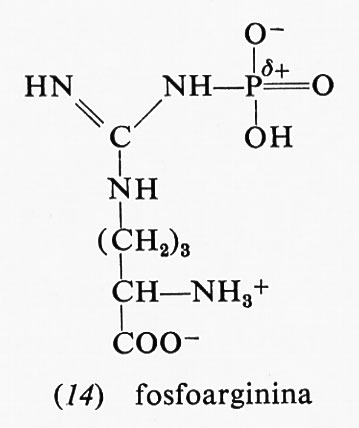
parte di essa è dovuta al fatto che, mentre il reagente è nella forma enolica, il prodotto, l'acido piruvico, è nella forma chetonica: appena il legame estere col fosfato viene idrolizzato, l'acido piruvico si trasforma nella forma che- tonica, che è più stabile. Anche altri due composti fosforici, la fosfocreatina (13) e la fosfoarginina (14), hanno una grande energia libera di idrolisi, i cui valori, a pH 7,0 e 25 °C, sono rispettivamente −10,3 e −7,7 kcal.
Entrambi questi composti sono fosfoguanidine. La guanidina è una base forte in quanto la carica positiva, nella forma protonata, può essere distribuita egualmente sui fre atomi di azoto; la fosfoguanidina, invece, non è una base forte perché l'azoto legato al fosforo non può assumere una carica positiva, data la vicinanza dell'atomo di fosforo positivo. Dopo l'idrolisi si torna a formare la guanidina, base forte che può assumere un protone formando lo ione, reso stabile dalla risonanza. La maggiore stabilità del gruppo guanidinico ionizzato così ottenuto rende la reazione di idrolisi più esoergonica. La fosfocreatina rappresenta il deposito di energia nei muscoli: si forma a spese dell'ATP e può rigenerare l'ATP quando il muscolo ne ha bisogno.
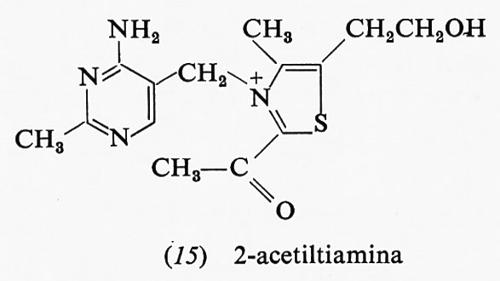
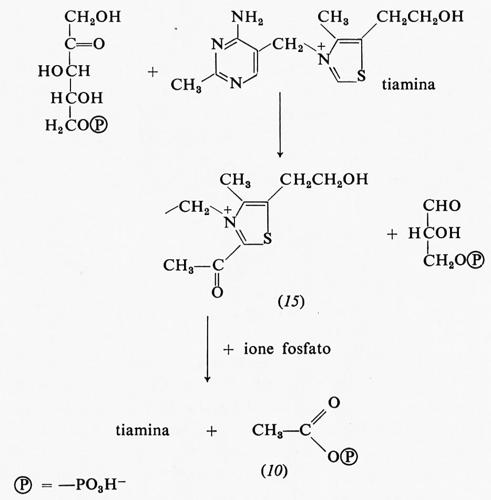
Anche la 2-acetiltiamina (15) ha una grande energia libera di idrolisi; essa è un intermediario della reazione fosfochetolasica che produce acetilfosfato e 3-fosfoglicerai- deide a partire da ribulosio-5-fosfato e acido ortofosforico:
Una risonanza del tipo di quella dei legami estere è impossibile nella 2-acetiltiamina: infatti è impossibile sottrarre elettroni dall'anello carico positivamente per spostarli sull'ossigeno del gruppo carbonilico.
L'acetilcoenzima A, che è un tioestere, presenta un'energia libera di idrolisi nettamente superiore a quella di un normale ossiestere (−8,0 kcal rispetto a −5,1 kcal). Il legame carbonio-zolfo ha pochissimo carattere di doppio legame rispetto al legame carbonio-ossigeno, cosicché in un tioestere vi è minore possibilità di risonanza di tipo estere che nel caso dell'ossiestere; invece in entrambi i casi il prodotto dell'idrolisi è lo ione acetato, reso grandemente stabile dalla risonanza. Dalla minore possibilità di risonanza del tioestere rispetto al comune estere nasce la sua più negativa energia libera di idrolisi.
Gli esteri degli amminoacidi hanno anch'essi un'energia libera di idrolisi a pH 7,0 maggiore dei normali esteri (−8,4 kcal contro −5,1 kcal); rappresentano importanti intermediari nella biosintesi delle proteine. La maggiore energia libera di idrolisi di questi esteri è dovuta alla maggiore stabilità dell'anfione dell'amminoacido formatosi nell'idrolisi a pH 7,0 rispetto alla stabilità dei comuni anioni carbossilici. L'interazione elettrostatica tra le cariche positiva e negativa dell'anfione determina anche la maggiore acidità di un amminoacido rispetto a un normale acido carbossilico.
Fotosintesi
Introduzione
La sorgente primaria dell'energia biologica è la fotosintesi, che avviene negli organismi fototrofi, cioè le piante e alcuni Batteri (v. fotosintesi). Essa consiste nella reazione, indotta dalla luce, tra diossido di carbonio e acqua per dare carboidrati e ossigeno, derivato dall'acqua. La reazione richiede una grande quantità di energia ricavata dalla luce. Infatti il potenziale di ossidoriduzione tra H2O e O2 è di circa +0,8 V e di circa −0,4 V tra CO2 e carboidrati. Una differenza complessiva dii ,2 V comporta un'energia complessiva pari a 4,8 elettronvolt per la riduzione di una mole di CO2, che richiede 4 elettroni. Ciò significa un consumo energetico di 112 kcal per ogni mole di CO2 ridotta.
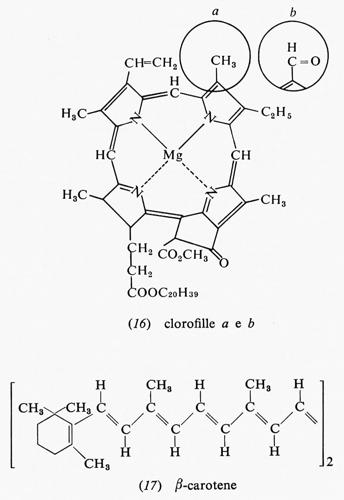
La fotosintesi ha luogo in organuli cellulari detti ‛cloroplasti', i quali contengono le clorofille, pigmenti, come il β-carotene, e molte altre sostanze in un sistema altamente organizzato.
Si pensa che la clorofilla a sia responsabile della conversione dell'energia luminosa in energia chimica. Le clorofille a e b (16), insieme col β-carotene (17), possono anche assorbire la luce e trasmettere l'energia di eccitazione ricavatane alla clorofilla a, che effettua la reazione chimica. Tutti questi composti sono comunemente chiamati ‛antenne' a causa della loro capacità di captare l'energia radiante. Vi sono circa 200 molecole di clorofilla fungenti da antenna per ogni molecola di clorofilla addetta alla conversione dell'energia radiante. Il trasferimento di energia dalle molecole ‛antenna' a quelle chimicamente attive è, con tutta probabilità, estremamente rapido: il processo avverrebbe in 10-10-10-12 secondi. Quando la clorofilla convertitrice di energia radiante assorbe luce o è eccitata da un'altra molecola, in essa un elettrone passa a un orbitale più e- sterno; se questo elettrone ricade nell'orbitale primitivo, vi è emissione di luce fluorescente. Il meccanismo del passaggio di energia dalle ‛antenne' alla clorofilla a è poco noto, ma deve essere estremamente efficiente: esso compete in modo talmente efficace con la fluorescenza, che pure è un processo rapidissimo, da rendere le molecole di clorofilla ‛antenne' completamente non fluorescenti.
Ovviamente una molecola può trasferire energia solo a un'altra molecola che presenti uno stato energetico pari o minore al proprio, ma sicuramente non può trasferirla a una molecola a energia maggiore. I livelli energetici della clorofilla a sono costituiti in modo da risultare a lunghezze d'onda leggermente maggiori, cioè a energie leggermente minori, rispetto alle molecole ‛antenna', così da poter ricevere energia da esse. La clorofilla b assorbe luce di lunghezza d'onda tra 630 e 660 nm e la clorofilla a tra 650 e 680 nm, il che significa che il primo livello eccitato della clorofilla a è a energia leggermente minore del primo livello eccitato della clorofilla b. Benché queste lunghezze d'onda siano nel visibile, posseggono una notevole energia: circa 44 kcal/einstein (mole di fotoni). La luce assorbita è nella parte rossa dello spettro, mentre le altre lunghezze d'onda sono riflesse: questa è la ragione per cui le piante appaiono verdi. Ambedue le cloroflile assorbono luce anche a lunghezza d'onda minore: la a a 430 nm e la b a 455 nm. Anche la luce assorbita a queste lunghezze d'onda può essere usata per la fotosintesi, ma con tutta probabilità lo stato chimico preminente è quello responsabile dell'assorbimento a 650-680 nm da parte della clorofilla a.
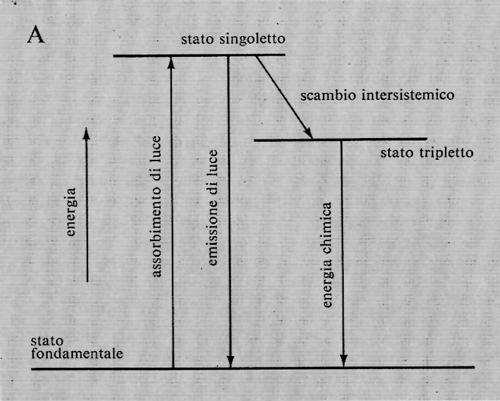
Stati eccitati
Quando una molecola di clorofilla che si trova nello stato fondamentale assorbe energia radiante, un elettrone passa, per eccitazione, da un orbitale stabile a uno a maggiore energia. Poiché in origine nell'orbitale stabile si trovavano due elettroni, uno dei due rimane in esso. Questi due elettroni, quello eccitato e quello rimasto nell'orbitale stabile, si troveranno accoppiati (con spins antiparalleli) nel primo stato eccitato formatosi. Questo stato eccitato è detto ‛singoletto' in quanto in un campo magnetico presenta un solo livello energetico. Se uno dei due elettroni cambia segno di spin divenendo parallelo all'altro, lo stato eccitato è detto ‛tripletto', in quanto sono possibili in un campo magnetico tre differenti orientazioni degli spins, con tre livelli energetici diversi. Il cambiamento di spin da uno stato singoletto a uno tripletto si chiama intersystem crossing (scambio intersistemico). Entrambi gli stati eccitati, singoletto e tripletto, possono reagire chimicamente o emettere una radiazione e tornare allo stato fondamentale. Però le probabilità di emissione con ritorno allo stato fondamentale da uno stato tripletto sono di gran lunga inferiori di quelle da uno stato singoletto. Il più lungo tempo di vita di uno stato tripletto equivale a maggiori probabilità di reazioni chimiche. È quindi ragionevole pensare che lo stato tripletto della clorofilla sia lo stato reattivo nella fotosintesi. Tuttavia è possibile che i reagenti si trovino molto vicini alla molecola di clorofilla, in modo che non sia richiesta una troppo lunga persistenza dello stato eccitato affinché la reazione avvenga. Che i doroplasti debbano essere strutturati in maniera eccellente è dimostrato dal fatto che una delle reazioni ossidoriduttive (tra P-700 e citocromo f, v. sotto, § d) avviene anche a -150 °C. Gli studiosi di biofisica si sono sempre sforzati di comprendere il meccanismo del cambiamento da stato singoletto a tripletto e come quest'ultimo stato nella clorofilla abbia un tempo di vita più lungo del previsto. Generalmente le conversioni singoletto-tripletto sono favorite dai metalli: si potrebbe dunque ipotizzare che questa è la funzione del magnesio nella clorofilla. Spesso si è detto che quando un elettrone della clorofilla viene eccitato può compiere un lavoro nel processo di ritorno allo stato fondamentale, così che una molecola eccitata è una buona sorgente di elettroni e quindi è un buon agente riducente. Però gli elettroni sono impiegati, nel legame chimico, nello stato fondamentale, e quindi l'eccitamento di un elettrone lascia libero un vuoto in cui un altro elettrone può essere risucchiato. Ne risulta che una molecola di clorofilla eccitata non è solo una buona sorgente di elettroni ad alta energia, ma può anche efficacemente attirare elettroni da un riducente. Lo stato eccitato forma sia un buon ossidante sia un buon riducente: se la clorofilla eccitata strappa un elettrone a una sostanza e ne dona uno a un'altra molecola, agisce come una pompa di elettroni, attirando elettroni da una parte e spingendoli dall'altra. Il problema dell'orientazione, cioè il perché la molecola eccitata della clorofilla prende elettroni sempre dalla stessa parte e li cede all'altra, è affascinante e ancora non risolto e deve dipendere in qualche modo dalla differente orientazione degli orbitali nello stato fondamentale e in quello eccitato.
Fotofosforilazione ciclica e non ciclica
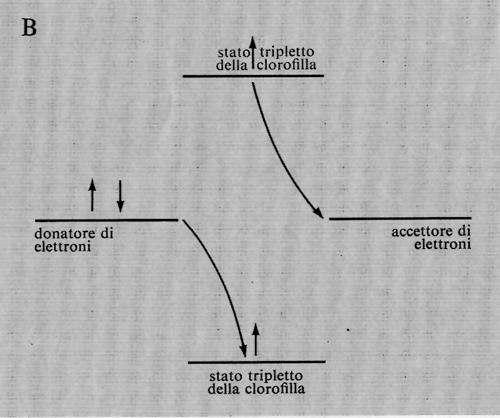
Una volta che l'elettrone passa, per eccitazione, a un orbitale più esterno, presumibilmente nello stato tripletto, si possono ipotizzare due diverse possibilità. Primo, il potere riducente della clorofilla eccitata potrebbe reagire con il potere ossidante della stessa attraverso una serie di reazioni ossidoriduttive che produrrebbero l'energia chimica. L'elettrone potrebbe compiere del lavoro chimico nel ritornare al suo posto rimasto vacante. Lo svantaggio insito in questo meccanismo è rappresentato dal fatto che l'organismo potrebbe ricavarne energia, ma non il potere riducente necessario per la sintesi di molecole organiche a partire dal diossido di carbonio.
La seconda possibilità è che il potere riducente della clorofilla eccitata sia adoperato per ridurre alcuni composti nella cellula, e che il potere ossidante sia destinato alla produzione di un agente ossidante (prrobabilmente l'ossigeno) che possa essere eliminato dalla pianta. La cellula diverrebbe così più ridotta e si potrebbe ottenere energia lasciando reagire i composti ridotti con l'atmosfera ossidante. Anche in questo meccanismo vi è un punto debole: l'organismo dovrebbe sempre produrre composti ridotti quando trasforma l'energia luminosa in energia chimica, senza tener conto della effettiva necessità, da parte sua, di composti riducenti. Tuttavia questo punto potrebbe essere secondario, in quanto l'eccesso di potere riducente potrebbe essere riconvertito in energia; in questo caso la formazione dell'ATP avrebbe luogo in due processi successivi, invece che in un processo diretto.
Gli organismi fototrofi risolvono questo dilemma utilizzando entrambi i meccanismi simultaneamente. Il primo processo è indicato col nome di fotofosforilazione ciclica, il secondo con quello di fotofosforilazione non ciclica. Due elettroni che seguono il processo ciclico producono due molecole di ATP; due elettroni che seguono il processo non ciclico producono una molecola di NADPH (nicotinammide-adenin-dinucleotide-fosfato ridotto) e mezza molecola di ossigeno; l'ossigeno deriva dall'acqua e non dal diossido di carbonio.
L'ossigeno è liberato nell'atmosfera e, poiché il NADPH è un potente riducente, la cellula diviene più ridotta. Sia l'ATP che il NADPH sono sorgenti di energia chimica per l'organismo.
Fotosistemi I e II
R. Emerson ha scoperto che l'efficienza fotosintetica della luce a lunghezze d'onda superiori a 680 nm è incrementata dalla simultanea irradiazione a lunghezza d'onda minore. Inoltre, la fotosintesi totale provocata da due differenti lunghezze d'onda agenti contemporaneamente è maggiore della somma delle efficienze a ciascuna delle due lunghezze d'onda. Questa osservazione ha permesso di formulare l'importante teoria secondo la quale l'assorbimento della luce avviene in due punti diversi della cellula, detti fotosistema I e fotosistema II.
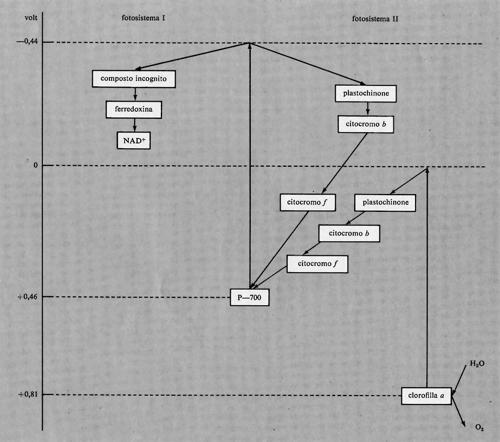
Il centro attivo del fotosistema I è una forma di clorofilla a chiamata P-700 perché questo pigmento assorbe a lunghezze d'onda maggiori di 700 nm, usuale limite per l'assorbimento della normale clorofilla a; il pigmento P-700 è attivo fotochimicamente fino a 730 nm. Il fotosistema I ha tre tipi di molecole-antenna: due diverse clorofille a, che presentano massimi di assorbimento a 695 nm e a 680 nm, e una clorofilla b, che assorbe a 650 nm. Il fotosistema II ha due tipi di antenne: una è una clorofilla a con assorbimento a 675 nm e l'altra è ancora una clorofilla b con massimo a 650 nm.
Il potere riducente del fotosistema I ammonta a circa −0,44 V e può essere sfruttato in due modi. Il primo consiste nella riduzione, con processo di fotofosforilazione non ciclica, di un composto, non ancora identificato, che a sua volta riduce la ferredoxina, la quale infine riduce il NAD+ a NADH. La ferredoxina è una proteina a potenziale di ossidoriduzione relativamente basso, −0,43 V a pH 7,5; essa contiene due atomi di ferro per molecola. Un interessante problema ancora insoluto nel campo della bio- energetica è la base chimica del basso potenziale della fer- redoxina rispetto ai comuni chelati del ferro. Il potere riducente del fotosistema I può essere usato in modo ciclico attraverso una serie di reazioni che riportano il sistema al suo stato iniziale. Queste reazioni interessano il plastochìnone, il citocromo b e il citocromo f; il plastochinone è un chinone con una lunga catena laterale organica; i citocromi b ed f sono ferro-porfirine legate a proteine. Se il fotosistema I agisce in modo non ciclico, viene ridotto dal potere riducente del fotosistema II, che è di 0,0 V. Il foto- sistema I richiede solo +0,46 V per essere ridotto; quindi il potenziale di 0,0 V del fotosistema Il è più che sufficiente. Gli elettroni sono trasportati tra fotosistema I e II da plastochinone, citocromo b e citocromo f Il potere 0ssidante del fotosistema Il (+0,81 V) è abbastanza elevato per produrre ossigeno dall'acqua. L'ossigeno viene liberato dalle piante e così esse aumentano il proprio potere riducente. Il centro attivo del fotosistema Il è la clorofilla a. La sequenza delle reazioni nella riduzione del fotosistema I da parte del fotosistema II è identica a quella della foto- fosforilazione ciclica nel fotosistema I - fotochinone, cito- cromo b e citocromo f.
Reazioni in assenza di luce
Dopo che l'energia luminosa è stata convertita in energia chimica mediante il processo primario della fotosintesi, vi è una serie di reazioni successive che utilizzano questa energia chimica per la riduzione del diossido di carbonio e la produzione di carboidrati. Queste reazioni sono dette ‛reazioni al buio o in assenza di luce', perché non richiedono direttamente energia luminosa, ma solo l'ATP e i coenzimi piridinici ridotti, che sono stati prodotti sotto l'azione della luce.
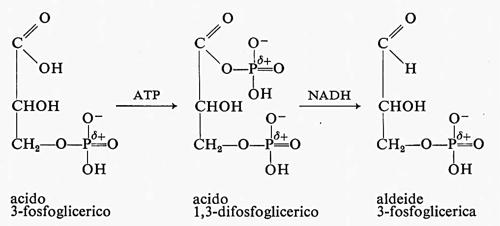
Durante la riduzione del CO2 a glucidi uno dei passaggi importanti, che richiede energia, è la riduzione dell'acido 3-fosfoglicerico a 3-fosfogliceraldeide:
La riduzione di un gruppo carbossilico ad aldeide è difficile a causa della grande stabilizzazione da risonanza dell'anione carbossilato. Infatti il NADH non è un riducente talmente forte da ridurre un acido carbossilico. La natura supera quest'ostacolo molto abilmente: usa prima ATP per fosforilare il gruppo carbossilico dell'acido 3-fosfoglicerico a formare acido 1,3-difosfoglicerico, che ha una stabilizzazione di risonanza notevolmente minore e può essere ridotto del NADH a 3-fosfogliceraldeide.
Ossidazione degli alimenti
Adeguatezza dell'ossigeno
Sia i fototrofi sia i chemiotrofi che dipendono dall'attività biosintetica dei fototrofi possono usare l'ossigeno molecolare per ossidare i composti organici sintetizzati a mezzo della fotosintesi per produrre energia. Questo processo, detto respirazione, può essere comparato con l'uso che fa l'uomo di carburanti per far funzionare le automobili o altri meccanismi. Tuttavia la respirazione si diversifica per il fatto che i carboidrati, i grassi, ecc. sono ossidati dall'ossigeno molecolare a temperatura ambiente in processi strettamente controllati. La combustione dei carburanti nei motori è un processo incontrollato che avviene a temperature elevate.
L'ossigeno è un ossidante ideale che un organismo per diverse ragioni: primo, è un ossidante molto potente; secondo, vi è una barriera cinetica per l'ossidazione da parte dell'ossigeno molecolare; terzo, i suoi prodotti di riduzione sono innocui; e quarto, esso è un gas e quindi prontamente disponibile.
Fortunatamente per noi, l'ossigeno è un potente ossidante: ciò significa che si può ricavare una maggiore quantità di energia da un determinato quantitativo di alimenti. Se noi vivessimo in un'atmosfera con potere ossidante molto minore, dovremmo consumare molto più cibo per produrre la stessa energia; d'altro canto, cittadini di nazioni con agricoltura avanzata potrebbero mangiare dolci coperti di panna montata senza avere preoccupazioni di peso. Quando si dice che un alimento contiene un certo numero di calorie per grammo, ciò significa che la sua ossidazione da parte dell'ossigeno molecolare fino al livello di CO2 e acqua produce quella quantità di calore. Per un ossidante più blando le calorie contenute in una fetta di torta sarebbero di meno.
La barriera cinetica dell'ossigeno è molto importante perché impedisce che gli organismi siano completamente distrutti dall'ossidante. Ovviamente non potremmo sopravvivere in una soluzione di permanganato o di dicromato perché in questo caso non vi sarebbe barriera cinetica e l'intero organismo si trasformerebbe presto in CO2 e acqua. È difficile trovare un altro ossidante potente che sia per di più non reattivo in presenza di materia organica.
Un altro aspetto favorevole dell'ossigeno è che il suo prodotto di riduzione è l'innocua acqua; la maggior parte degli ossidanti efficaci sono ridotti ad acidi forti. Se noi vivessimo in un'atmosfera di cloro, produrremmo acido cloridrico e tutte le proteine e i polisaccaridi sarebbero rapidamente idrolizzati, il che richiederebbe organismi costituiti da materiali più resistenti delle proteine e dei polisaccaridi.
Anche la pronta disponibilità dell'ossigeno in qualità di gas è importante. Un organismo sarebbe in difficoltà se dovesse immagazzinare sia il carburante sia l'agente ossidante, come avviene nel caso dei razzi. L'organismo dovrebbe essere ancora più complesso per immagazzinare entrambi e dovrebbe procacciarsi sia cibo-combustibile sia cibo-agente ossidante. Si può perfino immaginare la possibilità di un'esplosione in caso di rottura, all'interno dell'organismo, dell'isolamento tra i compartimenti del combustibile e dell'ossidante.
Benché finora sia stata sottolineata la produzione di energia da parte delle ossidazioni con l'ossigeno, bisogna chiarire che non tutte le ossidazioni condotte dall'ossigeno sono energetiche. Per esempio l'ossidazione dell'azoto nei suoi ossidi è endotermica. Un organismo non potrebbe essere adattato a vivere a spese dell'azoto o di un metallo nobile. Invece l'ossidazione da parte dell'ossigeno di tutti i composti organici produce grandi quantità di energia. Quindi potenzialmente ogni composto organico può essere un alimento, a condizione che esista un meccanismo per utilizzarlo.
Respirazione
La combustione di materiale organico da parte della cellula è detta respirazione. La respirazione non avviene in tutta la cellula, ma è localizzata in organuli chiamati mitocondri, la cui principale funzione è di fornire energia chimica al resto della cellula e, che quindi possono essere considerati il centro motore della cellula stessa. Questa importante scoperta è stata fatta da A. L. Lehninger quando si trovava nell'Università del Wisconsin. L'energia proveniente dalla combustione degli alimenti è accumulata sotto forma di ATP, come nel caso della fotofosforilazione ciclica. In generale il processo ha una resa di circa il 40%, valore relativamente elevato per un convertitore di energia. Tuttavia bisogna precisare che questo valore è applicabile alla conversione dei combustibili in energia chimica immagazzinata; vi è un'ulteriore perdita quando questa energia è utilizzata per eseguire lavoro meccanico. L'ammontare dell'energia dipende naturalmente dal tipo di combustibile usato, se si tratta cioè di grassi, carboidrati o proteine. I calori di combustione di alcuni tipici costituenti lipidici, glucidici e proteici sono riportati nella tab. III; questi valori rappresentano tutta l'energia disponibile e non l'energia che l'organismo ricava dai composti in questione. L'energia libera per la conversione del glucosio in CO2 e acqua è più negativa (−686 kcal per mole) del calore di combustione suindicato a causa della grande entropia per grammo delle piccole molecole CO2 e acqua. L'aumento totale di entropia è 43,6 u.e. per mole di glucosio ossidato. I grassi, rappresentati qui dall'acido palmitico, producono molta più energia, per grammo di peso, di quella prodotta dai carboidrati e dalla glicina.
Glicolisi
L'ossidazione dei carboidrati (v. metabolismo: metabolismo dei carboidrati) può essere convenientemente divisa in due parti: nella prima, lo zucchero è degradato fino ad acido lattico o acido piruvico; nella seconda, l'acido piruvico è ulteriormente degradato a CO2 e acqua. Il primo processo è detto glicolisi e può aver luogo in assenza di ossigeno, dato che si forma acido lattico. Quando una mole di glucosio è scissa in due moli di acido lattico, la variazione totale di energia libera è solo -52 kcal per mole di glucosio. In questo processo si formano 2 moli di ATP da due moli di ADP e due moli di ortofosfato, con l'impiego di 14 kcal, così che circa il 27% (14 × 100/52) dell'energia totale è conservato dall'organismo come energia chimica durante la glicolisi in anaerobiosi. Quindi si libera poca energia e il processo è relativamente poco efficiente.
L'energia chimica nella glicolisi si produce nel modo seguente. Durante la glicolisi un intermediario della degradazione del glucosio, la 3-fosfogliceraldeide, è ossidato ad acido 3-fosfoglicerico. Per utilizzare l'energia di questa ossidazione come energia chimica, la reazione avviene in due fasi che sono l'inverso di quelle mostrate precedentemente. Dapprima la 3-fosfogliceraldeide è ossidata dal NAD+ in presenza di uno ione fosfato, dando luogo a NADH e acido 1,3-difosfoglicerico. Pertanto una parte del potere riducente della fosfogliceraldeide è conservata come NADH, che può essere in seguito ossidato per produrre ATP. Inoltre l'energia libera di idrolisi dell'acido 1,3-difosfoglicerico a 3-fosfoglicerico a pH 7 è −11,8 kcal per mole, sufficiente a esterificare una molecola di ADP con ortofosfato, producendo ATP. L'acido 1 ,3-difosfoglicerico reagisce con l'ADP, producendo ATP e acido 3-fosfoglicerico, e conservando l'energia di ossidazione residua come ATP.
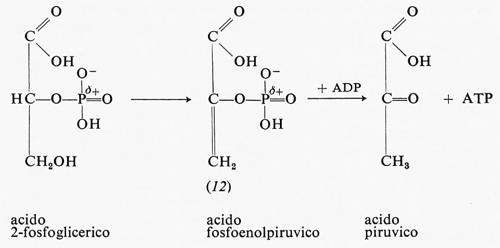
L'altro passaggio, nella glicolisi, che produce energia chimica è l'ossidazione dell'acido 2-fosfoglicerico ad acido piruvico:
L'acido 2-fosfoglicerico è prima ossidato a fosfoenolpiruvico, che reagisce in seguito con l'ADP per produrre ATP. L'ossidazione dell'acido 2-fosfoglicerico a fosfoenolpiruvico produce un estere fosforico instabile. L'energia libera di idrolisi del fosfoenolpiruvato a piruvato e fosfato in soluzione neutra è −12,8 kcal, sicuramente sufficiente per trasportare un gruppo fosforico all'ADP e formare così ATP. La causa della grande energia libera di idrolisi è la maggiore stabilità della forma chetonica dell'acido piruvico, come detto in precedenza.
Demolizione degli acidi grassi
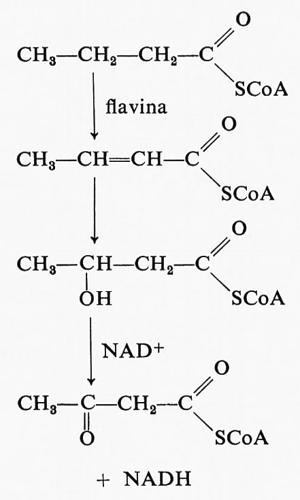
Prima di essere demolito, un acido grasso deve essere esterificato con il coenzima A; ciò richiede energia e infatti in questa fase si consuma una mole di ATP. Tuttavia dopo questo iniziale ‛investimento', grosse rendite di energia sono prodotte dalla ossidazione degli acidi grassi. La trasformazione degli acidi grassi in acetil-CoA produce due tipi di agenti riducenti in due diversi passaggi. L'acetilCoA formatosi entra nel ciclo di Krebs ed è ulteriormente ossidato a CO2 e acqua. Il primo passaggio nel metabolismo degli acidi grassi che produce potere riducente è la reazione dell'acil-CoA con una liavina ossidata, con produzione di un acil-CoA α-β insaturo e dellaliavina ridotta:
Dopo il secondo passaggio, che non richiede intervento di enzimi, il terzo passaggio (v. schema precedente) è l'ossidazione del β-idrossiacil-CoA con il NAD+, con produzione di un gruppo carbonilico e NADH. Durante la degradazione di un acido grasso a 16 atomi di carbonio, come l'acido palmitico, si formano 7 moli di flavina ridotta e altrettante di piridin-nucleotide ridotto. Entrambi questi composti possono reagire con l'ossigeno tramite la catena respiratoria e così formare ATP.
Ciclo di Krebs
Se la cellula dispone di ossigeno, il prodotto della glicolisi è l'acido piruvico, che può essere ulteriormente ossidato a CO2 e acqua nel ciclo di Krebs, proposto per la prima volta da H. A. Krebs e W. A. Johnson nel 1937. Sir Krebs per questa scoperta ricevette il premio Nobel nel 1953. Le cellule aerobiche sono capaci di estrarre dal glucosio molta più energia rispetto a quelle anaerobiche. L'ossidazione totale di una mole di glucosio a CO2 e acqua produce 38 moli di ATP a partire dall'ADP e quindi conserva 266 kcal delle 686 disponibili, ossia il 39%. Le 266 kcal di energia accumulate dalla cellula devono essere comparate alle 14 che una mole di glucosio produce in anaerobiosi. La cospicua differenza è il risultato di due fattori: l'ossidazione aerobica non ha solo più energia a disposizione, ma è anche più efficiente della glicolisi anaerobica. Nel ciclo di Krebs l'acido piruvico è ossidato dando 3 moli di CO2 e 5 moli di composti ridotti da due elettroni ciascuno; di queste cinque, tre sono di NADH, una è di flavina ridotta e una è di NADPH. L'energia della reazione con l'ossigeno di ciascun composto ridotto è sfruttata per esterificare tre molecole di ADP con ortofosfato a dare ATP. 52 kcal sono disponibili per l'ossidazione di ogni NADH da parte dell'ossigeno. Le cinque moli di composti ridotti sono formate nel ciclo di Krebs per mezzo di tre decarbossilazioni ossidative, una insaturazione ossidativa e l'ossidazione di un alcool secondario a chetone.
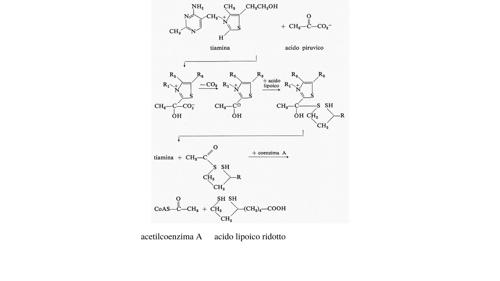
La decarbossilazione dell'acido piruvico e la successiva ossidazione di un intermediario, al livello di ossidazione dell'acetaldeide, per formare un tioestere dell'acido acetico, l'acetilcoenzima A, produce la prima mole di NADH. L'energia libera totale di questa reazione è -8,0 kcal a pH 7. Le reazioni suddette sono qui schematizzate:
In esse sono implicate numerose importanti vitamine. Prima l'acido piruvico si condensa con il tiamin-difosfato, che è l'estere difosforico (pirofosforico) della vitamina B1. Il complesso si decarbossila rapidamente producendo un anione che reagisce con l'acido lipoico dando infine l'acetil-diidrolipoato. La reazione dell'acetil-diidrolipoato con il coenzima A dà luogo all'acetil-CoA e libera l'acido lipoico ridotto, che alla fine riduce il NAD+ a NADH.
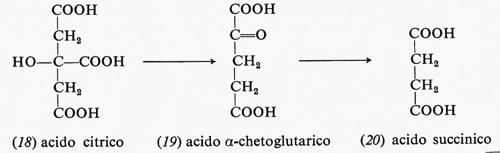
La decarbossilazione ossidativa dell'acido citrico (18) forma, attraverso alcuni intermedi, l'acido α-chetoglutarico (19) e il NADPH dal NADP+: in questa reazione uno ione idruro viene trasferito dal carbonio dell'acido citrico al NADP+ mentre viene liberato CO2.
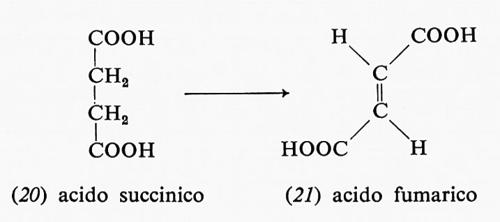
La decarbossilazione ossidativa dell'acido α-chetoglutarico (19) forma l'acido succinico (20) e un'altra mole di NADH con una sequenza di reazioni simili a quella già descritta per la decarbossilazione dell'acido piruvico:
La rimozione ossidativa di due atomi di idrogeno dall'acido succinico (20) produce acido fumarico (21) e la flavina ridotta come FADH2:
Poco si conosce circa il meccanismo di questa reazione: sicuramente è complesso, in quanto l'acido succinico è un composto stabile, poco reattivo. L'enzima contiene quattro atomi di ferro, ma la loro funzione non è ancora nota. Le flavine normalmente operano attraverso la formazione intermedia di radicali, quindi si potrebbe pensare che anche questa reazione sia radicalica.
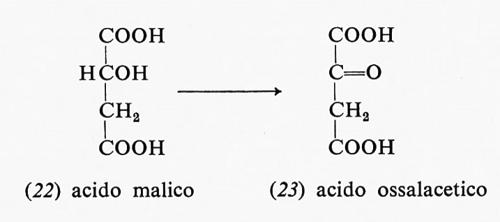
La restante mole di NADH si forma nell'ossidazione dell'acido malico (22) ad acido ossalacetico (23):
Questa reazione consiste nel trasferimento di uno ione idruro dal gruppo alcolico al NAD+. La reazione ha una energia libera positiva (+7,1 kcal a pH 7), ma procede egualmente in quanto nella cellula vi è una concentrazione piccolissima di entrambi i prodotti di reazione, cioè 0ssalacetato e NADH. La concentrazione di questi prodotti è mantenuta a livelli minimi, nella cellula, da reazioni successive. Quindi la reazione è spinta in avanti dalle reazioni successive, che sono favorevoli dal punto di vista energetico.
Trasporto degli elettroni
Il trasporto di elettroni dai substrati ossidabili ai coenzimi piridinici, alle flavine, ai citocromi e all'ossigeno avviene attraverso la sequenza di reazioni qui riportata:
La successione delle ossidoriduzioni è nota, ma i dettagli della formazione delle tre moli di ATP prodotte nella riossidazione dei coenzimi ridotti non sono chiariti.
E. C. Slater ha suggerito una spiegazione chimica secondo la quale si formerebbero composti intermedi reattivi, come nella glicolisi, e questi farebbero reagire l'ADP con l'ortofosfato per produrre ATP. In alternativa P. Mitchell ha proposto una teoria basata sui potenziali elettrici; secondo questa teoria, durante l'ossidazione si verrebbero a formare notevoli differenze di potenziale tra le opposte superfici di una membrana a causa del trasferimento di elettroni, e questi potenziali sarebbero la causa della reazione dello ione fosfato con l'ADP per formare l'ATP.
È noto che il NADH può ridurre una flavina e che questa a sua volta riduce un chinone, producendo nel corso di questo processo la prima mole di ATP. Questo chinone è detto ubichinone a causa della sua ubiquitarietà in tutti i tessuti viventi. L'ubichinone a sua volta riduce il citocromo b, che produce un'altra mole di ATP nel reagire poi con il citocromo c1. Quest'ultimo riduce il citocromo c e questo il citocromo a.
L'ultima mole di ATP si forma quando il citocromo a reagisce con la citocromossidasi (detta anche citocromo a3). La citocromossidasi reagisce direttamente con l'ossigeno. Questa reazione deve comprendere un interessantissimo ‛trucco' in quanto, malgrado la barriera cinetica interposta nella maggior parte delle ossidazioni con l'ossigeno molecolare, è estremamente rapida. Gli altri citocromi non reagiscono direttamente con l'ossigeno. La citocromossidasi contiene due grammoatomi di ferro e due di rame per mole.
I citocromi sono complessi ferro-porfirinici chimicamente legati alla proteina. Le reazioni ossidoriduttive comportano la ossidoriduzione dell'atomo di ferro, dal livello ferroso al ferrico e viceversa. L'anello porfirinico può avere vari sostituenti, ma la maggior parte dei citocromi contiene un chelato del ferro con la protoporfirina IX (24).
Il complesso ferro-porfirina con la proteina è detto eme nello stato ridotto ed ematina in quello ossidato. In questa situazione il ferro è coordinato con quattro azoti, mentre il quinto e il sesto legame di coordinazione sono occupati dall'acqua. Quando l'eme (o l'ematina) è covalentemente legato a una proteina, come nel caso dei citocromi, o quando le posizioni quinta e sesta sono in altro modo occupate, si parla di emocromogeno. La sesta posizione può, nella maggior parte dei citocromi, legarsi con lo ione cianuro o col monossido di carbonio e questa è la causa della grande tossicità di tali composti per quasi tutti gli organismi. Le denominazioni a, b e c dei citocromi si riferiscono al tipo di spettro di assorbimento nello stato ridotto.
Le presenti conoscenze sulla localizzazione dei siti di formazione dell'ATP lungo la catena respiratoria sono il risultato degli studi di A. L. Lehninger, B. Chance, E. Racker e altri.
La reazione del NADH con l'ossigeno, cioè il trasporto di elettroni lungo la catena respiratoria, può aver luogo anche se viene inibita la reazione dell'ADP col fosfato per produrre ATP. Gli inibitori di questa reazione sono detti ‛agenti disaccoppianti'. Il primo di questi, il 2,4 dinitrofenolo, è stato scoperto da W. F. Loomis e F. Lipmann. L'uso di composti del genere ha portato un grande contributo alla scoperta della sequenza di reazioni nella fosforilazione ossidativa.
I componenti ossidoriduttivi della catena respiratoria non sono presenti nel citoplasma come proteine solubili o composti a basso peso molecolare; sono invece localizzati in organuli altamente strutturati in modo che gli elettroni possano fluire dai coenzimi piridinici o flavinici ridotti all'ossigeno quasi come in un circuito elettrico. I citocromi, con l'eccezione del citocromo c, fanno così intimamente parte della membrana mitocondriale che non possono essere cristallizzati come entità separate. La maggior parte degli studi sulla sequenzialità e sulla tenace aderenza di questi componenti è stata effettuata da B. Chance, con metodi di cinetica rapida, e da D. Green.
Ultilizzazione dell'energia
Sintesi di composti
La crescita di certi tipi di cellule può essere molto rapida; ciò richiede numerose sintesi e quindi un buon apporto di energia. Le cellule batteriche possono duplicarsi in 20 minuti: ciò richiede la sintesi a partire dagli amminoacidi, a ogni secondo, di circa 1.000 molecole di proteine aventi ciascuna dai 200 ai 300 legami peptidici. Anche Organismi che in effetti non aumentano di peso possono contenere cellule che metabolizzano molto rapidamente. Per esempio, le cellule epatiche di un ratto adulto compiono ancora una considerevole attività di sintesi e sono a loro volta rimpiazzate da nuove cellule che le vanno sostituendo a velocità misurabili. Anche le cellule appartenenti a tessuti che non sono più in fase di sviluppo continuano ad avvicendarsi molto rapidamente. La semivita del glicogeno nelle cellule epatiche è di solo sei ore.
L'energia è necessaria a vari livelli nei processi di sintesi. Non è solo necessario formare le unità strutturali (amminoacidi, zuccheri e nucleotidi), ma anche riunire insieme queste unità monomeriche in polimeri e questi in organuli subcellulari e infine mantenere l'integrità della cellula in toto. Poco si sa delle esigenze energetiche di questi ultimi due processi.
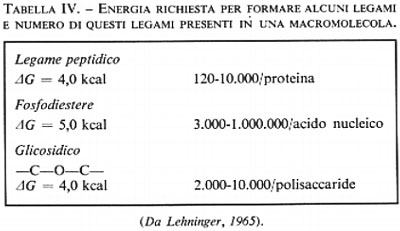
Gli organismi devono consumare grandi quantità di energia per sintetizzare le proteine, gli acidi nucleici, i carboidrati e i lipidi necessari alla crescita. Come si vede nella tab. IV, l'energia richiesta per ciascun legame non è molta, ma un grandissimo numero di questi legami sono necessari per la sintesi delle macromolecole cellulari.
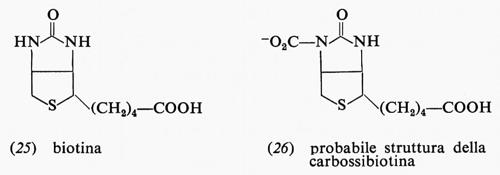
Vi sono molte reazioni di sintesi che richiedono energia: una di queste avviene nella biosintesi dei carboidrati ed è la carbossilazione dell'acido piruvico ad acido ossalacetico (23), con produzione contemporanea di una mole di ADP. A questa reazione partecipa una vitamina, la biotina (25), che diviene carbossibiotina (26). Durante la carbossilazione
l'ATP è idrolizzato ad ADP e fosfato. Presumibilmente l'ATP con il CO2 forma carbonilfosfato, che trasferisce il CO2 alla biotina e infine all'acido piruvico. La reazione nel suo insieme ha una energia libera di −0,5 kcal a pH 7 per la reazione di una mole di piruvato con CO2 e ATP per formare ossalacetato, ADP e fosfato; se l'ATP non fosse idrolizzato in questa reazione, si avrebbe un'energia libera fortemente positiva.
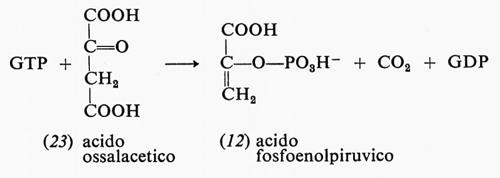
Un'altra reazione, nella sintesi dei carboidrati, che trae energia dall'idrolisi di un estere fosforico è quella dell'acido ossalacetico (23) con il GTP per formare acido fosfoenolpiruvico (12), CO2 e GDP:
Il GTP e il GDP sono simili all'ATP e all'ADP rispettivamente; ne differiscono per la presenza di un'altra base, la guanina, al posto dell'adenina.
L'energia libera di questa reazione a pH 7 è appena positiva (+0,7 kcal), ma sarebbe molto più positiva se non intervenisse l'energia liberata dall'idrolisi del GTP.
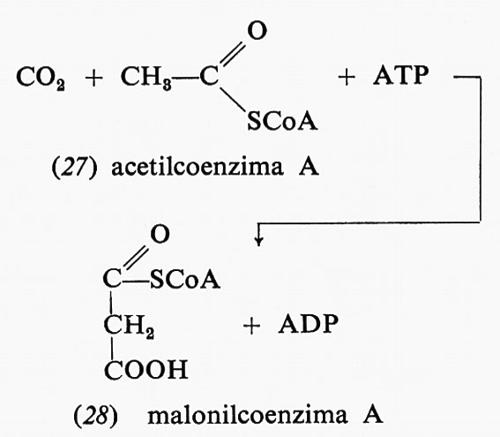
La carbossilazione dell'acetil-CoA (27) a malonil-CoA (28) si verifica durante la biosintesi degli acidi grassi:
Anche questa reazione richiede il consumo di una molecola di ATP, similmente alla carbossilazione dell'acido piruvico nella biosintesi dei carboidrati. Essa richiede la presenza di biotina come catalizzatore. La reazione completa è data da acetil-CoA, CO2 e ATP, che formano malonil-CoA, ADP e fosfato.
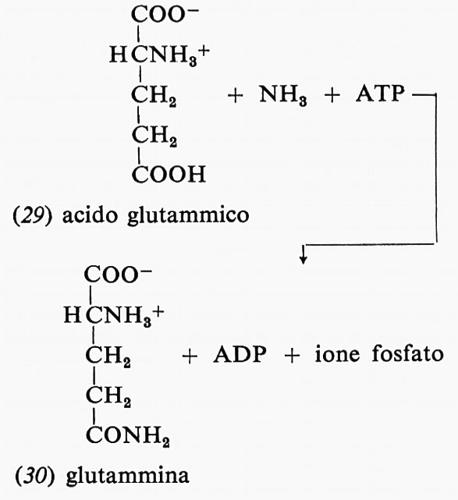
Un altro esempio dell'uso di una molecola di ATP in processi di biosintesi è dato dalla reazione dell'ammoniaca con acido glutammico (29) e ATP per formare glutammina (30), ADP e fosfato:
Analogamente ATP, ammoniaca e acido aspartico formano ADP, asparagina e fosfato.
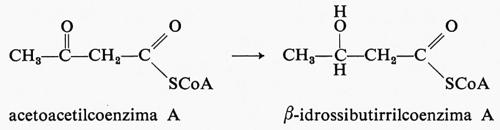
Anche il potere riducente è usato in più occasioni nelle reazioni di biosintesi. Ad esempio nella formazione degli acidi grassi vi è la riduzione da parte del NADPH di un radicale acetoacetico, legato a una proteina, a radicale β-idrossibutirrico:
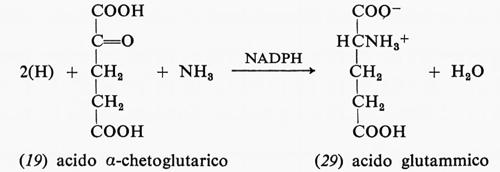
Molte altre reazioni di biosintesi del tipo indicato sfruttano il potere riducente contenuto nel NADH o nel NADPH; quest'ultimo composto viene usato anche nella biosintesi dell'acido glutammico a partire dall'acido α-chetoglutarico; la reazione avviene tra acido α-chetoglutarico (19), ammoniaca e NADPH con produzione di acido glutammico (29) e NAD+:
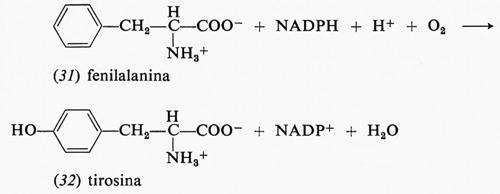
Il potere riducente è necessario per molte reazioni di idrossilazione in cui interviene l'ossigeno molecolare: l'ossigeno è parzialmente ridotto da due elettroni e i due equivalenti di ossidazione residui in esso servono a idrossilare il substrato. In questo caso il riducente agisce in modo leggermente diverso, in quanto queste reazioni non richiedono energia: infatti l'energia libera complessiva, partendo dall'ossigeno e dal substrato per formare il substrato idrossilato, è negativa; però il meccanismo di reazione è poco favorevole e il riducente serve a formare ossigeno cineticamente attivo. Un esempio è costituito dalla sintesi della tirosina a partire dalla fenilalanina: fenilalanina (31), NADPH, un protone e ossigeno molecolare reagiscono insieme dando luogo a tirosina (32), NADP+ e acqua:
Le Leguminose e anche molte altre piante, in combinazione con Batteri, fissano l'azoto molecolare in composti organici; negli amminoacidi e in molti altri composti presenti nelle cellule, l'azoto è al livello di ossidazione dell'ammoniaca. La riduzione di una mole di azoto molecolare ad ammoniaca richiede sei equivalenti di riduzione; sono inoltre necessarie 12 moli di ATP. La fissazione di una mole di azoto è quindi effettuata con notevole dispendio energetico.
Fenomeni di trasporto
Le membrane cellulari sono impermeabili alla maggior parte delle molecole polari e quindi vi deve essere un meccanismo che permetta l'ingresso dei fattori nutritivi nella cellula e l'eliminazione da essa dei prodotti di rifiuto.
Vi sono due tipi di trasporto: attivo e passivo. Il trasporto passivo è quello in cui una molecola specifica è trasportata secondo un gradiente di concentrazione e non contro di esso; questo meccanismo non richiede energia e quindi non sarà ulteriormente considerato in questa sede. Il trasporto attivo si verifica quando la cellula fa passare un composto attraverso una membrana da una concentrazione minore ad una maggiore. Questo trasporto può essere del tutto specifico per un dato tipo di molecola ed è unidirezionale. La velocità di trasporto è funzione, a basse concentrazioni, della concentrazione del composto trasportato, ma diventa indipendente da essa ad alte concentrazioni. Dovendo questa ‛pompa' lavorare contro un gradiente di concentrazione, vi è richiesta di energia. Una delle più spettacolari ‛pompe' è quella che spinge gli idrogenioni dal plasma sanguigno dei Mammiferi, dove la loro concentrazione è 10-7 M, al succo gastrico, dove la concentrazione è decimolare. Questo processo, che comporta l'aumento della concentrazione di un milione di volte, richiede 8,04 kcal per mole di acido.
Un altro esempio è costituito dagli eritrociti, che contengono un'alta concentrazione di potassio ed una piccola concentrazione di sodio, pur essendo immersi nel plasma in cui la concentrazione del sodio è elevata e quella del potassio bassa. Similmente la radice di una pianta è capace di estrarre dal suolo ioni potassio preferenzialmente agli ioni sodio e di portarli nelle cellule a una concentrazione maggiore di quella presente nel terreno circostante. La concentrazione intracellulare degli ioni potassio è mantenuta tra 100 e 150 mM per mezzo di queste ‛pompe' in quasi tutte le cellule. Sembra che i processi riguardanti Na+ e K+ siano accoppiati: lo ione sodio è pompato fuori e contemporaneamente lo ione potassio è aspirato dentro la cellula.
Questi processi richiedono ‛pompe' biologiche azionate dall'ATP: una molecola di ATP viene consumata ogni tre ioni sodio espulsi dalla cellula od ogni due ioni potassio accumulati; una ‛pompa' può spingere circa 20 ioni sodio al secondo.
Anche gli amminoacidi sono spinti nella cellula per mezzo di cinque o forse più ‛pompe'. Le singole pompe sono specifiche per i piccoli amminoacidi neutri, i grandi amminoacidi neutri, gli amminoacidi basici, gli amminoacidi acidi e gli imminoacidi rispettivamente. La presenza di ioni sodio all'esterno sembra favorire l'azione di pompaggio degli amminoacidi verso l'interno della cellula.
Gli zuccheri sono anch'essi pompati nella cellula con un processo che richiede energia; essi possono essere aspirati anche da soluzioni molto diluite. Il reale meccanismo di azione di queste pompe e la struttura delle membrane sono oggetto di ricerche intense, ma molto controverse. Le membrane hanno uno spessore di circa 60-100 Å, mentre gli zuccheri e gli amminoacidi hanno dimensioni intorno ai 5-6 Å: la pompa deve quindi non solo vincere il gradiente di concentrazione, ma anche trasportare la molecola per un certo tratto all'interno della membrana stessa, a meno che non vi siano in essa parti a minore spessore. A. B. Pardee è riuscito a isolare una proteina vettrice responsabile del trasporto dello ione solfato all'interno della cellula. Questo potrebbe essere il primo importante passo per la scoperta di un meccanismo generale. Pompe di questo genere, attive sugli ioni sodio e potassio lungo le fibre nervose, sono responsabili degli impulsi nervosi. Questi si spostano lungo il nervo a una velocità di 10 metri al secondo, come un'onda di variazione della permeabilità della membrana: ciò consente un flusso di Na+ e K+.
Un fenomeno strettamente correlato è la formazione di cariche elettriche: l'interno delle cellule è normalmente 50-70 mV più negativo dall'esterno; ma nei Gimnoti possono formarsi differenze di potenziale, tra una parte e l'altra, di 500 V. La torpedine può dare scariche di 50 A a 50-60 V.
Energia meccanica
Il tessuto muscolare converte l'energia chimica in energia meccanica; la sorgente di energia è l'ATP. Il muscolo è capace di produrre ATP con l'ossidazione dei composti organici. Tuttavia spesso l'ATP è utilizzato più velocemente di quanto possa essere prodotto dalla respirazione. Per permettere al muscolo di continuare a lavorare, al di là della sua capacità di produrre ATP per mezzo di processi ossidativi, vi è nel muscolo un deposito di fosfocreatina, che mantiene l'ATP a concentrazioni elevate fosforilando l'ADP a spese della fosfocreatina stessa, con produzione di ATP e creatina. Il fattore limitante fondamentale nella produzione di ATP nel muscolo è l'apporto di ossigeno; quando la scorta di ossigeno si esaurisce, le cellule muscolari si convertono alla glicolisi anaerobica e producono acido lattico, anche se abbiamo visto prima che questo non è un meccanismo efficiente per la produzione di ATP dal glucosio. L'acido lattico formatosi può essere ulteriormente metabolizzato ossidativamente (v. tessuto muscolare).
I muscoli sono composti di strati di filamenti che scivolano uno sull'altro in una unità detta ‛sarcomero'; il sarcomero consiste in strati alternati di filamenti spessi e sottili, che sembrano fare e disfare molto rapidamente connessioni intrafilamentose mentre il muscolo si contrae. Il sarcomero si può contrarre fino al 20-30% o espandersi fino al 120% delle sue dimensioni in condizioni di riposo.
Un importante gruppo di proteine nel muscolo scheletrico è detto ‛miogene': è idrosolubile e rappresenta circa il 20-25% di tutte le proteine muscolari; il miogene è una miscela di diversi enzimi. La parte proteica insolubile in acqua è composta di tre principali proteine filamentose denominate ‛miosina', ‛actina' e ‛tropomiosina B', oltre a componenti minori che vengono chiamati α-actinina, β-actinina e troponina.
La miosina catalizza l'idrolisi dell'ATP ad ADP e fosfato; essa contiene due lunghissime catene polipeptidiche identiche, dal peso molecolare di 225.000, ciascuna delle quali è formata da circa 1.800 amminoacidi, la più lunga catena polipeptidica naturale conosciuta. Alcuni gruppi solfidrilici di quelli presenti lungo la catena sembrano necessari per l'idrolisi dell'ATP.
L'actina ha un peso molecolare di 46.000; esiste in due forme: una globulare, detta ‛actina G', e una fibrosa polimerica, detta ‛actina F'. L'actina G idrolizza anch'essa l'ATP producendo ADP e fosfato e trasformandosi durante il processo in actina F. Quest'ultima è formata da due catene di actina G monomerica disposte a spirale. La miosina forma complessi molto tenaci, detti ‛actomiosina', sia con l'actina G che con l'actina F. Sembra che l'actina si leghi al sito attivo della miosina, dove avviene l'idrolisi dell'ATP. Quando si aggiungono ATP e ioni magnesio all'actomiosina, l'actina e la miosina si dissociano e l'ATP viene idrolizzato. L'actomiosina costituirebbe i legami tra i filamenti spessi e quelli sottili dei sarcomeri. La tropomiosina esiste in una forma insolubile in acqua, detta A, e una solubile, detta B. La tropomiosina è formata da due catene polipeptidiche simili, dal peso molecolare di circa 70.000. La tropomiosina B forma un complesso con l'actina F.
La contrazione muscolare è scatenata dalla liberazione di ioni calcio: l'importanza della presenza di ioni calcio per l'idrolisi dell'ATP spiega questa funzione scatenante.
Considerazioni finali
Questa rassegna intende essere un tentativo di puntualizzare i fondamenti attuali della bioenergetica e le parti ancora da chiarire.
Una meta impossibile da raggiungere in un articolo cosi breve è di seguire lo sviluppo storico della bioenergetica: il lettore potrebbe avere la falsa impressione che tutto ciò si sia svelato agli occhi di alcuni scienziati in maniera molto logica, senza tener conto dei problemi e dei vicoli ciechi incontrati.
G. W. Lewis e M. Randall hanno detto che la termodinamica potrebbe essere paragonata a una cattedrale antica, in cui la bellezza e la perfezione dell'insieme fanno dimenticare il lavoro degli innumerevoli manovali, il rumore e le impalcature presenti durante la costruzione e perfino quelle ancora presenti in alcune parti in costruzione. Similinente, quando si guarderà indietro allo svilupparsi della bioenergetica nel sec. XX, ci si ricorderà degli archi- tetti, ma si dimenticherà che essi erano esseri umani e si dimenticheranno gli umili operai, le discussioni e il sudore e le lacrime e le delusioni e gli errori, tutti necessari per edificare la struttura della bioenergetica stessa. Anche ora è impossibile ricordare tutti questi elementi, ma è sperabile che il lettore comprenda che molti dettagli della costruzione sono necessariamente stati trascurati in questo articolo.
(L'Autore desidera ringraziare i dott. George Bruening e James N. Lowe per il loro contributo critico alla stesura dell'articolo).
Bibliografia
Alberty, R. A., Effect of pH and metal ion concentration on the equilibrium hydrolysis of adenosine triphosphate to adenosine disphosphate, in ‟Journal of biological chemistry", 1968, CCXLIII, pp. 1337-1343.
Alberty, R. A., Standard Gibbs free energy, enthalpy, and entropy changes as a function of pH and pMg for several reactions involving adenosine phosphates, in ‟Journal of biological chemistry", 1969, CCXLIV, pp. 3290-3302.
Arnon, D. I., The role of light in photosynthesis, in ‟Scientific American", 1960, CCIII, pp. 105-118.
Axelrod, B., Glycolysis, in Metabolic pathways (a cura di D. M. Greenberg), vol. I, New York 19673, pp. 122-145.
Baker, J. J. W., Allen, G. E., Matter, energy and life. An introduction for biology students, Reading, Mass., 1965.
Bassham, J. A., The path of carbon in photosynthesis, in ‟Scientific American", 1962, CCVI, pp. 89-100.
Bendall, J. R., Muscles, molecules, and movement, London 1969.
Boardman, N. K., The photochemical systems of photosynthesis, in Adances in enzymology (a cura di F. F. Nord), vol. XXX, New York 1968, pp. 1-79.
Boyd, D. B., Lipscomb, W. N., Electronic structures for energy-rich phosphates, in ‟Journal of theoretical biology", 1969, XXV, pp. 403-420.
Florkin, M., Stotz, E. H. (a cura di), Comprehensive biochemistry, vol. XXII, Bioenergetics, Amsterdam-London-New York 1967.
Greenberg, D. M. (a cura di), Metabolic pathways, 2 voll., New York 19673.
Grundfest, H., Electric fishes, in ‟Scientific American", 1960, CCIII, pp. 115-124.
Huxley, H. E., The mechanism of muscular contraction, in ‟Science", 1969, CLXIV, pp. 1356-1365.
Ingraham, L. L., Pardee, A. B., Free energy and entropy in metabolism, in Metabolic pathways (a cura di D. M. Greenberg), vol. I, New York 19673, pp. 1-46.
Kalckar, H. M., Biological phosphorylation. Development of concepts, Englewood Cliffs, N. J., 1969.
Kaplan, N. O., Kennedy, E. P., Current aspects of biochemical energetics, New York 1966.
Krebs, H. A., Kornberg, H. L., Energy transformation in living matter, Berlin 1957.
Lehninger, A. L., How cells transform energy, in ‟Scientific American", 1961, CCV, pp. 62-73.
Lehninger, A. L., The mithocondrion: molecular basis of structure and function, New York 1964.
Lehninger, A. L., Bioenergeetics, New York 1965.
Lehninger, A. L., Biochemistry, New York 1970.
Levine, R. P., The mechanism of photosynthesis, in ‟Scientific American", 1969, CCXXI, pp. 58-70.
Meister, A., Biochemistry of the amino acids, 2 voll., New York 19652.
Mitchell, P., Chesmosmotic coupling in oxidative and photosynthetic phosphorylation, in ‟Biological reviews", 1966, XLI, pp. 445-502.
Mitchell, P., Moyle, J., Estimation of membrane potential and pH difference across the cristae membrane of rat liver mitochondria, in ‟European journal of biochemistry", 1969, VII, pp. 471-484.
Morowitz, H. J., Energy flow in biology, New York 1965.
Phillips, R. C., George, S. J. P., Rutman, R. J., Potentiometric studies of the secondary phosphate ionizations of AMP, ADP and ATP, and calculations of thermodynamic data for the hydrolysis reactions, in ‟Biochemistry", 1963, II, pp. 501-508.
Stein, W. D., Movement of molecular across cell membranes, New York 1967.
Stumpf, P. K., Metabolism of fatty acids, in ‟Annual review of biochemistry", 1969, XXXVIII, pp. 159-212.
Vernon, L. P., Seely, G. R., The chlorophylls, New York 1966.