Biologia molecolare
Biologia molecolare
(App. IV, i, p. 291; V, i, p. 378)
Le conoscenze acquisite sulla struttura e la funzione degli acidi nucleici (v. nucleici, acidi, App. IV e V; riproduzione, XXIX, App. III, IV e V; genetica, XVI, App. II, III, IV e V; cromosoma, App. V), nonché quelle ottenute dalle tecnologie di clonaggio molecolare, hanno dato un grande impulso allo sviluppo delle metodologie di b. m., in particolare alle tecniche per la costruzione e l'analisi di genoteche di DNA. Si definisce 'genoteca' o library una collezione di frammenti di DNA, opportunamente modificati, inseriti in specifici vettori di clonaggio (v. biologia molecolare, App. V; trasponibili, elementi, App. V), in modo da generare molecole ricombinanti. I frammenti clonati possono essere di DNA complementare (cDNA), ottenuti per copia dal RNA messaggero (mRNA) a opera della trascrittasi inversa, o di DNA genomico, direttamente provenienti dal materiale genetico della cellula o del tessuto di interesse. Queste molecole vengono successivamente introdotte in cellule batteriche - rese 'competenti' all'introduzione di DNA esogeno - in cui sono in grado di replicarsi come fossero parte integrante del patrimonio genetico dell'ospite. Ogni clone di cellule batteriche conterrà una sola delle diverse molecole ricombinanti: pertanto, per ricercare il clone che contiene il frammento di DNA oggetto di studio, bisognerà analizzare un numero elevato di colonie batteriche.
L'analisi o screening di una genoteca si basa sulle tecniche di ibridazione degli acidi nucleici: un tratto di DNA opportunamente marcato con un isotopo radioattivo, in modo tale da poter essere successivamente seguito, viene usato come sonda o probe per l'ibridazione con le sequenze a esso complementari del cDNA presenti in uno dei cloni batterici della genoteca. Dopo ripetuti lavaggi, la sonda non ibridata viene rimossa e rimane solo quella piccola quota che ha formato un tratto di DNA a doppio filamento. L'individuazione del clone che contiene le sequenze di interesse avviene mediante autoradiografia. Nel caso non si disponga di segmenti di DNA da poter usare come sonde, allora si utilizzano tratti di DNA molto brevi, sintetizzati artificialmente (oligonucleotidi) sulla base della sequenza amminoacidica della proteina che si vuole identificare, previamente trasformata in sequenza nucleotidica.
Alternativamente, le genoteche vengono costruite in opportuni vettori, detti d'espressione, provvisti degli elementi di sequenza necessari per la trascrizione e la traduzione dei cDNA in essi clonati (cosiddette librerie d'espressione). In questo caso, l'identificazione del clone batterico che contiene il cDNA di interesse avviene utilizzando anticorpi diretti contro la proteina che è prodotta dal batterio ospite. In tutti i tipi di genoteca, comunque, quanto maggiore è il numero dei frammenti diversi clonati tanto più essa sarà informativa, cioè più elevata sarà la probabilità che contenga frammenti di DNA corrispondenti a geni presenti in singola o poche copie. Esistono genoteche derivate da specie diverse e, nell'ambito di ciascuna specie, genoteche relative a organi, tessuti, cellule o fasi embrionali diverse.
L'analisi delle genoteche consente l'isolamento di tratti di DNA corrispondenti ai geni di interesse, che potranno così essere caratterizzati, da un punto di vista strutturale, nelle regioni trascritte, introni ed esoni (v. biologia molecolare e genetica, App. V), e nelle sequenze del promotore e di regolazione. L'identificazione di queste ultime è alla base dell'analisi funzionale del gene stesso: infatti un gene, per poter esprimere la sua capacità codificante, cioè per poter funzionare, deve essere trascritto. Nella maggioranza dei casi, la regolazione dell'espressione genica si realizza a livello della trascrizione. Questa ha luogo attraverso l'interazione fra sequenze, generalmente localizzate in prossimità dell'estremità 5′ del gene, e fattori di trascrizione prodotti da altri geni, di solito localizzati su altri cromosomi. Sempre più numerose sono le proteine identificate come fattori di trascrizione. Esse vengono raggruppate in classi, a seconda delle caratteristiche dei due domini da cui sono costituite: quello di legame al DNA (DNA binding domain) e quello di transattivazione, cioè quello responsabile della funzionalità del gene attraverso l'interazione con altri fattori che partecipano alla formazione di un complesso trascrizionale attivo (v. biologia molecolare e zinco, App. V; biochimica, in questa Appendice). I geni di alcuni fattori di trascrizione vengono attivati in fasi specifiche dello sviluppo embrionale, come i geni omeotici, responsabili dell'organizzazione dello sviluppo dell'embrione, per i quali si realizza un'espressione embrionale-specifica. I geni di altri fattori vengono attivati in tessuti diversi, determinando l'espressione tessuto-specifica dei geni bersaglio. Altri ancora rispondono a ormoni o a fattori di crescita, attivando i geni bersaglio in presenza degli stimoli specifici.
Molte proteine che agiscono come fattori di trascrizione sono state isolate e purificate, e di esse è stata determinata la struttura tridimensionale con metodo cristallografico ai raggi X: è stato possibile in questo modo riconoscere, nell'ambito dei singoli domini, gli specifici residui amminoacidici coinvolti nel legame al DNA o con gli altri fattori dell'apparato trascrizionale. Le informazioni raccolte da queste analisi hanno dimostrato che la regolazione dell'espressione genica negli eucarioti è un processo complesso, che coinvolge livelli diversi di organizzazione biologica, sia strutturali sia funzionali.
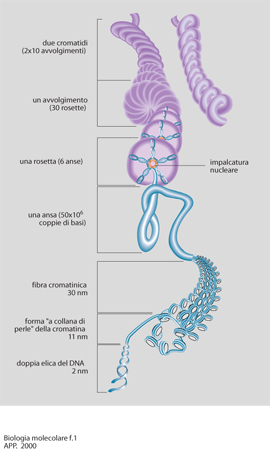
Questo concetto integra le ipotesi di base della b. m. degli anni Settanta-Ottanta, fondate sul presupposto, rivelatosi parziale, che i meccanismi di regolazione degli eucarioti potessero essere estrapolati da quelli dei procarioti. La maggiore complessità è stata ulteriormente confermata dai risultati che nel contempo si sono ottenuti dagli studi sull'organizzazione del genoma degli eucarioti. In questi organismi, infatti, il DNA è complessato a una serie di proteine basiche, gli istoni, con i quali forma livelli di organizzazione sempre più complessi, definiti nel loro insieme cromatina. Erano già noti i livelli più semplici di tale organizzazione costituita dai nucleosomi con la tipica struttura a collana di perle. Livelli più complessi di struttura implicano l'esistenza di regioni di DNA associate ad una impalcatura nucleare, delle anse di DNA che da essa si dipartono, nonché la formazione delle rosette e, dunque, una più articolata composizione dei cromosomi (fig. 1). Nonostante la complessa organizzazione, la cromatina si è rivelata una struttura estremamente flessibile, con la possibilità di formare ripiegamenti che permettono l'avvicinamento di segmenti di DNA anche molto distanti fra di loro.
Questi dati strutturali hanno anche rivelato che negli eucarioti non c'è colinearità fra il DNA e il mRNA perché i geni sono interrotti, sono, cioè, costituiti dalla successione di sequenze codificanti (esoni) e non (introni). I geni, infine, sono intervallati da altre sequenze, relativamente semplici, presenti nel genoma in maniera mediamente o altamente ripetuta. Sono questi tratti di DNA che, pur costituendo gran parte del genoma degli eucarioti, non sono in grado di sintetizzare RNA o proteine funzionanti, ma che hanno invece la proprietà di duplicarsi e di espandersi nel genoma (v. trasponibili, elementi, App. V).
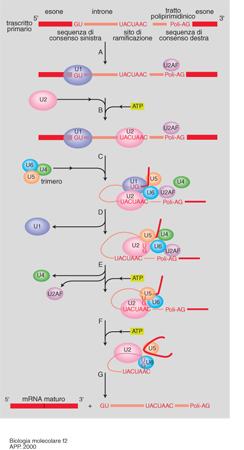
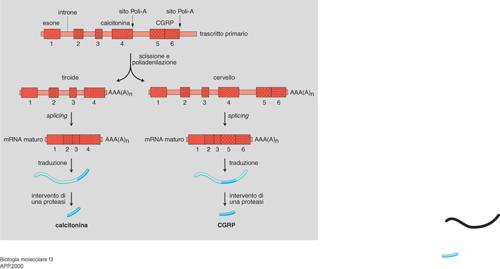
L'esistenza di geni interrotti in introni ed esoni presuppone un'ulteriore tappa di maturazione. Si definisce splicing o 'montaggio' quel processo cui va incontro il prodotto primario della trascrizione, che comporta la giustapposizione dei tratti di RNA corrispondenti agli esoni, in seguito all'eliminazione dei tratti corrispondenti agli introni. Questi ultimi, quindi, pur non avendo potere codificante, vengono trascritti insieme agli esoni, ma devono essere successivamente rimossi. La loro eliminazione richiede l'intervento di particelle ribonucleoproteiche (snNRP, Small nuclear ribonucleoprotein), particelle a localizzazione nucleare costituite da proteine e piccoli RNA (U-RNA, cioè RNA ricchi in uracile), in grado di riconoscere specificamente le giunzioni introne-esone, di idrolizzare i legami fosfodiesterici a livello delle stesse e di riformarne dei nuovi fra due esoni adiacenti, liberando l'introne che viene generalmente degradato (fig. 2). Questa tappa di maturazione del mRNA costituisce un ulteriore livello di regolazione dell'espressione genica: l'assortimento differenziale delle sequenze corrispondenti agli esoni di uno stesso gene, mediante uno splicing alternativo, determina la formazione di messaggeri diversi che producono proteine diverse in cellule diverse, come per il gene della calcitonina. Nelle cellule C della tiroide il trascritto primario viene sottoposto a uno splicing tale da produrre un mRNA maturo che viene poi tradotto nel precursore della calcitonina, un ormone che controlla il metabolismo del calcio e del fosforo. Lo stesso trascritto primario nel cervello va incontro a una maturazione differente con uno splicing diverso, che porta alla formazione di un prodotto definito CGRP (Calcitonin gene related peptide) con funzione di neurotrasmettitore (fig. 3). In altri casi di splicing alternativo, un identico prodotto proteico dello stesso gene viene sintetizzato in tessuti differenti: la stessa α-amilasi è, per es., espressa esclusivamente nelle ghiandole salivari e nel fegato.
La regolazione dell'espressione genica può essere effettuata anche a livello della sintesi proteica, cioè della traduzione. In questo caso la regolazione prevede un meccanismo a feedback negativo che controlla l'assemblaggio del complesso di traduzione.
Il gene della globina, la proteina che lega un gruppo eme contenente ferro e che trasporta l'ossigeno dai polmoni ai tessuti periferici consentendo la respirazione cellulare, costituisce un sistema modello rappresentativo dei vari livelli di regolazione sopra citati. I geni delle globine α e β sono raggruppati su tratti ben distinti di cromosomi diversi e sono organizzati ciascuno in tre esoni e due introni. Per ciascun tipo di globina esistono diversi geni che si esprimono in fasi successive della vita embrionale, fetale e adulta: l'espressione di ciascuno di essi è regolata nel tempo ed è correlata alla fase di sviluppo. Tale espressione differenziale si ottiene attraverso l'interazione di fattori trascrizionali diversi, espressi nelle varie fasi dello sviluppo embrionale, con le sequenze di regolazione poste in prossimità di ciascun gene. Diverse patologie che risultano in una diminuita sintesi di una o più catene polipeptidiche sono ascrivibili a un'alterata o a una mancata trascrizione dei rispettivi geni. Un'alterazione del meccanismo di splicing è responsabile di una forma della β-talassemia, in cui viene prodotta una globina tronca, non funzionale. Infine, è noto che la sintesi delle globine è regolata a livello della traduzione dalla disponibilità dell'eme. Quest'ultimo determina l'attivazione di una chinasi specifica per un fattore di inizio della traduzione; la sua mancata fosforilazione comporta il mancato assemblaggio del complesso di traduzione e, conseguentemente, il blocco della produzione di globine.
Le informazioni sulla regolazione dell'espressione genica sono state ottenute mediante l'utilizzo di colture cellulari in vitro. Esse sono basate essenzialmente sull'analisi dei prodotti dell'espressione di geni introdotti in cellule eucarioti o di geni reporter (geni indicatori o geni di riferimento), la cui espressione dipende direttamente dai tratti di DNA di interesse clonati a monte. La determinazione di un'attività enzimatica normalmente non presente nella cellula viene utilizzata per verificare se un gene è trascritto da parte delle sequenze clonate a monte, e la sua quantificazione viene utilizzata come indice del livello di espressione. A queste metodiche, più di recente, se ne sono affiancate altre che prevedono l'utilizzo di animali e sono più rappresentative dell'andamento dei processi biologici che si svolgono in vivo. Uno degli strumenti maggiormente utilizzati è rappresentato dagli animali transgenici, cioè animali in cui è stato inserito un tratto di DNA corrispondente a un gene di un'altra specie. Questi organismi consentono di studiare i vari livelli di regolazione dell'espressione del gene esogeno in un contesto più fisiologico, quale quello dell'animale in toto, che include anche le molteplici interazioni umorali, ormonali e nervose. La metodologia degli animali transgenici si sta sviluppando sempre più, anche in funzione delle applicazioni biotecnologiche che questa tecnica offre. È infatti possibile generare animali di grandezza superiore alla norma, quali storioni, trote, salmoni, inserendo e facendo esprimere in tempi e tessuti opportuni il gene per l'ormone della crescita; ovvero è possibile far produrre dalle mucche proteine del latte di origine umana, inserendo e facendo esprimere opportunamente geni per proteine umane presenti nel latte (v. biotecnologia: Animali transgenici; clonazione, in questa Appendice). Gli scenari futuri che si aprono per le applicazioni di questa tecnica sono sempre più ampi e non del tutto prevedibili.
Un'ulteriore estensione di questa tecnica prevede la possibilità di sostituire un gene con un altro variamente modificato nel suo stesso locus cromosomico, mediante la tecnica della ricombinazione omologa o tecnica del knock out genico. La ricombinazione omologa è quel processo di scambio di tratti omologhi di DNA, che avviene normalmente e a bassa frequenza nella cellula e che è responsabile, fra l'altro, del fenomeno del crossing over fra cromatidi omologhi nel corso del processo della meiosi. La tecnica del knock out si riferisce in particolare allo scambio che avviene in cellule embrionali staminali totipotenti, dette ES (Embryonic Staminal), tra le sequenze di un gene nella sua localizzazione cromosomica e quelle dello stesso gene introdotto dall'esterno, clonato in un vettore e opportunamente modificato con l'inserimento di un gene per la resistenza agli antibiotici. Le cellule ES in cui è avvenuto l'evento di ricombinazione, selezionate per la resistenza all'antibiotico, vengono iniettate in una blastocisti e quest'ultima impiantata nell'utero di una topina gravida. Se lo sviluppo embrionale avviene regolarmente, nasceranno dei topini con un patrimonio genetico chimerico, da cui, per incroci successivi, sarà possibile ottenere topini contenenti una sola o entrambe le copie del gene inattivato, cioè topini eterozigoti od omozigoti per il gene mutato. È possibile in questo modo stabilire se quel gene è indispensabile per lo sviluppo dell'embrione, in quale fase e in quali abbozzi di tessuti esso è richiesto, con quali prodotti di altri geni interagisce. Con questa tecnica si sono ottenute informazioni fondamentali per la comprensione del ruolo che i diversi geni svolgono nelle varie fasi di sviluppo dell'intero organismo e nello sviluppo di organi o tessuti particolari.
I risultati lusinghieri hanno anche orientato la ricerca verso una possibile applicazione di tale tecnica per sostituire un gene malato con il corrispondente gene sano: è stato questo il principio di base della terapia genica (v. in App. V), utilizzata per introdurre una copia normale di un gene in sostituzione di una alterata, non funzionante. Dal momento che la frequenza con cui si verifica la ricombinazione omologa è molto bassa, la tecnica del knock out genico è utilizzata raramente per la terapia genica; più frequentemente, a questo scopo, vengono utilizzate metodiche che fanno uso di vettori di tipo retrovirale o derivati del virus adeno, opportunamente modificati, che garantiscono maggiore probabilità di successo. Questi vettori, in genere, conservano solo le sequenze importanti per l'integrazione del virus nel genoma ospite e per la sua replicazione, mentre le sequenze di regolazione sono quelle del gene umano e contengono gli elementi di sequenza che ne regolano l'espressione. I vettori con i geni clonati vengono introdotti in cellule dove normalmente si esprime il gene di interesse, o in cellule che si dividono rapidamente e che quindi possono integrare nel proprio genoma con frequenza più alta il gene introdotto dall'esterno. In sistemi sperimentali viene riportato un numero sempre maggiore di casi in cui un gene in qualche modo alterato viene sostituito da uno funzionante, che viene regolato e che risponde agli stessi stimoli del gene naturale, assicurando il ripristino di quella funzione della cellula. È invece ancora molto limitato il successo nella pratica clinica. Più di recente, questo tipo di approccio è stato utilizzato anche in particolari forme di tumori: in questo caso, si usano vettori che contengono un gene il cui prodotto è tossico per la cellula che lo esprime, determinandone, pertanto, la morte. Questi vettori vengono introdotti in tutte le cellule di un particolare distretto, ma il gene 'suicida' si esprime solo nelle cellule tumorali, perché si utilizzano opportuni promotori attivi solo in esse. Il risultato è la morte delle cellule trasformate, la riduzione della massa tumorale e, in alcuni casi, la sua totale eradicazione.
Gli sviluppi più recenti della b. m. si sono concentrati sulle possibili applicazioni alla medicina, come per es. la diagnosi precoce di patologie a determinazione genetica. I. RFLP (Restriction Fragment Length Polymorphism; v. biologia molecolare, App. V) sono determinati dalle variazioni individuali di lunghezza dei frammenti del DNA sottoposto a digestione con enzimi di restrizione. Tale variabilità individuale del DNA, rivelata dai RFLP sia intra- sia extragenici lungo un tratto di un cromosoma, è utilizzata per stabilire un legame genetico con il gene putativo, ancora sconosciuto, ritenuto responsabile della patologia nelle famiglie in cui essa si manifesta. Infatti, il ritrovamento del profilo di restrizione o aplotipo caratteristico del soggetto malato anche in altri membri della famiglia, in cui non si è ancora manifestata la malattia, è indicativo dell'avvenuta trasmissione dell'allele mutato e quindi della possibilità di sviluppare la malattia. L'identificazione e la mappatura di un numero sempre più elevato di marker polimorfici su un dato tratto cromosomico permettono di restringere la regione dove è localizzato il gene ritenuto responsabile della malattia.
Questo approccio sperimentale, definito positional cloning, consente di riconoscere il gene ritenuto responsabile di una patologia non direttamente, ma attraverso la trasmissione del tratto di cromosoma dove è localizzato l'allele mutato. L'isolamento del gene responsabile viene poi effettuato facendo uso di genoteche di DNA genomico, contenenti frammenti di DNA i più lunghi possibile. Sono stati per questo costruiti i vettori YAC (Yeast Artificial Chromosomes), capaci di contenere frammenti di DNA lunghi fino a 1000 o più kilobasi (v. biologia molecolare, App. V). L'analisi del contenuto di questi YAC, il corretto posizionamento dei vari frammenti, l'identificazione del gene e del suo prodotto di trascrizione hanno permesso di riconoscere i geni responsabili di molte malattie: la distrofia muscolare di Duchenne, che è dovuta a un'alterazione del gene della distrofina, una proteina del citoscheletro delle cellule muscolari; la fibrosi cistica, che è causata da un'alterazione di un gene il quale codifica per una proteina dei canali del cloro delle cellule epiteliali.
Il numero dei geni identificati in questo modo va aumentando sempre di più, soprattutto negli ultimi anni Novanta, in seguito al perfezionamento e al maggior uso di queste tecniche. Molti di essi si sono rivelati particolarmente complessi: si estendono su tratti di DNA insolitamente lunghi; sono costituiti da un numero elevato di esoni intervallati da introni molto lunghi; infine, la determinazione della loro struttura e della sequenza del DNA ha reso possibile il riconoscimento delle mutazioni che sottendono le corrispondenti patologie. La possibilità di effettuare diagnosi corretta e precoce di patologie invalidanti e con prognosi infausta è diventata ancora più concreta con l'introduzione della tecnica della PCR (Polymerase Chain Reaction). Questa tecnica consente di amplificare, cioè di ottenere grandi quantità di frammenti di DNA anche se presenti nel genoma in singola copia e a partire da quantità minime di materiale.
Per ottenere ciò è necessario che siano note la struttura e la sequenza del gene di interesse e sia disponibile una particolare DNA polimerasi, la Taq polimerasi. Questa si ottiene dal batterio termofilo Termus aquaticus, organismo che vive ad alte temperature, capace di sintetizzare molecole nuove di DNA alla temperatura di 72 °C, quindi con un'altissima specificità ed efficienza. Come inneschi della reazione vengono utilizzati oligonucleotidi sintetizzati in maniera specifica sulla sequenza del DNA da amplificare. I prodotti dell'amplificazione vengono successivamente analizzati mediante sequenziamento del DNA o per digestione con enzimi di restrizione, se le mutazioni responsabili della malattia determinano una variazione a carico di una sequenza riconosciuta da uno di tali enzimi. È possibile così eseguire diagnosi genetica e molecolare e stabilire la trasmissione dell'allele mutato. Se la patologia ereditaria di interesse non si manifesta alla nascita ma solo successivamente, allora la possibilità di effettuare diagnosi genetica precoce acquista ancora maggiore interesse, perché si può procedere a opportuni e risolutivi interventi terapeutici.
Le tecniche di b. m. consentono anche di analizzare materiale biologico prelevato dal feto nel corso della gravidanza per effettuare diagnosi prenatale: sapere se il prodotto del concepimento è portatore di un allele alterato associato a una patologia offre, anche in questo caso, la possibilità di scelta di opportuni interventi terapeutici. Si sono particolarmente sviluppate, perciò, delle metodologie atte a evidenziare la presenza di mutazioni del DNA responsabili di malattie. Queste metodiche consentono anche di mettere in evidenza variazioni individuali a carico delle sequenze dette 'altamente ripetute'. Sono queste sequenze semplici di DNA che non hanno potere codificante, a cui è associata probabilmente una funzione strutturale e che sono distribuite in tutti i cromosomi. Le sequenze del tipo STR (Simple Tandem Repeats) o del tipo VNTR (Variable Number of Tandem Repeats) sono molto variabili e contemporaneamente assai specifiche, nel senso che è molto bassa la probabilità che uno stesso profilo si ritrovi in due individui diversi.
L'univocità del reperto viene per questo utilizzata in medicina legale, per es. quale prova di riconoscimento di un individuo sospettato di un reato (il cosiddetto Test del DNA). Il materiale biologico ritrovato sul luogo di un delitto viene utilizzato quale fonte per l'estrazione del DNA e l'analisi dei marker succitati. I profili vengono confrontati con quelli ottenuti sul DNA di una serie di individui, fra cui quello del sospettato del reato stesso. Nel caso in cui i profili coincidano, la probabilità che quell'individuo sia il responsabile del reato è molto alta. Quest'analisi viene condotta anche per quei casi in cui è richiesto il riconoscimento della paternità. Infatti, la serie di bande che si ritrovano all'analisi del DNA di un figlio derivano da quelle del padre e della madre. La presenza di bande completamente non correlate depone per una diversa paternità. Ancora, questo tipo di analisi è stato recentemente esteso all'analisi del patrimonio genetico di particolari animali e di piante, allo scopo di poter riconoscere genotipicamente gli appartenenti a un determinato ceppo, per es. per proteggerlo o mantenerlo il più possibile puro o per potersi fregiare dei marchi DOC.
Anche i prodotti proteici dei geni responsabili di varie patologie si sono avvalsi dei progressi compiuti nella purificazione e nell'analisi cristallografica ai raggi X. Questi studi sono particolarmente interessanti, perché consentono di stabilire la configurazione spaziale della molecola di interesse e le interazioni con altre molecole. Essi hanno anche consentito di determinare gli effetti di varie mutazioni sulla struttura e, in definitiva, sulla loro funzione. Facendo uso di programmi al computer, si sono potuti costruire modelli tridimensionali delle molecole e di loro ipotetici ligandi. Il principio che sottende questo approccio è quello di sintetizzare molecole con attività biologiche che siano il più possibile simili ai prodotti naturali, in modo da usare dosaggi particolarmente bassi, riducendo la possibilità di effetti collaterali indesiderati. Tali molecole vengono analizzate in sistemi in vitro e in sistemi animali per verificarne l'efficacia ed, eventualmente, operare ulteriori modifiche atte a migliorarne gli effetti.
È possibile con questo approccio ottenere molecole da utilizzare nella pratica clinica, agendo selettivamente su specifiche funzioni. Analoghi funzionali di molecole naturali con attività agonista o antagonista vengono anche ottenuti sintetizzando peptidi corrispondenti solo a parti ben definite delle molecole biologiche di interesse, ma con funzioni ben precise, rilevate proprio in base agli studi cristallografici. Mimando solo alcune funzioni, è possibile bloccare gli effetti globali della molecola. È questo il caso di analoghi di ligandi di vari recettori di membrana, che, interagendo con il recettore, lo 'occupano' bloccando la sua capacità di trasdurre il segnale all'interno della cellula. Altri peptidi tendono a interagire con il dominio intracellulare di recettori di membrana, saturandoli e bloccando anche in questo caso la trasmissione di segnali extracellulari. L'approccio si sta rivelando particolarmente promettente nella sintesi di peptidi che eliminano la funzionalità di recettori di membrana con attività tirosino-chinasica, che sono risultati mutati e costitutivamente attivati in una serie di tumori.
Un'estensione complementare di questo approccio è rappresentata dalle librerie di epitopi. Si intende con questo termine la collezione di cloni fagici che esprimono una varietà di piccoli peptidi, composti da cinque a quindici amminoacidi in sequenza assolutamente casuale, come parte integrante di alcune proteine del microrganismo utilizzato come vettore. Tali genoteche vengono costruite a partire da segmenti di DNA esogeno, corrispondenti ai diversi epitopi. Questi vengono clonati in geni che codificano proteine localizzate nel rivestimento del fago usato come vettore di clonaggio. Vengono in genere utilizzate la proteina piii (disposta all'estremità del virus) o la pviii (che costituisce l'involucro che circonda il DNA) del fago M13, che sono espresse in un alto numero di copie. Pertanto, ogni particella fagica esprimerà in superficie uno solo dei molteplici epitopi, che può essere così facilmente selezionato. L'analisi o screening di tali librerie viene condotta cimentando la genoteca con una macromolecola, immobilizzata su una matrice insolubile, verso la quale i peptidi rivelano una certa affinità. Solo i fagi che dispiegano peptidi affini alla macromolecola fissata al supporto verranno trattenuti, gli altri verranno eliminati.
Se si ricercano peptidi in grado di riconoscere e legare un recettore, si eseguiranno saggi di legame e si selezioneranno i cloni in base alla loro affinità. Nel caso si ricerchino peptidi come substrati di enzimi, si eseguiranno saggi per quella particolare attività enzimatica e, ancora una volta, si sceglieranno quelli che presentano la maggiore affinità. I cloni risultati positivi a questi saggi biologici vengono sottoposti a cicli successivi di analisi, allo scopo di arricchirli e di selezionare solo quella piccola sottopopolazione di varianti che presenta la più alta affinità verso la molecola usata come bersaglio.
Questa tecnologia si è rivelata particolarmente potente perché consente di 'ingegnerizzare' i peptidi, in modo da migliorarne la funzionalità. Queste nuove molecole artificiali potranno essere sottoposte agli stessi procedimenti di analisi di quelle naturali: potranno essere purificate e utilizzate in sistemi in vitro e in vivo; se ne potranno determinare le proprietà biologiche in funzione della dose; se ne potranno misurare l'emivita e i possibili effetti collaterali indesiderati.
La tecnica è utilizzata per l'identificazione di molecole simili agli anticorpi (frammenti Fab e anticorpi a singola catena), epitopi antigenici, inibitori enzimatici, peptidi neutralizzanti o inattivanti o che invece mimano l'azione di ormoni, fattori di crescita o di importanti citochine. Questo approccio viene anche utilizzato per l'identificazione di peptidi capaci di riconoscere e di interagire con regioni importanti di proteine virali neutralizzandone l'attività.
Infine, queste molecole, di cui viene studiata sia la sequenza amminoacidica sia la particolare struttura tridimensionale, costituiscono uno degli sviluppi più promettenti della b. m., perché rappresentano le molecole di partenza per allestire vaccini contro malattie a diffusione endemica, quali le epatiti ancora poco definite e, in prospettiva, anche contro l'AIDS.
bibliografia
A.L. Lehninger, D.L. Nelson, M.M. Cox, Principles of biochemistry, New York 1982 (trad. it. Bologna 1983, 1994²).
H. Lodish, J. Darnell, D. Baltimore, Molecular cell biology, New York 1986, 1995³ (trad. it. Bologna 1994).
J.-C. Kaplan, M. Delpech, Biologie moléculaire et médecine, Paris 1989 (trad. it. Napoli 1995).
Combinatorial chemistry, ed. J.N. Abelson, San Diego 1996.
B. Lewin, Gene vi, Oxford-New York-Tokyo 1997.