BIOTECNOLOGIE
BIOTECNOLOGIE
Biotecnologie del genoma.Deep sequencing. Sequenziamento per lo studio dell’evoluzione. Biotecnologie della manipolazione embrionale. Cellule staminali embrionali umane e cellule riprogrammate. Clonazione. Sviluppi controversi e sorprendenti. Bibliografia
Si può intendere per b. un insieme di tecniche, procedure e approcci che sfruttano proprietà dei viventi per ottenere un beneficio per l’umanità. Per questo motivo, le b. aumentano in complessità parallelamente all’aumento delle conoscenze nel settore della biologia e a loro volta contribuiscono alla comprensione dei fenomeni vitali. La seconda metà del 20° sec. ha visto l’inizio del periodo d’oro della biologia e conseguentemente delle b., e negli ultimi 10 anni le scoperte e le applicazioni biotecnologiche hanno continuato a crescere a un ritmo elevato e ad aprire scenari inattesi.
Biotecnologie del genoma. – Deep sequencing. – Gli enormi progressi nella capacità di sequenziamento del DNA (Deoxyribo Nucleic Acid) e la conseguente diminuzione dei costi sono senz’altro il fattore più rilevante che ha contribuito a espandere l’ambito delle analisi genomiche, tanto che oggi è possibile ottenere giornalmente con un so lo strumento la sequenza grezza di milioni di nucleotidi (sequenziamento massivo di DNA, deep sequencing), ossia le lettere dell’alfabeto del vivente. È quindi sorto il problema del l’analisi di tale elevatissima quantità di dati. Questo ha stimolato lo sviluppo del settore della bioinformatica genomica. Il miglioramento tecnologico si è tradotto nel sequenziamento sia di genomi di numerose specie sia di molti genomi all’interno di una stessa specie, prima fra tutte, ovviamente, la specie umana. Si sono così identificate decine di milioni di varianti genetiche a livello di singolo nucleotide (single nucleotide polymorphism, SNP), ma la vera sorpresa è stata la dimostrazione delle varianti ‘strutturali’, denominate anche copy number variations (CNV), in cui grandi porzioni di genoma sono presenti in un numero di copie che varia da persona a persona. Tali varianti sono più ardue da studiare e definirne il ruolo è più difficile, ma oggi si sospetta che alcune di esse potrebbero essere implicate anche in processi patologici quali l’autismo, il ritardo mentale o altri disturbi psichiatrici come la schizofrenia.
È interessante notare come il sequenziamento massivo di tutto il genoma abbia ormai raggiunto il letto del malato, in quanto viene utilizzato per fare la diagnosi di malattie poco conosciute in pazienti, soprattutto bambini, in cui si sospetta una malattia ereditaria di difficile classificazione. Inoltre l’analisi delle mutazioni nei pazienti portatori di tumori solidi è diventato un utile strumento non solo per la classificazione delle neoplasie, ma anche per la loro prognosi e in certi casi per indirizzare la terapia in maniera più personalizzata. Nel loro insieme, la conoscenza delle varianti genetiche del singolo individuo e delle eventuali mutazioni che avvengono durante la trasformazione neoplastica, aprono la strada alla cosiddetta medicina personalizzata, che prescrive trattamenti diversi in base al genoma del singolo individuo. In questa prospettiva va vista anche la recente sentenza della Corte suprema americana, che, chiamata a pronunciarsi sulla liceità della brevettazione dei geni umani, ha per la prima volta affermato che i geni, in quanto prodotti di natura, non possono essere fatti oggetto di brevetto (Cook-Deegan, Niehaus 2014). Il dibattito era nato da un ricorso presentato da organizzazioni non profit contro la società Myriad Genetics che aveva brevettato i due geni BRCA1 e BRCA2, le cui mutazioni sono associate a tumore della mammella e dell’ovaio. In seguito a tale decisione le diagnosi genetiche potranno essere effettuate liberamente e a costi più bassi per il paziente. Non è chiaro tuttavia quale sarà l’impatto di questa sentenza sullo sviluppo delle compagnie biotecnologiche e in particolare su eventuali brevetti che coinvolgono altri prodotti naturali, quali per es. le cellule staminali.
Sequenziamento per lo studio dell’evoluzione. – Applicate allo studio dell’evoluzione, le b. del genoma permettono di ricostruire gli eventi che nel corso di miliardi di anni hanno portato alla vita sul nostro pianeta così come la conosciamo oggi. Il sequenziamento del DNA delle specie viventi ha consentito di aggiungere allo studio dei fossili e delle conformazioni geologiche a essi associate un nuovo utilissimo strumento. Infatti, dal momento che la differenza nella sequenza nucleotidica tra due specie è proporzionale al tempo intercorso dalla loro separazione, è possibile costruire interi alberi genealogici confrontando tra loro i genomi sequenziati. Inoltre, dai progressi nella capacità di sequenziamento hanno avuto sviluppo tecnologie per l’analisi di DNA ottenibile da fossili di organismi vecchi di decine di migliaia di anni. Queste procedure, associate all’implementazione di rigorose tecniche che evitano ogni contaminazione, si sono rivelate particolarmente fruttuose nell’analisi della storia recente della specie umana. Grazie a questi studi oggi conosciamo il genoma dell’uomo di Neanderthal e di un altro ‘cugino’, l’Homo denisovianus, di cui ignoravamo l’esistenza. Inoltre, l’antica diatriba sulla possibilità che l’Homo sapiens si sia mischiato geneticamente con i suoi cugini è stata risolta dall’analisi genomica, dimostrando che alcune porzioni del genoma di questi ultimi sono presenti nell’uomo moderno (Pääbo 2014).
Biotecnologie della manipolazione embrionale. – A partire dalla seconda metà del 20° sec. – con i topi chimerici, i topi transgenici, le cellule staminali embrionali, i topi knockout (nei quali è soppressa l’espressione di un determinato gene), il trasferimento nucleare e la pecora Dolly – le tecniche di manipolazione dell’embrione murino e di altri animali hanno rivelato potenzialità sorprendenti. Il terzo millennio si è aperto con la prospettiva dell’applicazione di queste tecnologie all’uomo. Le cellule staminali embrionali (CSE) possono dare origine a qualsiasi tessuto: questo consentirebbe di creare organi in provetta e di sostituirli a quelli difettosi, aprendo nuove prospettive per la medicina rigenerativa, branca medica che affronta le malattie degenerative. Tuttavia vi sono almeno due problemi da affrontare: ottenere organi a struttura tridimensionale composti di cellule mature e funzionanti e far sì che essi non vengano rigettati.
Cellule staminali embrionali umane e cellule riprogrammate. – Il secondo millennio si è chiuso (1998) con la produzione di cellule staminali embrionali umane (CSE-U).
Questo risultato, a quasi vent’anni dalla generazione delle CSE di topo (1981) che tanto hanno contribuito allo studio della funzione genica grazie alla tecnologia degli animali knockout, ha fornito nuovi strumenti per la medicina rigenerativa. Le CSE sono pluripotenti, ossia hanno la capacità di dare origine a tutte le cellule dell’organismo. Ma i processi di differenziamento, che si svolgono con estrema precisione al momento dello sviluppo embrionale e fetale, sono conosciuti solo superficialmente, malgrado negli ultimi 30 anni gli studi di embriologia sperimentale abbiano compiuto passi da gigante. Inoltre, come già detto, le cellule abitualmente crescono in coltura in due dimensioni, mentre gli organi sono tridimensionali e per giunta composti da molti tessuti che si integrano in maniera perfetta e costituiscono strutture estremamente complesse. A questa difficoltà si aggiunge il fatto che, per non venire rigettati, questi organi devono essere immunologicamente compatibili con il ricevente, come del resto avviene già in tutti i casi di trapianto. Il miglior modo per essere compatibili è avere lo stesso genoma e le CSE-U derivate da embrioni normali non hanno questo requisito perché devono essere trapiantate in individui diversi. Per superare questo ostacolo e avere cellule immunologicamente compatibili, le CSE-U potrebbero essere ottenute mediante la procedura del trasferimento nucleare (nuclear transfer), ossia con l’approccio che viene talora denominato clonazione terapeutica. In tal caso, otterremmo cellule ‘clonate’ che sarebbero compatibili con il paziente, dal momento che si utilizza come donatrice di nucleo una cellula del paziente stesso. La procedura tuttavia è molto complessa ed è stata creata solamente nel 2013 dal gruppo di Shoukhrat Mitalipov dell’Oregon health and science university di Beaverton (Tachibana, Amato, Sparman et al. 2013), dopo anni di tentativi infruttuosi se non controproducenti, che hanno visto anche la pubblicazione di lavori contenenti dati falsificati. Inoltre, c’è il problema etico della distruzione inevitabile di un embrione. Per questo motivo alcuni Stati consentono la produzione di tali cellule, mentre altri la impediscono. La situazione peraltro è molto fluida, perché visioni diverse del mondo, incarnate talora in potenti organizzazioni, si scontrano su questo tema in maniera spesso polemica, il che non giova alla comprensione reciproca.
Anche, ma non solo, a causa di tali difficoltà, le ricerche si sono rivolte a identificare fattori che potessero ‘riprogrammare’ le cellule dell’adulto e farle tornare allo stadio embrionale rendendole di nuovo pluripotenti. Che questo dovesse essere possibile era stato dimostrato dalla pecora Dolly: nella clonazione, basata sulla procedura del trasferimento nucleare, le molecole contenute nella cellula uovo sono in grado di riportare il nucleo trasferito allo stadio embrionale. Nel 2006 questo obiettivo è stato raggiunto in maniera relativamente semplice: inserendo quattro fattori di trascrizione in una cellula matura quale il fibroblasto, è possibile produrre cellule molto simili alle CSE di topo (Takahashi, Yamanaka 2006). Queste cellule, chiamate tecnicamente cellule staminali pluripotenti indotte (induced pluripotent stem cells, iPSC), possono colonizzare la linea germinale della blastocisti murina, che rappresenta la massima espressione della staminalità. Studi successivi hanno confermato ed esteso tale risultato anche alle cellule umane e la procedura è oggi adottata da numerosissimi laboratori nel mondo. Questo approccio è stato considerato così innovativo da meritare al suo scopritore, Shinya Yamanaka, il premio Nobel per la fisiologia o la medicina nel 2012. Vi sono tuttavia dei limiti all’utilizzo delle iPSC umane per la medicina rigenerativa. Il primo, come abbiamo visto, è la difficoltà di farle differenziare in uno specifico tessuto, a causa della nostra ignoranza in merito ai passi intermedi e ai fattori coinvolti in vivo. Il secondo consiste nel fatto che potrebbero rivelarsi in grado di sviluppare neoplasie, in quanto il loro mantenimento in coltura per il tempo necessario a produrle e a farle differenziare comporta l’acquisizione di un certo numero di mutazioni, alcune delle quali potrebbero riguardare geni coinvolti nella patogenesi tumorale.
Secondo alcuni pareri, le CSE-U sono di qualità ‘migliore’ rispetto alle iPSC, poiché la conformazione della loro cromatina rappresenta veramente lo stadio indifferenziato pluripotente, mentre le iPSC potrebbero mantenere alcune marcature epigenetiche della cellula matura da cui sono derivate. In secondo luogo, le CSE-U, essendo state ottenute direttamente dagli embrioni, non hanno subito gli stress associati alla riprogrammazione e sono state in coltura per un tempo più breve. Problemi etici a parte, il grande limite delle CSE-U è che esse hanno un profilo immunologico a sé stante, mentre le iPSC hanno ovviamente gli stessi antigeni di istocompatibilità del paziente da cui sono derivate. Questo significa che le iPSC non sono rigettate se inoculate nel paziente, al contrario delle CSE-U (se non sono ottenute con il trasferimento nucleare, come visto sopra).
Clonazione. – Pur essendo impedita da questioni etiche, la clonazione potrebbe tornare alla ribalta attraverso una specifica e limitata variazione sul tema. Esistono infatti malattie genetiche dovute a mutazioni del DNA mitocondriale, che si trova in organelli specifici chiamati mitocondri, indispensabili per il bilancio energetico della cellula e localizzati nel citoplasma e non nel nucleo. Per questo motivo essi vengono ereditati principalmente dalla madre, in quanto sono abbondantemente presenti nel citoplasma dell’uovo(oocita). È stato dimostrato in animali da esperimento che, trasferendo il nucleo da un oocita portatore di un difetto mitocondriale a un oocita normale, l’embrione che ne deriva è esente dalla malattia mitocondriale, pur essendo geneticamente identico alla madre donatrice. Nel 2015 la proposta di applicare questa tecnologia ai casi di donne portatrici di malattie mitocondriali è in corso di valutazione nel Regno Unito e a breve potrebbe diventare una realtà.
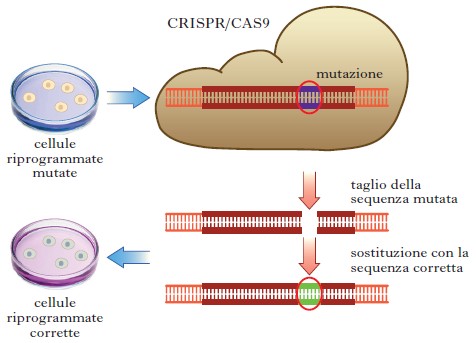
Sviluppi controversi e sorprendenti. – Le b. da sempre hanno aspetti sia controversi sia stimolanti. Tra i più recenti possiamo ricordare: l’inserimento di una nuova coppia di basi nel DNA, ottenuto nel 2014 (Malyshev, Dhami, Lavergne et al. 2014); l’introduzione di nuovi amminoaci di nelle proteine manipolando il codice genetico; la sintesi del genoma di un piccolo organismo con circa un milione di basi a partire dai suoi costituenti nucleotidici e il suo trasferimento in una cellula procariotica privata del suo DNA (Gibson, Glass, Lartigue et al. 2010); la possibilità di sostituire un intero cromosoma in cellule di mammifero (studi in corso); la possibilità di correggere il genoma in maniera semplice e precisa mediante una nuova tecnologia (CRISPR/CAS9, Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR Associated protein 9) basata su nucleasi in grado di riconoscere sequenze specifiche e tagliare il DNA in loro corrispondenza (Doudna, Charpentier 2014), aprendo così nuove prospettive alla terapia genica che dopo tanti anni sembra avviata al raggiungimento di risultati applicabili ai pazienti (v. fig.).
Un grande dibattito è sorto in merito a due studi nei quali è stato modificato il genoma del virus dell’influenza rendendolo più aggressivo, così da infettare per via aerea animali da esperimento normalmente non suscettibili (Herfst, Schrauwen, Linster et al. 2012; Imai, Watanabe, Hatta et al. 2012). Ci si chiede se questo genere di studi debba essere permesso o bandito tout court: i detrattori sottolineano i pericoli legati a terrorismo o errore umano, mentre i favorevoli evidenziano la possibilità di prevedere per tempo pandemie provocate da nuovi virus mutanti. Invece, nel settore delle cellule staminali, fa discutere la possibilità di produrre gameti (uova e spermatozoi) da CSE-U o da iPSC umane. Dal momento che queste cellule hanno la potenzialità di produrre qualsiasi tessuto, potrebbero essere dirette a differenziarsi anche in cellule riproduttive, sebbene il processo sia piuttosto complesso perché in questo caso deve intervenire una divisione meiotica, con dimezzamento del patrimonio genetico. Se questa difficoltà venisse superata, si potrebbe giungere al paradosso di ottenere embrioni dalla fusione di un uovo e uno spermatozoo derivati entrambi da cellule di un adulto tramite riprogrammazione a iPSC. Studi di questo genere sono stati compiuti nel topo (Handel, Eppig, Schimenti 2014). Infine, nel settore delle b. vegetali le controversie sono sorte da subito, quando circa 30 anni fa sono nati i primi organismi geneticamente modificati (OGM; v. anche organismi geneticamente modificati). L’opinione pubblica, almeno in Europa, resta scettica nei confronti di questi approcci, malgrado le loro potenzialità non siano ancora pienamente sviluppate. Nel 2015 la ricerca nel settore si dirige a miglioramenti tecnologici quali l’inserimento di grandi frammenti di DNA che possono contenere numerosi geni, l’utilizzo di promotori sintetici per la regolazione fine dei transgeni e la modificazione mirata con le metodiche giàdescritte per le cellule animali (CRISPR). È possibile che queste nuove b. contribuiscano a diminuire i dubbi e le paure che rimangono ancora assai diffusi.
Bibliografia: K. Takahashi, S. Yamanaka, Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors, «Cell», 2006, 126, 4, pp. 663-76; D.G. Gibson, J.I. Glass, C. Lartigue et al., Creation of a bacterial cell controlled by a chemically synthesized genome, «Science», 2010, 329, 5987, pp. 52-56; S. Herfst, E.J. Schrauwen, M. Linster et al., Airborne transmission of influenza A/H5N1 virus between ferrets, «Science», 2012, 336, 6088, pp. 1534-41; M. Imai, T. Watanabe, M. Hatta et al., Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/ H1N1 virus in ferrets, «Nature», 2012, 486, 7403, pp. 420-28; M. Tachibana, P. Amato, M. Sparman et al., Human embryonic stem cells derived by somatic cell nuclear transfer, «Cell», 2013, 153, 6, pp. 1228-38; R. Cook-Deegan, A. Niehaus, After Myriad: genetic testing in the wake of recent Supreme Court decisions about gene patents, «Current genetic medicine reports», 2014, 2, 4, pp. 223-41; J.A. Doudna, E. Charpentier, The new frontier of genome engineering with CRISPR-Cas9, «Science», 2014, 346, 6213, p. 1077; M.A. Handel, J.J. Eppig, J.C. Schimenti, Applying ‘gold standards’ to in-vitro-derived germ cells, «Cell», 2014, 157, 6, pp. 1257-61; D.A. Malyshev, K. Dhami, T. Lavergne et al., A semi-synthetic organism with an expanded genetic alphabet, «Nature», 2014, 509, pp. 385-88; S. Pääbo, The human condition. A molecular approach, «Cell», 2014, 157, 1, pp. 216-26.