Cellula. Fisiologia e patologia della cellula
Cellula. Fisiologia e patologia della cellula
L'identificazione della cellula come unità fondamentale della materia vivente è stata confermata attraverso l'osservazione ‒ dapprima al microscopio ottico e poi anche al microscopio elettronico ‒ di una miriade di preparati. Sappiamo che il mondo cellulare è diviso in due componenti fondamentali: le cellule procariotiche (i batteri) e le cellule eucariotiche (quelle di tutti gli altri organismi). In termini di nomenclatura, procarioti ed eucarioti si distinguono per l'assenza, o la presenza, di un nucleo (karion) distinto e riconoscibile. Il legame storico tra microscopia e studio delle cellule si deve alla dimensione della maggior parte di queste ultime, il cui diametro ‒ dell'ordine di millesimi di millimetro (tra 7 e 50 μm per la maggior parte delle cellule) ‒ è tale da non renderle distinguibili a occhio nudo o con l'aiuto di semplici lenti. Solo attraverso il microscopio ottico, che assicura un potere di risoluzione fino a 0,2 μm, fu possibile studiare il mondo delle cellule e identificare molti organuli intracellulari, a partire dal nucleo; tuttavia, solo con l'avvento del microscopio elettronico (potere di risoluzione 〈1 nm=1 milionesimo di mm) divennero visibili anche strutture intracellulari fondamentali come le membrane. Per molti anni il progresso delle conoscenze sulle cellule rimase sostanzialmente limitato agli aspetti strutturali.
Contemporaneamente cominciò anche lo studio dei caratteri funzionali, soprattutto biochimici, condotto su preparazioni ottenute attraverso la frammentazione di cellule (omogenati), su estratti o composti purificati. A partire dagli anni Cinquanta del XX sec. lo sviluppo delle tecniche di frazionamento subcellulare ha consentito di isolare dagli omogenati di cellule alcune strutture e organuli intracellulari, analizzabili sia al microscopio elettronico sia biochimicamente. Da questi studi è progressivamente emersa una conoscenza integrata, non più relativa alle sole caratteristiche strutturali, ma anche alla composizione ‒ e quindi alla funzione ‒ della materia vivente. Gli sviluppi degli ultimi anni dipendono in parte dal progresso delle tecniche di analisi morfologica: per esempio, mediante l'uso di anticorpi oggi è divenuto possibile stabilire la localizzazione intracellulare di singole proteine. Ancora più importanti, però, sono state la progressiva messa a punto e l'utilizzazione di tecniche di biologia molecolare, attraverso le quali il funzionamento integrato della cellula può essere non solo studiato nei suoi componenti più significativi ‒ DNA, RNA e proteine ‒ ma anche manipolato modificandone l'espressione. Nel quadro che emerge dagli studi recenti risultano sempre più sfumati i confini tra la fisiologia della cellula ‒ con i suoi molteplici aspetti quali proliferazione e differenziamento ‒ e la sua patologia (che comporta in molti casi una terza alternativa, la morte cellulare), ossia i disturbi di singole funzioni, spesso dovuti a disequilibri dei meccanismi fisiologici o a mutazioni genetiche a carico dei singoli componenti.
Fisiologia della cellula
A un'analisi superficiale le cellule possono apparire molto eterogenee. La dimensione può cambiare enormemente, da quella delle gigantesche uova ripiene di materiale nutritizio fino ai 5÷6 μm di diametro delle cellule più piccole, quali i neuroni granulari del cervelletto o i linfociti non attivati. Con pochissime eccezioni tutte le cellule eucariotiche mantengono la struttura base binaria, costituita cioè dal nucleo circondato dal citoplasma. In proporzione, nei vari tipi di cellule le variazioni di volume del nucleo sono modeste a confronto di quelle del citoplasma. Alcune cellule possono apparire bi- o multinucleate, perché nel corso della mitosi la divisione del nucleo non è seguita da quella del citoplasma, oppure perché hanno origine dalla fusione di molte cellule, come avviene per le fibre muscolari scheletriche. Non solo il volume, ma anche la forma delle cellule può variare, da sferica a poligonale, con o senza prolungamenti, e così via: queste variazioni costituiscono il risultato dei processi di differenziamento. Altre proprietà appaiono invece comuni a tutte le cellule eucariotiche: esse, pertanto, pur nel loro ampio spettro differenziativo, possono essere considerate come variazioni rispetto a un certo numero di temi comuni.
La membrana plasmatica
Ogni cellula è delimitata da una membrana continua (la membrana plasmatica o plasmalemma) che ne media i contatti con l'ambiente extracellulare e ne difende la specificità. Ogni soluzione di continuità di questa membrana che si protragga per periodi di tempo più lunghi di qualche secondo comporta un'alterazione della struttura della materia vivente e può quindi concludersi con la morte della cellula (necrosi). Come tutte le membrane biologiche, il plasmalemma è composto da lipidi e proteine: i primi sono in larga misura fosfolipidi, che sono caratteristicamente anfipatici, forniti cioè di un polo idrofilico (o 'testa') e di uno idrofobico. Le proteine sono in parte proteine integrali (ossia penetrano nello spessore della membrana stessa), in parte proteine periferiche (cioè sono adese alla superficie). Con la disposizione dei fosfolipidi, le cui teste idrofiliche sporgono verso gli ambienti acquosi extra- e intracellulari, si viene a creare una struttura a triplo strato, dello spessore di 6÷7 nm, resa impenetrabile sia all'acqua che alle molecole idrofiliche dallo strato interno che è uniformemente idrofobico. Tale strato, alla temperatura corporea, è liquido e permette quindi il movimento delle molecole fosfolipidiche e delle proteine di membrana, a meno che queste ultime non siano ancorate ad altre molecole localizzate nel citoplasma o nello spazio pericellulare. Il grado di fluidità delle diverse membrane varia, specialmente in rapporto al contenuto dell'altro componente lipidico, il colesterolo, particolarmente abbondante nel plasmalemma.
Alcune proteine integrali sono tali in quanto fornite di una o più (fino a 20) sequenze di amminoacidi idrofobici che, nel corso della sintesi proteica, vengono inserite nello spessore della membrana dove permangono in maniera stabile. Le altre molecole proteiche integrali sporgono rispetto alle due superfici della membrana: tali sporgenze, essendo in genere idrofiliche ed elettricamente cariche, forniscono il meccanismo per il legame delle proteine periferiche. Queste ultime restano legate alla superficie. La struttura generale delle membrane è quindi a sandwich, con lo strato idrofobico all'interno (acidi grassi e sequenze idrofobiche transmembrana delle proteine) coperto sui due lati dagli strati idrofilici composti dalle teste dei fosfolipidi e da proteine. Altre proprietà fondamentali delle membrane sono l'asimmetria ‒ dovuta alla diversità sia dei fosfolipidi sia delle porzioni delle proteine di membrana che si affacciano alle loro due superfici ‒ e la carica elettrica, che è negativa sul lato interno.
Pur trattandosi di una struttura continua tutt'intorno alla cellula, il plasmalemma permette comunque il trasferimento dei segnali necessari affinché la cellula stessa operi in maniera coordinata, per esempio nell'ambito di un organismo multicellulare. Alcuni tipi di cellule sono capaci di rispondere a stimolazioni, per esempio elettriche, e di trasferire segnali in tempi assai brevi (dell'ordine del millesimo di secondo) lungo la membrana stessa, anche a notevole distanza dal sito di stimolo. Questi processi sono resi possibili da variazioni del potenziale elettrico che fungono sia da segnale di attivazione, sia da forza motrice dei flussi ionici attraverso specifici pori (canali) di natura proteica, attivati per un tempuscolo all'interno della membrana stessa. Questa proprietà, essenziale per il funzionamento di vari tipi di cellule, quali quelle nervose e muscolari, è alla base del concetto di eccitabilità.
Altri segnali, attivati da stimoli chimici esterni (quali ormoni, neurotrasmettitori o altri mediatori chimici), trovano a livello della membrana adeguati sistemi di trasduzione che non solo ne permettono il ricevimento, ma anche l'intelligibilità da parte della cellula. Oltre a canali e recettori, la membrana plasmatica possiede anche le pompe e i trasportatori. L'azione coordinata di tutte queste proteine permette alla cellula di stabilire un microambiente appropriato nel citosol e di acquisire metaboliti importanti, quali glucosio, amminoacidi, ecc. Un'altra caratteristica importante della membrana plasmatica, comune a molte se non a tutte le cellule, è la sua capacità di specializzazione locale, che spesso si realizza attraverso l'interazione con il citoscheletro. Altrettanto importante è il fatto che per molte cellule è necessario integrarsi in un tessuto e stabilire interazioni, a livello di siti o regioni specifiche, con la matrice extracellulare. Ciò avviene grazie alla presenza nella membrana plasmatica di varie famiglie di proteine di legame, quali, per esempio, le integrine.
Sistemi di giunzione
Le cellule sviluppano a livello della loro membrana plasmatica sistemi di giunzione diversi a seconda delle specifiche esigenze funzionali. Le giunzioni gap sono composte da numerosi canali di elevata permeabilità. Questi canali, distribuiti in registro nel plasmalemma di cellule adiacenti, permettono il passaggio intercellulare di ioni e secondi messaggeri direttamente da una cellula all'altra. Quando vengono stimolati, i gruppi di cellule collegate da giunzioni comunicanti sono quindi capaci di rispondere in blocco. Anche le giunzioni tight sono costituite da molecole proteiche in registro e rinforzate sul lato intracellulare da altre proteine; tali giunzioni ‒ esposte alla superficie e saldate tra due cellule adiacenti, ma prive della funzione di canale ‒ consentono la formazione delle pareti del lume degli organi cavi. I desmosomi, infine, o giunzioni aderenti, permettono di stabilire una continuità funzionale, attraverso lo spazio intercellulare, tra il citoscheletro di cellule adiacenti, e di realizzare quindi collegamenti meccanici intercellulari nell'ambito di un tessuto.
Un'importante proprietà della membrana plasmatica è la possibile eterogeneità regionale. Considerando per esempio, una cellula secernente che delimita il lume di un viscere cavo, quale può essere lo stomaco: le stimolazioni la raggiungeranno a livello della regione basolaterale della membrana plasmatica, quella prospiciente l'ambiente intercellulare, mentre la secrezione avrà luogo a livello della regione che contribuisce a delimitare il lume cavo dell'organo. Le due regioni devono quindi essere diverse, esprimere cioè componenti molecolari differenti: recettori, per ricevere informazioni, a livello basolaterale; componenti del sistema di rilascio di granuli di secrezione, ossia dell'esocitosi, a livello luminale. Nei neuroni si riscontra un'eterogeneità regionale tra l'assone ‒ la fibra che conduce l'impulso in senso centrifugo ‒ e il resto della cellula, cioè il corpo cellulare e i dendriti, che costituiscono i prolungamenti ramificati a cui sono indirizzate molte delle sinapsi che provengono dagli altri neuroni. Tra queste zone non sono presenti giunzioni, ma funziona un ulteriore meccanismo (finora non completamente identificato) che induce eterogeneità di superficie. La specificità della membrana plasmatica riguarda anche le strutture deputate al movimento ‒ le ciglia e i flagelli ‒ che sporgono sulla superficie della cellula e sono strettamente connesse con il citoscheletro.
Nucleo
La presenza di un nucleo, spesso situato verso il centro della cellula, è la caratteristica che distingue le cellule eucariotiche dalle procariotiche. In realtà, la struttura mancante in queste ultime cellule è l'involucro nucleare, costituito da due membrane: la prima, coperta di ribosomi, è in diretta continuità con il reticolo endoplasmatico; la seconda, caratterizzata da proteine almeno in parte specifiche, aderisce strettamente alla lamina nucleare, una struttura composta da proteine filamentose disposte tutt'intorno al contenuto nucleare vero e proprio. La proprietà fondamentale dell'involucro nucleare è la sua 'transitabilità' da parte di macromolecole attraverso i pori. Attraverso il canale centrale del poro diffondono passivamente piccole molecole (fino a ca. 20 kDa di peso molecolare). Mediante meccanismi ATP-dipendenti, il poro funge da grande via di traffico attraverso la quale l'RNA raggiunge il citoplasma, da dove si muovono in direzione inversa specifiche proteine ivi sintetizzate.
In ogni specie il numero di molecole di DNA presenti nel nucleo è fisso e corrisponde a quello dei cromosomi. All'interno del nucleo, le molecole di DNA interagiscono strettamente con specifiche proteine basiche, gli istoni, dando luogo a una struttura composta da nucleosomi (complessi DNA-proteine) collegati tra loro da tratti di DNA libero. Questa struttura, ripiegandosi su sé stessa, dà origine a un'organizzazione ordinata che a livello microscopico si rivela come cromatina. Quest'ultima peraltro dà luogo a due tipi di strutture: la eterocromatina, più compatta, distribuita di preferenza in prossimità dell'involucro nucleare (ma non dei pori), e la eucromatina, caratterizzata da una distribuzione più lassa. Oggi è ormai chiaro che la eucromatina contiene i geni espressi dalla cellula, mentre quelli repressi vengono, almeno in gran parte, intrappolati nella eterocromatina. All'interno del nucleo è situato un organulo assai ricco di RNA, il nucleolo, che costituisce la zona di sintesi e di assemblaggio dei ribosomi. Le zone del nucleolo riconoscibili microscopicamente (filamentosa e granulare) corrispondono ai diversi stadi del processo di formazione dei ribosomi.
Le attività fondamentali che hanno luogo nel nucleo sono due: la duplicazione, attraverso la quale il contenuto di DNA viene raddoppiato in preparazione alla divisione per mitosi, e la trascrizione, cioè il trasferimento dell'informazione genetica dal DNA all'RNA, che è in grado di uscire dal nucleo per 'dirigere' la sintesi proteica; questo secondo processo è soggetto a regolazione (regolazione trascrizionale) da parte di specifici fattori di trascrizione, che possono essere modulati a loro volta da secondi messaggeri generati a livello dei recettori nella membrana plasmatica. L'RNA, sintetizzato a partire da uno dei filamenti di DNA, va in genere incontro a un processo di maturazione che comporta la rimozione di sequenze interne (splicing), i cosiddetti 'introni', con successivo legame delle sequenze residue, gli esoni. L'ambiente intranucleare condivide con il suo omologo citoplasmatico, il citosol, numerose proprietà: per esempio, il pH, la distribuzione di ioni, di piccoli metaboliti e anche di diverse proteine. Altre proprietà invece differiscono, oppure possono differire in certe fasi della vita cellulare: per esempio, i recettori per gli ormoni steroidei possono trovarsi localizzati nel citoplasma o nel nucleo, a seconda che siano attivati o meno.
Citosol
All'interno della membrana plasmatica, delimitato anche dall'involucro nucleare e dalle endomembrane (ossia le membrane degli organuli endocellulari), si riscontra la presenza di un ambiente con caratteristiche largamente ‒ ma non completamente ‒ omogenee: il citosol in cui è immerso il citoscheletro. Il citosol comunica direttamente con il lume nucleare attraverso i pori, mentre è collegato con il lume di altri organelli (mitocondri, reticolo endoplasmatico, apparato di Golgi, perossisomi) soltanto attraverso meccanismi assai più complessi. In tutte le cellule il citosol rappresenta il compartimento operativo della vita cellulare: si pensi, per esempio, ai segnali di crescita o differenziamento, che hanno origine a livello di specifici recettori della membrana per essere poi trasferiti lungo catene di fattori ed enzimi intracellulari, fino a raggiungere il nucleo e a modificare il funzionamento di specifici sistemi di trascrizione. Anche molti processi metabolici, quali il metabolismo anaerobico del glucosio, nella maggior parte delle cellule hanno una localizzazione esclusivamente citosolica.
La cellula assicura il coordinamento tra le varie funzioni attraverso equilibri non rigidi, modificabili in funzione delle condizioni fisiologiche. La fosforilazione è la reazione che regola il funzionamento di innumerevoli enzimi e substrati a localizzazione citosolica. Un'alta percentuale di proteine citosoliche (o rivolte verso il citosol) è quindi dinamicamente fosforilata e poi defosforilata, talvolta in più siti. Molte proteina-chinasi e proteina-fosfatasi sono a loro volta regolate da secondi messaggeri, prodotti a livello dei recettori della membrana plasmatica. Un altro meccanismo regolativo che funziona nel citosol (e peraltro anche nel nucleo e nell'apparato di Golgi) è quello basato su proteine regolatrici che si attivano quando legano il nucleotide guanosintrifosfato, GTP (come il protoncogene RAS). Infine, un ruolo fondamentale è riconosciuto allo ione Ca2+, che agisce sia attraverso l'attivazione di proteina-chinasi e proteino-fosfatasi Ca2+-dipendenti, sia legandosi direttamente a specifiche proteine.
L'esistenza di grandi molecole (proteine) di legame riduce la diffusione di alcune piccole molecole, per esempio quelle che legano il Ca2+ e forse anche altri ioni. Ne consegue che, in particolari condizioni, si possono generare localmente dei microterritori citosolici ad alta concentrazione di Ca2+, circondati da territori a bassa concentrazione. Queste condizioni, da un lato, rendono possibile la realizzazione di processi che richiedono elevate concentrazioni di Ca2+ (per es., 10÷100 μM), dall'altro, finiscono per dare luogo nel citosol a processi ritmici (oscillazioni) od orientati (onde) ad alta concentrazione di Ca2+ che, ricordando i processi di trasporto ionico attivati nella membrana plasmatica, hanno dato origine al concetto di citosol come 'mezzo eccitabile'. Un'ultima caratteristica del citosol è la presenza in questo compartimento di complessi di ribosomi (poliribosomi o polisomi) deputati alla sintesi di proteine destinate al citosol stesso, al nucleo e, in parte, anche agli organuli, soprattutto ai perossisomi e agli organuli semindipendenti: mitocondri e cloroplasti.
Citoscheletro
Che la cellula contenga uno scheletro non può sorprendere chi ha posto anche una sola volta l'occhio al microscopio. Quello che invece sorprende è la complessità dello scheletro cellulare, cui sono deputate funzioni multiple e non soltanto di semplice sostegno. Considerato globalmente, il citoscheletro risulta costituito da strutture filamentose, disposte diversamente e organizzate a seconda della specializzazione, della zona e del momento funzionale della cellula: citoscheletro contrattile, microtubuli e filamenti intermedi.
Citoscheletro contrattile. La capacità di contrazione rappresenta la proprietà principale di qualunque fibra muscolare. Nel corso del tempo, però, questa proprietà si è progressivamente differenziata. L'aumento delle conoscenze ha permesso di stabilire che la capacità di contrarsi è condivisa, sia pure su scala assai più modesta, anche dalle cellule non muscolari. Perché possa esservi contrazione è necessaria la coespressione di actina e miosina, entrambe filamentose, che si assemblano per polimerizzazione orientata (i filamenti hanno cioè un capo e una coda, indicati come verso + e verso −) a partire da un pool di monomeri. La loro caratteristica è quella di organizzarsi ordinatamente nello spazio, in modo che l'actina formi filamenti sottili che circondano il filamento spesso di miosina. Il processo base della contrazione, infatti, non è l'accorciamento dei filamenti, ma il loro slittamento l'uno sull'altro, che determina comunque un accorciamento della fibrilla actomiosinica in toto. L'energia per lo slittamento dei filamenti è fornita dall'ATP liberato dalla miosina, che ha attività ATPasica. Tale attività viene indotta per effetto dell'aumento del Ca2+ nel citosol provocato dalla stimolazione cellulare. Qualunque movimento rilevante della cellula, o al suo interno, richiede la collaborazione actomiosinica. La presenza di actina a ridosso della membrana plasmatica conferisce elasticità a questa zona della cellula e permette una stretta interazione citoplasma-membrana a livello di strutture particolari (villi e flagelli, siti di adesione della membrana alla matrice extracellulare, ecc.).
Microtubuli. Un altro componente fondamentale del citoscheletro è rappresentato dai microtubuli. Si tratta non di filamenti ma di strutture costituite dalla polimerizzazione, anche in questo caso orientata, di proteine globulari, le tubuline. Nella cellula i microtubuli si organizzano irradiandosi ordinatamente a partire da un sito perinucleare, o centrosoma, da cui hanno origine anche gli astri della mitosi. I microtubuli sono simili a rotaie sulle quali vengono rapidamente trasportati gli organelli che si muovono verso mete specifiche. Il ruolo dei microtubuli è di fondamentale importanza anche per il funzionamento delle strutture di superficie che assicurano motilità alla cellula o al materiale presente nell'ambiente in cui essa vive, quali i lunghi flagelli (si pensi allo spermatozoo) e le ciglia, più piccole ma più numerose.
Filamenti intermedi. Dal punto di vista strutturale e funzionale, i filamenti intermedi, rispetto agli altri componenti del citoscheletro, sono più semplici. La proteina base dei filamenti intermedi non è sempre la stessa: a seconda del tipo cellulare ne esistono quattro tipi, tutti filamentosi e resistenti dal punto di vista sia meccanico sia metabolico. Il costituente più conosciuto dei filamenti intermedi ‒ organizzati come corde o fasce che attraversano il citoplasma ‒ è la cheratina, specifica delle cellule epiteliali.
I vari componenti del citoscheletro fin qui descritti non funzionano indipendentemente ma in modo coordinato. Il citoplasma, in realtà, contiene una complessa rete tridimensionale di filamenti proteici, la cui organizzazione generale dipende dai microtubuli. In questo quadro i filamenti di actina hanno soprattutto un ruolo dinamico e i filamenti intermedi un ruolo meccanico. Dall'interazione tra i vari componenti citoscheletrici hanno origine, tra l'altro, la forma cellulare e la sua straordinaria plasticità.
Organelli citoplasmatici
Il citoplasma contiene diversi tipi di organelli, completamente circondati da membrana. Alcuni, strettamente connessi all'attività cellulare, sono spesso capaci di operare in coordinazione con organelli diversi, dando luogo a vie funzionali, quali la via esocitica e quella endocitica. Altri, invece, almeno parzialmente indipendenti dal resto della cellula, si distinguono per la presenza di due membrane e per le loro caratteristiche genetiche peculiari: sono i mitocondri (presenti in tutte le cellule) e i cloroplasti (presenti nelle foglie e responsabili della fotosintesi).
Mitocondri e cloroplasti. Questi due tipi di organelli sono definiti anche 'organelli semiautonomi', in quanto possiedono un intero, sebbene assai ridotto, patrimonio genetico, completo di sistema di espressione simile a quello di cellule procariotiche (batteri). In base a questa proprietà è stata prospettata l'ipotesi di un'origine simbiotica di mitocondri e cloroplasti, a partire da un evento accaduto all'incirca un miliardo e mezzo di anni fa. I mitocondri e i cloroplasti sono responsabili del metabolismo aerobico. Entrambi sono circondati da una doppia membrana: quella esterna, di presunta origine cellulare, delimita un primo compartimento; quella interna, batterica, delimita il più ampio compartimento interno denominato matrice (nel mitocondrio) o stroma (nel cloroplasto). In più i cloroplasti possiedono un terzo compartimento, contenuto all'interno dei primi due e anch'esso delimitato da un sistema membranario molto specializzato, quello dei tilacoidi. È qui che la luce viene captata dalla clorofilla e usata per due scopi principali: la sintesi di ATP e il suo impiego per la fissazione dell'anidride carbonica nella sintesi degli zuccheri. In breve, la captazione di fotoni fornisce l'energia per il trasporto di protoni, H+, attraverso la membrana nel lume dei tilacoidi, generando così un potenziale elettrochimico (acidità e carica positiva all'interno). Questa distribuzione asimmetrica di cariche costituisce evidentemente una fonte di energia che può essere liberata attraverso il ritorno degli H+ nello stroma, il compartimento che circonda i tilacoidi. Tale flusso retrogrado non avviene a caso, ma coinvolge una ATP-sintetasi che utilizza l'energia dissipata dal trasporto di H+ per sintetizzare il nucleotide ATP attraverso la fosforilazione dell'ADP. Tramite la sua successiva defosforilazione l'ATP libera energia, questa volta nello stroma del cloroplasto dove è utilizzata, insieme ad altri metaboliti, innanzitutto per la sintesi di carboidrati semplici (ciclo di fissazione del CO2).
Rispetto al cloroplasto il mitocondrio possiede un tipo di membrana (e quindi un compartimento) in meno, mentre la sua membrana interna, dentro la quale si trova lo spazio chiamato matrice, è assai più estesa di quella esterna e si ripiega a formare le creste. Non essendo capace di utilizzare quanti di luce, il mitocondrio impiega per il suo funzionamento sostanze da metabolizzare che provengono dal citosol. Gli enzimi della matrice sono in grado di sottrarre elettroni a queste sostanze, cioè di ossidarle, trasferendoli ad altri enzimi, responsabili della catena di trasporto elettronico, allineati nella membrana interna, fino a raggiungere l'ossigeno cui gli elettroni si legano formando acqua. La perdita di energia che avviene attraverso quattro stadi di 'salto degli elettroni' è utilizzata per espellere H+ dal mitocondrio. In esso, come nel cloroplasto, si crea un gradiente elettrochimico, questa volta però tra membrana interna e citosol (dato che la membrana esterna è molto permeabile). Per la perdita di H+ la membrana diviene elettronegativa (−160 mV, assai più della membrana plasmatica) e la matrice diventa alcalina. Queste condizioni favoriscono il rientro degli H+, rendendo disponibile energia per il funzionamento di una ATP-sintetasi che genera ATP. Il sistema è così straordinariamente ben costruito che il mitocondrio è una delle macchine più efficienti esistenti in natura: pochissima dell'energia liberata dall'ossidazione dei substrati viene infatti dispersa in calore. Tramite i cloroplasti e i mitocondri (oltre che tramite la glicolisi citosolica, di cui non abbiamo parlato in dettaglio) la cellula sintetizza grandi quantità di ATP (il cui contenuto intracellulare in condizioni normali è molto alto, 1÷3 mM), il che le permette di unificare le fonti dirette di energia; la cellula funziona cioè quasi sempre ad ATP.
Perossisomi. Reazioni ossidative, in parte simili a quelle della matrice mitocondriale, hanno luogo in un altro tipo di organello, il perossisoma. Anche in questo caso è stata ipotizzata un'origine batterica. A differenza di cloroplasti e mitocondri, i perossisomi possiedono però una sola membrana e sono privi di DNA e RNA.
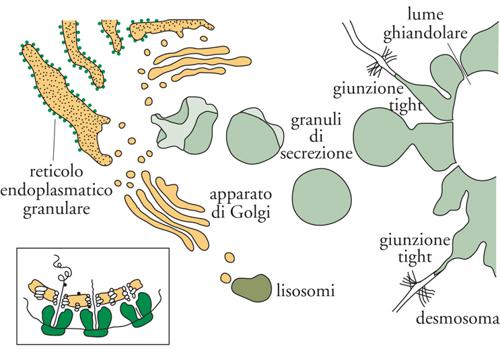
Organelli della via esocitotica. Il reticolo endoplasmatico consiste in un ampio sistema di endomembrane costituito da cisterne e tubuli largamente continui tra loro. Le cisterne, coperte da complessi di ribosomi (poliribosomi o polisomi), e i tubuli, che sono invece lisci, formano il reticolo granulare e quello liscio, rispettivamente. La presenza di polisomi indica chiaramente come il reticolo sia sede di sintesi proteica, analogo in questo al citosol: nel caso di proteine destinate al citosol, alla faccia citosolica delle membrane, al nucleo e agli organuli semiautonomi, la sintesi avviene nei polisomi liberi; se invece il destino è la secrezione (nel caso di proteine solubili) o l'inserimento nel lume o nelle membrane degli organuli connessi funzionalmente con le vie esocitotica ed endocitotica, la sintesi si verifica quasi sempre nei ribosomi legati alle membrane del reticolo (fig. 1). Il reticolo endoplasmatico svolge anche altre funzioni importanti: tra queste ricordiamo la sintesi di fosfolipidi e l'accumulo di Ca2+ a rapido scambio.
Successivamente al reticolo, la via esocitica prosegue con l'apparato di Golgi ‒ composto da 3÷5 cisterne, distinte l'una dall'altra e disposte parallelamente, denominate 'cis' (la più interna) e 'trans' (la più periferica) ‒ e quindi raggiunge la rete transgolgiana, composta da tubuli disposti in tre dimensioni e ampiamente continui tra loro. A questo punto la via esocitotica si dirama in almeno tre direzioni: gli enzimi lisosomiali vengono trasportati in vescicole e raggiungono infine i lisosomi; il restante materiale si divide tra granuli e vescicole responsabili della secrezione, regolata e non regolata. Il ruolo dell'apparato di Golgi è quello di modificare le proteine provenienti dal reticolo tramite coniugazione con zuccheri (glicosilazione), oppure con residui fosfato (fosforilazione) o solfato (solfatazione). È la molteplicità delle cisterne che permette l'ordinato svolgimento dei numerosi eventi connessi, per esempio, con la glicosilazione. Nella rete transgolgiana di molte cellule, inoltre, il pH del lume diviene più acido, determinando in tal modo l'aggregazione delle proteine che devono essere secrete. Questo meccanismo permette alla cellula di accumulare i prodotti della propria secrezione, finché un segnale (per es., l'aumento del Ca2+ nel citosol) non induca la fusione (esocitosi) sincrona della membrana di molti granuli con il plasmalemma, con conseguente secrezione extracellulare del loro contenuto. Analogo è il destino delle altre proteine non condensate nella rete transgolgiana, le quali viaggiano in vescicole che si fondono con la membrana plasmatica in modo non regolato. La secrezione di queste proteine avviene quindi continuamente e non a impulsi, come avviene invece, per gli ormoni o gli enzimi dei granuli.
L'esocitosi è accoppiata all'endocitosi, cioè alla formazione di vescicole che si distaccano dal plasmalemma e tornano quindi nel citoplasma. Alla formazione di vescicole segue (come per l'esocitosi, ma in senso inverso) una via di circolazione di membrane assai complessa, la via endocitotica, il cui scopo non è soltanto quello di preservare la dimensione opportuna del plasmalemma, ma anche quello di mantenere sotto controllo la sua composizione; in particolare i recettori attivati dai ligandi specifici vengono qui sottoposti al cosiddetto 'lavaggio acido' delle membrane, che determina il distacco degli stimolatori dai recettori internalizzati negli endosomi. Successivamente alla formazione degli endosomi, anche la via endocitotica si biforca. Alcune vescicole si fondono con i tubuli della rete transgolgiana e rientrano quindi nella via esocitotica; altre invece divengono ancora più acide e finiscono per fondersi con i lisosomi. I lisosomi sono gli organelli deputati alla digestione intracellulare attraverso una cinquantina di enzimi capaci di attaccare proteine, lipidi, zuccheri, ecc. Questi enzimi raggiungono i lisosomi seguendo una diramazione della via esocitotica; i substrati originati dallo spazio extracellulare o dalla superficie della cellula vengono invece trasferiti ai lisosomi soprattutto attraverso la via endocitotica, o dalla rete transgolgiana o anche da intere zone di citoplasma che i lisosomi finiscono per inglobare al loro interno (autofagocitosi). L'attività digestiva dei lisosomi, essendo in equilibrio con le attività sintetiche della cellula, ne mantiene la giusta dimensione sia dal punto di vista del rapporto volume/superficie, sia in termini di composizione. Una vita, quella della cellula, ben diversa da quella apparentemente tranquilla che sembra evincersi dall'indagine della microscopia classica; anzi, addirittura, una vita convulsa, eppure meravigliosamente sotto controllo.
Differenziamento
La cellula 'tipo' descritta è spesso molto diversa da quelle che si osservano nella realtà. Nel suo complesso, il processo di differenziamento è governato dalle interazioni che si stabiliscono tra le cellule e si attua attraverso modificazioni dei processi di espressione genica. A livello molecolare, gli attori del differenziamento sono quindi determinati fattori di trascrizione, attraverso i quali viene regolata la sintesi di specifici mRNA e quindi delle corrispondenti proteine. In un periodo precoce fattori generali, che possono esprimersi nell'arco di finestre temporali anche assai brevi, inducono nelle cellule non tanto uno specifico fenotipo, quanto la potenziale capacità di differenziamento secondo particolari programmi, realizzati successivamente sotto il controllo di ulteriori stimoli. In organi altamente differenziati, il processo differenziativo può riprendere in seguito a lesioni che inducono lo sdifferenziamento delle cellule rimaste (per es., nel caso del fegato) o lo sviluppo di una piccola frazione residua di precursori (come le cellule satelliti del muscolo). Il differenziamento finale può rimanere sospeso anche a lungo e attivarsi in seguito a un evento fisiologico, come l'incontro di linfociti B con antigeni specificamente riconosciuti dai loro anticorpi di superficie, con conseguente maturazione a plasmacellule. Possiamo quindi concludere che il differenziamento è costituito da un gran numero di fenomeni strettamente coordinati ‒ che dipendono sia dal tempo, cioè dallo stadio di sviluppo, che dall'interazione tra cellule ‒ ed è comandato a livello molecolare dai processi di espressione genica.
Proliferazione cellulare: la mitosi
Nel corso del proprio ciclo la cellula, dopo un periodo di vita operativa definito dalla sigla G0, rispondendo alla stimolazione da parte di fattori di crescita, passa alla fase G1, durante la quale si prepara a raddoppiare il proprio DNA (fase S, sintesi), per passare quindi, dopo un ulteriore periodo preparatorio (G2), alla ridistribuzione del proprio materiale vivente in due cellule (fase M, mitosi). Lo scopo di quest'ultima fase è appunto una ridistribuzione egualitaria, che permette a entrambe le cellule risultanti di essere vive e attive. La divisione non riguarda quindi solo l'informazione genetica immagazzinata nel DNA, ma anche i sistemi di espressione e i componenti cellulari, quali le membrane, che possono crescere (cioè espandersi) per inserimento di nuovi componenti molecolari, ma non possono essere messi insieme a partire dai singoli componenti. Per rispondere a queste esigenze è necessario che la cellula vada incontro a processi di semplificazione organizzativa e di riordinamento spaziale, mentre altre funzioni non indispensabili sono temporaneamente ridotte o completamente interrotte. Tradizionalmente la mitosi viene descritta in sei fasi, rivelabili dall'indagine microscopica. Prima dell'inizio della mitosi, il DNA è diffuso nel nucleo e i microtubuli sono disposti geometricamente nella cellula a partire dal centrosoma. Nella profase, la cromatina si condensa per dare luogo ai cromosomi, contenenti ciascuno la sua singola molecola raddoppiata di DNA. Contemporaneamente, nel citoplasma si assiste al raddoppiamento del centrosoma e alla migrazione verso i poli della cellula dei due centrosomi risultanti, dai quali originano i microtubuli interagenti all'equatore cellulare, che vanno a formare il fuso.
Le fasi successive prevedono in primo luogo la disintegrazione dell'involucro nucleare, accompagnata peraltro da quelle del reticolo endoplasmatico e dell'apparato di Golgi, con formazione di numerosissimi gruppi di vescicole disperse per l'intera cellula (prometafase); successivamente, ciascun cromosoma si attacca a un gruppo di microtubuli del fuso. In questa fase (metafase) i cromosomi si posizionano all'equatore della cellula e si dispongono in modo che le due metà (cromatidi) prodotte dal raddoppiamento del DNA siano ciascuna orientata verso un polo; si forma così la tipica placca metafasica. L'improvviso venir meno del legame tra i cromatidi dà inizio alla loro migrazione verso i due centrosomi (anafase). Infine, raggiunta la zona dei due centrosomi, il rapporto tra cromosomi e fuso viene meno, e intorno ai due ammassi di DNA comincia a riformarsi un involucro nucleare, mentre gli organuli citoplasmatici iniziano a riorganizzarsi nel citoplasma (telofase). A questi processi segue la separazione delle due cellule (citodieresi) che si verifica in genere a livello della zona equatoriale, dove un anello di actina si forma proprio sotto la membrana plasmatica e contribuisce, contraendosi per interazione con miosina, allo strozzamento fino al distacco. La regolazione dei processi fin qui descritti sembra essenzialmente dipendere dalla sintesi, durante il periodo preparativo alla mitosi (G2), di proteine a rapido turnover capaci di controllare il funzionamento di specifiche proteina-chinasi e quindi la fosforilazione di importanti substrati. Nel suo insieme il processo costituisce un vero successo. Gli errori nella ridistribuzione del materiale alle cellule figlie sono infatti straordinariamente rari.
Patologia della cellula
Nel momento in cui si sono cominciati a comprendere pienamente i meccanismi responsabili del funzionamento di specifici processi fisiologici e a collegare le varie modificazioni con gli eventi patologici, i confini tra fisiologia e patologia della cellula si sono progressivamente confusi. D'altra parte, molte delle lesioni descritte in maniera tradizionale sono talvolta considerate di dubbio significato patologico (come, per es., la degenerazione ialina o quella grassa) oppure di significato largamente aspecifico, come risultato di condizioni di disagio cui le cellule sono state sottoposte.
Morte della cellula: apoptosi e necrosi
In ogni organismo, la proliferazione è controbilanciata, almeno in larga misura, dalla morte delle cellule. Dallo studio sia dello sviluppo embrionale che della fisiologia di specifici tipi cellulari, come le cellule del sangue e quelle immunocompetenti, è stato chiarito che la morte cellulare può essere conseguenza di due processi profondamente diversi: morte programmata, o apoptosi, e morte occasionale, o necrosi. L'apoptosi non è un evento imprevisto per la cellula, ma piuttosto l'attivazione di un programma mediato dalla sintesi di specifiche proteine e inibito da altre, la più famosa delle quali è il prodotto del protoncogene BCL-2. Una volta entrata nel programma, la cellula va incontro a una serie di modificazioni molto vistose: condensazione ed estesa idrolisi del DNA, condensazione e progressiva frammentazione del citoplasma; i frammenti così prodotti sono rapidamente fagocitati dalle cellule adiacenti e/o da macrofagi, con rapida digestione lisosomiale delle molecole e riutilizzo dei componenti base a fini sintetici. Il processo è rapido e finisce per non lasciar traccia, dato che non stimola reazioni infiammatorie o di altra natura.
Lesioni di qualunque natura (fisica, chimica, traumatica, ecc.) possono indurre morte cellulare attraverso l'altro meccanismo, la necrosi. In questo caso ha luogo non tanto condensazione, quanto rigonfiamento e disorganizzazione di nucleo e citoplasma, con rottura della membrana plasmatica e fuoriuscita del citosol. Il processo richiama leucociti e linfociti, con formazione di infiltrati che possono durare anche a lungo. Nel processo di necrosi un ruolo importante è attribuito al Ca2+, il cui aumento nel citoplasma provoca attivazione di enzimi (proteasi, nucleasi) che digeriscono il materiale cellulare. Nel caso dei neuroni anche processi prolungati di iperstimolazione si sono dimostrati capaci di indurre morte Ca2+-dipendente, oggi nota come 'eccitotossicità'.
Le cellule tumorali
In generale, le cellule tumorali mantengono proprietà tipiche dei tessuti di origine, accompagnate da un variabile stato di sdifferenziamento e da frequenti aberrazioni di crescita, dovute anche alle condizioni di vascolarizzazione del tumore. Se messe in coltura si osserva un aumento della frequenza delle mitosi, minore dipendenza da siero e fattori di crescita, perdita dell'inibizione da contatto. Il grande progresso degli ultimi decenni è rappresentato dall'identificazione di una serie di geni specifici per proteine che regolano la crescita cellulare, la cui alterazione (in genere per mutazione puntiforme) aumenta la probabilità di uno sviluppo tumorale della cellula (protoncogeni). I prodotti dei vari protoncogeni sono tutti responsabili di specifici passaggi nella catena di reazioni scatenate da fattori di crescita, a partire dai recettori fino ai fattori di trascrizione nucleari. Una lesione molecolare multipla risulterà quindi inevitabilmente sinergica, travolgendo i meccanismi di compenso e inducendo irreversibili cambiamenti fenotipici e funzionali.
Le malattie genetiche
Più di cinquemila malattie sono oggi riconosciute come genetiche, dovute cioè a mutazioni, in genere germinali, di singoli geni. Molte volte la lesione colpisce in modo specifico un organello. Le conseguenze cellulari possono essere varie. Alcune volte riguardano direttamente le strutture lese: per esempio, si ha accumulo di sostanze nei lisosomi (tesaurismosi) o degenerazione dei mitocondri; altre volte le conseguenze sono soprattutto indirette, come nel caso della distrofia muscolare, in cui l'apparato contrattile del muscolo tende a degenerare, mentre la lesione genetica riguarda una proteina periferica della membrana; in altri casi ancora, infine, la lesione molecolare può affiorare funzionalmente solo in condizioni particolari dell'organismo.
Bibliografia
Berridge 1993: Berridge, Michael J., Inositol trisphosphate and calcium signalling, "Nature", 361, 1993, pp. 315-325.
Egan, Weinberg 1993: Egan, Sean E. - Weinberg, Robert A., The pathway to signal achievement, ‟Nature", 365, 1993, pp. 781-783.
Hall, Sanes 1993: Hall, Zach - Sanes, Joshua R., Synaptic structure and development: the neuromuscular junction, "Cell", 72 (suppl.), 1993, pp. 99-121.
Pozzan 1994: Pozzan, Tullio e altri, Molecular and cellular physiology of intracellular calcium stores, "Physiological reviews", 74, 1994, pp. 595-636.