Cluster atomici e molecolari
Cluster atomici e molecolari
In chimica e in fisica con i termini di microaggregato o di cluster si indica un insieme di atomi o di molecole con proprietà particolari, intermedie tra quelle di una molecola singola e quelle di un solido. Infatti, se si suddivide ripetutamente un solido, per esempio un metallo, si otterranno frammenti sempre più piccoli che conservano le tipiche caratteristiche del metallo massivo, sino a che le particelle diventano così piccole da contenere solo alcune migliaia o alcune centinaia di atomi. Si entra, allora, nel dominio colloidale in cui le particelle, pur avendo perso la loro individualità atomica, assumono proprietà peculiari, diverse da quelle proprie degli stati condensati, liquido e solido. Per chiarire il procedimento illustrato è sufficiente pensare che 59 grammi di nichel, ovvero una quantità pari a un grammo atomo di sostanza, occupano allo stato solido un volume di qualche centimetro cubico, e contengono un numero di atomi pari al numero di Avogadro, circa 6 ×1023. Se si suddivide ripetutamente il solido, in modo da ottenere particelle di un milionesimo di grammo, aventi un volume di 10−6 cm3, ognuna di esse contiene ancora circa 1016 atomi di nichel. Queste particelle conservano le proprietà di un pezzo di metallo del peso di un grammo o di una tonnellata. Solo procedendo ulteriormente nella suddivisione si entra nel mondo dei colloidi, in cui sono incluse particelle con proprietà uniche, già osservate nella seconda metà dell'Ottocento da vari chimici. Si tratta di uno stato di aggregazione il cui studio fa sorgere diversi problemi per la chimica e la fisica della materia, e la cui applicazione apre nuove prospettive nel campo della scienza dei materiali.
Anzitutto, ci si chiede quanti atomi siano necessari per poter osservare la transizione dallo stato di microaggregato a quello solido (o liquido) vero e proprio. La risposta non può essere univoca, poiché alcune delle proprietà chimico-fisiche di un cluster evolvono verso quelle del solido, all'aumentare delle sue dimensioni, con un andamento e con una rapidità differenti. Uno stesso aggregato può mostrare alcune proprietà simili a quelle del corrispondente stato condensato, mentre altre proprietà sono molto diverse. Tale varietà di comportamenti rende questa classe di materiali assai interessante, non solo dal punto di vista della ricerca fondamentale, ma anche da quello applicativo.
Uno dei problemi fondamentali della ricerca sui cluster è la loro metastabilità, poiché essi tendono a evolvere spontaneamente verso uno stato di aggregazione più stabile, liquido o solido. Sorge, quindi, il problema di impedire la riaggregazione dei singoli cluster, tenendoli separati abbastanza a lungo da poterne studiare le caratteristiche e sfruttarne le eventuali proprietà.
La potenziale importanza dei cluster è stata intuita molto tempo fa dal chimico inglese Robert Boyle. Nel suo libro The sceptical chymist, pubblicato nel 1661, vengono infatti menzionate masse minuscole o aggregati, difficili da scindersi nelle particelle costitutive. Una volta formatisi essi, mostrano la tendenza a combinarsi assieme per dare origine a entità sempre più grandi e aventi le tipiche caratteristiche del solido.
Solo da pochi decenni sono state messe a punto opportune tecniche per generare e analizzare microaggregati di varie dimensioni attraverso due approcci diversi: uno chimico e uno fisico. Nel primo caso, mediante sintesi condotte in un solvente, si ottengono microaggregati di diversi elementi, principalmente di metalli di transizione, che sono poi stabilizzati da molecole leganti, le quali formano una sorta di guscio protettivo che ne impedisce l'ulteriore aggregazione. Nel secondo caso, per vaporizzazione del metallo e combinazione diretta degli atomi allo stato gassoso, sono generati microaggregati contenenti da 2 o 3 sino a qualche migliaio di atomi. (fig. 1)
Microaggregati stabilizzati da ligandi
Storicamente, i composti di questo tipo, i primi a essere stati scoperti e identificati, hanno dato origine a una nuova branca della moderna chimica inorganica chiamata chimica dei composti a grappolo o chimica dei composti organometallici polinucleari.
Cluster di elementi in alto stato di ossidazione
La prima grande categoria di composti polinucleari è costituita da alcuni atomi di metallo, tipicamente 6÷8, circondati da atomi leganti fortemente elettronegativi, ossia con spiccata tendenza ad acquistare elettroni, come il cloro (Cl), lo zolfo (S), l'ossigeno (O), e così via. In questo caso gli atomi di metallo del cluster cedono elettroni agli atomi o ai gruppi leganti che li circondano, assumendo quindi uno stato di ossidazione positivo. Molti di questi composti hanno formule del tipo [M6X8] e [M6X12], dove M indica un metallo di transizione, quale il molibdeno (Mo) o il tungsteno (W), e X un atomo di Cl o di S. Allorché queste unità, condensate allo stato solido, vengono combinate con un terzo tipo di atomo, per esempio il piombo (Pb), formano composti di grande interesse, le cosiddette fasi di Chevrel, con insolite caratteristiche elettriche e magnetiche.
Purtroppo, sinora non è stato possibile ottenere per questa via composti in cui l'aggregato metallico contenga più di una decina di atomi; pertanto questi sistemi sono di minor interesse per lo studio dell'evoluzione delle proprietà di un aggregato in funzione del suo accrescimento.
Cluster di elementi in basso stato di ossidazione
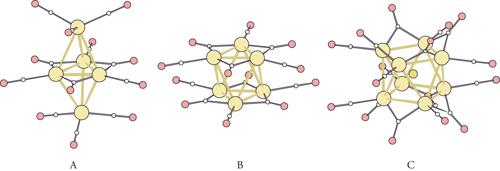
La seconda classe di composti polinucleari è costituita da gruppi di atomi di metallo in numero variabile da 2 o 3 ad alcune decine, completamente circondati da piccole molecole elettricamente neutre, come il monossido di carbonio (CO), l'ossido d'azoto (NO), le fosfine (PR3, dove R indica un radicale organico: metile, etile, benzile, ecc.), e composti analoghi, che vengono chiamati ligandi. Queste molecole si legano agli atomi di metallo e formano una sorta di involucro protettivo, o sfera , al cui interno si trova l'aggregato metallico. Poiché le molecole leganti hanno poca tendenza a cedere o acquistare elettroni, in questi composti gli atomi di metallo si trovano in un basso stato di ossidazione, intendendo con ciò che nella formazione del legame con i ligandi hanno sostanzialmente mantenuto gli elettroni che possegono nell'atomo libero. Esempi classici di questi composti sono i cluster carbonilici del Ni, [Ni5(CO)12]2−, [Ni6(CO)12]2− o [Ni8C(CO)16]2− (fig. 2).
I composti polinucleari di metalli in bassi stati di ossidazione si sono rivelati assai promettenti per lo studio della transizione dalle proprietà tipicamente molecolari a quelle parzialmente metalliche. Finora sono stati sintetizzati per via chimica più di un migliaio di composti di questo tipo contenenti sino a 50 e più atomi di metallo. I vantaggi offerti dai cluster organometallici sono sostanzialmente legati al modo con cui vengono ottenuti, ossia mediante sintesi chimica. Questo approccio permette di ricavare quantità apprezzabili di materiale, dell'ordine dei milligrammi e dei grammi, e quindi consente un'accurata caratterizzazione dell'aggregato con tecniche di analisi chimico-fisica.
Caratterizzazione strutturale di cluster con ligandi
In molti casi è possibile ottenere i cluster allo stato solido sotto forma di cristalli regolari. Nel caso di aggregati neutri, per esempio Co6(CO)16, si formano solidi molecolari, mentre più spesso in soluzione si formano cluster carichi elettricamente, come [Ni5(CO)12]2−, che, in presenza di controioni di dimensioni appropriate, possono venire cristallizzati sotto forma di solidi ionici. In questo modo, si ottengono insiemi di aggregati metallici di identiche dimensioni, immersi in una matrice dielettrica solida formata dai ligandi e dai controioni. In questi casi è possibile determinare la struttura del grappolo metallico mediante tecniche di diffrazione dei raggi X.
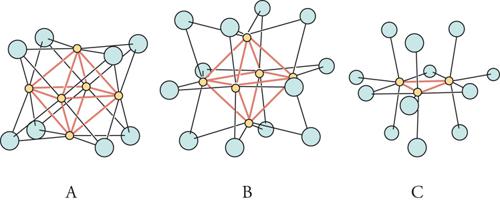
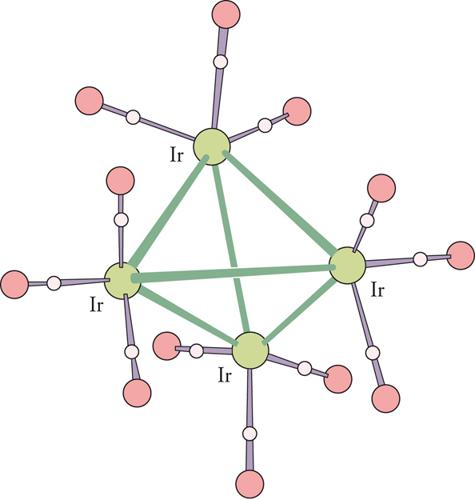
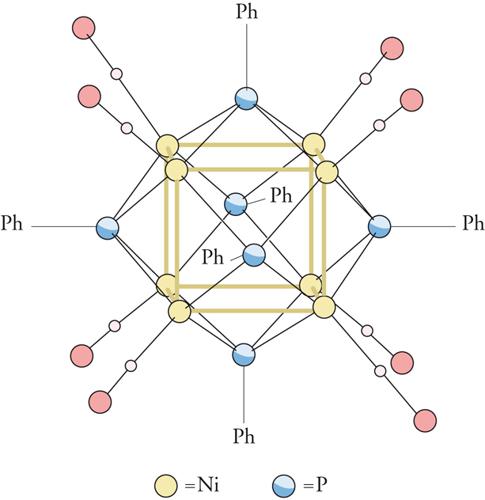
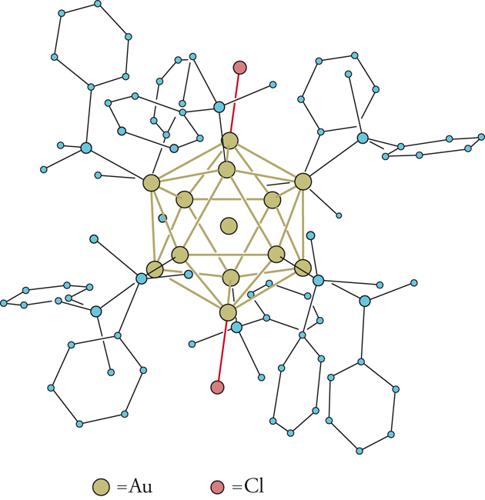
La struttura ai raggi X ha chiaramente messo in evidenza che il nocciolo metallico del cluster assume forme basate su poliedri regolari. Per esempio, nel composto Ir4(CO)12 i 4 atomi di iridio (Ir) formano un tetraedro (fig. 3); nel Ni8(CO)8(PPh)6 gli 8 atomi di nichel (Ni) sono disposti ai vertici di un cubo (fig. 4); mentre nel [Rh13H(CO)24]4− i 13 atomi di rodio (Rh) formano un cubo-ottaedro centrato. Non mancano nemmeno casi di simmetria pentagonale, come per esempio in [Au13Cl2(PR3)10]3+, in cui gli atomi di oro (Au) definiscono un icosaedro centrato (fig. 5).
Sono state formulate numerose teorie per dar conto di questo affascinante aspetto della chimica dei composti a cluster col particolare obiettivo di stabilire come procede la loro crescita all'aumentare delle loro dimensioni. Va detto, però, che, mentre gli esempi di composti polinucleari contenenti sino a una decina di atomi metallici sono molto numerosi, quelli di composti ad alta nuclearità, ossia contenenti qualche decina di atomi e per i quali è stata possibile una caratterizzazione strutturale ai raggi X, sono relativamente pochi.
Cluster di dimensioni molto grandi, dell'ordine delle decine o centinaia di atomi, sono praticamente impossibili da ottenere allo stato cristallino e più spesso si trovano sotto la forma di dispersioni colloidali. In assenza di cristalli ben formati, la tecnica solitamente utilizzata per la caratterizzazione strutturale è la microscopia elettronica a trasmissione o TEM (Transmission electron microscopy), anche se in certi casi il nocciolo metallico risulta abbastanza grande da poter rivelare la presenza di un impaccamento regolare degli atomi metallici mediante tecniche di diffrazione dei raggi X.
Analogia cluster-superfici
Lo studio strutturale dei cluster organometallici ha evidenziato una serie di analogie con le superfici metalliche su cui vengano adsorbite specie atomiche o molecolari. In particolare, le distanze metallo-ligando, nonché gli angoli di legame, spesso sono assai simili quando si confrontino i ligandi di un cluster con le stesse molecole adsorbite su una ben precisa faccia cristallografica di un metallo. Anche i dati spettroscopici, spesso utilizzati come una sorta di impronte digitali della natura di un dato ligando, sono risultati del tutto confrontabili nei due casi.
Un classico esempio è rappresentato dalla molecoladi CO, che è uno dei ligandi più diffusi nella chimica organometallica, ma ha una notevole importanza anche come reagente e come intermedio nella catalisi eterogenea. Per questo motivo il suo adsorbimento su superfici di metalli di transizione è stato studiato in modo molto dettagliato. Il CO può legarsi a 1 atomo singolo, 'a ponte' tra 2 atomi adiacenti e infine su un sito in cui l'interazione avviene contemporaneamente con 3 atomi metallici. Questi tipi di coordinazione sono stati osservati sia in cluster carbonilici sia su superfici solide: geometrie di legame, frequenze vibrazionali, nonché spettri di fotoemissione sono risultati del tutto confrontabili nei due casi. Ciò è dovuto al fatto che il tipo di legame è praticamente lo stesso sia che il CO sia legato a un cluster di pochi atomi, sia che interagisca con una superficie metallica, e quindi anche le sue conseguenze strutturali e spettroscopiche sono molto simili.
Un comportamento analogo è stato osservato anche per numerose altre specie molecolari. Ciò ha portato, verso la fine degli anni Settanta, a formulare la cosiddetta analogia cluster-superfici. Il confronto di tutta una serie di dati strutturali, spettroscopici e termodinamici ha permesso di stabilire che le interazioni tra una molecola e un cluster mostrano una certa analogia con le interazioni tra la stessa molecola e una superficie metallica. Va detto, però, che studi teorici successivi e tecniche di indagine superficiale hanno mostrato che l'analogia cluster-superfici non può essere spinta oltre un certo limite. Essa, soprattutto, riflette il fatto che il legame tra una molecola e gli atomi di metallo della superficie è di natura molto locale, nel senso che coinvolge soltanto i pochi atomi direttamente a contatto con la molecola stessa e non si estende al di là di questi. Che questi atomi facciano parte di un solido esteso (come nel caso di una superficie) o che siano circondati solo da pochissimi altri atomi metallici (come nel caso di un microaggregato) fa poca differenza ai fini del legame con la molecola.
Microaggregati in getti molecolari
A differenza dei cluster organometallici, che si possono ottenere in fase condensata e, in particolare, allo stato solido anche in forma cristallina, cluster senza ligandi si ottengono principalmente allo stato gassoso. Si tratta di cluster liberi o nudi, come talora vengono chiamati, che devono essere distinti dalle molecole presenti in una fase gassosa. Se, per esempio, consideriamo lo zolfo o il fosforo cristallini e ne analizziamo la struttura, scopriremo che essi sono formati rispettivamente da anelli di 8 atomi di zolfo e da tetraedri di 4 atomi di fosforo disposti regolarmente nel reticolo cristallino. Se si vaporizza il solido, il vapore in equilibrio termodinamico è formato da unità S8 e P4, che esistono in natura con una elevata stabilità e pertanto possono essere considerate molecole a tutti gli effetti, diversamente dai cluster nudi.
Tecniche di produzione di cluster gassosi
I primi microaggregati in fase gassosa sono stati ottenuti vaporizzando il metallo in un forno e facendolo quindi depositare sotto forma di aggregati di varie dimensioni su un substrato inerte. Questo approccio, però, non consente di selezionare le masse dei cluster, che si formano con una distribuzione molto variabile delle dimensioni, da pochi atomi sino a molte migliaia. La mancanza di selettività nella formazione dei cluster costituisce un limite assai serio all'uso di questa tecnica. Agli inizi degli anni Ottanta, è stato messo a punto un metodo più generale basato sulla tecnologia laser. Focalizzando il fascio di luce di un laser su un dischetto di metallo si provoca la vaporizzazione degli atomi del metallo e la formazione di un plasma costituito da atomi isolati a elevata temperatura. A questo punto, nella camera di vaporizzazione viene immessa una corrente di elio che raffredda il plasma provocando l'aggregazione degli atomi e la formazione di cluster di varia nuclearità. Questi, quindi, vengono fatti passare attraverso una piccola apertura in una camera ad alto vuoto, dove la differenza di pressione provoca l'espansione del getto dei cluster a velocità supersonica. In questa fase i cluster si raffreddano e si stabilizzano; si trovano però mescolati aggregati di dimensioni assai diverse, che devono essere selezionati e divisi a seconda delle dimensioni stesse prima di poterli studiare con tecniche spettroscopiche. Microaggregati prodotti in questo modo hanno vite medie che vanno dai nanosecondi (ns) aimicrosecondi (μs), sufficienti comunque per separarli e analizzarli.
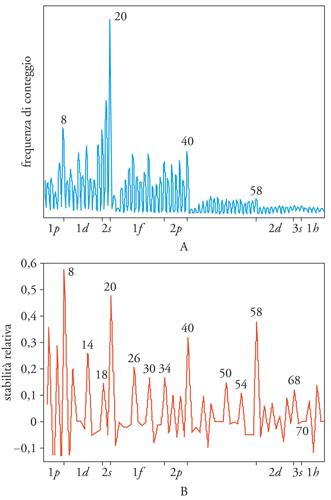
Per selezionare i cluster in base alla loro dimensione si irradia il getto dei cluster con un laser ultravioletto che ha un'energia sufficiente per strappare un elettrone dall'aggregato e ionizzarlo. Quindi, da oggetti neutri si passa ad aggregati ionizzati, carichi positivamente, che possono essere accelerati in un campo elettrico esterno. Questo dispositivo, noto come spettrometro di massa a tempo di volo, accelera in modo diverso i vari cluster a seconda della loro massa per cui gli aggregati più piccoli raggiungono un analizzatore prima di quelli più pesanti. In questo modo i cluster vengono suddivisi per massa e quindi per numero di atomi (fig. 6).
Stabilità dei cluster e 'numeri magici'
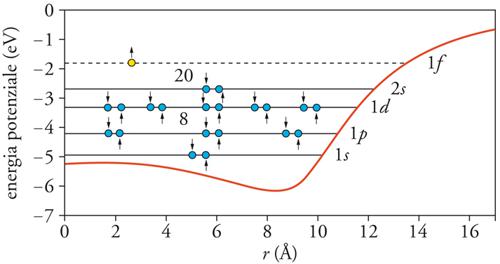
La tecnica di selezione dei cluster ha permesso di stabilire che le abbondanze relative di aggregati di diversa nuclearità sono assai differenti e risultano molto accentuate in corrispondenza di particolari dimensioni. Chiaramente, l'abbondanza di un certo tipo di cluster è determinata dalla sua stabilità: cluster energeticamente più stabili hanno più probabilità di formarsi durante il processo di aggregazione. Stabilità elevate sono state osservate per certi particolari numeri di atomi, chiamati pertanto numeri magici. La loro esistenza è stata razionalizzata grazie a un modello teorico, noto come shell model, analogo a quello quantistico del nucleo atomico. In esso si presume che il cluster raggiunga una stabilità particolarmente elevata in corrispondenza del riempimento completo dei livelli energetici generati da un potenziale di tipo sferico determinato dalle cariche nucleari (fig. 7). Questo riempimento completo avviene solo in corrispondenza di particolari numeri di elettroni e quindi di nuclei atomici. Il modello si è mostrato assai utile per spiegare i numeri magici di cluster in cui gli elettroni sono altamente delocalizzati, non legati cioè a un particolare nucleo atomico o a una coppia di nuclei come avviene nelle molecole. Questo comportamento è caratteristico dei metalli con un solo elettrone nell'orbitale s più esterno, come gli alcalini (litio, sodio, potassio, ecc.) e i metalli da conio (rame, argento, oro). Per questi elementi lo shell model ha dato risultati interessanti. Nei casi in cui l'aggregato sia formato da elementi nei quali gli elettroni esterni occupano orbitali di tipo p e d, che non hanno una simmetria sferica come l'orbitale s, i legami tra atomo e atomo tendono a essere più localizzati e lo shell model non è applicabile.
Evoluzione delle proprietà al crescere dell'aggregato
Come si è accennato, una motivazione che ha dato impulso allo studio di cluster in fase gassosa è stata quella di evidenziare in che modo evolvono le loro proprietà elettroniche all'aumentare delle dimensioni. Una delle proprietà che è stata misurata sin dall'inizio delle ricerche è il potenziale di ionizzazione, ossia l'energia richiesta per rimuovere un elettrone dall'aggregato neutro. Si procede irradiando i cluster con luce laser che possiede una frequenza corrispondente a una bassa energia, aumentandola via via sino a che vengono rilevati nello spettrometro di massa i primi cluster ionizzati. Riportando in un grafico il potenziale di ionizzazione in funzione della massa degli aggregati si è notato che esso diminuisce in modo non regolare e che certi aggregati mostrano potenziali di ionizzazione particolarmente alti o bassi. Questo fatto è strettamente legato alla loro struttura elettronica e ne costituisce, in un certo senso, una caratteristica peculiare. In ogni caso, man mano che il cluster diviene più grande il potenziale di ionizzazione diminuisce e tende verso il valore del lavoro di estrazione del metallo; in realtà la coincidenza fra i due valori si verifica soltanto con aggregati di grandi dimensioni, contenenti migliaia di atomi.
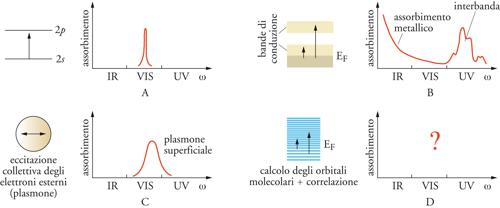
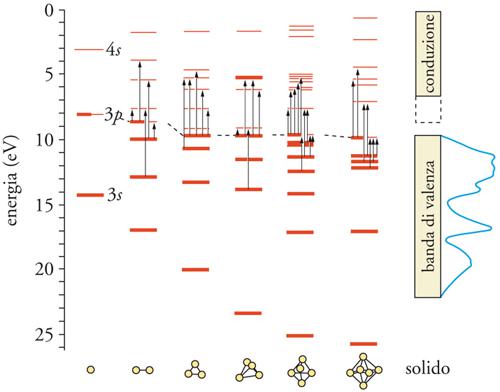
Di grande interesse per lo studio della transizione da microaggregato a solido è lo studio delle proprietà ottiche, ossia della risposta all'interazione con la luce. Un singolo atomo di litio ha uno spettro di assorbimento molto semplice, che consiste essenzialmente in una riga nella regione del visibile (fig. 8A). Questo assorbimento è dovuto a una transizione elettronica dal livello 2s al livello 2p dell'atomo. Il litio metallico, d'altra parte, ha uno spettro di assorbimento completamente differente. L'assorbimento della luce è molto forte nella regione del lontano infrarosso, passa attraverso un minimo nella regione del visibile e quindi torna a crescere nell'ultravioletto (fig. 8B). Ciò è dovuto al fatto che fotoni a energia molto bassa come quelli del lontano infrarosso possono eccitare elettroni dagli stati del continuo appena al di sotto del livello di Fermi a stati energetici vuoti appena al di sopra di esso. In un ipotetico aggregato di circa 50 atomi, lo spettro di assorbimento della luce cambia ancora e nel visibile appare un massimo di assorbimento piuttosto largo (fig. 8C). Questo assorbimento è dovuto a un'eccitazione collettiva degli elettroni esterni chiamata plasmone che può essere considerato come un movimento collettivo di tutti gli elettroni di valenza da una parte all'altra dell'aggregato. Questo moto comporta un elevato momento di dipolo e un forte assorbimento di luce nel visibile. Quando il cluster diviene ancora più piccolo, sino a contenere pochi atomi, il suo spettro di assorbimento dipende in modo diretto dalla disposizione dei nuclei, per cui ogni cluster presenta uno spettro caratteristico e unico.
La natura dell'interazione fra radiazione e materia in un cluster è strettamente legata alla struttura elettronica di questo. I livelli elettronici di un sistema di pochi atomi sono discreti, ossia con valori dell'energia ben distanziati. Al crescere del numero di atomi nell'aggregato essi infittiscono sino a formare un continuo dove non è più possibile distinguere tra un livello energetico e il successivo. In questo caso si parla della formazione di bande che possono essere occupate o vuote a seconda della loro posizione rispetto al livello di Fermi. La differenza di energia tra bande occupate e vuote, chiamata anche band gap, è un'importantissima caratteristica di un solido, in quanto ne determina il comportamento (metallico, isolante o semiconduttore) (fig. 9). In un aggregato, molte di queste caratteristiche elettroniche non sono facilmente quantificabili sperimentalmente, mentre lo sono per mezzo di calcoli teorici basati sui principî della meccanica quantistica. Questi metodi, che si basano sulla soluzione numerica dell'equazione di Schrödinger per sistemi costituiti sino a qualche decina di atomi, offrono risposte assai accurate sia sulla struttura elettronica che su quella geometrica dei microaggregati.
Numerose altre proprietà chimico-fisiche dei microaggregati sono divenute accessibili negli ultimi anni grazie al poderoso sviluppo di nuove tecniche sperimentali. è importante, a tale proposito, citare la misura del punto di fusione di un microaggregato condotta attraverso esperimenti di microscopia elettronica e con tecniche di diffrazione elettronica. Il suo valore è risultato assai più basso di quello del metallo.
Al di sopra di una certa dimensione critica, dell'ordine almeno delle decine di atomi, i cluster cominciano ad assumere una struttura ordinata tale che ogni volta che viene aggiunto un nuovo atomo non viene più modificata la loro forma. In pratica ha inizio la formazione di un reticolo ordinato di atomi all'interno dell'aggregato. Se, però, la temperatura esterna supera un certo valore, i moti termici degli atomi scardinano tale struttura ordinata e l'aggregato si comporta come un liquido, per cui si parla di fusione.
Aspetti applicativi
L'interesse applicativo per sistemi aventi dimensioni superiori a quelle di una molecola ma minori di quelle di un solido, per i quali è stato suggerito il nome di dimensioni mesoscopiche, è enormemente aumentato negli ultimi decenni. I corrispondenti materiali vengono spesso chiamati nanostrutturali, con un'espressione che fa riferimento alle loro piccole dimensioni. Tra di essi vanno annoverati i cluster, le cui potenziali applicazioni verranno brevemente discusse nel seguito.
Microaggregati in catalisi
I successi più significativi raggiunti nelle applicazioni della catalisi ai processi industriali, quali per esempio la raffinazione del petrolio, l'abbattimento di inquinanti o la sintesi di prodotti farmaceutici, fanno largo impiego di metalli supportati. La tendenza che si è manifestata nello sviluppo di tali catalizzatori è di impiegare dispersioni molto spinte dei componenti attivi del sistema catalitico presenti sul supporto, tanto da arrivare alla formazione di microaggregati.
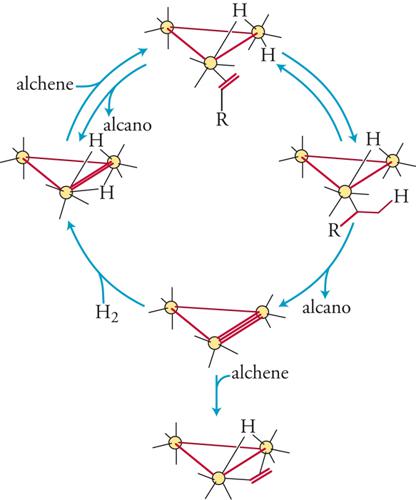
La possibilità di usare come substrati per il processo catalitico microaggregati di dimensioni e forma ben definite offre la possibilità teorica di ottenere reazioni ad altissima specificità, che possono avere luogo solamente su cluster dotati di una particolare forma e nuclearità. I primi tentativi di utilizzare cluster organometallici come catalizzatori in fase omogenea risalgono agli anni Settanta, quando si è avuto un forte impegno di ricerca in questa direzione. In realtà, le ricerche nel campo della catalisi omogenea, in cui si fa uso di composti organometallici polinucleari (fig. 10), sono poche, anche perché i cluster organometallici sono spesso sistemi troppo stabili per risultare buoni catalizzatori. L'efficienza di un catalizzatore, infatti, dipende non solo dalla sua capacità di legare a sé i reagenti in modo da permetterne l'adsorbimento, ma anche da quella di trattenere i prodotti della reazione in modo sufficientemente debole da consentirne il desorbimento.
Un'importante alternativa all'uso dei cluster in fase liquida è quella di depositare i cluster organometallici su un substrato inerte, di solito un ossido tipo MgO, Al2O3 o SiO2, o nelle cavità di materiali porosi, come le zeoliti. Per semplice riscaldamento il cluster perde i ligandi e sulla superficie o nelle cavità zeolitiche rimangono piccole particelle metalliche di dimensioni ben definite e con attività catalitica molto pronunciata. Queste tecniche hanno dato vita a una nuova disciplina chiamata chimica organometallica di superficie.
Microaggregati come nuovi materiali nanostrutturali
L'utilizzazione dei microaggregati come materiali di interesse tecnologico è ancora nella sua infanzia, anche se sembra aprire prospettive molto interessanti in alcune ben definite direzioni. Per esempio, sottili pellicole di aggregati con proprietà elettroniche, ottiche e magnetiche speciali possono risultare di grande utilità pratica in microelettronica, nel settore delle memorie ottiche e magnetiche. È possibile che i microaggregati possano essere utilizzati anche per ottenere pellicole fotografiche ad alta risoluzione e per l'alimentazione chimica dei laser. Sono già stati ottenuti materiali ceramici per assemblaggio di microaggregati che uniscono proprietà di duttilità a quelle di inerzia termica e di durezza tipica di tali materiali.
Il campo di applicazione potenziale dei microaggregati è vastissimo e in gran parte ancora inesplorato. Le ricerche sono altamente interdisciplinari e richiedono competenze in settori diversi, come la chimica, la fisica, la scienza e la tecnologia dei materiali. Considerati i successi spettacolari riportati finora, nei prossimi anni è più che lecito attendersi ulteriori sviluppi che portino a notevoli avanzamenti tanto nella comprensione della struttura della materia quanto a livello tecnologico e applicativo.
Bibliografia
De Jongh 1994: Physics and chemistry of metal cluster compounds, edited by L. J. de Jongh, Dordrecht, Kluwer, 1994.
Kreibig, Vollmer 1995: Kreibig, Uwe - Vollmer, Michael, Optical properties of metal clusters, Berlin, Springer, 1995.
Kroto 1991: Kroto, Harry W. - Allaf, A. Wahalo - Balm, Simon P., C60 Buckminsterfullerene, ‟Chemical reviews", 91, 1991, pp. 1213-1235.
Martin 1996: Large clusters of atoms and molecules, edited by T. Patrick Martin, Berlin, Springer Netherlands, 1996.
Siegel 1993: Siegel, Richard W., Exploring mesoscopia: the bold new world of nanostructures, ‟Physics today", 46, 1993, pp. 64-68.
Simon 1994: Simon, Arndt, Discrete and condensed transition metal clusters in solids, in: Clusters and colloids, edited by Günter Schmid, Weinheim-London, VHC, 1994, pp. 373-458.
Van Staveren 1991: van Staveren, M.P.J. - Brom, H.B. - de Jongh, L.J., Metal cluster compounds and universal features of the hopping conductivity of solids, ‟Physics reports", 208, 1991, pp. 1-96.