Come i parassiti inattivano la sorveglianza immunitaria: il caso del protozoo Leishmania
Come i parassiti inattivano la sorveglianza Immunitaria: il caso del protozoo Leishmania
I parassiti hanno bisogno di altri organismi per completare il loro ciclo cellulare. Nei vertebrati che li ospitano essi devono far fronte sia alla risposta immunitaria innata che a quella acquisita e hanno pertanto sviluppato alcuni sistemi per inattivare la sorveglianza immunitaria e riuscire a portare a termine il loro ciclo cellulare. In questo saggio verrà illustrato come il protozoo intracellulare Leishmania major adotti specifiche strategie per inattivare i meccanismi immunitari e come un modello murino costituito da topi suscettibili e resistenti abbia contribuito notevolmente a chiarire i meccanismi immunitari che permettono o meno a L. major di sopravvivere nei loro ospiti. In particolare, nell'ambito dell'interazione tra ospite e parassita, hanno assunto un significato critico due popolazioni linfocitarie (TH1 e TH2) in grado di produrre citochine capaci di favorire la risposta immunitaria o, al contrario, di bloccare il potere difensivo del sistema immunitario nei confronti di L. major.
Introduzione
In molti paesi in via di sviluppo, le infezioni parassitarie rappresentano un grave problema per la salute pubblica e un notevole ostacolo al progresso socio-economico. Negli anni Ottanta e Novanta, sono stati fatti grandi passi avanti nella comprensione dei meccanismi alla base della risposta immunitaria contro varie malattie parassitarie e dei fattori che contribuiscono ai processi immunopatologici cronici. Sfortunatamente, nonostante questi importanti e significativi progressi, non è stato ancora raggiunto l'obiettivo di sviluppare misure immunoprofilattiche efficaci, da attuare nelle aree in cui le malattie parassitarie sono endemiche. Le difficoltà incontrate nel raggiungimento di tale obiettivo dipendono, almeno in gran parte, dal fatto che molti parassiti, una volta invaso il loro ospite, sviluppano la capacità di sopravvivere e crescere anche in presenza di una potente risposta immunitaria specifica. Inoltre, le strategie sviluppate dai singoli parassiti per sottrarsi ai meccanismi dell'immunità innata, o per evitare o inattivare le risposte immunitarie acquisite messe in atto dal loro ospite, sono abbastanza specifiche e tipiche per ogni singola coppia parassita-ospite e riflettono il coadattamento dei due genomi.
Piuttosto che enumerare le diverse strategie sviluppate dai singoli parassiti per sopravvivere anche quando devono fronteggiare risposte immunitarie potenti, in questo saggio intendiamo focalizzare l'attenzione sui risultati recentemente ottenuti nella caratterizzazione dei fattori immunologici dell'ospite che determinano la resistenza e la suscettibilità al parassitismo, utilizzando come sistema di riferimento il parassita intracellulare Leishmania spp. Questi protozoi sono capaci di portare a termine il loro ciclo cellulare negli esseri umani e in molte altre specie di mammiferi. I parassiti, una volta iniettati nella loro forma flagellata (promastigoti) attraverso la puntura di moscerini della sabbia nel derma dei mammiferi, sono rapidamente inglobati dai fagociti mononucleati localizzati nel derma, all'interno dei quali assumono la forma aflagellata (amastigoti).
Negli uomini, l'infezione causata da Leishmania può svilupparsi in modo clinicamente silente o portare a una gamma di manifestazioni patologiche, a seconda della specie e dell'assetto genetico dell'ospite. Le forme cliniche delle principali categorie di leishmaniosi includono la leishmaniosi cutanea, caratterizzata dalla formazione, nella sede della puntura, di lesioni cutanee che guariscono spontaneamente; la leishmaniosi mucocutanea che si ritiene sia dovuta a metastasi dei microrganismi che, dalle lesioni cutanee iniziali, si estendono alle mucose e sono in grado di produrre un grave danno ulcerativo nei tessuti molli della cavità nasale e orofaringea; la leishmaniosi viscerale, caratterizzata dall'infestazione di molti tessuti, tra cui in particolare il midollo osseo, la milza e il fegato, con notevole ingrossamento degli ultimi due organi citati (Sacks et al., 1993).
Forti evidenze sperimentali dimostrano che la risoluzione dell'infezione, spontanea o a seguito di chemioterapia, è accompagnata da uno stato di persistente immunità alla reinfezione. Dato l'elevato costo della terapia farmacologica, in particolare per i paesi in via di sviluppo, la vaccinazione potrebbe essere un mezzo importante, e sufficientemente economico, con cui controllare definitivamente le leishmaniosi. La progettazione razionale di tali vaccini dipende non solo dall'identificazione delle molecole del parassita che sono bersaglio delle risposte immunitarie protettive, ma anche da una precisa comprensione dei meccanismi cellulari e molecolari che conducono allo sviluppo e al mantenimento delle risposte immunitarie protettive.
Negli anni Novanta, lo studio di un modello murino di parassitismo da Leishmania major ha notevolmente contribuito al chiarimento dei meccanismi immunitari che limitano o favoriscono la sopravvivenza di questi parassiti nei loro ospiti. In questo saggio verranno riportati dati recenti ottenuti da una serie di ricerche svolte nei nostri e in altri laboratori, relativi alla caratterizzazione dei parametri cellulari e molecolari delle risposte immunitarie specifiche indotte nei topi dal parassita L. major e dei loro effetti sul destino finale dei parassiti. Accenneremo, inoltre, alla possibilità di applicare nell'uomo i risultati ottenuti in questo modello sperimentale.
Il modello murino di parassitismo da L. major
Quasi tutta la gamma di manifestazioni cliniche osservate negli uomini infettati da Leishmania può essere riprodotta nei topi preventivamente sottoposti a un inoculo sperimentale di L. major. I topi della maggior parte dei ceppi inbred, ottenuti dopo vari incroci sequenziali tra consanguinei (per esempio C3H/He, CBA/Ca, B10.D2, C57BL/6, 129/Sv/Ev), sono resistenti all'infezione. Questi ceppi murini sviluppano lesioni lievi, che guariscono spontaneamente, e diventano immuni alla reinfezione. Al contrario, i topi di un numero ridotto di ceppi inbred geneticamente suscettibili, come BALB/c, sviluppano gravi lesioni cutanee, che non guariscono, e non diventano immuni alla reinfezione (fig. 2). Gli studi effettuati in questo modello murino di parassitismo hanno contribuito in modo significativo alla comprensione di alcune delle complesse interazioni tra il sistema immunitario dell'ospite e L. major, parassita obbligato dei macrofagi.
Attivazione e inattivazione dei macrofagi
I risultati ottenuti da studi condotti sia su ospiti naturali (uomini infestati) sia sperimentali (topi) hanno dimostrato, in modo inequivocabile, che per la guarigione delle lesioni è necessario lo sviluppo di risposte immunitarie mediate dai linfociti T capaci di attivare, nei macrofagi che hanno fagocitato i parassiti, meccanismi che conducono all'uccisione dei protozoi. Quest'attivazione dei macrofagi implica la produzione dell'enzima iNOS (inducible Nitric-Oxide Synthase, ossido di azoto sintasi inducibile) che determina la sintesi, a partire dalla L-arginina, di radicali di ossido di azoto estremamente tossici per Leishmania intracellulare (Assreuy et al., 1994). Per questo meccanismo è importante la produzione di fattori solubili, le citochine, da parte di cellule T attivate in modo specifico (v. il saggio di A. Mantovani, Circuiti molecolari di regolazione del reclutamento leucocitario). La cito china fondamentale prodotta dalle cellule T, responsabile dell'attivazione dei macrofagi, è l'interferone γ (lFN-γ) che agisce in sinergia con il fattore di necrosi tumorale α (TNF -α, Tumor Necrosis Factor α) prodotto dai macrofagi stessi (Green et al., 1990). A conferma di queste conclusioni è stato dimostrato che i topi di un ceppo inbred resistente all'infezione, privati del gene codificante IFN-γ o il recettore di IFN-γ, non sono in grado di guarire le loro lesioni (Wang et al., 1994; Swihart et al., 1995). Al contrario, un'altra citochina, l'interleuchina-4 (lL-4) attivate, esercita una funzione opposta, inibendo l'attivazione dei macrofagi indotta da IFN-γ (Liew, 1989). Così topi transgenici IL-4, seppur di un ceppo normalmente resistente, non riescono a controllare l'infezione e diventano sensibili (Leal et al., 1993). Altre citochine sono in grado di ridurre la capacità di controllo dell'infezione da parte dei macrofagi. Esse sono IL-10, IL-13 e TGF-β che contrastano l'induzione di iNOS attivata da IFN-γ (Moore et al., 1993; Zurawski e De Vries, 1994).
Due sottopopolazioni parassita-specifiche di linfociti T CD4
È noto da tempo che nei topi la resistenza all'infezione da L. major dipende strettamente dall'attività delle cellule T (Mitchell et al., 1981). Usando anticorpi monoclonali che discriminano cellule T di sottopopolazioni differenti, è stato dimostrato che la guarigione delle lesioni nei topi appartenenti a ceppi resistenti è dovuta all'espansione e all'attività di una specifica sottopopolazione linfocitaria T CD4+. Alcuni anni fa si è avuta la dimostrazione che un fattore importante nella progressione della malattia era l'attività delle cellule T CD4 in espansione nei topi parassitati appartenenti a ceppi suscettibili all'infezione (Titus et al., 1987). Più precisamente Leishmania major si localizza nel compartimento fagolisosomiale dei macrofagi, dove avviene il processamento proteico per la presentazione dell'antigene sull'MHC (Major Histocompatibility Complex, complesso maggiore di istocompatibilità) di classe II. Questa particolare localizzazione spiega l'induzione preferenziale di cellule T CD4 specifiche per il parassita i cui recettori delle cellule T (TCR, T cell receptor) riconoscono peptidi presentati su molecole MHC II.
Studi in vitro hanno chiarito che i precursori delle cellule T CD4 possono differenziarsi in due sottopopolazioni distinte da un punto di vista funzionale, riconoscibili per la combinazione mutualmente esclusiva di cito chine che producono in seguito all'attivazione (Mosmann e Coffmann, 1989). Le cellule CD4 THl (T helper o coadiutrici di tipo l) producono IFN-γ e IL-2, mentre le cellule TH2 (T helper o coadiutrici di tipo 2) producono IL-4, IL-10 e IL-13 (v. il saggio di R.M. Steinman, nel II volume).
L'analisi particolareggiata dei meccanismi effettori, che si sviluppano lentamente dopo l'infezione dei topi con L. major e che giustificano la suscettibilità o la resistenza, ha rivelato in modo inequivocabile che queste opposte caratteristiche dipendono da due distinte sottopopolazioni di linfociti T CD4. La prima chiara correlazione tra le manifestazioni della malattia e la via differenziativa seguita in vivo dai linfociti T CD4 precursori è stata fornita da studi che hanno utilizzato il modello murino dell'infezione con L. major e hanno dimostrato chiaramente che, in seguito all'infezione da questo parassita, i topi resistenti attivano una risposta polarizzata di cellule CD4 T H l, mentre i topi suscettibili generano una risposta polarizzata di tipo CD4 TH2 (Sadick et al., 1989). La risposta guidata dalle cellule CD4 T H l è quindi di cruciale importanza nell' induzione della resistenza a L. major. Un'inequivocabile dimostrazione di ciò è rappresentata dall' osservazione che il trasferimento adottivo di linee cellulari CD4 T H l specifiche per il parassita in topi BALB/c, portatori della mutazione che causa la SCID (Severe Combined lmmunodeficiency Disease, sindrome da immunodeficienza grave combinata) e per natura estremamente suscettibili al parassita, li rende resistenti all'infezione (Holaday et al., 1991). Al contrario, il trasferimento di linee cellulari di tipo TH2 in topi affetti da SCID ha provocato, in seguito all'infezione, lo sviluppo di lesioni addirittura maggiori di quelle dei topi non trattati. Questi risultati dimostrano chiaramente che le cellule THl e TH2 specifiche per il parassita sono, rispettivamente, capaci di bloccare lo sviluppo delle lesioni o di favorire la progressione della malattia. La funzione effettrice anti-Leishmania delle cellule CD4 THl specifiche è mediata da IFN-γ, rilasciato dopo l'attivazione, che è in grado di conferire alla maggior parte dei macrofagi una potente attività parassiticida. Al contrario, la funzione effettrice pro-Leishmania dei linfociti CD4 T H2 specifici sembra essere mediata dal rilascio di IL-4, IL-10 e IL-13, interleuchine che inibiscono la capacità parassiticida dei macrofagi. Successivamente, è stato possibile chiarire la cinetica e la natura delle molecole di trasduzione del segnale responsabili di indirizzare i linfociti T CD4 precursori lungo una delle due vie differenziative in vivo. Le strategie usate si basano su differenti procedure sperimentali di manipolazioni di topi in vivo, tra cui l'eliminazione selettiva delle cellule immunocompetenti presenti in circolo, la neutralizzazione mirata e specifica delle varie cito chine e altre procedure che includono studi con topi transgenici (v. il saggio di M. Owen, Topi transgenici e topi knock out come modelli di immunodeficienza) o che portano mutazioni mirate, per esempio mediante distruzione genica.
Focalizziamo ora la nostra attenzione sulla natura e sulla funzione delle molecole di trasduzione del segnale che agiscono nei momenti immediatamente successivi all'infezione, all'interno degli organi linfoidi che drenano la zona cutanea in cui è penetrato il parassita. È ragionevole prevedere che soprattutto le cellule T vergini, che ricircolano in modo costitutivo all'interno di tali organi linfoidi, siano in grado di rispondere a segnali di differenziamento e polarizzazione nell'area che dipende dalle cellule T (Abbas et al., 1996; Fearon e Locksley, 1996).
Variabili iniziali che inducono la polarizzazione funzionale dei linfociti T CD4 precursori
Il processo di attivazione e differenziamento delle cellule T potrebbe dipendere da numerose variabili che si vengono a generare, in seguito all'infezione, nelle zone T -dipendenti degli organi linfoidi. Tra le diverse variabili di polarizzazione delle cellule T presentate in tabella (tab. I), le citochine sono state quelle più diffusamente studiate.
lL-12 è una citochina prodotta dai leucociti, come le cellule dendritiche e i fagociti mononucleati, con importanti funzioni per l'attivazione delle cellule T (Trinchieri, 1996). Nella risposta a Leishmania, questa citochina sembra giocare un ruolo protettivo, in quanto favorisce il differenziamento dei linfociti T CD4 in senso TH1. La somministrazione di IL-12 a topi suscettibili BALB/c durante i primi cinque giorni dall'infezione inibisce lo sviluppo di una risposta TH2 (Heinzel et al., 1993; Sypek et al., 1993), sfavorendo la crescita dei parassiti. Al contrario, il trattamento di topi C57BL/6, normalmente resistenti all'infezione, con anticorpi anti - IL-12, capaci di neutralizzare l'attività biologica della cito china, previene lo sviluppo di cellule T H l; questi topi vanno così incontro a importanti fenomeni patologici (Sypek et al., 1993). Inoltre, i topi knock out per IL-l2, cioè quelli in cui è stato distrutto il gene codificante questa citochina, pur avendo un assetto genetico resistente, non riescono a sviluppare correttamente una risposta THl e sono suscettibili all'infezione (Mattner et al., 1996).
La funzione di IL-12 è pertanto quella di favorire la risposta T H l, con azione protettiva, e contemporaneamente inibire l'attività TH2. Al contrario, sembra che IL-4 sia favorevole per il parassita. Inizialmente, è stato dimostrato che IL-4 era prodotta dai linfociti T H2 ma, successivamente, si è visto che IL-4 era sintetizzata anche da altri leucociti tra cui i mastociti baso fili ed eosinofili, popolazioni cellulari che risiedono in modo costitutivo nello spazio extravascolare o che possono penetrarvi in seguito ad alterazioni della permeabilità vasale e a reclutamento dal torrente circolatorio (v. il saggio di A. Mantovani, Circuiti molecolari di regolazione del reclutamento leucocitario). Non vi è dubbio che IL-4 favorisca lo sviluppo dei linfociti CD4 TH2 nei topi BALB/c suscettibili: l'iniezione di anticorpi monoclonali anti-IL-4 nella fase iniziale dell'infezione impedisce il differenziamento e l'espansione delle cellule T H2 e provoca lo sviluppo di una risposta THl protettiva (Sadick et al., 1990).
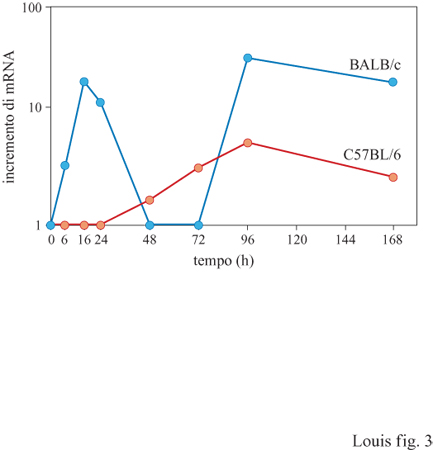
In base a questi risultati, che indicano il ruolo chiave di IL-4 e IL-12 nel differenziamento delle cellule T CD4, sono stati attuati degli esperimenti che confrontano direttamente le cinetiche di produzione di queste due cito chine all'interno dei linfonodi di topi resistenti e suscettibili. L'analisi di mRNA per IL-4 in questi topi è stata effettuata per 10 giorni consecutivi a partire dall'inoculo di L. major. Contrariamente ai topi resistenti, nei topi suscettibili compare un picco di mRNA specifico per IL-4, in un linfonodo drenante, appena 16 ore dopo l'infezione con L. major (Launois et al., 1995). Dopo questa iniziale iperproduzione, la trascrizione di mRNA specifico per IL-4 ritorna al livello basale fino al 4° giorno (fig. 3), in cui nuovamente si riscontra un'elevata trascrizione del gene che codifica IL-4. Questo secondo picco di attività trascrizionale di IL-4 riflette, con ogni probabilità, lo sviluppo della polarizzazione in senso T H2 dei linfociti T CD4 specifici per il parassita. Come ricordato in precedenza, il trattamento con IL-12 esogena il giorno che precede l'infezione protegge i topi BALB/c, normalmente incapaci di difendersi dal parassita; è importante notare che il trattamento con questa cito china sopprime completamente l'iperproduzione di IL-4, normalmente riscontrata 16 ore dopo l'infezione (Launois et al., 1995). Al contrario, in topi C57BL/6 trattati con anticorpi anti-IL-12 neutralizzanti il giorno precedente l'inoculo di L. major, si osserva un aumento di trascrizione di IL-4 all'interno dei linfonodi entro le prime 24 ore. In accordo con tali risultati, topi con assetto genetico resistente, privati del gene che codifica IL-12, mostrano un'iniziale sovraespressione di mRNA di IL-4 in risposta all'infezione da L. major (Mattner et al., 1996). Presi nel loro complesso, questi risultati suggeriscono che, in topi resistenti, IL-12 inibisce la produzione precoce di IL-4 (fig. 4). Sembra quindi che vi sia una competizione tra IL-12 e IL-4 nel determinare la risposta immunitaria verso il parassita; la prima sposta la bilancia a favore dell'ospite, la seconda favorisce invece il parassita. Per quanto riguarda l'esatto ordine di comparsa dei due componenti di lL-12, p40 e p35, i dati finora ottenuti non consentono di trarre conclusioni definitive. Attualmente, è in corso un'intensa attività di ricerca che monitorizza sia i trascritti lL-12 sia le proteine. Le difficoltà incontrate nella valutazione della produzione di lL-12 biologicamente attiva potrebbero dipendere dalla sua natura di eterodimero e dalla complessa regolazione della produzione di ogni monomero (Trinchieri, 1996).
Ben più chiari sono i dati in nostro possesso sull' origine di lL-4 prodotta nelle fasi iniziali dell'infezione indotta da L. major. Tutti i dati disponibili indicano chiaramente che i linfociti T CD4 sono responsabili dell'iperproduzione iniziale di lL-4 nei topi BALB/c suscettibili infettati da L. major (Launois et al., 1995). All'interno della popolazione linfocitaria CD4 TCRαβ, è stata recentemente identificata una sottopopolazione minoritaria che può produrre rapidamente grandi quantità di lL-4 in seguito a stimolazione con anticorpi anti-CD3 (Yoshimoto e Paul, 1995), un trattamento che simula gli eventi normalmente indotti dal legame del TCR con l'antigene. Le cellule che appartengono a questa sottopopolazione minoritaria esprimono la molecola transmembrana NKl.l e utilizzano un caratteristico repertorio TCR, con regioni Vαl4 appaiate a Vβ2, Vβ7 o Vβ8. Alcuni studi hanno suggerito che queste cellule potrebbero essere la fonte di IL-4 che indirizza il differenziamento in senso TH2 dei linfociti T CD4 specifici verso antigeni di Leishmania presentati nel contesto di molecole MHC di classe II. Tuttavia, risultati recenti hanno dimostrato che questa sottopopolazione minoritaria non contribuisce alla rapida iperproduzione di IL-4 osservata 16 ore dopo l'inoculo nei linfonodi di topi BALB/c suscettibili a L. major (Launois et al., 1995). Inoltre, i topi BALB/c privi di questa popolazione di linfociti T CD4 NKl.l + sono ancora capaci di sviluppare una risposta CD4 TH2 in seguito all'infezione da L. major (Brown et al., 1996). Deve ancora essere chiarito in quale stadio differenziativo dei linfociti T CD4, indotto dai prodotti derivati da L. major, si abbia l'iperproduzione iniziale di IL-4. In particolare, si tratta di capire se si è allo stadio di cellula vergine, di cellula che ha incontrato l' antigene o di cellula della memoria.
Linfociti T e resistenza murina
Recentemente è stato proposto un modello per spiegare la resistenza o la suscettibilità a L. major in base ai risultati di studi in vitro con linfociti T CD4 specifici per un peptide derivato dall' ovoalbumina e provenienti da topi BALB/ c (suscettibili) o BIO.D2 (resistenti). La rilevanza di questo modello è stata confermata sperimentalmente in molti laboratori. Esso si basa sulla differente capacità dei linfociti T di topi BALB/c e BIO.D2 di andare incontro a differenziamento THl indotto da IL-l2 in vitro. Mentre i linfociti T CD4 provenienti da topi BIO.D2 mantengono la reattività a IL-l2 in coltura e presentano un fenotipo differenziativo THl, i linfociti T CD4 di topi BALB/c, trattati nello stesso modo, mostrano un fenotipo differenziato TH2 e perdono la reattività a IL-12, come si può dimostrare valutando la produzione di IFN-γ (Giller et al., 1996). Uno dei risultati più recenti indica che un singolo locus sul cromosoma Il potrebbe avere un ruolo cruciale per il mantenimento della re attività a IL-12 e quindi per il controllo della risposta TH1/TH2; secondo alcuni ricercatori questo locus potrebbe essere un modificatore della risposta immunitaria (Gorham et al., 1996).11 suo intervento più o meno rapido potrebbe, quindi, dipendere dalle proprietà intrinseche degli organismi immunogenici oppure dalle molecole rilasciate negli organi linfoidi in cui le cellule T vergini vengono polarizzate dopo essere state attivate specificamente mediante i loro TCR. In accordo con questo modello, abbiamo recentemente dimostrato che, poco dopo l'inoculo di L. major, le cellule CD4 specifiche per il parassita provenienti da topi BALB/c non rispondono più a IL-12, come si è osservato misurando la produzione di IFN-γ. La mancata re attività a IL-12 è totalmente dipendente da IL-4 prodotta durante una finestra temporale critica, corrispondente alle prime 48 ore che seguono l'infezione da L. major (Launois et al., 1997). Questi risultati favoriscono quindi l'ipotesi che la suscettibilità a L. major sia di origine genetica e che la rapida ed elevata progressione verso la via differenziativa T H2 dei linfociti CD4 di topi BALB/c suscettibili sia essenzialmente il risultato di una rapida iperproduzione iniziale di IL-4, la quale a sua volta conduce all'assenza di reattività a IL-12 (v. figura 4).
Traffico leucocitario iniziale dal derma parassitato all'organo linfoide
I parassiti sono rilasciati all'interno del compartimento extravascolare del derma, sito in cui i leucociti risiedono o migrano temporaneamente. Mentre macrofagi, mastociti e cellule dendritiche sono ancorati alla matrice extracellulare, è stato dimostrato che i linfociti T che esprimono l'antigene linfocitario cutaneo sono in grado di lasciare i capillari sanguigni, migrare nella matrice extracellulare e quindi entrare nei vasi linfatici e nei linfonodi che drenano quel distretto specifico (Belkaid et al., 1996). Tuttavia, è probabile che la localizzazione e il traffico linfocitario siano temporaneamente modificati in seguito all'inoculo dei parassiti nel derma. Per esempio, le cellule dendritiche di Langherans e le cellule T che esprimono recettori di tipo γδ sono mobilizzate dall'epidermide al derma, mentre i neutro fili, le cellule NK (Natural Killer) e i monociti sono reclutati in questa zona dal sangue. Y. Belkaid e i suoi collaboratori (1996) hanno sviluppato metodi derivati dalle colture di espianti di cute che hanno permesso di controllare questo traffico leucocitario: sono già state ottenute importanti informazioni sulla natura e sulla cinetica dei leucociti che migrano dal derma parassitato allinfonodo drenante. È importante notare che nel derma di topi BALB/c normali è stato riscontrato un maggior numero di cellule T CD4 rispetto a quello osservato nei topi C57BL/6 normali. Si ipotizza quindi che alcune di queste cellule CD4, una volta attivate da molecole derivate da Leishmania, entrino nei vasi linfatici e nei linfonodi, dove potrebbero contribuire all'iperproduzione di IL-4 osservata 16 ore dopo l'inoculo del parassita.
Gli studi volti ad analizzare il flusso di leucociti, la loro natura e la loro origine sono solo all'inizio e forniranno senza alcun dubbio una più precisa caratterizzazione dell'origine cellulare dei segnali alla base del differenziamento delle cellule T CD4.
Conclusioni
Usando come ospiti sperimentali di Leishmania major topi con diversi assetti genetici, è stato possibile documentare il modo in cui i parassiti inattivano alcune molecole immunitarie che esplicano la loro funzione regolatrice o effettrice poco tempo dopo il loro rilascio nel derma. I topi BALB/c rappresentano gli ospiti in cui L. major crea rapidamente un microambiente tollerante per la sua crescita ottimale e la sua diffusione. La caratterizzazione dei geni dell'ospite, 'sovvertiti' da questi parassiti intracellulari, è di fondamentale importanza perché potrebbe aiutare a progettare un razionale intervento immunitario che impedisca il parassitismo incontrollato e i processi patogenetici che ne derivano. Il problema potrebbe essere però di difficile soluzione se la differenza 'genetica' produce come unico risultato una bassa o una alta produzione di segnali fondamentali per indirizzare il differenziamento delle cellule CD4. Comunque, il modello murino di infezione con L. major ha permesso di fare luce su alcuni meccanismi che regolano il differenziamento di una sottopopolazione di cellule T in vivo. Si spera che i progressi raggiunti con questo modello di infezione contribuiscano allo sviluppo di strumenti in grado di controllare la leishmaniosi umana, grave problema per la salute pubblica in molte parti del mondo.
Ringraziamenti
Il lavoro svolto dai laboratori degli autori è stato realizzato grazie a sovvenzioni provenienti dalla Swiss National Science Foundation, dall'Unione Europea, dalla Roche Research Foundation, dall'Organizzazione mondiale della sanità e dall'Istituto Pasteur.
Bibliografia citata
ABBAS, A.K., MURPHY, K.M., SHER, A. (1996) Functional diversity ofhelper T Iymphocytes. Nature, 383, 787-793.
ASSREUY, J., CUNHA, F.Q., EPPERLEIN, M., NORONHA-DUTRA, A., O'DoNNELL, C. A. , LIEW, F.Y., MONCADA, S. (1994) Production of nitric oxide and superoxide by activated macrophages and killing of Leishmania major. Eur. J. Immunol., 24, 672-676.
BELKAID, Y., JOUlN, H., MILON, G. (1996) A method to recover, enumerate and identify Iymphomyeloid cells present in an inflammatory dermal site: a study in laboratory mice. J. Immunol. Methods, 199, 5-25.
BROWN, D.R., FOWELL, D.J., CORRY, D.B., WYNN, T.A., MOSKOWITZ, N.H., CHEEVER, A.W., LOCKSLEY, R.M., REINER, S.L. (1996) β2-microglobulin-dependent NKl.l + T cells are not essential for T helper cell 2 immune responses. J. Exp. Med., 184, 1295-1304.
FEARON, D.T., LOCKSLEY, R.M. (1996) The instructive role of iunate immunity in the acquired immune response. Science, 272, 50-53.
GORHAM, J.D., GULER, M.L., STEEN, R.G., McKEY, A.J., DALY, M.J., FREDERICK, K., DIETRICH, W.F., MURPHY, K.M. (1996) Genetic mapping of a murine locus controlling development of T helper 1/T helper 2 type responses. Proc. Natl. Acad. Sci. USA, 93, 12467-12472.
GREEN, S.I., CRAWFORD, R.M., HOCKMEYER, I.T., MELTZER, M.S., NACY, C.A. (1990) Leishmania major amastigotes initiate the L-arginine dependent killing mechanism in IFN-γ stimulated macrophages by induction of tumor necrosis factor-alpha. J. lmmunol., 145, 4290-4297.
GULER, M.L., GORHAM, lD., HSIEH, C.S., McKEY, A.I., STEEN, R.G., DIETRICH, W.F., MURPHY, K.M. (1996) Genetic susceptibility to Leishmania: IL-l2 responsiveness in Thl cell development. Science, 271, 984-987.
HEINZEL, F.P., SCHOENHAUT, D.S., RERKO, R.M., ROSSER, L.E., GATELY, M.K. (1993) Recombinant interleukin 12 cures mice infected withLeishmania major. J. Exp. Med., 177, 1505-1509.
HOLADAY, B.I., SADICK, M.D., WANG, Z.E., REINER, S.L., HEINZEL, F.P., PARSLOW, T.G., LOCKSLEY, R.M. (1991) Reconstitution of Leishmania immunity in severe combined immunodeficient mice using Thl- and Th2-like celllines. J lmmunol., 147, 1653-1658.
LAUNOIS, P., OHTEKI, T., SWIHART, K.G., McDoNALD, H.R., LOUlS, J.A. (1995) In susceptible mice, Leishmania major induce very rapidly interleukin-4 production by CD4+ T cells which are NKl.r. Eur. J. lmmunol., 25, 3298-3307.
LAUNOIS, P., SWIHART, K.G., MILON, G., LOUlS, J.A. (1997) Early production of IL-4 in susceptible mice infected with Leishmania major rapidly induces IL-l2 uuresponsiveness. J. lmmunoI., 158, 3317-3324.
LEAL, L.M.C.C., MOSS, D.W., KUHN, R., MULLER, W., LIEW, F.Y. (1993) Interleukin-4 transgenic mice of resistant background are susceptible to Leishmania major infection. Eur. J lmmunol., 23, 566-569. LIEw, F.Y. (1989) Functional heterogeneity of CD4+ T cells in leishmaniasis.lmmunol. Today, 10, 40-45.
MATTNER, F., MAGRAM, J., FERRANTE, J., LAUNOIS, P., DI PADOVA, K., BEHIN, R., GATELY, M.K., LOUlS, J.A., ALBER, G. (1996) Genetically resistant mice lacking interleukin-12 are susceptible to infection with Leishmania major and mount a polarized Th2 cell response. Eur. J. lmmunol., 26, 1553-1559.
MITCHELL, G.F., CURTIS, J.M., SCOLLAY, R.G., HANDMANN, E. (1981) Resistance and abrogation of resistance to cutaneous leishmaniasis in reconstitued BALB/c nude mice. Aust. J. Exp. Biol. Med. Sci., 59, 539-544.
MOORE, K.W., O'GARRA, A., DE WAAL MALEFYT, R., VIEIRA, P., MOSMANN, T.R. (1993) Interleukin-lO. Annu. Rev. lmmunol., Il, 165-190.
MOSMANN, T.R., COFFMANN, R.L. (1989) THI and TH2 cells: different patterns of Iymphokine secretion lead to different functional properties. Annu. Rev. lmmunol., 7, 145-173.
SACKS, D.L., LOUlS, J.A., WRITH, D.F. (1993) Leishmaniasis. In lmmunology and molecular biology of parasitic inJections, Boston, Blackwell Scientific Publications, pp. 71-86.
SADICK, M.D., HEINZEL, F.P., HOLADAY, B.J., COFFMANN, R.L., LOCKSLEY, R.M. (1989) Reciprocal expression of interferon γ or interleukin 4 during the resolution or progression of murine leishmaniasis. Evidence for expansion of distinct helper T cell subsets. J. Exp. Med. 169, 59-72.
SADICK, M.D., HEINZEL, F.P., HOLADAY, B.I., PU, R.T., DAWKINS, R.S., LOCKSLEY, R.M. (1990) Cure of murine leishmaniasis with anti-interleukin 4 monoclonal antibody. Evidence for a T cell-dependent, interferon gamma-independent mechanism. J. Exp. Med., 171, 115-127.
SWIHART, K., FRUTH, D., MESSMER, N., HUG, K., BEHIN, R., HUANG, S., DEL GIUDICE, G., AGUET, M., LOUlS, I.A. (1995) Mice from a genetically resistant background lacking the interferon y receptor are susceptible to infection with Leishmania major but mount a polarized T helper cell I-type CD4+ T cell response. J. Exp. Med., 181, 961-971.
SYPEK, I.P., CHUNG, C. L. , MAYOR, S.E., SUBRAMANAYAM, J.M., GOLDMAN, S.I., SIEBURTH, D.S., WOLF, S.F., SCHAUB, R.G. (1993) Resolution of cutaneous leishmaniasis: interleukin 12 initiates a protective T helper type I immune response. J. Exp. Med., 177, 1797-1802.
TITUS, R.G., MILON, G., MARCHAL, G., VASSALLI, P., CEROTTINI, J.C., LOUlS, I.A. (1987) Involvement ofspecific Lyt-2+ T cells in the immunological control of experimentally induced murine cutaneous leishmaniasis. Eur. J lmmunol., 17, 1429-1433.
TRINCHIERI, G. (1996) Interleukin-12: a proinflammatory cytokine with immunoregulatory functions that bridge innate resistance and antigen-specific adaptive immunity. Annu. Rev. lmmunol., 13, 251-276.
WANG, Z.-E., REINER, S.L., ZHENG, S., DAL TON, D.K., LOCKSLEY, R.M. (1994) CD4+ effector cells default to the Th2 pathway in interferon y-deficient mice infected with Leishmania major. J Exp. Med., 179,1367-1371.
YOSHIMOTO, T., PAUL, W.E. (1995) CD4PoS NKl.lPoS T cells promptly produce interleukin 4 in response to in vivo challenge with anti-CD3. J. Exp. Med., 179, 1285-1295.
ZURAWSKI, G., DE VRIES, J.E. (1994) Interleukin-13, an interleukin-4 like cytokine that acts on monocytes and B cells, but not on T cells. lmmunol. Today, 15, 19-26.
Bibliografia generale
BOGDAN, C., GESSNER, A., SOLBACH, W., ROLLINGHOF, M. (1996) Invasion, control and persistance of Leishmania parasites. Curr. Opin. lmmunol., 8, 517-525.
REINER, S.L., LOCKSLEY, R.M. (1995) The regulation of immunity to Leishmania major. Annu. Rev. lmmunol., 13, 151-177.
SCOTT, P. (1996) Th cell development and regulation in experimental cutaneous leishmaniasis. Chem. lmmunol., Basilea, Karger, 63, 98-114.