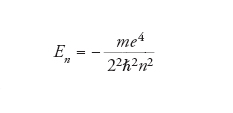Elementi chimici: origine e natura
Elementi chimici: origine e natura
Un atomo consiste in un nucleo molto piccolo circondato da elettroni. Il nucleo è carico positivamente e, malgrado la sua piccola dimensione, costituisce quasi l'intera massa dell'atomo. Esso consiste di un certo numero di particelle elementari dette nucleoni: i protoni e i neutroni. I protoni sono particelle fondamentali cariche positivamente, dotate di una massa circa 1840 volte più grande di quella di un elettrone. I neutroni hanno la stessa massa dei protoni, ma sono elettricamente neutri. I protoni si respingono l'un l'altro a causa della loro carica elettrica, ma si attraggono quando sono sufficientemente vicini fra loro, a causa di una forza molto intensa, ma a cortissimo raggio d'azione, detta interazione forte, che agisce anche nell'attrazione fra neutroni e in quella fra i protoni e i neutroni. In ogni caso l'interazione forte è efficace soltanto se i nucleoni sono sufficientemente vicini tra loro, e questo determina la natura compatta e la stabilità della maggior parte dei nuclei atomici, e la grande quantità di energia liberata quando i nucleoni cambiano la loro disposizione. Tale forza è dunque all'origine dell'energia nucleare.
Il numero di protoni in un nucleo è detto numero atomico ed è indicato con Z. Il numero totale dei nucleoni in un nucleo è detto numero nucleonico ed è indicato con A. D'altra parte, poiché sono stati identificati tutti i nuclidi con valori da Z=1 a Z=111, possiamo essere certi che sono stati identificati anche tutti gli elementi fino al valore più alto di Z e quindi non esiste nessuna possibilità di scoprire un elemento che possieda un valore intermedio. Un allungamento della lista degli elementi può verificarsi solo per valori di Z>111. Nuclidi con un dato valore di Z ma con differenti numeri nucleonici (cioè nuclidi con lo stesso numero di protoni, Z, ma con un diverso numero di neutroni, A−Z) sono detti isotopi dell'elemento. Per esempio, benché la più comune forma di idrogeno consista di atomi il cui nucleo è costituito solamente da un protone, lo 0,015% degli atomi di idrogeno presenti in natura ha un nucleo che consiste in 1 protone e in 1 neutrone in più. Questo isotopo è chiamato deuterio. Un altro isotopo dell'idrogeno con 1 protone e 2 neutroni è il trizio.
L'esistenza di isotopi di elementi più pesanti è un'indicazione che i neutroni sono necessari per tenere incollati i protoni, contrastando così il loro reciproco effetto repulsivo di tipo elettrostatico. L'esistenza di serie di isotopi, soprattutto per gli elementi più pesanti, indica che un nucleo può tollerare la presenza di un numero variabile di nucleoni. L'identità di un elemento deriva dal numero dei protoni e non dal numero totale dei nucleoni, perché, essendo un atomo, è una specie elettricamente neutra: la carica positiva del nucleo è neutralizzata dalla carica negativa degli elettroni circostanti. Poiché la carica di un elettrone è esattamente uguale, ma di segno opposto, a quella di un protone, un atomo neutro deve avere quindi un numero di elettroni uguale a quello dei protoni presenti nel nucleo. Il numero degli elettroni che circondano il nucleo determina le proprietà chimiche di un elemento.
Nella tavola periodica, gli elementi sono ordinati secondo il numero atomico Z con lo scopo di evidenziarne le analogie chimiche. Il loro carattere varia da metallico, alla sinistra della tavola, a non metallico, alla destra. Pertanto la varietà di proprietà degli elementi stessi sottintende la ripetizione periodica di configurazioni elettroniche simili.
Nucleosintesi
Gli atomi degli elementi si sono formati nel corso del processo chiamato nucleosintesi, che ebbe inizio circa 15 miliardi di anni fa, ai primordi dell'Universo. Quasi immediatamente dopo il big bang, i quark condensarono originando i nucleoni. Successivamente (di fatto, dopo circa 100 s), con il raffreddarsi dell'Universo, nucleoni ed elettroni condensarono a loro volta originando gli atomi dei due elementi primordiali, ossia l'idrogeno e l'elio. La nucleosintesi, tuttavia, non si sviluppò lungo una progressione uniforme. Il processo di fusione nucleare che avviene nelle stelle è un fenomeno complesso, e sebbene elementi più pesanti siano generati successivamente a mano a mano che un nucleo fonde in un altro nucleo, alcuni nuclidi formati in questa maniera sono altamente instabili. Tali sono, per esempio, il deuterio, il litio e il berillio (con Z=1, 3, 4 rispettivamente) e, infatti, queste specie sono relativamente rare nell'Universo nel suo complesso.
In seguito al big bang, la costruzione di elementi più pesanti progredì ben poco, anche perché la collisione dei nuclei di elio per formare il berillio è un processo endotermico (cioè avviene con assorbimento di energia). Così, alla composizione dell'Universo fu di fatto preclusa un'ulteriore evoluzione, finché esso non poté superare questa sorta di strettoia. Ciò avvenne quando l'idrogeno e l'elio cominciarono a condensare in quei corpi che poi sarebbero diventate le stelle, che sono fornaci durature, caldissime, disomogenee, dove vi sono zone circoscritte ad altissima temperatura nelle quali i nuclei possono collidere l'uno con l'altro, con alte energie cinetiche e per considerevoli periodi. A questo punto, vale la pena di fare una pausa e prendere in considerazione la nucleosintesi del carbonio, elemento che rappresenta un caso molto speciale, sia per la sua formazione sia per quanto riguarda le sue potenzialità. Sono state proposte numerose ipotesi non scientifiche, soprannaturali, teleologiche e teologiche, per spiegare la sua straordinaria, molto utile e inusuale abbondanza: il carbonio è il terzo elemento più diffuso, cosa particolarmente rilevante ai fini della formazione degli organismi.
La quantità relativamente elevata del carbonio può essere fatta risalire a tre coincidenze apparentemente in accordo fra loro. La nostra discussione su questa importante caratteristica dell' Universo si concentrerà su due fondamentali reazioni nucleari:
[1] 3 4He → 12C formula
[2] 4He + 12C → 16O + γ.
La prima crea carbonio, la seconda lo distrugge. La prima reazione apre la via anche alla nucleosintesi degli elementi più pesanti, e quindi rappresenta chiaramente un'importante fase sia da un punto di vista generale sia per il caso particolare della formazione del carbonio stesso. La prima di questa coppia di reazioni è autocatalitica, nel senso che dipende dall'abbondanza di un nuclide intermedio, il 8Be, formato anch'esso nel corso della reazione:
[3] 4He + 4He → 8Be
[4] 8Be + 4He → 12C.
Così, il processo globale è il risultato della sequenza di passaggi qui esposti, che potremmo abbreviare secondo lo schema seguente:
[5] 2 4He → 8Be
[6] 8Be + 4He → 12C.
In questa sequenza vi sono due aspetti importanti. Il primo, insolito ma essenziale, consiste nel fatto che il 8Be ha un tempo di vita sorprendentemente lungo. Esso vive abbastanza a lungo da consentire circa 10.000 collisioni, e, di conseguenza, vi è una probabilità ragionevolmente alta che avvenga anche la seconda reazione.
Anche se il 8Be possiede una vita media piuttosto lunga (ma non troppo), non è sufficiente da solo perché si verifichi una formazione significativa di carbonio. In questo caso, entra in gioco un'altra coincidenza, cioè il fenomeno della risonanza. Questa si presenta quando due oscillatori hanno la stessa frequenza e vi è un rapido trasferimento di energia fra di essi, a condizione che siano collegati in qualche modo. In generale, sistemi degeneri (cioè di eguale energia) sono fortemente accoppiati e l'energia può fluire fra di essi senza difficoltà. In altri termini, gli stati iniziali possono evolvere facilmente in stati finali degeneri con essi. Dal punto di vista delle collisioni, la risonanza può aumentare la probabilità di cattura e di assimilazione. La risonanza significativa nella nucleosintesi del carbonio risiede nell'estrema vicinanza delle energie del sistema 4He+8Be (7,37 MeV quando i nuclei sono stazionari) e di un particolare livello del 12C (7,66 MeV). La differenza (0,29 MeV) può essere acquisita abbastanza rapidamente, alla temperatura presente all'interno della stella, dall'energia cinetica dei nuclidi (la media dell'energia cinetica del movimento termico, pari a ca. kT, a 108 K corrisponde a ca. 0,1 MeV), perciò i nuclidi 4He+8Be, che prendono parte a una collisione tipica, sono risonanti col livello designato di 12C. Di conseguenza, le collisioni relativamente numerose di 4He e 8Be hanno una percentuale di successo ragionevolmente alta per la formazione del carbonio.
In seguito, nell'evoluzione della stella, seguirono numerosi altri processi, in particolare cominciò la combustione del carbonio, dell'ossigeno e perfino del silicio, per cui si formarono gli elementi situati nelle vicinanze del ferro (il più stabile di tutti i nuclei). Alcuni di questi elementi, tuttavia, erano così instabili che non sopravvissero, e infatti il 6Li, il 10Be, il 10B e il 11B erano presenti in quantità estremamente scarsa. L'era della loro formazione doveva ancora venire. In condizioni di equilibrio, gli elementi più pesanti del ferro non si possono formare, perché hanno un contenuto energetico maggiore rispetto al ferro stesso, e quindi troverebbero modo di decadere formando tale elemento, se fossero concessi loro il tempo e l'opportunità di raggiungere l'equilibrio. Inoltre, una cosa è costruire gli elementi, un'altra è disperderli per l'Universo, dove essi possono essere usati per la costruzione di entità macroscopiche.
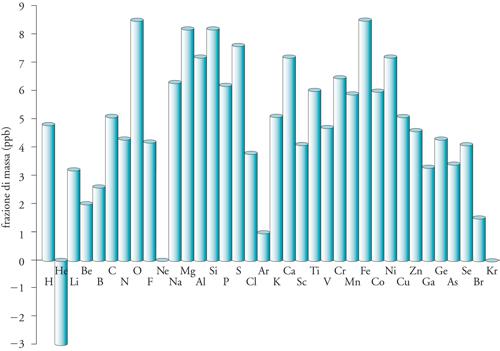
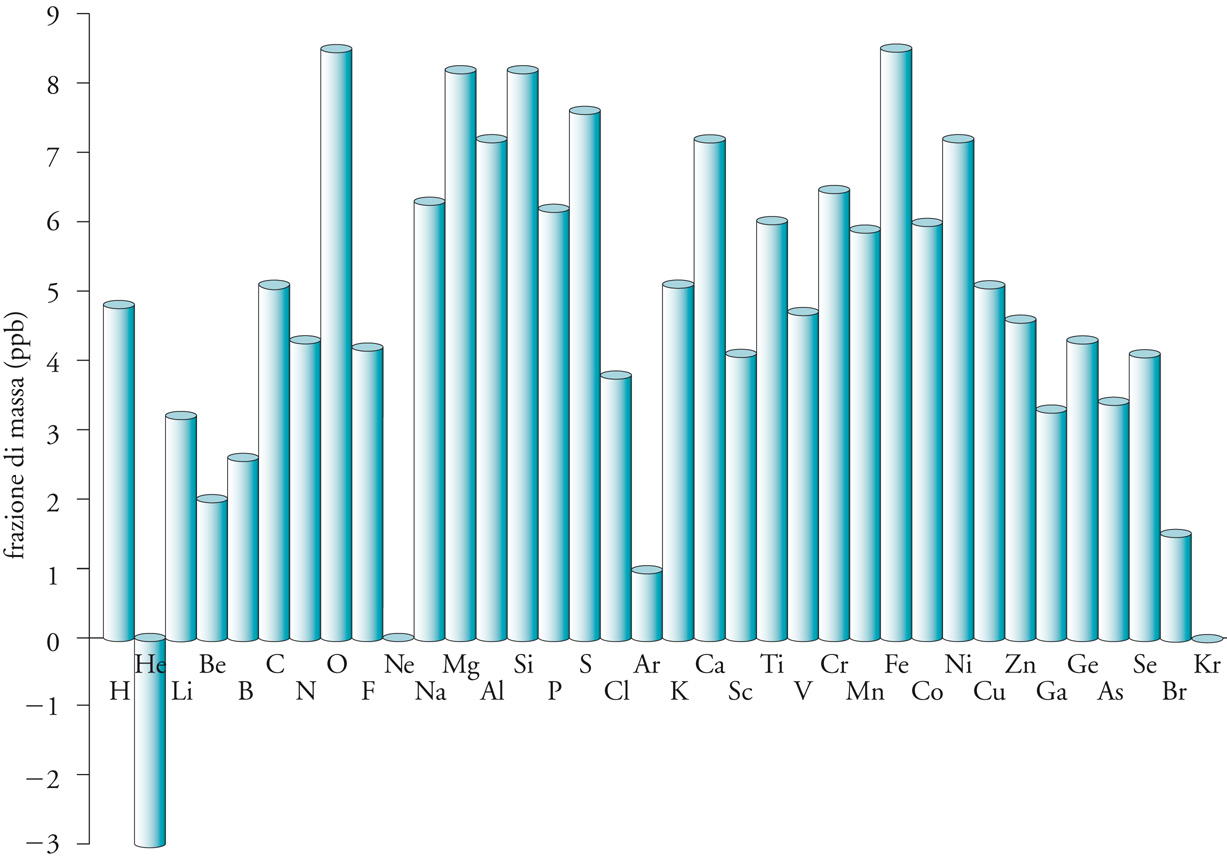
Il processo di dispersione è basato sull'instabilità intrinseca di molte stelle. Appena il suo combustibile nucleare è esaurito, una stella sufficientemente pesante è soggetta a divenire una supernova e a esplodere. Quando questo si verifica, i nuclidi nelle regioni più esterne della stella vengono scagliati con violenza l'uno contro l'altro, con un'energia cinetica sufficientemente alta per fondere insieme dando luogo a nuclidi più pesanti. Tuttavia, poiché essi vengono lanciati nello spazio quasi immediatamente, raffreddandosi, la composizione non raggiunge l'equilibrio e gli elementi più pesanti possono essere conservati nella composizione cosmica attuale. Sebbene le supernovae siano alquanto rare, esse costituiscono il mezzo per formare la materia e per distribuirla attraverso l'Universo: circa l'11% della materia presente sulla Terra è stato formato in questo modo. La Terra, fonte di quasi tutti gli elementi chimici disponibili, condensò da particelle di polvere che, a loro volta, si erano condensate da atomi formati in eventi stellari del tipo di quelli che abbiamo appena descritto. Tuttavia, la confusa distribuzione della grande quantità di elementi sulla Terra (fig. 2) è correlata solo debolmente alle abbondanze cosmiche degli elementi, mentre un ruolo fondamentale è giocato dalla storia termica del pianeta e dalle volatilità dei composti che gli elementi possono formare. I pianeti si sono costituiti per l'accumulazione di particelle di polvere che, a loro volta, si erano formate per condensazione di atomi e di semplici aggregati ionici. I rimanenti, essenzialmente gas, furono sospinti verso le regioni più esterne del Sistema solare dal flusso di particelle emesso dal Sole e noto come vento solare.
La struttura elettronica degli atomi
Per comprendere le differenze nelle individualità chimiche e fisiche degli elementi, dobbiamo soffermarci brevemente sulla teoria della struttura atomica.
L'atomo d'idrogeno
La soluzione dell'equazione di Schrödinger per l'atomo d'idrogeno porta a una serie di funzioni d'onda accettabili, che sono caratterizzate da terne di numeri quantici interi n, l e ml. Il numero quantico principale, n, ha soltanto valori interi positivi (n=1, 2, …) e da solo definisce l'energia di un elettrone in ognuna delle funzioni d'onda attraverso la relazione: formula
[7] formula
essendo m ed e rispettivamente la massa e la carica dell'elettrone e ℏ=h/2π, con h la costante di Planck. Il valore di riferimento dell'energia (che corrisponde a n infinito) si riferisce al nucleo e all'elettrone posti a distanza infinita l'uno dall'altro. Lo stato a più bassa energia (lo stato fondamentale dell'atomo) corrisponde a n=l e si trova a un'energia al di sotto di quello di riferimento. Viceversa, il numero quantico angolare, l, che determina l'ampiezza del momento angolare, può assumere i valori l=0, 1, 2, 3, …, n−1. Perciò, per un dato valore di n esistono n valori di l.
Il numero quantico magnetico, ml, può assumere i 2l+1 valori l, l−1, …,−l. Il suo significato fisico risiede nel fatto che esso determina la componente del momento orbitale angolare su un asse arbitrario (che è convenzionalmente designato come asse z); questo valore è pari a mlℏℏ. I valori positivi di ml corrispondono a una rotazione in senso orario dell'elettrone attorno al nucleo (quando viene osservato dal basso), mentre i valori negativi corrispondono a una rotazione in senso antiorario. Nella descrizione della struttura atomica, le funzioni d'onda di un elettrone sono dette orbitali atomici e, da quanto precede, consegue che per definire un orbitale atomico è necessario specificarne i tre numeri quantici. Si dice che tutti gli orbitali con un dato valore di n (e quindi in un atomo idrogenoide con la stessa energia) appartengono allo stesso guscio di un atomo. Gli orbitali di un dato guscio con lo stesso valore di l appartengono al medesimo sottoguscio dell'atomo. Esistono n sottogusci per ogni dato guscio, che comprendono 2l+1 orbitali. Il numero totale di orbitali in un dato guscio è quindi n2.
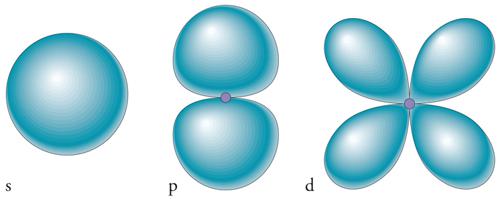
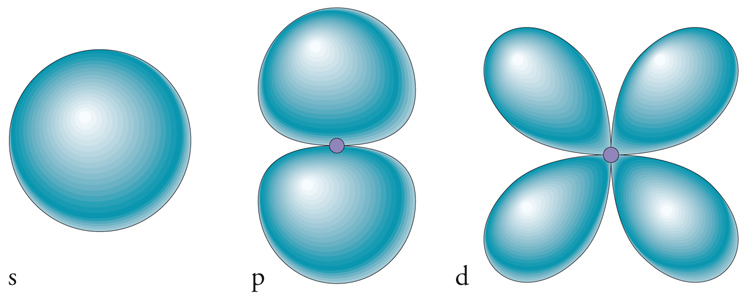
Sebbene la designazione di un orbitale sia fornita univocamente dalla definizione dei suoi tre numeri quantici, gli orbitali atomici sono normalmente specificati anche in una maniera diversa (fig. 3). Un orbitale con l=0 è chiamato orbitale s, uno con l=1 orbitale p, uno con l=2 orbitale d, e uno con l=3 orbitale f. Sebbene l possa assumere valori maggiori di 3 a condizione che n sia più grande di 4, in chimica tali orbitali intervengono solo in particolari situazioni. Inoltre, singoli orbitali di un sottoguscio vengono normalmente designati da un pedice piuttosto che dal valore di ml, e tale pedice è scelto per indicare le direzioni nelle quali gli orbitali hanno la loro massima ampiezza. Come tali, gli orbitali sono più adatti alla descrizione del legame chimico, in corrispondenza del quale si accumula fra gli atomi la densità elettronica. Così, i tre orbitali di un sottoguscio con l=1 sono designati come px, py e pz, a indicare che i massimi della loro ampiezza giacciono rispettivamente lungo gli assi x, y e z. Gran parte di questi concetti restano validi anche quando ci riferiamo ad atomi multielettronici, cioè atomi con più di un elettrone, e quindi includono tutti gli atomi neutri, eccetto ovviamente l'atomo d'idrogeno. L'unica eccezione rilevante consiste nel fatto che viene rimossa parzialmente la degenerazione, ovvero l'uguaglianza dell'energia di tutti gli orbitali di un dato guscio. Ciò è dovuto alla presenza della repulsione tra gli elettroni.
La struttura elettronica di un atomo con molti elettroni è definita dal tipo di orbitali che sono occupati dai suoi Z elettroni (per un atomo di numero atomico Z). La vera funzione d'onda elettronica di un atomo è una singola funzione di tutte le 3Z coordinate dei suoi elettroni. Comunque, per la soluzione dei problemi della chimica, tale complicata funzione multidimensionale può essere quasi sempre approssimata mediante il prodotto delle funzioni d'onda degli Z orbitali atomici, ognuna delle quali è una funzione delle tre coordinate di un singolo elettrone. Secondo il principio di Aufbau (o di costruzione), gli elettroni occupano gli orbitali corrispondenti al livello minimo globale dell'energia di un atomo, compatibilmente alla condizione richiesta dal principio di esclusione di Pauli, per il quale ogni singolo orbitale non può essere occupato da più di 2 elettroni. In pratica, si trova che il principio di Aufbau può riprodurre le configurazioni elettroniche fondamentali (cioè a energia minima) degli elementi osservate sperimentalmente, se si suppone che gli Z elettroni siano collocati negli orbitali disponibili nell'ordine
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p.
Secondo il principio di esclusione, ogni sottoguscio è occupato dal numero massimo di elettroni prima che inizi l'occupazione del successivo sottoguscio. Quando è disponibile più di un orbitale di pari energia, viene completata l'occupazione di ciascuno di essi da parte di un solo elettrone, prima di iniziare l'occupazione da parte di un secondo elettrone. Questa regola riflette il fatto che l'atomo avrà un'energia più bassa se i suoi elettroni si trovano in regioni spazialmente distinte, poiché in questo caso essi si respingono il meno possibile. Infine, se gli elettroni si trovano in orbitali differenti, allora l'energia minima si ottiene quando gli spin degli elettroni sono paralleli. Questo semplice insieme di regole si è rivelato estremamente efficace nel dar conto delle configurazioni osservate dello stato fondamentale.
La tavola periodica degli elementi
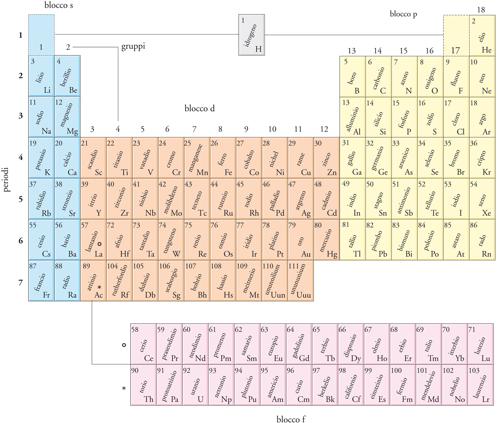
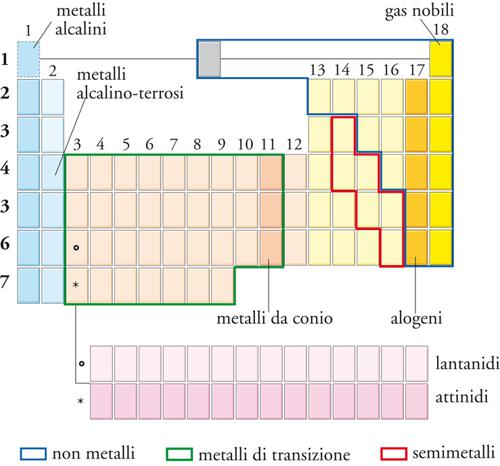
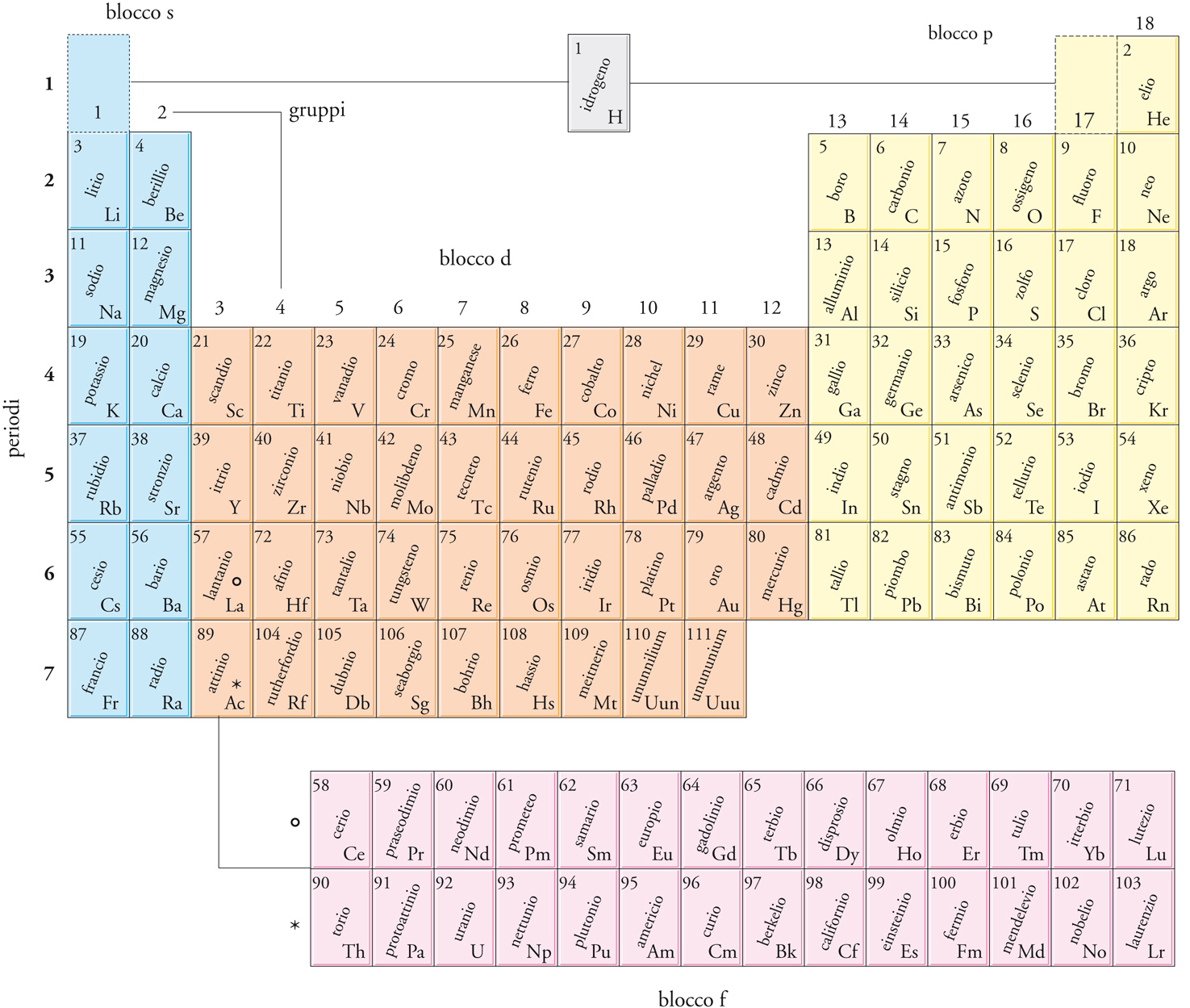
La tavola periodica è una classificazione nella quale gli elementi sono ordinati secondo il numero atomico Z ed elaborata allo scopo di evidenziarne le analogie chimiche. Nella sua forma attuale, la tavola è organizzata in blocchi, gruppi e periodi (fig. 4). Originariamente la tavola fu compilata (principalmente dal chimico Dmitrij I. Mendeleev) sulla base di evidenze empiriche, ma la sua struttura è stata spiegata successivamente a partire dalle configurazioni elettroniche dello stato fondamentale degli atomi.
L'organizzazione della tavola periodica
Nella tavola periodica (fig. 4) il raggruppamento degli elementi è in 4 blocchi s, p, d, f. La designazione del blocco deriva dall'identità del sottoguscio di orbitali che, secondo il principio di Aufbau, è occupato dall'ultimo elettrone che deve essere aggiunto. Più per ragioni di senso comune che di stretta aderenza a questa regola, l'elio è assegnato al Blocco p in base alla sua somiglianza chimica con gli altri gas nobili, mentre risulta più opportuno non assegnare l'idrogeno a nessun blocco (sebbene molte tavole lo assegnino al Blocco s, alcune al Blocco p e altre a entrambi). Gli elementi del Blocco d (con l'eccezione dello zinco, del cadmio e del mercurio) vengono anche chiamati metalli di transizione, dato che rappresentano un blocco intermedio che si trova fra i metalli fortemente reattivi del Blocco s e i metalli molto meno reattivi del Blocco p. Talvolta quelli del Blocco f vengono designati come elementi interni di transizione: la prima riga di questo blocco è costituita dai lantanidi, e la seconda dagli attinidi. Gli elementi successivi all'uranio talvolta vengono chiamati transuranici.
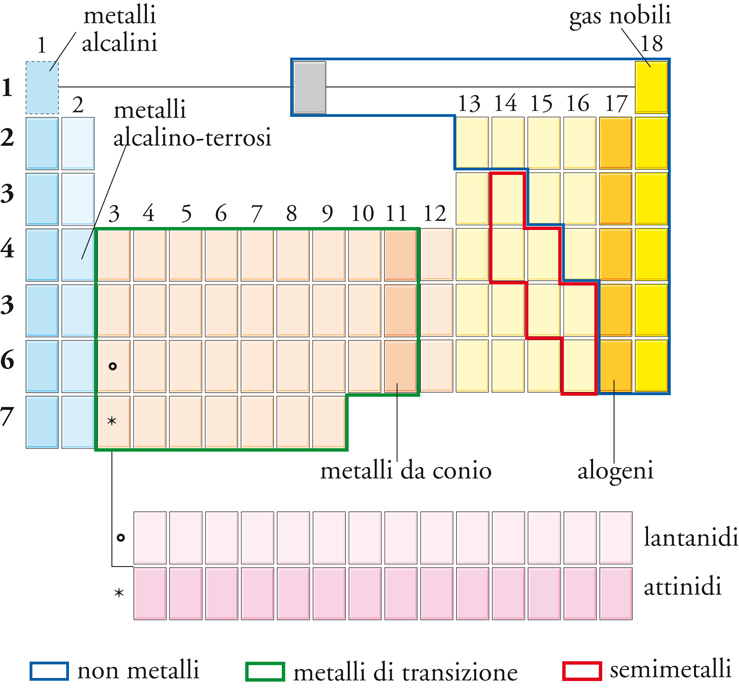
Le colonne verticali della tavola periodica sono dette gruppi. Nel sistema di nomenclatura proposto più recentemente, i gruppi sono numerati, da sinistra a destra, da 1 a 18 (in questa numerazione è trascurato il Blocco f). Il numero del gruppo può essere interpretato in termini del numero di elettroni nello strato più esterno dell'atomo. Alcuni gruppi hanno nomi speciali (fig. 5). I membri del Gruppo 1 (che comprende anche il calcio, lo stronzio e il bario) sono detti metalli alcalini; quelli del Gruppo 2 sono chiamati metalli alcalino-terrosi. Dall'altro lato della tavola, i membri del Gruppo 16 sono detti calcogeni; quelli del Gruppo 17 alogeni, e quelli del Gruppo 18 gas nobili.
Le righe orizzontali della tavola sono dette periodi e sono numerate da 1 a 7 secondo il numero quantico principale del guscio più esterno di elettroni nello stato fondamentale dell'atomo. Così, il Periodo 1 comprende l'idrogeno e l'elio, nei quali viene occupato il guscio n=1. Il Periodo 2 comprende gli elementi nei quali gli elettroni più esterni occupano il guscio con n=2, e così via.
Andamento delle proprietà atomiche nella tavola periodica
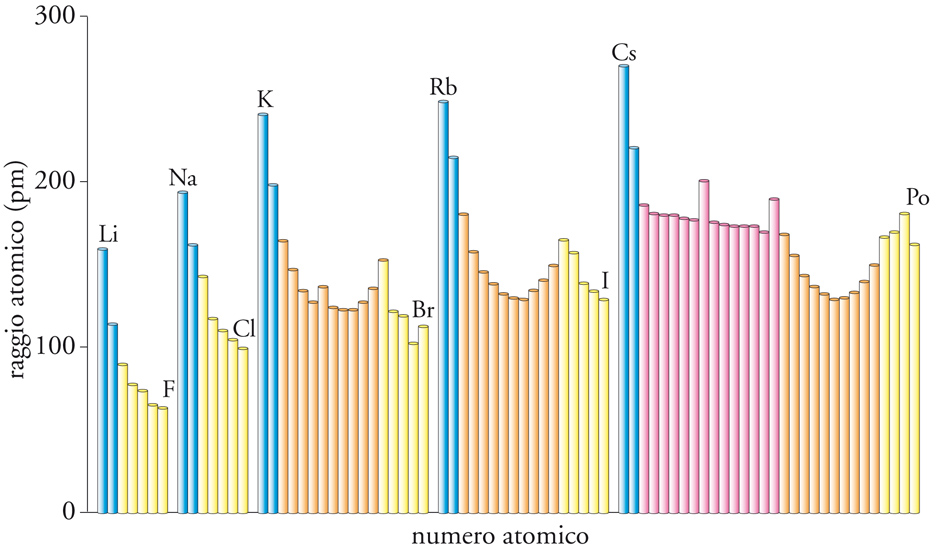
Raggi atomici
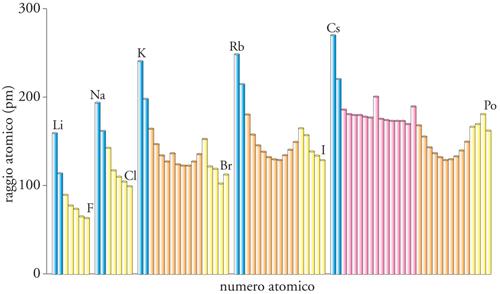
In generale, i raggi atomici decrescono da sinistra a destra lungo un periodo e crescono lungo un gruppo (fig. 6). Quest'ultimo andamento è facile da capire in quanto all'interno di ciascun gruppo si ha il riempimento graduale dei gusci. A prima vista può risultare inaspettata la diminuzione lungo un periodo, dato che il numero di elettroni è crescente, e quindi ci si potrebbe attendere che cresca anche il raggio atomico. Tuttavia, anche la carica nucleare è crescente, e il suo effetto è quello di attirare gli elettroni. Dove vi sono eccezioni all'andamento (come in alcune localizzazioni alla destra del Blocco d), la spiegazione va ricercata nel diverso risultato di questo conflitto. I raggi atomici sono una componente molto importante dell'interpretazione delle proprietà di un elemento, poiché il numero di legami che un atomo può formare è determinato in gran parte dal numero di atomi che si possono raccogliere intorno a esso. Per esempio, la sorprendente differenza di reattività dell'azoto e del fosforo è un'altra conseguenza della piccola dimensione del raggio di un atomo di azoto e della maggior dimensione di quello del fosforo. A causa del suo piccolo raggio, l'azoto può formare una molecola biatomica con un triplo legame, ed essa è così inerte che diluisce l'ossigeno dell'aria rendendo l'atmosfera un ambiente meno pericoloso. Il fosforo non può formare tali legami ed è un solido costituito da molecole tetraedriche a legame singolo che, all'aria, prende fuoco spontaneamente. Queste implicazioni, così rilevanti per la biologia, derivano, dunque, dai piccoli raggi degli atomi del Periodo 2.
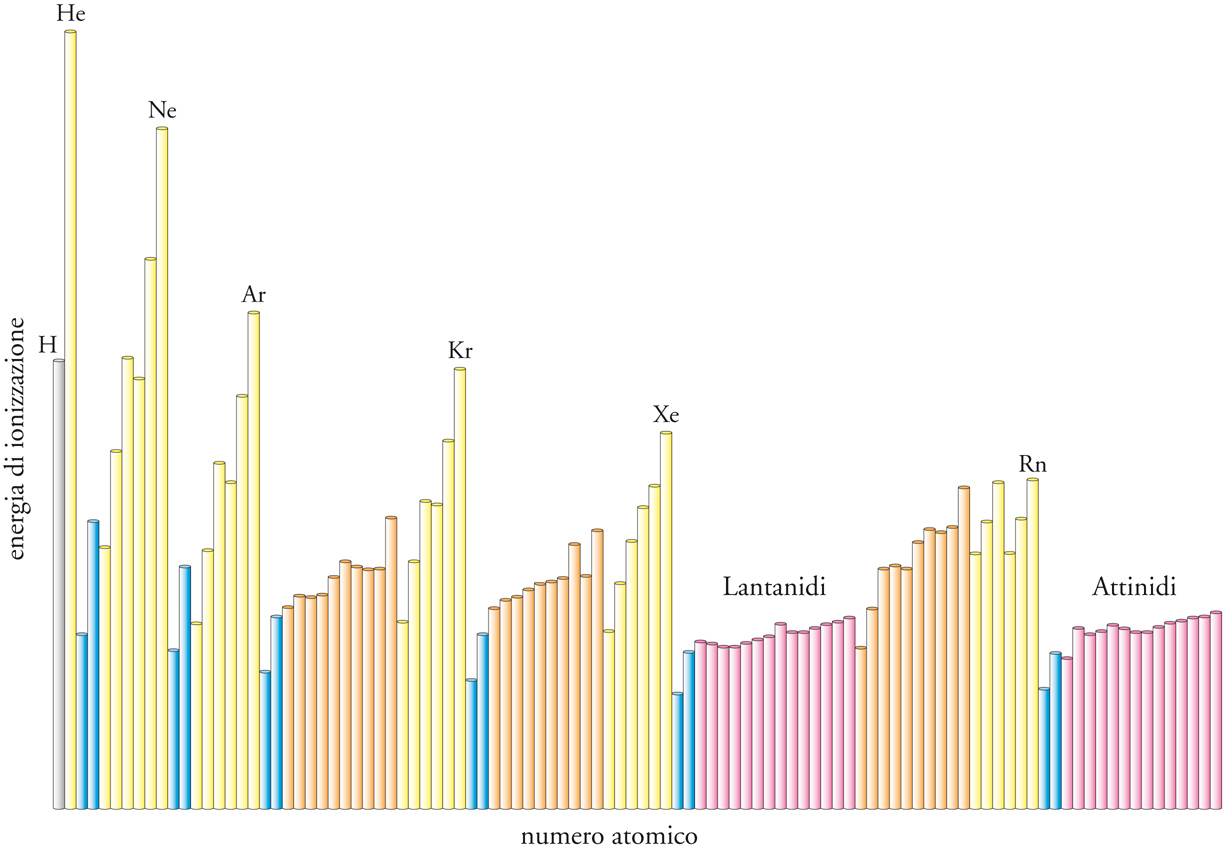
Energia di ionizzazione
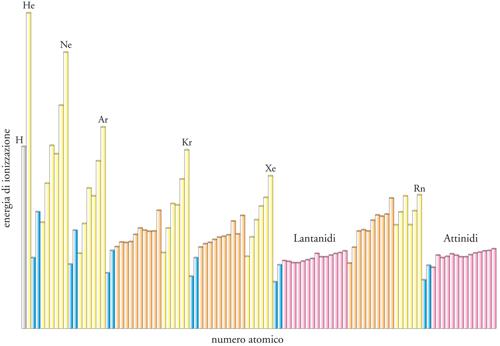
Un secondo fattore rilevante che determina il carattere chimico di un elemento è la sua energia di ionizzazione, cioè l'energia minima richiesta per allontanare un elettrone da un atomo dell'elemento in fase gassosa. Questa proprietà è di fondamentale importanza nella formazione dei legami chimici, che dipendono strettamente dalla maggiore o minore capacità di un elemento di donare o di condividere elettroni con un potenziale partner. Tipicamente, le energie di ionizzazione aumentano da sinistra a destra lungo un periodo e, lungo un gruppo, diminuiscono dall'alto in basso (fig. 7). In larga misura questa variazione è speculare, e inversa, rispetto alla variazione dei raggi atomici. Si tratta di un risultato atteso poiché, in effetti, ci si può aspettare che elettroni che giacciono a grande distanza dal nucleo siano solo debolmente legati e posseggano quindi basse energie di ionizzazione.
In generale, le energie di ionizzazione degli elementi del Blocco s sono basse. Ciò spiega il carattere metallico di questi elementi, poiché un metallo consiste di atomi i cui elettroni esterni costituiscono una sorta di 'mare' comune che lega insieme i cationi risultanti in un solido rigido ma duttile e malleabile. Tali strutture possono formarsi soltanto se gli elettroni più esterni degli atomi possono essere ceduti facilmente. Per le stesse ragioni, la maggior parte dei composti degli elementi del Blocco s sono ionici, poiché, per formare i loro cationi, è sufficiente un investimento di energia relativamente piccolo. I sistemi biologici fanno uso di questa capacità utilizzando il calcio nella formazione di strutture: il calcio è un elemento largamente disponibile, con una bassa energia di ionizzazione e i cui ioni sono piccoli e quindi in grado di formare forti legami ionici e, di conseguenza, composti rigidi.
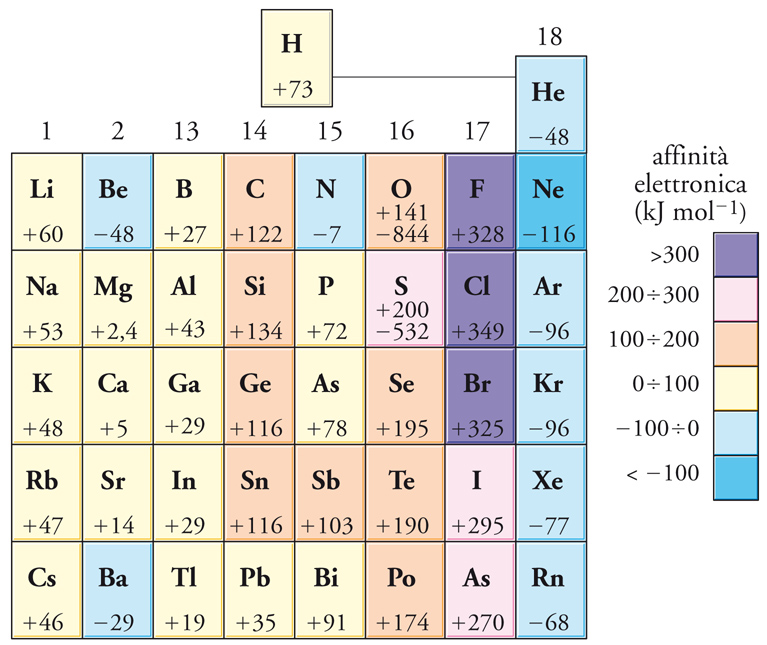
Affinità elettronica
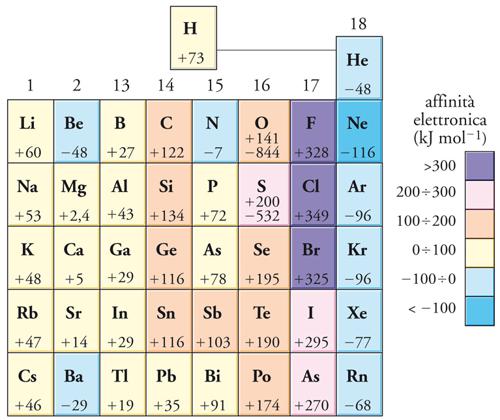
Strettamente associata all'energia di ionizzazione è l'affinità elettronica di un elemento, cioè l'energia che entra in gioco quando un elettrone si unisce a un atomo in fase gassosa. Un'affinità elettronica positiva implica che l'anione risultante abbia un'energia più bassa di quella complessiva dell'atomo neutro e dell'elettrone stazionario acquistato. Lungo la tavola periodica le affinità elettroniche variano in maniera complessa, ma i valori più positivi si trovano in prossimità del fluoro, dove la piccola dimensione degli atomi e la loro carica nucleare piuttosto alta comportano che l'elettrone acquistato sia strettamente legato (fig. 8). Quando si forma un composto, un'alta affinità elettronica sta a indicare una forte propensione alla formazione di anioni.
Elettronegatività
L'energia di ionizzazione e l'affinità elettronica danno luogo congiuntamente, almeno secondo una certa accezione, all'elettronegatività χ di un elemento, cioè al suo potere di attrarre a sé gli elettroni quando fa parte di un composto. Anche se la prima definizione di elettronegatività fu proposta da Linus Pauling in termini di entalpie di dissociazione di legame di diverse specie, una definizione un po' più chiara è quella data da Robert Mulliken, che pose χ uguale alla media dell'energia di ionizzazione e dell'affinità elettronica. Pertanto, è probabile che specie con elevate affinità elettroniche e con alte energie di ionizzazione (come gli elementi vicini al fluoro) siano altamente elettronegative. È probabile che tali elementi portino cariche negative parziali in composti covalenti e, purché la differenza di elettronegatività sia sufficientemente grande, diventino anioni in composti legati prevalentemente in maniera ionica. Per le molecole biologiche è significativo che le elettronegatività del carbonio e dell'idrogeno siano molto simili, cosicché i legami fra questi due elementi sono essenzialmente non polari.
Polarizzabilità e potere polarizzante
La polarizzazione è la distorsione di un atomo, o di uno ione, dalla sua forma sferica naturale sotto l'influenza di un campo elettrico. Un anione è altamente polarizzabile se, anche in un campo elettrico molto debole, può dar luogo a una deviazione significativa dalla sua forma sferica. In generale, anioni grandi con numerosi elettroni sono altamente polarizzabili, perché il nucleo esercita soltanto una forza netta debole sugli elettroni più esterni. La polarizzazione può derivare dal campo elettrico di un catione che si trova nelle vicinanze, nel qual caso ci aspettiamo che il massimo potere polarizzante sia associato a cationi piccoli con alta carica (come Al3+). La tendenza moderna è di sostituire i concetti di polarizzabilità e potere polarizzante con i concetti di hardness (durezza) e softness (morbidezza). Gli elementi sono definiti chimicamente hard (duri), se tendono a partecipare a legami ionici, e soft (morbidi), se i loro legami sono prevalentemente covalenti.
Rassegna della chimica degli elementi
Tenendo presenti queste basi teoriche, possiamo passare in rassegna, in maniera sintetica, le proprietà fisiche e chimiche degli elementi, concentrandoci soprattutto sugli elementi dei Periodi 2 e 3 dei periodi principali. L'idrogeno, posto all'inizio della tavola, è unico per il fatto di possedere soltanto un singolo elettrone. Quando quell'elettrone viene perduto, l'entità risultante, sebbene sia formalmente denominata ione idrogeno (H+), è, di fatto, un semplice protone, producendo un'enorme contrazione nel raggio dell'atomo. In realtà, nell'ambito dei sistemi chimici, lo ione idrogeno non si trova mai allo stato libero. Così, quando una molecola di un acido, in soluzione acquosa, perde uno ione idrogeno, l'entità effettivamente presente nella soluzione è lo ione idronio H3O+, o qualche entità ancora più idratata. Un altro elemento di distinzione dell'atomo di idrogeno e del suo ione consiste nel fatto che entrambi hanno una massa estremamente piccola. Poiché la massa del protone è così piccola, esso può quantisticamente sfuggire ai suoi legami per effetto tunnel. Questa mobilità è la base essenziale dell'azione degli acidi e delle basi (rispettivamente donatori e accettori di protoni) e, per estensione, dell'azione tampone e catalitica degli acidi e delle basi che si trovano nelle cellule degli organismi. La piccola dimensione dell'atomo di idrogeno è responsabile anche del ruolo strutturale di questo elemento, in particolare della sua capacità di formare legami idrogeno inter- e intra-molecolari, nei quali un atomo di idrogeno si trova tra gli atomi di due elementi fortemente elettronegativi.
L'idrogeno origina più composti di qualsiasi altro elemento. I composti ionici cui dà luogo sono basati sullo ione idruro H− e formati con la maggior parte degli elementi dei Gruppi 1 e 2. Con gli elementi di transizione, a parte qualche eccezione, esso forma una serie di idruri interstiziali di composizione variabile. Tuttavia, la maggior parte dei suoi composti sono molecolari. Essi includono l'enorme gamma degli idrocarburi, nei quali l'idrogeno ha poco più che il ruolo di porre termine alla capacità di formare catene del carbonio. Anche la maggior parte degli altri composti organici contiene l'idrogeno. Sono di particolare interesse i composti in cui l'idrogeno si lega a un elemento fortemente elettronegativo come l'ossigeno o un alogeno, poiché questi sono i composti che classifichiamo come acidi.
Gli elementi del Blocco s
Gli elementi del Gruppo 1 sono tutti metalli fortemente reattivi. In larga misura, la loro reattività dipende dalla facilità con la quale perdono il loro elettrone più esterno, o di valenza, per l'azione di un elemento più elettronegativo. La maggior parte dei composti che essi formano sono ionici, ma vi è un accenno di covalenza all'inizio del gruppo, cioè nel litio, poiché la sua piccola dimensione ha come conseguenza un'energia di ionizzazione e una polarizzabilità relativamente elevate. Un'importante classe di sistemi è costituita dalle soluzioni ammoniacali di metalli alcalini, nelle quali i metalli si trovano disciolti nell'ammoniaca liquida. In questo caso, essi eliminano il loro elettrone di valenza, che è trattenuto in cavità formate da gruppi di molecole del solvente. Queste soluzioni, di colore blu inchiostro, sono molto utili come agenti riducenti per numerosi composti organici. La caratteristica degli elementi del Gruppo 1 di essere metalli reattivi si ritrova in quelli del Gruppo 2, ma in una forma meno aggressiva. La combinazione di carica maggiore e raggio minore negli ioni del Gruppo 2, rispetto a quelli del Gruppo 1, assicura che i composti ionici formati da questi elementi abbiano energie reticolari maggiori rispetto ai loro vicini più immediati.
Gli elementi dei Blocchi d e f
Gli elementi del Blocco d rappresentano un insieme con carattere di transizione fra metalli reattivi e blandamente reattivi, e non metalli. A sinistra del blocco, lo scandio è un metallo fortemente reattivo; a destra, si trovano i metalli da conio, cioè rame, argento e oro. Un'altra caratteristica di questi elementi, con importanti implicazioni di tipo biologico, è la loro capacità di perdere un numero variabile di elettroni quando formano composti. Questa capacità deriva dalle variazioni di energia relativamente piccole che accompagnano la perdita di successivi elettroni d. Si dice che i metalli di transizione possono esistere in un'ampia varietà di stati di ossidazione, ovvero di stati di perdita di elettroni, poiché in chimica l'ossidazione consiste in una perdita di elettroni. Una terza caratteristica dei metalli del Blocco d è la loro straordinaria capacità di formare complessi in cui piccoli ioni molecolari o poliatomici, detti leganti, che hanno un'esistenza indipendente, si legano a un atomo metallico centrale o a uno ione per dar luogo a un grande ione, dotato di una certa stabilità, o a una molecola neutra. I leganti si attaccano all'atomo o allo ione in una varietà di differenti geometrie, la più comune delle quali, per complessi con 6 leganti, è quella ottaedrica.
Gli elementi del Blocco p
Quando si arriva al Blocco p, incontriamo la linea di confine degli elementi non metallici. I gruppi situati al centro della parte principale della tavola periodica, quelli vicino al boro e al carbonio, sono notevoli per la peculiarità della loro chimica e, meno significativamente, per il modo in cui il carattere non metallico lascia il posto al carattere metallico quando si discende lungo il gruppo: basta confrontare, per esempio, il carbonio e il piombo.
Il boro si trova all'inizio del Blocco p. Il suo piccolo raggio atomico gli conferisce alcune importanti proprietà. La più rimarchevole è la sua capacità di formare un'estesa gamma di composti con l'idrogeno, detti borani, nei quali, ragionando secondo il punto di vista classico, non ci sarebbero abbastanza elettroni per formare tutti i legami necessari e che per questo vengono detti elettrondeficienti. Essi si legano sfruttando il fatto che gli atomi di boro sono così piccoli che gli atomi di idrogeno possono avvicinarvisi tanto che l'effetto di legame di una coppia di elettroni può essere condiviso da molti atomi invece che da due atomi soltanto.
Nel Gruppo 13, proprio sotto il boro, si trova l'alluminio, che è un autentico metallo. Tuttavia, a destra nella tavola periodica, nessun metallo è univocamente metallico e perfino l'alluminio mostra certe proprietà chimiche che suggeriscono un accenno di carattere non metallico.
In cima al Gruppo 14 si trova il carbonio. Esso non possiede né un'elevata energia di ionizzazione, né un'elevata affinità elettronica, cosicché accetta di formare legami covalenti e perfino di formarli con se stesso. Da ciò deriva la sua straordinaria capacità di originare una così ampia gamma di strutture dotate di un'architettura specifica, alle quali sono attaccati i gruppi funzionali che partecipano ai processi biochimici. Un'altra delle ragioni della peculiarità delle proprietà chimiche del carbonio risiede nella configurazione elettronica del suo stato fondamentale. Un atomo di carbonio ha 2 elettroni nel suo orbitale s più esterno e 2 nel suo orbitale p più esterno. A prima vista, dunque, ci si aspetterebbe di essere in presenza di un elemento relativamente poco interessante, in grado di formare soltanto 2 legami con gli atomi circostanti. Tuttavia, per una sorta di eco delle risonanze nucleari che sono responsabili della sua abbondanza nel cosmo, occorre pochissima energia per eccitare uno di quegli elettroni s in un orbitale p non pieno. Di conseguenza, il carbonio risulta in grado di formare composti tetravalenti, cioè può legarsi a 4 atomi vicini, e immediatamente da elemento 'noioso' diventa un elemento 'brillante'. In breve, la sua capacità di dar vita a 4 legami stereochimicamente orientati, formare catene con se stesso, nonché la sua elettronegatività non aggressiva, lo portano a formare milioni di composti. Sotto il carbonio, nel Gruppo 14, si trova il silicio. Sebbene questo elemento condivida un certo numero di proprietà con il carbonio, l'immaginare forme di vita fondate sul silicio è probabilmente una pia illusione. In primo luogo, il silicio ha una tendenza molto meno pronunciata a formare catene e anelli con se stesso, sicché, probabilmente, non si possono formare quelle delicate impalcature per molecole complesse che invece sono date dal carbonio. In secondo luogo, un atomo di silicio è probabilmente troppo grande per essere adatto a formare strutture complesse. Le sue dimensioni precludono la formazione di legami multipli con se stesso, se non in circostanze particolari. Inoltre, i composti del silicio sono molto più reattivi di quelli del carbonio, poiché una specie reagente presente può avvicinare l'atomo di silicio e iniziare a formare un legame con esso; le piccole dimensioni dell'atomo di carbonio rendono difficile la formazione di tale legame e lo proteggono da ogni attacco.
Il Gruppo 15 ha come primo elemento l'azoto che è il componente più abbondante dell'atmosfera, dove diluisce l'aggressiva reattività dell'ossigeno. La sua inerzia chimica deriva dai legami tripli che vincolano gli atomi nella molecola N2 e rendono particolarmente difficile la loro interazione con altri atomi. D'altra parte, catturare l'azoto dall'aria, realizzare cioè la fissazione dell'azoto, è un obiettivo di notevole importanza per la moderna industria chimica. Biologicamente, ciò avviene nei tubercoli radicali di alcune piante leguminose; nell'industria, l'unico processo commercialmente realizzabile è il processo Haber, nel quale l'azoto viene convertito in ammoniaca, mediante una reazione con l'idrogeno, a elevate temperature e ad alte pressioni. Un gran numero di ricerche è teso a chiarire il processo biologico e a imitarlo. Una volta che l'azoto è stato fissato, esso può essere convertito prontamente (di solito cataliticamente) in una vasta gamma di prodotti utilizzati nell'industria e nell'agricoltura. L'importanza biologica di questo elemento non sarà mai valutata abbastanza, essendo un componente di tutte le proteine e degli acidi nucleici.
Nel Gruppo 15, subito sotto l'azoto, si trova il fosforo. La forma elementare del fosforo differisce straordinariamente da quella dell'azoto: il primo è un solido allotropico e reattivo, il secondo un gas relativamente inerte. Il fosforo, al contrario dell'azoto, non è in grado di formare legami multipli con se stesso. Inoltre, siccome il raggio atomico di questo elemento è molto più grande di quello dell'azoto, il fosforo può formare composti con un numero più elevato di atomi direttamente legati a esso. Per i processi biochimici sono di straordinaria importanza gli ossiacidi del fosforo e la capacità dei gruppi fosfato di formare catene, come nella formazione dell'ATP (Adenosintrifosfato).
Non meno importanti dell'azoto e del fosforo sono i loro vicini, l'ossigeno e lo zolfo. Sebbene l'ossigeno origini composti con quasi tutti gli elementi, sotto forma di gas non è così reattivo come ci si potrebbe attendere sulla base della sua collocazione accanto al fluoro nella tavola periodica, perché le sue molecole posseggono in realtà un doppio legame, e quindi richiedono un maggior investimento di energia per essere separate. Un aspetto essenziale dell'importanza dell'ossigeno è il suo piccolo raggio atomico, accompagnato dalla sua alta elettronegatività, che concorre a far sì che l'ossigeno sia in grado di indurre la formazione di stati di ossidazione molto elevati in un gran numero di elementi e, all'interno di particolari strutture, di partecipare alla formazione di legami idrogeno. Una rilevante conseguenza chimica delle proprietà dell'ossigeno è l'importanza degli ossiacidi, cioè il fatto che un atomo di idrogeno legato a un atomo di ossigeno viene spesso rapidamente perduto a favore di un accettore di protoni.
Il ruolo speciale dello zolfo deriva dalla sua capacità di formare catene con se stesso. Così, mentre la proprietà dell'ossigeno di dare luogo a catene di atomi con se stesso arriva fino all'ozono (O3) e agli ioni ozonuro (O3−), lo zolfo può formare catene e anelli di lunghezza quasi indefinita. La forma comune dello zolfo elementare consiste di anelli S8, ma si possono costituire catene più lunghe quando lo zolfo fuso viene raffreddato rapidamente. Il fatto di formare catene con se stesso fa aumentare la varietà di anioni che possono derivare dallo zolfo: sono ben noti ioni polisolfuro come S52−. Una conseguenza biochimica di questa capacità è l'esistenza di legami disolfuro tra i residui peptidici nei polipeptidi.
Il Gruppo 17 è la sede degli alogeni, una famiglia di elementi che, scendendo lungo il gruppo, mostra una variazione considerevolmente regolare delle proprietà fisiche e chimiche, a partire dal colore e dallo stato fisico. Questi elementi, inoltre, sono tra i più aggressivi ed elettronegativi della tavola periodica, in particolare il fluoro. Oltre alla loro ampia gamma di ossiacidi e ossianioni, una straordinaria caratteristica degli alogeni è la loro capacità di formare composti tra loro. Questi composti interalogeni, come BrCl e IF7, spesso mostrano caratteristiche fisiche intermedie fra quelle dei due alogeni costituenti. Tuttavia, essi possono essere maggiormente reattivi, e in misura più spiccata, dei singoli alogeni: poche sostanze possono resistere al potere fluorurante del trifluoruro di bromo.
All'estremità destra della tavola periodica, nel Gruppo 18, si trovano i gas nobili, così chiamati perché sono chimicamente inerti. Questa caratteristica deriva dal fatto che gli strati esterni dei loro orbitali sono completi e il guadagno di energia nell'acquisire elettroni, come pure nel perderli, è irrilevante. Tuttavia, essi non sono completamente inerti, dal momento che il fluoro, e in qualche misura l'ossigeno, possono reagire con questi gas. D'altra parte, non vi è alcun ruolo biologico apparente per questi elementi, se si eccettuano gli effetti distruttivi del radon radioattivo quando filtra dal sottosuolo.
bibliografia
Atkins 1998: Atkins, Peter W., Physical chemistry, 6. ed., Oxford, Oxford University Press; New York, Freeman, 1998 (1. ed.: 1978).
Atkins, Jones 1997: Atkins, Peter W. - Jones, Loretta L., Chemistry, New York, Freeman, 1997.
Cowley 1995: Cowley, Charles R., The introduction to cosmochemistry, Cambridge, Cambridge University Press, 1995.
Cox 1989: Cox, Paul A., The elements: their origins, abundance and distribution, Oxford, Oxford University Press, 1989.
Emsley 1991: Emsley, John, The elements, 2. ed., Oxford, Oxford University Press, 1991 (1. ed.: 1989).
King 1994: King, R. Bruce, Encyclopedia of inorganic chemistry, Chichester-New York, Wiley, 1994.
Shriver 1994: Shriver, Duward F. - Atkins, Peter W. - Langford, Cooper H., Inorganic chemistry, Oxford, Oxford University Press; New York, Freeman, 1994 (1. ed.: 1990).