elementi
elementi
Le cento sostanze che formano milioni di composti
Gli elementi sono sostanze costituite da atomi tutti uguali tra loro. Nell'antichità si pensava che l'Universo fosse formato da quattro elementi oppure da atomi tutti uguali. Importanti scoperte scientifiche hanno dimostrato che in natura la materia è costituita da quasi cento elementi e hanno chiarito la struttura degli atomi che li costituiscono. Gli elementi sono stati classificati in una tavola periodica in base alle loro proprietà chimiche e dei loro atomi. Indagini cosmologiche hanno provato che la materia è costituita dagli stessi elementi in tutto l'Universo. Sulla Terra, le sfere geochimiche (i vari gusci da cui è formata) presentano ciascuna elementi caratteristici; attraverso cicli di reazioni questi elementi passano da una sfera all'altra
Dividere fino all'indivisibile
Fino a che punto è possibile dividere la materia? Sbriciolando un minerale in tante parti sempre più piccole, otterremo piccolissime particelle che ancora possiedono tutte le proprietà del minerale di partenza: queste piccole unità della materia sono chiamate molecole.
Dividendo anche le molecole otteniamo delle parti ancora più piccole ‒ chiamate atomi ‒ che non sono ulteriormente divisibili con mezzi chimici (ma lo sono con mezzi fisici) e sono diverse l'una dall'altra. Gli atomi con le stesse proprietà chimiche e fisiche costituiscono i diversi elementi, che sono i mattoni chimici dell'edificio del mondo in cui viviamo. Attualmente, quindi, il concetto di elemento è strettamente collegato a quello di atomo. Il termine elemento indica soprattutto il carattere omogeneo della parte più semplice di materia di cui si tratta; l'atomo rappresenta la più piccola quantità chimica di materia dotata di una propria individualità.
Gli elementi secondo i filosofi antichi
Nell'antichità alcuni filosofi ‒ detti naturalisti ‒ sostenevano che l'Universo e i singoli corpi che lo compongono fossero costituiti da uno o più elementi fondamentali e primordiali.
I greci Empedocle e Aristotele, per esempio, ritenevano che la materia fosse composta da quattro elementi, e cioè fuoco, terra, aria e acqua. Il primo rappresentava la luce solare o i fuochi terrestri come quello dei vulcani; il secondo la sostanza solida del nostro pianeta; il terzo quella gassosa dei venti e dell'atmosfera; il quarto, infine, la sostanza liquida dei mari. Secondo questa ipotesi gli elementi rappresentavano sia le grandi aggregazioni naturali del mondo, sia le proprietà assolute della materia, che si riteneva fossero il caldo, il freddo, il secco e l'umido.
Altri filosofi greci, detti atomisti, come Democrito ed Epicuro, sostenevano invece che tutti i corpi fossero costituiti da particelle indivisibili piccolissime, insensibili e omogenee, dette atomi. Gli atomi non erano differenti fra loro dal punto di vista qualitativo, e le qualità dei corpi da essi formati erano il risultato delle particolari aggregazioni degli atomi stessi.
Scoperte rivoluzionarie
L'idea di un Universo formato da quattro elementi rimase in voga fino alla metà del 18° secolo. In quest'epoca, però, grazie alle ricerche di molti studiosi ‒ fra i quali eccelse il chimico francese Antoine-Laurent Lavoisier ‒ avvenne una grande rivoluzione nella scienza: infatti si scoprì che l'aria non era un singolo elemento ma era composta di almeno due sostanze molto diverse tra loro, chiamate ossigeno e azoto; che anche l'acqua era composta da due gas semplici, l'idrogeno e l'ossigeno; che la terra non era un elemento unico, poiché in laboratorio venivano trovate tante 'terre' differenti, a loro volta composte da sostanze diverse; infine, che il fuoco non era una sostanza elementare, ma era il prodotto della combustione di alcune sostanze che si combinavano con l'ossigeno liberando una grande quantità di calore e producendo alcuni gas e ossidi.
Nel frattempo l'idea atomistica ebbe nuovi sviluppi. All'inizio del 19° secolo, il chimico inglese John Dalton elaborò un'importante teoria sulla costituzione chimica dei corpi: ogni elemento risulterebbe costituito da atomi uguali, indivisibili, dotati di un peso e di una forma determinati e invarianti, differenti dagli atomi degli altri elementi. In questo modo la teoria degli elementi e quella degli atomi venivano unificate in maniera coerente, dando luogo a una sintesi semplice che produsse ulteriori importanti sviluppi.
Sulla base di queste teorie la scoperta di nuovi elementi ebbe grande impulso. Nel 1789 erano noti 33 elementi, ma durante i due secoli successivi furono scoperti moltissimi altri elementi, fino agli attuali 112. Di questi, 91 sono naturali, mentre gli altri sono artificiali, cioè realizzati in laboratorio.
Dalla combinazione di questo 'pugno' di elementi diversi (e quindi di atomi diversi) si formano i milioni di corpi naturali composti, naturali e artificiali, oggi noti. Questi composti si differenziano tra loro per il tipo e le quantità relative di elementi presenti in essi, cioè per il tipo, il numero e la disposizione degli atomi nelle loro molecole.
Gli elementi sono formati da una materia ancora più semplice?
A partire dal 19° secolo, però, si scoprì che alcuni degli elementi già noti erano in realtà composti, cioè formati da elementi ancora più semplici. La lista di queste sostanze, quindi, diveniva sempre più lunga. Allora alcuni scienziati si domandarono se all'origine dei diversi elementi via via scoperti non vi fosse un solo elemento semplicissimo, progenitore di tutti gli altri, chiamato protilo (spesso identificato con l'idrogeno, il più leggero fra tutti gli elementi).
La risposta si trovò a cavallo fra i secoli 19° e 20°, e nei suoi aspetti generali è valida ancora oggi: esiste in effetti una materia che si trova in tutti i corpi, universale, rappresentata però da particelle di diverso tipo. Si tratta infatti dei costituenti degli atomi ‒ che quindi non sono più indivisibili ‒ ossia gli elettroni, con carica elettrica negativa, i protoni, con carica elettrica positiva e i neutroni, senza carica elettrica. Queste particelle, aggregandosi in numero diverso e secondo diverse strutture, danno luogo agli atomi dei differenti elementi. Si è scoperto che ognuno di questi atomi possiede un insieme di proprietà particolari che lo distinguono da ogni altro perché dotato di un diverso numero di protoni (e di un uguale numero di elettroni, perché la carica elettrica di ogni atomo deve essere neutra). Questo numero caratteristico è detto numero atomico e da esso discende la particolare individualità di ogni elemento. Le proprietà dei singoli atomi, quindi, sono diverse ma non tanto perché questi abbiano un peso particolare e distintivo, come pensavano i chimici del 19° secolo a partire da Dalton, quanto perché è diverso il numero di protoni dei loro atomi.
In effetti, agli inizi del 20° secolo, si scoprì che molti elementi sono formati da atomi con un diverso peso ma con le stesse proprietà chimiche (detti perciò isotopi): ciò dipende dal fatto che isotopi di uno stesso elemento pur avendo lo stesso numero di protoni hanno diverso numero di neutroni. Il peso atomico è dato dalla somma dei neutroni e dei protoni (gli elettroni in confronto sono leggerissimi e quindi trascurabili), da cui il peso diverso degli isotopi, mentre il numero atomico è dato dalla somma dei soli protoni. Sono quindi i protoni a rappresentare, per così dire, le 'impronte digitali' dell'atomo di ogni elemento.
Gli interrogativi del 19° secolo
In natura, gli elementi sono disposti casualmente e senza alcuna relazione fra di loro oppure esiste un qualche criterio che li lega? Da che cosa dipende il fatto che molti elementi sembrano possedere una stessa 'aria di famiglia'? Dato che si scoprono sempre più elementi, il loro numero è finito o infinito? Questi sono gli interrogativi che si sono posti molti scienziati, soprattutto a partire dal 19° secolo.
Sembrava strano, infatti, che tanti e diversi corpi semplici esistessero in maniera indipendente l'uno dall'altro, così come erano stati in effetti scoperti. Si sapeva che alcuni di essi avevano proprietà simili, mediante le quali potevano essere raggruppati: per esempio i metalli e i non metalli. Ma era importante scoprire se esistesse un unico principio generale in grado di collegarli tutti e di definire con esattezza quale grandezza invariante e specifica potesse stare alla base di tale collegamento. Solo così era possibile dare una qualche risposta agli altri quesiti.
La classificazione degli elementi
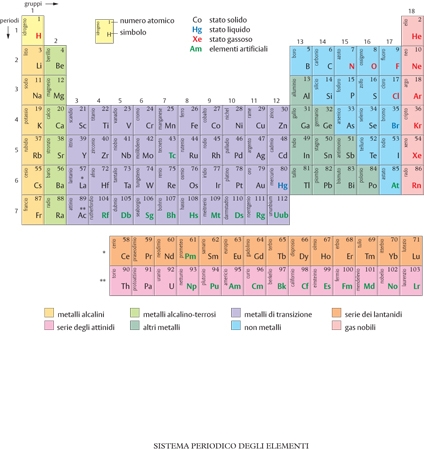
Nel 1869 il chimico russo Dmitrij Ivanovič Mendeleev fece un'importante scoperta a questo riguardo: disponendo gli elementi secondo la serie crescente dei loro pesi atomici, si presentavano periodicamente elementi dalle proprietà chimiche simili; e queste proprietà variavano gradualmente al crescere del peso atomico. Di qui la possibilità di disporre tutti gli elementi in una tavola secondo un criterio generale di classificazione. Nasceva in questo modo la celebre tavola degli elementi di Mendeleev, che, però, ai primi del 20° secolo è stata modificata sostituendo ‒ e ora sappiamo il perché ‒ il numero atomico al peso atomico come criterio ordinativo. In questa tavola (detta anche sistema periodico degli elementi) gli elementi sono ordinati in righe successive dette periodi, in modo tale che gli elementi analoghi formino colonne verticali dette gruppi.
La tavola di Mendeleev è dunque una sorta di affresco nel quale viene rappresentata la grande varietà della struttura della materia. Tuttavia anche questa varietà possiede limiti. Essa, infatti, non è continua ‒ poiché procede secondo la serie dei numeri interi che rappresentano i numeri atomici ‒ e non è comunque indefinita, poiché la serie naturale degli elementi, cioè degli elementi stabili esistenti in natura, parte da 1 e si arresta a 92, con l'elemento uranio (con l'eccezione dell'elemento tecnezio, numero atomico 43, che non è stabile e può essere preparato solo artificialmente). Al di sopra di questo numero (da 93 a 112) gli elementi sono instabili e possiedono una vita media molto breve (rispetto all'età della Terra che è di circa 4,5 miliardi anni) e quindi non esistono stabilmente nel nostro pianeta.
L'origine e…
Ogni pietra del nostro e degli altri pianeti dell'Universo è stata una volta parte di una stella. Infatti i vari elementi presenti nei pianeti, e i corpi che ne sono derivati, hanno la loro origine dal materiale cosmico formatosi alcuni milionesimi di secondo dopo il big bang, l'evento che circa 15 miliardi di anni fa ha originato il nostro Universo. Per prima, ovviamente, si è formata la materia primordiale, unica, di cui sono composti tutti gli atomi, costituita da particelle chiamate quark, e con essi è stata liberata una grande quantità di energia. Dai quark, poi, si sono prodotti i nucleoni (protoni e neutroni), e da questi gli elementi più leggeri, cioè l'idrogeno e l'elio, e poi, per sintesi ulteriori, tutti gli altri elementi più pesanti.
A partire dal big bang, dunque, si è avuta una sorta di complicatissima evoluzione cosmica della materia, dalle particelle più semplici fino alle strutture più complesse, alle nebulose, alle stelle, ai pianeti, a tutti i corpi che conosciamo, compreso il nostro.
… l'abbondanza degli elementi
Si è constatato, inoltre, che la struttura chimica elementare del nostro Universo è simile in ogni sua parte. Questa scoperta è stata possibile solo dopo che si è potuto esaminare la composizione chimica del Sole e delle stelle grazie all'invenzione, nel 1860, di un importante strumento chiamato spettroscopio, in grado di analizzare la luce solare e stellare (spettroscopia). Prima dell'invenzione di questo strumento non esisteva nessuna prova che gli elementi presenti sulla Terra e le leggi che governano le loro combinazioni e trasformazioni fossero uguali anche nel resto dell'Universo; né che i corpi extraterrestri fossero simili a quelli del nostro pianeta. Le esplorazioni spaziali compiute dalla seconda metà del 20° secolo fino a oggi hanno confermato queste ipotesi. Per di più, lo studio della composizione chimica della Terra, degli altri pianeti, delle stelle, dei meteoriti, e così via ha consentito la determinazione precisa delle abbondanze relative degli elementi presenti in questi corpi celesti, ottenendo un risultato straordinario: su larga scala la costituzione chimica dell'Universo risulta notevolmente uniforme, pur tenuto conto della differente storia dei vari corpi celesti. L'evoluzione cosmica della materia è testimoniata anche dal fatto che nelle stelle più calde (le più giovani) sono presenti solo pochi elementi, i più leggeri (cioè con numero atomico più piccolo), mentre in quelle più fredde (più vecchie) sono via via presenti quelli più pesanti. Nei pianeti sono generalmente presenti tutti gli elementi che conosciamo dall'analisi elementare dei corpi terrestri.
La distribuzione degli elementi sulla Terra
Sulla Terra i 91 elementi naturali non sono distribuiti in modo uniforme. Infatti, nelle parti del Pianeta dotate di determinate proprietà (dette sfere geochimiche) non si trovano gli stessi elementi. Ciò rende possibile una loro speciale classificazione, che esprime la tendenza di ogni elemento a concentrarsi in maniera particolare nelle diverse sfere.
Intorno a noi vi è l'atmosfera, grazie alla quale respiriamo e dove sono concentrati gli elementi atmofili, come l'ossigeno, l'azoto, i gas rari (elio, neon, argo, cripto, xeno, rado), l'idrogeno.
Nella biosfera, lo strato che comprende tutti gli organismi viventi incluso l'uomo, sono presenti gli elementi detti biofili o bioelementi cioè gli elementi della vita: sono il carbonio, l'idrogeno, l'ossigeno, l'azoto, il fosforo, il sodio, il potassio, il calcio.
L'idrosfera è l'insieme delle acque terrestri, dove sono concentrati gli elementi talassofili, cioè l'idrogeno, l'ossigeno, il sodio, il magnesio, il cloro, lo zolfo, il carbonio, il cromo e il boro.
Nelle rocce di monti, colline e campagne, cioè nella crosta terrestre, vi sono diversi tipi di aggregazioni di elementi: i calcofili, presenti nelle rocce di solfuri, come lo zolfo, il rame, lo zinco, l'argento, il cadmio, il piombo, il selenio; i litofili, concentrati in alcune rocce composte di silicati le quali, oltre al silicio e all'ossigeno, comprendono l'alluminio, il magnesio, il sodio, il potassio, il calcio. Infine, nel nucleo più profondo del nostro pianeta, subito sotto la crosta terrestre, vi sono gli elementi detti siderofili, soprattutto il ferro e il nichel, e poi il carbonio, il fosforo, l'oro, il renio e il molibdeno.
Gli elementi circolano
Quando pensiamo agli elementi, viene spontaneo credere che, così come sono chimicamente invarianti, essi rimangano fermi lì dove si sono formati all'origine o dove si sono combinati successivamente per formare tutti i corpi naturali. Ma se riflettiamo sull'evoluzione cosmica, geologica e biologica dei corpi, sulla storia chimica del nostro stesso corpo, ci possiamo rendere conto che gli elementi‒ sulla scala dei tempi geologici ‒ sono in gran movimento.
Già dai libri più antichi sappiamo che "siamo nati dalla polvere e sotto forma di polvere ritorneremo" alla fine della nostra esistenza individuale. È esattamente ciò che la scienza ha dimostrato per tutti i corpi organizzati, se per 'polvere' si vogliano intendere le parti elementari o poco composte dei corpi. La chimica della natura, infatti, non è altro che un incessante ciclo di reazioni degli elementi; una migrazione continua da una sfera geochimica all'altra; un passaggio senza fine da un corpo composto a un altro (come nel caso del ciclo dell'azoto o del ciclo del carbonio).
Inoltre, già da molto tempo si è capito che sulla Terra il mondo vivente, cioè la biosfera, è uno dei motori più attivi di questi fenomeni di migrazione degli elementi. E da quando la nostra specie, grazie alla sua capacità di pensare, ha inventato tecniche, scienze e industrie, anche gli esseri umani sono fra i principali responsabili della dinamica degli elementi chimici del nostro pianeta. Se tutti gli esseri viventi scomparissero, la Terra sarebbe pervasa da una relativa e impressionante 'calma chimica'.