Farmacologia e sperimentazione animale
Farmacologia e sperimentazione animale
sommario: 1. Premesse generali. 2. Gli argomenti degli oppositori. a) Differenze e similitudini tra l'uomo e gli animali. b) Le tecniche alternative. 3. La strategia della ricerca biomedica. 4. Gli animali impiegati nella sperimentazione. a) Animali transgenici. b) Topi knock-out. 5. Le leggi sulla sperimentazione animale. 6. Prospettive future. □ Bibliografia.
1. Premesse generali
Da quando la medicina è divenuta una scienza moderna la sperimentazione animale ne è stata una componente fondamentale, fornendo un modello che permette di porre domande ed esplorare soluzioni che possono essere utili alla salute degli uomini e degli stessi animali. Sebbene il valore storico della sperimentazione animale sia indiscutibile, in periodi ricorrenti viene rimessa in questione da vari gruppi di pressione la legittimità del suo impiego per il progresso delle conoscenze biomediche e lo sviluppo di nuovi ‛mezzi' diagnostici e terapeutici. Le argomentazioni utilizzate sono state per molto tempo di tipo emotivo-ideologico; in epoca più recente, invece, il movimento cosiddetto ‛antivivisezionista' tende a legittimare le proprie asserzioni con considerazioni di ordine scientifico: si rimprovera ai ricercatori biomedici di continuare a utilizzare con pigrizia vecchie tecniche che richiedono l'impiego degli animali, mentre la scienza ‛moderna' sarebbe in grado di utilizzare tecniche completamente diverse. Prima di entrare nel vivo del problema è forse utile sgombrare il campo da alcune false informazioni che - grazie anche ai frequenti e spesso acritici interventi dei mass media - rischiano di passare per fatti dimostrati.
Anzitutto sarebbe opportuno sostituire il termine ‛vivisezione', che suscita emozioni e immagini di orrore e di sangue, con quello più corretto di ‛sperimentazione animale'. Non si capisce perché un intervento eseguito su animali da esperimento si debba chiamare vivisezione, mentre lo stesso intervento condotto sull'uomo si chiama operazione chirurgica; o perché lo studio degli effetti di un farmaco nell'uomo si chiami sperimentazione, mentre lo stesso studio nell'animale da esperimento sia considerato vivisezione.
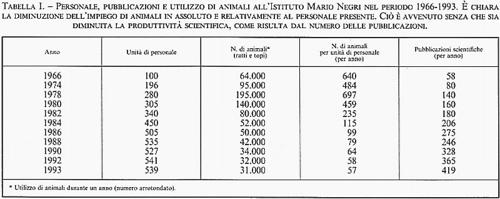
Va anche sottolineato come l'utilizzazione degli animali per la ricerca sia in continuo calo. Nella tab. I vengono riportati i dati riguardanti l'Istituto Mario Negri - preso come indice di quello che è oggi l'orientamento della ricerca biomedica in tutto il mondo - dai quali risulta con chiarezza come il numero degli animali impiegati continui a diminuire nonostante l'aumento del numero dei ricercatori.
Questo risultato è dovuto agli sviluppi delle metodologie scientifiche: ad esempio, la disponibilità di tecnologie analitiche dotate di alta specificità e sensibilità per misurare farmaci e mediatori chimici nei tessuti rende possibile utilizzare frammenti di cervello di ratto, mentre anche solo vent'anni fa erano necessarie decine di cervelli di ratto per eseguire lo stesso tipo di misurazioni. I metodi non invasivi della statistica, dei modelli matematici attualmente impiegati rappresentano altrettanti fattori che permettono di ottenere risultati scientificamente validi, riducendo considerevolmente il numero degli animali utilizzati a scopo sperimentale.
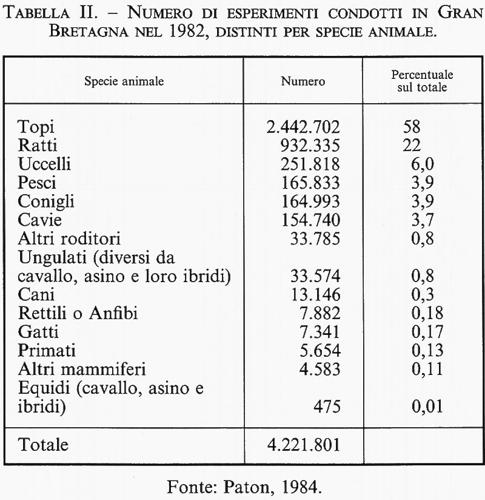
Quando l'opinione pubblica pensa alla sperimentazione animale pensa soprattutto agli animali con cui ha più contatto e ai quali è legato per ragioni affettive. La tab. II, che riporta le statistiche relative all'uso degli animali in Inghilterra, mostra che per la stragrande maggioranza gli animali impiegati nella ricerca scientifica sono ratti e topi, mentre è molto limitata e comunque in continua diminuzione l'utilizzazione di animali superiori quali gatti, cani e scimmie.
La mobilitazione degli ambientalisti contro la sperimentazione animale è anch'essa incomprensibile, dato che gli animali impiegati non esisterebbero se non esistesse la sperimentazione; infatti, poiché gli animali utilizzati devono avere caratteristiche genetiche ben definite e perciò essere appositamente allevati in centri specializzati, non possono essere certamente raccolti a caso. In questo senso è sicuramente accettabile da tutti la legge che vieta l'impiego degli animali randagi (cani e gatti) per la sperimentazione animale.
Le immagini che spesso vengono proposte all'opinione pubblica - cani o scimmie durante una operazione chirurgica - sono vecchie di molti anni e in molti casi non se ne conosce neppure l'origine; esse vengono mostrate col preciso scopo di suscitare emozioni e sensazioni di dolore. In realtà, oggi nella sperimentazione animale vengono prese tutte le precauzioni possibili per evitare la sofferenza. L'uso dell'anestesia, delle cure postoperatorie, l'attenzione a evitare stress sono diventate pratiche strettamente legate alla professionalità del ricercatore. Indipendentemente da ogni considerazione di carattere ‛umanitario', la buona riuscita di un esperimento, la sua attendibilità e la sua riproducibilità dipendono dall'evitare in modo assoluto all'animale ogni danno che potrebbe poi interferire con il significato dei risultati ottenuti. Nell'ambito della sperimentazione animale sono stati perfino messi a punto anestetici e analgesici specifici per una determinata specie animale, che, fra l'altro, possono essere utilizzati con successo quando vi sia la necessità di un intervento chirurgico indipendentemente da ragioni di sperimentazione.
Vengono spesso avanzati argomenti di ordine economico, secondo i quali, ad esempio, l'uso degli animali sarebbe dettato solo da volontà di risparmio. In realtà è vero il contrario, perché mantenere degli animali - come è necessario - in buone condizioni di stabulazione, con dieta controllata, aria condizionata, temperatura e umidità costanti, costa certamente molto di più degli studi condotti in vitro. A titolo d'esempio si può citare un test di carcinogenesi, che in vitro costa circa 30 milioni di lire, mentre in vivo ha un costo 100 volte superiore, e cioè circa 3 miliardi. Inoltre - sempre nel campo della cancerogenesi - il tempo necessario per eseguire un test in vitro è di qualche settimana, mentre in vivo sono necessari oltre 3 anni. Evidentemente per scegliere la via più costosa e più lunga ci devono essere - come vedremo in seguito - delle buone ragioni!
Si richiede anche di finanziare la ricerca in vitro per poter finalmente eliminare l'uso degli animali. Anche questa richiesta crea disinformazione, perché già oggi, in Italia, in tutti i laboratori viene effettuata molta ricerca in vitro sostenuta da finanziamenti pubblici erogati sia dall'Università, sia dal Consiglio Nazionale delle Ricerche. La tab. III riporta i dati relativi alle spese sostenute per l'utilizzazione di animali rispetto alla spesa totale per la ricerca del Medical Research Council (MRC) del Regno Unito. I dati non hanno bisogno di commenti.
Un'altra accusa che si rivolge ai ricercatori è quella di eseguire esperimenti inutili che non daranno mai risultati interessanti. È forse il caso di sottolineare il fatto che la ricerca scientifica spesso non dà risultati prevedibili, altrimenti non vi sarebbe alcuna ragione per effettuarla. È pertanto impossibile valutare a priori quale sarà il destino - a breve o a lunga scadenza - di una osservazione scientifica ed è difficile giudicare della validità e opportunità di un esperimento. Quando si sono iniziati i primi studi sui trapianti di organo negli animali, nessuno poteva prevedere che saremmo giunti a trapiantare con successo organi come il rene, il fegato e il cuore nell'uomo. Se all'epoca di questi studi fosse stato dato un giudizio - anche da persone competenti - sarebbe stato con tutta probabilità un giudizio negativo e l'attività dei ricercatori sarebbe stata considerata dai più come stravagante e senza senso.
La libertà nella ricerca biomedica è essenziale se vogliamo ottenere quei progressi nella diagnosi e nella terapia delle malattie che tutti, anche coloro che sono contrari alla sperimentazione animale, auspicano.
Esiste anche la convinzione che gli scienziati che si avvalgono della sperimentazione animale siano dei sadici che sfogano attraverso la ricerca i loro bassi istinti. Si tratta evidentemente di affermazioni che non val la pena di smentire, ma che spesso colpiscono l'opinione pubblica anche per la diffusa convinzione che ‟chi ama gli animali ama gli uomini". Ci sarebbe molto da discutere su quest'ultimo punto: basti ricordare che l'unico paese al mondo a proibire la sperimentazione animale è stata la Germania nazista! Tuttavia, non vi è dubbio che anche fra i ricercatori - come in tutte le altre professioni - possono esistere individui privi di professionalità o che presentano comportamenti devianti. In questi casi - peraltro finora pochissimi - si può far ricorso alla legislazione esistente e ogni giusta azione in questo senso non può che trovare concorde la maggioranza dei ricercatori, che ha tutto l'interesse a eliminare dalla comunità scientifica coloro che non sono degni di farne parte.
Nei dibattiti pubblici si tende a dare l'impressione che anche nel mondo della ricerca esista una divisione fra favorevoli e contrari alla sperimentazione animale. In realtà nel caso dei ricercatori i contrari rappresentano delle assolute eccezioni. In Italia, oltre 25 società scientifiche, che rappresentano più di 20.000 iscritti, si sono pronunciate in modo chiaro contro coloro che vorrebbero bloccare la ricerca scientifica sugli animali. Nel 1992 è stata introdotta in Italia una nuova legge sulla sperimentazione animale (d.l. n. 116, Gazzetta Ufficiale, suppl. 40, 18 febbraio 1992) sulla base delle direttive della Comunità Europea. L'Italia ha recepito tali direttive in modo molto rigido e severo. Tutti i laboratori (pubblici e privati) che intendono svolgere sperimentazione animale devono ottenere una specifica autorizzazione. Per ottenere tale autorizzazione occorre disporre di stabulari con precise caratteristiche tecniche (temperatura, umidità, ricambi d'aria, servizi, dimensione delle gabbie, ecc.) e presentare un programma di ricerca, con relativi protocolli validi per un triennio. L'autorizzazione richiede un sopralluogo da parte di ispettori; ogni laboratorio deve avere la consulenza di un medico veterinario. Per esperimenti che richiedono di essere compiuti senza anestesia, come pure per l'impiego di cani, gatti o Primati, è necessario un permesso speciale, concesso di volta in volta dal Ministero della Sanità. Le sanzioni pecuniarie e penali per i trasgressori sono molto severe.
2. Gli argomenti degli oppositori
Dopo queste premesse di ordine più generale possiamo affrontare argomenti di ordine più scientifico, riguardanti la legittimità della sperimentazione animale. Gli argomenti avanzati dagli oppositori si possono raggruppare in due grandi categorie, riguardanti da un lato le differenze tra l'uomo e gli animali, e dall'altro la possibilità di utilizzare tecniche alternative.
a) Differenze e similitudini tra l'uomo e gli animali
Secondo la prima obiezione avanzata dagli oppositori della sperimentazione animale, sarebbe impossibile utilizzare per l'uomo gli studi fatti sugli animali, date le differenze esistenti tra le specie. Che gli animali siano differenti dall'uomo non è ovviamente in discussione. Esistono però anche delle somiglianze, relative, ad esempio, ad alcune funzioni fondamentali, quali quella del sistema nervoso, la respirazione, la circolazione, la riproduzione. È importante, perciò, capire a fondo tali differenze e somiglianze per poter utilizzare i risultati ottenuti nell'animale a beneficio dell'uomo (e degli stessi animali!).
Sia nell'uomo che negli animali l'organizzazione cellulare ha molti aspetti simili (nucleo, citoplasma, membrane, mitocondri, ecc.), e anche a livello molecolare molti enzimi, mediatori chimici, ormoni, citochine, recettori hanno un grado di somiglianza molto elevato; perfino il codice genetico è lo stesso. Sulla base di queste conoscenze, si può scegliere la specie animale più adatta per ogni tipo di esperimento, a seconda delle finalità che si perseguono.
Ovviamente, i risultati devono essere poi sottoposti a interpretazione, ma quanto più sono generalizzabili a specie diverse, tanto più esiste la probabilità che siano estensibili anche all'uomo. Bisogna dire con chiarezza che non si è mai sicuri di poter estrapolare un dato da una determinata specie animale all'uomo, e proprio per questo occorre moltiplicare gli studi su varie specie animali. Ad esempio, la conoscenza degli effetti di un farmaco in varie specie animali è indispensabile per poter eseguire la prima somministrazione nell'uomo, così da avere almeno un'idea della dose che si deve impiegare e sapere quali tipi di reazioni si possono prevedere. La legislazione di tutti i paesi del mondo richiede, giustamente, una serie di esperimenti negli animali prima di dare un'autorizzazione a impiegare un farmaco per la prima volta nell'uomo.
Questi esperimenti, spesso lunghi e costosi, mirano a sapere qual è l'effetto benefico che ci si può attendere da un farmaco nell'uomo e soprattutto se tale effetto può essere ottenuto senza eccessivi rischi. Pertanto, vengono richiesti studi in più di una specie animale al fine di conoscere la tossicità di un farmaco (acuta e cronica) e il suo eventuale effetto cancerogeno, mutageno, teratogeno. Queste ricerche vengono spesso condotte su più generazioni di animali, osservando effetti morfologici, biochimici, funzionali, comportamentali. È sulla base della somma, dell'analisi e del confronto di un gran numero di dati che si può tentare l'impiego di un farmaco nell'uomo, con la probabilità, se non altro, di non nuocere ed eventualmente di ottenere informazioni utili sui sintomi o sulla progressione delle malattie.
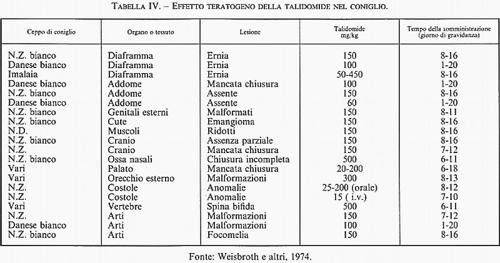
Gli oppositori portano sempre come esempio della inutilità della sperimentazione animale il caso della talidomide. Ma la tragedia della talidomide, con le migliaia di bambini nati con malformazioni che il suo impiego ha causato, prova proprio il contrario. Infatti, all'epoca della scoperta della talidomide come farmaco sedativo, gli studi di tossicità si limitavano agli animali normali e non includevano anche gli animali gravidi. Altrimenti, si sarebbero individuati degli effetti (v. tab. IV) che avrebbero messo in allarme gli sperimentatori. La talidomide, infatti, è teratogena in varie specie animali - e in particolare nel coniglio - quando venga somministrata all'inizio della gravidanza. Da allora, purtroppo solo da allora, è diventato obbligatorio per ogni farmaco uno studio degli effetti esercitati sulla riproduzione in almeno due specie animali.
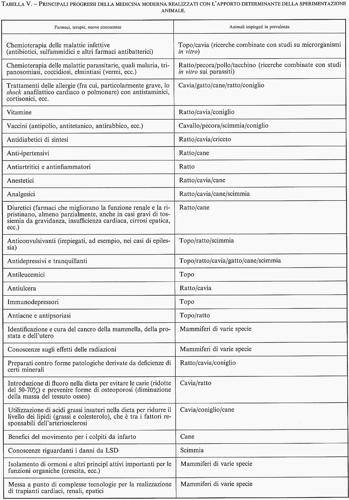
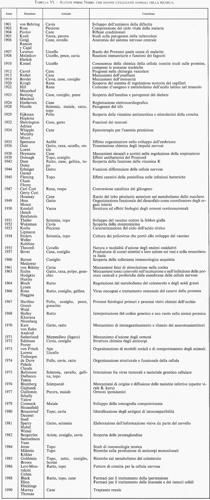
La sperimentazione animale ha invece contribuito moltissimo al progresso delle nostre conoscenze e al miglioramento della nostra capacità di curare alcune malattie. Basti pensare al ruolo che hanno avuto i vaccini; ad esempio, prima del vaccino contro la poliomielite, solo in Italia alcune migliaia di bambini ogni anno si ammalavano di questa terribile e invalidante malattia; dopo l'obbligatorietà della vaccinazione antipoliomielitica, i casi sono diminuiti in modo impressionante e in questi ultimi anni non si è avuto in Italia un solo caso. Chi mai può negare l'importanza della sperimentazione animale nella scoperta e nello sviluppo di tale vaccino? Questo è solo un esempio, ma sono numerosissimi i farmaci che - studiati per la prima volta negli animali - vengono correntemente impiegati nell'uomo. Nella tab. V sono elencati solo alcuni dei risultati terapeutici ottenuti nell'uomo, che non sarebbero stati possibili senza l'impiego degli animali.
Un modo attraverso cui è possibile ricercare terapie impiegabili nell'uomo è quello di sviluppare modelli animali delle malattie umane. Ad esempio, la stimolazione ottenuta somministrando anfetammina nel topo ha permesso di scoprire alcuni farmaci neurolettici che si utilizzano nel trattamento delle psicosi acute; l'infezione da micobatteri nel topo ha portato allo sviluppo dell'isoniazide, un farmaco che ha rivoluzionato il trattamento della tubercolosi; l'edema da carragenina nel ratto ha permesso di ottenere farmaci antinfiammatori molto potenti che possono lenire il dolore in gravi forme di artrite; l'ulcera gastrica da istamina nel ratto ha portato alla scoperta dei nuovi farmaci antiulcera gastrica che hanno ridotto la necessità di intervenire chirurgicamente.
Gli esempi potrebbero continuare. In molti casi è proprio la mancanza di un modello animale che impedisce di studiare possibilità terapeutiche; ad esempio, fra le molte difficoltà che si frappongono alla scoperta di farmaci o di vaccini anti-AIDS è certamente significativa la mancanza di un modello che possa riprodurre le caratteristiche di questa malattia almeno in una specie animale.
I progressi delle conoscenze nel campo della biologia molecolare stanno rivelandosi molto importanti anche per mettere a punto nuovi modelli animali di malattie umane: basti pensare agli animali transgenici, che si ottengono in seguito a modifiche del genoma nelle prime fasi della riproduzione, subito dopo la fecondazione; l'impiego di tecniche appropriate permette di annullare o potenziare determinati geni, ottenendo così deficienza o abbondanza di specifiche proteine. Alcuni risultati sono già stati ottenuti e in futuro sarà possibile sviluppare modelli molto più razionali di quelli del passato e soprattutto più vicini alle cause effettive delle patologie umane. Ad esempio, la conoscenza dei geni che codificano per vari tipi di collagene ha permesso di riprodurre nel topo la osteogenesi imperfetta, una rara malattia ossea che conduce a morte precoce. Questi studi sono preliminari alla possibilità di intervenire nei primi stadi della fecondazione per rimediare a danni genetici. La gene therapy non è più fantascienza e questi progressi non sarebbero stati possibili senza l'impiego degli animali (v. Sechzer, 1983; v. Leader e Stark, 1987; v. Orlans e altri, 1987; v. Paton, 19932; v. Hay, 1988; v. Garattini e van Bekkum, 1990; v. U. S. Department of Agriculture, 1992).
Abbiamo finora esaminato alcune somiglianze fra certe specie animali e l'uomo, ma esistono anche alcune profonde differenze che non solo non sono di ostacolo al progresso delle conoscenze, ma possono essere utilizzate nell'interesse dell'uomo. Anche in questo caso si può citare un esempio: il ratto, a differenza dell'uomo, non sviluppa spontaneamente arteriosclerosi. È chiaro quindi che il ratto non servirà come modello di tale patologia, ma potrà servire moltissimo a capire perché, a differenza dell'uomo, non ne soffra spontaneamente: trovare le ragioni di questa differenza potrebbe con ogni probabilità rendere disponibili elementi determinanti per mettere a punto una efficace terapia.
L'impiego degli animali ha rappresentato un fattore di fondamentale importanza nella maggioranza delle principali scoperte scientifiche in campo biomedico, come risulta chiaramente dalla tab. VI. In definitiva, l'impiego degli animali deve essere considerato come una qualsiasi forma di modellistica. Nessuno si sognerebbe di costruire una diga, un'autovettura o un aeroplano senza aver prima realizzato adeguati modelli di dimensione sempre maggiore. I modelli sono dei mezzi che permettono di porre delle domande e di ottenere delle risposte che certamente aiutano a mettere a punto il prodotto finale. È chiaro che tutto ciò non è automatico, ma deve essere sottoposto a vaglio critico; in questo senso la ‛costruzione' dei modelli animali rappresenta di per sé un progetto di ricerca utile a sviluppare nuovi farmaci per l'uomo.
b) Le tecniche alternative
La seconda argomentazione di coloro che sono contrari alla sperimentazione animale è quella relativa alla possibilità di utilizzare tecniche alternative, quali colture cellulari, sistemi enzimatici, modelli matematici.
Tuttavia, attualmente disponiamo di tecniche alternative alla sperimentazione animale solo in casi molto particolari e specifici. Anche la possibilità - aperta dai più recenti sviluppi tecnologici - di utilizzare cellule di provenienza umana in vitro non risolve il problema per alcune fondamentali ragioni che cercheremo di riassumere qui di seguito.
In primo luogo, le cellule di qualsiasi specie animale coltivate in vitro cambiano considerevolmente le loro caratteristiche morfologiche, funzionali e biochimiche rispetto a quelle riscontrabili in vivo. Ad esempio, le cellule neuronali in coltura crescono molto rapidamente, mentre è noto che in vivo queste cellule normalmente non si moltiplicano; è chiaro che questa differenza di comportamento implica l'esistenza di un metabolismo diverso rispetto alla situazione in vivo; è anche chiaro che l'effetto di un farmaco può essere molto diverso in vitro, proprio per la diversità del metabolismo cellulare, rispetto a quanto può accadere in vivo.
In secondo luogo, le cellule in vitro non hanno contatti con altre cellule, mentre invece in vivo la funzionalità di un tessuto dipende proprio dall'interazione fra le funzioni delle varie cellule. Molti tessuti hanno una innervazione che ne determina lo stato funzionale; ovviamente non è possibile riprodurre questa situazione in vitro e quindi ci troviamo di fronte a una condizione semplificata, incompleta, rispetto a quella presente in vivo.
In terzo luogo, le cellule in vivo sono irrorate dal sangue, che porta non solo elementi nutritivi, ma soprattutto ormoni e altri fattori che regolano le funzioni cellulari in rapporto con gli stati funzionali dell'organismo. In vitro, invece, anche se si possono aggiungere fattori nutritivi e ormoni, manca ovviamente questa situazione dinamica.
Infine, la somministrazione di una sostanza chimica in vivo comporta spesso una sua trasformazione. L'organismo, infatti, determina la formazione di altre specie chimiche, spesso biologicamente attive e pertanto in grado di esercitare effetti farmacologici e tossici. È impossibile, almeno per il momento, riprodurre in vitro una situazione qualitativamente e quantitativamente comparabile a quella in vivo.
Oltre alle colture in vitro, gli oppositori della sperimentazione animale propongono anche altre metodologie, quali ad esempio l'impiego di organi isolati, di preparazioni enzimatiche, di modelli matematici, di programmi computerizzati, di banche dati, ecc. Tutte queste metodologie sono già impiegate dai ricercatori biomedici: si tratta di tecniche che hanno grande interesse e che spesso riescono a dare risultati di notevole importanza e a ridurre l'impiego di animali. Tuttavia, è impossibile pensare, almeno per il prossimo futuro, che queste tecniche rappresentino un'alternativa all'impiego di animali, poiché esse sono ancora più riduttive delle colture cellulari, che pure sono un pallido modello della situazione presente in vivo anche nel più semplice degli organismi viventi.
Gli oppositori della sperimentazione animale danno anche grande enfasi alla utilità degli studi epidemiologici, cioè degli studi di popolazione compiuti attraverso metodi retrospettivi o prospettici. Tuttavia queste tecniche, pur rientrando a buon diritto tra le metodologie biomediche, affrontano un solo aspetto dei molti problemi che la medicina deve risolvere. Infatti, l'epidemiologia retrospettiva permette di ottenere dati importanti sui fattori di rischio delle malattie, ma questi devono essere corroborati da dati biologici che ne verifichino il rapporto di causa ed effetto. Per quanto riguarda gli studi prospettici, qualsiasi tentativo di modificare la storia naturale di una malattia non può nascere solo da un'idea: questa deve essere sostenuta da una serie di osservazioni sperimentali che devono essere necessariamente condotte sugli animali da esperimento e su piccoli gruppi di pazienti prima di coinvolgere intere popolazioni. Bisogna infatti ricordare che qualsiasi intervento farmacologico non è solo portatore di effetti benefici, ma è anche accompagnato da effetti tossici. Lo scopo della sperimentazione animale, pur con le sue incertezze, è proprio quello di accertare l'esistenza di effetti benefici e di svelare eventuali effetti tossici, al fine di stabilire quel rapporto benefici/rischi che giustifichi razionalmente ogni studio nell'uomo.
Un'altra delle possibilità sostenute dagli oppositori della sperimentazione animale è quella di impiegare animali inferiori (ad es. Invertebrati), per evitare l'impiego di animali a più alto livello di sviluppo. Anche in questo caso non si tratta certo di una proposta innovativa; basti pensare ai notevoli studi che si sono sviluppati da molti anni su di un moscerino, Drosophila, per dimostrare che i ricercatori utilizzano tutte le specie animali che possono essere utili allo sviluppo delle conoscenze: tuttavia deve essere ribadito il concetto che ogni metodologia ha pregi e limiti e che perciò ha un suo posto preciso nella complessa strategia che permette di fare passi avanti in medicina.
3. La strategia della ricerca biomedica
Già le poche argomentazioni sopra riportate tra le molte disponibili pongono le cosiddette tecniche alternative nella loro reale prospettiva: si tratta di metodologie che sono a loro volta modelli di quanto accade in vivo, con tutte le limitazioni inerenti ai modelli. Se è vero che gli animali non sostituiscono l'uomo, a maggior ragione bisogna ammettere che queste tecniche alternative non possono sostituire né gli animali, né l'uomo. È più corretto, quindi, chiamarle tecniche ‛complementari': esse infatti, anche se sono state e continueranno a essere preziose per affrontare in dettaglio molti problemi biologici, in realtà non sono alternative. È chiaro che queste metodologie, peraltro scoperte e sviluppate dai ricercatori (e non dagli oppositori della sperimentazione animale!), vengono utilizzate in tutti i casi in cui sono utili per affrontare un determinato problema di ricerca (v. Comitato Nazionale per la Bioetica, 1992; v. Garattini, 1995).
Occorre dire che porre il problema in termini alternativi fra ricerca in vitro e ricerca in vivo, significa non avere esperienza di ricerca sperimentale; infatti, affrontare un problema con metodologia scientifica significa utilizzare - secondo una diversa cronologia in rapporto ai problemi che si studiano - tutte le tecniche disponibili; un problema può essere affrontato inizialmente con uno studio in vivo, quindi approfondito sui modelli in vitro, successivamente può esserne verificata la validità in vivo e così via. Nella storia di ogni risultato biomedico importante si può rintracciare questa sequenza di continue interazioni fra ricerche in vitro e in vivo, impiegando enzimi, cellule, organi, varie specie animali, prima di arrivare alla verifica definitiva che deve necessariamente avvenire nell'uomo. In altre parole, le vie da percorrere per risolvere un problema scientifico - soprattutto quando si lavori alla frontiera delle conoscenze - sono le più diverse e non possono essere predeterminate: sono i risultati che si ottengono quelli che suggeriscono il modo migliore per procedere; la scelta di utilizzare tecniche in vitro o in vivo dipende appunto da questi risultati e dalla via individuale - e perciò spesso creativa - che il ricercatore intende seguire. Intervenire attraverso leggi troppo limitative sulla creatività del ricercatore significa mortificare la fantasia dell'uomo e inserire dannosi ostacoli nell'iter delle conoscenze scientifiche che sono alla base delle scoperte utili alla salute.
Un esempio che si può presentare per illustrare come le tecniche in vitro e in vivo siano complementari e non alternative, ci è fornito dal problema di come si possa individuare quali tra le sostanze chimiche (pesticidi, erbicidi, detersivi, additivi alimentari, cosmetici, farmaci, ecc.) con le quali l'uomo viene a contatto possano avere potere cancerogeno. Fino a circa 15 anni fa, il metodo fondamentale era rappresentato dalla somministrazione della sostanza chimica in questione a topi o ratti, per tutta la vita durante due generazioni. Parallelamente, è stato osservato che molte sostanze cancerogene interagivano direttamente con il DNA e che questa era la causa della trasformazione neoplastica della cellula. Tale osservazione ha permesso di mettere a punto dei test in vitro, predittivi di effetto cancerogeno, che impiegano dei microrganismi. Ad esempio, nel cosiddetto ‛test di Ames', che impiega le salmonelle, l'eventuale interazione della sostanza chimica con il DNA del microrganismo determina una mutazione che rappresenta un possibile indice di cancerogenicità (v. Zeiger, 1987; v. trasformazione delle cellule). I primi dati ottenuti, come spesso capita, sembravano entusiasmanti, perché più del 90% delle sostanze cancerogene risultava positiva al test di Ames e quindi si era realmente indotti a pensare alla possibilità di disporre di un metodo alternativo. Tuttavia, col tempo le conclusioni diventarono meno ottimistiche, perché si osservò, ad esempio, che molte sostanze - tipico esempio, alcuni idrocarburi policiclici - non interagiscono direttamente con il DNA, ma hanno bisogno di essere trasformate in specie chimiche altamente reattive. Per risolvere questo problema si introdusse una variante al test di Ames, che consisteva nell'utilizzare dei sistemi che potevano metabolizzare le sostanze chimiche in esame; ciò tuttavia fu possibile solo impiegando dei ratti, il cui fegato poteva fornire i cosiddetti enzimi microsomiali epatici. Ecco quindi che la tecnica cosiddetta ‛alternativa' diveniva affidabile solo se si poteva integrare con l'impiego di animali da esperimento. Nonostante questo, i risultati non furono ancora soddisfacenti. Ad esempio, su 224 composti esaminati il test di Ames ha mostrato una ‛sensibilità' (percentuale di sostanze cancerogene identificate come mutagene) del 54% e una ‛specificità' (percentuale di sostanze non carcinogene identificate come non mutagene) del 70% (v. Hay, 1988). Altri autori (v., ad es., Tennant e altri, 1987) arrivarono a conclusioni ancor più negative: a loro avviso, il test di Ames poteva identificare solo il 45% delle sostanze cancerogene. Per migliorare la percentuale dei ‛falsi positivi' (sostanze cancerogene in vitro, ma non in vivo) si ritiene oggi indispensabile realizzare uno o più test in vivo, molto spesso sul topo.
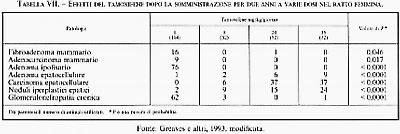
Molto più preoccupanti sono naturalmente i ‛falsi negativi' (sostanze non cancerogene in vitro, ma cancerogene in vivo) perché danno un senso di falsa sicurezza. La negatività di queste sostanze in vitro dipende spesso dal fatto che la loro cancerogenicità non dipende strettamente da una diretta interazione con il DNA, ma è legata a un'azione esercitata solo su un sesso o su un determinato organo (sono le cosiddette ‛sostanze cancerogene non genotossiche'). Ad esempio, il cloroformio e il dibromoclorometano non sono mutageni in vitro, ma sono cancerogeni negli animali da esperimento. La necessità di integrare sempre le ricerche in vitro con quelle in vivo risulta con chiarezza dall'analisi degli effetti tossici prodotti dal tamoxifene, un antagonista degli estrogeni largamente utilizzato nella donna per il trattamento del tumore della mammella e per la profilassi dello stesso tumore in soggetti ad alto rischio. Il tamoxifene, infatti, è risultato privo di attività mutagena in vitro in una serie di test, ritenuti predittivi per gli effetti in vivo, quali la mutagenesi di vari ceppi di salmonella e l'analisi di metafasi in leucociti umani. Tuttavia, uno studio condotto nel ratto, somministrando tamoxifene, per due anni ha dato risultati sorprendenti, riassunti nella tab. VII: questo farmaco, che protegge realmente dai tumori della mammella, induce tumori epatici in modo proporzionale alla dose applicata; risulta, inoltre, che il tamoxifene protegge dai tumori dell'ipofisi e dalla glomerulonefrite cronica (v. Greaves e altri, 1993). La consapevolezza di questa varietà di effetti in vivo, peraltro non osservabile nei test in vitro attualmente disponibili, pone ovviamente problemi all'impiego di questo farmaco nella donna.
Queste considerazioni, molto riassuntive, mostrano che in effetti i test in vitro possono essere estremamente utili per avere dei rapidi risultati su cui basare successive azioni. Ad esempio, se si hanno a disposizione parecchi composti con un certo effetto farmacologico, un test di Ames ci può indurre a continuare a studiare solo i composti non mutageni, eliminando quelli mutageni. Tuttavia, dati negativi ottenuti in vitro dovranno necessariamente essere seguiti da test di breve e di lunga durata in vivo, prima di pensare a un'esposizione cronica dell'uomo a un determinato composto. La disponibilità di test in vitro e in vivo permette quindi di sviluppare strategie diverse per la ricerca preclinica di un farmaco, ma non sostituisce in sede finale la necessità di disporre di test in vivo. Sono queste le conclusioni a cui giunge un autorevole e recente studio: ‟I test sugli animali, sfortunatamente, rimangono ancora la sola via sicura per ottenere informazioni sulla carcinogenicità. Ma opportuni test di breve durata possono diminuire il numero di animali da utilizzare, permettendo di identificare i più pericolosi carcinogeni genotossici" (v. Hay, 1988, p. 783).
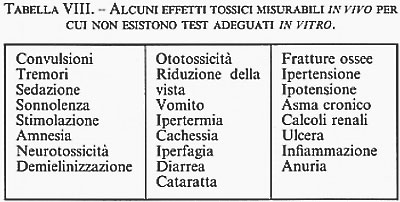
Abbiamo scelto - parlando di carcinogenesi - l'esempio più favorevole all'uso di test in vitro, ma per molti altri campi che riguardano la tossicità sulle funzioni riproduttive, immunologiche, cerebrali, la necessità di utilizzare animali è ancora più essenziale. Pur ammettendo che cellule coltivate in vitro possano dare un'indicazione sulla tossicità dei farmaci o di altre sostanze chimiche cui sono esposti gli uomini, gli animali o le piante, appare difficile eliminare la sperimentazione animale per una serie di effetti che richiedono una situazione molto più complessa che non quella di cellule che proliferino in contenitori di vetro o di plastica. La tab. VIII illustra una serie di effetti tossici misurabili solo in vivo e solo in alcune specie animali. La tab. IX, infine, riporta una lista parziale di condizioni relative alla riproduzione e allo sviluppo sulle quali allo stato attuale gli effetti dei farmaci possono essere studiati solo in vivo. Si tratta di effetti importanti, perché possono essere potenzialmente indotti da qualsiasi sostanza con cui l'uomo può venire in contatto, il che, fra l'altro, mette in evidenza l'impossibilità di porre limiti al numero di specie animali impiegate, se si vuole avere un panorama predittivo di ciò che può avvenire nell'uomo. È ovvio che quanto più le specie animali sono simili all'uomo, tanto più si avrà cura di utilizzarle solo per casi eccezionali e dopo approfondite ricerche per stabilirne l'indispensabilità. D'altra parte, c'è qualcuno che avrebbe il coraggio di esporre bambini, adulti e vecchi a sostanze chimiche che non siano mai state precedentemente somministrate ad animali da esperimento?
4. Gli animali impiegati nella sperimentazione
Contrariamente a ciò che molti pensano, gli animali utilizzati nella sperimentazione non vengono raccolti nell'ambiente, ma - salvo poche eccezioni - vengono allevati esclusivamente per la ricerca. Come già accennato, la stragrande maggioranza degli animali utilizzati nella ricerca biomedica è rappresentata da ratti e topi, per ragioni molto semplici: la loro rapida proliferazione, una vita media relativamente breve (circa 3 anni), un costo relativamente minore rispetto a quello di altre specie, uno spazio relativamente piccolo per il loro mantenimento. Tutto ciò permette di rispondere all'esigenza di sperimentare su gruppi di animali in numero sufficiente a raggiungere una significatività statistica, cosa spesso difficile se si impiegano animali di grande taglia.
Ratti e topi sono stati selezionati in modo tale da essere omogenei nella loro crescita e nelle loro caratteristiche. Si parla di animali outbred quando si impieghino ratti e topi che sono stati accoppiati senza tener conto della loro ‛parentela'; si parla di animali inbred per indicare animali accoppiati fra discendenti degli stessi genitori. Gli animali inbred possono essere considerati geneticamente uguali: essi permettono quindi di operare su gruppi che presentano una variabilità relativamente piccola nella espressione di parametri biochimici e funzionali.
Gli studi genetici hanno anche permesso di selezionare innumerevoli ceppi di animali portatori di malattie ereditarie, utilizzabili in tutte le specializzazioni della medicina. Sono ad esempio disponibili ceppi murini che manifestano vari tipi di convulsioni, di tremori, di rigidità, di distrofia muscolare; altri ceppi sono caratterizzati da anomalie della coagulazione o da vari difetti metabolici, incluso il diabete; altri ancora sono caratterizzati da danni renali che determinano una insufficienza funzionale, oppure da malattie molto simili a quelle dell'uomo, come il lupus.
È chiaro che questi ceppi rappresentano modelli particolarmente importanti in vista di almeno due risultati fondamentali: anzitutto capire quali sono i meccanismi che determinano queste situazioni morbose, in modo da poterli confrontare con i meccanismi noti per le stesse malattie dell'uomo; in secondo luogo, per sviluppare metodi preventivi o trattamenti terapeutici che impediscano lo sviluppo della malattia o che ne curino i sintomi quando si sia già manifestata.
L'identificazione di queste malattie negli animali è spesso stata casuale, ma attualmente si comincia a prospettare la possibilità di ‛costruire' modelli patologici a seconda delle necessità e delle problematiche poste dalla ricerca. È verosimile e auspicabile che questa possibilità apra nuove strade nell'ambito della sperimentazione animale.
a) Animali transgenici
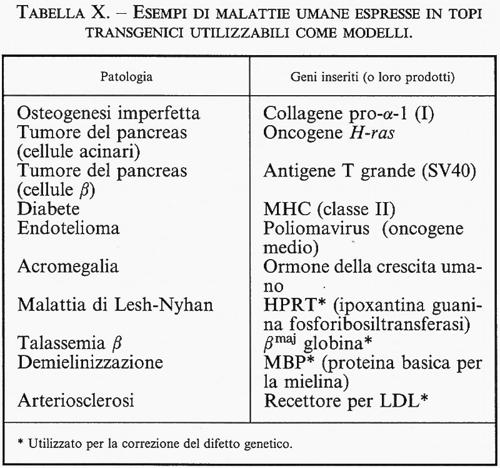
Negli ultimi dieci anni si è assistito a una vera e propria esplosione di tutta una serie di tecniche che permettono l'isolamento e la manipolazione del materiale genetico. Questo corpo di nuove tecnologie rappresenta, nel suo complesso, una porzione importante di quella branca della moderna biologia nota come biologia molecolare. Essa ha determinato una vera e propria rivoluzione in campo biomedico, permettendo l'isolamento e la caratterizzazione strutturale di oltre 150.000 (ma il numero è in continua espansione) geni o comunque strutture di DNA in grado di codificare per altrettante strutture proteiche di diverse specie animali. Tali sequenze di DNA sono tutte teoricamente e praticamente manipolabili in modo tale da alterarne la struttura o la capacità di esprimersi nei loro normali contesti cellulari. È ovvio che un avanzamento scientifico di tale importanza abbia avuto e continui ad avere riflessi anche nel campo della sperimentazione animale (v. Sambrook e altri, 1989). La biologia molecolare permette infatti di ‛creare' nuovi ceppi animali in grado di esprimere prodotti genici normalmente non sintetizzati nell'organismo, oppure di sintetizzare gli stessi in maniera specifica all'interno di distretti o tessuti altrimenti incapaci di produrre la proteina in questione. Animali di questo tipo sono noti come animali transgenici, in quanto portano, stabilmente integrato all'interno del loro normale complemento genomico, una o più copie di un determinato gene esogeno, il ‛transgene' per l'appunto. Questa tecnologia è attualmente applicabile in maniera routinaria solamente nel topo, anche se ormai esiste tutta una serie di dati relativi anche ad altre specie animali. L'animale transgenico permette la sovraespressione di geni potenzialmente utili al miglioramento delle caratteristiche di una determinata specie animale, ma permette anche di studiare in vivo, a livello dell'organismo intero, le conseguenze di una inappropriata espressione di qualsiasi tipo di gene. Al di là delle ovvie e future o futuribili applicazioni da un punto di vista zootecnico, è importante sottolineare il fatto che gli animali transgenici ci hanno permesso di sviluppare una serie di modelli sperimentali animali di patologie umane, una lista molto limitata e incompleta dei quali è presentata nella tab. X.
La tecnologia di base necessaria alla produzione di animali transgenici è relativamente semplice da un punto di vista concettuale (v. Hogan e altri, 1986). Sviluppare linee di animali transgenici non è comunque alla portata di qualsiasi laboratorio, in quanto richiede una strumentazione relativamente sofisticata ed elevata professionalità. In breve, topi femmina preventivamente sopraovulati attraverso trattamento ormonale vengono fatti accoppiare; dopo un intervallo di circa 12 ore, le uova fecondate vengono estratte dalle tube ovariche e nel loro pronucleo viene microiniettata, sotto controllo microscopico, una soluzione contenente una certa preparazione di DNA, cioè il transgene di interesse. Le uova fecondate così manipolate vengono reimpiantate all'interno dell'utero di una femmina recipiente resa pseudogravida con un adeguato trattamento ormonale. Le femmine recipienti, dopo una normale gravidanza della durata approssimativa di circa 20-22 giorni, daranno vita a una progenie composta da individui alcuni dei quali (non più del 10%) presenteranno il transgene integrato.
L'avvenuta integrazione del transgene verrà analizzata attraverso una tecnica standard, nota come Southern blot, applicata al DNA genomico isolato da una piccola quantità di cellule ottenute classicamente da una piccolissima porzione della coda dell'animale in esame. Verificata l'integrazione nel genoma, l'animale transgenico (il cosiddetto founder) verrà fatto accoppiare in modo da generare una progenie in grado di trasferire il transgene con frequenza mendeliana. La linea transgenica verrà successivamente stabilizzata attraverso adatti incroci. Il passaggio successivo è rappresentato dalla verifica dell'espressione del transgene attraverso la ricerca all'interno dei tessuti o degli organi inizialmente prescelti del prodotto da esso codificato (v. Hogan e altri, 1986). Con un po' di fortuna e in un laboratorio ben attrezzato sia in termini di apparecchiature che di conoscenze, esperimenti di questo tipo possono essere completati nell'ambito di 6-8 mesi, sebbene la tecnica abbia un'efficienza relativamente bassa. Infatti, come già detto, solo una piccola percentuale degli animali nati a seguito di un esperimento di microiniezione risulta effettivamente transgenica. Peraltro, l'avere a disposizione una linea di animali transgenici può risultare di estrema importanza per il ricercatore: si pensi alle possibilità che offre per lo studio di una malattia quale la sclerosi laterale amiotrofica un animale transgenico che ne ricapitoli alcuni degli aspetti essenziali, un animale, cioè, ottenuto per sovraespressione nel topo del gene codificante la superossidodismutasi (v. Gurney e altri, 1994); o, per lo studio dell'insulinoma del pancreas, un topo transgenico ottenuto per sovraespressione tessuto-specifica nel pancreas murino di uno dei geni costituenti il patrimonio genetico del virus SV40 (v. Hanahan, 1985). Modelli sperimentali di questo tipo rappresentano strumenti unici per lo studio dei meccanismi eziopatogenetici della malattia oltreché per lo sviluppo di strategie terapeutiche o di trattamenti farmacologici adeguati. Al di là delle malattie dismetaboliche e delle patologie da difetto monogenico, è ormai sempre più chiaro che la disregolazione di uno o più geni è alla base dello sviluppo o della progressione di tutta una serie di malattie anche comuni. Un esempio per tutti è rappresentato dai tumori: si conoscono oramai parecchie decine (forse centinaia) di geni che svolgono una importante funzione nella genesi e nello sviluppo di tumori di diverso tipo. Alcuni geni hanno funzione dannosa e sono alla base del processo neoplastico (oncogeni), altri hanno funzione protettiva (oncosoppressori). È facile, quindi, prevedere che ben presto avremo a disposizione una batteria di animali transgenici sovraesprimenti i vari oncogeni implicati nei diversi tipi di tumore e potremo quindi disporre nell'animale di modelli sperimentali delle varie neoplasie che ricapitolino più da vicino il processo neoplastico osservabile nell'uomo (v. anche biotecnologie, vol. X).
b) Topi knock-out
Le nuove possibilità aperte nel campo della sperimentazione animale dalla biologia molecolare non si limitano però alla creazione di ceppi di animali in grado di sovraesprimere transgeni. Tecnologie ancor più recenti ci permettono attualmente di eliminare in maniera assolutamente specifica praticamente ciascun tipo di gene dal complemento genomico di un topo, ottenendo così quelli che vengono definiti ‛topi knock-out'. Le potenzialità di questo tipo di tecnologia e l'impatto che ha già avuto negli ultimi 3-4 anni sono stati di grandissima portata e sono testimoniati dall'aumento veramente impressionante delle pubblicazioni scientifiche nelle quali si è fatto uso di animali knock-out, che rappresentano ormai il paradigma sperimentale necessario per definire la funzione di un determinato gene nell'ambito di un determinato processo fisiologico o patologico di interesse. Inoltre, l'animale knock-out rappresenta attualmente il sistema di elezione per la creazione di modelli sperimentali di patologia umana da difetto monogenico. Anche la creazione di questo tipo di animale, come già la creazione dell'animale transgenico, è relativamente semplice sul piano concettuale e prevede l'ablazione funzionale del gene di interesse. Peraltro, da un punto di vista tecnologico il processo necessario alla creazione del topo knock-out è complicato e prevede due distinte fasi, una in vitro e l'altra in vivo. La tecnica è attualmente utilizzabile soltanto a livello del topo, anche se si prevede che in futuro potrà essere utilizzata anche per altre specie animali. Esistono diversi articoli che descrivono i vantaggi e i limiti della metodica, oltre alle diverse fasi sperimentali necessarie per ottenere un animale knock-out. Ne citiamo una per tutte, dovuta alla penna dello scienziato che forse più di ogni altro (senza nulla togliere a quel manipolo di ricercatori che ha variamente partecipato alla messa a punto metodologica della tecnica) ha contribuito a dimostrare la fattibilità dell'approccio, Mario Capecchi (v., 1989), un biologo americano di chiare origini italiane. Il metodo per la creazione di un topo knock-out si basa sulla capacità di manipolare in vitro, utilizzando tecniche di ingegneria genetica, le cellule embrionali staminali (in inglese embryo-stem cells, ES). Si tratta di cellule in coltura primaria o linee cellulari parzialmente stabilizzate, ottenute dalla componente embrionale della blastocisti di topo, le quali hanno un potenziale differenziativo illimitato, potendo dar luogo a qualsiasi tipo di cellula osservabile nell'organismo murino. Le cellule ES possono crescere sotto forma di colture cellulari in vitro, essere manipolate geneticamente in questo contesto e, successivamente, reimpiantate in una blastocisti recipiente. A seguito di esperimenti di microiniezione di cellule ES nella blastocisti e di reimpianto della stessa in femmine pseudogravide è possibile ottenere una progenie di animali ‛chimera', in cui una o più componenti tissutali sono di derivazione dalle cellule ES stesse. In linea di massima, lo sviluppo di un topo knock-out prevede le seguenti fasi.
Fase in vitro. - 1) Crescita della coltura di cellule ES in vitro sotto forma di monostrato; 2) inattivazione di una singola copia del gene in esame attraverso ricombinazione omologa con un adeguato costrutto molecolare inserito all'interno della cellula mediante permeabilizzazione della stessa con una scarica elettrica (elettroporazione); 3) selezione del clone cellulare contenente ricombinazione omologa a livello del gene in esame, attraverso crescita in medium di coltura selettivo e analisi del DNA genomico; 4) crescita di massa del(i) clone(i) selezionato(i).
Fase in vivo. - 1) Microiniezione di una certa quantità di cellule provenienti dalla coltura di massa del clone cellulare prescelto all'interno di blastocisti recipienti ottenute da femmine gravide sopraovulate; 2) reimpianto delle blastocisti microiniettate nell'utero di femmine pseudogravide; 3) sviluppo di una progenie di animali chimerici i cui tessuti derivano in parte dalle cellule ES, e in parte dalle cellule costituenti la blastocisti recipiente. Gli animali chimerici sono facilmente riconoscibili in quanto hanno un colore di mantello ibrido tra quello del ceppo di animali da cui derivano le cellule ES e quello del ceppo da cui derivano le cellule originate dalle blastocisti recipienti (si usano infatti due ceppi di topi a colore di mantello diverso per derivare le blastocisti e le cellule ES); 4) verifica della presenza di una componente chimerica a livello delle cellule germinali (oogoni e spermatogoni) e conseguente verifica dell'inattivazione di uno dei due alleli del gene di interesse attraverso accoppiamento e nascita di una progenie eterozigote per il difetto genico stesso; 5) accoppiamento fra due animali eterozigoti per l'inattivazione del gene di interesse e sviluppo di una progenie omozigote per il difetto.
I principali problemi e ostacoli nella creazione di topi knock-out sono rappresentati dalle caratteristiche del gene in esame e dalla possibilità di ottenere una trasmissione verticale (chimerismo a livello delle cellule germinali degli animali mosaico derivati dalla blastocisti microiniettata) del gene inattivato. Per quanto riguarda il primo problema, esso è funzione dell'importanza biologica del gene in esame ed è di estrema rilevanza quando lo scopo primario dello sviluppo di un animale knock-out sia quello di investigare le peculiarità fisiologiche o fisiopatologiche di un determinato gene. Tanto più il gene che si vuole inattivare per studiarne la funzione a livello organismico è importante, tanto più la sua inattivazione determinerà un fenotipo letale (morte intrauterina, aborto, morte alla nascita); quanto più il gene agisce precocemente durante le fasi di sviluppo dell'embrione, tanto più la morte dell'embrione stesso sarà precoce e tanto più sarà difficile studiare la caratteristica fisiologica del gene in esame. All'estremo opposto, è possibile che il gene in esame sia ridondante e di conseguenza la sua inattivazione non porterà ad alcun fenotipo osservabile, il che, fortunatamente o sfortunatamente, sembra essere vero per un non trascurabile numero di geni. Anche nel caso di un gene ridondante, l'approccio dei topi knock-out potrà comunque essere utile al fine di sviluppare conoscenze più approfondite sulla funzione del gene stesso in un contesto organismico. Il secondo problema cui si accennava più sopra è rappresentato dalla trasmissione verticale del tratto ‛inattivazione genica': trattandosi di un problema unicamente di carattere tecnico, che peraltro può rallentare fortemente il processo di produzione di un animale knock-out, sarà qui sufficiente ricordare che la trasmissione verticale è sostanzialmente funzione della qualità delle cellule ES cui si ha accesso.
Al di là dei limiti intrinseci della metodologia, più sopra ricordati, l'approccio sperimentale dei topi knock-out ha permesso di stabilire la funzione a livello organismico di una serie di geni clonati la cui attività fisiologica sarebbe altrimenti ancora ignota. Con questo tipo di approccio si è, ad esempio, potuto determinare l'importanza della proteina CREBP (cAMP-Responsive Element-Binding Protein) nei processi di apprendimento e di memoria a lungo termine (v. Bourtchuladze e altri, 1994). Data la crescita esponenziale dei ricercatori interessati allo sviluppo di animali knock-out e in considerazione anche del fatto che la tecnica può essere riprodotta in molti laboratori, si ritiene che in un futuro forse non troppo lontano avremo a disposizione una collezione di animali knock-out e di modelli sperimentali animali per tutte le malattie a difetto monogenico note nell'uomo, con prevedibili vantaggi - dal punto di vista sia delle conoscenze di base, sia delle applicazioni in termini di terapia sperimentale - che è superfluo sottolineare.
5. Le leggi sulla sperimentazione animale
Il decreto legislativo n. 116 del 27 gennaio 1992, pubblicato sulla Gazzetta Ufficiale del 18 febbraio 1992, n. 33 (suppl. n. 40), pp. 5-25, riguarda l'attuazione della direttiva n. 86/609/CEE in materia di protezione degli animali utilizzati a fini sperimentali o ad altri fini scientifici. Si deve osservare che la legge italiana è particolarmente restrittiva rispetto a leggi esistenti in altri paesi - si veda, ad esempio, la legge francese - anche in considerazione del fatto che la nostra amministrazione pubblica non è particolarmente efficiente nei suoi adempimenti. Ciò è naturalmente in contrasto con le necessità della ricerca, che richiedono invece tempi particolarmente rapidi e tempestività di intervento.
Un rapido riassunto della legge sulla sperimentazione animale non può che iniziare con la definizione che viene data della sperimentazione stessa: ‟esperimento: l'impiego di un animale a fini sperimentali o ad altri fini scientifici che può causare dolore, sofferenza, angoscia o danni temporanei o durevoli, compresa qualsiasi azione che intenda o possa determinare la nascita di un animale in queste condizioni, ma esclusi i metodi meno dolorosi di uccisione o marcatura di un animale comunemente accettati come umanitari; un esperimento comincia quando un animale è preparato per la prima volta ai fini dell'esperimento e termina quando non occorrano ulteriori osservazioni per l'esperimento in corso; l'eliminazione del dolore, della sofferenza, dell'angoscia o dei danni durevoli, grazie alla corretta applicazione di un anestetico, di un analgesico o di altri metodi, non pone l'utilizzazione di un animale al di fuori dell'ambito di questa definizione. Sono escluse le pratiche agricole o cliniche veterinarie non sperimentali."
L'art. 1 indica il fine della nuova legge, mentre l'art. 2 precisa il significato dei termini utilizzati nel testo della legge stessa.
L'art. 3 richiama le leggi precedentemente in vigore (n. 924, 12 giugno 1931, modificata dalla n. 615, 1 maggio 1941) e specifica le finalità per cui è consentita la sperimentazione animale: lo sviluppo, la produzione e le prove di qualità, di efficacia e di innocuità dei preparati farmaceutici, alimentari o diagnostici; la valutazione, il controllo o le modificazioni delle condizioni fisiologiche; la protezione dell'ambiente naturale nell'interesse dell'uomo e degli animali; la ricerca di base, cioè propedeutica alle finalità autorizzate. La lista degli animali autorizzati è riportata nell'allegato I, mentre si dichiara che è proibita la sperimentazione sugli animali appartenenti a specie in estinzione (legge n. 874, 19 dicembre 1975).
L'art. 4 indica quando si deve ricorrere alla sperimentazione animale e con quali modalità generali; il minor numero possibile di animali, quello a più basso sviluppo neurologico, gli esperimenti che causano meno dolore o danni durevoli.
L'affermazione che ‟fra più esperimenti debbano preferirsi quelli che offrono maggior probabilità di risultati soddisfacenti" è un insulto al buon senso. Se qualcuno conosce in anticipo i risultati che può ottenere non fa l'esperimento. C'è qualcuno che fa esperimenti per ottenere risultati insoddisfacenti?
Questo articolo stabilisce inoltre che tutti gli esperimenti devono essere effettuati sotto anestesia generale e locale: una dizione ambigua, perché per molti esperimenti l'anestesia non è necessaria e potrebbe essere dannosa per l'animale. Si definisce anche il tipo di laurea necessario per la sperimentazione animale e si ribadisce la necessità di una adeguata formazione specifica.
In altri articoli si definiscono le condizioni da utilizzare per la stabulazione degli animali (art. 5 e, per i dettagli, allegato II), la necessità che sia disponibile per controllo e per consultazione un medico veterinario (art. 6), mentre l'art. 7 dà le prescrizioni per la presentazione delle domande di autorizzazione che devono essere corredate dei progetti di ricerca che si intendono realizzare.
Gli artt. 9 e 10 si riferiscono alle situazioni in cui si possono ottenere deroghe rispetto alle prescrizioni dell'art. 3; tali deroghe possono essere autorizzate solo dal ministro della Sanità.
Negli altri articoli si differenziano gli ‟stabilimenti fornitori", cioè le organizzazioni che provvedono all'allevamento degli animali per la sperimentazione (artt. 10 e 11) dagli ‟stabilimenti utilizzatori", cioè i laboratori in cui si effettuano le ricerche (artt. 12 e 13). In particolare, si prevede che per i due tipi di stabilimenti vi siano registri specifici obbligatori che possono essere ispezionati dalle autorità competenti.
Le sanzioni pecuniarie sono evidenziate nell'art. 14 e sono particolarmente significative, potendo arrivare, salvo che i fatti non costituiscano reati, fino alla cifra di 150 milioni di lire. Finalmente, gli artt. 15-20 riguardano una serie di norme, alcune transitorie, altre che includono l'obbligo di una relazione che contenga dati statistici circa l'impiego degli animali.
Alla legge per la sperimentazione animale è seguita un'altra legge (n. 413, 12 ottobre 1993) che riguarda le ‟norme sull'obiezione di coscienza alla sperimentazione animale". Questa legge riguarda non soltanto i ricercatori, ma anche coloro che indirettamente hanno a che fare con la sperimentazione animale: stabularisti, segretarie e tecnici. Il datore di lavoro, sia esso pubblico o privato, di fronte all'obiezione di coscienza deve assicurare all'obiettore un altro lavoro che non implichi l'uso degli animali e deve garantirgli una carriera. Anche lo studente può obiettare e anche in questo caso il professore deve effettuare insegnamenti ‛alternativi', cosicché può accadere che uno studente in veterinaria si rifiuti di imparare a operare chirurgicamente sugli animali, ma possa avere egualmente la laurea in medicina veterinaria.
Si tratta chiaramente di una legge che non ha alcuna base logica: essa porta a considerare la sperimentazione animale come contraria ai principî morali e probabilmente serve solo ad accontentare ali estreme dei movimenti animalisti. In realtà, l'obiezione di coscienza dovrebbe essere possibile per tutte le attività obbligatorie, mentre appare ridicola quando venga applicata ad attività che sono assolutamente facoltative e anzi scelte su base volontaria.
Il diritto all'obiezione per la sperimentazione non è accompagnato da alcuna prescrizione circa i doveri da adempiere in alternativa; pertanto, si presta a essere utilizzato per altri scopi, come mascherare un contrasto di vedute con i superiori o il rifiuto di svolgere un lavoro gravoso, come può essere quello di occuparsi degli animali nello stabulario, solo per desiderio di un lavoro più leggero.
Chi fa obiezione di coscienza alla leva militare non deve avere il porto d'armi, non deve essere cacciatore e non deve avere riportato condanne per violenza. Per analogia, chi obietta alla sperimentazione animale dovrebbe essere vegetariano, non dovrebbe portare scarpe di pelle, non dovrebbe tenere in casa animali in spazi ristretti, non dovrebbe avere avuto condanne per maltrattamenti ad animali, non dovrebbe fare il chirurgo e addirittura dovrebbe rinunciare a usare farmaci e a farsi ricoverare in ospedale, visto che tutti i vantaggi che può offrire la medicina moderna sono passati direttamente o indirettamente attraverso l'impiego di animali.
È incredibile che una tale legge sulla sperimentazione animale possa coesistere con altre leggi che la rendono obbligatoria per stabilire la eventuale presenza di sostanze tossiche negli alimenti, nell'aria o nel suolo o per determinare se nuovi farmaci esercitino effetti tossici o cancerogeni o sulla riproduzione prima di poter essere utilizzati nell'uomo. Infatti, per quanto la sperimentazione animale rappresenti oggi solo una piccola parte di tutta la ricerca biomedica, essa è ancora indispensabile per il progresso delle conoscenze e per dare risposte alle tante malattie che ancora affliggono l'umanità.
6. Prospettive future
È difficile immaginare oggi una ricerca biomedica sganciata dalla sperimentazione animale, che certamente continuerà anche in futuro a svolgere un ruolo di primaria importanza per il progresso delle conoscenze e permetterà di scoprire nuove terapie. D'altra parte in tutti i paesi occidentali, accanto alle leggi che disciplinano la sperimentazione animale, esistono leggi altrettanto severe che impongono una serie sempre crescente di studi su animali prima di poter iniziare qualsiasi sperimentazione sull'uomo. L'uso degli animali è inoltre richiesto per valutare l'eventuale tossicità di qualsiasi sostanza chimica che venga a contatto con l'uomo e con l'ambiente. Queste norme continueranno a rimanere in vigore anche in futuro, visto che non esistono, come si è finora dimostrato, tecniche alternative, ma solo complementari.
In prospettiva è quindi difficile immaginare una ulteriore contrazione del numero di animali impiegati, ma certamente si assisterà allo sviluppo di una serie di strategie per evitare - quando sia fattibile - che l'impiego degli animali sia necessariamente il primo passo dell'approccio sperimentale. Già attualmente, infatti, è possibile - attraverso le tecniche in vitro disponibili - fare una prima selezione, eliminando da successive indagini quei composti che abbiano dimostrato una forte tossicità. L'impiego della statistica e di tecniche analitiche più sofisticate dovrebbe permettere di programmare meglio l'uso di animali, limitandolo allo stretto necessario.
Aumenteranno certamente i controlli per quanto riguarda le condizioni di stabulazione degli animali. Già oggi, come abbiamo visto, esistono nella nostra legislazione disposizioni molto severe riguardanti gli ambienti, gli spazi, l'alimentazione, l'uso dell'anestesia, ecc. In questo senso è necessario che si sviluppi una cultura adeguata, anzitutto fra i ricercatori, ma anche fra coloro che dovranno sorvegliare l'applicazione della legge e - auspicabilmente - fra gli stessi oppositori della sperimentazione animale che riusciranno a essere tanto più efficaci nella loro critica quanto più saranno in grado di argomentare con solide basi conoscitive.
Molto più problematica e potenzialmente pericolosa è invece la tendenza a voler controllare la validità della ricerca attuata attraverso la sperimentazione. È infatti difficile - anche da parte degli esperti - stabilire a priori quale possa essere il risultato di una ricerca: solo a posteriori è possibile dare un giudizio. Molti dei progressi più significativi sono nati andando controcorrente, seguendo, cioè, ipotesi che erano considerate erronee nella cultura predominante; ciò è tanto più vero quanto più si lavora ai confini della conoscenza. Basti pensare al problema del trapianto di organi: i ricercatori che, all'inizio della messa a punto di questa tecnica, lavoravano nel settore erano considerati dei visionari e nessun comitato per la sperimentazione animale avrebbe ritenuto giustificato l'impiego di centinaia di cani per arrivare a trapiantare con successo un rene. Eppure senza queste ricerche il trapianto di rene e di molti altri organi non sarebbe diventato pratica corrente e non avrebbe rappresentato per centinaia di migliaia di pazienti la differenza fra la morte e la vita. Occorre riflettere su questi aspetti, non per allentare i controlli, ma per evitare di impedire ricerche che possono essere rivoluzionarie per la salute di molti pazienti.
È certamente necessario far sì che le condizioni della sperimentazione animale siano sempre meno invasive e meno dolorose, ma non bisogna per questo dimenticare la sofferenza degli ammalati che attendono nuovi rimedi.
In conclusione, indicare all'opinione pubblica l'abolizione della sperimentazione animale come obiettivo da raggiungere significa assumersi gravi responsabilità che non trovano riscontro nelle attuali conoscenze scientifiche. Impiegare argomenti (pseudo)scientifici a sostegno delle tesi abolizionistiche significa asservire nozioni mal digerite a una ideologia precostituita e mostrare una notevole ignoranza delle modalità con cui procede il progresso scientifico.
Impedire o anche solo rendere difficile attraverso eccessivi intralci burocratici la sperimentazione animale significa esporre la popolazione a possibili e inutili rischi tossicologici, e rallentare o vanificare lo sforzo dei ricercatori per trovare rimedi alle numerose malattie che ancora rimangono senza terapie soddisfacenti.
All'emotività suscitata dalle campagne degli abolizionisti occorre opporre una serena informazione che tutti, ricercatori e medici, hanno il dovere di divulgare con maggiore intensità e spirito di servizio rispetto a quanto non si è fatto finora.
BIBLIOGRAFIA
Balls, M., Recent progress toward reducing the use of animal experimentation in biomedical research, in The importance of animal experimentation for safety and biomedical research (a cura di S. Garattini e D. W. van Bekkum), Dordrecht 1990, pp. 223-235.
Bourtchuladze, R., Frenguelli, B., Blendy, J., Cioffi, D., Schutz, G., Silva, A. J., Deficient long-term memory in mice with a targeted mutation of the cAMP-responsive element-binding protein, in ‟Cell", 1994, LXXIX, pp. 59-68.
Capecchi, M. R., The new mouse genetics: altering the genome by gene targeting, in ‟Trends in genetics", 1989, V, pp. 70-76.
Comitato Nazionale per la Bioetica, La sperimentazione dei farmaci, Roma 1992.
Garattini, S., In vitro and in vivo: alternative or complementary techniques?, in World congress on alternatives and animal use in the life sciences: education, research, testing (a cura di A. M. Goldberg e L. F. M. van Zutphen), New York 1995, pp. 727-735.
Garattini, S., van Bekkum, D. W. (a cura di), The importance of animal experimentation for safety and biomedical research, Dordrecht 1990.
Greaves, P., Goonetilleke, R., Nunn, G., Topham, J., Orton, T., Two-year carcinogenicity study of tamoxifen in Alderley Park Wistar-derived rats, in ‟Cancer research", 1993, LIII, pp. 3919-3924.
Gurney, M. E., Pu, H., Chiou, A. Y., Motor neuron degeneration in mice that express a human Cu, Ln, superoxide dismutase mutation, in ‟Science", 1994, CCLXIV, pp. 1772-1775.
Hanahan, O., Heritable formation of pancreatic beta-cell humans in transgenic mice expressing recombinant insulin/Simian virus 40 oncogenes, in ‟Nature", 1985, CCCXV, pp. 115-122.
Hay, A., How to identify a carcinogen, in ‟Nature", 1988, CCCXXXII, pp. 782-783.
Hogan, B., Costantini, F., Lacy, E., Manipulating the mouse embryo. A laboratory manual, Cold Spring Harbor, N. Y., 1986.
Leader, R. W., Stark, D., The importance of animals in biomedical research, in ‟Perspectives in biology and medicine", 1987, XXX, 4, pp. 470-485.
Lohnes, D., Kastner, P., Dierich, A., Mark, M., LeMeur, M., Chambon, P., Function of retinoic acid receptor gamma in the mouse, in ‟Cell", 1993, LXXIII, pp. 643-658.
Orlans, F. B., Simmonds, R. C., Dodds, W. J., Effective animal care and use committees, in ‟Laboratory animal science", 1987, n. speciale.
Paton, W., Man and mouse. Animals in medical research, New York 1984, 19932 (tr. it.: L'uomo ed il topo. Gli animali nella ricerca biomedica, Padova 1987).
Sambrook, J., Fritsch, E. F., Maniatis, T., Molecular cloning. A laboratory manual, Cold Spring Harbor, N. Y., 1989.
Sechzer, J. A. (a cura di), The role of animals in biomedical research, in ‟Annals of the New York Academy of Sciences", 1983, CDVI.
Tennant, R. W., Margolin, B. H., Shelby, M. D., Zeiger, E., Haseman, J. K., Spalding, J., Caspary, W., Resnick, M., Stasiewicz, S., Anderson, B., Minor, R., Prediction of chemical carcinogenicity in rodents from in vitro genetic toxicity assays, in ‟Science", 1987, CCXXXVI, pp. 933-941.
U. S. Department of Agriculture - Animal and Plant Health Inspection Service, Animal welfare enforcement, Washington 1992.
Weisbroth, S. H., Flatt, R. E., Kraus, A. L. (a cura di), The biology of the laboratory rabbit, New York 1974.
Zeiger, E., Carcinogenicity of mutagens: predictive capability of the Salmonella mutagenesis assay for rodent carcinogenicity, in ‟Cancer research", 1987, XLVII, pp. 1287-1296.