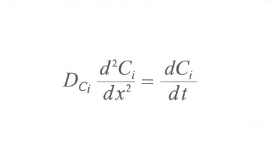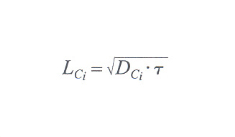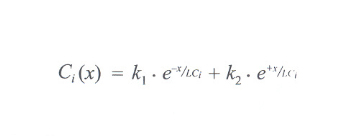Fegato
Fegato
Il fegato è il più grande organo ghiandolare dei Vertebrati. Nell'uomo è disposto trasversalmente nella parte superiore dell'addome, ha colorito rosso bruno, forma ovoidale, peso di circa 1500 g (nell'adulto di sesso maschile). Svolge molteplici funzioni indispensabili alla vita: produce la bile; determina importanti modificazioni metaboliche, intervenendo nel metabolismo di grassi, zuccheri e proteine, e nel ricambio di molti ormoni; sintetizza alcune proteine del plasma sanguigno.
Evoluzione ed embriologia
di Daniela Caporossi
1.
Filogenesi
Il fegato svolge molteplici funzioni; dal momento, però, che la sua comparsa è in rapporto con la progressiva specializzazione di un tratto della parete dell'intestino medio, possiamo supporre che il suo ruolo originario fosse correlato con la digestione, come ghiandola tributaria dell'intestino, e che abbia assunto solo successivamente funzioni di regolazione ematica e metabolica. Sebbene cellule o ghiandole digestive siano associate all'epitelio intestinale di molti Invertebrati, si può parlare di fegato e di secreto epatico solo nei Vertebrati, nei quali si delinea la presenza di una struttura di tipo ghiandolare in parte definita. Già nell'anfiosso si osserva una struttura sacciforme, il cieco epatico, deputata alla secrezione di enzimi e all'assorbimento di materiale; pur essendo collegata al sistema venoso portale, essa non possiede, tuttavia, il dominio della regolazione metabolica. Nei Vertebrati superiori, invece, il fegato, collegandosi al sistema portale e alla ghiandola pancreatica, diviene la sede del controllo del metabolismo intermedio di zuccheri, proteine e lipidi. Nella lampreda (Ciclostomi), il fegato si presenta ancora come un'estroflessione entodermica cava, mentre negli altri Vertebrati l'abbozzo epatico è composto di cordoni compatti che proliferano per formare il parenchima epatico.
Il fegato raggiunge uno sviluppo ponderale notevole in tutti gli organismi, ma il numero e la disposizione dei lobi di cui è costituito, così come la sua forma generale, variano a seconda delle specie. Generalmente è bilobato e con il lobo destro più grande del sinistro. Tuttavia, i serpenti e altri animali con morfologia simile presentano un fegato indiviso a forma allungata. Negli Uccelli, il parenchima epatico mostra una conduzione reticolare, mentre nei Mammiferi esso assume la tipica suddivisione in lobuli. Canalicoli biliari e un piccolo dotto epatico si riscontrano già nella lampreda, dove manca invece la colecisti, presente nella maggior parte degli altri Vertebrati, con alcune eccezioni riscontrabili sia tra gli Uccelli sia tra i Mammiferi. L'assenza della vescichetta biliare è spesso compensata dalla presenza di molteplici dotti biliari che si aprono indipendentemente nell'intestino tenue: per es., nel piccione manca la colecisti, ma vi sono due dotti epatici, in altre specie di Uccelli uno dei due dotti epatici è collegato al dotto cistico proveniente dalla colecisti.
2.
Ontogenesi
L'abbozzo epatico si rende evidente come diverticolo dell'entoderma intestinale molto precocemente durante lo sviluppo fetale (18° giorno) e già al 25° giorno di gestazione può essere identificato appunto come un diverticolo entodermico, che si proietta ventralmente e cranialmente all'interno del mesoderma del setto trasverso. La porzione entodermica darà successivamente origine al parenchima epatico e all'epitelio dell'apparato biliare. Le cellule mesenchimali si organizzano in vescicole, denominate isolotti sanguigni, le cui cellule si differenzieranno in tessuto ematopoietico, cellule di Kupffer ed elementi endoteliali di rivestimento. Il diverticolo epatico si accresce rapidamente e si divide in due porzioni: una grande anteriore, da cui deriverà il fegato, e una più piccola posteriore, dalla cui espansione si originerà la colecisti. Il peduncolo che tiene unite le due porzioni si trasformerà nel dotto cistico, mentre il prolungamento del peduncolo che tiene uniti il dotto epatico con quello cistico diverrà il dotto biliare comune, o coledoco. Il fegato aumenta di dimensione velocemente, andando a riempire buona parte della cavità addominale. Inizialmente equivalenti, ben presto i due lobi si differenziano: il lobo destro più grande di quello sinistro darà origine al lobo caudato e al lobo quadrato. Durante la 6ª settimana di gestazione ha inizio l'emopoiesi, che rappresenta la funzione principale del fegato durante la vita fetale; tra il 3° e il 4° mese di vita intrauterina inizieranno la glicogenesi e la formazione e secrezione della bile. Alla nascita sono abbastanza comuni leggere variazioni non patologiche nella forma dei lobi epatici.
Aspetti anatomofunzionali e patologici
di Nicola Dioguardi
1.
Anatomia microscopica e funzional-strutturale
Nella trattazione che presentiamo qui di seguito verranno presi in esame soltanto alcuni aspetti riguardanti l'anatomia microscopica dell'organo, che rivestono notevole importanza per la comprensione della sua fisiologia.
Il tessuto proprio del fegato, detto anche parenchima epatico, è formato dagli epatociti, cellule epiteliali tipiche dell'organo, fornite di uno o due voluminosi nuclei, di un citoplasma ricco di organuli (un abbondante reticolo endoplasmatico liscio e rugoso, un apparato del Golgi particolarmente ricco attorno al canalicolo biliare, numerosi mitocondri) e di un plasmalemma (membrana plasmatica pericellulare) polimorfo. Gli epatociti hanno la forma di poliedro a numero variabile di facce. La faccia basolaterale è fornita di numerosi villi che aumentano di circa sei volte la superficie; ha la duplice funzione di intrusore di materia da elaborare e di estrusore di materia elaborata. La faccia apicale, che corrisponde al polo biliare, è fornita di un'introflessione increspata da numerosi villi sottili, che concorre con due o più introflessioni delle cellule limitrofe alla formazione del canalicolo biliare.
Gli epatociti sono saldati l'uno all'altro dalle tight-junctions ("giunzioni intercellulari serrate"), che uniscono due cellule epatiche contigue e separano il canalicolo biliare dallo spazio di Disse (spazio compreso fra l'epatocito e il sinusoide, capillare sanguigno modificato), e sono sistemati in strutture di forma laminare (laminae hepatis) immerse nella rete dei sinusoidi. Le laminae con le loro biforcazioni e il loro congiungimento (anastomosi) formano il muralium hepatis, organizzato in modo da convergere verso i rami delle vene epatiche di scarico. Le cellule del muralium che circondano gli spazi portali formano le laminae limitantes, termine indicativo del loro compito di segnare il confine tra le strutture portali e quelle parenchimali. Nelle sezioni istologiche, le filiere di cellule che convergono verso la vena centrale (denominate trabecole di Remack) danno luogo alla struttura chiamata lobulo.
La tettonica epatica a scala microscopica, collegabile con il decorso del flusso del sangue che attraversa il fegato, ha messo in evidenza due tipi di microstrutture cellulari: il lobulo di Kiernan e l'acino di Rappaport. Il lobulo, descritto per la prima volta nel 1833 da F. Kiernan, ha forma di ovoide poligonale costituito da epatociti raggruppati attorno a una venula epatica centrale di scarico. Più di un secolo e mezzo prima di Kiernan, M. Malpighi, nel De viscerum structura exercitatio anatomica, aveva già parlato di questa componente del fegato, senza fornirne però un disegno e limitandosi a dare una meticolosa descrizione scritta di 'corpuscoli', la cui forma, poi confermata dai disegni di Kiernan, ricorda due emiparaboloidi coincidenti. Malpighi chiamò 'lobuli a struttura acinosa' i suoi corpuscoli per sottolinearne la coronatura 'glandolare'. L'acino si configura invece nel tratto di muralium che si trova dalle due parti della rete di vasellini portali, venosi e arteriosi, tra due tratti portali. Questa disposizione conferisce all'acino la caratteristica forma a diamante. Durante l'attraversamento dell'acino, la progressiva denaturazione di ossigeno e il cambiamento delle altre caratteristiche del sangue, dipendente dalla cattura delle molecole in esso contenute a opera dalle cellule epatiche, determinano il formarsi di tre zone funzionali: la prima, particolarmente implicata nel metabolismo ossidativo e nei processi di fosforilazione a esso collegati, è detta zona portale o zona 1; la terza è la zona centrolobulare, chiamata anche zona 3, sede dei processi glicolitici e del metabolismo dei farmaci; la zona medioacinale, o zona 2, presenta caratteristiche intermedie. L'acino è considerato la più piccola unità epatica ripetitiva codificata dalla comunità scientifica, capace di svolgere l'intera attività funzionale.
Parti ripetitive del fegato di volume minore dell'acino e del lobulo, contenenti porzioni più piccole di funzione epatica complessiva analoghe al nefrone, nel rene, o al neurone nel sistema nervoso, non sono state identificate. H. David, nel 1987, e D. Smedsrod, nel 1990, hanno potuto stabilire che gli epatociti rappresentano il 70%, le cellule sinusoidali il 20-22%, le cellule macrofagiche di Kupffer il 5-7% e le cellule di Ito il 2-3% delle cellule del tessuto epatico. L'epatocito, elemento centrale del metabolismo epatico, secondo questi dati, utilizza per la sua parte di funzione nell'ambito di quella complessiva del fegato 1/18 di cellula di Ito, 1/9 di cellula macrofagica di Kupffer, 1/3 di cellula sinusoidale. Con questi elementi è stato costruito un ente la cui struttura è fornita di un core, l'epatocito, che si completa con le parti delle tre cellule (satelliti) mesenchimali a esso pertinenti. Tale ente, che contiene la più piccola e indivisibile porzione potenziale della funzione globale dell'intero fegato, è stato denotato con il termine di epatone. Le quattro cellule che formano questa struttura topologica sono fornite, infatti, di genomi che possono essere eccitati per svolgere attività pertinenti a qualsiasi funzione dell'organo in qualunque posizione si trovino. Malattie che alterino i rapporti numerici che fissano le relazioni tra le quattro cellule si riflettono nella funzione complessiva del fegato.
Lo studio dell'anatomia funzional-strutturale del fegato inizia con J. Cantlie, il quale per primo si dedicò alla ricerca sulla tettonica, vale a dire sulla dislocazione delle componenti che formano l'architettura dell'organo strutturata in modo tale da poter assolvere al meglio le proprie attività funzionali. Basandosi sull'esame della distribuzione del tratto portale e dei vasi sanguigni che entrano nel fegato con questa struttura, Cantlie divide la massa epatica in due emifegati (non in due lobi), separati da un piano ideale (linea di Cantlie) percorrente la scissura in cui giacciono la vena epatica mediana e la fossa colecistica. I due emifegati di Cantlie sono concepiti come strutture incentrate sulle due vene epatiche destra e sinistra con l'interrelazione della grande vena mediana giacente nella scissura portale principale di Cantlie: come dire che le due strutture sono basate sulla funzione di arrivo e di scarico del sangue che affluisce all'organo. T. That Tung, A.H. McIndoe e V.S. Counseller e, più recentemente, C. Couianaud, hanno proposto la distinzione di due emifegati - destro e sinistro - in funzione della loro dipendenza dai due rami destro e sinistro del tratto portale, contenenti i grandi canali vascolari di input afferenti sangue in entrata e le strutture canalari in uscita delle vie biliari. I due rami destro e sinistro del tratto portale si biforcano ulteriormente dopo un breve tragitto e generano ciascuno due rami, uno mediano e uno laterale. L'intero organo risulta così suddiviso in quattro settori, due per ogni emifegato, rispettivamente irrorati dal ramo portale laterale sinistro, dal ramo mediano sinistro, dal ramo mediano destro e dal ramo laterale destro.
Il sistema vascolare in input (sistema portale) e il sistema vascolare in output (sistema delle vene epatiche) restano separati, anche se si intersecano come le dita di due mani. Nel suo percorso intraepatico, la diramazione portale laterale sinistra non si biforca. Le altre tre (mediana sinistra, mediana destra e laterale destra) si dividono ognuna in altre due diramazioni. Il fegato risulta così formato da un insieme di otto segmenti, indicati con i numeri romani da I a VIII. Sette di questi (dal II all'VIII) sono singolarmente dipendenti da una delle ultime diramazioni del tratto portale, mentre il I segmento è costituito dal lobo caudato di Spigelio che ha una vascolarizzazione indipendente: quella in input affluente direttamente dai due rami principali del tronco portale, quella in output defluente direttamente nella vena cava inferiore. L'indipendenza vascolare ha fatto definire il lobo caudato 'terzo fegato'. Questo segmento solitamente è escluso dalle grandi sindromi trombotiche massive del sistema venoso epatico. In tali casi esso supporta tutta la circolazione del restante fegato bloccata dalla trombosi; ciò spiega l'enorme ipertrofia cui l'organo va incontro nei casi di sindrome di Budd-Chiari, di malattie venoocclusive, di trombosi portale intraepatica.
2.
Fisiologia
Dopo la vita perinatale e durante quella adulta il fegato sintetizza materia per automantenere le proprie strutture, scambia molecole con il sangue che lo attraversa e produce bile. Questo insieme di funzioni ha tre finalità: mantenere le caratteristiche fisico-chimiche dei fluidi extracellulari (sangue e linfa); rifornire l'organismo di materia utile alla sua omeostasi; inattivare ed eliminare sostanze tossiche che pervengono al fegato dall'intestino e dall'organismo. Questo comportamento è tipico di quei sistemi che vengono definiti aperti, perché ricevono nel loro ambito dall'ambiente esterno (in input) materia, energia e informazione e dismettono queste componenti dopo averle elaborate. Fatta questa premessa, è possibile ordinare la successione degli accadimenti della funzione epatica complessiva in tre fasi.
1) La fase di input consiste nell'arrivo, all'interno dell'organo, di materia grezza inorganica (sali minerali) e organica (molecole di natura glucidica, lipidica, protidica e vitaminica), nonché di informazioni consistenti nei segnali veicolati da ormoni e da sostanze attive secrete dalle cellule intestinali con funzione endocrina; informazioni provenienti da stimoli nervosi sono invece trasmesse dalle fibre colinergiche e adrenergiche del sistema autonomo parasimpatico e simpatico. Definiremo intrusore l'insieme, costituito dalla vena porta, dall'arteria epatica e dai tronchi del sistema nervoso autonomo, che trasporta l'input, formato da materia da biotrasformare, energia da consumare e informazione da utilizzare per conservare il sistema lontano dallo stato entropico.
2) La fase di biotrasformazione è quella nella quale la materia in entrata (input del sistema) viene processata e trasformata in prodotti finiti per l'automantenimento dell'organo, per l'omeostasi dell'organismo e per essere esportata nell'intestino con la bile. Definiremo processore dell'input l'ente, costituito dalle cellule parenchimali e mesenchimali, che è deputato, nel sistema, a svolgere il complesso delle operazioni di biotrasformazione.
3) La fase di output è quella in cui i prodotti finiti vengono esportati nell'organismo, mediante il sangue delle vene sovraepatiche e la linfa dei dotti linfatici, e nell'intestino, tramite la bile attraverso i dotti biliari. Definiremo estrusore l'insieme, formato dalle vene sovraepatiche, dai dotti biliari e dai dotti linfatici, che porta a termine le operazioni di esportazione dei prodotti finiti. Va detto che nell'output del sistema vengono incluse le scorie prodotte nel corso di tutti i processi della funzione epatica. In condizioni normali, il risultato dell'attività funzionale del fegato risponde alle necessità dell'organismo. Risultati minori stabiliscono una condizione funzionale e clinica che viene definita come insufficienza epatica. Tutte le funzioni del sistema epatico sono sottoposte a una regolazione e a un controllo a breve e a lungo termine.
Tra i sistemi di regolazione a breve termine vanno ricordati i meccanismi di feedback negativo, basati sugli effetti inibitori (segnale di tipo pieno) indotti dai prodotti finiti, sull'input di materia grezza e sulle biotrasformazioni, secondo le leggi della teoria generale dei sistemi. L'effetto feedback si esercita mediante gli stimoli che permettono la rapida accensione di un certo processo in caso di necessità e l'altrettanto rapido spegnimento quando la necessità è decaduta. Questi meccanismi si basano sulla produzione nel nucleo cellulare di fattori induttori dell'attività di trascrizione del sistema DNA-RNA nella fase di stimolo e di inibitori a necessità soddisfatta. Anche l'attività recettoriale e non recettoriale della membrana cellulare, con cui viene catturata in modo specifico materia da internalizzare negli epatociti, è regolata da leggi di feedback negativo.
Tra i sistemi di controllo a lungo termine vanno ricordati: le rigide leggi della genetica; l'eterogeneità delle attività riferibili alle cellule epatiche, a seconda della loro locazione nel tessuto compreso tra i vasi portali di input e le vene sovraepatiche di output; la direzione del flusso ematico e il suo contenuto di substrati; i segnali ormonali veicolati dal sangue circolante nei vasi sinusoidali; il sistema nervoso autonomo simpatico e parasimpatico; gli scambi e le interazioni molecolari tra le cellule parenchimali e tra queste e le cellule mesenchimali.
a) Fisiologia dell'intrusore del sistema epatico. L'intrusore del sistema epatico penetra nell'organo attraverso l'ilo epatico, per immettere materia con il sangue della vena porta (75%) e dell'arteria epatica (25%). Il flusso del sangue venoso in input, proveniente dalle vene mesenteriche e dalla vena splenica, ha uno scorrimento continuo e anche il sangue dell'arteria epatica scorre con moto continuo, perché la pulsatilità che è impressa al flusso arterioso dalla contrazione del ventricolo sinistro viene smorzata, dapprima per l'effetto della dilatazione elastica che si verifica nell'aorta e nelle sue branche maggiori, successivamente, più a valle, a causa della caduta di pressione indotta dalla resistenza offerta dalle arteriole terminali all'interno dell'organo. L'unidirezionalità del flusso intraepatico decorrente dalle reti porto-portali verso la venula sovraepatica di scarico (vena centrale) è assicurata dalla vis a tergo impressa dalla pressione venosa e arteriosa della circolazione generale. La pressione venosa del tronco portale varia da 5 a 13 mmHg. La pressione dell'arteria epatica corrisponde a quella sistemica. Il fegato non controlla il flusso venoso portale in entrata; l'aumento della pressione venosa intraepatica non varia, infatti, il flusso di sangue portale; l'unica regolazione del flusso intraepatico è funzione dell'arteria epatica, la cui pressione dipende solo da quella generale dell'organismo. Le grandi quantità di sostanze vasoattive (tra cui l'adenosina) secrete dagli epatociti non hanno, infatti, possibilità di contatti diretti con questa arteria, perché la normale corrente del sangue epatico senza reflussi le allontana rapidamente dalla sua portata.
La parete dei vasi venosi epatici di entrata e di uscita del fegato è priva di tonaca muscolare; ne consegue che queste strutture canalari sono facilmente distensibili e quindi hanno modesta resistibilità. Ciò spiega la scarsa partecipazione (non più dell'1-2%) del circolo epatico alla resistenza complessiva del circolo splancnico costituito dall'insieme dei visceri addominali, l'elevata compliance del sistema vasculoparenchimale di questo organo che consente un rilevante accumulo di sangue nel suo ambito e l'aumento di resistenza della circolazione epatica quando la pressione intravascolare supera anche di poco i 13 mmHg di pressione.
L'immissione diretta e contemporanea di sangue arterioso e di sangue venoso e la loro commistione nella microcircolazione del lago sinusoidale del fegato rappresentano una condizione unica nell'organismo. Dopo la mescolanza, la pressione sanguigna del sinusoide si equilibra tra i 7 e i 10 mmHg, mentre la saturazione di ossigeno si porta attorno all'80-90%. Il miscuglio di sangue lambisce la faccia rivolta verso il lume del sinusoide delle cellule endoteliali, delle cellule di Kupffer, delle cellule di Ito e delle pit-cells. Queste cellule, per la loro allocazione, sono definite cellule di sponda.
Le cellule endoteliali (sinonimi: cellule sinusoidali, cellule di parete) sono fornite di numerose fenestrae (pori), il cui diametro, regolato da impulsi ormonali, ha funzione di filtro separatore del plasma dalla parte corpuscolata e dalle molecole di volume maggiore; il plasma circola liberamente attraverso tali pori dal sinusoide allo spazio di Disse che separa questa struttura vascolare dall'epatocito. Le cellule macrofagiche di Kupffer, a forma stellata, appartengono al sistema mesenchimale e formano il 5-7% degli elementi cellulari presenti nel tessuto epatico; sono chiamate anche scavenger cells ("cellule spazzino") in quanto hanno la funzione di eliminare le scorie, i detriti derivanti dall'apoptosi (v. oltre) e dalla necrosi cellulare, le molecole strane presenti nel sangue sinusoidale con un processo di cattura, inglobamento e digestione detto fagocitosi. Le cellule di Ito hanno il compito di immagazzinare alcuni lipidi e alcune vitamine liposolubili (vitamina A) e di produrre il collagene delle cicatrici che si formano a seguito di estesa necrosi degli epatociti, oppure ogni qualvolta le pareti dei sinusoidi collabiscono per fenomeni di schiacciamento da masse occupanti spazio; le fibre di collagene naturalmente presenti nello spazio di Disse sono prodotte da queste cellule. Le pit-cells, appartenenti al sistema immunitario, servono a eliminare parte delle molecole antigeniche che giungono nel fegato.
Il volume del flusso del sangue nel lago sinusoidale si aggira attorno a 1,5 l/min. Questo parametro cambia con le variazioni del lume dei vasi in entrata, indotte da sfinteri forniti di recettori sensibili all'adenosina localizzati a livello dei rami terminali della rete vascolare portale, immediatamente prima del suo sbocco nel sistema sinusoidale. La distribuzione distrettuale del flusso ematico nel letto sinusoidale è invece regolata da variazioni di volume delle cellule macrofagiche e delle cellule endoteliali di parete. Tutti questi fenomeni risentono dell'effetto di ormoni. Anche i vasi venosi di uscita sono forniti di sfinteri i quali, regolando il flusso del sangue, modulano la pressione nel letto sinusoidale (valori normali: 7-10 mmHg).
b) Fisiologia del processore del sistema epatico. Il processore è formato dagli epatociti ordinati in lamine che si incrociano e si interconnettono, il cui insieme forma il muralium hepatis, dalle cellule mesenchimali fornite di attività metabolica, i macrofagi, e dalle cellule di Ito. Il processore assorbe materia utile dal sangue portale e arterioso e la dismette, dopo averla elaborata in materia utilizzabile che il fegato sfrutta per il proprio mantenimento o esporta nell'organismo, il quale ne fruisce per la propria omeostasi; produce bile, inattiva tossici endogeni e xenobiotici e li elimina con le scorie derivanti dalle attività complessive del sistema. Alcune sostanze, come per es. l'ammoniaca, si diffondono liberamente nelle cellule epatiche. La maggior parte delle sostanze, tuttavia, per entrare e uscire dagli epatociti e dalle altre cellule del tessuto epatico funzionale necessita di meccanismi atti ad agevolarne il passaggio transmembrana. Nell'epatocito questi meccanismi sono distribuiti in due regioni del plasmalemma, separate dalle tight-junctions: una a dominio o polarità basolaterale, l'altra a dominio o polarità apicale. La membrana basolaterale (sinonimo: plasmalemma o membrana sinusoidale) è addetta agli scambi con il sangue. Essa guarda verso il sinusoide con una sua parte ricca di microvilli, che ne aumentano la superficie assorbente; ha la duplice funzione di assorbimento di materia grezza dal sangue del sinusoide e di dismissione dei prodotti finiti elaborati nell'epatocito, e copre il 75% dell'estensione del plasmalemma. Questa parte di membrana plasmatica contiene meccanismi che modulano il gradiente ionico fisiologico del sodio (Na) e del potassio (K) tra la faccia intracellulare e quella extracellulare; esso può essere così formulato:
Naextra ≫Naintracellulare
Kextra ≪ Kintracellulare
Tra questi meccanismi, l'ATPasi Na/K dipendente e i canali del potassio contribuiscono a fissare il potenziale elettrico transmembrana di ‒35 mV, utile a mantenere il pH intracellulare. La membrana sinusoidale dell'epatocito è provvista anche di meccanismi che utilizzano lo scambio Na/K per l'estrusione protonica, di scambiatori di Na-H e di Na-bicarbonati e di dispositivi per l'internalizzazione sodio-dipendente e sodio-indipendente degli acidi e dei sali insieme ad altri composti lipofili. Una gran parte del traffico in entrata di materia attraverso la membrana basolaterale dell'epatocito avviene con fenomeni di endocitosi, mediata da recettori; di quello in uscita con fenomeni di esocitosi.
I meccanismi dell'endocitosi e dell'esocitosi sono i mezzi d'internalizzazione della materia usati anche dalle cellule macrofagiche di Kupffer. Il meccanismo endocitosico si svolge in tre fasi: durante la prima fase, i recettori di differente natura si riuniscono in un sito della membrana plasmatica sufficientemente ampio affacciato verso l'ambiente in cui la cellula è immersa. Qui riconoscono e catturano la materia da internalizzare; nella seconda fase, sotto questo tratto di membrana si forma uno strato di catene polipeptidiche ordinate, con le caratteristiche strutturali di un lattice poliedrico. Si origina così quel tratto di membrana plasmatica definito coated-pit. Il lattice forma un mantello (coat) che delimita l'area (pit) della membrana sovrastante in cui sono riuniti i recettori; nella fase finale, quando i recettori sono saturati dalle molecole catturate, il coat di lattice si invagina formando una coated vescicle. Quest'ultima si stacca dalla membrana per dirigersi verso il reticolo endoplasmatico liscio, organulo citoplasmatico che dismette i complessi molecole-recettore da metabolizzare. I recettori liberati delle molecole catturate vengono demoliti se denaturati, riciclati sulla membrana se utilizzabili.
La membrana apicale (sinonimi: plasmalemma canalicolare o biliare) è fornita di un'introflessione che forma un settore del canalicolo biliare. Anch'essa è arricchita da microvilli e si unisce con le analoghe increspature di una o più cellule adiacenti per costituire il canalicolo biliare. Questa parte di membrana ha nel suo dominio solo la funzione di dismissione dei componenti (sinonimo: determinanti) della bile verso il lume canalicolare. A tale scopo contiene pompe di estrusione ATP-dipendenti di anioni, di sali biliari, di fosfolipidi, di glicoproteine, sistemi di trasporto ATP-indipendenti (canali del cloro, scambiatori di anioni Cl-bicarbonati) e trasportatori del glutatione. Questi due segmenti del plasmalemma hanno differente composizione lipidica e proteica, la cui formazione è regolata da uno specifico sito genico. Durante la biogenesi della membrana plasmatica, alcune proteine destinate al polo biliare pervengono nel suo dominio dalla parte di plasmalemma basolaterale, trasportate da vescicole di Golgi, con fenomeno di transcitosi, modulato da una proteina-chinasi che disciplina lo stato delle due polarità. Tali movimenti molecolari endocellulari vengono governati da una proteina-chinasi che regola la polarità basolaterale e biliare dell'epatocito.
L'insieme degli epatociti e delle altre cellule funzionali che formano il processore del sistema epatico elabora materia utile proveniente dagli alimenti, dalla quale ricava prodotti con due differenti destinazioni: una parte di essi resta nell'organo, ove viene utilizzata ai fini dell'automantenimento delle cellule epatiche e delle altre cellule del sistema processore, oppure viene dismessa nel sangue per essere utilizzata dall'organismo o eliminata come scorie; una seconda parte viene sintetizzata per essere trasferita con la bile nell'intestino per la digestione degli alimenti. Questo insieme di funzioni vitali è svolto soprattutto dagli epatociti che formano il core del processore. I macrofagi (cellule di Kupffer) e le cellule di Ito concorrono alla funzione complessiva del processore con l'eliminazione di alcune sostanze tossiche, di alcune glicoproteine denaturate e dei detriti cellulari che si accumulano nel sangue, e con il metabolismo del collagene, di un certo numero di lipidi e della vitamina A. Alcuni prodotti del metabolismo delle cellule kupfferiane sono captati dagli epatociti per essere dismessi dal fegato con la bile.
I fenomeni costituenti l'esocitosi iniziano a livello della parete interna della membrana plasmatica allorché sopraggiungono le vescicole, che dai siti di produzione trasportano nel citoplasma (transcitosi) i prodotti finiti e le scorie da esportare. La vescicola transcitosica a contatto con la membrana plasmatica si salda con essa, aprendosi quindi per riversare il suo contenuto verso l'esterno.
Durante il suo percorso tra la zona portale e la venula centrale sovraepatica di scarico, il sangue sinusoidale, a seguito del contatto con il processore, perde gradatamente ossigeno e materia grezza, ricevendo in cambio prodotti di elaborazione e scorie da esportare, derivanti dal lavoro delle cellule di questo organo. Tali fenomeni polivalenti dividono in tre zone l'area di tessuto epatico situata tra il sistema vascolare di entrata e il sistema vascolare di uscita: la zona 1 comprende gli epatociti dislocati più vicino agli spazi portali e alla rete microvascolare porto-portale; la zona 3 comprende gli epatociti più vicini alla venula centrale di scarico; gli epatociti che si trovano in posizione intermedia fanno parte della zona 2. La divisione in queste tre zone è dettata dalle differenze dei processi che si svolgono nelle loro cellule, in ragione delle differenze qualitative dell'input proveniente con il sangue.
Nella zona 1 si svolge soprattutto il metabolismo energetico, diretto a fornire energia libera attraverso il ciclo dell'acido citrico e della catena respiratoria. Altre importanti funzioni che hanno luogo in questa zona sono: la dismissione di glucosio accumulato sotto forma di glicogeno con la neoglicogenesi e decostruito con la glicogenolisi; la proteolisi delle molecole proteiche del sangue usurate (per es. l'albumina) a opera delle catepsine B e H; il catabolismo degli aminoacidi; l'eliminazione della maggior parte dell'ammoniaca; la sintesi di molte proteine del sangue (albumina, prealbumina, transtiretina) e delle glicoproteine (proteine della fase acuta, fattori della coagulazione-fibrinoformazione e della fibrinolisi, apolipoproteine, metalloproteine, enzimi di esportazione); la sintesi di alcuni enzimi ‒ aminoacido-ossidasi, L-idrossi-acido-ossidasi, monoamino-ossidasi, fosfatasi alcalina e acida, acetilglucosidasi, γ-glutamil transferasi, glucuronidasi, lecitina-colesterolo-acil-transferasi, lipasi lipoproteica epatica, pseudocolinesterasi ‒; la sintesi di colesterolo; la β-ossidazione degli acidi grassi; l'azione protettiva nei riguardi di alcune sostanze tossiche (a mezzo della glutatione perossidasi); la sintesi di sali biliari e la biligenesi. Nella zona 3 si svolgono soprattutto: l'assunzione di glucosio proveniente dalla zona 1; la formazione di composti chetonici con la chetogenesi; una parte della detossicazione dell'ammoniaca; il metabolismo dei farmaci e altri xenobiotici; la proteolisi; la sintesi di albumina; è anche presente in questa zona anidrasi carbonica. La zona 2 intermedia, infine, consiste nella commistione tra queste attività.
Gli epatociti non sono cellule specializzate in quanto sono provvisti di uno stesso corredo genomico; perciò sono in grado di svolgere tutti i compiti della funzione epatica di loro pertinenza, attivandosi in rapporto alla materia messa a disposizione dal sangue che li lambisce. Esperimenti nei quali il fegato è stato perfuso con taurocolato o con bromosulfonftaleine per via retrograda attraverso le vene epatiche di uscita hanno dimostrato lo svilupparsi di concentrazioni di questi prodotti nella zona 3, speculari alle concentrazioni della zona 1 osservabili con la normale perfusione portale anterograda. Le interazioni tra le cellule delle tre zone avvengono attraverso scambi di metaboliti prodotti da cellule di una zona, catturati da cellule appartenenti ad altre zone che possono essere anche non adiacenti. I più noti processi che riguardano le sintesi di prodotti per l'automantenimento e l'esportazione nell'organismo sono: il metabolismo energetico, quello del glucosio e del glicogeno, la sintesi delle proteine e degli aminoacidi, il metabolismo lipidico, la chetogenesi, la sintesi dei determinanti biliari.
Uno dei ruoli metabolici fondamentali del tessuto epatico è la sintesi di composti energetici che vengono utilizzati dagli altri organi (muscolo, cervello, cuore). La demolizione ossidativa e la produzione di energia a partire da molecole di nutrienti che reagiscono con l'ossigeno costituiscono quello che è definito processo della respirazione cellulare. La maggiore quantità di energia viene prodotta dalla cellula epatica, utilizzando come substrati di partenza il lattato (ottenuto dalla conversione del glucosio) e il piruvato. Sia il lattato sia il piruvato vengono ossidati completamente a CO₂.
L'elaborazione del glucosio è distribuita in tutto il parenchima epatico. Gli epatociti della zona 3, i meno aerobici, hanno la più alta capacità di assorbire dal sangue sinusoidale glucosio, con cui sintetizzano direttamente glicogeno. Questa sintesi (glicogenosintesi) è il processo più diffuso nel tessuto epatico. Il glicogeno è la molecola polimerica con cui il fegato immagazzina idrati di carbonio. Gli epatociti della zona 3 usano il glicogeno per almeno tre operazioni: come fonte di rapido impiego di glucosio da dismettere nell'organismo; come fonte di molecole minori per la lipogenesi; come fonte di lattato per la neoglucogenesi di altre cellule. Nelle cellule della zona 1, invece, sono allocati processi più aerobici (il sangue che le contatta è più ricco di ossigeno), diretti a costruire glucosio da lattato e da alanina. La capacità degli epatociti della zona 1 di produrre glicogeno dal lattato fornito dagli epatociti della zona 3 è definita 'paradosso del glucosio epatico'. In sintesi, il complesso fenomeno è basato sull'osservazione che il glucosio del sangue sinusoidale, direttamente assorbito dalle cellule epatiche, è scarsamente utilizzato per la sintesi di glicogeno. La maggior parte di questa molecola polimerica deriva da processi di sintesi che partono da molecole a tre atomi di carbonio, tra cui la più importante è il lattato derivante dalla demolizione del glucosio (glicolisi) che si svolge negli epatociti della zona 3. Da quest'area il lattato giunge agli epatociti della zona 1, dopo aver attraversato il circolo generale per mezzo dell'arteria epatica. Nella zona 1 il lattato viene prima metabolizzato a glucosio, e successivamente trasformato in glicogeno.
Gli epatociti sintetizzano quasi tutte le proteine del sangue, tranne le γ-globuline e il fattore VIII della coagulazione. Quasi tutti gli epatociti contengono albumina, α-fetoproteina, la proteina che lega il retinolo (retinol-binding protein) ecc. Si è potuta riscontrare una zonazione certa della sintesi delle proteine plasmatiche. In particolari condizioni, per es. il digiuno, si può osservare una maggiore attività di sintesi dell'albumina nelle cellule della zona 3. Va sottolineato che l'eccitazione dell'attività proteosintetica non si propaga da cellula a cellula in modo uniforme. Lo studio di quest'azione ha dimostrato che le cellule con attività proteosintetica non sono mai consonanti perché si trovano in fasi diverse di operatività. In termini teleologici, data la canonica importanza vitale di questi processi, siffatto comportamento può avere significato di fenomeno protettivo. Generalizzando, è possibile dire che un agente patogeno con attitudine a colpire elettivamente soltanto una fase di un'attività metabolica danneggia unicamente le cellule in quella fase di attività, risparmiando invece le altre che si trovano in fasi differenti. Mediante quest'attività, la cellula epatica ricava aminoacidi che parzialmente riutilizza per la sintesi di nuove proteine, parzialmente dismette con la bile e in parte demolisce producendo ammoniaca (NH₃), molecola che viene poi eliminata per la sua elevata tossicità. La funzione del fegato nell'ambito del metabolismo dei lipidi può essere suddivisa in tre attività principali: la neolipogenesi, operazione attinente alla sintesi di lipidi; la sintesi del colesterolo; la sintesi di apolipoproteine, proteine che hanno il compito di solubilizzare e di trasportare grassi nel sangue (lipoproteine). Solo le cellule intestinali producono proteine con un ruolo analogo. Spetta al fegato rimuovere dalla circolazione i remnant chilomicrons, complessi molecolari, che trasportano colesterolo dall'intestino. Le cellule epatiche posseggono meccanismi specializzati nel trasporto transmembrana in input e in output di tutti i tipi di lipoproteine (v. colesterolo; lipoproteine).
I processi di produzione dei chetoni sono limitati alla zona 3, come si può dedurre dall'identificazione in questa regione di un'alta presenza di β-idrossibutirildeidrogenasi che deve essere considerato come il più significativo indicatore di questo processo. Fonti di produzione di chetoni sono gli acidi grassi e alcuni aminoacidi. La loro produzione si accentua in corso di malattie metaboliche, quali il diabete, e di epatite alcoolica.
La bile è un liquido acquoso, alcalino, isoosmolare, di colore marrone verdastro, destinato a essere esportato nell'intestino per la digestione dei grassi. La sua produzione si aggira intorno a 400-600 ml, ma può salire sino a 2000 ml nelle 24 ore. La bile è il risultato della mescolanza nel lume del canalicolo biliare di sostanze rese disponibili dall'epatocito, dette determinanti biliari, di cui le principali sono: gli elettroliti (ioni) in concentrazione analoga a quella del sangue, esclusa la concentrazione di HCO₃ (determinanti ionici); i sali biliari, fosfolipidi e colesterolo sotto forma di micelle (determinanti colanici e lipidici); i pigmenti biliari (bilirubina), il muco, alcune proteine enzimatiche, anticorpi di tipo IgA, aminoacidi, xenobiotici (determinanti colefili); i metalloioni e frammenti di materiale corpuscolato derivante dalla lisi fisiologica delle cellule delle vie biliari ed epatiche (determinanti misti).
La secrezione della bile avviene attraverso la membrana canalicolare, mediata dal citoscheletro presente nel citoplasma pericanalicolare. Ciascun determinante secreto nel canalicolo biliare conserva la propria acqua di idratazione e con essa una parte dell'acqua della bile nativa; il resto filtra attraverso le tight-junctions, attratto dal gradiente osmotico prodotto dai determinanti biliari. Fibre contrattili di actina e di miosina imprimono alla parete del canalicolo movimenti peristaltici, preposti a convogliare la bile verso i dotti di uscita man mano che essa si forma. Il riassorbimento di alcuni determinanti (proteine, aminoacidi, elettroliti), la secrezione di altri (bicarbonati) durante il tragitto nei dotti biliari e lo stazionamento nella colecisti determinano la trasformazione della bile nativa in bile di escrezione. Detta anche ionocoleresi, la produzione della bile elettrolitica (indipendente dai sali biliari) si svolge per processi che trasportano, dapprima attraverso la membrana basolaterale, ioni Na⁺, K⁺ e soluti organici dal sangue nell'epatocito, poi, tramite la membrana apicale, dall'interno all'esterno di questa cellula. Alla componente ionica, soprattutto agli ioni sodio, è legato il trasporto transmembrana di gran parte dell'acqua biliare (idrocoleresi). Questa parte di bile indipendente dai sali biliari viene prodotta in uguale misura nelle tre zone funzionali dell'acino.
La produzione di bile sali biliari-dipendente è definita colanocoleresi. La raccolta di questi determinanti biliari nel canalicolo crea un gradiente osmotico che attira acqua in esso. I sali biliari all'interno del canalicolo hanno una doppia origine, di riciclo e di neosintesi. La parte di riciclo viene riassorbita dal tubo digerente dopo avere attivamente partecipato al processo di digestione. Essa viene ripresentata all'epatocito dal sangue portale in entrata. Questa cellula estrae i sali biliari dal sangue con due meccanismi che sono localizzati sulla sua membrana basale. Il primo internalizza Na⁺-taurocolato con un cotrasportatore sodio-indipendente che utilizza sia il gradiente del Na creato da una ATPasi Na⁺/K⁺ dipendente, sia il potenziale di membrana generato dai canali del potassio. Il secondo meccanismo, mediante un trasportatore polipeptidico Na⁺-indipendente, internalizza l'acido colico. I sali biliari del riciclo intestino-fegato migrano nell'interno dell'epatocito contenuti in vescicole endocitosiche, che si dirigono dalla membrana basolaterale a quella apicale. Quest'ultima parte della membrana della cellula epatica capta le vescicole di trasporto e le apre, determinando il ritorno dei sali biliari nel canalicolo. La sequenza di questi passaggi forma il circolo enteroepatico dei sali biliari.
La parte di sali biliari che completa la quota utile giornaliera viene sintetizzata nel reticolo endoplasmatico liscio dell'epatocito. Da questa struttura, le molecole neoformate vengono trasportate, a mezzo delle vescicole di Golgi, verso il sistema di microtubuli del citoscheletro che facilitano il loro passaggio transmembrana nel canalicolo.
Colesterolo e fosfolipidi, che pure hanno attraversato la membrana canalicolare entrando nel canalicolo, vengono rapidamente intrappolati dai sali biliari, con i quali, per le loro naturali proprietà detergenti, si aggregano con legami non covalenti, formando micelle. In questi aggregati, le parti idrofobiche (idrorepellenti), che rendono insolubili in acqua le molecole lipidiche, vengono posizionate verso l'interno, fuori dal contatto con l'acqua. Ciò rende la micella il trasportatore in mezzo acquoso di colesterolo e di fosfolipidi, in quanto queste molecole lipidiche intrappolate nelle micelle non possono precipitare dall'acqua biliare. La sintesi delle nuove molecole di sali biliari nell'epatocito parte dal colesterolo prodotto all'interno di questa cellula. Da tale molecola scarsamente idrosolubile (idrofobica) il fegato ricava quattro acidi (250-500 mg in 24 ore) attraverso due processi: l'ossidazione della sua catena laterale con una molecola carbossilica; l'idrossilazione delle posizioni 3, 7, 12 del nucleo ciclopentano-fenantrenico con un ossidrile (OH). I quattro acidi biliari (acidi litocolico, deossicolico, chemodeossicolico, colico) che si trovano nell'organismo, tutti idrossilati in posizione 3α, si distinguono tra loro per la differente idrossilazione nelle posizioni 7α e 12α. Il metabolismo di queste sostanze inizia con la sintesi dal colesterolo 7-idrossilato di acido colico e deossicolico e si completa nell'intestino. Gli acidi biliari, di per sé insolubili, vengono resi solubili attraverso la coniugazione con due aminoacidi, la glicina o la taurina. Questo processo di salificazione impedisce il riassorbimento degli acidi biliari lungo l'albero biliare e ne favorisce il riciclo dall'ileo terminale. Il loro rientro nell'epatocito regola con azione di feedback negativo la neosintesi epatica dei sali biliari. La zonazione del processo biligenetico sali biliari-dipendente è stata identificata, in ordine decrescente di intensità, nelle zone 1, 2 e 3.
La bilirubina è il pigmento responsabile della colorazione gialla della cute e delle mucose, quando il suo accumulo nel sangue supera la concentrazione di 117 mmol/l. Ciò avviene allorché la produzione sopravanza la possibilità di eliminazione del fegato. Le fonti molecolari della bilirubina sono: l'emoglobina presente nei globuli rossi del sangue, a seguito della loro rottura, quando i più vecchi vengono eliminati nella milza; la mioglobina che si trova nelle fibre muscolari; i citocromi e le molecole enzimatiche contenenti ferro delle cellule epiteliali. Nel sangue, il 90% della bilirubina è presente in forma non-coniugata (sinonimi: bilirubina IXa, bilirubina nativa, bilirubina indiretta). Per la sua polarità, questa molecola viene veicolata nel sangue legata all'albumina con legame non-covalente. La restante parte di bilirubina è presente nel sangue in forma libera solubile (sinonimi: bilirubina coniugata, bilirubina glucuronata, bilirubina diretta). Il legame con l'acido glucuronico, grazie alla cui azione essa è solubile, consente la sua eliminazione tramite il rene, cosa impossibile alla bilirubina non-coniugata, che, per l'alto peso molecolare dell'albumina con cui è legata, non oltrepassa il filtro renale. Nelle urine normali si riscontrano solo tracce di bilirubina diretta. Questa bilirubina si complessa in forma labile con l'albumina. Solo quando la sua presenza nel sangue dura a lungo, il legame con l'albumina può diventare stabile; il complesso molecolare prende allora il nome di biliproteina o anche bilirubina delta.
La coniugazione della bilirubina nativa non polare con l'acido glucuronico avviene nel fegato. Il processo rende la molecola solubile ed eliminabile con la bile. Esso si svolge nel seguente modo: distacco della bilirubina non-coniugata dall'albumina a livello della membrana plasmatica dell'epatocito; entrata della molecola nella cellula epatica per diffusione o con la facilitazione di molecole trasportatrici; trasferimento su ligandine, molecole endocellulari aventi lo scopo di trasportare questo pigmento nell'interno del reticolo endoplasmatico liscio; glucuronazione in due tempi con acido glucuronico a opera della glucuronil-transferasi, e conseguente formazione prima di bilirubina monoglucuronide (che in tracce passa nel sangue), successivamente di bilirubina digluronide; infine, passaggio della molecola diglucuronata nella bile attraverso la membrana del canalicolo biliare, nel quale giunge trasportata dalle vescicole di Golgi. Accanto alle molecole lipidiche, giungono nel canalicolo biliare metallo-ioni e le parti corpuscolate. Durante il suo percorso epatofugo, la bile nativa canalicolare va incontro a importanti aggiustamenti della concentrazione dei suoi soluti, che dipendono, da una parte, dal riassorbimento di acqua, aminoacidi e proteine, dall'altra parte, dall'arricchimento di detriti cellulari e di bicarbonati.
La funzione protettiva del fegato nei riguardi di sostanze tossiche si svolge con l'inattivazione molto efficace di ormoni e di altre sostanze potenzialmente nocive endogene ed esogene (xenobiotici), idrosolubili o liposolubili. Queste ultime, poiché non vengono naturalmente eliminate con le urine, tendono ad accumularsi nell'organismo. Tali molecole vengono convertite in composti atti alla loro eliminazione renale. Il più importante metabolita endogeno neutralizzato dal fegato è la molecola dell'ammoniaca (NH₃). La rimozione dell'ammoniaca esogena che si forma nell'intestino, nel colon e nel rene, o endogena, prodotta dal catabolismo epatico proteico, viene effettuata mediante due processi. Con il primo, il fegato rimuove nella zona 1 e 2 circa il 95% dell'ammoniaca sotto forma di urea, ottenuta da due molecole di ammoniaca e una molecola monocarboniosa. Per mezzo del secondo processo, le restanti molecole di ammoniaca vengono eliminate sotto forma di glutammina, ottenuta da una molecola di glutammato e una molecola di ammoniaca. I due processi sono interrelati, perché la zona 1 e la zona 2 sintetizzano urea dall'ammoniaca derivata dalla demolizione di proteine e aminoacidi, tra questi da glutammina a glutammato; la zona 3 capta il glutammato e con sintesi che utilizza ammoniaca produce glutammina. Le sintesi di urea e di glutammina sono considerati processi sequenziali.
Le molecole di medicamenti e altri xenobiotici viaggiano nel sangue trasportate soprattutto dall'albumina, pronta a cederle ai recettori situati sulla membrana degli epatociti. Queste cellule con fenomeno endocitosico le internalizzano e le trasferiscono (transcitosi) a livello del reticolo endoplasmatico liscio, dove numerosi enzimi catalizzano le reazioni dirette alla loro trasformazione. Quasi tutte queste reazioni si verificano in due fasi. Con la prima fase vengono resi inattivi i gruppi reattivi attraverso processi di idrossilazione, di ossidazione, di riduzione, di coniugazione con il glutatione e l'acido solforico, di metilazione e di deaminazione. La ricchezza di enzimi monossigenasici, dipendenti dalla catena respiratoria e dalle varie forme molecolari del citocromo P450 nella zona pericentrale, indica che questi processi si svolgono nella zona 3 del lobulo. Altre sostanze endogene tossiche eliminate dal fegato sono i radicali superossidi (anioni), l'acqua ossigenata (perossido di idrogeno) e i radicali idrossilici. La loro tossicità è legata all'attitudine a iniziare una catena che porta alla lipoperossidazione e alla formazione di altri perossidi. L'eliminazione di queste sostanze tossiche avviene soprattutto nella zona 1. Enzimi che operano la detossicazione sono superossido-dismutasi, glutatione-perossidasi e catalasi. Ciò rende ragione della localizzazione pericentrale delle lesioni indotte da sostanze tossiche, tra le quali va ricordato soprattutto l'alcol, quando esse eccedono le possibilità di neutralizzazione da parte delle cellule di questa zona. Con le reazioni della seconda fase, il fegato trasforma alcune sostanze insolubili e molti lipidi in forma solubile, coniugandoli con l'acido glucuronico, con l'acido acetico, con la taurina, con la glicina e con acido solforico (solfatazione).
c) Fisiologia dell'estrusore del sistema epatico. L'estrusore del sistema epatico è costituito da due strutture che dismettono dal fegato i prodotti finiti da esportare, resi disponibili dal processore. La funzione di dismissione è attuata da due sottosistemi distinti: l'estrusore venoso, formato dalle tre grandi vene sovraepatiche, esporta nell'organismo i prodotti finiti attraverso il sangue che si raccoglie dalle venule centrali, nelle quali è confluito il sangue del letto sinusoidale (sono stati descritti, ma non tutti confermati, sfinteri aventi il ruolo di regolare l'output del sangue dai sinusoidi immediatamente prima delle venule centrali); l'estrusore biliare esporta nell'ambiente intestinale la bile che si forma nel canalicolo biliare, struttura iniziale del cosiddetto albero biliare. I canalicoli biliari eseguono movimenti peristaltici, indotti dalle fibrille di actina e di miosina presenti nel citoplasma adiacente alla faccia endocellulare della membrana del canalicolo. I canalicoli formano una rete diffusa in tutto il sistema epatico; essa si continua con i duttuli della triade portale, passando attraverso i canali di Hering. La parete di queste discusse strutture canalari, priva di membrana basale, sarebbe tappezzata da biliociti, cellule proprie delle vie biliari. Per trovare le strutture canalari di output biliare sicuramente fornite di membrana basale propria, bisogna arrivare ai duttuli dello spazio portale. Il flusso della bile nei dotti intra- ed extraepatici, sino al dotto epatico comune e al dotto coledoco, viene regolato dall'apertura e dalla chiusura della papilla di Vater a opera dello sfintere di Oddi. La parte della bile che non viene escreta si raccoglie nella colecisti.
Durante il digiuno, lo sfintere di Oddi, costituito da fibre muscolari lisce, resta chiuso, impedendo il passaggio di bile nel duodeno. Questa contrazione favorisce il riempimento della colecisti e il reflusso della bile dal duodeno nello stomaco. La colecistochinina (CKK), o fattore duodenale, determina la contrazione della parete colecistica. Accanto a questa sua funzione primaria, la colecistichinina riduce il tono dello sfintere di Oddi, favorendo in questo modo il transito della bile colecistica e di quella prodotta estemporaneamente dal fegato quando a livello del duodeno pervengono lipidi e aminoacidi dietari. La colecisti concentra la bile che le perviene assorbendo acqua e conservando sali biliari durante il digiuno per fornirli al primo pasto.
d) L'equilibrio instabile delle strutture epatiche. Tutti i processi che si svolgono nel fegato sono raccolti in microstrutture, descritte per la prima volta da Malpighi, il quale le chiamò indifferentemente lobuli o acini per sottolineare la struttura 'glandolare del fegato'. Si deve, però, a Kiernan (v. sopra) la prima raffigurazione in tre dimensioni di questa struttura, cui egli attribuì la denominazione di lobulo. Con precisione attualmente ancora valida, Kiernan ricavò i suoi disegni dalle figure piane quadrangolari, pentagonali, esagonali, definite da 4-5-6 spazi portali, ciascuna contenente in posizione centrale una venula sovraepatica di scarico, le quali tassellano l'intera superficie dei preparati istologici di fegato. Questa impostazione della struttura del fegato dominò l'area epatologica sino al 1963, quando H. Rappaport ridisegnò la struttura epatica ponendo come base una microunità funzionale alla quale diede il nome di 'acino' (v. sopra). Nel disegno di Rappaport questa struttura istologica ha una forma triangolare, con la base corrispondente alla linea che congiunge due spazi portali e l'angolo al vertice a livello della vena centrale. In tre dimensioni appare come uno spicchio di lobulo. I complessi fenomeni che caratterizzano lo scambio di molecole tra sangue e fegato inizialmente sono propri del dominio dell'input, vale a dire della cattura della materia grezza proveniente dall'ambiente esterno oppure dall'organismo, del suo trasferimento e della sua elaborazione all'interno delle cellule epatiche; successivamente, divengono dominio dei fenomeni di output, cioè dell'esportazione dei prodotti dal fegato all'organismo attraverso le vene sovraepatiche.
I processi compresi tra i due momenti canonici di input e di output della fisiologia del fegato sono tutti supportati dal medesimo tratto di tessuto epatico limitato dalle reti vascolari che si stendono fra 3-6 spazi portali, il cui sangue è tributario di una venula di scarico. Le due fasi (input e output) improntano l'organizzazione di questo tratto di tessuto epatico, assegnandole due configurazioni prevalenti durante le due fasi funzionali: una configurazione incentrata sulla fase di input, durante la quale vasi arteriosi e venosi introducono materia grezza e gli epatociti sono attivati dalla materia grezza da biotrasformare; una configurazione incentrata sulla fase di output, durante la quale vasi venosi di scarico esportano prodotti finiti ed espletano anche attività collegate con la funzione di uscita.
Consideriamo pertanto una zona triangolare, avente come base i vasi arteriosi e venosi in uscita dalla rete portale e con vertice nell'arteria epatica al centro del lobulo. Possiamo supporre che il flusso di materia grezza in ingresso proceda dalla base verso il vertice in modo sostanzialmente monodimensionale. Consideriamo inoltre un piccolo volume di tessuto epatico di spessore Δx, all'interno del quale avviene la trasformazione della materia grezza in ingresso in prodotti finiti in uscita; chiamiamo Ci(x) la concentrazione dell'i-esimo componente del materiale grezzo nel punto x e Δt il tempo necessario alla trasformazione nei prodotti in uscita della quantità infinitesima ΔCi. Pertanto nel volumetto di spessore Δx la trasformazione di materia avviene con un tasso pari a ΔCi/Δt. Tale tasso di trasformazione, derivando dall'azione combinata di tutti gli epatociti compresi nel volumetto, può essere supposto costante. Questa variazione deve corrispondere alla variazione tra la concentrazione a monte e quella a valle del volumetto in esame; passando al limite, considerando cioè una sezione infinitesima, ciò si esprime attraverso la seguente equazione di continuità:
dove DCi è il cosiddetto coefficiente di diffusione per il componente i-esimo, che viene supposto costante per tutto l'asse X. Si può supporre che nell'equazione differenziale scritta sopra il flusso di materia grezza in ingresso sia costante nel tempo. Detta allora lunghezza di diffusione
la quantità con τ il corrispondente tempo di diffusione, a soluzione dell'equazione di continuità risulta
con k₁ e k₂ costanti che devono essere determinate conoscendo le condizioni al contorno per il componente i-esimo, cioè l'andamento della sua concentrazione lungo l'asse X a un istante predeterminato. L'andamento della concentrazione della materia grezza in ingresso decresce pertanto procedendo verso lo scarico centrale del lobulo, con un andamento dato dalla combinazione delle due curve esponenziali espresse dall'equazione risolutiva. Da tale andamento dipende, quindi, la caratterizzazione di un elemento di tessuto epatico posto a una distanza x dalla rete di vasi in ingresso come appartenente al lobulo o all'acino. In modo simmetrico si può rappresentare l'andamento della concentrazione degli elementi prodotti dal metabolismo epatico, che trovano pertanto la loro massima concentrazione in corrispondenza della venula centrale, mentre sono assenti sulla base del triangolo acinale considerato. Queste relazioni, lette in termini di energia interscambiabile, confermano che la configurazione acinale è massima quando è minima l'energia scambiata dalla configurazione lobulare e viceversa. In sintesi: l'acino e il lobulo così concepiti sono due enti a significazione diversa per le attività funzionali che si innestano nella tettonica funzional-strutturale di uno stesso segmento di tessuto epatico. I due enti risultano complementari, essendo la configurazione lobulare espansione di quella acinale, in quanto l'attività del lobulo, condizionata dall'output, continua quella dell'acino, generata dall'input che ne costituisce la premessa. Anche se questa interpretazione unitaria dal significato dell'acino e del lobulo risolve molti problemi, non chiarisce se il segmento di tessuto epatico, sito tra gli spazi portali e la vena centrale, sia la più piccola unità funzionale del fegato.
Patologia
La sistemazione classica data dall'epatologia alle malattie del fegato si basa sul principio di causalità, ereditato dal meccanicismo della concezione atomistica che con Leucippo (5° secolo a.C.) interconnette i fatti dell'esperienza facendo ricorso alle 'cause fisiche', mentre con Anassagora, Platone e gli Stoici, riporta tali fatti a 'cause intelligenti', frutto dell'intelletto. Questa concezione, basata sul concetto di causa approfondito da Aristotele (Fisica, 1, 1, 184) e in seguito dalla filosofia scolastica, ha costituito il modello da cui è fiorita la fisica classica da Newton a Laplace e si è originato il determinismo, che ha dominato a lungo il pensiero scientifico occidentale e permane tuttora in alcuni orientamenti. L'epatologia tradizionale non è sfuggita ai principi deterministici: infatti essa distingue gli stati patologici indotti da cause 'primitive', vale a dire determinate nell'organo, da quelli secondari, ovvero provenienti da patologie sviluppatesi in altri organi, come elemento di riferimento alla funzione di filtro depuratore dell'intera massa di sangue circolante che il fegato assume nella tettonica dell'organismo. Questa funzione espone l'organo al rischio di essere implicato in affezioni che insorgono in altri organi e apparati, veicolate dal doppio flusso arterioso e portale dal quale è attraversato. L'epatologia ha dato un ordine alle malattie primitive e secondarie del fegato, correlando il loro determinarsi con tre categorie di agenti patogeni (causae morborum), a seconda della loro natura: genetica (epatopatie congenite e disgenopatiche di tipo vascolare, cistiche, autoimmuni, metaboliche); tossica e infettiva (epatopatie batteriche virali, fungine e parassitarie); neoplastica (tumori primitivi e metastatici). A queste liste sono stati aggiunti quadri clinici derivati da conseguenze (per es., ipertensione portale, grave insufficienza funzionale epatocellulare, stati cirrotici) indotte dall'evoluzione di stati morbosi di particolare evidenza e gravità. Tale metodologia classificatoria ha portato a formulare due constatazioni. La prima riguarda il fatto che uno stesso agente patogeno può generare lesioni anatomiche e quadri clinici anche assai diversi, e che la stessa lesione anatomica e lo stesso quadro clinico possono essere determinati da differenti agenti patogeni. È legittimo quindi dedurne come la classificazione causale abbia dato origine a un intreccio ambiguo dei concetti classici di infiammazione, degenerazione, apoptosi, necrosi, ipertrofia e rigenerazione. Questa confusione ha reso spesso tali elementi poco esaustivi, non solo come criteri classificatori per differenziare le diverse forme morbose e al contempo per riunirle in gruppi associati secondo univoche vie logiche, ma anche come criteri patogenetici idonei a spiegare o a interpretare deduttivamente stati di anormalità anatomica e clinica. La seconda constatazione riguarda il fatto che ogni causa può essere preceduta da un'altra causa a monte (la causa della causa) o accompagnata da una causa parallela. Ne deriva che i concetti di cronicità, ricorrenza, recidiva, e finanche il tipo delle lesioni anatomiche rilevabili con la biopsia epatica, da sempre considerata l'esame diagnostico definitivo della patologia epatica, visti nell'ottica causale, hanno finito per diventare anch'essi indici di riferimento insicuri e non definitivi ai fini della valutazione del grado di gravità (grading) e dello stadio di avanzamento (staging) della forma morbosa. Con queste premesse, il comportamento del fegato, che, come abbiamo detto, è assai simile a un sistema aperto, ha suggerito di costruire, in termini schematici, un nosografismo delle malattie epatiche, in funzione della loro localizzazione a livello delle tre componenti canoniche di questo tipo di sistemi. Se si usa come elemento di riferimento la tettonica dei sistemi aperti, è possibile ricavare una classificazione 'topologica', che distingue tutta la patologia epatica in: stati di lesioni dell'intrusore, che coinvolgono le strutture venose e arteriose del tratto portale in cui scorre il sangue epatopedo in input e le strutture sinusoidali della microcircolazione intraepatica; stati di lesioni del processore, che interessano gli epatociti e le altre cellule del tessuto epatico elaboratori di materia, energia e informazioni, destinati all'automantenimento del sistema, all'omeostasi dell'organismo e alla biligenesi; stati di lesioni dell'estrusore, che riguardano soprattutto le vene sovraepatiche, il cui sangue viene esportato con flusso epatofugo nel circolo generale, e le vie biliari, deputate a drenare la bile che si forma nella rete dei canalicoli biliari nell'intestino.
a) Quadri morbosi da patologia dell'intrusore. I principali stati morbosi riferibili all'intrusore del sistema possono essere dovuti a patologie che colpiscono l'arteria epatica, la vena porta, il lago sinusoidale e lo spazio di Disse. La patologia dell'arteria epatica congenita riguarda soprattutto la displasia arteriopatica (malattia di Alagille) la quale si accompagna a scarsa presenza di dotti biliari. Altre malformazioni possono essere rappresentate dalle stenosi congenite o acquisite dell'arteria polmonare. Tipica la formazione di aneurismi o la trombosi di questa arteria. La patologia della vena porta dipende soprattutto da: anormale obliterazione delle vene vitelline; trasformazione cancerosa della vena porta; aneurismi, molto rari; dilatazione e ipertensione portale in corso di iperplasia epatocellulare nodulare rigenerativa, stimolata da vasculite della vena centrale di scarico che determina lesione ischemica secondaria e rigenerazione nodulare abnorme (i noduli autoalimentano l'ipertensione portale per compressione delle vene centrali); atresia e stenosi congenita o deviazioni del tronco portale o dei suoi rami, per effetto di masse cistiche (congenite e parassitarie) e neoplastiche occupanti spazio; occlusione della vena porta o dei suoi rami da trombosi o da infiltrazione neoplastica. È opportuno sottolineare che trombosi portale può stabilirsi spontaneamente in corso di malattie epatiche anche con grave deficit dei fattori della coagulazione per il rallentamento del flusso ematico. L'uso improprio di vitamina K, a scopo preventivo, in caso di varici esofagee e gastriche minacciose, può facilitare lo stabilirsi di trombosi in questo tronco venoso e nei suoi rami. La patologia della microcircolazione sinusoidale epatica può riguardare il lume dei sinusoidi, le cellule di sponda (o di parete) e lo spazio di Disse. Il lume dei sinusoidi può subire modificazioni e riduzioni da: coagulazione intravascolare disseminata (CID); compressione da cisti congenite o acquisite (quando sono molto numerose, la loro presenza può indurre una riduzione del letto sinusoidale così estesa da determinare ipertensione portale); compressione da masse ascessuali di natura batterica o parassitaria (amebiasi); anormali fenomeni rigenerativi o neoproduttivi di tessuto epatico, caratterizzati da iperplasia nodulare focale iatrogena, da nodulazione in corso di cirrosi, da masse occupanti spazio di natura neoplastica, dall'adenoma al carcinoma epatocellulare o da neoplasie delle vie biliari; fenomeni di fibrosi cicatriziale di natura traumatica o di derivazione necroinfiammatoria; peliosi epatica (piccole cisti ematiche distribuite in modo disordinato, isolatamente oppure in grappoli, nel parenchima epatico da uso di azotiopina, steroidi anabolizzanti, contraccettivi; le cisti ematiche sono asintomatiche ma possono rompersi). Le cellule della parete del sinusoide possono andare incontro a fenomeni patologici riferibili a: cambiamenti delle caratteristiche delle cellule endoteliali per la chiusura delle fenestrae a opera di processi infiammatori che esitano in fibrosi (questo evento blocca il passaggio di plasma tra l'interno del sinusoide e lo spazio di Disse, con susseguente abolizione degli scambi tra plasma ed epatocito nel tratto di tessuto colpito da patologia); partecipazione delle cellule macrofagiche a numerose malattie granulomatose (tra queste, la sarcoidosi, la miliare tubercolare, l'istoplasmosi, la brucellosi, la schistomatosi, la berillosi e le reazioni da farmaci, per es. sulfonamidi; la stessa patologia coinvolge anche le cellule di Ito che producono collagene). Lo spazio di Disse è esposto a patologia in dipendenza di deposizione di materiale proteico strutturato (collagene) postinfiammatorio o di materiale amorfo di origine metabolica. La deposizione di collagene a livello della faccia dissiana delle cellule endoteliali forma una neomembrana basale; questo fenomeno, detto di capillarizzazione del sinusoide, blocca la libera circolazione del sangue tra lume sinusoidale ed epatociti, perché chiude le fenestrae di queste cellule. La deposizione di amiloide, primaria, idiopatica o familiare, o secondaria a malattie croniche sistemiche o neoplastiche, determina anch'essa chiusura dei pori delle cellule endoteliali del sinusoide; l'amiloidosi, che di solito non riguarda solo lo spazio di Disse ma colpisce anche le ramificazioni dell'arteria epatica, blocca l'assorbimento e gli scambi metabolici, quindi provoca con questo meccanismo atrofia cellulare. La deposizione di mucopolissaccaridi (condroitin solfato ed eparan solfato) porta a effetti funzionali analoghi che si osservano anche nella sindrome di Hurler.
b) Quadri morbosi da patologia del processore. I quadri clinici dipendenti da patologia del processore sono riferibili soprattutto a stati anormali degli epatociti core di questa parte del sistema epatico. Le altre cellule che formano il tessuto di quest'organo, vale a dire le cellule di Kupffer (i macrofagi), le cellule di Ito e le cellule della parete dei sinusoidi, poiché esplicano attività metaboliche minori possono essere considerate cellule satelliti nel metabolismo che si attivano nel sistema. La patologia dipendente dal processore è di ordine metabolico e riguarda difetti che sono riferibili alle funzioni di deposito, interconversione e regolazione del metabolismo della materia da cui viene ricavata energia libera, e la sintesi delle proteine, di idrati di carbonio, di grassi e di determinanti biliari. Il controllo del processore si attua non solo sui processi metabolici che si svolgono nelle sostanze nutritizie di origine intestinale in arrivo al fegato attraverso il sangue portale, ma si esercita anche sul metabolismo delle proteine e degli idrati di carbonio (glicogeno) del muscolo. I quadri clinici di grave insufficienza epatica, che si verificano in corso di malattie acute dell'organo caratterizzate da ipoproteinemia, ipoglicemia, ipolipidemia (colesterolo e trigliceridi), dipendono quindi non solo da ridotta attività metabolica epatica, ma anche da difetto grave di regolazione del metabolismo muscolare. La clinica delle fasi finali delle malattie croniche vede sommarsi ai difetti metabolici che si verificano nei processi patologici acuti gravi, le conseguenze delle modificazioni della circolazione epatica, stabilite dai processi cicatriziali (fibrosi) e da quelli di nodulazione che caratterizzano la cirrosi, stato conclusivo cui giungono tutte le forme di epatopatia cronica. Gli stati patologici degli epatociti possono essere distinti in quattro categorie: disordini molecolari da stato anomalo della parte di genoma che regola la sintesi selettiva di determinate molecole; difetti singolari di processi autoconservativi della cellula epatica o incremento dell'apoptosi (morte programmata); necrosi cellulare limitata, estesa, massiva di natura virale o tossica; processi rigenerativi anormali.
1) I disordini molecolari da stato anomalo del genoma sono dipendenti da alterazioni genetiche congenite o indotte da insulti tossici, infettivi, metabolici, autoimmuni. Nella genesi di questi stati patologici possono essere implicate singole strutture molecolari dell'epatocito, che supportano i processi di captazione e internalizzazione di materia grezza, quelli di elaborazione della materia internalizzata (ivi compresa l'inattivazione delle sostanze tossiche), quelli di immagazzinamento di materia inorganica e organica e di prodotti finiti, e quelli di dismissione dei prodotti destinati all'organismo o alla formazione della bile (determinanti biliari). Il disordine genetico, congenito o acquisito, può determinare difetto o incremento della captazione, della sintesi e dello stoccaggio delle sostanze regolate dal gene difettoso. La patologia per difetto dipendente da questi disordini molecolari selettivi, congeniti o acquisiti, può riguardare soprattutto: i processi finalizzati a mantenere l'omeostasi dell'organismo (processi per la sintesi destinati a mantenere i livelli di proteine del plasma e del metabolismo dei carboidrati e delle lipoproteine; processi della detossicazione di xenobiotici e di altre sostanze nocive dell'organismo; processi diretti a smaltire materiale prodotto dal sistema oppure in transito per evitarne l'accumulo; alcuni tra questi processi sono dipendenti da eccesso di produzione della materia che si accumula) e i processi della coleresi, che sono finalizzati alla sintesi delle molecole (i determinanti) da esportare nel canalicolo per la formazione della bile. La patologia genetica o acquisita settoriale implicante lesioni selettive del fegato, quando non comporta la morte delle cellule epatiche, non si può supporre che possa accelerarne il turn over. La patologia settoriale da lesioni dipendenti da disordini genetici riguardanti il settore della produzione di molecole destinate all'omeostasi del plasma può riguardare la sintesi di proteine, di glicoproteine, di lipoproteine: tra i disordini più noti ricordiamo la sintesi di albumina (ipo- e analbuminemia) o del fibrinogeno (afibrinogenia); la sintesi di tutti i fattori della coagulazione tranne il fattore VIII e di alcuni componenti del complemento. I disordini del metabolismo dei carboidrati determinano alcune glicogenosi, fra le quali la via metabolica che concerne la produzione di prodotti intermedi, sia della sintesi sia della demolizione del glicogeno; la stessa origine disgenopatica è alla base di alcune dislipidemie in difetto e in eccesso. I difetti genetici selettivi dei processi di detossicazione procurano lesioni molecolari selettive. Tali lesioni, che portano a ridotta detossicazione di xenobiotici e a scarsa inattivazione di ormoni e di medicamenti, si possono stabilire in forma isolata per effetto di alcuni farmaci che riducono l'attività ossidativa o di coniugazione o i processi di idrossilazione. I processi idrossilativi e di coniugazione del fegato sono il principale meccanismo di inattivazione degli ormoni, la cui molecola contiene il nucleo ciclopentanofenantrenico: gli ormoni mineralcorticoidi e glucocorticoidi, il progesterone, gli estrogeni, gli androgeni. Deve essere sottolineato che la coniugazione degli ormoni steroidei avviene sia con acido glucuronico sia con acido solforico. Entrambe le coniugazioni si svolgono al fine di solubilizzare le molecole steroidee e facilitarne l'eliminazione con la bile (le molecole più grandi) o con le urine. Alterazioni di questi stessi enzimi che ossidano o coniugano o idrossilano molecole xenobiotiche lipofiliche sono state descritte in corso di alcune malattie epatiche e sempre in corso di insufficienza epatica complessiva. Tali riscontri clinici hanno portato a concludere che il fegato gioca un ruolo canonico nel limitare e nell'estinguere l'attività dei medicamenti. Questo tipo di turbe funzionali è appannaggio costante di malattie epatiche a impegno funzionale generalizzato. Anche alcune iperlipidemie familiari sono riferite a difetti dei meccanismi della traslazione di queste molecole attraverso la membrana cellulare dell'epatocito. Gli stati anomali che implicano i processi selettivi di stoccaggio delle sostanze di sintesi epatica e di metalli pesanti hanno anch'essi patogenesi molecolare. Il più comune degli stati anomali di stoccaggio è la steatosi, termine che indica l'accumulo di grassi negli epatociti. Questa condizione può manifestarsi nelle due forme micro- e macrovescicolare. Nella prima il grasso è contenuto in piccole vesciche distribuite in tutto il citoplasma dell'epatocito, senza che il nucleo venga spinto alla periferia della cellula. Si pensa che possano determinare questo quadro sostanze tossiche (per es., alcuni antibiotici, il valproato e qualche altra molecola), con attitudine a inibire la β-ossidazione mitocondriale degli acidi grassi. La steatosi è presente anche in alcune infezioni virali, per es. nell'epatite virus C correlata, e nella sindrome di Reye, in corso di gravidanza (steatosi acuta gravidica). La steatosi microvescicolare è presente in casi di emorragie profuse, ipotensione grave, pancreatite. La steatosi macrovescicolare è caratterizzata da grosse vescicole. Quando è unica e voluminosa confina il nucleo alla periferia del citoplasma cellulare, determinando il quadro di epatocito a castone. Di per sé questo tipo di deposito lipidico non ha un corrispettivo clinico. Esso è presente negli stati di cattiva nutrizione, in eccesso o in difetto, per es. nel kwashiorkor, nell'alcolismo cronico, nel diabete, nei by-pass digiunali, in corso di malattie croniche e di alcune intossicazioni e, sempre, nei casi di obesità. La steatosi può accelerare i fenomeni di morte cellulare programmata (apoptosi). Altre condizioni di accumulo di materiale nei depositi epatici sono la malattia di Gaucher (deposito di carboidrati) e di Niernan-Pick (lecitina e sfingomielina). Materiale inorganico costituito da metalli pesanti, ferro o rame, può riempire i depositi contenuti negli epatociti. Questo tipo di turba molecolare comporta necrosi epatocellulare discreta. L'emocromatosi si stabilisce per accumulo di ferro, dovuto a inappropriato assorbimento dello stesso dall'intestino. La malattia evolve in cirrosi per l'accelerato turn over epatocellulare, che provoca sia l'aumento dei fenomeni apoptotici sia l'intervento di fenomeni di necrosi, stimolati entrambi dall'azione irritante del ferro. Il rame si accumula per difetto di eliminazione da insufficiente trasporto transmembrana ATP-correlato di questo metallo pesante. Le cellule epatiche in tale malattia accumulano anche glicogeno. I difetti selettivi della produzione di determinanti la coleresi (biligenesi) riguardano i processi di produzione nell'epatocito dei determinanti biliari e il loro passaggio attraverso la membrana del canalicolo. Questo tipo di patologia è anche definita anticoleresi. I difetti che determinano anticoleresi possono essere congeniti, se dipendenti da stato anomalo del genoma, o acquisiti, se collegati a disordini molecolari riportabili all'effetto di farmaci o di sostanze tossiche. I difetti più frequenti che causano patologia della coleresi riguardano i processi di produzione della bilirubina coniugata e dei sali biliari. Nelle turbe selettive del metabolismo della bilirubina l'accumulo nel sangue oltre un certo valore soglia della bilirubina comporta colorazione gialla (ittero) della cute e delle mucose. Questa condizione può verificarsi per eccessiva produzione assoluta o relativa di bilirubina nativa non coniugata indiretta nel corso di emolisi (ittero emolitico da aumentata distruzione dei globuli rossi). Il difetto di assorbimento e incorporazione della normale bilirubina indiretta da parte dell'epatocito può essere congenito da disordine genetico, e in tal caso comporta difetto di produzione di proteine di trasporto transmembrana, o acquisito per effetto di alcuni medicamenti tendenti a interferire nei processi di internalizzazione della bilirubina indiretta. Accumulo nel sangue di bilirubina indiretta può avvenire anche per ridotta o assente attività glucuronil-transferasica, enzima che all'interno dell'epatocito coniuga la bilirubina nativa con l'acido glucuronico. Attraverso questo processo, la bilirubina nativa viene solubilizzata per essere trasferita nella bile. L'ittero emolitico caratterizzato da modesta o media persistente iperbilirubinemia indiretta è noto in clinica come sindrome di Gilbert. Carenze enzimatiche gravi danno luogo a itteri con bilirubina indiretta assai alta, tipici dell'età perinatale, noti come sindrome di Criegler-Najar di tipo I e di tipo II in funzione dell'entità del difetto enzimatico, che può giungere sino all'assenza totale, e della gravità delle conseguenze neurologiche che comporta. L'accumulo nel sangue di bilirubina coniugata (diretta) può dipendere dal difetto di escrezione del pigmento nella bile. Dopo avere riempito i depositi endocellulari, la bilirubina coniugata refluisce nel sangue provocando ittero. Questo difetto si accompagna a ridotta capacità escretiva anche delle porfirine. L'insieme dei sintomi che per la loro benignità non assumono dignità vera di malattia prende il nome di sindrome di Dubin-Johnson nei casi in cui il fegato assume colore quasi piceo per il deposito di bilirubina nelle sue cellule, aggiuntivo della capacità di trattenere nei depositi la bilirubina coniugata che non passa nella bile; si parla di sindrome di Rotor nei casi in cui il fegato presenta invece apparenza normale per il difetto. I difetti dipendenti da disordini molecolari, che portano alla riduzione, sino all'assenza, di proteine che trasportano i determinanti biliari nell'epatocito, sono responsabili di stati all'origine di alcune gravi, o meno gravi, malattie colestatiche progressive a carattere familiare. Esse iniziano nell'infanzia, terminano per grave insufficienza epatica dovuta alla necrosi epatocellulare indotta dalla lesione colestatica. La colestasi familiare di tipo I è una grave malattia colestatica dipendente dalla mutazione a livello del cromosoma 18q21-22 che regola la sintesi di P-ATPasi; questa forma è caratterizzata da bassi livelli serici di γ-glutamiltransferasi, nonostante la colestasi indotta dal deficit di trasporto di determinanti attraverso la membrana canalicolare ATP-dipendente. La colestasi familiare di tipo II è anch'essa grave malattia colestatica dipendente dalla mutazione nel cromosoma 2q24 a livello del gene che regola la sintesi di una delle sorelle delle P-glicoproteine, che è parte della funzione di trasporto transmembrana dei sali biliari; anche questa forma è caratterizzata da bassi livelli di γ-glutamiltransferasi. La colestasi familiare di tipo III è grave malattia colestatica dipendente dalla mutazione nel cromosoma 7q21 a livello del gene che regola la sintesi della 3-P-glicoproteina della resistenza multipla a medicamenti, responsabile del passaggio transmembrana canalicolare dei fosfolipidi e della bilirubina coniugata; questa forma, al contrario delle precedenti, si presenta con alti valori di γ-glutamiltransferasi nel siero. La colestasi intraepatica ricorrente è, invece, malattia colestatica benigna che si manifesta negli adulti; è stata riferita a mutazione dalla stessa regione del cromosoma 18q21-22; i difetti del trasporto di determinanti attraverso la membrana canalicolare rappresentano un legame con alcune colangiopatie.
2) L'apoptosi è un evento fisiologico programmato, collegato con l'invecchiamento e l'autoeliminazione delle cellule inefficienti e inefficaci, che può essere accelerato da riduzione distrettuale della microcircolazione, distorta da patologia che produce numerosi agenti esterni, anche non specificamente epatotossici, in grado di incrementare il fenomeno. L'abuso di sostanze che distraggono per la loro eliminazione i processi vitali dell'epatocito, anche se assunte in dosi apparentemente tollerate, accelera i normali processi addetti alla morte programmata di singole cellule o di piccoli gruppi di cellule parenchimali. Questi episodi, tuttavia, raramente ingenerano riduzione della funzione complessiva dell'organo, e ciò favorisce l'assunzione di alcune droghe con l'alibi della loro non epatotossicità.
3) L'evento accidentale catastrofico (non programmato), che porta alla distruzione improvvisa della cellula, è definito necrosi. La distruzione riguardante larghe estensioni di tessuto provoca riduzione altrettanto massiva dell'attività funzionale dell'organo. La necrosi cellulare dipende da modificazioni funzionali e strutturali non compatibili con la vita della cellula, generate dagli effetti diretti o immunomediati di agenti patogeni che giungono nell'ambiente in cui le cellule epatiche sono immerse. Agenti aggressori necrotizzanti possono essere: tossici naturali (fungini) e chimici (tra questi alcuni farmaci); anticorpi dell'autoimmunità (paradigmatica l'epatite lupoide); virus a tropismo squisitamente epatico, quali i virus dell'epatite A, B, C, E, F dal virus D (associato all'epatite B), il citomegalovirus, il virus di Epstein-Bar. Questi agenti vengono definiti epatitici per le lesioni necroinfiammatorie pauci- o multifocali o massive che generano. Queste possono autolimitarsi ed estinguersi, oppure essere rapidamente mortali (epatiti fulminanti), oppure cronicizzarsi. La distruzione diretta o immunomediata degli epatociti porta alla prevedibile conseguenza della riduzione della superficie funzionante e a stati di insufficienza funzionale complessiva di differente gravità, in relazione all'estensione della necrosi.
4) La rigenerazione, vale a dire la ricostruzione di parti estese, è un fenomeno peculiare del fegato. I meccanismi per cui quest'organo viene stimolato a riformare il tessuto perduto sono solo parzialmente noti. Il fenomeno riguarda in modo assai vistoso gli epatociti. Il suo processo di base consiste nella produzione di due cellule figlie da una cellula madre che, nel dividersi, trasmette a esse le sue caratteristiche. Il fenomeno rigenerativo è regolato da fattori che sincronizzano la proliferazione e regolano la crescita di tutti i differenti stipiti cellulari costituenti il tessuto epatico, ciascuno con la propria specializzazione funzionale. Tutte le strutture del tessuto epatico si rinnovano sostituendo le cellule vecchie o usurate grazie al controllo di questi meccanismi, che consentono la ricostruzione delle parti perdute secondo i canoni della loro architettura naturale. Il processo del ricambio cellulare avviene con ritmo lento nelle condizioni di normalità fisiologica. L'influenza di ormoni naturali oppure l'assunzione di contraccettivi è fortemente sospettata di rompere le relazioni tra i fattori di crescita e di regolazione, nonché di provocare il formarsi di alcune neoplasie benigne del fegato. Una di queste è l'adenoma epatocellulare, che insorge soprattutto in donne durante la terza e la quarta decade di vita, in particolar modo durante terapia estrogenica. Altre condizioni analoghe determinano la genesi dell'iperplasia nodulare focale, lesione solida con al centro un nucleo irritativo fibroso che si espande in forma stellata. Le proiezioni di queste formazioni contengono tra le loro propaggini, fatte di tralci di tessuto collagene, epatociti atipici senza aspetti carcinomatosi, cellule simili ai biliociti, cellule di Kupffer e cellule mononucleate infiammatorie. Anche i noduli multipli dell'iperplasia nodulare rigenerativa, che si manifesta in condizioni di infiammazione cronica da collagenopatie e in corso di neoplasie a lenta evoluzione, possono essere associati a difetti delle interrelazioni tra fattori di crescita e di regolazione anche in assenza di cirrosi. La fibrosi, la necrosi cronica, la rigenerazione nodulare e l'infiammazione sono le componenti caratterizzanti la genesi della cirrosi epatica. L'importanza della relazione tra fattori di crescita e di regolazione che assicurano la sincronia dei processi rigenerativi appare particolarmente evidente dopo estese distruzioni da parte di agenti necrotizzanti o dopo ampie resezioni chirurgiche, condizioni nelle quali gli epatociti sono chiamati a rimpiazzare velocemente le parti perdute, ripetendone la struttura.
c) Quadri morbosi dipendenti da patologia dell'estrusore. Le vene sovraepatiche, i vasi linfatici e i canali biliari sono le strutture di uscita del sangue, della linfa e della bile, che formano l'estrusore del sistema. Ciascuna di queste strutture può essere sede di patologia congenita, dipendente da disordini genetici, e acquisita, per l'effetto di tossici, di medicamenti, di agenti infettivi, di turbe del metabolismo e di fenomeni autoimmunitari. Le principali patologie del sistema venoso di scarico del fegato sono la trombosi, che oblitera il lume delle vene epatiche maggiori (sindrome di Budd-Chiari, o endoflebite epatica obliterante), e la flebosclerosi intraepatica. La trombosi ha due forme, acuta (epatomegalia improvvisa, itterigena, ascitogena rapidamente mortale) e cronica (epatomegalia e ascite graduale; edemi agli arti inferiori, decesso dopo mesi, a volte anche anni). Questo tipo di patologia, che in molti casi resta sconosciuto, si verifica: negli stati di ipercoagulabilità del sangue dovuti a difetti congeniti di inibitori della coagulazione (proteina C, proteina S, antitrombina III, fattore V Leiden); nelle malattie mieloproliferative (policitemia vera, anemia falciforme, emoglobinuria parossistica notturna); per anticorpi antifosfolipidi, ormoni sessuali femminili e gravidanza; negli ascessi epatici, nella neoplasia del fegato e del rene, nonché nell'occlusione delle venule epatiche lobulari e dei vasellini sinusoidali adiacenti loro tributari. Risparmia le vene maggiori e provoca necrosi perivenulare. La clinica di questa patologia è caratterizzata da epatomegalia da congestione, ittero e ascite. La flebosclerosi intraepatica consiste in un indurimento fibroso delle vene centrali, criptogenetico o da tossici. A proposito della patologia dell'estrusore linfatico, bisogna ricordare che la parte plasmatica del sangue, dopo essere passata attraverso i pori delle cellule sinusoidali nello spazio di Disse, scorre verso la porta hepatis per poi uscire dal fegato incanalata nei vasi linfatici che percorrono gli spazi portali diretti verso i linfonodi dell'ilo epatico. Da qui tale fluido, assunto il nome di linfa, viene immesso da vasi linfatici nella cisterna magna e dal dotto toracico nel circolo generale. Dal momento che con questo meccanismo il fegato forma più del 50% della linfa totale dell'organismo, si comprende perché l'aumento della pressione nei sinusoidi indotto da invasione dei linfonodi ilari ingeneri un aumento di produzione di linfa, che trasuda dai dotti linfatici e si raccoglie nel cavo addominale. Il flusso linfatico che dal fegato, attraversato l'ilo epatico, si dirige verso la cisterna magna, è inferiore a 1ml/min. Il fatto che i vasi linfatici epatofughi del fegato si anastomizzano con quelli pleurici spiega la formazione di versamento pleurico destro quando il flusso linfatico verso la cisterna magna viene ostacolato. La patologia dell'estrusore biliare può riguardare ogni punto della complessa rete che inizia a livello del lume dei canalicoli ricavati dall'introflessione della membrana apicale dell'epatocito alla papilla di Vater. Poiché la vescichetta biliare, detta anche colecisti, è un'estroflessione di questa rete con funzione di deposito, le sue malattie sono comprese nella patologia della struttura di uscita biliare del sistema epatico (v. colecisti). La colestasi è la sindrome dominante della parte duttale dell'estrusore biliare. Si tratta di un complesso di sintomi clinici e di segni biochimici derivanti dalla riduzione del flusso biliare impedito da ostacoli congeniti acquisiti che chiudono o riducono il lume delle vie biliari. Va ricordato che con il termine colestasi si intende la patologia dipendente dalla riduzione e dal ristagno epatico del deflusso del fluido biliare che si forma e si completa nel lume del canalicolo con l'arrivo dei determinanti biliari. I difetti di formazione e completamento della composizione di questo fluido biologico, che possono ridurre il suo volume globale, dipendenti da deficit di produzione da parte dell'epatocito o da impedito arrivo per blocco del passaggio transmembrana apicale di qualche determinante biliare, prendono il nome di anticoleresi. In altre parole, con il termine anticoleresi si intendono definire tutti i difetti della secrezione biliare (epatocitodipendenti); con il termine colestasi tutti i difetti dell'escrezione biliare, ossia i difetti dell'espulsione di questo fluido dalla bile. Poiché l'ostruzione o la stenosi possono verificarsi in ogni punto della rete canalare biliare, un'utile distinzione clinica divide le colestasi dipendenti da ostruzione della parte dell'albero biliare a locazione intraepatica dalle colestasi da ostruzione extraepatica dei grandi dotti biliari terminali di uscita. Deve essere sottolineato che la patologia dei grossi tronchi di uscita, per continuità, tende a estendersi seguendo il senso ascendente verso la rete intraepatica. La colestasi da lesione intraepatica congenita più frequente è determinata dai seguenti quadri anatomoclinici: sindrome da povertà intraepatica di dotti biliari; sindrome da vanishing bile ductules; dilatazione cistica delle radici intraepatiche (malattia di Caroli), spesso complicate da calcolosi intracistica. La colestasi da lesione extraepatica congenita più nota è l'atresia o ipoplasia delle vie biliari maggiori. Il quadro più frequente di colestasi da lesione intraepatica acquisita è la cirrosi biliare primitiva, malattia di natura ignota, insorgente con la distruzione progressiva dei duttuli biliari indotta da un'infiammazione florida, seguita da una proliferazione molto attiva di queste strutture e dalla diffusione dell'infiammazione nel parenchima periportale. Segue fibrosi porto-portale che conduce allo stadio finale di cirrosi. I quadri più frequenti di colestasi extraepatica acquisita sono: la sindrome epatitica neonatale a cellule giganti; l'atresia delle vie biliari da sclerosi progressiva di grandi dotti epatici che si stabilisce poche settimane dopo la nascita a seguito di infezione ignota (virus?); la colangite sclerosante, affezione cronica caratterizzata da infiammazione dei dotti extraepatici che si propaga ai dotti intraepatici con attitudine a indurre stenosi nonché, eventualmente, chiusura dei dotti colpiti ed esita in cirrosi (la sua eziologia è sconosciuta: sono stati ipotizzati come agenti causali alcuni tossici, farmaci e fenomeni di autoimmunità); infezioni batteriche, acute e ricorrenti come complicanza e più comuni della colestasi meccanica, oppure da ampia apertura della papilla di Vater a seguito di papillotomia chirurgica (endoscopica); la calcolosi duttale come più frequente causa di ostruzione delle vie biliari extraepatiche; le neoplasie primitive e secondarie intrinseche ed estrinseche con attitudine a occludere per compressione o invadere la via biliare con cui contraggono rapporto; l'infiammazione della papilla di Vater (papillite vateriana); tutti i tumori che metastatizzano nei linfonodi ilari. Si possono considerare stretture dell'estrusore così importanti da determinare colestasi anche gli esiti cicatriziali di erosioni dei dotti dovute a calcoli e le cisti del coledoco. La pancreatite acuta e i suoi esiti cicatriziali e cistici possono determinare stretture del coledoco intrapancreatico, che possono diventare così gravi da provocare il blocco totale del flusso biliare. Le neoplasie, possibile causa di occlusione delle vie biliari, sono il colangiocarcinoma, le neoplasie coledociche della papilla di Vater e dei grossi dotti biliari intraepatici, il tumore della testa del pancreas, l'epatocarcinoma. La colestasi acquisita, come le infiammazioni o le patologie a lungo decorso che colpiscono le strutture del tessuto epatico colpite, evolve verso la cirrosi (biliare) secondaria (v. cirrosi).
Bibliografia
I.M. Ariaset al., The liver: biology and pathophysiology, New York, Raven Press, 19882.
A companion to medical studies, 1° vol., ed. R. Passmore, J.S. Robson, Oxford-Edinburgh, Blackwell, 1968.
C. Couinaud, Le foie. Études anatomiques et chirurgicales, Paris, Masson, 1957.
N. Dioguardi, Il fegato: un sistema aperto, Milano, Masson, 1984.
Harrison's principles of internal medicine, ed. A. Fauci et al., New York, McGraw-Hill, 199814.
E.R. Schiff, Update in hepatology, "Annals of Internal Medicine", 1999, 130, 1, pp. 52-57.
L. S. Schiff, E.R. Schiff, Diseases of the liver, Philadelphia, Lippincot, 19876.
S. Sherlock, Diseases of the liver and biliary system, Oxford, Blackwell, 19898.
R. Wright et al., Liver and biliary disease: pathophysiology, diagnosis, management, Philadelphia, Saunders, 19852.