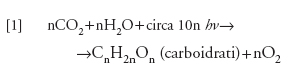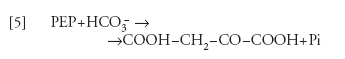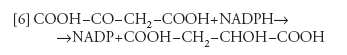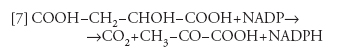Fotosintesi
Fotosintesi
La fotosintesi clorofilliana è un fenomeno fisico e chimico col quale le piante verdi e i batteri fotosintetici convertono l'energia delle radiazioni elettromagnetiche (la luce del Sole) nell'energia di legame dei composti chimici che si formano. Essa provoca un aumento dell'energia libera nella biosfera e una diminuzione di entropia, al contrario di quanto avviene in tutte le altre trasformazioni naturali dove l'energia libera può essere solo degradata e l'entropia solo aumentata, come prescrive il secondo principio della termodinamica. Dal punto di vista fisiologico, la fotosintesi è alla base della nutrizione e della crescita delle piante, degli animali e dei batteri: infatti ogni sostanza organica è prodotta mediante fotosintesi a partire dall'anidride carbonica presente nell'aria e dall'acqua con l'apporto dell'energia solare, secondo l'equazione:
formula
dove hν rappresenta il quanto di energia.
Tramite la catena alimentare queste sostanze sono poi distribuite tra tutti i viventi. La respirazione e le fermentazioni degli organismi degradano le sostanze organiche, producendo CO2 e H2O e aumentando l'entropia globale della biosfera. La respirazione cellulare ossida le sostanze organiche consumando l'ossigeno (O2) dell'aria, secondo l'equazione generale:
[2] formula
La [1] descrive il processo globale della 'fotosintesi ossigenica', propria delle piante verdi, ossia tutte le piante terrestri, le alghe verdi unicellulari e i cianobatteri. La [2], invece, descrive, in maniera globale, la respirazione cellulare di tutti gli organismi nel caso in cui gli idrati di carbonio costituiscano il substrato respiratorio. Le due reazioni sono irreversibili a causa della grande perdita di energia libera che comportano.
Tutti questi processi, quindi, costituiscono un sistema omeostatico che regola, diversamente, la composizione dell'atmosfera: la CO2 rappresenta lo 0,036% (in volume) dell'atmosfera, mentre l'O2 ne rappresenta il 20,78%. La diversa concentrazione dei due gas (dal momento che tutto l'O2 presente proviene dalla fotosintesi e in essa il rapporto CO2−O2 è uguale a 1) è spiegata dalla loro diversa solubilità nelle acque degli oceani (la CO2, in equilibrio con HCO3−, è circa 25 volte più solubile in acqua dell'O2), dall'accumulo avvenuto nei giacimenti fossili in oltre 3 miliardi di anni di attività fotosintetica, e dalla grande quantità di CO2 che si è fissata nelle rocce contenenti carbonati. Le combustioni dovute alle attività industriali dell'uomo, che hanno conosciuto un forte incremento nel corso del XX sec., e la diminuzione delle foreste, sono in parte responsabili dell'aumento della CO2 atmosferica.
Oltre alla fotosintesi ossigenica [1], esiste anche la cosiddetta 'fotosintesi anossigenica', propria dei batteri fotosintetici, che non utilizza l'acqua come donatore di elettroni per ridurre la CO2, ma sostanze minerali od organiche presenti nell'ambiente o anche prodotti dal metabolismo delle stesse cellule. Poiché questi donatori sono tutti a potenziale elettrochimico più negativo (più basso) di quello dell'H2O, la fotosintesi anossigenica richiede meno energia e utilizza regioni dello spettro solare differenti rispetto a quella ossigenica. La [3] è l'equazione generale della fotosintesi anossigenica, assumendo che la sostanza organica prodotta sia al livello redox di uno zucchero:
[3] formula
dove con XH2 si indica un qualsiasi donatore di 2 elettroni.
La fotosintesi è un processo di ossidoriduzione
Le equazioni [1] e [3] mostrano come la fotosintesi sia un processo di ossidoriduzione, in cui un riducente debole (l'acqua nella fotosintesi ossigenica, un diverso donatore di elettroni in quella anossigenica) viene utilizzato per ridurre la CO2 a zuccheri e altre sostanze organiche, contro il gradiente termodinamico. Il processo descritto dall'equazione [1] avviene in molte tappe e comporta un lavoro elettrochimico di circa 1,37 eV, dal potenziale normale di 0,81 V della coppia H2O/0,5 O2, a quello di −0,56 V della coppia 3-fosfogliceraldeide/acido3-fosfoglicerico, il primo zucchero prodotto nel ciclo di reazioni di riduzione della CO2 nelle 'piante C3', così dette perché assimilano la CO2 attraverso il ciclo di Calvin-Benson in cui uno zucchero a 3 atomi di carbonio è il primo prodotto dell'assimilazione di CO2. La differenza di potenziale dei primi prodotti delle reazioni fotochimiche 'primarie' è tuttavia molto maggiore di 1,36 eV, e corrisponde a una maggiore efficienza di utilizzazione dell'energia dei quanti di luce. Tuttavia, a causa della bassa efficienza della sequenza di reazioni chimiche (catalizzate da trasportatori di elettroni e da enzimi) che seguono alle reazioni fotochimiche primarie, il rendimento complessivo del processo dell'assimilazione della CO2 è assai basso. Il numero di quanti di energia hν è di circa 10 per molecola di CO2 ridotta a zucchero secondo la [1] nelle condizioni ottimali, che di rado sono realizzate in natura. Il rendimento complessivo, se si considera la luce rossa di lunghezza d'onda λ di 680 nm ‒ la λ corrispondente al massimo di assorbimento delle foglie nella regione rossa dello spettro ‒ è dunque di 0,32, e assai meno se si considerano i valori di hν delle radiazioni effettivamente assorbite, tutte nella regione visibile dello spettro, tra λ=400 e λ=710 nm.
Le strutture supermolecolari in cui avviene la fotosintesi
La fotosintesi ossigenica si svolge nel cloroplasto; negli anni Sessanta è stato dimostrato che i cloroplasti isolati intatti dalle foglie sono capaci di fotosintesi completa a velocità ed efficienza comparabili con quelle della foglia. Negli eucarioti fotosintetici il cloroplasto è dunque autosufficiente per la fotosintesi, ed esporta i suoi prodotti nel citoplasma delle cellule. Tuttavia, gli scambi di metaboliti con il citoplasma solubile e i mitocondri avvengono di continuo e sono di rilevante importanza per la fotosintesi, soprattutto durante la transizione buio-luce. I cloroplasti sono immersi nel citoplasma della cellula verde e da esso separati da una doppia membrana, la parte interna della quale contiene gli specifici trasportatori per i prodotti della fotosintesi che vengono 'esportati' nel citoplasma e per le sostanze necessarie alla fotosintesi 'importate', come H2O, fosfato inorganico (Pi) e CO2. All'interno della doppia membrana si trova una fase, detta 'stroma', una densa soluzione proteica contenente tutti gli enzimi responsabili del metabolismo fotosintetico del carbonio, dalla fissazione della CO2 alla sua riduzione e alla sintesi dell'amido. Nello stroma si trovano anche il DNA del cloroplasto e l'insieme degli enzimi e delle strutture necessarie alla duplicazione, alla trascrizione e alla traduzione del DNA. Tuttavia, una parte delle proteine del cloroplasto sono codificate nel nucleo della cellula e vengono sintetizzate nel citoplasma, per essere poi trasferite nel cloroplasto. Il cloroplasto ha dunque continuità genetica, ma non è autosufficiente per la propria riproduzione.
Immerse nello stroma si trovano le membrane fotosintetiche, i 'tilacoidi' o 'lamelle', che costituiscono un sistema di membrane delimitanti un unico spazio interno, detto 'lumen'. I tilacoidi sono membrane lipoproteiche dello spessore di circa 70 Å, e contengono tutti i pigmenti fotosintetici adibiti all'assorbimento della luce e alle reazioni fotochimiche e i trasportatori di elettroni. I pigmenti sono legati stabilmente, anche se non covalentemente, a specifiche proteine all'interno di complessi macromolecolari. Sono inoltre proteine integrali dei tilacoidi quelle del complesso citocromo b6-f, trasportatore di elettroni essenziale nella fotosintesi. Infine, legato ai tilacoidi è il complesso dell'ATPsintasi-ATPasi, costituito da una parte, detta CF0, che è fortemente lipofilica e che consiste di numerosi polipeptidi che attraversano la membrana; e da una parte che sporge dalla superficie stromatica detta CF1. Il CF1 è legato a CF0, e il loro complesso ha la specifica funzione di sintetizzare l'ATP da ADP e ortofosfato inorganico, utilizzando l'energia del potenziale elettrochimico dei protoni generato attraverso la membrana dalle due reazioni fotochimiche e dal trasporto di elettroni tra i due fotosistemi. Inoltre, nei tilacoidi sono contenute molecole liposolubili quali i plastochinoni, simili agli ubichinoni dei mitocondri, che possono diffondere nel piano della membrana e hanno una funzione essenziale nel trasporto di elettroni. I tilacoidi costituiscono un'unica membrana, a tratti ripiegata su sé stessa a costituire zone (grana) in cui molte membrane sono appressate tra loro. I numerosi grana di un cloroplasto sono collegati da tratti più o meno lunghi di membrane non appressate, denominate 'lamelle (o tilacoidi) stromatiche'.
Assorbimento della luce e reazioni fotochimiche primarie
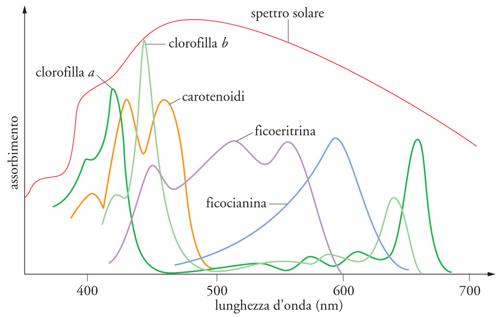
Se seguiamo il processo fotosintetico nella successione dei suoi eventi, il primo di questi è l'interazione dei fotoni con le molecole di pigmenti. La frazione di luce incidente assorbita dipende dalla lunghezza d'onda della luce, dalla struttura molecolare dei pigmenti, dalla loro concentrazione e, infine, dallo spessore dello strato su cui sono disposti. La fig. 3 mostra lo spettro della luce solare che raggiunge la biosfera e gli spettri di assorbimento (in solventi organici) dei differenti pigmenti fotosintetici presenti nei tilacoidi dei diversi organismi, procarioti ed eucarioti. Mentre la fotosintesi ossigenica delle piante verdi e dei cianobatteri (in cui i pigmenti sono le clorofille a e b e la ficocianina) utilizza la regione visibile dello spettro solare, la fotosintesi anossigenica utilizza radiazioni nel vicino ultravioletto e nel vicino infrarosso. Il loro 'spettro d'azione' è dunque molto diverso, per cui i cianobatteri e le alghe verdi possono convivere nello stesso ambiente acquatico senza competere tra loro per l'energia disponibile.
L'assorbimento di un fotone da parte di una molecola porta quest'ultima a uno stato elettronico eccitato, che rappresenta l'incorporazione dell'energia del fotone nella molecola, e consiste nel passaggio di un elettrone a un orbitale a energia maggiore di quello dello 'stato fondamentale' ‒ normalmente occupato in assenza di assorbimento di luce, alla stessa temperatura. Molecole complesse, come le clorofille, hanno diversi picchi di assorbimento, corrispondenti a diversi oscillatori: in particolare le clorofille a e b assorbono luce blu e rossa (fig. 3), con picchi rispettivamente a 447 nm e 663 nm per la clorofilla a, e 470 nm e 645 nm per la clorofilla b (nei solventi organici). Gli spettri di assorbimento sono spostati verso il rosso in vivo, perché le clorofille sono sempre legate a proteine, in complessi in cui numerose clorofille sono legate, non covalentemente, a un polipeptide.
I pigmenti fotosintetici hanno due funzioni distinte: l'assorbimento della luce su vasta superficie nei tilacoidi, dove essi sono contenuti sotto forma di complessi con specifiche proteine (funzione di 'antenna'); la reazione fotochimica primaria, che avviene al 'centro di reazione' (CR) e consiste nel trasferimento di un elettrone da una molecola di clorofilla eccitata (allo stato di singoletto) a un accettore, la cui natura è diversa nelle due reazioni fotochimiche della fotosintesi ossigenica. La reazione fotochimica primaria genera un accettore ridotto e la formazione di una clorofilla (correntemente indicata come P, che sta per 'pigmento') con una carica positiva che è un radicale (a potenziale redox molto alto), avendo perso un solo elettrone. Un donatore di elettroni riduce il P+ del CR, che ritorna allo stato iniziale, mentre il donatore viene ossidato. La reazione fotochimica primaria produce così una separazione di cariche elettriche:
[4] formula
dove D è il donatore e A l'accettore di elettroni; P il pigmento allo stato fondamentale e P* allo stato eccitato; hν è il quanto di energia trasferito dall'antenna, o assorbito direttamente. Nella fotosintesi ossigenica P è sempre una molecola di Chla, e in quella anossigenica sempre batterioclorofilla a. Il donatore e l'accettore stanno il primo vicino alla superficie interna (lumenale) e il secondo alla superficie esterna (stromatica) dei tilacoidi, quindi la separazione di cariche ha come conseguenza quella di creare una differenza di potenziale attraverso la membrana. L'assorbimento della luce produce lo stato di singoletto eccitato delle clorofille, e lo stato di eccitazione migra molto velocemente da molecola a molecola, fino ad arrivare alla clorofilla del CR, dove viene utilizzato per la reazione fotochimica primaria. L'insieme di antenna e CR viene chiamato fotosistema (PS). Le dimensioni dell'antenna possono variare in funzione delle condizioni di crescita delle piante, e tuttavia si osservano di solito nelle piante verdi circa 250-300 molecole di pigmenti-antenna per ogni CR.
La separazione di carica, dunque, rappresenta la conversione dell'energia del fotone in energia di potenziale redox ‒ nella misura in cui l'accettore ha potenziale più negativo del donatore ‒ e in energia di potenziale di membrana ‒ in quanto la superficie esterna delle membrane si carica negativamente e quella interna positivamente, e le membrane sono intrinsecamente impermeabili alle specie cariche. Le reazioni fotochimiche hanno rendimenti quantici (rapporto tra fotoni assorbiti ed elettroni trasferiti) vicini all'unità. La separazione di cariche che ne risulta avviene in tempi da 1 a 3 ps. Il CR converte l'energia dei fotoni solo se si trova nello stato 'aperto', cioè quando P è legato a un accettore ossidato e a un donatore ridotto: occorre quindi che A− e D+ [4] vengano, rispettivamente, ossidati e ridotti dai successivi eventi di trasporto di elettroni. Mentre le reazioni fotochimiche primarie avvengono in picosecondi, le successive reazioni di trasporto di elettroni sono molto più lente, e ancor più lente sono le reazioni enzimatiche necessarie all'assimilazione della CO2. Questi eventi, oramai ben stabiliti, sono alla base dell'osservazione di Robert Emerson e William Arnold (1932) che ha portato al concetto di unità fotosintetica. Misurando, nell'alga verde Chlorella, l'evoluzione dell'O2 con lampi di luce di intensità saturante e della durata di pochi μs, l'O2 evoluto/lampo era massimo solo se i lampi erano distanziati l'uno dall'altro da un periodo buio non inferiore di 20 ms. È questo il tempo richiesto per la riossidazione degli accettori e la riduzione dei donatori di elettroni delle reazioni fotochimiche. Nelle loro condizioni, Emerson e Arnold hanno trovato che l'unità fotosintetica, cioè l'insieme di pigmenti e di tutti gli altri effettori della fotosintesi (allora totalmente sconosciuti), era di 2400 molecole di clorofilla/O2 prodotto.
Fotosintesi ossigenica
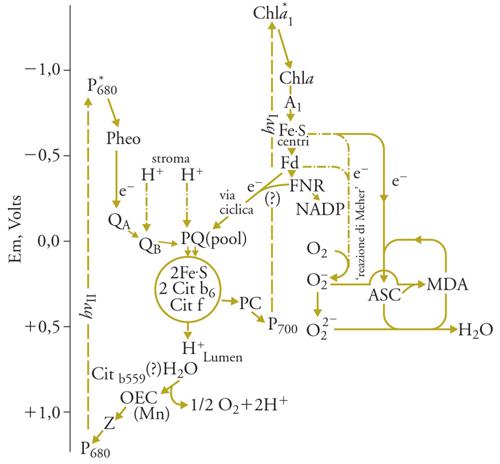
Nella fotosintesi ossigenica il trasporto di elettroni dall'H2O all'NADP (nicotinammideadenindinucleotide-2-fosfato) avviene attraverso due reazioni fotochimiche 'in serie', collegate da una catena di trasportatori che ossida il riducente primario prodotto dall'ossidazione dell'H2O da parte del fotosistema II (PS II) e riduce il CR+ (Chla1+) del fotosistema I (PS I). Al lato riducente del PS I, una serie di trasportatori riduce l'NADP, che è in soluzione nello stroma, o, alternativamente, l'ossigeno. Uno schema aggiornato del trasporto di elettroni fotosintetico è rappresentato nella fig. 4. Il PS II è costituito da un grosso complesso di molte proteine, che è stato recentemente cristallizzato e la sua struttura studiata mediante la diffrazione dei raggi X, alla risoluzione di 3,5 Å. Il PS II ossida l'H2O riducendo una molecola di feofitina (Pheo) facente parte del CR. L'ossidante primario prodotto dalla reazione fotochimica in pochi picosecondi è una molecola di Chla+ (chiamata anche P680 perché la sua ossidazione può esser misurata dalla diminuzione di assorbanza a 680 nm). La reazione fotochimica primaria, sia nel PS II che nel PS I, ha un rendimento quantico vicino all'unità. P+680 viene ridotto in poche decine di nanosecondi da una tirosina della proteina a cui è legato.
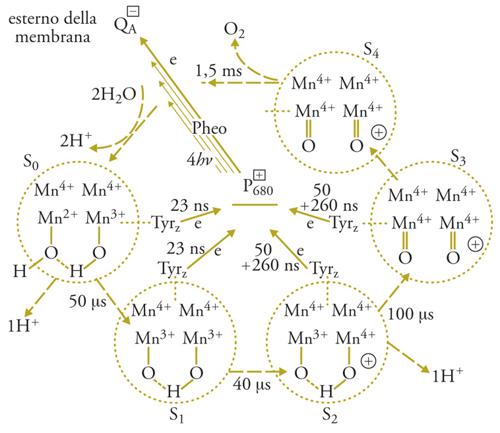
Il trasporto di elettroni tra la tirosina+ e l'H2O avviene tramite 4 atomi di Mn, che fanno parte del PS II e legano 2 molecole di H2O. Durante il ciclo catalitico gli stati di ossidazione del Mn sono inizialmente, al buio, Mn2+ (1 solo dei 4 atomi), Mn3+ (1 atomo) e Mn4+ (2 atomi). Allo stato di massima ossidazione del complesso, ottenuto con 4 successivi lampi di luce, tutti gli atomi di Mn sono allo stato di Mn4+, e un'ulteriore carica positiva rende il complesso (Em>1,1V) capace di ossidare le due molecole di H2O legate e di liberare l'O2, ritornando allo stato iniziale; nello stesso tempo si riversano nel lumen 4 H+.. Il ciclo completo avviene in circa 1,5 ms. L'ossidazione del Mn si attua asportando un elettrone alla volta dal complesso, come si è potuto osservare usando lampi di luce saturanti della durata di 1 ns, separati da intervalli al buio di decine di ms. I diversi stati di ossidazione dei componenti il sistema sono osservabili con metodi spettroscopici, e sono necessari 4 lampi per liberare una molecola di O2 partendo dal sistema adattato al buio. Questa scoperta dimostra in modo definitivo che l'ossidazione fotosintetica dell'acqua richiede l'accumulo di 4 cariche positive all'estremità ossidante del PS II e che l'ossigeno atomico non è un intermediario del processo. Prima della scoperta dei singoli passi dell'ossidazione dell'H2O, era stata scoperta la periodicità di 4 nella liberazione di O2 da parte del PS II. La fig. 5 riassume il ciclo catalitico del PS II, che porta all'ossidazione dell'acqua e alla riduzione del chinone QA.
Al lato riducente del PS II, la sequenza di trasportatori consta di una molecola di feofitina, quasi isoenergetica con la Chla2 e legata alla stessa proteina D2; segue il plastochinone QA, legato a D2, che accetta un solo elettrone in meno di 1 ns e ha un Em di circa −0,120 V. Questi componenti sono in prossimità della superficie esterna (stromale) dei tilacoidi, che si carica negativamente, mentre una carica positiva si forma sulla superficie interna (lumenale). QA− è riossidato da una molecola di plastochinone (QB, fig. 4) diffusibile nella membrana, che si lega in stretta prossimità di QA alla proteina D1 e riceve 2 elettroni, in due tappe, diventando QB2−. Questo si protona prelevando 2H+ dallo stroma. La costante di dissociazione di QBH2 da D1 è molto più alta di quella di QB, quindi il QBH2 si dissocia, e diffonde lateralmente e trasversalmente nella membrana. Il QBH2 viene riossidato dal citocromo b6−f, un grosso complesso macromolecolare di membrana che contiene una ferro-solfo proteina, detta proteina di Rieske, due molecole di un citocromo del gruppo b, il cit b6, e un citocromo del gruppo c, detto 'cit f'. La via degli elettroni è qui assai complessa: il PQH2 viene ossidato al sito Qo del complesso (vicino alla superficie lumenale della membrana), trasferendo un elettrone al Fe3+ della proteina di Rieske e uno a quello del cit b a basso potenziale (cit bl). La proteina di Rieske viene rapidamente riossidata dal cit f, il cui gruppo eminico sporge nel lumen dei tilacoidi. Due protoni vengono simultaneamente scaricati nel lumen, e il PQ lascia il sito Qo. Il cit bl ridotto (Fe2+) viene riossidato dal cit bh al sito Qi (vicino alla superficie esterna della membrana) e una seconda molecola di PQH2 si lega al sito Qo e percorre la stessa sequenza di reazioni. Una molecola di PQ si lega al sito Qi e qui viene ridotta in due tempi a PQH2 dal cit bhFe2+. PQH2 si dissocia dal sito. Riossidandosi al sito Qo, questo PQH2 porta a 6 il numero dei protoni scaricati nel lumen durante l'ossidazione di due molecole di PQH2, secondo il cosiddetto ciclo di Mitchell, l'autore che lo descrisse nell'analogo complesso cit1bc1 dei mitocondri, prima che se ne avesse la dimostrazione sperimentale.
La riossidazione del cit f avviene per opera di una piccola proteina a rame, la plastocianina (PC), che è in soluzione nel lumen e trasferisce un elettrone alla volta dal cit1f al CR ossidato (Chla1+, o P700) del PS I. Al lato riducente di PS I (dove la separazione di carica avviene più rapidamente che nel PS II in 1 ps), la serie di trasportatori di elettroni sono, nell'ordine: 1 Chla, 1 molecola di fillochinone, 3 centri Fe-S (tutti legati nel complesso macromolecolare del PS I), e infine la ferredossina, una piccola ferro-solfo proteina in soluzione nello stroma che trasporta 1 solo elettrone e si lega reversibilmente al PS I, dove viene ridotta. Nella forma ridotta diffonde e trasferisce gli elettroni a una flavoproteina contenente FAD legata alla superficie esterna dei tilacoidi, che infine riduce l'NADP, in soluzione nello stroma. Complessivamente si ha dunque il trasporto di due elettroni dall'H2O all'NADP con un guadagno di potenziale elettrochimico di 1,13 eV. Accoppiato al trasporto di elettroni si ha il trasporto vettoriale, dallo stroma al lumen dei tilacoidi, di 4 o, se funziona il ciclo di Mitchell, 6 protoni. Dal momento che la membrana è impermeabile ai protoni (e a qualsiasi sostanza carica), si genera così un potenziale elettrochimico dei protoni (Δp), dato dalla differenza di pH ai due lati della membrana (ΔpH) e dalla differenza di cariche elettriche complessive (Δφ); le due reazioni fotochimiche primarie, infatti, generano una separazione di cariche, positive sul lato lumenale e negative su quello stromatico. La somma di ΔpH e Δφ, indicata con Δp, può raggiungere a luce intensa il valore di oltre 200 mV; nello stato stazionario è molto più bassa, perché continuamente utilizzata per la sintesi dell'ATP, che comporta la fuoruscita di protoni attraverso l'ATPsintasi.
La sintesi di ATP 'accoppiata' al trasporto di elettroni attraverso il Δp è catalizzata dal complesso denominato ATPsintasi, costituito da polipeptidi idrofobici che attraversano la membrana (detti complessivamente CF0), e da 5 polipeptidi che, legati a CF0, protrudono nello stroma dalla superficie esterna dei tilacoidi (CF1). Il sito catalitico è in CF1, lega ADP e ortofosfato inorganico (Pi), presenti nello stroma, e riversa nello stroma l'ATP formato. L'enzima attivo consiste in un trimero di composizione in subunità 3α, 3β, 1γ, 1δ, 1ε, ed è sostenuto da un supporto proteico. La sintesi dell'ATP avviene per rotazione (legata a cambiamenti di conformazione dovuti al trasferimento dei protoni) del CF1 sull'asse che lo lega a CF0, e a ogni giro completo vengono formate 3 molecole di ATP ed estrusi 9 H+ nello stroma. L'ATPsintasi, quasi identica a quella dei mitocondri e a quella batterica di Escherichia coli, è stata cristallizzata e il suo meccanismo d'azione messo in relazione alla struttura dettagliata quale appare dall'analisi dei cristalli.
Se tutte le molecole di PQH2 ossidate dal complesso cit b6−f dessero luogo al ciclo di Mitchell, si avrebbero 6 H+ trasportati nel lumen per ogni NADPH prodotto, quindi la possibilità di sintetizzare 2 molecole di ATP, essendo il rapporto ATP/H+ uguale a 1/3. Tuttavia, o perché una parte dei PQH2 non dà luogo al ciclo di Mitchell, o perché si possono avere perdite di H+, i migliori dati disponibili al momento indicano che il rapporto ATP/NADPH nel trasporto di elettroni fotosintetico è uguale a 1. Dal momento che l'assimilazione di CO2 nel ciclo di Calvin richiede 3 ATP e 2 NADPH per ogni molecola di CO2 ridotta (nel ciclo di Calvin-Benson), è ovvio che la sintesi del terzo ATP deve essere accoppiata a un trasporto di elettroni alternativo alla riduzione di NADP. Infatti, nelle piante superiori si osserva la riduzione di O2 all'estremità riducente del PS I (reazione di Mehler), che produce il radicale O2−, il quale ossida l'acido ascorbico (sempre presente nei cloroplasti) ad acido monodeidroascorbico (MDA), un radicale libero che viene ridotto dal PS I a velocità comparabile alla riduzione di NADP. 2O2−, per azione di una superossidodismutasi, producono H2O2 e O2, e la ascorbicoperossidasi riproduce MDA da acido ascorbico (ASC) e H2O2.
Il trasporto di elettroni dall'H2O all'MDA è identico, fino all'estremità riducente del PS I, a quello che porta alla riduzione dell'NADP (fig. 4), ed è accoppiato alla sintesi di ATP con la stessa stechiometria ATP/elettroni trasportati. Nella fotosintesi nello stato stazionario si ha un costante consumo di O2 nei cloroplasti dovuto alla reazione di Mehler, nella misura del 20-25% circa degli elettroni utilizzati per la riduzione dell'NADP. La distribuzione degli elettroni tra l'NADP e l'O2-MDA è regolata dal rapporto ATP/NADPH: quando manca l'ATP necessario alla formazione del 1,3-bis-trifosfoglicerato ‒ il composto che viene ridotto dall'NADPH nel ciclo di Calvin-Benson ‒ non si rigenera l'NADP e il PS I riduce l'O2-MDA. La sintesi di ATP che ne consegue riattiva l'assimilazione di CO2 e la rigenerazione di NADP, consentendo così la ripresa della riduzione di quest'ultimo.
Un altro sistema di trasporto di elettroni, il trasporto ciclico intorno al PS I, può generare ATP, senza evoluzione di O2 e senza riduzione di NADP: questo processo, simile a quello che avviene nella fotosintesi anossigenica dove c'è un solo fotosistema, funziona nelle piante superiori solo in condizioni di stress, quando PS II è inattivo, e utilizza la sola luce assorbita dal PS I, dissipando tutta quella assorbita dal PS II. Nell'alga verde unicellulare Chlamydomonas reinhardtii la fotosintesi ossigenica si interrompe in particolari condizioni fisiologiche, e oltre l'80% dell'antenna di PS II si sposta per diffusione laterale nei tilacoidi al PS I: in queste condizioni (dette 'stato 2') solo il PS I funziona, e si osserva il trasporto ciclico di elettroni intorno a esso con produzione di solo ATP e non assimilazione di CO2. Questa situazione è reversibile in presenza di O2, che consente la fotoriossidazione del PQH2 da parte del PS I (reazione di Mehler). Questo organismo ‒ e forse altre alghe unicellulari ‒ ritorna dunque in particolari condizioni (come la mancanza di ossigeno), reversibilmente, al trasporto di elettroni ciclico intorno al PS I simile a quello dei procarioti fotosintetici.
==Organicazione e assimilazione della CO2==
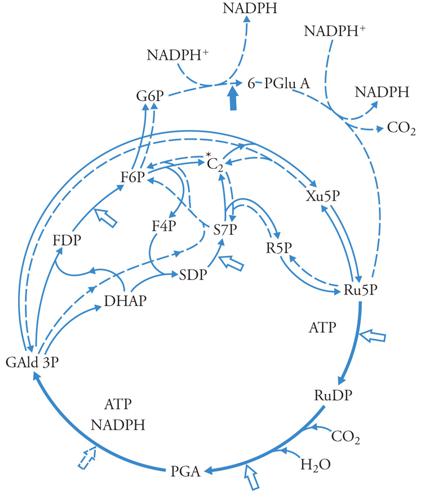
La fissazione della CO2 in un composto organico e la sua riduzione a 3-fosfogliceraldeide (3 GAP) avvengono nello stroma del cloroplasto attraverso la sequenza di reazioni del ciclo di Calvin-Benson, rappresentato nella fig. 6. La CO2 viene legata al ribulosio-1,5-bisfosfato (Ru1,5bisP o RuDP) per la catalisi dell'enzima ribulosio-1,5-bisfosfatocarbossilasi, producendo 2 molecole di acido 3-fosfoglicerico (3PGA) che viene fosforilato dall'ATP e ridotto dall'NADPH a 3GAP, ADP e Pi. Il ciclo, ogni tre giri, rigenera il Ru1,5bisP e una molecola di trioso fosfato, 3GAP, nonché il diossiacetonfosfato (DOAP) nelle proporzioni molto vicine all'equilibrio termodinamico tra i due, di circa 20/1 a favore del chetoso, a 27°C. Percorrendo in senso gluconeogenetico le reazioni della glicolisi, nel cloroplasto si osserva la sintesi di amido, che può venire esportato dopo fosforolisi o idrolisi.
Sulla membrana interna del cloroplasto esiste un trasportatore specifico per 3GAP o DOAP in scambio contro Pi. Questo trasportatore è responsabile dell'esportazione dal cloroplasto dei prodotti della fotosintesi, e dell'importazione del Pi. Un altro trasportatore, con specificità di gruppo per gli acidi e gli aminoacidi dicarbossilici trasporta questi composti, in scambio elettroneutro, tra cloroplasto e citoplasma. Il ciclo di Calvin-Benson non è l'unico sistema enzimatico per l'assimilazione della CO2 nelle piante: una diversa via è caratteristica di alcune famiglie di piante di origine equatoriale tra le quali alcune di grande importanza per l'agricoltura (come il mais e la canna da zucchero), le cosiddette 'piante C4'. In queste, l'assimilazione della CO2 avviene con la collaborazione di due tipi di cellule: le cellule della guaina dei fasci vascolari, che rappresentano circa il 15-20% del totale delle cellule fotosintetiche, e le cellule del mesofillo (l'80-85%). In queste ultime, l'HCO3− viene organicato nella reazione catalizzata dalla fosfoenolpiruvico-carbossilasi:
[5] formula(
dove PEP è il fosfoenolpiruvato), seguita dalla riduzione dell'ossalacetato a malato, a opera della malicodeidrogenasi specifica per l'NADPH, che è prodotto dal trasporto di elettroni fotosintetico:
[6] formula
Il malato prodotto così nelle cellule del mesofillo viene trasportato nelle cellule della guaina del fascio, dove viene ossidato e decarbossilato dall'enzima malico, secondo la reazione:
[7] formula
Nelle cellule della guaina del fascio l'NADPH e la CO2 prodotte nelle reazioni [6] e [7] vengono utilizzate per la fissazione della CO2 secondo il ciclo di Calvin-Benson; il piruvato viene trasferito nelle cellule del mesofillo. In questa sede viene fosforilato a PEP a opera della piruvatofosfatodicinasi e utilizzato secondo l'equazione [5]. La fotosintesi delle piante C4, molto più dispendiosa di energia sotto forma di ATP (e quindi di fotoni) per CO2 assimilata, presenta una maggiore affinità per la CO2, perché la forma di carbonio inorganico utilizzata è il bicarbonato e non la CO2, e al pH della cellula l'HCO3− è molto più abbondante della CO2, all'equilibrio. Inoltre, la CO2 viene concentrata nelle cellule della guaina del fascio dalla reazione [7]: questo evento favorisce la reazione di carbossilazione e inibisce la concorrente reazione di ossigenazione della ribulosio-bisfosfato-carbossilasi. Queste piante presentano quindi una 'affinità apparente' molto maggiore per la CO2.
Fotosintesi anossigenica
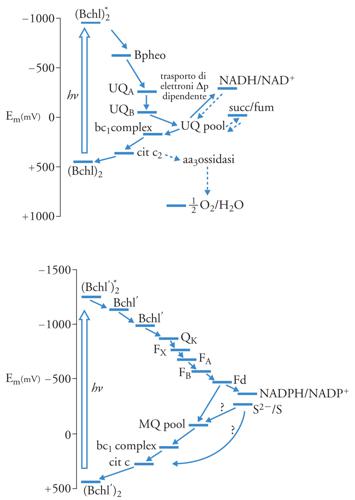
I microrganismi procarioti (batteri fotosintetici) che assimilano la CO2 senza produrre O2, secondo l'equazione [3] hanno una sola reazione fotochimica e un solo fotosistema, il cui funzionamento per quanto riguarda antenna e CR è identico a quanto detto sopra. Nelle diverse famiglie di microrganismi si hanno differenze nei fotosistemi, che sono rappresentati nella fig. 7. Essi sono simili all'uno o all'altro fotosistema della fotosintesi ossigenica. Nella fig. 7 in alto è mostrato il sistema di trasporto di elettroni di R. sphaeroides, un fotoanaerobo facoltativo, e degli Heliobacteria. Il CR è la (Bbhl)2, e la sequenza dei trasportatori, simile a quella del PS II, comprende la batteriofeofitina (Bpheo) e l'ubichinone A (UQA), l'UQB (analoghi del PQA e del PQB del PS II), e il pool dell'UQ diffusibile nella membrana. Seguono il complesso citocromo bc1, strettamente analogo al cit b6−f, e infine un cit c2, che viene ossidato dal CR+, come la plastocianina viene ossidata dal P+700 del PS I. Si chiude così un trasporto ciclico di elettroni intorno al fotosistema, in cui si genera ΔpH e Δφ a livello dell'ossidazione dell'UQH2 da parte del complesso cit bc1, e Δφ a livello della reazione fotochimica. Il complesso ATPsintasi utilizza il Δp per la sintesi di ATP. Il ciclo può essere interrotto a livello dell'UQH2: in questo caso si può avere trasferimento di elettroni al NAD, contro il gradiente elettrochimico, utilizzando il Δp prodotto dal trasporto di elettroni ciclico e dalla reazione fotochimica (fig. 7 in alto). L'NADH così prodotto, insieme all'ATP, viene utilizzato nell'assimilazione della CO2, che avviene attraverso il ciclo di Calvin-Benson. Il riducente utilizzato è NADH, e non NADPH: tale è infatti la specificità della 3-GAPdeidrogenasi di questi microrganismi, che è comune alla glicolisi ed è in soluzione nel citoplasma.
Le membrane fotosintetiche di questi batteri sono comuni alle membrane respiratorie, e il pool di UQ, il citbc1, il cit c2 e l'ATPsintasi sono utilizzati sia dalla fotosintesi che dalla respirazione. Il cit c2 può essere ossidato al buio da un cit aa3 (citocromoossidasi). Alla luce, la maggior velocità di ossidazione da parte di (Bchl)2+ inibisce la citocromoossidasi. Il donatore finale di elettroni per la fotosintesi è il succinato, a potenziale 0,0 V, che tramite la succinicodeidrogenasi riduce il pool di UQ (fig. 7 in alto), oppure altro composto del ciclo di Krebs (ciclo degli acidi tricarbossilici). La fig. 7 in basso mostra il sistema fotosintetico dei batteri fotosintetici verdi, anaerobi obbligati, e delle Chloroflexaceae. Il sistema è simile al PS I della fotosintesi ossigenica: la batterioclorofilla eccitata (Bchl*)2, anche qui un dimero, riduce una sequenza di due Bchl. Il successivo accettore è un chinone, il fillochinone (QK nella fig. 7 in basso), che precede i tre centri ferrosolfo (FX, FA, FB, fig. 7 in basso). Questi riducono una ferrodossina (Fd) trasportatrice di 2 elettroni, a differenza di quella delle piante verdi che ne trasporta 1 e può ridurre NADP (interrompendo così il ciclo) oppure il pool di menachinone (QK). Questo viene riossidato dal complesso cit bc1. Il successivo trasportatore è un cit c, che viene ossidato dal CR+, e così si chiude il ciclo. La riossidazione del pool di MQ è accoppiata alla formazione di Δp, e il potenziale di membrana è utilizzato per la sintesi di ATP. In questi microrganismi anaerobi obbligati l'assimilazione di CO2 avviene utilizzando la Fd o l'NADPH. È stato descritto il funzionamento in senso riduttivo del ciclo di Krebs, dove la Fd e l'NAD(P)H ridotti fotochimicamente vengono utilizzati per la carbossilazione riduttiva di acetilCoA e succinilCoA e per la riduzione dei chetoacidi, rispettivamente. Il donatore esterno di elettroni è il solfuro e altri composti ridotti dello zolfo, oppure l'H2.
Bibliografia
Arnon 1977: Arnon, Daniel I., Photosynthesis 1950-73: changing concepts and perspectives, in: Encyclopedia of plant physiology. New series, V, edited by Achim Trebst e altri, Berlin-New York, Springer, 1977, pp. 7-56.
Bassham, Calvin 1957: Bassham, James A. - Calvin, Melvin, The path of carbon in photosynthesis, Englewood Cliffs (N.J.), Prentice-Hall, 1957.
Duysens 1961: Duysens, Louis N. - Amesz, Jan - Kamp, B.M., Two photochemical systems in photosynthesis, "Nature", 190, 1961, pp. 510-511.
Emerson, Arnold 1932: Emerson, Robert - Arnold, William, A separation of the reactions in photosynthesis by means of intermittent light, "Journal of general physiology", 15, 1932, pp. 391-420.
Forti, Ehrenheim 1993: Forti, Giorgio - Ehrenheim, A.M., The role of ascorbic acid in photosynthetic electron transport, "Biochimica et biophysica acta", 1183, 1993, pp. 408-412.
Forti, Finazzi 1998: Forti, Giorgio - Finazzi, Giovanni, Modulation of the electron transport system of oxygenic photosynthesis, in: Biophysics of electron transport and molecular bioelectronics, edited by Claudio Nicolini, New York, Plenum, 1998.
Hill, Bendall 1960: Hill, Robert - Bendall, Fay, Function of the two cytochrome components in chloroplasts: a working hypothesis, "Nature", 186, 1960, pp. 136-137.
Jennings 2005: Jennings, Robert C. e altri, Photosynthesis and negative entropy production, "Biochimica et biophysica acta", 1709, 2005, pp. 251-255.
Joliot, Joliot 1964: Joliot, Pierre - Joliot, Anne, Etude cinétique de la réaction photochimique libérant l'oxygène au cours de la photosynthèse, "Comptes rendus de l'Académie des Sciences de Paris", 258, 1964, pp. 4622-4625.
Kok 1970: Kok, Bessel - Forbush, Bliss - McGloin, M., Cooperation of charges in photosynthetic O2 evolution - I. A linear four step mechanism, "Photochemistry and photobiology", 11, 1970, pp. 457-475.
Mitchell 1977: Mitchell, Peter, A commentary on alternative hypotheses of protonic coupling in the membrane systems catalysing oxidative and photosynthetic phosphorylation, "FEBS letters", 78, 1977, pp. 1-20.
Witt 1996: Witt, Horst T., Primary reactions of oxygenic photosynthesis, "Berichte der Bunsengesellschaft für physikalische Chemie", 100, 1996, pp. 1923-1942.