Ingegneria genetica
Ingegneria genetica
Definizioni e fondamenti
La genetica è una scienza teorico-sperimentale che cerca di spiegare il processo per cui da simile nasce simile. L'i. g. ne è un'applicazione che mira ad alterare in modo controllato questo processo, interferendo nella distribuzione, trasmissione ed espressione dei geni. Spesso ciò è realizzabile col trapianto di geni di una specie, per es. geni umani, in ospiti diversi; risultati interessanti possono anche essere ottenuti attraverso un'espressione dei geni a livelli quantitativamente più elevati che nell'uomo: tutto questo vale per qualsiasi combinazione di geni e organismi viventi e può avere riflessi commerciali importanti. Mentre la genetica studia le regolarità dei meccanismi di trasmissione (verticale) dei geni da una generazione all'altra, l'i. g. utilizza a fini applicativi alcune peculiarità, come il loro passaggio (orizzontale) da un individuo all'altro, anche tra specie diverse, e vi induce predeterminati cambiamenti di sequenza (mutazioni).
Tutti gli organismi viventi, microrganismi, animali e vegetali, possiedono geni (sequenze delle basi A, C, G e T variamente allineate in lunghe molecole di DNA, i cromosomi) che attraverso intermedi detti RNA messaggeri o mRNA, fungono da stampo (o codificano) per la sintesi delle proteine (i loro prodotti d'espressione) e quindi di tutti gli altri composti cellulari. Di norma l'espressione dei geni in proteine è finemente regolata: a tal fine la cellula usa altri geni, detti regolatori. Il codice genetico lega il linguaggio dei geni (le lettere sono le 4 basi del DNA) con quello delle proteine (le lettere sono i 20 amminoacidi naturali) ed è universale: lo stesso mRNA specifica una proteina (per es., l'insulina) nell'uomo come in ogni altra cellula animale, vegetale o batterica, purché dotata dei relativi geni. Se questi sono giustapposti ad altre sequenze che ne permettono la replicazione, possono venire duplicati col resto del DNA cellulare e passati alle cellule discendenti.
Col trapianto di geni diventano possibili infrazioni alle leggi della fedeltà replicativa del DNA, per cui da simile nasce simile, a meno di rare e casuali mutazioni. Come sottolineato nel titolo di un fortunato libro del premio Nobel francese J. Monod (1910-1976), coscopritore della regolazione genica, la biologia molecolare ha ingaggiato un'impari lotta col caso e la necessità che dominano la natura: l'i. g. ne è uno strumento importante.
La promiscuità genetica che può risultare dall'i. g. non origina necessariamente nuove specie. Perché un evento di speciazione si realizzi, occorre tra l'altro che gli scambi di geni interessino frazioni genomiche cospicue, sia come qualità sia come quantità. Non è facile prevedere 'quanti' geni potrebbero essere necessari, anche perché sappiamo poco su 'quali' entrano nel processo. Sia Bacillus subtilis che Escherichia coli, ultime aggiunte alla lista dei microrganismi completamente sequenziati, contano oltre 4000 geni: come per i diversi altri organismi dei quali sono stati sequenziati i genomi, conosciamo le funzioni di poco più della metà dei geni. Per ingegnerizzare un microrganismo basta il trapianto di un solo gene; per modificarlo in una nuova specie forse occorrerà trapiantarne diverse decine. La questione non è solo accademica: mettere a punto tecniche per il trapianto di crescenti porzioni di genomi, sino a milioni di basi, significa anche approntare strumenti di difesa nei confronti di una natura che evolve comunque non sempre secondo i nostri interessi.
Per gli organismi multicellulari il discorso è più complesso. L'i. g. può manipolare cellule sia somatiche, come fegato, milza, rene ecc., sia riproduttive, come ovociti (bersagli ottimali per via delle ragguardevoli dimensioni), oppure spermatozoi o embrioni: nel caso delle cellule somatiche gli effetti sono limitati all'organismo trattato; nel caso delle cellule riproduttive, essi sono generazionali e, in prospettiva, evolutivi. Manipolazioni della linea riproduttiva umana, anche se finalizzate alla terapia, sono sconsigliate, e talvolta proibite, ma per ragioni più tecniche che etiche: oggi nell'uomo al più si può intervenire su cellule somatiche.
Strumenti e tecniche
La strategia operativa dell'i. g. è il trapianto di geni. Le sue tecniche si basano sull'uso integrato di tre strumenti: il gene da trapiantare che funga o da stampo per la sintesi di una proteina o da segnale di regolazione; un sistema per realizzarne il trapianto; una cellula o un organismo ospite che l'esprima e lo replichi.
Geni stampo. - Ogni cellula sintetizza migliaia di sostanze: per quelle proteiche segue le istruzioni dei geni che le codificano, trascritte in un intermedio di mRNA; per quelle non proteiche ricorre a conversioni di prodotti catalizzate per lo più da proteine, dette enzimi. A ogni tipo di proteina corrispondono un gene e quindi un mRNA; talvolta dallo stesso gene derivano mRNA diversi perché maturati in modo diverso (e quindi proteine diverse), anche grazie a schemi alternativi di rimozione di introni e saldatura di esoni (v. anche biologia molecolare, in questa Appendice). A ogni gene corrisponde quindi almeno una proteina, o, meglio, vi corrispondono uno o più caratteri variabili in risposta a mutazioni della sequenza genica che esprime il carattere stesso oppure a diversi meccanismi di espressione.
Il gene stampo può essere un gene genomico, cioè un lungo tratto di DNA cromosomico codificante un particolare prodotto e completo di esoni, introni ed elementi regolatori generali e tessuto-specifici; o una copia in DNA del suo mRNA, sintetica e più breve del corrispondente gene genomico; o il risultato di una sintesi totale. Talvolta è più facile ottenere un mRNA piuttosto che il gene corrispondente: alcune cellule sono molto ricche in mRNA specifici (nelle isole di Langerhans del pancreas il 70% di mRNA codifica insulina). In questi casi, grazie a uno speciale enzima (la 'trascrittasi inversa') si copia mRNA in cDNA (o copia di mRNA) e lo si usa come stampo.
Vettori e sistemi di trapianto. - Il trasferimento di frammenti di DNA in una cellula ne richiede la permeabilizzazione, ottenibile con metodi chimico-fisici, quali stimoli elettrici, bombardamenti con particelle metalliche ricoperte di DNA, microiniezioni, coprecipitazioni con sali, trattamenti con sostanze che possono fondersi con le membrane. L'efficienza di questi metodi è scarsa; in più, una volta nella cellula le molecole di DNA estraneo vengono decimate dall'azione dei suoi enzimi degradativi. Pochissime arrivano al nucleo: gli effetti genetici sono trascurabili.
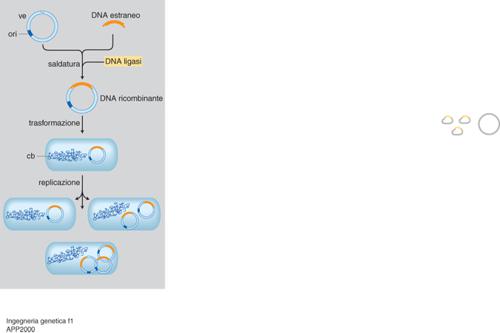
Risultati migliori si hanno unendo un gene stampo a strutture naturalmente in grado di veicolarlo nella cellula trattata come sopra e capaci di renderlo compatibile con la cellula stessa. Di norma tali strutture hanno come supporto un virus e/o un plasmide, che offrono diversi vantaggi: le ridotte dimensioni dei loro genomi permettono una più facile manipolazione, ma impongono una minore capacità di carico; più copie intracellulari significano più stampi e quindi più prodotto (fig. 1). L'unione tra stampo e vettore avviene grazie alla cosiddetta ricombinazione in vitro (da cui la locuzione DNA ricombinante spesso data a tutta quanta l'i. g.) mediata da enzimi. Segue il trapianto nella cellula e la migrazione nel nucleo: qui il gene estraneo o si integra per lo più a caso nei cromosomi o vi si associa in forma indipendente (episomica; v. trasponibili, elementi, App. V).
Particolare importanza hanno i vettori d'espressione: accanto al gene stampo, portano sequenze di controllo (promotori) che ne regolano la trascrizione in mRNA. Ce ne sono per tutti i sistemi, microbici, animali e vegetali. I vettori detti di espressione-secrezione contengono anche sequenze che permettono la secrezione della proteina: la sua purificazione ne è facilitata.
Oggi è possibile trapiantare molecole di DNA più lunghe dei cDNA, contenenti geni e sequenze di regolazione. Per questo si usano vettori di seconda generazione, i cromosomi artificiali, ottenuti ricombinando le sequenze essenziali dei cromosomi degli organismi eucarioti. Sinora sono stati ottenuti dai lieviti e dall'uomo, ma altri sono in arrivo: ciascuno dovrebbe funzionare nelle cellule della propria specie. Con sorpresa si è però notato di recente che cromosomi umani naturali possono essere attivi nel topo. Anche i cromosomi potrebbero quindi superare barriere evolutive. In vista di loro applicazioni terapeutiche, sono oggetto di attiva sperimentazione.
Sistemi ospiti. - Un tempo le proteine umane d'importanza farmacologica erano estratte da liquidi organici (sangue, urina) o da tessuti di cadaveri: i rischi igienico-sanitari, le difficoltà pratiche e le complicazioni morali erano rilevanti. Nel passato l'ormone della crescita umano veniva recuperato da ipofisi di cadaveri occasionalmente contaminati anche dall'elusivo e pericoloso agente della malattia di Kreutzfeldt-Jacob. Oggi l'ormone ricombinante ha sostituito quello naturale e non presenta problemi.
In teoria, qualunque cellula può ospitare qualunque sequenza di DNA e quindi sintetizzare qualunque proteina, sebbene ci siano eccezioni, per quanto poche e incerte. Tuttavia, nell'espressione di geni trapiantati, oltre ai vettori, anche i sistemi ospiti possono essere determinanti. I più usati sono per ora le cellule di due organismi unicellulari ben conosciuti: il batterio Escherichia coli e il fungo Saccharomyces cerevisiae (il lievito di birra). Tra i batteri, Bacillus subtilis risponde meglio a esigenze di sicurezza (vive nel suolo, non è patogeno). In generale i sistemi microbici sono preferibili per semplicità e convenienza: sino al 50% delle loro proteine totali può essere rappresentato dalla proteina estranea. Ma spesso questa è inattiva, perché non correttamente maturata, per es. per l'aggiunta di zuccheri. Si deve ricorrere allora a cellule animali coltivate in vitro.
Numerosi altri sistemi d'espressione sono allo studio: grande attenzione è dedicata ai ceppi virali utilizzati per la preparazione dei vaccini, quali il virus 71 Epstein-Barr e il citomegalovirus. Per un'efficace sintesi di proteine umane si può ricorrere anche a cellule di insetti infettati dai cosiddetti baculovirus. Spesso la proteina d'interesse è sintetizzata come prodotto, fuso con una proteina dell'ospite: sono noti diversi enzimi in grado di separarle dopo purificazione. Impiegati anche in interventi di terapia genica sono vettori basati su virus adeno, Herpes simplex e retrovirus di topo.
Organismi transgenici
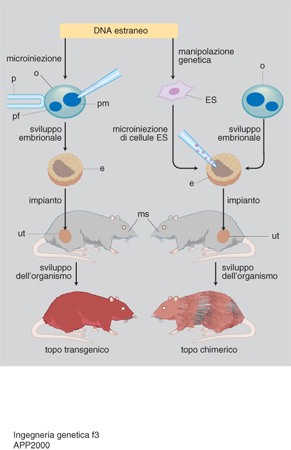
Si parla di organismi transgenici quando il gene estraneo è presente non solo nelle loro cellule somatiche, ma anche in quelle riproduttive, e può quindi essere ereditato dai discendenti come gli altri geni. Rispetto alle cellule coltivate in vitro, gli organismi transgenici hanno il vantaggio di potersi riprodurre naturalmente. L'aleatorietà della riproduzione sessuale non ne garantisce la trasmissione ai discendenti: anche per questo si cerca di accoppiare la clonazione (v. in questa Appendice) alle metodiche di produzione di organismi transgenici. In questi ultimi le cellule manipolate devono essere in grado di svilupparsi in organismi completi. Nei mammiferi si trapianta il DNA nell'ovocita fecondato o in cellule embrionali totipotenti e lo si lascia integrare nei cromosomi (fig. 3). Nel primo caso si permette lo sviluppo in vitro dell'ovocita trattato; l'embrione che ne risulta viene poi reimpiantato nell'utero di una madre surrogata. Nel secondo, le cellule embrionali manipolate vengono iniettate in una blastocisti: tutte le cellule (quelle manipolate e quelle della blastocisti ricevente) partecipano allo sviluppo dell'organismo, che risulterà chimerico, in quanto le sue cellule saranno in parte quelle estranee modificate. Oltre ai mammiferi sono oggetto di sperimentazione uccelli e pesci. Di particolare interesse è la produzione di piante transgeniche per uso industriale, alimentare e ornamentale: spesso si usano vettori basati sul plasmide Ti presente in batteri simbionti delle piante, come Agrobacterium tumefaciens e rhizogenes.
Risultati
Quasi ogni giorno vengono descritte nuove applicazioni dell'i. g.: forse però il suo maggior contributo è ancora alla ricerca di base. Oggi è difficile immaginare un protocollo di genetica sperimentale che non usi il trapianto di geni. I vari Progetti Genoma (v. App. V e in questa Appendice) sarebbero impensabili senza l'ingegneria genetica. In questa luce vanno viste anche la nascita e lo sviluppo di centinaia di piccole industrie di biotecnologie, soprattutto nei paesi anglosassoni, in Francia, Germania e Giappone: per anni molte di queste hanno venduto (sotto forma di know-how) solo ricerca di base, competitiva con quella dei più qualificati centri universitari. Ne è risultato un rapporto tra accademia e impresa tanto intenso quanto ambiguo: accanite battaglie legali sui brevetti dell'insulina o della tecnica di clonazione in vitro, detta PCR (Polymerase Chain Reaction), hanno dimostrato che spesso i valori del mercato prevalgono su quelli dell'accademia.
Traguardi molto significativi sono stati raggiunti nel campo della produzione di proteine: alcune (l'eritropoietina, l'insulina, gli interferoni, i fattori di crescita e di coagulazione ecc.) sono già in uso e molte sono in fase di studio preclinico e clinico. Sono alcune centinaia le voci che hanno contribuito al decollo di un settore ora giustamente considerato prioritario in quasi tutti i paesi più avanzati. Già nel 1995 il totale delle vendite mondiali ha superato i 10.000 miliardi di lire.
Altri settori di rilevanza economica sono le industrie alimentari, dei detersivi, dei coloranti, degli adesivi. Di grande interesse, anche se ancora a livello sperimentale, sono le linee che portano alla produzione di organismi resi transgenici sia per una più efficiente produzione di proteine, sia per migliori prestazioni in diverse operazioni. Sono noti numerosi esempi sia tra gli animali che tra le piante: ne ricorderemo alcuni.
Gli organismi transgenici per eccellenza sono forse due topi: tra i pionieri ricordiamo il maxitopo e l'oncotopo (i topi sono, con l'uomo, i mammiferi geneticamente più studiati). Il maxitopo risultò dall'iniezione in ovociti del cDNA dell'ormone della crescita (di ratto, di topo o di uomo: l'importante era l'alta frequenza di stampi introdotti nel genoma ricevente, utile per fini produttivi ma fisiologicamente nociva). Alcuni dei maxitopi così prodotti arrivarono a pesare una volta e mezza i loro simili: un risultato non grande ma suggestivo, anche grazie all'insistenza dei media. Minore attenzione ricevettero, invece, i problemi di cui soffrivano i maxitopi, in particolare a livello riproduttivo: la loro scarsa discendenza pare infatti si sia ingloriosamente estinta nel giro di poche generazioni. Inoltre, forse ancora più discreto fu l'annuncio che un accurato programma di incroci tradizionali tra topi naturalmente più grossi della norma aveva portato nel giro di una dozzina di generazioni ad animali di dimensioni simili ai maxitopi ingegnerizzati. A riguardo è forse malizioso ricordare che un maxitopo si ergeva accanto a un normotopo nella copertina di un testo classico di i. g., curato nel 1983 dal premio Nobel J.D. Watson (n. 1928), uno degli scopritori della doppia elica del DNA; nella seconda edizione, però, nove anni dopo, l'immagine è stata rimpiazzata da quella di due topini chimerici e addirittura rimossa dal testo.
Più rilevanti sono i risultati ottenuti nei tentativi di creare topi transgenici per geni coinvolti in tumori e malattie. L'oncotopo sviluppato alla Harvard University (USA) è un topo nel quale è stato trapiantato un gene (detto myc) che predispone a tumori; è stato il primo (e per ora l'unico) mammifero brevettato anche in Europa, dopo che la Harvard lo cedette alla multinazionale DuPont. Topi transgenici forniscono utili modelli per malattie come il morbo di Alzheimer, l'artrite, la distrofia muscolare, la fibrosi cistica. Talvolta negli organismi transgenici si riscontra una discordanza tra gene trapiantato e manifestazione fisiopatologica indotta. In questo campo forse più promettenti sono quei topi nei quali alcuni geni indigeni sono stati inattivati selettivamente con tecniche basate sulla ricombinazione omologa: sono detti topi knock-out e meritano qui una citazione anche se non sono veramente transgenici.
Un originale approccio produttivo consiste nel trapianto in ovociti di geni posti sotto il controllo di segnali attivi solo in cellule secretrici, come quelle della ghiandola mammaria. L'animale che ne risulta esprimerà il transgene solo se femmina e solo in una specifica cellula (la ghiandola mammaria) e in uno specifico stadio (la lattazione): il prodotto viene secreto nel latte, semplificando purificazione e conservazione. Risultati incoraggianti sono stati ottenuti con l'α-1-antitripsina, una proteina utilizzabile nella cura dell'enfisema polmonare, e con alcuni fattori di coagulazione del sangue.
Ma forse i risultati più brillanti dell'i. g. sono alcuni prodotti nuovi ottenuti con approcci sia combinatoriali (che portano a numerosissimi esemplari e ne selezionano i più soddisfacenti) sia sistematici (che procedono alla ricerca dei prodotti più idonei per tentativi successivi). La disponibilità di sistemi di sintesi robotizzati e miniaturizzati ha contribuito alla loro diffusione: dall'approccio combinatoriale sono derivati una serie di enzimi anche non proteici (fatti di RNA e detti ribozimi), da quello sistematico prodotti che mostrano proprietà superiori ai modelli naturali. È il caso di un'insulina umana in cui l'inversione di due amminoacidi (lisina e prolina) nella catena B migliora l'azione farmacologica.
Tra le piante transgeniche ricordiamo il mais reso resistente a insetti e insensibile a erbicidi. Francia, Italia e altri paesi europei ne hanno impedito la coltivazione, ma non l'importazione e l'uso, formalmente perché contiene anche un gene batterico usato nella costruzione del vettore che conferisce resistenza all'ampicillina e che potrebbe venire accidentalmente disseminato dalle coltivazioni, ma in realtà più per motivi commerciali. Sempre negli USA è stato prodotto un pomodoro che dopo il raccolto resterebbe più a lungo maturo grazie all'inattivazione, mediata da un RNA (detto antisenso) complementare al mRNA, di un enzima (poligalatturonasi) che degrada gli zuccheri. L'inibizione del mRNA abbassa il livello dell'enzima, gli zuccheri restano polimerici e il pomodoro conserva più a lungo consistenza e gusto. Gli ambientalisti e gli oppositori dell'i. g. stanno boicottando la commercializzazione di queste e altre piante manipolate, che denunciano come pericolose per i consumatori e l'ambiente. Memorabili sono le battaglie combattute negli anni Ottanta tra ecologisti e ingegneri genetici sulla disseminazione su piante invernali di batteri Pseudomonas (ingegnerizzati come antigelo): alla fine la marginalità della protezione e i rischi di un impatto ambientale negativo hanno ridimensionato la contesa.
Problemi
Alcuni dei problemi dell'attuale i. g. sono già stati accennati: si riferiscono tanto all'immagine quanto alla sostanza. I primi derivano da un'opposizione spesso prevenuta, di tipo vagamente luddistico, nei confronti della scienza e della tecnologia, giustificata anche dai talvolta discutibili comportamenti degli operatori. I secondi sono riconducibili a una commercializzazione forse affrettata dei più svariati prodotti e servizi prima che le conoscenze di base siano consolidate. La zona d'ombra riguarda soprattutto la correlazione tra gene e prodotto (o funzione), spesso applicata in modo acritico e affrettato: tanto nel momento analitico-diagnostico che in quello sintetico-funzionale le conoscenze oggi disponibili sono limitate. Individuare un gene associato a una malattia e identificarvi una o più mutazioni non deve significare una diagnosi infausta a carico di chi le porta. La diagnosi richiede l'effettiva espressione del gene 'malato': negli USA lo prescrive sin dal 1990 una legge detta ADA (Americans' Disability Act). Così, trapiantare a caso un gene 'sano' in una cellula o in un organismo non significa attuare realmente una terapia o un miglioramento genetico, a meno che non si riesca a sostituire esattamente la sequenza sbagliata con quella corretta.
Se si vogliono applicare le attuali conoscenze della genetica fisiologica e dell'ecologia funzionale a sistemi complessi come il corpo umano e gli ambienti naturali, l'impatto di introduzioni mal programmate non è né prevedibile né trascurabile. Contro questo assioma scatta quella che alcuni hanno elegantemente chiamato hýbris prometeica dei ricercatori, in realtà un mix di motivazioni non sempre nobili. Si pensi ai primi esperimenti di terapia genica compiuti dall'americano M. Cline (poi censurato) negli anni Ottanta su ignari talassemici italiani e israeliani con la collaborazione di condiscendenti ma non coscienziosi colleghi locali.
Quanto alla probabilità di assestarsi in modo corretto, un singolo gene associato a caso a un genoma complesso è come un organismo vivente, geneticamente manipolato o meno, artificialmente immesso in un ecosistema estraneo. In più, un organismo transgenico passa i suoi geni, originali o manipolati che siano, ai propri discendenti; ma talvolta, proprio in quanto transgenico, li può passare orizzontalmente anche ad altri membri dell'ecosistema. Le variabili di queste transazioni genetico-ambientali sono comprese solo in termini generali.
Vanno quindi accolti con prudenza i trionfalismi di quanti esaltano l'approccio biologico (sia esso genetico o ecologico) rispetto a quello, per es., chimico per la soluzione di problemi ambientali o terapeutici. Un errore genetico-biologico è probabilmente più grave di uno chimico, in quanto i suoi effetti possono avere ripercussioni spazio-temporali più ampie. L'aggressione chimica compiuta ai danni della biosfera nei decenni passati (per es., con l'insetticida DDT) ha prodotto ferite che stiamo ancora dolorosamente medicando: un'aggressione genetico-biologica può essere altrettanto se non più grave, ma certo più difficile da individuare e ancor più da correggere.
Agli esordi l'uso del DNA ricombinante in laboratorio è stato regolato da un lodevole sforzo di autodisciplina dei ricercatori, siglato nella famosa conferenza tenuta ad Asilomar, California, nel 1975. Una sua rivisitazione diretta all'estensione delle nuove tecnologie all'uomo e all'ambiente è auspicabile.
Comunque l'aggiunta dell'i. g. alla cornucopia (o alla faretra) degli strumenti che l'uomo è venuto acquisendo a partire dal Paleolitico può essere considerata un evento rivoluzionario. Circa 10.000 anni or sono l'addomesticamento di animali e piante gli permise di abbandonare il nomadismo: con l'avvento della civiltà urbana la sua evoluzione culturale ha subito una forte e crescente accelerazione. A questa prima rivoluzione biotecnologica è corretto accostare il recente sviluppo dell'i. g.: infatti, con la capacità di 'addomesticare' i geni l'uomo ne sta avviando una seconda, con la quale può incidere sull'evoluzione e passare da oggetto passivo a soggetto proponente di cambiamenti biologici. Al rigido determinismo dei geni si affianca la crescente flessibilità dell'ingegno umano.
bibliografia
J. Monod, Le hasard et la nécessité, Paris 1970 (trad. it. Milano 1970).
J.D. Watson, M. Gilman, J. Witkowski et al., Recombinant DNA, New York 1983, 1992².
B.R. Glick, J.J. Pasternak, Molecular biotechnology. Principles and applications of recombinant DNA, Washington (D.C.) 1994.
V. Sgaramella, Ingegneria genetica, in Genetica generale e umana, a cura di L. De Carli, E. Boncinelli, L. Larizza et al., Padova 1997, pp. 549-84.
V. Sgaramella, S. Riva, Il progetto genoma umano, Milano 1997.