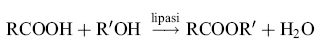Lo sviluppo di biotecnologie per l'ambiente
Lo sviluppo di biotecnologie per l'ambiente
In questo saggio illustreremo il contributo delle biotecnologie alle nuove tecniche di sintesi di prodotti chimico-industriali, agroalimentari e farmaceutici, e al pretrattamento di prodotti di largo consumo, mediante i quali si realizza una diminuzione del potenziale inquinante rispetto a processi, o a prodotti, tradizionali. Dopo una breve rassegna dei miglioramenti delle specie vegetali ottenibili mediante l'impiego di biotecnologie, descriveremo i processi basati sull'uso di enzimi (allo stato libero o immobilizzato) e di cellule, sia microbiche che vegetali. Discuteremo poi i possibili contributi delle biotecnologie ai processi di raffìnazione dei minerali e dei combustibili fossili, e alla produzione di materiali di largo consumo (fertilizzanti, vettori energetici e polimeri) a basso impatto ambientale. Delineeremo infine le più promettenti prospettive di sviluppo del settore.
Introduzione
Carattere peculiare e unico delle biotecnologie è che esse sono basate sulla stretta interazione tra scienze naturali e tecnologie ingegneristiche. Da tale interazione deriva l'uso di interi organismi, cellule e costituenti cellulari per creare nuovi prodotti e sviluppare nuove tecnologie di produzione o di 'servizi', comprendendo in quest'ultima categoria le metodologie più varie, dalla distruzione degli inquinanti e il ripristino degli eco sistemi a tutte le metodologie analitiche o terapeutiche che impiegano componenti di tipo biologico. Lo sviluppo di queste tecnologie richiede l'impiego cooperativo di discipline biologiche (la biochimica, la microbiologia, la genetica, la biologia molecolare ecc.) e fisiche (la chimica, la fisica, l'elettronica, ecc.).
Le biotecnologie contribuiscono alla difesa ambientale, non solo facilitando lo smaltimento di rifiuti e il ripristino di ambienti inquinati, ma anche permettendo la produzione di beni di largo impiego con metodi meno inquinanti, sia per i reagenti che per i reflui. l settori applicativi, molteplici e di grande importanza, riguardano le produzioni chimiche e agroindustriali. Grande importanza riveste, per esempio, l'impiego di materie prime più economiche o rinnovabili, non solo per produzioni chimiche, ma anche come combustibili meno inquinanti dei derivati del petrolio (per esempio, l'etanolo, il biodiesel, l'idrogeno ottenuto per fermentazione di reflui agricoli, ecc.).
Un altro settore applicativo delle biotecnologie riguarda l'introduzione di processi meno inquinanti dei corrispondenti processi chimici, che non implichino l'uso di solventi organici o di catalizzatori a base di metalli pesanti, oppure che introducano selettivamente specifici gruppi funzionali in composti chimici, in condizioni di processo blande (temperatura e pressione ambiente, acqua come solvente, pH vicino alla neutralità, ecc.). Le biotecnologie possono essere utilizzate anche per l'impiego di biotrasformazioni che creano intermedi o prodotti finiti per i quali non esista un'idonea sintesi chimica, come gli intermedi chirali per la produzione di farmaci o di fitofarmaci, o per la rimozione di sostanze tossiche nei processi di trattamento di materie prime fossili, come la desolforazione del petrolio o carbone o l'impiego di microrganismi nei processi estrattivi di metalli. Il monitoraggio continuo di inquinanti mediante l'uso di biosensori, in aree anche distanti e di grande estensione, è un altro settore applicativo delle biotecnologie.
A questi impieghi si aggiungerà, in un prossimo futuro, la produzione, mediante coltivazioni estensive di specie vegetali modificate mediante l'ingegneria genetica, di prodotti chimici specialistici ad alto valore aggiunto, come nuove proteine, carboidrati, enzimi vegetali, oli e grassi particolari, materie plastiche biodegradabili, nuovi farmaci e così via. Gli usi non alimentari dell'agricoltura e dei raccolti potranno in futuro diventare estremamente rilevanti nei paesi industrializzati, dove la produzione di cibo è ormai più che sufficiente, con implicazioni positive per quanto riguarda l'impatto ambientale.
La manipolazione dello sviluppo, dei metabolismi e della resistenza alle malattie e ai parassiti sono da sempre gli obiettivi del miglioramento genetico delle piante coltivate. Le biotecnologie offrono strumenti nuovi e straordinari al miglioramento genetico. L'aspetto innovativo dell'approccio biotecnologico è la possibilità di identificare e manipolare i geni preposti alle varie funzioni vitali delle piante e la possibilità di creare piante transgeniche, in cui uno o più di questi geni sono modificati o espressi con modalità diverse da quelle naturali. Le biotecnologie offrono anche la possibilità di trasferire nelle piante geni totalmente estranei, provenienti da altri organismi, per migliorarle, proteggerle o per renderle capaci di produrre sostanze utili.
Una migliore comprensione dei metabolismi del carbonio, dei carboidrati e dei composti azotati, dei meccanismi molecolari di adattamento delle piante e delle interazioni tra piante e microrganismi, permetterà di creare varietà capaci di crescere in condizioni ambientali estreme e su terreni marginali, limitando l'uso dei fertilizzanti chimici, inquinanti e costosi. La maturazione dei fiori e dei frutti, controllata geneticamente, può anch'essa essere modificata. Piante più nutrienti potranno essere create alterando la composizione delle proteine di riserva del seme che, per i raccolti più importanti (cereali e leguminose), rappresentano la parte commestibile del raccolto. I geni che codificano le proteine di riserva del seme sono stati, peraltro, tra i primi geni delle piante a essere isolati e studiati in dettaglio. È possibile intervenire anche modificando la composizione degli oli estraibili, sia per usi alimentari sia per la produzione, per esempio, di detergenti, come nel caso della colza, con un maggiore contenuto di acido laurico.
Particolarmente spettacolari sono i risultati che le biotecnologie hanno già ottenuto nella protezione dei raccolti dagli insetti e dalle malattie. La dimensione economica del problema è in questo caso definita dai 3÷5 miliardi di dollari spesi annualmente nel mondo (con gravissimo danno ambientale) per il controllo chimico dei soli insetti. I primi esempi di piante transgeniche (tabacco e pomodoro), resistenti a insetti grazie a un gene derivato da un batterio, risalgono addirittura al 1987÷1988, e di quegli anni sono anche le prime piante biotecnologiche resistenti a virus, rese tali da un derivato di geni virali. Dal 1996 è stata autorizzata la commercializzazione negli Stati Uniti di numerose piante resistenti agli insetti grazie alla presenza di geni batterici (granoturco, patata, cotone) e di piante resistenti a virus (zucchina, papaya). Alla prima generazione di prodotti biotecnologici appartengono le piante resistenti ai diversi erbicidi (granoturco, soia, cotone), già commerciabili negli Stati Uniti, che consentono di dosare meglio e di mirare l'uso di queste sostanze chimiche fortemente inquinanti.
Per quanto riguarda l'impiego delle biotecnologie per produzioni chimiche, è necessario premettere che la grande maggioranza delle tecnologie chimico-industriali utilizza come materia prima, e utilizzerà ancora per molto tempo, il petrolio, o gas a esso associati (come il metano) data la loro abbondanza, il basso costo e l'esistenza di numerosissime tecnologie petrolchimiche ormai ottimizzate.
Dato tuttavia l'elevato inquinamento ambientale determinato da tutte le fasi del ciclo petrolifero (compresi il trasporto e lo stoccaggio), una maggiore sensibilità ecologica sta portando alla sua sostituzione, ove possibile ed economicamente sostenibile, con metodi di sintesi basati sulla fermentazione di substrati naturali a opera di lieviti o di batteri (o di sistemi enzimatici da essi ricavati). Il maggiore esempio è l'alcol etilico, prodotto in Brasile non più dall'etilene, ma dalla fermentazione di sostanze zuccherine (soprattutto canna da zucchero).
In Brasile oggi quasi 5.000.000 di automobili utilizzano etanolo puro e 9.000.000 una miscela di bioalcol (20%) e benzina. A rendere possibile il 'miracolo' è stato un programma del governo (denominato Proalcol) per il quale sono stati stanziati 6,97 miliardi di dollari. Il risparmio ottenuto riducendo l'importazione di petrolio è stato di 12,48 miliardi di dollari. Inoltre, a San Paolo, i residui della fermentazione della canna da zucchero sono impiegati come concime naturale nelle piantagioni, con un aumento della produttività del 30%. Anche negli Stati Uniti viene prodotto etanolo come carburante; attualmente la produzione è di l miliardo di galloni americani (1 gallone è pari a circa 3,8 l), cioè di 4.000.000 m³. Esso è ottenuto per fermentazione di amido di mais e venduto a 1,2÷l,3 dollari per gallone.
Grande importanza ha anche la produzione di acidi organici per via fermentativa. La produzione di acido citrico (acidulante) mediante la fermentazione di sottoprodotti della lavorazione del grano con Aspergillus niger ha quasi completamente soppiantato la sua estrazione da agrumi, meno economica e assai più inquinante. Analogamente l'acido lattico è ottenuto per fermentazione delle melasse derivanti dalla lavorazione del saccarosio, di sieri di caseificio o di residui dell'estrazione dell'amido dal mais. I vantaggi insiti nell'impiego di catalizzatori enzimatici anziché chimici per la trasformazione, la modificazione, la degradazione o la sintesi di composti chimici di natura complessa sono molteplici. Gli enzimi catalizzano quasi ogni tipo di reazioni organiche: ossidazioni, riduzioni, trasferimento intra- o intermolecolare di gruppi, idrolisi, eliminazioni, addizione a doppi legami, isomerizzazioni. Essi sono caratterizzati da elevata specificità catalitica, consentono l'uso di condizioni operative molto blande in termini di temperatura e di pressione e hanno uno scarsissimo impatto ambientale a causa della ridotta formazione di prodotti secondari o di impurezze.
Lo sviluppo di nuovi biocatalizzatori richiede la valutazione di un gran numero di microrganismi, allo scopo di identificare quelli provvisti dell'attività desiderata e di isolare poi l'enzima o gli enzimi relativi. Le tecniche di coltura microbica idonee a sviluppare ceppi mutanti per reazioni specifiche sono molto importanti, così come le tecniche di isolamento e di rimozione degli enzimi che catalizzano reazioni non desiderate. Tutto questo richiede, da parte delle industrie operanti in questo settore, notevoli sforzi in termini di tempo e di denaro.
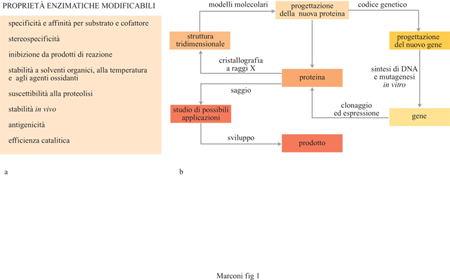
Notevoli sviluppi applicativi sono attesi anche dall'ottenimento di enzimi modificati in modo da aumentarne l'attività catalitica e da renderli idonei a operare per lungo tempo in condizioni di processo avverse, quali elevata temperatura, condizioni estreme di pH o di salinità, presenza di solventi organici, ecc. Queste modificazioni strutturali delle molecole enzimatiche saranno rese possibili combinando, sulla base delle informazioni fornite dalle moderne tecniche di indagine strutturale, le tecniche di ingegneria proteica con quelle di trasformazione chimica dei polipeptidi. Lo sviluppo delle tecniche del DNA ricombinante ha oggi un notevole impatto sulla produzione di biocatalizzatori e sulla loro applicazione, in particolare per quanto riguarda l'aumento della quantità di enzima prodotto da un particolare microrganismo e la modifica della configurazione di un enzima nativo, allo scopo di modificarne la specificità o la stabilità.
Il primo di questi fattori è ormai largamente perseguito dai principali produttori di enzimi, poiché l'attività enzimatica di un microrganismo esistente in natura è in genere troppo bassa per essere di interesse commerciale. Una tecnica molto seguita a questo scopo consiste nell'isolare il gene che codifica l'enzima desiderato e nel clonarlo in un altro organismo (organismo ospite) utilizzando come vettore del gene un plasmide, cioè sezioni di DNA extranucleare presenti nei microrganismi e capaci di inglobare, con le tecniche del DNA ricombinante, il gene in oggetto, e di trasferirlo nel patrimonio genetico del microrganismo ospite; quest'ultimo, sottoposto all'intensa attività riproduttiva tipica di un processo fermentativo, esprimerà a livelli ben più elevati la proteina enzimatica codificata dal gene introdotto. L'isolamento del gene che codifica l'enzima e il suo trasferimento sono operazioni di ingegneria molecolare assai complesse, rese oggi possibili dal rapido aumento di conoscenze avvenuto negli anni Ottanta e Novanta per quanto riguarda la natura dei geni e degli enzimi. Tali enzimi sono utilizzati per isolare il frammento di DNA che codifica la proteina che si vuole produrre (enzimi di restrizione), e per inserire il frammento nel nuovo organismo ospite che deve produrre la proteina. L'inserimento nel plasmide del frammento di DNA estraneo da introdurre nel microrganismo ospite è effettuato dalle ligasi. In un sistema di espressione ben realizzato, la proteina prodotta dal gene clonato può costituire sino al 70% delle proteine cellulari totali, con il vantaggio addizionale di una semplificazione nelle operazioni di isolamento dell'enzima dopo la fermentazione.
Invece, la modificazione della configurazione dell'enzima, non ancora applicata diffusamente alla biocatalisi come strumento per aumentarne l'efficienza, richiede tecniche quali la mutagenesi sitospecifica, che consiste nel cambiare particolari residui amminoacidici coinvolti nella struttura del sito attivo dell'enzima così da alterare, per esempio, la forma o le dimensioni di quest'ultimo, allo scopo di permettergli di trasformare substrati diversi da quelli tipici dell'enzima nativo (fig. 1). l cambiamenti nella sequenza amminoacidica sono ottenuti applicando le tecniche del DNA ricombinante per alterare, nei plasmidi dell'organismo ospite, i segmenti di DNA che la codificano.
Tecnologie enzimatiche
Nei processi di bioconversione gli enzimi possono essere utilizzati sia liberi in soluzione acquosa, sia immobilizzati in matrici di varia natura, sia usando come catalizzatore enzimatico l'intera cellula. L'impiego degli enzimi in soluzione è molto diffuso. Per esempio, le proteasi e le lipasi sono utilizzate in questa forma nelle polveri per lavatrici, dove vengono impiegate per eliminare dai tessuti macchie di difficile rimozione, con notevole risparmio di detergenti e conseguente minore impatto ambientale.
Il costo di produzione di enzimi sia estrattivi sia di origine microbica, tuttavia, è spesso elevato, e così pure il costo di purificazione; per questo motivo sono state sviluppate diverse tecniche per la loro immobilizzazione e per l'impiego dei preparati enzimatici immobilizzati in reattori industriali, in particolare per la sintesi di prodotti per usi speciali, farmaceutici e di chimica fine.
Impiego di enzimi in soluzione
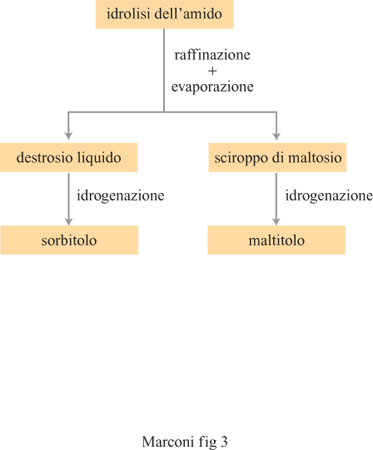
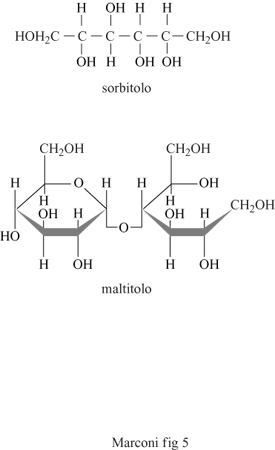
Un importante capitolo dell'impiego industriale delle biotecnologie riguarda l'ottenimento di derivati del mais. Questi procedimenti, che portano all'ottenimento di sorbitolo e maltitolo a elevato grado di purezza, si avvalgono largamente dell'impiego di enzimi idrolitici, che portano gradualmente alla degradazione dell'amido fino a prodotti di bassa massa molecolare, quali il glucosio e il maltosio, e alla loro successiva conversione per idrogenazione catalitica, rispettivamente a sorbitolo e a maltitolo. Tali sostanze vengono principalmente impiegate come dolcificanti, dove hanno sostituito prodotti di sintesi come la saccarina e i ciclammati, non sicuri dal punto di vista tossicologico e sintetizzati mediante processi a elevato impatto ambientale. La loro importanza come dolcificanti è dovuta alla forte richiesta da parte di consumatori affetti da patologie oggi assai diffuse nei paesi a elevato sviluppo industriale, quali il diabete e l'obesità; inoltre, essi hanno trovato impiego come additivi che sostituiscono altri, e meno innocui, prodotti chimici di sintesi in vastissimi settori produttivi, dall'industria alimentare alla farmaceutica, da quella dei cosmetici a quella dei prodotti per l'igiene personale. Il sorbitolo, inoltre, è ormai impiegato, dopo reazione di eterificazione con epossidi (ossido di etilene e soprattutto di propilene), come materia prima per la produzione di poliuretani (gommapiuma, rivestimenti, ecc.) dotati di elevate proprietà quali ottima stabilità dimensionale, elevata resistenza all'invecchiamento e alta densità di reticolazione. Esso trova anche impiego nella fabbricazione di materie plastiche termoindurenti (resine melamminiche).
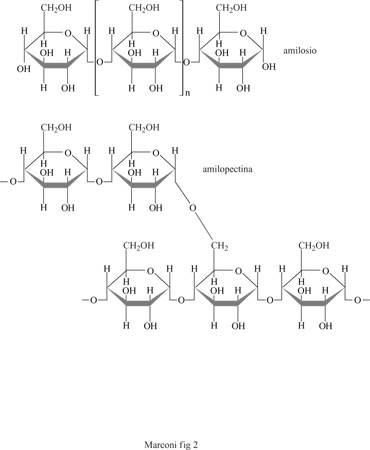
L'amido è un polisaccaride ad alto grado di polimerizzazione costituito da molecole di glucosio (D-glucosio o destrosio), legate insieme mediante legami α-glucosidici. La formula generale dell'amido (C6H1005)m dove n è circa 1000, ne rispecchia solo grossolanamente l'intima struttura poiché nell'amido sono presenti un polimero lineare (amilosio), in cui tutti i legami sono in posizione 1,4 e un polimero ramificato (amilopectina), in cui 20÷ 30 unità di glucosio formano catene con legami 1,4 mentre la ramificazione avviene attraverso legami 1,6 (fig. 2).
Il latte d'amido viene sottoposto ad alcuni processi, per l'ottenimento dei polioli, cioè alcoli alifatici polifunzionali (fig. 3). L'idrolisi, realizzata mediante α-amilasi batterica da Bacillus licheniformis o B. subtilis, porta alla formazione di maltodestrine. Allo scopo di degradare anche le amilopectine, con conseguente aumento delle rese fmali di glucosio e maltosio e della loro purezza, vengono impiegati in questa fase anche enzimi, come l'isoamilasi o la pullulanasi, in grado di agire sui legami che nelle amilopectine ramificano le unità glucosidiche in posizione 1,6 (Warren, 1996).
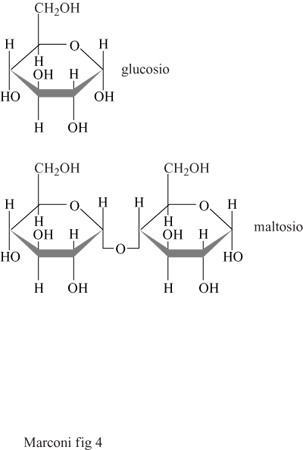
In seguito, a seconda del prodotto desiderato, si procede alla saccarificazione con glucoamilasi, per l'ottenimento di sciroppi di glucosio, oppure a incubazione con amilasi, per l'ottenimento di soluzioni di maltosio (fig. 4). Gli sciroppi di glucosio e maltosio sono poi trasformati, per trattamento con idrogeno a temperatura e pressione elevate, rispettivamente in sorbitolo e maltitolo (fig. 5). Questi sciroppi, dopo essere stati purificati mediante passaggio in colonne di demineralizzazione e purificazione, riempite di resine a scambio ionico (sia cationiche sia anioniche), operanti in continuo, vengono essiccati (a un valore di solidi pari almeno al 99,7%) mediante concentratori sottovuoto.
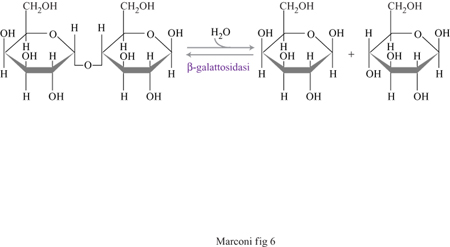
Un altro tipo di industria, quella lattiero-casearia, presenta invece un problema estremamente significativo dal punto di vista economico e ambientale: l'utilizzazione del lattosio contenuto nei sieri di caseificio. lliattosio (β-D-galattopiranosil-D-glucopiranosio), costituito da una molecola di glucosio e una di galattosio, è uno zucchero di scarso valore, costituisce oltre il 75% del peso secco del siero e si accumula nel mondo nella quantità di circa 1,2 milioni di tonnellate l'anno. Esso ha attualmente pochissimi sbocchi di mercato per numerose ragioni, la più importante delle quali è la sua scarsa digeribilità, dovuta a intolleranza intestinale da parte non solo di numerose popolazioni umane, ma anche di importanti specie animali di allevamento.
Numerose trasformazioni enzimatiche sono allo studio per la trasformazione del lattosio in prodotti fmali di un certo interesse quali illattitolo, illattulosio o l'acido lattobionico; la trasformazione di gran lunga più importante dellattosio, tuttavia, consiste nella sua scissione, operata dall'enzima galattosidasi, nei due monosaccaridi costituenti (glucosio e galattosio), entrambi impiegabili anche per l'alimentazione umana (con qualche limitazione per il galattosio) (fig. 6). La reazione è condotta in continuo, facendo fluire il siero in un reattore ripieno di lattasi (f3-galattosidasi) fungina immobilizzata, a una velocità di flusso tale da realizzare, nel siero uscente, un'idrolisi del lattosio pari all'85÷90%. Questa tecnologia semplice ed economica applicata, anziché all'enzima immobilizzato, a cellule di lievito o fungine contenenti lattasi, ha permesso l'ottenimento di biocatalizzatori dotati di un'attività pari al 70÷80% di quella dell'enzima libero operante in soluzione acquosa e confrontabile con quella di preparati contenenti l'enzima immobilizzato. Anche la stabilità nel tempo dell'attività delle cellule immobilizzate si è rivelata ottima.
Un'applicazione delle biotecnologie abbastanza recente e dotata di notevole rilevanza ambientale riguarda, come già accennato, l'impiego di enzimi nell'industria dei detergenti, dove le proteasi e le lipasi, in grado di rimuovere dai tessuti contaminanti di tipo organico, hanno permesso di sostituire sostanze tossiche (perborato e ipoclorito) o inquinanti (polifosfati). Le proteasi e le lipasi impiegate a questo scopo sono sempre di origine microbica, poiché la loro sintesi mediante la fermentazione di microrganismi ne consente la produzione a costi assai minori rispetto ad altre fonti vegetali o animali. Inoltre è stato possibile migliorare la produttività di questi enzimi nei microrganismi termofili, capaci di vivere e riprodursi a temperature superiori a 80÷90 °C e sono stati quindi ottenuti enzimi attivi non solo a temperatura ambiente ma anche a elevate temperature di lavaggio. Le proteasi e le lipasi, grazie alla loro efficienza catalitica demoliscono macchie e incrostazioni di natura complessa, che resisterebbero all'azione dei soli detergenti.
Le lipasi hanno trovato largo impiego nei processi industriali di idrolisi di oli e grassi animali e vegetali e per la produzione di glicerina e acidi grassi. Anche in questo caso, poiché gli enzimi operano in condizioni assai più blande rispetto ai processi tradizionali, il loro impiego garantisce una più elevata purezza dei prodotti, un minore inquinamento e più bassi consumi energetici.
Un importante settore applicativo degli enzimi proteasi ma anche lipasi, è costituito dallo sgrassaggio e dalla concia delle pelli. l vantaggi ottenuti consistono nella migliore qualità del prodotto e, soprattutto, in una drastica riduzione del grave inquinamento ambientale associato a queste lavorazioni. Poiché i diversi strati di pelle sono costituiti da proteine quali il collagene, l'αcheratina e l'elastina (in aggiunta a proteine globulari come l'albumina, la globulina e le glicoproteine), l'impiego di proteasi dotate di diversa specificità ha reso possibile l'eliminazione, per idrolisi selettiva, dei costituenti della pelle diversi dal collagene. Così, nella prima fase della lavorazione che consiste nell'imbibizione con acqua delle pelli grezze salate ed essiccate (soaking), si usano proteasi alcaline e tripsina per rimuovere le proteine a struttura non fibrillare (prevalentemente albumine e globuline), mentre nella fase successiva, consistente nella depilazione e nel pretrattamento (bating) in vista della successiva fase di coloritura con cromato, viene impiegata tripsina con minori quantità di proteasi neutre e alcaline. A seconda del tipo di pelle da produrre, nella seconda fase vengono variati il pH, la temperatura, il tempo di trattamento, il tipo di enzimi e il loro rapporto nella miscela. Uno sviluppo futuro di questa tecnologia prevede di operare sotto pressione per accelerare la diffusione degli enzimi all'interno dei vari strati della pelle.
L'immobilizzazione di enzimi
l vantaggi insiti nell'impiego di enzimi allo stato immobilizzato sono illustrati nella tabella (tab. I). Naturalmente esistono anche alcuni svantaggi, quali il costo di immobilizzazione, la perdita di attività che spesso risulta dall'immobilizzazione, l'estrema difficoltà di far reagire con preparati enzimatici insolubili substrati di elevata massa molecolare (come peptidi, polisaccaridi o polinucleotidi), e la purificazione più spinta che spesso si richiede per l'enzima da immobilizzare.
Poiché tali vantaggi e svantaggi dipendono spesso dalle tecniche di immobilizzazione impiegate, sono stati sperimentati numerosi metodi di immobilizzazione che si basano sulla formazione di legami chimici tra l'enzima e la materia solida di supporto o sull'intrappolamento dell'enzima all'interno di essa. Le molecole immobilizzate sono in genere più stabili rispetto a quelle in soluzione. Questa proprietà è il risultato di una minore elasticità conformazionale nella struttura tridimensionale della molecola proteica.
Qualunque sia il tipo di immobilizzazione impiegato, le caratteristiche del materiale di supporto possono avere grande influenza sul successo dell'immobilizzazione e della successiva applicazione del preparato enzimatico immobilizzato. lnnanzitutto il costo e la disponibilità del materiale possono influire sull'intera economicità del processo, specialmente per quelle applicazioni in cui il costo di trasformazione deve risultare molto basso. Le altre caratteristiche del materiale che possono esercitare un effetto sul sistema sono la forma fisica, la stabilità chimica e meccanica, l'idrofilicità, la perme abilità, le cariche elettrostatiche e la resistenza all'attacco microbico, ecc. Le caratteristiche principali di un supporto destinato a uso industriale sono riassunte nella tabella (tab. 2).
In generale, non esiste un ideale e universale metodo di immobilizzazione né un ideale e universale supporto: sia il metodo di fissazione sia il supporto devono essere selezionati in funzione delle caratteristiche strutturali della molecola biologica e della sua applicazione.
L'immobilizzazione di cellule
L'immobilizzazione di cellule intere di origine microbica e vegetale rappresenta un'evoluzione della tecnica di immobilizzazione di enzimi e delle loro applicazioni nella catalisi eterogenea e presenta, rispetto all'uso di singoli enzimi immobilizzati, minori costi di produzione, e soprattutto offre la possibilità di ottenere molecole a struttura complessa e ad alto valore aggiunto partendo da substrati semplici, mediante una sequenza di reazioni chimiche catalizzate dai vari enzimi presenti all'interno delle cellule. Grazie alla struttura bene organizzata della cellula, questa tecnica consente di ottenere reazioni di bio sintesi che richiedono la partecipazione dei coenzimi. Le cellule immobilizzate trovano infine una valida applicazione nella produzione di metaboliti microbici di interesse industriale (etanolo, acidi organici, vitamine, ecc.), in alternativa ai tradizionali processi fermentativi. Le cellule immobilizzate possono essere sia morte sia vive. Nel primo caso la cellula è assimilabile a un piccolo involucro contenente l'enzima o l'insieme di enzimi attivi. Nel secondo caso la cellula dispone di tutti i suoi componenti metabolici intatti ed è quindi in grado di riprodursi.
Le cellule utilizzate si possono trovare nello stadio di crescita oppure nello stato stazionario (resting cells). Esistono vari metodi per l'immobilizzazione delle cellule, omologhi a quelli applicati per gli enzimi. l tre principali metodi sono l'inglobamento in materiale polimerico, l'attacco a un supporto mediante adsorbimento e la reticolazione con reagenti bifunzionali. L'inglobamento in materiali sia di sintesi sia naturali è la procedura più diffusa. l materiali generalmente impiegati sono costituiti da polisaccaridi (naturali o modificati chimicamente) o da polimeri sintetici come la poliacrilammide. Questo sistema è alternativo all'uso degli enzimi e quindi le cellule immobilizzate non sono generalmente vive. l vantaggi e gli svantaggi derivanti dall'uso delle cellule sono sintetizzati nella tabella (tab. 3). Le cellule possono essere anche impiegate in mezzi costituiti da solventi organici, quando la solubilità dei substrati e dei prodotti lo impone. Le cellule vive immobilizzate hanno il loro patrimonio metabolico intatto e quindi sono in grado di riprodursi dopo essere state introdotte in un mezzo nutritivo, il cosiddetto terreno di coltura delle cellule libere. Se da un punto di vista metabolico cellule libere e immobilizzate sono simili, non lo sono da un punto di vista tecnologico. Le cellule immobilizzate sono facili da separare dal mezzo di reazione, sono facilmente riutilizzabili e sono particolarmente adatte per processi a flusso continuo.
Questa tecnica si pone come alternativa ai normali processi fermentativi usati per produrre alcoli, amminoacidi, acidi organici, vitamine, solventi e altri metaboliti primari e secondari di interesse industriale. Come è ovvio, l'immobilizzazione permette il riutilizzo del microrganismo, trasformando, nel caso specifico dei processi fermentativi, il sistema operativo da discontinuo (batch) in continuo, mantenendo alta la popolazione cellulare e in definitiva la velocità di fermentazione. Questa maggiore produttività metabolica, effetto di un'alta densità microbica, consente al reattore che contiene le cellule immobilizzate di operare a velocità idrauliche di diluizione, notevolmente superiori a quelle consentite dalla massima velocità specifica di crescita del microrganismo libero (Marconi, 1989). Le colture di cellule vegetali e il loro impiego a scopi produttivi, sia allo stato libero sia immobilizzate, saranno trattate nel paragrafo dedicato all'utilizzazione delle biotecnologie nel settore agroindustriale. Impiego di enzimi microbici in sistemi eterogenei Nella tabella (tab. 4) sono elencate alcune tipiche biotrasformazioni, ottenute con catalizzatori enzimatici immobilizzati, di rilevante interesse commerciale. L'attività e la stabilità degli enzimi, requisiti indispensabili per l'ottimizzazione economica dei relativi processi, sono state in ogni caso migliorate con tecniche di ingegneria delle proteine (protein engineering). Attualmente, e ancor più in futuro, intermedi chimici chirali, cioè dotati di una determinata configurazione spaziale (fra le due o più possibili), acquisiranno un'importanza crescente per l'industria farmaceutica. Le biotrasformazioni giocheranno certamente, già nel medio termine, un ruolo determinante nella preparazione di tali composti, in alternativa alle tecniche tradizionali (Roberts, 1990), che sono la cristallizzazione selettiva, da una miscela, di un solo intermedio chirale; la disponibilità da fonti naturali, generalmente vegetali, e la sintesi asimmetrica mediante sistemi catalitici speciali (stereoselettivi) in grado di sintetizzare direttamente uno solo degli enantiomeri statisticamente possibili. Queste tecnologie sono, in genere, fortemente inquinanti a causa dell'uso di solventi impiegati nell'estrazione, da prodotti naturali, dei principi attivi, dei complessanti (per esempio, ammine o fosfine asimmetriche) e dei solventi organici impiegati nei processi chimici stereoselettivi (di sintesi asimmetrica) dell'enantiomero desiderato.
Lo sviluppo di maggiore successo delle biotecnologie si è realizzato nel settore farmaceutico; negli Stati Uniti, per esempio, nel decennio 1986÷1996 il fatturato annuo delle dieci maggiori società operanti nelle biotecnologie per la salute è salito da 6,2 a 26,5 miliardi di dollari. Con un decreto del maggio 1992, il potente organo statunitense che approva l'immissione sul mercato di nuovi farmaci e alimenti (FDA, Food and Drug Administration) stabilì che, nel caso di farmaci costituiti da miscele racemiche, l'approvazione era subordinata alla fornitura, da parte dell'industria richiedente, di estese documentazioni farmaco-tossicologiche su ognuno dei singoli enantiomeri presenti. Il costo e la complessità di queste procedure hanno fatto sì che alla fine degli anni Novanta oltre il 20% del mercato dei farmaci negli Stati Uniti (stimato in oltre 250 miliardi di dollari annui) fosse costituito da principi attivi costituiti da un unico enantiomero. Come risultato di questa crescente domanda di principi attivi chirali, il mercato di intermedi chirali, necessario per la loro produzione, è salito a livello mondiale a l miliardo di dollari annui ed è in rapida crescita.
Produzione di farmaci e fitofarmaci. - Il settore farmaceutico è quello in cui le biotecnologie hanno ottenuto il maggiore successo commerciale, e quello nel quale sono stati investiti i maggiori sforzi di sviluppo e di commercializzazione. In questo ambito gli antibiotici costituiscono la maggiore categoria di farmaci chirali. Essi formano quindi una categoria di composti ideale per trattamenti enzimatici o di ingegneria genetica, data la caratteristica di queste tecniche di agire su miscele di composti aventi uguale composizione chimica, ma diversa configurazione spaziale.
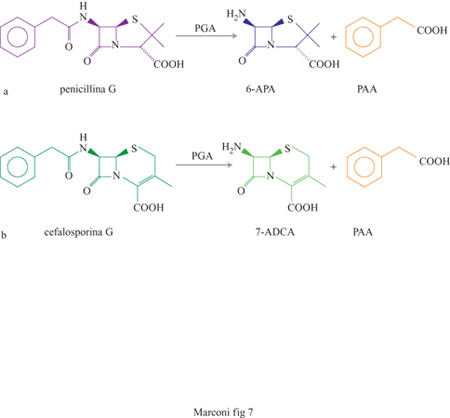
Nonostante la penicillina sia stata il primo antibiotico scoperto, essa ha mantenuto una grande importanza terapeutica (e quindi commerciale), grazie all'enorme lavoro di ricerca svolto su di essa, che ha permesso di ottenere derivati a più ampio spettro di azione antibatterica, e resistenti all'inattivazione da parte dei microrganismi patogeni su cui essa deve agire. Queste nuove penicilline si basano sull'introduzione nella molecola di sostituenti diversi da quelli naturalmente introdotti dai microrganismi che la sintetizzano durante il processo fermentativo, e in particolare nella variazione dei sostituenti chimici dello 'scheletro' di base della penicillina, cioè l'acido 6-amminopenicillanico (6-APA).
La produzione industriale di 6-APA per idrolisi enzimatica di penicillina (prodotta per via fermentativa), introdotta negli anni Ottanta, ha raggiunto alla fine degli anni Novanta, insieme a quella dell'acido 7-amminodesossiacetilcefalosporanico (7-ADCA) da cefalosporina G, parecchie migliaia di tonnellate all'anno (fig. 7).
La penicillinaacilasi (PGA) è specifica per la catena laterale della penicillina (acido fenilacetico). Industrialmente si adopera PGA prodotta da Escherichia coli (v. figura 7a), che idrolizza la penicillina G (benzilpenicillina). Un altro enzima utilizzato è la PGA sintetizzata da Bovista plumbea che idrolizza invece la penicillina V (fenossimetilpenicillina), ottenuta aggiungendo 2-fenossietanolo, invece che acido fenilacetico, come precursore durante la fermentazione. Questi due enzimi idrolizzano anche le cefalosporine ottenute per allargamento chimico delle rispettive penicilline, come mostrato in figura 7b per la cefalosporina G. L'economia del processo, dalla sua introduzione, è stata continuamente migliorata, manipolando geneticamente i microrganismi allo scopo di aumentame la produzione enzimatica e perfezionando le tecniche di immobilizzazione.
Il 6-APA è il prodotto di partenza per la sintesi delle penicilline semisintetiche, composti nei quali l'acido fenilacetico è sostituito da altri gruppi che conferiscono alla molecola una maggiore stabilità e un più ampio spettro antibatterico, e quindi sono terapeuticamente più utili. Per lungo tempo l'unico metodo praticabile per la produzione di 6-APA fu l'idrolisi chimica, operante a bassa temperatura (-40°C) e impiegante, per l'idrolisi del legame ammidico, cloroderivati del fosforo e del silicio e ammine aromatiche in solventi organici. I motivi dell'affermazione del processo enzimatico sono quindi evidenti: l'uso della dimetilanilina nel processo chimico solleva non solo perplessità sulla sicurezza del prodotto, ma anche problemi ambientali notevoli, a causa della cancerogenicità dell'ammina aromatica. Inoltre il pentacloruro di fosforo è un composto difficile da maneggiare e immagazzinare, e richiede particolari precauzioni nell'utilizzo e nel trattamento degli efiluenti. Le rese in 6-APA del processo enzimatico, infine, sono molto elevate e almeno pari a quelle del processo chimico (Johann, 1993).
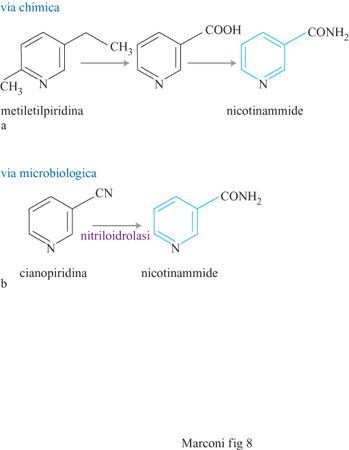
Un'importante società svizzera, leader nella produzione di acido nicotinico (importante intermedio per prodotti farmaceutici e di chimica fine) e di nicotinammide (vitamina PP o B₃), ha sviluppato recentemente a livello industriale una biotrasformazione della 3-cianopiridina in nicotinammide che si è rivelata competitiva con la sintesi chimica da metiletilpiridina (fig. 8). Per l'idrolisi parziale della cianopiridina si impiega l'enzima nitriloidrolasi (da Rhodotorula rhodoctous) immobilizzato, simile a quello impiegato per idrolizzare l'acrilonitrile ad acrilammide.
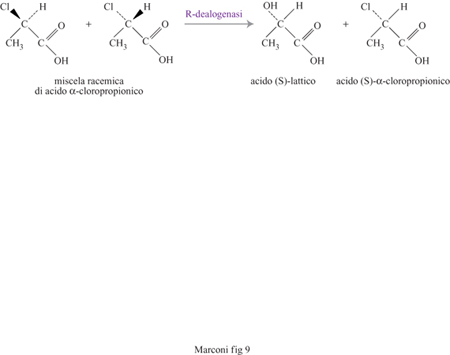
Un importante campo di applicazione delle sintesi chirali è costituito dagli intermedi per fitofarmaci. Una delle più importanti classi di tali prodotti è costituita dai derivati dell'acido 2-fenossipropionico, erbicidi venduti come miscele racemiche, ma nei quali la forma biologicamente attiva è sempre costituita da un solo isomero. Sebbene la miscela racemica ottenuta per sintesi chimica possa essere separata nei suoi enantiomeri con le tradizionali tecniche di cristallizzazione, vi sono notevoli vantaggi, economici e ambientali, nel produrre direttamente l'erbicida da intermedi a elevata purezza ottica. A spingere in questa direzione sono sia l'ampiezza del mercato di questi prodotti sia il fatto che, in linea di principio, le tecnologie già studiate per la sintesi di farmaci chirali possono essere adattate per produrre intermedi chirali per fitofarmaci. In un processo sviluppato a questo scopo (processo Zeneca) l'intermedio chiave è l'acido α-cloropropionico racemico, una miscela equimolare dei due enantiomeri contenenti l'atomo di carbonio chirale in configurazione assoluta, rispettivamente R e S. L'obiettivo è quello di dealogenare selettivamente l'acido (R)-α-cloropropionico lasciando inalterato l'isomero S, che si desidera impiegare in forma pura per la successiva sintesi dell'erbicida (fig. 9). La dealogenazione, che trasforma l'acido (R)-cloropropionico in acido (S)-lattico, è ottenuta impiegando cellule microbiche selezionate per produrre in abbondanza l'enzima specifico Rdealogenasi. Le cellule sono prodotte a parte in un fermentatore e aggiunte in un reattore contenente il substrato. Il reattore, adeguatamente mescolato, opera in discontinuo. Alla fine della reazione le cellule sono rimosse per filtrazione. La capacità dell'impianto è di 2000 t/anno. È interessante notare che il processo Zeneca non costituisce l'unica tecnologia industrialmente impiegabile per questo tipo di produzione: presso il Massachusetts lnstitute of Technology è stato sviluppato un processo basato sull'esterificazione selettiva con butanolo, catalizzata dall'enzima lipasi, del solo isomero S, separabile con le normali tecniche (data la notevole differenza di proprietà fisiche) dall'acido libero di forma R.
Biotrasformazioni di acidi grassi e loro derivati. - L'idrolisi dei grassi animali e vegetali è alla base di processi tradizionali di grande importanza che portano alla produzione di acidi grassi a catena lunga (i cui sali alcalini costituiscono il sapone) e di glicerina. Questi processi avvengono industrialmente con l'impiego di soluzioni alcaline o di acidi minerali forti e risultano per questo altamente inquinanti. L'impiego generalizzato di enzimi per questo tipo di processi è per ora economicamente troppo oneroso; essi trovano invece impiego crescente per le biotrasformazioni di acidi grassi e loro derivati. In queste reazioni, di notevolissimo interesse industriale e spesso impossibili da realizzarsi con metodologie di tipo chimico, vengono principalmente impiegate le lipasi. Esse sono di vario tipo e specificità: esistono lipasi in grado di saponificare il legame estereo localizzato sull'ossidrile secondario della glicerina, ma non quelli legati ai due ossidrili alcolici primari.
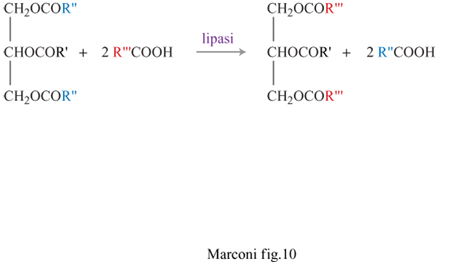
Le lipasi non sono in genere specifiche per quanto riguarda il tipo (presenza o assenza di insaturazioni) e la lunghezza della catena dell'acido grasso, cosa che ne permette una notevolissima versatilità di impiego. L'importanza di questo mercato ha spinto i produttori di enzimi a studiare microrganismi in grado di produrre non solo quantità più elevate di enzima, ma anche enzimi più stabili e in grado di operare in ampi intervalli di temperatura e di pH e in presenza di solventi organici. Le lipasi catalizzano la scissione idrolitica dei trigliceridi, presenti in oli e grassi, nei loro costituenti (glicerina e acidi alifatici a catena lunga). Tali enzimi catalizzano anche, in assenza di acqua, la reazione di sintesi dell'estere, o la reazione di transesterificazione, che permette di sostituire nella molecola lipidica uno o due residui acidi con altri di tipo diverso (a catena insatura, a più basso numero di atomi di carbonio, ecc.), secondo lo schema mostrato in figura (fig. 10), dove R'" è il nuovo sostituente che si vuole introdurre. Questa reazione permette di ottenere un nuovo olio o grasso con proprietà fisiche o caratteristiche strutturali o nutrizionali migliorate.
Caratteristica peculiare di questa tecnologia è di fornire prodotti a elevata purezza. Inoltre, la specificità e le blande condizioni di reazione delle transesterificazioni (o delle esterificazioni) enzimatiche possono essere sfruttate per produrre esteri per i quali le vie di sintesi convenzionali non sono economiche e talvolta neppure disponibili, come nel caso di alcuni acidi o alcoli insaturi. Una multinazionale, per esempio, ha sviluppato un nuovo trigliceride basato su grassi vegetali, da impiegare nel latte artificiale per neonati, in quanto la struttura di questo nuovo trigliceride è molto simile a quella dei grassi contenuti nel latte umano. In generale, i trigliceridi 'strutturati' che presentano vantaggi dal punto di vista nutrizionale costituiscono un mercato in forte sviluppo con numerose formulazioni già commercializzate in Giappone e negli Stati Uniti.
Centinaia di tonnellate l'anno di esteri per l'industria cosmetica sono attualmente prodotte impiegando lipasi immobilizzata per fare avvenire, anziché l'usuale reazione di idrolisi degli esteri, la loro sintesi a partire da acido e alcol, in assenza di acqua:
Le lipasi microbiche accoppiano a un'elevata stereoselettività (cioè la capacità di agire su un solo enantiomero in una miscela racemica) un'ampia specificità di substrato, nel senso che possono esercitare la loro azione catalitica su molecole contenenti, sull'atomo di carbonio otticamente attivo, sostituenti anche notevolmente diversi fra loro. Esse sono inoltre attive (cosa rara per un enzima) in solventi organici in assenza quasi totale di acqua. Per questo sono attivamente studiate per la risoluzione di miscele racemiche di alcoli, acidi o esteri. Un'applicazione molto importante riguarda gli antinfiammatori non steroidei, spesso costituiti da derivati dell'acido propionico sostituito con gruppi arilici in posizione β (Naproxen, Ibuprofen, ecc.). Poiché solo uno dei due isomeri presenti nella specialità è dotato di attività terapeutica e poiché questi farmaci non sono privi di effetti secondari, vi è un forte interesse nel risolvere la miscela racemica, in modo da commercializzare specialità contenenti il solo isomero attivo. Le lipasi (in particolare quelle di lieviti e muffe) si sono dimostrate assai efficaci nell'idrolizzare con velocità molto diversa gli esteri (metilico, etilico, ecc.) dei due stereoisomeri, e nel sintetizzare, partendo dall'acido racemico e dall'alcol, l'estere di una sola delle due forme prima dell'inizio della sintesi (chimica e non enzimatica) dell'estere dell'altro stereoisomero (Servi, 1996). Ciò rende possibile una separazione abbastanza agevole del prodotto voluto.
Amminoacidi e loro derivati. - Gli amminoacidi sono i costituenti fondamentali delle proteine, e la loro produzione industriale ha come principali destinatari le industrie farmaceutiche e alimentari.
La domanda di amminoacidi da parte delle società farmaceutiche deriva dal fatto che i peptidi e le proteine sono impiegati a scopo terapeutico, e questo ha portato, soprattutto a partire dalla fine degli anni Ottanta, allo sviluppo di farmaci costituiti da particolari amminoacidi e da loro derivati. La loro tipologia è assai varia e non si limita agli amminoacidi presenti in natura; vi è, per esempio, una grande domanda di alcuni D-amminoacidi, che ovviamente non sono presenti in natura (salvo rarissime eccezioni, non rilevanti da questo punto di vista). Diversi dolcificanti sintetici e aromatizzanti (come l'aspartame e il glutammato monosodico) sono costituiti da amminoacidi, e vi è attualmente un'intensissima attività di ricerca e di sviluppo in quest'area, data l'importanza del mercato stimato, a livello mondiale, in 3 miliardi di dollari annui alla fine degli anni Novanta. Il successo commerciale dell'aspartame, su cui torneremo, ha dimostrato la possibilità di successo di una sintesi industriale di peptidi e del loro impiego come additivi alimentari.
Alcuni amminoacidi sono prodotti direttamente su larga scala per via fermentativa, altri richiedono vie di sintesi enzimatiche, o in parte chimiche e in parte enzimatiche. I progressi fatti nell'applicazione delle tecniche di ingegneria genetica per migliorare l'efficienza dei processi fermentativi hanno esercitato un impatto decisivo sulla produzione di alcuni di essi. Per esempio, negli anni Novanta, sono stati sviluppati numerosi processi di sintesi di L- fenilalanina da benzaldeide; la via fermentativa, tuttavia, appare economicamente più conveniente, a causa dei miglioramenti produttivi ottenuti con microrganismi modificati geneticamente. Le industrie giapponesi sono all'avanguardia nella produzione di amminoacidi e loro derivati, e hanno dimostrato notevoli capacità non solo nell'individuazione e nell'ottimizzazione del biocatalizzatore idoneo, ma anche nello sviluppo dei relativi processi industriali su larga scala. Una società giapponese, per esempio, è leader del mercato dell'acido L-aspartico a grado farmaceutico, la cui produzione ammonta a 6000 tonnellate l'anno. Esso è sintetizzato a partire da acido fumarico e ammoniaca mediante l'enzima aspartasi, secondo lo schema:
HOOCCH = CHCOOH + NH₃ →
HOOCCH₂CH (NH₂) COOH
Il biocatalizzatore non è costituito dall'enzima o da preparati enzimatici, ma sono utilizzate cellule di E. coli ad alta attività aspartasica, modificate con tecniche del DNA ricombinante, immobilizzate in un gel polisaccaridico (carragenano). Le cellule così immobilizzate vengono impaccate in un reattore a letto fisso operante in continuo. L'immobilizzazione delle cellule permette l'impiego di reattori operanti in continuo ed evita i costi di estrazione dell'enzima; il catalizzatore inoltre è estremamente stabile: la sua attività si dimezza solo dopo tre anni di lavoro.
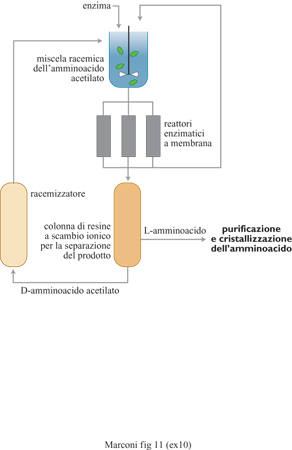
L'impiego di amminoacidoacilasi per ottenere amminoacidi otticamente attivi a elevata purezza, utilizzando come materia prima di partenza l'amminoacido racemico acetilato al gruppo amminico rappresenta un importante capitolo dell'enzimologia industriale, e può essere realizzato impiegando l'enzima sia allo stato immobilizzato su matrici polimeriche, sia in soluzione in reattori a membrane ultrafiltranti. Una società all'avanguardia nello sviluppo di reattori a membrana su scala industriale ha sviluppato parecchie tecniche enzimatiche per la produzione di L-amminoacidi e di D-amminoacidi. La prima applicazione fu l'impiego di acilasi nella produzione di L-valina e di L-metionina, che non sono facilmente ottenibili in modo economico per via fermentativa. Il reattore a membrana permette così la risoluzione della miscela racemica dell'N-acetilamminoacido sintetizzato per via chimica. Parecchie centinaia di tonnellate l'anno di L-amminoacidi ad altissima purezza sterica sono prodotte con questa tecnologia (fig. 11).
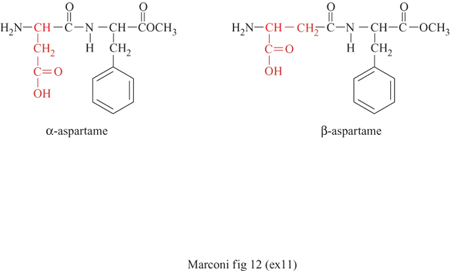
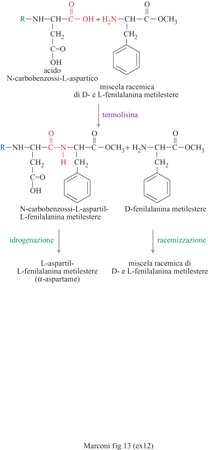
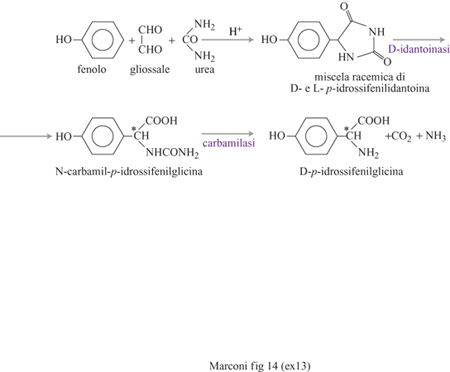
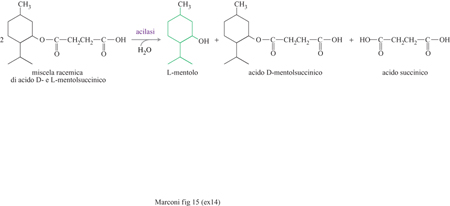
L'interesse commerciale di amminoacidi come l'acido Laspartico e la L-fenilalanina deriva in larga misura dal fatto che essi costituiscono le materie prime fondamentali per la sintesi dell'aspartame, un dolcificante ipocalorico non presente in natura, con un potere edulcorante di molto superiore al saccarosio (da 150 a 200 volte), completamente metabolizzabile e innocuo, come confermato da lunghi studi tossicologici e dall'approvazione da parte della FDA alla sua messa in commercio negli Stati Uniti. Dal punto di vista chimico, esso è un dipeptide, derivante dalla condensazione dell'acido L-aspartico con l'estere metilico della L-fenilalanina. Il suo sapore dolce dipende dalla conformazione L degli amminoacidi, dalla presenza del gruppo metilestere sulla fenilalanina e dalla condensazione selettiva di questa con il carbossile dell'acido aspartico in posizione a rispetto al proprio gruppo amminico. Quest'ultima caratteristica è essenziale affrnché non venga prodotto anche il β-aspartame, che ha un sapore amaro (fig. 12). Mediante la tradizionale sintesi chimica, invece, la formazione anche di β-aspartame è inevitabile (20÷40% a seconda della via seguita); la sua eliminazione richiede tecnologie complesse data l'estrema somiglianza, dal punto di vista chimico, dei due composti. La sintesi chimica, inoltre, richiede stadi complessi di protezione e il successivo ristabilimento di gruppi funzionali, nonché l'impiego di amminoacidi in forma L, assai più costosi della forma racemica. Una società giapponese ha introdotto la sintesi enzimatica, che evita tutti questi inconvenienti, e che impiega l'enzima termolisina, una proteasi neutra sintetizzata da Bacillus thermoproteoliticus. La reazione è condotta in acetato di etile saturo d'acqua, a 50÷60 °C, impiegando l'enzima immobilizzato in una matrice polimerica idrofilica, e usando come reagenti l'acido L-aspartico (il cui gruppo amminico è protetto con un gruppo carbobenzossilico che viene poi eliminato per idrogenazione) e l'estere metilico della D, L-fenilalanina. La reazione, a causa delle regioselettività e della stereoselettività indotte dall'enzima, avviene solo fra il gruppo carbossilico dell'acido aspartico in posizione a e l'isomero L dell'estere della fenilalanina (fig. 13). Nel 1999 la produzione enzimatica di aspartame da parte di una delle maggiori società del settore ammontava a 2000 tonnellate l'anno, per un fatturato di circa 100 milioni di dollari. Di notevole rilevanza industriale è anche il processo di sintesi enzimatica della para-idrossifenilglicina, impiegata al posto dell'acido fenilacetico nelle moderne penicilline (amoxicillina) o nelle cefalosporine semisintetiche (fig. 14). Derivati terpenici Un'interessante applicazione di risoluzione di miscele racemiche con cellule immobilizzate operanti in un sistema non acquoso, ma in un solvente organico, è costituita dall'idrolisi stereo specifica degli esteri racemici del mentolo a opera di cellule immobilizzate di Rhodotorula minuta, nella quale viene idrolizzato solo uno dei due costituenti della miscela di esteri (destrogiro o levogiro) del mento lo con formazione di L-mentolo (fig. 15). Questa sostanza viene usata come aromatizzante in molti prodotti di largo consumo come la gomma da masticare. La necessità di operare in un solvente organico deriva dall'insolubilità in acqua dei prodotti.
Tecnologie produttive impieganti enzimi e cellule vegetali
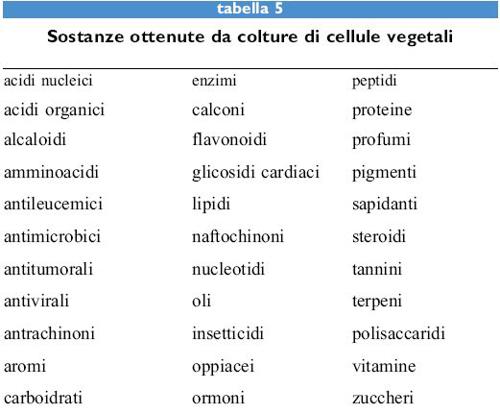
Le cellule vegetali, e più in generale le piante nel loro insieme, forniscono un considerevole contributo a molti settori dell'industria, in particolare a quello farmaceutico e a quello dei cosmetici. Per esempio, nella farmaceutica il 25% delle medicine contiene prodotti isolati da piante; le più comuni di queste sostanze sono steroidi, glicosidi cardiaci, alcaloidi e acetogenine (tab. 5). Dalla tabella si può notare che sono rappresentate quasi tutte le classi merceologiche di prodotti. Va inoltre rilevato che i miglioramenti nell 'utilizzazione delle produzioni agricole primarie, conseguiti spesso mediante un'intelligente azione sinergica fra miglioramenti vegetali di tipo genetico e processi innovativi basati sull'impiego dell'enzimologia, hanno condotto non solo ad alimenti e prodotti industriali di tipo innovativo, ma anche, grazie a notevoli diminuzioni dei costi di produzione, a una valorizzazione ottimale delle risorse agricole esistenti.
Uno degli scopi fondamentali dell'evoluzione di queste tecnologie, nel prossimo futuro, sarà anche la realizzazione di sistemi produttivi in grado di diminuire sensibilmente l'attuale impatto inquinante. Inoltre è prevedibile che l'introduzione di nuove biotecnologie provocherà, in settori di importanza fondamentale come quello alimentare, profonde modificazioni anche nelle abitudini dei consumatori. Nei paesi industrializzati, infatti, accanto a una sovrapproduzione di derrate agricole tradizionali, i consumatori sono sempre più informati ed esigenti per quanto riguarda le caratteristiche dietetiche, il contenuto nutrizionale e la non pericolosità degli alimenti, anche in relazione alle tecniche di trasformazione, conservazione e confezionamento. Sono state così introdotte modificazioni dei prodotti di base allo scopo di migliorarne le caratteristiche nutrizionali e funzionali, ed è stata svolta un'intensa attività nei settori della produzione di metaboliti importanti quali gli aromi, i pigmenti, le vitamine, gli antiossidanti di origine naturale, gli enzimi, i lipidi, ecc. mediante una grande varietà di tecniche basate sull'uso di microrganismi e colture di tessuti. La produzione di sostanze naturali mediante coltura in vitro di cellule vegetali presenta, senza dubbio, dei vantaggi rispetto all'isolamento degli stessi prodotti da materiale vegetale proveniente da piantagioni di tipo tradizionale. I principali sono l'indipendenza da fattori ambientali (clima, infezioni delle colture, fattori stagionali, geografici e geopolitici); la possibilità di ottenere prodotti di qualità più elevata e costante attraverso il controllo delle variabili di processo; una maggiore elasticità decisionale, intesa come possibilità di stabilire, in base alle esigenze di mercato, dove, quando e in che quantità produrre e, infine, rese più elevate rispetto alle tradizionali tecnologie estrattive.
Il maggiore interesse della coltura di cellule vegetali risiede nella produzione di farmaci difficili da sintetizzare per via chimica o che possono sostituire molecole di sintesi complessa e inquinante (Van der Esch et al., 1993). Nella tabella (tab. 6) sono elencati i principali farmaci ottenibili da organismi vegetali superiori e la relativa attività farmacologica.
Anche altri settori industriali possono trarre notevoli vantaggi dall'ottenimento di prodotti ad alto valore aggiunto mediante colture di cellule vegetali. Tra questi si possono citare l'industria alimentare, l'industria cosmetica, per la produzione di oli essenziali (olio di rose e di gelsomino dalle relative specie) e, infine, l'industria dei fitofarmaci per la produzione di piretroidi da Chrysanthemum spp. Tuttavia questo tipo di coltura, in grado di fornire un numero crescente di sostanze, ha una bassa produttività cellulare. L'impegno della ricerca in questo settore è quindi indirizzato all'ottenimento di linee cellulari maggiormente produttive, alla loro stabilizzazione genetica e, infine, all'identificazione di parametri bio fisici che permettano la crescita del processo fino a dimensioni industriali (Miele, 1997).
Le colture di cellule vegetali vengono effettuate usando come materiale di partenza il callo della pianta, una massa di tessuto non differenziato che si forma ogni qualvolta una pianta subisce una ferita, come escrescenza cicatriziale. Questo ammasso cellulare, espiantato e posto in un terreno di coltura arricchito con opportune sostanze nutrienti e regolatori di crescita (auxine, giberelline, ecc.), è in grado di sviluppare cellule differenziate, capaci di produrre le sostanze desiderate, con tecniche fermentative di tipo continuo o semicontinuo simili a quelle impiegate per organismi di tipo microbico.
L'immobilizzazione di cellule vegetali è stata sperimentata inizialmente per studiare il comportamento di queste cellule in un mezzo che simuli quello presente nel tessuto delle piante, per studiare il ridifferenziamento cellulare e, successivamente, per verificare i vantaggi dell'immobilizzazione nella produzione di alcune sostanze naturali molto costose. La lenta crescita delle cellule vegetali rispetto a quelle microbiche consiglia metodi di immobilizzazione da realizzare in condizioni di sterilità per evitare rischi di contaminazioni batteriche.
L'immobilizzazione di cellule vegetali offre vantaggi senza dubbio superiori rispetto all'immobilizzazione di cellule batteriche. Innanzitutto per il maggiore costo di investimento e di gestione nella produzione di biomassa: le cellule vegetali crescono molto lentamente, raggiungono densità cellulari molto basse, la crescita è influenzata dalla sintesi di inibitori e, infine, i terreni di coltura sono molto costosi. La possibilità di riutilizzare questa biomassa offre, così, consistenti benefici economici.
Trasformazioni e sintesi di sostanze complesse mediante cellule vegetali
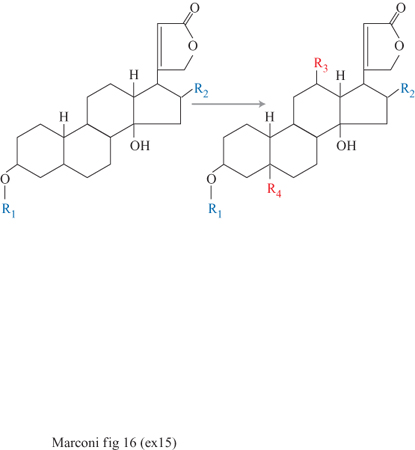
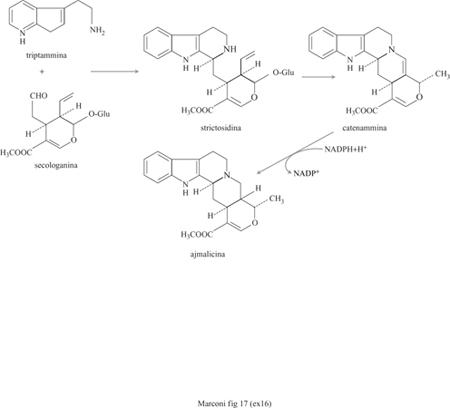
Le cellule vegetali sono molto grandi (100 μm), sono sensibili agli stress meccanici e sono anche molto sensibili ai re attivi chimici; pertanto, l'immobilizzazione mediante inclusione in matrici polimeriche risulta la più adatta. La capacità delle cellule vegetali di trasformare e sintetizzare sostanze a struttura molecolare molto complessa e di grande interesse commerciale può realizzarsi mediante tre distinte attività biosintetiche: semplici biotrasformazioni, sintesi da precursori e sintesi ex novo. Nella prima categoria rientrano reazioni di idrossilazione, glucosilazione, metilazione e riduzione od ossidazione di molecole molto complesse. Un esempio di biotrasformazioni di glucosidi, con cellule immobilizzate di Digitalis causata o di Daucus carota, è riportato in figura (fig. 16); l'introduzione dei gruppi funzionali R3 e R4 (generalmente ossidrili), effettuata per via chimica, sarebbe estremamente difficile. La sintesi da precursori è un'attività complessa che porta a una serie di biotrasformazioni a partire da alcuni precursori. Un esempio pratico è fornito da cellule immobilizzate di Catharanthus roseus che a partire da triptamina e secologanina producono ajmalcina, un antipertensivo e tranquillante (fig. 17).
La sintesi di metaboliti secondari complessi a partire da comuni fonti di carbonio, come il saccarosio (sintesi ex novo) costituisce la più ambiziosa applicazione delle colture di cellule vegetali, e si basa sullo sfruttamento coordinato del patrimonio enzimatico elaborato dalla cellula per le funzioni metaboliche.
Le difficoltà che si incontrano in queste procedure sono sostanzialmente di due tipi: le cellule contengono enzimi che catalizzano reazioni indesiderate e la parete e la membrana cellulare possono impedire o rallentare la diffusione di substrati e prodotti. A questi inconvenienti si sta ovviando con l'impiego di agenti in grado di operare sia un'appropriata permeabilizzazione cellulare sia un'inattivazione enzimatica selettiva.
Le biotrasformazioni possono risultare, sotto un certo aspetto, meno interessanti delle biosintesi perché altri catalizzatori più semplici (enzimi o cellule microbiche) sono in grado di compiere le stesse reazioni. La biosintesi, d'altra parte, richiede un maggiore controllo del metabolismo cellulare ed è difficile che un substrato semplice sia trasformato in uno a struttura complessa con elevata efficienza di bioconversione. La complessità del metabolismo cellulare e la scarsa conoscenza, allo stato attuale, dei fattori di controllo impongono un approccio empirico all'uso degli ormoni e degli altri mediatori cellulari nel promuovere la formazione del metabolita desiderato, minimizzando reazioni collaterali.
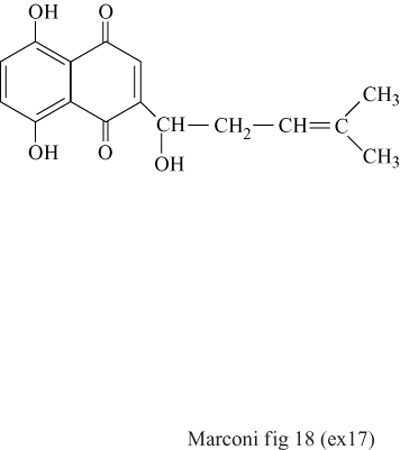
Un esempio interessante di come la combinazione di tecniche sofisticate possa portare a spettacolari miglioramenti nei processi produttivi basati su biotecnologie avanzate è dato dai recenti sviluppi nella sintesi della sciconina. La sciconina, un derivato naftochinonico di colore rosso scuro, è impiegata come colorante, antibatterico e agente antinfiammatorio, ed è prodotta industrialmente mediante colture cellulari di Lithospermum erythrorbizon (fig. 18). In un recente studio queste cellule vegetali sono state impiegate in bioreattori, immobilizzate in alginato di calcio, e, altra novità, è stato usato un sistema bifasico impiegante come fase organica n-esadecano, in grado di dissolvere, allontanando la dalla fase acquosa, la maggior parte della sciconina prodotta. Si sono così ottenuti incrementi di produttività, a parità di volume di reazione, sino a 25 volte rispetto alla tecnologia tradizionale, basata sull'uso di colture cellulari non immobilizzate.
È certo comunque che il contributo maggiore al miglioramento di questi processi catalitici verrà dall'ingegneria genetica. Mediante le tecniche del DNA ricombinante è infatti possibile aumentare la produzione degli enzimi che regolano l'attività del complesso catalitico; è anche possibile modificare i meccanismi di regolazione metabolica al fine di massimizzare il flusso metabolico verso i prodotti desiderati, bloccando le vie secondarie. Tali sforzi di ricerca, abbinati a quelli per migliorare la stabilità operativa dei biocatalizzatori e l'efficienza reattoristica, condizioneranno in modo decisivo il successo delle applicazioni industriali delle biotecnologie anche nel settore dei prodotti vegetali.
Biotecnologie nei processi di raffinazione
Un settore delle biotecnologie di crescente interesse applicativo riguarda la sostituzione nell'industria estrattiva di tecnologie chimiche altamente inquinanti che spesso richiedono elevati consumi energetici. Un particolare interesse è rivolto all'introduzione di queste metodologie innovative nel settore minerario e metallurgico e in quello dei combustibili fossili, come il petrolio e il carbone, data l'ampiezza dei volumi di queste produzioni e il conseguente inquinamento ambientale che le tecnologie tradizionali possono provocare. Queste nuove biotecnologie devono misurarsi con fattori economici assai penalizzanti, come il basso valore aggiunto ormai legato ai processi di trasformazione delle materie prime e il fatto che decenni (e talvolta secoli) di impiego delle tecnologie tradizionali hanno portato a una loro ottimizzazione tecnica ed economica. È quindi probabile che una loro estesa applicazione potrà derivare non solo da un miglioramento dei ceppi microbici impiegati (in termini di produttività, selettività, resistenza a prodotti tossici) o dall'ottimizzazione del ciclo impiantistico, ma anche da una crescente sensibilità dell'opinione pubblica verso i problemi ambientali e, quindi, dall'emanazione di conseguenti norme legislative. l principali campi applicativi di queste biotecnologie riguardano essenzialmente il trattamento microbiologico di minerali metallici e la desolforazione microbiologica di combustibili fossili.
Trattamento microbiologico di minerali metallici
Diversi processi chimici industriali per il trattamento di minerali sono da tempo in discussione per ragioni d'impatto ambientale; in particolare questo problema riguarda il settore estrattivo, il trattamento dei minerali, lo smaltimento dei reflui di miniera e di scarti derivanti da processi metallurgici.
Considerando la crescente attenzione legislativa per l'ambiente, è probabile che questa tendenza si accentui in futuro. Questi processi richiedono fasi ossidative ad alta temperatura alquanto costose (pirometallurgica) o lisciviazioni acide con sostanze ossidanti e riducenti (idrometallurgia) che comportano la liberazione o l'impiego di sostanze tossiche come il diossido di zolfo, il solfuro di idrogeno, il monossido di carbonio, ecc. Questa situazione ha favorito lo sviluppo della ricerca di tecnologie alternative, potenzialmente meno inquinanti e costose, adatte anche ai trattamenti di materiali a basso tenore di metalli, non trattabili con le tecniche convenzionali. In questo contesto, notevole interesse hanno ricevuto le biotecnologie in grado di operare ossidoriduzioni ad alta velocità e a temperatura ambiente. l processi bioidrometallurgici, che utilizzano microrganismi nel trattamento dei minerali e nei processi di depurazione di reflui inquinati da metalli pesanti, rappresentano una potenziale alternativa tecnologica ai processi convenzionali di trattamento dei minerali, quali i processi pirometallurgici e idrometallurgici. Per questa ragione si assiste in tutto il mondo allo sviluppo di molti processi industriali integrati, di tipo chimico-biologico, che aprono nuove frontiere nel settore della bioidrometallurgia.
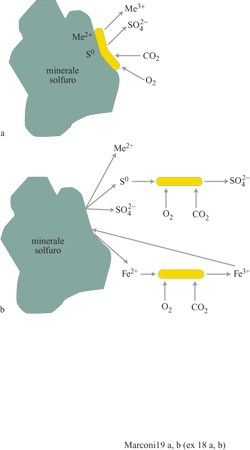
L'ossidazione biologica di minerali solfuri sfrutta le proprietà di un particolare gruppo di microrganismi in grado di ossidare il minerale a temperatura e pressione ambiente. Tali microrganismi sono chemioautotrofi, cioè ricavano l'energia da sostanze chimiche e utilizzano CO2 come principale fonte di carbonio. I composti da cui i microrganismi in questione traggono energia sono in generale composti inorganici ridotti (composti solforati ridotti, composti azotati ridotti, composti ferro si, ecc.). Nel caso della biolisciviazione la fonte di energia è la reazione di ossidazione del minerale solfuro o quella di ossidazione dello ione ferro so in soluzione, a seconda del tipo di microrganismo. I batteri più utilizzati per il processo di biolisciviazione sono quelli appartenenti al genere Thiobacillus, in particolare il T. thiooxidans e il T. ferrooxidans.
Il processo di lisciviazione batterica si realizza attraverso varie interazioni di tipo fisico e chimico tra i batteri, i minerali solfuri, gli ioni e i composti precipitati nel mezzo di coltura. Di conseguenza il sistema è molto complesso e non ne è stata ancora data una definizione esauriente. Sulla base delle conoscenze attuali dei processi la dissoluzione dei minerali solfuri ha luogo attraverso due meccanismi principali. Nel primo (meccanismo diretto) la dissoluzione del minerale è determinata dai microrganismi, adesi sulla superficie, che utilizzano il minerale come sorgente energetica (fig. 19). Si tratta quindi, in questo caso, di un'ossidazione biologica diretta. Nel secondo (meccanismo indiretto) si verifica l'ossidazione degli ioni ferrosi da parte dei batteri liberi in soluzione, seguita dall'ossidazione chimica del minerale da parte dello ione ferrico. In seguito all'ossidazione chimica si ha la formazione di ione ferroso e di zolfo elementare, i quali vengono successivamente ossidati biologicamente (v. figura 19b).
Le principali applicazioni industriali riguardano la biolisciviazione di minerali di uranio, di rame e auriferi. In questi processi sono utilizzate di solito popolazioni naturali di solfobatteri come T. acidophilus e T. ferrooxidans che possono essere isolati dagli effluenti delle miniere di uranio. In particolare T. acidophilus (o T. organoparus) è un batterio che ossida ferro e zolfo e utilizza zuccheri come glucosio e fruttosio, acidi organici come citrato e malato, amminoacidi come aspartato e glutammato. T. ferrooxidans è una tipica specie litoautotrofica che ricava l'energia necessaria per rendere organico il carbonio di CO2, dall'ossidazione di differenti solfuri. Entrambi questi batteri crescono a pH molto bassi (1,5÷2,0). La solubilizzazione dell 'uranio è catalizzata da questi microrganismi, mentre l'ossidazione dell'uranio ridotto è ottenuta con ione ferrico:
UO2 + 2Fe3+ → UO22+ + 2Fe2+.
La riossidazione dello ione ferro so a pH bassi è molto lenta in assenza di un ossidante chimico o di un catalizzatore biologico. T. ferrooxidans permette la rapida sostituzione dello ione ferrico consumato mediante la seguente reazione:
4Fe2+ + O2 + 4H+ → 4Fe3+ + 2H2O.
D'altro canto T. ferroxidans è in grado di ossidare direttamente i composti d'uranio allo stato ridotto (quali il solfato di uranile e diossido UO2) senza il coinvolgimento diretto della coppia Fe³+/Fe2+, ma agendo come trasportatore esterno di elettroni, secondo le reazioni:
2U⁴+ + O2 + 4H+ → 2U⁶+ + 2H2O
2UO2 + O2 + 4H+ → 2UO22+ + 2H2O.
La produzione di uranio nell'Ontario (Canada), ottenuta mediante lisciviazione chimica seguita da separazione liquido/solido e scambio ionico è stata accresciuta di 210 tonnellate l'anno, inserendo nella macinazione convenzionale una fase di biolisciviazione.
La solubilizzazione del rame e dello zinco è conseguente all'attacco microbico di calcopiriti o di blende. Il rame ottenuto per questa via rappresenta più del 10% della produzione industriale totale degli Stati Uniti.
L'oro può essere recuperato da alcuni minerali mediante metodi gravimetrici o mediante lisciviazione diretta con cianuro, ottenendo rese di estrazione fino al 90%. La cianurazione è un processo relativamente semplice ed economico, applicabile al trattamento di minerali e residui di varia natura contenenti oro. l minerali solfuri spesso contengono oro e altri metalli preziosi finemente disseminati all'interno dei cristalli di solfuro; l'incapsulamento di queste particelle conferisce al materiale un carattere inerte, per cui queste frazioni vengono frequentemente perse come scarti. Per ottenere un recupero soddisfacente è necessario rompere i cristalli di solfuro per liberare le particelle aurifere, e applicare poi un processo di estrazione convenzionale.
La scelta del processo per il trattamento del minerale o del concentrato refrattario si basa su valutazioni tecniche, economiche e ambientali. Esistono diverse metodiche che consentono la degradazione ossidativa di una matrice minerale costituita da solfuri: arrostimento ossidante, pressione ossidante, ossidazione batterica e ossidazione chimica.
Il processo di lisciviazione biologica è stata preso in considerazione solo recentemente per il trattamento di minerali e concentrati auriferi. In alcuni casi, il biotrattamento ha consentito di ottenere un incremento dal 30% al 90% dell'estrazione dell'oro e dal 45% al 95% di quella dell'argento. Il processo di biolisciviazione dissolve la matrice del solfuro, esponendo così i metalli preziosi all'azione dell'attacco chimico.
Per concludere questo argomento, accenneremo al biotrattamento di efiluenti di miniera. Gli efiluenti delle miniere risultano spesso ricchi di metalli e notevolmente acidi; per ovvie ragioni è necessario un trattamento di neutralizzazione e di purificazione. Per ottenere con successo la precipitazione del ferro, però, lo ione ferroso, derivante dai solfuri semplici come le blende e dai solfuri complessi come le calcopiriti, deve essere ossidato prima della neutralizzazione. L'ossidazione tramite T. ferrooxidans, già realizzata nelle miniere di pirite a Yanahara (Giappone), consente un risparmio del 70% rispetto all'ossidazione ottenuta con l'ossido di azoto (lmaizurni, 1986). Sulla base di questi risultati il governo giapponese ha sviluppato un impianto di neutralizzazione degli scarichi acidi delle miniere di Matsuo. Questo impianto si avvale dell'azione di T. ferrooxidans che ossidando lo ione ferro so a ione ferrico permette la sua precipitazione.
Desolforazione microbiologica di combustibili fossili
È ben noto che la presenza di zolfo nei combustibili fossili comporta problematiche di ordine ambientale e tecnologico. Possono essere citate per esempio le emissioni di SOx (principalmente SO2), che contribuiscono all'originarsi di piogge acide, la formazione di particolato, i fenomeni di corrosione delle pipeline e delle apparecchiature, l'avvelenamento dei catalizzatori usati nella raffrnazione e nella combustione. Le normative di legge tendono ad arrestare le emissioni di SO2 (e H2S) presso le raffinerie di petrolio, direttamente alla bocca dei pozzi di produzione del gas e negli impianti di generazione di energia elettrica e termica. Nel contempo, ne vengono sempre più abbassati i livelli ammissibili nei prodotti di origine petrolifera. Per esempio, in alcuni stati europei quali la Finlandia e la Svezia, sono in atto politiche fiscali che favoriscono la commercializzazione di gasolio a tenore di zolfo molto limitato (0,001÷0,005%) e negli Stati Uniti il programma dei veicoli a bassa emissione prevede un contenuto di zolfo nelle benzine di 30÷40 parti per milione.
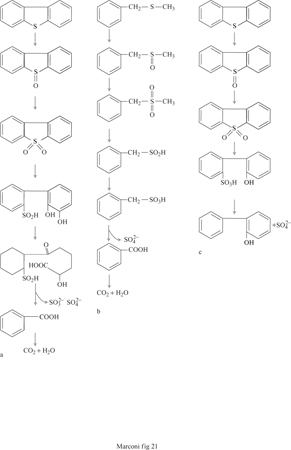
Lo zolfo contenuto nelle frazioni petrolifere non si elimina con facilità, e le difficoltà crescono al crescere del punto di ebollizione del combustibile; è quindi più difficile desolforare un gasolio che la benzina, a causa della maggiore varietà e refrattarietà ai trattamenti chimici dei composti solforati presenti nel primo. Inoltre i trattamenti di deidrosolforazione effettuati in raffineria, operanti ad alta temperatura, con idrogeno sotto pressione e in presenza di opportuni catalizzatori, non solo producono residui solidi fortemente inquinanti, ma trasformano lo zolfo contenuto nella carica idrocarburica solfuro di idrogeno, H₂S. Quest'ultimo è estremamente maleodorante e notevolmente tossico, e richiede ulteriori trattamenti ossidativi che lo trasformino in diossido di zolfo. Nello specifico settore della desolforazione dei prodotti petroliferi le biotecnologie stanno facendo numerosi passi avanti (Klein et al., 1994). Esse mostrano potenzialità di indubbio interesse per le favorevoli condizioni di esercizio, in termini di temperatura, pressione, pH, con conseguente semplicità degli impianti e ridotti fabbisogni energetici, per la capacità di numerosi ceppi batterici di desolforare molecole organiche aromatiche (come, per esempio, il dibenzotiofene, tra le più scarsamente re attive negli impianti di idrodesolforazione convenzionale), e per il loro limitato impatto ambientale. Nel petrolio lo zolfo è legato con ponti solfuro, disolfuro o polisolfuro alle catene alifatiche. In particolare esso si ritrova in molecole organosolforate come mercaptani, solfuri, tiofeni, benzotiofeni e dibenzotiofeni (Oshiro et al., 1995). La rimozione dello zolfo può avvenire mediante attacchi ossidativi del legame C-C, mediante attacchi riduttivi o ossidativi del legame C-S e mediante meccanismi fotosintetici. La rottura ossidativa del legame C-S si presenta come la più interessante sul piano tecnologico; essa avviene secondo percorsi biochimici che possono portare alla completa degradazione delle molecole solforate o al distacco del solo zolfo (fig. 21).
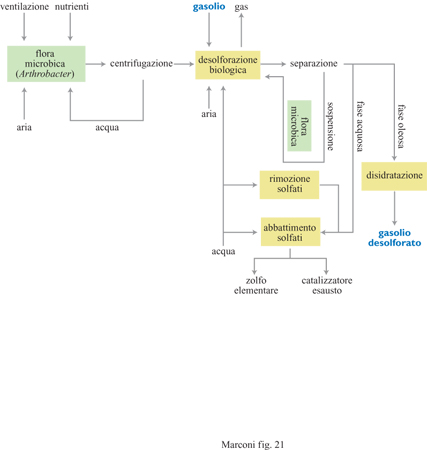
Una società statunitense, in collaborazione con alcune compagnie petrolifere, sta sperimentando in un progetto pilota un processo per la desolforazione di distillati medi petroliferi basato sull'impiego di Rhodococcus rhodocrous. L'impianto pilota, realizzato a St. Louis, ha una capacità di 0,5÷5 barili al giorno. La stessa società prevede di estendere il processo a benzine e petroli debolmente acidi e, a tal fine, ha stabilito accordi con altre compagnie petrolifere. Studi di fattibilità, effettuati impiegando greggi petroliferi e frazioni di distillati medi di vario tipo, hanno dimostrato livelli di desolforazione dal 40% all'80% dello zolfo presente originariamente e si ritiene che questi risultati possano essere ottimizzati. L'analisi economica effettuata ha permesso di concludere che il costo totale di desolforazio ne sarebbe, su scala industriale, di circa 3 dollari al barile (un barile corrisponde a circa 160 kg) per il petrolio grezzo e di 2 dollari al barile per il gasolio.
La figura (fig. 22) mostra lo schema a blocchi di un altro processo, messo a punto dai laboratori di ricerca dell'ENI (Ente nazionale idrocarburi), operante in continuo con un ceppo di Arthrobacter, coltivato a parte e aggiunto dopo centrifugazione al desolforatore.
Per quanto riguarda la desolforazione microbica del carbone, il suo interesse scaturisce da stringenti necessità ambientali legate alla crescente presenza nell'atmosfera di ossidi e acidi dello zolfo derivanti dalla combustione di fossili ad alto tenore di zolfo. Inoltre la depurazione del carbone da solfuri incrementa le sue proprietà calorifiche. Lo zolfo è presente nel carbone in forma inorganica (pirite e solfato) o come zolfo organico (dibenzotiofene e benzotiofene) finemente disperso, che resiste alla rimozione convenzionale. Diversi microrganismi sono utilizzati per la rimozione dello zolfo piritico. I più noti tra questi batteri sono T. ferrooxidans e Leptospirillum ferrooxidans, mentre i risultati più promettenti di rilascio dello zolfo organico derivano dall'impiego di specie batteriche termofile (in grado di lavorare a temperature anche di 70÷80 °C) come Sulfolobus acidocaldarius. I vantaggi del trattamento biologico consistono nella selettività dell'attacco (scarsa perdita di carbone utile), nell'assenza di ceneri, nel riciclo dei sottoprodotti concomitanti (soluzioni acide, solfati di ferro e alluminio), nel basso costo del processo e nella possibilità di effettuare la desolforazione in prossimità delle miniere, lontano dai centri abitati.
Bioproduzioni di interesse ambientale
Un interessante settore di sperimentazione e di applicazione produttiva delle biotecnologie riguarda la produzione di beni anche di largo consumo come polimeri, vettori energetici o prodotti per l'agricoltura, aventi caratteristiche 'pulite' dal punto di vista del loro impatto ambientale. A volte si tratta dell'impiego, strettamente interconnesso, di tecnologie chimiche e biologiche, come nel caso dei ferormoni, che si sono rivelati di fondamentale importanza per la lotta contro gli insetti. Ognuna di queste sostanze, a seconda della sua formula chimica, presenta un'azione estremamente selettiva su ogni singola specie e permette di richiamare solo gli insetti a essa appartenenti in luoghi appositi in cui è possibile la loro eliminazione. Le scienze biologiche hanno fornito le chiavi del meccanismo di azione di queste sostanze, che sono ora prodotte con metodologie chimico-sintetiche.
Un'altra interessante possibilità di questo tipo, nel settore dei vettori energetici, riguarda la produzione di gasoli per esterificazione o transesterificazione di frazioni oleose ottenute da vegetali quali la colza, il girasole o la soia modificati geneticamente. Il vantaggio ambientale sarebbe enorme, poiché combustibili di questo tipo sarebbero, a differenza degli equivalenti prodotti petroliferi, totalmente esenti da zolfo, e perché le fonti vegetali (a differenza dei combustibili fossili) sono rinnovabili.
Premesso che il fattore limitante di queste affascinanti possibilità risiede per ora nell'elevato costo delle tecnologie e dei prodotti che ne derivano, può essere interessante analizzarle più dettagliatamente.
Insetticidi microbici
L'uso degli insetticidi chimici per il controllo degli insetti nocivi presenta alcuni aspetti negativi tra cui spiccano il costo, la persistenza nell'ambiente e la necessità di usare dosi sempre maggiori per l'instaurarsi di meccanismi di resistenza o per la perdita della loro efficacia. Questi inconvenienti hanno incrementato la spinta verso il controllo biologico, basato sull'utilizzo di predatori, parassiti, patogeni e sostanze naturali attrattive o repulsive. Nell'ambito del controllo microbiologico, Bacillus thuringiensis è l'organismo entomopatogenico più studiato. È un batterio largamente distribuito, si trova naturalmente nel suolo e in altri comuni habitat dove si possono trovare gli insetti e può, in particolari condizioni ambientali, generare delle spore. La maggior parte dei batteri entomopatogeni forma endospore all'interno della cellula madre (sporangio). Bacillus thurigiensis, in particolare di tipo aerobio e sporigeno, durante la fase di sporulazione, produce un cristallo proteico detto corpo parasporale, che è il principale responsabile della entomopatogenicità del batterio. Tuttavia, le proteine costituenti il cristallo possono essere presenti anche in altre parti della cellula batterica, quali l'endosporium o la parete della spora, che pertanto possono avere anch'esse una capacità insetticida. Queste tossine non sono dannose per gli uccelli, per i mammiferi (compreso l'uomo) e anche per parecchie specie di insetti utili (api, predatori e parassiti di insetti nocivi).
Bacillus thuringiensis ha un cromosoma circolare lungo circa 1,5 μm e una massa molecolare di 5.000 MDa. Il ciclo vitale di questa specie presenta due fasi ben distinte: nella prima si verifica la crescita esponenziale per moltiplicazione delle cellule vegetative, mentre nella seconda si ha la loro maturazione in sporangi (fig. 23). Ogni sporangio contiene una spora e uno o più corpi parasporali. L'induzione alla sporulazione è determinata dalla carenza di certi elementi nutritivi. Per poter esercitare la sua azione insetticida, Bacillus thuringiensis deve essere ingerito. Esso produce diverse tossine, generalmente durante la fase vegetativa (esotossine), eccetto quella contenuta nel cristallo proteico (endotossina). Ovviamente la composizione e la concentrazione di queste sostanze sono estremamente variabili, e sono influenzate sia dalle caratteristiche genetiche del ceppo batterico sia da fattori ambientali (Rowe e Margalitis, 1987). La classificazione dei diversi biotipi di B. thuringiensis può essere effettuata basandosi sulle loro proprietà immunologiche, suddividendo la specie in sierotipi oppure, più comunemente, in base alla specificità patologica, distinguendo patotipi che infettano gruppi differenti di insetti. Per esempio molti ceppi sono attivi sulle larve di lepidottero, ma altri infettano solo larve di dittero di coleottero.
Bacillus thuringiensis è stato usato per la produzione di insetticidi biologici per applicazioni fogliari a partire dagli anni Sessanta. Viene generalmente prodotto dalla fermentazione di singoli ceppi del batterio su terreni di coltura poveri, che vengono centrifugati. Il prodotto finale è generalmente una polvere solubile in acqua o che può essere dispersa in granuli sul terreno. Uno dei limiti di questo tipo di prodotto è dato dal suo meccanismo d'azione che si basa sull 'ingestione da parte delle larve, cosicché una formulazione di questo tipo non si adatta al controllo di insetti che si alimentano all'interno del loro ospite vegetale.
Per tale motivo le ricerche si sono indirizzate verso la produzione delle proteine del bacillo all'interno delle piante, mediante la creazione di piante transgeniche. Negli anni Novanta questo tipo di approccio ha portato alla produzione di piante quali mais, cotone, pomodoro e patata resistenti all'attacco di vari fitofagi, in quanto in grado di produrre le tossine di B. thuringiensis (Wilson et al., 1992).
Va infine considerato il fatto che l'uso sempre più diffuso di sostanze prodotte da B. thuringiensis ha portato alla selezione di ceppi di insetti resistenti alle sue tossine. In particolare, gli insetti con un pool genetico molto ampio hanno una maggiore capacità di sviluppare velocemente meccanismi di resistenza al batterio. Per questo motivo, va enfatizzata l'importanza di inserire la lotta microbiologica in un contesto di gestione fitopatologica integrata (integrated pest management, controllo integrato degli organismi infestanti), che consenta di influenzare la dinamica di popolazione degli insetti da controllare, intervenendo a vari livelli e impedendo così la selezione di caratteri resistenti a fattori limitanti caratterizzati da pochi geni.
Biotecnologie per la produzione di polimeri
Un settore applicativo estremamente interessante delle produzioni biotecnologiche è rappresentato dai polimeri di origine biologica. La loro fonte può essere vegetale, animale o microbica, e le loro applicazioni spaziano in campi diversissimi, da quelle minerarie (per esempio, nell'estrazione del petrolio) ai beni di consumo più comuni (film per imballaggio e per usi agricoli, contenitori biodegradabili, ecc.) e a numerosi e crescenti impieghi terapeutici. È interessante notare come produzioni ormai secolari e di enorme interesse economico per ampie aree del pianeta, come quella della gomma naturale estratta da Hevea brasiliensis, sono state capaci di superare con successo la concorrenza di tecnologie chimiche alternative, grazie a un'ottimizzazione delle modalità di coltivazione, e dei livelli di produzione del lattice di gomma, da parte della pianta. La gomma naturale è costituita da un polimero del 2-metilbutadiene (isoprene), avente una struttura particolare (1,4-cis):
Questa struttura conferisce al polimero naturale, dopo la vuIcanizzazione con zolfo, le ben note proprietà elastiche e le eccezionali proprietà dinamiche, cioè il bassissimo sviluppo di calore in seguito a sollecitazioni ripetute. Di conseguenza esso costituisce il polimero di elezione per impieghi produttivi enormi come i pneumatici per veicoli pesanti (autocarri, autobus, ecc.).
Questo esempio costituisce tuttavia un'eccezione (seppure economicamente rilevante), poiché l'interesse applicativo delle biotecnologie nel campo dei polimeri naturali, se non riguarda le polidiolefine, investe in modo rilevante i polisaccaridi o le loro miscele con polimeri di sintesi. Questi, come pure i poliesteri alifatici, hanno la caratteristica di essere biodegradabili, cioè decomponibili dai microrganismi presenti nell'ecosistema naturale. Poiché i microrganismi operano la degradazione attraverso il loro sistema enzimatico, è importante stabilire il tipo di legami e di strutture che gli enzimi sono in grado di degradare. Si è dimostrato così che, come era ovvio attendersi, legami di tipo peptidico, polisaccaridico o estereo sono sottoposti a idrolisi. Inoltre caratteristiche come la cristallinità, l'elevato peso molecolare, le reticolazioni fra catene polimeriche o l'elevata idrofobicità del polimero sono fattori negativi per quanto riguarda la sua biodegradabilità. Ciò ha di fatto ristretto a poche categorie di polimeri (polisaccaridi o poliesteri alifatici) il campo di indagine (Hocking, 1992).
La chitina, per esempio, derivante dal concatenamento 1,4-β di residui acetilglucosamminici, è un costituente, abbondantissimo in natura, dell'esoscheletro di crostacei e insetti, e della parete cellulare dei funghi filamentosi e di alcune alghe (fig. 24). La sua deacetilazione per idrolisi chimica produce il chitosano. Sia la chitina sia il chitosano, a causa delle loro ottime proprietà meccaniche, presentano notevoli potenzialità applicative; il chitosano è attualmente prodotto su scala semindustriale e commercializzato da diversi produttori per applicazioni che vanno dai flocculanti, agli additivi per l'industria alimentare, ai rivestimenti per sementi e ai film. In campo biomedico, grazie alla loro biodegradabilità, sembra promettente l'impiego di chitina e di chitosano per la produzione di cicatrizzanti e di pelle artificiale, poiché le molecole del polisaccaride possono essere progressivamente sostituite dall'epitelio in fase di orgamzzazione.
Un'importante categoria di polisaccaridi è costituita da quelli di origine microbica, cioè prodotti dalla fermentazione effettuata da microrganismi, come il destrano, prodotto da Leuconostoc mesenteroides coltivato su saccarosio, e impiegato come costituente fondamentale del plasma sanguigno umano artificiale (plasma expander). Oltre al destrano, notevole importanza riveste lo xantano, un altro polisaccaride di fonte microbica, ottenuto per fermentazione del batterio Xantomonas campestris. Esso è costituito da uno scheletro di tipo cellulosico cui sono legate unità laterali contenenti mannosio e acido glucuronico, e trova impiego nella stabilizzazione di sospensioni per uso alimentare, come ispessente dei fanghi di perforazione di giacimenti di petrolio o di gas naturale e, soprattutto, nel recupero 'terziario' del petrolio. L'estrazione spontanea di petrolio, cioè dovuta alla fuoruscita naturale del greggio sotto la spinta della pressione gassosa sovrastante il giacimento, non supera in media il 35÷40% del petrolio contenuto nel giacimento stesso. Allo scopo di 'spiazzare' le gocce di petrolio trattenute nelle porosità della roccia, si impiegano tecniche che vanno dal semplice ripristino della pressione del pozzo a sistemi sofisticati come l'uso di tensioattivi. Uno dei più usati consiste nel pompare nel giacimento acqua 'ispessita' con polimeri, come appunto lo xantano, in grado di fornire soluzioni altamente viscose anche a bassissime concentrazioni. Altri polisaccaridi microbici di crescente interesse sono l'acido ialuronico, di natura polisaccaridica (fig. 25) e poliesteri alifatici come il poli-β-idrossibutirrato (PHB) e l'acido polilattico (PLA) e i loro copolimeri. L'acido ialuronico, che veniva ottenuto per estrazione dalle creste di gallo con metodologie complesse, costose e assai inquinanti, è ora ottenibile in quantità industriali dalla fermentazione di batteri del genere Streptococcus. Questa tecnica si è rivelata estremamente competitiva sul piano economico, e il prodotto ottenuto, dopo purificazione, può essere impiegato in preparazioni cosmetiche e soprattutto farmaceutiche, in particolare in chirurgia oftalmica (per la cura della cataratta), come antinfiammatorio e nella cura dell'artrite reumatoide. Sotto forma di microsfere del diametro di alcune decine di micrometri, l'acido ialuronico può essere inoltre utilizzato per veicolare dei farmaci, così da permettere, man mano che le microsfere di acido ialuronico vengono bio degradate in vivo, il rilascio a velocità costante e programmata del farmaco contenuto all'interno delle microsfere o legato covalentemente al polimero. I poliesteri alifatici di origine microbica, data la loro totale biodegradabilità e l'assenza di tossicità, trovano impiego soprattutto per contenitori di cibi o di prodotti igienici, ma anche in sofisticati impieghi biomedici, in ortopedia o per il rilascio controllato di farmaci. Il costo di questi prodotti è ancora troppo elevato per consentirne un uso massivo; allo scopo di ridurre i costi e di semplificare le operazioni di purificazione dei prodotti sono in corso studi di donazione, in batteri come E. coli e in piante, dei geni responsabili della bio sintesi dei polimeri. Poliesteri derivati dall'acido lattico sono invece preparati per polimerizzazione con catalizzatori ionici del dimero cidico (lattide) di questi, e le biotecnologie intervengono essenzialmente nella produzione fermentativa da cui si ottiene l'acido L-lattico a elevatIsslllla purezza sterica. Questi polimeri trovano impieghi analoghi a quelli degli altri poliesteri alifatici.
Produzione microbiologica di idrogeno
Le fonti di energia fossile sono presenti in natura in quantità limitate e nei processi di combustione producono diossido di carbonio, una delle sostanze maggiormente responsabili dell'effetto serra. La loro combustione, inoltre, genera NOx e SO2, principali responsabili delle piogge acide. È quindi di fondamentale importanza trovare fonti alternative rinnovabili, che non producano sostanze dannose per l'ambiente e pericolose per l'uomo.
La recente attenzione verso l'impiego del metano non risolve il problema. Anche se è più abbondante del petrolio, il metano non è di produzione biologica e non può quindi considerarsi una fonte rinnovabile. Infatti, benché il metano sia più puro del petrolio e le impurezze presenti (come CO2 e H2S) siano facilmente eliminabili, tuttavia la sua combustione genera CO2, che aggrava il preoccupante effetto serra che sta surriscaldando il pianeta. Diverso può essere il caso del biogas, costituito da una miscela di metano e diossido di carbonio, che è ottenuto come sottoprodotto nel trattamento microbiologico di effluenti in fermentatori di tipo anaerobio. Gli effluenti possono essere diversi: residui urbani, di tipo zootecnico o agro industriale (come i residui delle porcilaie o delle industrie lattiero-casearie). Il biogas che si ottiene è di basso potere calorifico, poiché il metano contenuto supera di poco il 50% del totale e viene combusto in appositi bruciatori. Il contributo di questo tipo di combustibile rimane comunque marginale rispetto all'approvvigionamento energetico globale. Analogamente fonti alternative, come quelle di tipo ligno-cellulosico (residui di potatura, tutoli di pannocchie di granturco, idrocoltura di alghe pluricellulari, ecc.) presentano elevati costi di raccolta, trasporto, stoccaggio, e talvolta essiccamento (alghe), e non alleviano l'effetto serra, dato che la loro combustione produce CO2.
Da un punto di vista energetico l'idrogeno rappresenta, invece, una fonte ideale poiché bruciando produce acqua. Esso è attualmente prodotto industrialmente a partire da combustibili fossili (gas naturale o carbone) mediante processi di gassificazione con vapore acqueo (steam reforming). Con questi processi l'emissione di inquinanti si sposta sul luogo di produzione e quindi essi non risolvono il problema ambientale. Inoltre essi ricorrono a materie prime non rinnovabili ed è quindi ragionevole supporre che i costi di produzione siano destinati a crescere in futuro. In alternativa si può produrre idrogeno dall'acqua; è questa la via più allettante dal punto di vista ambientale ed è quindi in questa direzione che sono in corso notevoli attività di ricerca. Queste, alternativamente all'elettrolisi, considerano per esempio la pIasmolisi, la magnetolisi e l'uso della luce solare. Quest'ultima tecnica è la più interessante perché fa uso di una fonte di energia rinnovabile che è la più abbondante sulla Terra. La produzione di idrogeno da acqua ed energia solare è strettamente legata alla possibilità di convertire l'energia luminosa in energia chimica mediante processi fotochimici. Lo studio di tali processi è ancora a un livello esplorativo. Tra i sistemi studiati a questo scopo vi sono i sistemi combinati celle fotovoltaiche-elettrolizzatore, sistemi fotoelettrochimici e sistemi fotocatalitici. l sistemi biologici sono da sempre oggetto di interesse come potenziali produttori di idrogeno, ma sino a ora non hanno trovato concrete possibilità di applicazione. Il costo dell'energia da fornire ai sistemi biologici è infatti spesso solo di poco inferiore, se non a volte superiore, al valore dell'energia prodotta. Le possibilità applicative delle biotecnologie per la produzione di idrogeno dipendono quindi dal reperimento di fonti di energia economiche. Da questo punto di vista i batteri fotosintetici, capaci di utilizzare la luce solare come sorgente di energia con una efficienza del 7÷8%, e di prelevare i protoni necessari per la produzione di idrogeno dalla degradazione di composti organici di scarto, risultano indubbiamente molto promettenti (Morimoto e Myake, 1994). Da un punto di vista generale va notato che la produzione biologica dell'idrogeno può avvenire attraverso sistemi in vivo o in vitro. Nel primo caso essa ha luogo a opera di organismi fototrofici (che utilizzano come fonte d'energia la luce) o chemiotrofici (che utilizzano il metabolismo di composti chimici). Nel secondo caso l'idrogeno viene prodotto da sistemi enzimatici estratti da microrganismi e accoppiati a semiconduttori e a composti chimici capaci di trasportare gli elettroni. Spesso l'idrogeno è ottenuto dalla degradazione di substrati organici che avviene in associazione con la scissione dell'acqua (Miura et al., 1994). La produzione può quindi risultare superiore all'idrogeno stechiometrico presente nelle sostanze organiche di partenza. l sistemi in vivo di tipo fototrofico comprendono le alghe, i cianobatteri e i batteri anossigenici fototrofici. Quelli di tipo chemiotrofico comprendono invece i batteri aerobici, anaerobici e gli organismi superiori (fig. 26).
La produzione di idrogeno in tutti i casi è catalizzata da sistemi enzimatici piuttosto complessi che quasi sempre operano con azione combinata fra loro. Negli attuali scenari economico-energetici dei paesi occidentali la produzione di idrogeno da valorizzare come combustibile non appare competitiva e prospettive di medio termine, più incoraggianti, possono invece essere individuate nella valorizzazione dell'idrogeno come materia prima per produzioni chimiche industriali, specialmente nell'ottica di una sua produzione da materiali a costo nullo o negativo presenti negli effluenti liquidi o nei rifiuti solidi. Ciò detto, è indubbio che le vie biologiche di produzione dell'idrogeno presentano notevoli vantaggi ambientali. l sistemi biologici, infatti (v. figura 25), consentono di fissare CO2 (alghe e cianobatteri) e NOx (soprattutto i cianobatteri) e di produrre quindi sostanze organiche di un certo pregio (amidi, glicerolo, formiato, ecc.) con il solo consumo di sostanze saline (almeno per quanto riguarda i cianobatteri). Inoltre, permettono la fotolisi dell'acqua con minori fabbisogni energetici rispetto ai processi fisici: nei processi biologici gli elettroni provengono dai substrati organici e dall'acqua e l'energia luminosa serve essenzialmente per attivare i processi metabolici. La lisi fisica dell'acqua, per esempio, richiede energia pregiata pari a 242,25 kJ/mole, mentre i cianobatteri e le alghe consentono il recupero di idrogeno da sostanze completamente ossidate (CO2 e H2O) a sole spese dell'energia luminosa. Infine, i sistemi biologici consentono il trattamento di affluenti di scarto, siano essi solidi, liquidi o gassosi.
Conclusioni
Poiché lo sviluppo, i miglioramenti e l'estensione delle applicazioni di una nuova tecnologia dipendono sempre in larga misura dal concomitante sviluppo delle discipline scientifiche che ne costituiscono la base teorica e sperimentale, è confortante constatare che le scienze fondamentali che stanno a monte delle biotecnologie (biologia cellulare e molecolare, biochimica, tecniche di DNA ricombinante, progettazione computerizzata di strutture molecolari molecular modelling, ecc.) stanno vivendo alla fine del 20° secolo una fase di sviluppo tumultuoso, in grado di sostenerne una rapida estensione applicativa. Quest'ultima sarà ancora condizionata da fattori economici, ma troverà uno dei suoi maggiori punti di forza nel diminuito impatto ambientale a essa connesso.
Per questo, una accresciuta sensibilità dell'opinione pubblica e dei legislatori per questi aspetti ne può condizionare in notevole misura il successo. Per quanto riguarda il settore agricolo, le biotecnologie si propongono come le ultime, in ordine di tempo, fra le numerose tecnologie che hanno portato a uno stupefacente aumento della produttività mondiale di alimenti, attraverso ulteriori aumenti di resa, la diminuzione di costi e lo sviluppo di nuovi prodotti ad alto valore aggiunto in grado di soddisfare le crescenti esigenze dei consumatori e dell'industria agroalimentare. Si possono fra questi citare nuove sementi e nuovi pesticidi, prodotti per la diagnostica e la terapia veterinaria, additivi alimentari, enzimi per l'industria alimentare, cibi a più elevato potere nutritivo (per esempio, un maggiore contenuto in amminoacidi essenziali) e prodotti agricoli di migliorate caratteristiche di lavorabilità. La manipolazione di varietà di mais, cotone e pomodoro mira a introdurre nel loro patrimonio genetico geni derivanti da batteri (per esempio, da B. thuringiensis) che regolano la sintesi di numerose tossine capaci di agire su vari insetti con meccanismi diversi. Mediante questo recente approccio, le piante, 'coniugate' geneticamente con il patrimonio di microrganismi, sono in grado di difendersi in modo autonomo da numerosi agenti infestanti. Un ulteriore vantaggio di questa tecnica consiste nel fatto che gli effetti letali di queste tossine sono limitati alle specie di insetti su cui esse sono attive, a differenza degli insetticidi chimici tradizionali, che possono esercitare un'azione tossica indifferenziata su tutti gli esseri viventi, compresi gli insetti utili o gli organismi superiori.
l prevedibili e cospicui vantaggi ambientali delle biotecnologie consisteranno in una minore produzione di prodotti di scarto, nella semplificazione dei cicli industriali e in un minore impiego di fertilizzanti. Per quanto riguarda quest'ultimo punto fondamentale, notevoli sforzi di ricerca sono in corso sia per indurre la produzione di ammoniaca nel terreno a opera di microrganismi azoto-fissatori opportunamente disseminati a questo scopo, sia per trovare specie batteri che in grado di fornire fertilizzanti azotati a specie vegetali diverse dalle leguminose. Queste ultime infatti, non richiedono per la loro coltura l'impiego di fertilizzanti, poiché batteri del genere Rhizobium (in grado di trasformare in ammoniaca l'azoto atmosferico mediante il complesso sistema enzimatico-coenzimatico chiamato nitrogenasi) si insediano come simbionti nei loro noduli radicolari. Le tecnologie produttive di prodotti chimici, farmaceutici e alimentari, basate sull'impiego di enzimi (preferibilmente immobilizzati), appaiono ricche di prospettive applicative, a causa dei notevoli progressi conseguiti negli ultimi anni nel campo del DNA ricombinante, che promettono virtualmente l'ottenimento di qualsiasi enzima desiderato, su larga scala e a costi ragionevoli. È in corso, infatti, una nuova fase della biochimica enzimatica basata sulla genetica molecolare, che è in grado di progettare e produrre enzimi aventi proprietà mirate in funzione delle richieste specifiche della catalisi industriale quali la specificità e l'affinità di substrato, la stereoselettività della reazione, la stabilità ai solventi non acquosi, al calore e all'ossidazione, la stabilità alla degradazione proteolitica e l'efficienza catalitica.
Ringraziamenti
L'autore desidera ringraziare vivamente il professor Paolo Costantino dell'Università 'La Sapienza' di Roma e il dottor Massimo Cristofaro, del Centro di Ricerche della Casaccia dell'ENEA, per gli importanti suggerimenti e le proficue discussioni su alcune tematiche trattate.
Bibliografia citata
HOCKING, P.J. (1992) The classification, preparation, and utility of degradable polymers. J.M.S. - Rev. Macromol. Chem. Phys., C32 (I), 35-54.
IMAIZUMI, T. (1986) Some industriaI applications of inorganic microbial oxidation. Japan-Biotech. & Bioeng. Symp., 16, 363-371.
JOHANN, P. (1993) The application of hydrolases in organic synthesis. Chemspec Europe - 93 BACS Symposium.
KLEIN, J., VAN ASSERDEN PFEIFER, F., SCHATCH, S. (1994) Microbial desulfurization of coal and oil. Fuel processing technology, 40, 297-310.
MARCONI, W. (1989) Processi enzimatici industriali. In Enciclopedia del Novecento. Roma, Istituto della Enciclopedia Italiana, vol. 8, 106-120.
MIELE, L. (1997) Plants as bioreactors for biopharmaceuticals: regulatory considerations. Trends in Biotechnology, 15, 45-50.
MIURA, Y., SAIOTH, C., MATSVOKA, S., MIYAMOTO, K. (1992) Stably sustained hydrogen production with high molar yield through a combination of a marine green alga and a photosynthetic bacterium. Biosci. Biotech., Biochem., 56, 751-754.
MORIMOTO, M., MYAKE, J. (1994) Development of environmentalIy friendly technology for the production of hydrogen. Hydrogen energy progress X. Proceedings of the 10th world hydrogen energy conference. Cocoa Beach (USA), 20-24 giugno 1994, 951.
OSHIRO, T., HIRATA, T., IZUMI, Y. (1995) Microbial desulfurization of benzotiophene in the presence of hydrocarbons. Appl. Microbial Biotechnol., 44, 249-252.
ROBERTs, S.M. (1990) Recent developments in the use of enzymecatalysed reactions in organic synthesis. San Diego, Ca, Academic Press, pp. 115-130.
ROWE, O.E., MARGALITIS, A. (1987) Bioprocess developments in the production of bioinsecticides by Bacillus thuringiensis. CRC Critics Reviews in Biotechnology, 6, 87-127.
SERVI, S. (1996) Biocatalysis in the preparation of homochiral pharmaceuticals. La Chimica e L'Industria, 78, 959.
VAN DER ESCH, S.A., MACCIONI, O., VITALI, F. (1993) Biomolecole d'interesse industriale da fermentazioni vegetali. Biotec, 5,20.
WARREN, R.A. (1996) Microbial hydrolisis of polysaccharides. Annu. Rev. Microbiol., 50, 183-212.
WILSON, F.D., FLINT, H.M., DEAToN, W.R., FISCHOFF, D.A., PERLAK, F.J., ARMSTRONG, T.A., FUCHS, R.L., BERBERICH, S.A., PARKS, N.J., STAPP, R.R. (1992) Resistance of cotton lines containing Bacillus thuringiensis toxin to pink bollworm and other insects. J. Econ. Entomol., 4, 516-1521.
Bibliografia generale
AUTORI VARI (1995) Trends in Biotechnology, 13,312-409.
KATCHALSKI-KATZIZ, E. (1993) Immobilized enzymes, learning from past successes and failures. Trends in Biotech., Il, 471-478.
MARCONI, W. (1989) Immobilized enzymes: their catalytic behaviour and their industriaI and analytical applications. Reactive Polymers, Il, 1-19.
ROBERTS, S.M., TUMER, N.J., WILIETS, A.J., TURNER, M.K. (1994) Introduction to biocatalysis using enzymes and microorganisms. Cambridge, Mass., Cambridge University Press.
WISEMAN, A. (1996) Novel biocatalysts will work even better for industry. J. Chem. Ed., 73, 55.