Materia soffice
Materia soffice
La fisica della materia condensata soffice si occupa di colloidi, soluzioni polimeriche, emulsioni, schiume, soluzioni tensioattive, polveri e materiali simili. Si tratta di sistemi largamente presenti nella nostra vita quotidiana: ne sono esempi le vernici, l'olio per motori, la maionese, la crema da barba, il talco e così via. In tutti questi casi, la composizione molecolare precisa del sistema ha solo una limitata influenza sul comportamento fisico, che è controllato dalla struttura su scala mesoscopica, cioè su lunghezze che vanno da 1 nm (10−9 m) a 1 μm (10−6 m), e che è facilmente modificabile da agenti esterni quali le sollecitazioni meccaniche. Negli ultimi due decenni la comprensione della fisica della materia condensata soffice ha compiuto notevoli progressi, conseguenti a importanti sviluppi avvenuti nel campo industriale e scientifico, nella simulazione al calcolatore e nell'uso di metodi teorici basati sulla meccanica statistica.
Non esiste, per la materia condensata soffice, una definizione su cui vi sia un accordo generale, ma una possibile è la seguente: un corpo che resiste fortemente alla compressione, ma debolmente al taglio. Un esempio è dato da un pezzo di gomma naturale a legami incrociati (lattice): esso può essere facilmente deformato a volume costante ma, forse sorprendentemente, la sua resistenza a cambiamenti di volume, misurata dal modulo di compressibilità, è alta quanto quella di un solido cristallino. È in questo senso che possono essere qualificati come materia condensata soffice, oltre a quelli già citati, i gel polimerici (gelatina), le emulsioni, le soluzioni detergenti viscoelastiche (shampoo), i reticoli cristallini di grassi (margarine), i colloidi concentrati (vernici), le soluzioni di polimeri e i cristalli liquidi liotropici (per es., la poltiglia prodotta da una saponetta quando è lasciata in una pozza d'acqua). Rientrano in questa categoria anche i colloidi densi, che possono sviluppare, sotto forti pressioni, un'alta resistenza alle deformazioni di taglio (un fenomeno chiamato shear thickening, ispessimento al taglio), ma sono comunque più facili da deformare trasversalmente che da comprimere. Anche le polveri secche vengono tradizionalmente fatte rientrare nel campo della materia condensata soffice, perché molti aspetti del loro comportamento sono simili a quelli dei colloidi densi. Tutti questi materiali differiscono dai liquidi semplici, come l'acqua. Quest'ultima non si comprime facilmente e, si potrebbe dire, oppone poca resistenza alle sollecitazioni di taglio, ma in un modo puramente viscoso: lo sforzo interno è proporzionale alla velocità della deformazione (questo comportamento è detto newtoniano). Al contrario, la maggior parte dei materiali elencati in precedenza si oppone alle sollecitazioni secondo una modalità detta viscoelastica: la loro risposta alla deformazione mostra una mescolanza di caratteristiche elastiche e viscose. La distinzione è basata sulle scale di tempo: anche l'acqua dapprima risponde elasticamente, ma per un tempo così breve che la maggior parte degli esperimenti non riesce a rilevarlo. I materiali soffici mostrano invece un qualche grado di elasticità su scale temporali facilmente osservabili (dai millisecondi ai giorni).
L'equilibrio termico
La fisica della materia condensata descrive il comportamento di sistemi contenenti moltissime particelle a una densità tanto alta che ciascuna interagisce con numerose altre. Esempi tipici sono i solidi cristallini e i liquidi. Poiché ogni atomo o molecola interagisce con numerosi vicini e ognuno di questi con molti altri e così via, l'intero sistema di particelle si dice accoppiato. Questa forte correlazione conferisce speciali proprietà collettive al materiale, quali l'elasticità di un cristallo e la viscosità (resistenza allo scivolamento) di un liquido. Di solito, non si possono comprendere tali proprietà riferendosi a singole particelle isolate e neppure a piccoli gruppi di particelle: la fisica della materia condensata è, sostanzialmente, un problema a 1023 corpi. Le proprietà collettive di una fase condensata sono espresse come medie sulla distribuzione di probabilità che un sistema a molti corpi si trovi in un particolare stato fisico microscopico (uno specifico stato quantistico o 'microstato'). Da piccoli cambiamenti nei parametri di controllo, come la temperatura, possono talvolta derivare mutamenti bruschi in queste proprietà; quando tale comportamento diventa sempre più singolare andando verso il limite termodinamico (di grandi dimensioni del sistema), tali fenomeni sono detti transizioni di fase. All'equilibrio termico, il comportamento del sistema dipende sia dal numero di microstati esistenti in un dato intervallo di energia, sia dalle caratteristiche fisiche dei microstati stessi. Uno dei risultati più importanti, raggiunti negli ultimi decenni del XX sec., è stata la comprensione, almeno a un livello schematico, della meccanica statistica d'equilibrio dei principali materiali soffici, tra i quali le soluzioni polimeriche e le sospensioni colloidali. In molti casi interessanti la fisica è dominata dal termine entropico dell'equazione per l'energia libera di Helmholtz
[1] F = E − TS
dove E è l'energia e S l'entropia. Lo stato di equilibrio termodinamico alla temperatura T in un sistema di composizione fissata (e per un fissato volume V) è quello che minimizza l'energia libera F.
I polimeri
Una catena polimerica lineare è una lunga sequenza non ramificata di unità chimicamente identiche collegate da legami e dotata di una certa flessibilità. Una tale catena può essere esaminata semplicemente, su una scala abbastanza grande, come una linea a zig zag: c'è un numero cospicuo di microstati (corrispondenti a varie sequenze di configurazioni di legami nella catena) con energie simili. Su questa scala i dettagli della chimica locale non sono rilevanti, quindi le proprietà di un polimero possono essere considerate universali. In tali condizioni, è solo la massimizzazione dell'entropia a essere importante nella minimizzazione dell'energia libera; da questo punto di vista ogni catena può essere vista come un cammino casuale (random walk). Questa espressione sta a indicare un cammino composto da una sequenza di passi, ognuno dei quali è fatto in una direzione casuale rispetto a quello precedente. In due dimensioni, si può illustrare il cammino casuale come la passeggiata di un ubriaco che si allontana barcollando da un bar, senza sapere dove è stato o dove sta andando. In tre dimensioni, il percorso tracciato da un polimero è simile, con la condizione limitativa importante che le catene non possono intersecarsi l'una con l'altra né autointersecarsi.
L'effetto dettagliato di questo vincolo di 'volume escluso' sulla statistica della catena è difficile a intendersi, ma l'effetto complessivo è che la catena si espande riempiendo una regione di spazio più grande. Si noti che un singolo polimero esplora costantemente il gran numero di microstati a esso accessibili (attraverso il moto browniano); perciò ben poche proprietà significative possono essere definite se non come una media sugli stati visitati. Tutto questo differisce significativamente da ciò che si verifica per gli atomi o per le molecole in un materiale duro 'convenzionale', come il ferro, dove le fluttuazioni entropiche possono essere viste come piccoli spostamenti (chiamati fononi) da un ben definito stato di base (il reticolo periodico). Per i polimeri, così come accade sempre nella materia condensata soffice, le fluttuazioni costituiscono invece la base delle proprietà fisiche. Ciò rende l'uso della meccanica statistica particolarmente stimolante e importante.
I colloidi
Un altro esempio di fisica dominata da fattori entropici è quello dei colloidi di sfere rigide, vale a dire colloidi in cui le particelle colloidali sono schematizzabili come sfere rigide. Si consideri una sospensione di sfere di raggio dell'ordine del micron, le cui interazioni sono puramente repulsive e attive su distanze molto corte. Ciò equivale a dire che sono vietate le distanze da centro a centro più piccole del diametro di una particella (sfere rigide), ma non si esercita alcuna forza tra le sfere a separazioni più grandi. Ne consegue che tutti i microstati permessi, che sono quelli senza sovrapposizioni tra le sfere, hanno esattamente la stessa energia. Perciò, minimizzare l'energia libera F equivale semplicemente a massimizzare l'entropia S (anche la temperatura T è irrilevante). Lo stato di equilibrio dipende dalla concentrazione delle sfere, espressa di solito attraverso la loro frazione di volume φ=(4/3)πR3(N/V), dove N è il numero delle sfere nel volume, V e R il loro raggio. Un modo semplice di vedere la massimizzazione dell'entropia consiste nel farla corrispondere allo stato di massimo disordine. Tuttavia, questo punto di vista è fuorviante in tale contesto: infatti, per alte concentrazioni, tali che 0,545≤φ≤0,74 (nessuna concentrazione maggiore di 0,74 è possibile per le sfere rigide), si trova che lo stato di entropia più alta è un reticolo regolare, detto cristallo colloidale. Un tale cristallo ha proprietà notevoli: per esempio, i suoi piani reticolari causano la diffusione della luce visibile, analogamente alla diffusione di Bragg dei raggi X, comunemente utilizzata per sondare la struttura dei solidi atomici. Questa proprietà conferisce al materiale un aspetto iridescente e variopinto, cui ci si riferisce con il termine opalescenza, che deriva dall'analogia con l'aspetto della luce diffusa dagli opali.
Per comprendere come la massimizzazione dell'entropia possa portare a una fase ordinata, occorre distinguere due contributi differenti all'entropia. Il primo è l'entropia associata alla densità media di particelle ϱ(r), che dipende dalla posizione r. Questo contributo, Sϱ=−k∫ϱlnϱd3r, è massimo per una densità media uniforme, cioè per ϱ=costante, come quella che si presenta nello stato fluido (k è la costante di Boltzmann). La fase cristallina, nella quale ϱ è fortemente accentuata sui siti reticolari, è nettamente sfavorita in termini di Sϱ. Tuttavia, vi è un secondo contributo all'entropia, che è molto più difficile da calcolare, ossia un termine collettivo SC che riflette la difficoltà che le particelle hanno nell'evitare localmente i loro vicini. In un fluido denso colloidale, poche sfere possono essere spostate a una distanza significativa senza richiedere che si muovano anche molte sfere vicine. In altri termini, il moto delle sfere nello stato fluido è estremamente correlato; ciò significa che il numero di microstati (o le configurazioni distinte di sfere) realmente disponibile per un dato valore della frazione di volume φ è molto minore di quanto il termine Sϱ potrebbe suggerire.
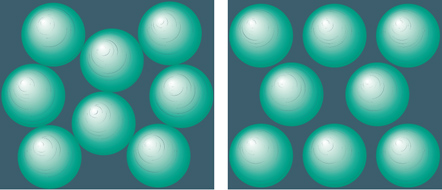
Se, d'altra parte, le sfere occupano un reticolo ordinato (in media), allora ognuna ha una maggiore libertà di effettuare piccoli spostamenti dalla sua posizione nel reticolo, senza interferire con i suoi vicini, rispetto a un fluido della stessa frazione di volume. Qualitativamente, questo si verifica perché l'ordine a lungo raggio di un reticolo cristallino è molto efficace per impacchettare le sfere e quindi rimane più spazio per l'esplorazione locale. Pertanto, se la densità è alta, SC è molto più grande per il cristallo che per il fluido. Il risultato è che quando φ è abbastanza elevata, Sϱ+SC è più grande per il cristallo che per una fase fluida disordinata e, perciò, il cristallo è stabile. Argomenti simili si applicano a casi più complessi, come una sospensione mista di sfere colloidali di diverse dimensioni (fig. 2). Benché il colloide di sfere rigide sia sospeso in un solvente, al fine di valutare l'energia libera F il solvente può essere quasi ignorato, poiché esso contribuisce all'energia libera per una quantità grande ma pressoché costante. Per sfere rigide ideali a una data frazione di volume, perciò, la minimizzazione di F può essere effettuata come se le sfere si trovassero nel vuoto, la qual cosa, finora, era stata assunta tacitamente.
L'elasticità entropica
I materiali citati finora (gel, emulsioni, colloidi, ecc.) sono tutti soffici; tuttavia ci si chiederà che cosa conferisca loro una certa elasticità e perché il modulo di taglio statico (elasticità trasversale) non sia nullo, come nei fluidi semplici. Per il caso degli elastomeri, quali le gomme a legami incrociati e i gel polimerici, è stata data la prima risposta soddisfacente. Un elastomero è formato da una rete di trefoli polimerici ‒ a ognuno dei quali è associato un cammino casuale ‒ tenuti insieme nei punti di congiunzione. Se il gel è improvvisamente deformato a temperatura costante, i trefoli, che si muovono a caso, devono cambiare la loro forma media: essi si stirano nella direzione di allungamento. L'entropia di un insieme di trefoli deformati è inferiore a quella di un insieme non deformato perché, per definizione, il cammino casuale originario è lo stato più casuale possibile (perciò l'argomento che la casualità massima equivalga all'entropia massima risulta corretto). Pertanto, l'energia libera F aumenta in seguito a una deformazione. L'entità dell'aumento è calcolabile con modelli statistici; per una piccola deformazione di taglio, caratterizzata da un piccolo angolo di deformazione γ (misurato in radianti), la variazione di F è ΔF∼kTNγ2, dove k è la costante di Boltzmann e N è il numero di trefoli della rete. Uguagliando questa energia libera immagazzinata a VGγ2/2 si definisce il modulo di elasticità di taglio G, che è dell'ordine di kTN/V, vale a dire kT volte il numero di 'gradi di libertà elastici' (N) per unità di volume V. I valori di G per un gel polimerico tipico si collocano nell'intervallo 10÷104 Pa, a seconda della concentrazione del polimero e della quantità di legami incrociati. Il limite superiore di questo intervallo si trova numerosi ordini di grandezza al di sotto del modulo di taglio di un comune metallo. Al limite inferiore, un valore G≈10 Pa rappresenta un materiale la cui elasticità somiglia a quella di un albume d'uovo a metà cottura.
Queste stime sull'ordine di grandezza del modulo degli elastomeri derivano dal lavoro pionieristico realizzato nel 1953 da Paul J. Flory e altri. Dagli anni Settanta in poi sono state sviluppate sofisticate teorie quantitative per il comportamento elastico degli elastomeri, per tener conto, per esempio, dell'effetto di aggrovigliamento. Quest'ultimo deriva dal fatto che le catene polimeriche non possono intersecarsi; ne risulta un accorciamento effettivo dei trefoli della rete e un aumento del loro numero. Valori ancora più piccoli del modulo di elasticità di taglio (G≤1 Pa) sono misurati nel caso di cristalli colloidali. Per questi sistemi si applica una formula simile al caso precedente: G∼kTN/V, dove N è il numero delle sfere. Confrontata con un coefficiente così piccolo, anche la forza di gravità, che agisce su un campione largo alcuni millimetri, è rilevante. Di solito un campione più grande di questo crolla sotto il proprio peso, formando in una provetta un menisco quasi piatto, in modo da sembrare un fluido a un occhio inesperto.
Sia negli elastomeri sia nei cristalli colloidali, il piccolo valore di G deriva dal piccolo numero di gradi di libertà elastici (catene o sfere) per unità di volume. In un solido convenzionale, i gradi di libertà elastici corrispondono ad atomi o a piccole molecole; il numero di questi oggetti per unità di volume è di gran lunga più alto, conferendo a G valori dell'ordine di 108 Pa o maggiori. Si noti che simili argomenti non si applicano al modulo di compressibilità di volume K, il quale controlla la risposta in energia libera, ΔF=(1/2)K(ΔV)2, a cambiamenti di volume ΔV in un sistema di composizione fissata. Esso è determinato non dai polimeri o dai colloidi, ma dal liquido circostante, che è acqua o qualche altro materiale molecolare normale (per cui, di solito, K≥108 Pa). D'altra parte, lo sperimentatore può scegliere di studiare, invece di K, il modulo di osmosi K_. Questo è definito (e misurato) confinando un materiale soffice all'interno di una cella semipermeabile di volume variabile. In questo caso la composizione del sistema non è fissata: il solvente può entrare e uscire, mentre i polimeri o le particelle colloidali sono confinati nella cella. Il contributo del solvente alla compressibilità di volume è perciò eliminato e si trova che K_ è di nuovo molto piccolo, all'incirca paragonabile a G. In molti materiali soffici, le interazioni coulombiane, cioè elettrostatiche, sono vitali: i polimeri, i colloidi e i tensioattivi possono contenere gruppi chimici che si ionizzano se messi in acqua. Le forze di Coulomb risultano essere, insieme all'entropia, un fattore determinante per definire le proprietà fisiche dei sistemi soffici. Altrettanto fondamentali sono le forze di dispersione, interazioni attrattive causate dalla correlazione di momenti di dipolo fluttuanti su vari atomi o molecole.
Le miscele
In molti materiali sono contemporaneamente presenti sia polimeri sia colloidi. Essi possono essere accompagnati da goccioline di emulsione o aggregati tensioattivi o da ulteriori tipi di materia in sospensione, praticamente in ogni combinazione possibile. Tali componenti possono interagire in modo fortemente non additivo: il che significa che un materiale di questo tipo è molto più della somma delle sue parti. Si supponga che in una soluzione siano miscelate grandi sfere e piccoli polimeri. Le spirali del polimero non possono avvicinarsi troppo alle sfere senza appiattirsi lungo la superficie, una deformazione che farebbe perdere loro entropia. Per evitare ciò, i polimeri tendono a stare fuori da una 'zona di esclusione' intorno a ogni sfera; anche questo fa perdere ai polimeri l'entropia, sebbene non in grande quantità. È possibile, però, una combinazione ancora più economica, cioè la sovrapposizione delle zone di esclusione di diverse particelle colloidali. Tali sovrapposizioni significano che il volume escluso totale (il volume in cui i polimeri non possono entrare senza deformarsi fortemente) è ridotto, cosicché l'entropia del polimero aumenta (fig. 3), e ciò mostra che l'energia libera dei polimeri è minimizzata negli stati in cui le grandi sfere sono vicine. Ne consegue che è proprio come se ci fosse una forza attrattiva tra di esse. Il raggio d'azione di questa attrazione entropica mediata dai polimeri dipende dalla dimensione media della catena, mentre la sua intensità dipende dalla concentrazione del polimero.
La fisica delle particelle colloidali in una tale miscela è strettamente analoga a un sistema di atomi inerti (come l'argon). Questi si respingono fortemente quando le loro nuvole elettroniche si sovrappongono ma, a distanze leggermente più grandi, si attraggono debolmente. Regolando la concentrazione del polimero, si possono progettare sperimentalmente gli analoghi delle diverse fasi di un sistema atomico. Come nel caso della transizione tra fluido colloidale e cristallo colloidale, si trova ora una transizione 'gas-liquido' tra due fluidi colloidali che hanno diverse frazioni di volume φ. Variando con attenzione la dimensione del polimero si può mostrare che, quando le interazioni attrattive sono di portata abbastanza lunga, esiste solo lo stato liquido. Oltre a essere importante per la comprensione dei colloidi, tale lavoro è illuminante per una questione fondamentale di fisica molecolare, ossia l'origine dello stato liquido.
La dinamica
Anche quando le particelle in sospensione sono permanenti (come nei sistemi colloidali e polimerici) e della stessa taglia, il loro comportamento dinamico può essere piuttosto complicato. In particolare, la risposta del materiale a un flusso dipende da quanto velocemente la sua struttura interna può riorganizzarsi per adattarsi alla forma mutevole del campione. Il meccanismo di base di questa riorganizzazione è il moto browniano: il lento e tortuoso procedere di un corpuscolo in sospensione causato dalle collisioni casuali e continue con le molecole del fluido circostante. Il moto browniano nella materia condensata soffice è complicato dal fatto che: (a) i corpuscoli in sospensione si scontrano l'uno con l'altro così come con le molecole del solvente; (b) nel caso di oggetti flessibili, come i polimeri, le collisioni ne cambiano la forma, oltre che la posizione. Una delle conseguenze è che i polimeri in soluzione, al di sopra di una certa concentrazione, si aggrovigliano irrimediabilmente l'uno con l'altro: il sistema assomiglia a spaghetti scotti (o, volendo dare un'immagine più forte, a un barattolo di vermi).
Il flusso di un fluido polimerico è dominato dalla lentezza con cui questi grovigli possono essere districati dal moto browniano. Una proposta tecnica ad hoc, per la prima volta presentata da Pierre-Gilles de Gennes, è stata sviluppata da Samuel F. Edwards e Masao Doi in una teoria semplificata ma quantitativa della viscoelasticità dei polimeri, chiamata modello a tubo. Ogni catena polimerica è immaginata come confinata in un tubo formato dal groviglio con le catene vicine; le collisioni la tengono all'interno del tubo, ma il moto browniano le consente ancora di strisciare lentamente lungo l'asse di esso. Il processo, chiamato diffusione curvilinea, può essere quantificato completamente nell'ambito del modello e da questo si può trovare la funzione di memoria della tensione μ(t), che è semplicemente la frazione di tubo iniziale occupata dalla catena al tempo t. Per flussi elevati, il tubo si deforma e di conseguenza aumenta la velocità di districamento. Questi effetti sono quantificati nell'equazione costitutiva di Doi-Edwards che collega lo stato di tensione σαβ alla storia di deformazione del mezzo.
Autoorganizzazione
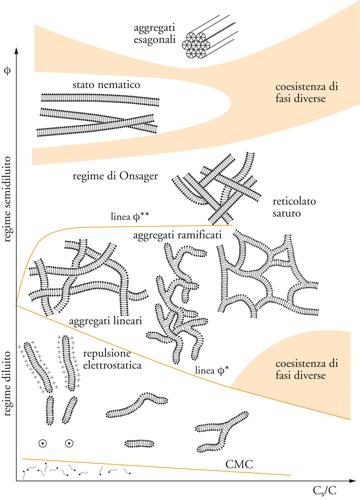
Passiamo ora a considerare il caso in cui gli oggetti mesoscopici in un fluido non sono di carattere permanente ma transitorio, come può verificarsi durante l'autoorganizzazione (o autoassemblaggio) di piccole molecole in grandi gruppi. Per esempio, una molecola detergente semplice è costituita da una coda idrocarburica che respinge l'acqua (idrofoba) e da un gruppo di testa idrofilo. La propensione all'autoorganizzazione e all'assorbimento in superficie di questo tipo di molecola, detta anfifilica, affascinò Irving Langmuir, premio Nobel per la chimica nel 1932. Se messe in acqua, tali molecole formano spontaneamente aggregati che minimizzano l'area di contatto tra le code e il liquido circostante. Questi aggregati sono transitori, poiché il moto browniano è sufficiente per romperli; in molti casi essi si creano e si distruggono su una scala di tempo del microsecondo. In relazione alle dimensioni relative di testa e coda, l'impacchettamento ottimale può essere una piccola sfera (micella), un lungo cilindro flessibile (micella gigante o cilindrica), o una lamina piatta (doppio strato). Le micelle giganti sono oggetti simili ai polimeri, ma la loro natura transitoria porta a una dinamica più complessa: il processo reversibile di divisione e ricostituzione delle catene modifica il processo di disimpigliamento browniano. In alcuni sistemi, le micelle possono ramificarsi, formando una rete fluida di tubetti cilindrici unidimensionali (fig. 4).
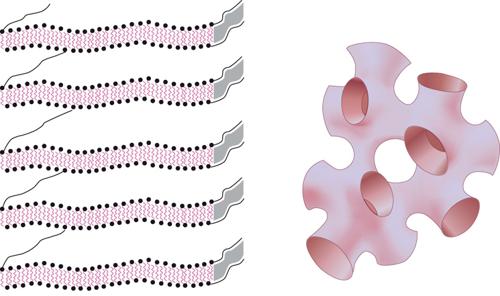
Il doppio strato esteso (fig. 5) si può riconnettere topologicamente a formare una pellicola spugnosa a connessioni multiple, sulla quale le molecole detergenti vivono come se fossero un fluido bidimensionale. Vi è una sorprendente e profonda analogia fra questa pellicola e l'interfaccia fra i domini di un solido ferromagnetico nei quali si ha una diversa orientazione dei momenti di dipolo (spin su e giù). La pellicola a doppio strato divide lo spazio in due domini, che sono di volume uguale ad alte concentrazioni di detergente (la spugna simmetrica, analoga a un paramagnete) ma di volume diverso a concentrazioni inferiori (la spugna asimmetrica, analoga a un ferromagnete). In alcuni sistemi a doppio strato queste due fasi distinte, entrambe fluidi isotropi, sono collegate da una transizione di fase in cui sono state osservate varie anomalie, per esempio nella torbidezza e nella diffusione della luce. Le stesse strutture locali cilindriche o aggregati laminari possono presentarsi anche in fasi ordinate, come una disposizione regolare di cilindri o una pila regolare di lamine: entrambi sono cristalli liquidi. I cilindri mostrano un ordine periodico (cristallinità) in due direzioni, ma una configurazione simile a un fluido nella terza direzione, cioè lungo l'asse del cilindro. Nel caso del doppio strato, le estese pellicole bidimensionali di fluido assumono un ordinamento a mazzo di carte, con un ordine periodico nella terza direzione (quella di accatastamento). Questa cosiddetta fase lamellare è, in effetti, la struttura della poltiglia di sapone bagnato citata precedentemente; la sua melmosità deriva dalla facilità con cui gli strati possono scivolare l'uno sull'altro (esattamente come in un mazzo di carte).
Nel caso di micelle cilindriche esiste una terza possibilità, chiamata cristallo liquido nematico. In questa fase le micelle puntano tutte, più o meno, nella stessa direzione, rompendo spontaneamente la simmetria rotazionale di un fluido isotropo, senza però un ordine posizionale a lungo raggio in una qualche direzione. Tutte queste fasi di cristallo liquido hanno tipi speciali di elasticità che riflettono il loro insolito stato di ordine. L'entropia e le fluttuazioni termiche giocano un ruolo importante. Per esempio, nel cristallo liquido lamellare il moto browniano fa sì che ogni doppio strato oscilli leggermente intorno alla sua posizione media; queste fluttuazioni sono limitate dal fatto che nessuno di essi può attraversare i suoi vicini. Quanto più i doppi strati sono flessibili e vicini, tanto maggiore è il prezzo da pagare in termini di entropia. Così, sebbene una pila di doppi strati molto flessibile si pieghi facilmente, è molto più difficile comprimerla, persino se si consente la fuga del solvente (test di compressibilità osmotica). Questo è, incidentalmente, il motivo per cui le strutture a doppio strato simili a cipolle assumono forme poliedriche e non sferiche: benché una sfera minimizzi la curvatura, un poliedro, facendo il miglior uso possibile dello spazio, minimizza la compressione.
In molti casi, la compressibilità osmotica e le altre proprietà delle fasi autoorganizzate possono essere collegate quantitativamente alle costanti elastiche locali degli aggregati che esse contengono. Tali costanti elastiche sono poco numerose e il controllo delle loro proprietà macroscopiche rappresenta un notevole esempio del concetto di universalità citato precedentemente. Questa intuizione chiave è stata alla base del lavoro pionieristico di Wolfgang Helfrich, il quale, negli anni Settanta del Novecento, ha applicato per primo tali idee alle membrane lipidiche studiate in biofisica; l'approccio è esaminato, insieme a molti degli sviluppi successivi descritti sopra, da Gerhard Gompper e Michael Schick (1994). Fin dai primi anni Novanta, lo studio di sistemi anfifilici autoorganizzati ha sempre più coinvolto applicazioni biofisiche, nelle quali i doppi strati lipidici semplificati sono ampiamente studiati come modelli per le membrane cellulari.
Aggregati frattali e gel colloidali
Un tipo piuttosto diverso di aggregazione spontanea si verifica nelle sospensioni colloidali, quando siano presenti forze attrattive tra le particelle colloidali (sfere adesive). Queste ultime possono attaccarsi formando strutture tenui filiformi, solitamente di natura frattale. Un esempio di strutture frattali è fornito dai domini ferromagnetici al punto critico: qui le regioni di spin allineati positivamente o negativamente formano strutture autosimili nel senso che, finché non si riescono a distinguere i singoli spin, è impossibile rilevare da un'immagine del campione quale ingrandimento o risoluzione siano stati usati. Osservazioni simili si applicano alle fotografie di aggregati colloidali formati cambiando improvvisamente la temperatura o il pH, in modo che tra le particelle colloidali, precedentemente repulsive l'una rispetto all'altra a causa, per esempio, di una repulsione coulombiana, si presenti una forte attrazione, quale quella prodotta dalle forze di dispersione.
Negli anni Ottanta del Novecento, la percezione che i concetti della geometria frattale potessero essere utilizzati per descrivere l'aggregazione colloidale ha prodotto, tra i fisici, un vivo interesse. Le simulazioni al computer hanno avuto un ruolo chiave di verifica in questo campo. Ogni volta che questi aggregati frattali si uniscono in una trama continua si presenta una rete, chiamata gel colloidale. A seconda della forza delle interazioni, gli aggregati possono rompersi gradualmente e riconnettersi attraverso il moto browniano oppure no; spesso essi possono essere facilmente rotti applicando una tensione. Il tipo di viscoelasticità che di conseguenza può manifestarsi è diverso da quello descritto in precedenza per i polimeri. In questo caso, il materiale rimane un solido elastico quasi a tempo indeterminato (μ(t)=1), finché la tensione applicata σ=Gγ permane sotto una certa soglia. Solo se si supera questa 'tensione di snervamento', il materiale inizia a fluire. Un'ulteriore complicazione consiste nel fatto che la tensione di snervamento può lentamente evolvere nel tempo per un processo detto di invecchiamento. La formazione, il flusso e il comportamento di invecchiamento dei gel colloidali rimangono relativamente poco compresi, in parte perché, diversamente da quanto assunto nei semplici modelli di aggregazione, affinché il gel sia in grado di fluire i legami non possono formarsi in un modo del tutto irreversibile.
Transizioni di fase indotte dal flusso
Sia gli aggregati anfifilici sia quelli colloidali possono mostrare un accoppiamento forte tra il loro stato di organizzazione e lo stato di flusso nel materiale. Ciò può avere conseguenze spettacolari. In alcuni casi è possibile convertire un fluido isotropo, contenente un doppio strato anfifilico a forma di spugna, in un cristallo liquido lamellare, semplicemente scuotendo leggermente il campione in una provetta. Allo stesso modo, molti cristalli colloidali possono essere convertiti rapidamente in uno stato fluido, applicando una leggera deformazione di taglio. Entrambi i fenomeni sono esempi di transizioni di fase indotte dal flusso. Nei casi più semplici, la forza di taglio produce una trasformazione che si potrebbe realizzare anche cambiando una variabile termodinamica, come la temperatura o la pressione. In entrambi gli esempi precedenti lo stesso effetto potrebbe essere ottenuto modificando leggermente la concentrazione, piuttosto che applicando la deformazione di taglio. Molte transizioni indotte dal flusso attualmente sono ben comprese in questi termini. In una seconda classe di sistemi (tra i quali le micelle giganti) è richiesta dall'equazione costitutiva una transizione repentina da uno stato di flusso a un altro, in funzione della velocità di flusso. Questa intrinseca instabilità del flusso può essere accompagnata da un cambiamento o meno dello stato termodinamico, per esempio in un cristallo liquido esagonale o nematico. In una terza classe di sistemi l'applicazione di un flusso produce uno stato di organizzazione che è completamente nuovo. Un esempio spettacolare si verifica quando un cristallo liquido lamellare è sottoposto a una deformazione di taglio stabile e prolungata. Piuttosto che rimanere ordinati secondo una pila regolare, gli strati si riorganizzano lentamente in gusci chiusi di topologia sferica (ma forma poliedrica), uno annidato nell'altro, formando strutture simili a cipolle. Ognuna di queste strutture di solito è larga alcuni micron e contiene centinaia di strati. Questa trasformazione è reversibile: infatti, riducendo la velocità di taglio, si ritorna alla struttura precedente. Tuttavia, se la forza di taglio cessa improvvisamente, cosicché non c'è più un'immissione stabile di energia dall'esterno, le cipolle non riescono a ritornare rapidamente alla loro struttura precedente; in alcuni casi esse sono stabili per mesi.
Questo fenomeno suggerisce un'interessante tecnologia per incapsulare piccole molecole, come i prodotti farmaceutici, consistente nell'aggiungerle alla miscela prima che le cipolle si siano formate. Un altro esempio di transizione di fase indotta dal flusso si verifica in soluzioni di micelle giganti, per concentrazioni al di sotto della soglia di aggrovigliamento. Una tale soluzione è a stento viscoelastica, ma, quando viene deformata lentamente e per un tempo lungo, si trasforma in un nuovo stato gelatinoso. Teoricamente ci si aspetterebbe che le sollecitazioni trasversali abbiano un effetto forte in un sistema come questo, ma solo quando la velocità di taglio γ∙τ≥1, dove τ è il tempo di rilassamento più lungo osservabile nel sistema in quiete (qui τ è il tempo di rilassamento rotazionale per le micelle, dell'ordine dei ms o dei μs). In questo caso, invece, la velocità di taglio minima richiesta è piccolissima: γ∙τ≤10−3; la comprensione di tale fenomeno sembra essere ancora molto lontana.
Stati bloccati e mezzi granulari
In particolari condizioni, una sospensione colloidale di sfere rigide può subire una transizione di fase, indotta dal flusso, da una fase libera di fluire a uno stato bloccato (jamming). Per illustrare questo fenomeno, si pensi agli ingorghi stradali: su un'autostrada molto trafficata c'è una velocità media al di sopra della quale il traffico non può scorrere liberamente; anche se tutti i conducenti volessero procedere più rapidamente, non potrebbero, perché il flusso è instabile e le piccole fluttuazioni conducono a intasamenti spontanei. Un esperimento classico secondo queste linee può essere eseguito in cucina: si metta un cucchiaio di maizena (amido di mais) in una tazza e si aggiunga acqua goccia a goccia, fino a quando tutto il materiale non si è sensibilmente inumidito; si mescoli ora con un cucchiaio. Se la composizione è proprio quella giusta - e finché il cucchiaio viene spostato lentamente - la sospensione fluisce quasi senza resistenza; viceversa, se il mescolamento è rapido, non si può ottenere lo stesso risultato: il tutto si muove come un unico pezzo solido. Alcuni lavori alla fine degli anni Novanta del Novecento hanno iniziato a far luce su tali processi, ma la fisica di questi fenomeni rimane tutt'altro che chiara. La natura di tale transizione nei colloidi suggerisce anche un collegamento con un'altra classe di materiali che facilmente si bloccano: i mezzi granulari, tra i quali figurano le polveri secche, come la sabbia. C'è uno spettro continuo che va dalle polveri asciutte allo stato colloidale, passando per le malte e le paste. Attraverso questo spettro, durante gli anni Novanta, hanno cominciato a emergere alcuni aspetti comuni, come una caratterizzazione della geometria locale basata su 'catene di forza', costituite da intense interazioni locali, ma una struttura teorica veramente unificata non esiste.
Dinamica bloccata
Molti materiali soffici, come le gocce fluide deformate in un'emulsione densa o le cipolle, restano intrappolati in uno stato bloccato, lontano dal vero equilibrio ma tanto vicino a un minimo metastabile di energia libera da permettere una trattazione termodinamica locale o su brevi intervalli temporali. Su scale di tempo più lunghe, tali materiali possono mostrare processi di rilassamento assai lenti; in molti casi, per quanto a lungo si possa osservare il sistema, le sue proprietà continueranno a evolvere. Dagli anni Settanta del Novecento in poi, un comportamento fortemente analogo a questo è stato osservato in altri settori della fisica della materia condensata, in particolare in magneti disordinati chiamati vetri di spin. Tale campo di ricerca è stato a sua volta parzialmente ispirato da precedenti studi sperimentali sui vetri strutturali; questi ultimi si presentano sovraraffreddando fluidi molecolari, come il glicerolo, in un regime vetroso. Negli anni Ottanta si è mostrato che le sospensioni colloidali dense sono esse stesse vetri strutturali, nel senso che le particelle rimangono intrappolate vicino a posizioni fisse che non formano un reticolo ordinato. Negli anni Novanta, è stato proposto che il paradigma del vetro possa spiegare uno spettro più ampio di dinamiche bloccate nella materia condensata soffice, come per le emulsioni dense o per le fasi cristalline liquide a trama (per es., le strutture a cipolla), nelle quali si può prevedere un'evoluzione lenta del sistema attraverso una sequenza di stati metastabili, vicini all'equilibrio. È stato anche ipotizzato che la transizione di jamming possa essere collegata a un passaggio dalla fase fluida a quella vetrosa, in seguito all'applicazione di una tensione.
Cinetica delle transizioni di fase
Una forma di metastabilità più semplice di quella trovata nei vetri si presenta, per esempio, in un vapore sovraraffreddato. In questo caso il sistema si attarda in uno dei pochi minimi di energia libera, corrispondenti alle varie fasi termodinamiche, anche se il passaggio a un altro stato potrebbe far diminuire la sua energia libera F. La transizione, alla fine, può manifestarsi per mezzo della nucleazione di una piccola goccia della fase preferita. Un meccanismo diverso si presenta quando, a causa di un cambiamento improvviso dei parametri ‒ come una variazione della temperatura o un congelamento (quenching) ‒ un sistema, che era originariamente in un minimo di energia libera, improvvisamente si trova in un massimo o nelle sue vicinanze e inizia a evolvere di conseguenza. Questo caso si verifica, per esempio, quando una miscela stabile di due fluidi è raffreddata e inizia a 'smescolarsi' in un processo detto di decomposizione spinodale.
La cinetica di smescolamento di liquidi e solidi semplici è un argomento importante della fisica della materia condensata. Nel caso delle leghe metalliche c'è una conoscenza empirica ragionevole di come il processo di formazione del materiale influisca sulla microstruttura risultante. Malgrado ampie ricerche, una comprensione simile dei canali di sviluppo di un processo nella materia condensata soffice non è stata ancora raggiunta, anche se progressi notevoli sono stati compiuti alla fine degli anni Novanta, almeno per una classe importante di sistemi (miscele colloidi-polimeri). Un colloide o una pasta (sia essa vernice, shampoo o salsa di pomodoro) può essere inutilizzabile se si separa prematuramente in un blocco solido e in uno strato di solvente sovrapposto. Il verificarsi o meno di ciò dipende dalla microstruttura del materiale che, a sua volta, è determinata dalla storia della sua formazione. Ugualmente interessante, ma meno studiato in altri campi della fisica degli stati condensati, è il processo inverso. Come si mescolano fasi inizialmente separate se si cambiano le condizioni termodinamiche ad hoc? Un comportamento peculiare è quello di un cristallo liquido a doppio strato che, mentre si dissolve in un eccesso di acqua, può mostrare diversi tipi di instabilità. Tra queste vi è l'instabilità mielinica, così chiamata dalle strutture osservate, a forma di dita, che somigliano strettamente alle guaine mieliniche che rivestono le cellule nervose nel corpo umano.
Bibliografia
Anderson, Lekkerkerker 2002: Anderson, Valerie J. - Lekkerkerker, Henk N.W., Insights into phase transition kinetics from colloid science, "Nature", 416, 2002, pp. 811-815.
Bray 1994: Bray, Alan J., Theory of phase ordering kinetics, "Advances in physics", 43, 1994, pp. 357-459.
Cates, Candau 1990: Cates, Michael E. - Candau, Sauveur Jean, Statics and dynamics of worm-like surfactant micelles, "Journal of physics: condensed matter", 2, 1990, pp. 6869-6892.
Cates, Evans 2000: Soft and fragile matter: nonequilibrium dynamics, metastability and flow, edited by Michael E. Cates, Martin R. Evans, Edinburgh, IOP, 2000.
Diat 1992: Diat, Olivier - Roux, Didier - Nallet, Frédéric, Effect of shear on a lyotropic lamellar phase, "Journal de physique", 3, 1992, pp. 1427-1452.
Gompper, Schick 1994: Gompper, Gerhard - Schick, Michael, Self-assembling amphiphilic systems, London-New York, Academic Press, 1994.
Haw, Poon 1997: Haw, Mark D. - Poon, Wilson C.K., Mesoscopic structure formation in colloidal aggregation and gelation, "Advances in colloid and interface science", 73, 1997, pp. 71-126.
Israelachvili 1985: Israelachvili, Jacob, Intermolecular and surface forces, London-New York, Academic Press, 1985.
Larson 1999: Larson, Ronald G., The structure and rheology of complex fluids, Oxford, Oxford University Press, 1999.
Lekkerkerker 2000: Lekkerkerker, Henk N.W., Phase separation and aggregation in colloidal suspension, in: Soft and fragile matter, nonequilibrium dynamics, metastability and flow, edited by Michael E. Cates and Martin R. Evans, Edinburgh, IOP, 2000.
Lipowsky, Sackmann 1995: Lipowsky, Reinhard - Sackmann, Erich, Structure and dynamics of membranes: from cells to vesicles, Amsterdam-Oxford, Elsevier, 1995.
Pusey 1991: Pusey, Peter N., Colloidal suspensions, in: Liquids, freezing and glass transition, edited by Jean-Pierre Hansen, Denis Levesque, Jean Zinn-Justin, Amsterdam-New York, Elsevier, 1991, pp. 767-942.
Rehage, Hoffmann 1991: Rehage, Heinz - Hoffmann, Heinz, Viscoelastic surfactant solutions. Model systems for rheological research, "Molecular physics", 74, 1991, pp. 933-973.
Vicsek 1989: Vicsek, Tamás, Fractal growth phenomena, Singapore, World Scientific, 1989.