Microscopia
Microscopia
La microscopia ottica, nelle sue svariate tipologie (campo oscuro, contrasto di fase, contrasto interferenziale, a luce polarizzata, a fluorescenza, ecc.), e la microscopia elettronica, sia a trasmissione sia a scansione, sono tecniche da tempo consolidate, che possono essere considerate tradizionali anche in relazione alla larga diffusione e al vasto spettro di applicazioni. Le due metodiche sono in una certa misura complementari, anche rispetto all'enorme differenza del potere risolutivo: frazioni di micron (1 μm=10−6 m) per il microscopio ottico, qualche nanometro (1 nm=10−9 m) per il microscopio elettronico. Tutti i microscopi che utilizzano onde o particelle hanno un limite di risoluzione teorico noto come barriera di Abbe, strettamente dipendente dalla lunghezza d'onda della radiazione utilizzata, e un potere risolutivo pratico legato, invece, alla qualità dello strumento. La necessità di ottimizzare la qualità delle immagini ha portato allo sviluppo di nuovi approcci e alla realizzazione di metodiche e apparecchiature le cui basi teoriche, nella maggior parte dei casi, erano state poste già da alcuni decenni.
Nel campo della microscopia ottica, la microscopia confocale analizza, in rapida successione, piccolissime aree di un campione, illuminato con un raggio intenso e puntiforme in un preciso piano focale. L'esame di piani focali in sequenza, la digitalizzazione del segnale e la successiva analisi delle immagini consentono una visione nitida e tridimensionale del campione. Nell'ambito della microscopia elettronica, i progressi nelle tecniche di diffrazione e analitiche hanno migliorato la risoluzione spaziale e l'efficienza di rilevamento del segnale. Il limite principale della microscopia elettronica è rappresentato dal trattamento a cui vanno sottoposti i campioni biologici per poter effettuare un'osservazione sotto vuoto di sezioni sottili. Le tecniche di congelamento rapido (criomicroscopia), eliminando la necessità di disidratare e colorare il campione, hanno offerto un'importante soluzione alternativa e hanno spesso consentito di effettuare nuove, rilevanti osservazioni.
Il congelamento di un campione, purché attuato con estrema rapidità, ossia con variazioni di temperatura superiori a 104 K al secondo, previene la formazione di cristalli di ghiaccio, che possono alterare e mascherare le strutture che si vogliono osservare. Per determinare la distribuzione topografica di molecole non direttamente osservabili, si ricorre alla tecnica dell'immuno-elettromicroscopia, basata sull'impiego di anticorpi coniugati con particelle elettrondense (opache al fascio di elettroni), come per esempio particelle di oro colloidale: l'anticorpo riconosce specificamente le molecole che si vogliono individuare e l'osservazione delle particelle di oro colloidale consente di determinarne la localizzazione. Una nuova era nel campo della microscopia è stata aperta dai cosiddetti microscopi con sonda di scansione (SPM, Scanning probe microscope), in cui una sonda dalla punta estremamente sottile è posizionata molto vicino alla superficie di un materiale e ne effettua una fine scansione; dall'analisi delle interazioni tra sonda e superficie è possibile determinare la topografia di quest'ultima con un livello di risoluzione mai raggiunto in precedenza.
Microscopia con sonda di scansione
La caratteristica più importante dei microscopi con sonda di scansione è quella di non utilizzare particelle libere: non sono perciò necessari obiettivi né sorgenti di luce o di elettroni. Ciò permette di superare uno dei limiti imposti da qualsiasi strumento che si serva di lenti per focalizzare luce o altre radiazioni, limite rappresentato dal fatto che la diffrazione impedisce di raggiungere una risoluzione superiore a circa metà della lunghezza d'onda della radiazione impiegata. Oltre a rendere possibile una risoluzione elevatissima, a livello atomico, i microscopi con sonda di scansione consentono di operare in presenza di gas o di liquidi, e non necessariamente sotto vuoto come i microscopi elettronici. È pertanto possibile osservare campioni senza doverli modificare e senza esporli a dannose radiazioni di alta energia; ciò permette di scegliere condizioni ottimali di analisi che, nel caso particolare dei campioni biologici, sono comparabili a quelle naturali. I primi rappresentanti di questa famiglia di microscopi sono il microscopio a scansione a effetto tunnel (STM, Scanning tunneling microscope) e il microscopio a forza atomica (SFM, Scanning force microscope, o AFM, Atomic force microscope), messi a punto negli anni Ottanta del Novecento da Gerard Binnig e Heinrich Rohrer del laboratorio di ricerca dell'IBM a Zurigo. Il microscopio a forza atomica è più versatile di quello a effetto tunnel poiché, oltre a fornire immagini della superficie di un campione, consente di selezionare molti tipi di forze ‒ quali interazioni elettrostatiche, forze di van der Waals, magnetismo e attrito ‒ prospettando lo sviluppo di vari tipi di microscopia che renderanno possibile analizzare le interazioni molecolari.
Microscopio a effetto tunnel
Nel microscopio a effetto tunnel l'unica sorgente di radiazioni è rappresentata dagli elettroni legati presenti nel campione da esaminare, che deve essere un conduttore. Il funzionamento di questo microscopio si basa su un fenomeno della meccanica quantistica noto appunto come effetto tunnel: gli elettroni, comportandosi come onde, possono attraversare la superficie di un materiale solido e formare una nube elettronica, tale che la probabilità di trovarvi un elettrone diminuisca esponenzialmente con l'aumentare della distanza dalla superficie stessa. Nel microscopio a effetto tunnel si utilizzano sonde la cui punta può avere un diametro di soli 0,2 nm ed essere costituita da un solo atomo. La qualità dell'immagine è determinata in modo fondamentale dalla forma e dalla qualità della punta ‒ che può essere di tungsteno, oro o platino/iridio ‒ mossa sul campione nelle due dimensioni del piano, secondo percorsi paralleli separati da una frazione di nanometro.
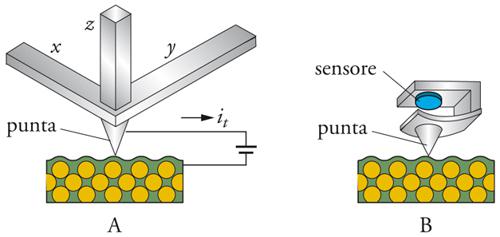
Questa precisa scansione è possibile grazie all'utilizzazione di tre guide, composte di materiali ceramici piezoelettrici, che hanno la proprietà di modificare le proprie dimensioni con il variare della differenza di potenziale a esse applicato (fig. 2A). Durante la scansione, la punta della sonda è mantenuta a una distanza dalla superficie del campione di circa 1 nm, tale che la nube di elettroni dell'atomo posto all'estremità della sonda e quella del più vicino atomo del campione si sovrappongono; applicando una piccola tensione elettrica, gli elettroni attraversano questo spazio per effetto tunnel e generano una piccolissima corrente di tunneling (it), che è dell'ordine di grandezza di 1 nA per differenze di potenziale di circa 1 V. L'intensità della corrente di tunneling dipende fortemente dalla distanza tra la punta e la superficie: se queste si allontanano di 0,1 nm, l'intensità diminuisce di un fattore dieci. La distanza tra la punta del microscopio e la superficie del campione può essere mantenuta costante grazie a un meccanismo a retroazione che rileva la corrente di tunneling e modifica corrispondentemente la tensione elettrica applicata a una terza guida piezoelettrica, capace di far muovere la sonda in direzione perpendicolare al piano di scansione. La punta della sonda segue pertanto il profilo della superficie, mentre le variazioni di tensione elettrica sono opportunamente amplificate e trasformate elettronicamente in un'immagine della superficie stessa. Questo modo di rilevazione dei dati è detto a corrente costante. È possibile operare anche ad altezza costante (con velocità di scansione più alta), oppure allontanare la sonda a ogni punto di scansione (minimizzando così l'interazione tra punta e campione), o altrimenti ricorrere alla spettroscopia. La velocità di scansione dipende sia dalle modalità operative sia dalla rugosità della superficie; si può considerare che siano necessari circa tre minuti per acquisire l'immagine di una superficie di 2 μm×2 μm (256×256 punti) che abbia dislivelli di circa 10 nm.
L'immagine topografica del campione così ottenuta non va però considerata nel senso usuale del termine immagine, poiché essa dipende anche dalle variazioni di abbondanza e di energia degli elettroni di superficie. Un atomo di un elemento estraneo su una superficie perfettamente uniforme può apparire, a seconda delle sue proprietà elettroniche, come un avvallamento o come un rilievo anomalo. Le proprietà del microscopio a effetto tunnel rendono possibile, se esso è opportunamente utilizzato, rilevare anche la composizione atomica della superficie di un materiale. In condizioni operative ottimali si possono ottenere risoluzioni di singoli atomi fino a 0,2 nm di diametro: si parla in questo caso di sovrarisoluzione, dal momento che la lunghezza d'onda degli elettroni è di circa 1 nm. Per l'osservazione di campioni biologici è necessario che questi siano posti su un opportuno conduttore e ricoperti uniformemente, per evaporazione, con un sottile velo di metallo. L'immagine così ottenuta riflette la topologia della superficie, dal momento che la densità elettronica locale può essere considerata costante.
Microscopio a forza atomica
A differenza del microscopio a effetto tunnel, il microscopio a forza atomica consente di analizzare campioni non conduttori. Una minuscola sonda, che può essere costituita da un diamante montato su una strisciolina metallica, effettua la scansione del campione seguendo un andamento a reticolo e rilevando l'entità della forza di repulsione generata dalla sovrapposizione della nube elettronica della punta della sonda e di quella degli atomi sulla superficie del campione. La strisciolina metallica serve a mantenere, grazie alla sua elasticità, un contatto continuo tra la sonda e la superficie da analizzare, seguendone le irregolarità a un livello di risoluzione atomica. La punta analizza la superficie, come la puntina di un giradischi legge il solco di un disco (fig. 2B). I problemi tecnici principali posti dal microscopio a forza atomica sono due, legati alla natura della sonda e al controllo della pressione che essa esercita sul campione. Inizialmente, si usava come sonda un frammento di diamante incollato su un foglio d'oro o su un filo di tungsteno, ma attualmente la tecnologia dei semiconduttori ha reso disponibili sonde di elevata qualità in cui il supporto elastico e la punta, costituiti dello stesso materiale, per esempio nitruro di silicio, sono fusi insieme. La struttura e i materiali delle punte sono oggetto di intensa ricerca e le più recenti tecnologie fanno sperare di poter ottenere punte di diametro inferiore ai 2 nm.
Il controllo della pressione esercitata sul campione era ottenuto, in origine, con un meccanismo a retroazione che rispondeva a correnti di tunneling; queste facevano variare la tensione elettrica che era applicata a una guida piezoelettrica, in grado di regolare la pressione sul campione. Attualmente si preferiscono sensori ottici, a raggi laser, che permettono di misurare la deflessione delle punte con una sensibilità di circa 0,01 nm, superiore a quella ottenuta per il tramite della corrente di tunneling. Si consideri che la pressione da esercitare per generare un'immagine della superficie del campione, pur essendo difficile da valutare, deve risultare sufficiente a superare le pellicole d'acqua e le piccole impurezze che sempre si accumulano sia sulla punta sia sul campione; se quest'ultimo non è molto duro, come è il caso, per esempio, delle strutture biologiche, può essere danneggiato da un eccessivo incremento di pressione. L'immersione della punta e del campione in una goccia d'acqua durante la scansione, consente di ridurre di un fattore dieci la pressione e di eliminare parzialmente questi inconvenienti. Tuttavia molte superfici, immerse in liquidi, legano fortemente ioni che generano forze repulsive e rappresentano un'ulteriore sorgente di interferenze. In condizioni ideali è possibile misurare forze di un ordine di grandezza compreso tra 10−3 e 10−4 N, con una risoluzione laterale dell'ordine di 0,1 nm.
Altri microscopi con sonda di scansione
Il microscopio a forza atomica con sonda di scansione per contatto esercita pressioni che possono danneggiare o contaminare il campione in esame. Sono stati sviluppati pertanto nuovi tipi di microscopi con sonda di scansione, che evitano il contatto con la superficie da esaminare. Il principale è il microscopio a effetto attrattivo con sensore laser, in cui è sfruttata la debole forza attrattiva che si esercita tra sonda e campione a una distanza di circa 20 nm. Questa forza attrattiva ‒ dovuta prevalentemente alla tensione superficiale dell'acqua di condensazione e in misura minore alle forze di van der Waals, deboli e transitorie ‒ è circa mille volte meno intensa delle forze repulsive generate dal microscopio a interazione atomica per contatto. La sonda è vibrante ed è costituita da un sottilissimo filo di tungsteno, la cui punta ha un diametro inferiore ai 50 nm, oppure da silicio, con una punta della dimensione di un diametro atomico. La frequenza di funzionamento è vicina alla frequenza di risonanza del filo, che amplifica il segnale come avviene per l'ancia di uno strumento musicale. Quando la punta in vibrazione si avvicina al campione, le forze attrattive smorzano la vibrazione abbassandone la frequenza. Per rilevare variazioni di ampiezza della vibrazione è impiegato un sensore laser, utilizzando la tecnica dell'interferometria e raggiungendo una sensibilità molto elevata. Dal momento che l'ampiezza si riduce in corrispondenza dei rilievi, dove le forze attrattive sono più intense, e aumenta negli avvallamenti, dove le forze attrattive sono ridotte, le fluttuazioni possono essere convertite in un profilo della superficie. Un meccanismo a retroazione mantiene costante la distanza tra punta e superficie.
Una variante del microscopio a effetto attrattivo con sensore laser è il microscopio a interazione magnetica, in cui la sonda vibrante, di ferro o di nichel, è magnetizzata. Quando essa si trova in prossimità di un campo magnetico, avviene un cambiamento nella frequenza di risonanza e quindi nell'ampiezza della vibrazione. È possibile in tal modo visualizzare, con una risoluzione superiore a 25 nm, la struttura di un campo magnetico, come quello generato dalla registrazione di dati su dischi o su altri supporti. Queste informazioni possono essere utili per giudicare la qualità dei supporti di memoria o delle prestazioni delle testine di registrazione. Il microscopio a interazione elettrostatica è un'ulteriore variante dei microscopi con sonda di scansione, che potrebbe rivelarsi particolarmente utile nella produzione di componenti microelettronici. In questo caso la sonda vibrante è dotata di carica elettrica e la vibrazione è modificata dalla presenza di forze elettrostatiche generate dalle cariche presenti nel campione. Un esempio applicativo è l'analisi della distribuzione e della concentrazione di alcuni atomi di impurezze, detti droganti, che nella preparazione di microcircuiti si aggiungono al silicio per modificarne le caratteristiche.
È possibile, con un apposito microscopio a sonda, misurare l'attrito su scala atomica. Diversamente dagli altri microscopi, nei quali si misura la flessione verticale del supporto elastico su cui si trova la sonda, in questo tipo di strumento è misurata la torsione causata da forze laterali. La punta è montata su una strisciolina metallica, la cui deflessione è monitorata con un interferometro laser durante il movimento trasversale sul campione. Nel microscopio termico a scansione, la sonda, costituita da tungsteno e nichel separati da un isolante, agisce come una termocoppia che genera una tensione elettrica proporzionale alla temperatura. La vicinanza al campione determina una perdita di calore, proporzionale alla distanza dalla superficie, che fornisce informazioni sulla topologia della superficie stessa. Nel microscopio a scansione a conduttanza ionica, la sonda è costituita da una micropipetta di vetro contenente un minuscolo elettrodo. L'immersione della pipetta in un elettrolita consente di misurare un flusso di ioni rispetto a un elettrodo di riferimento. Questa corrente si riduce, fino ad annullarsi, quando la pipetta si avvicina e tocca il campione. Il diametro della pipetta limita per ora la risoluzione dello strumento a circa 0,2 μm.
Il microscopio ottico a scansione in campo prossimo (SNOM, Scanning near-field optical microscope), entrato in commercio nel 1994, utilizza il principio descritto per la prima volta nel 1956 da John A. O'Keefe, il quale propose di effettuare la scansione di un campione con un fascio di luce emergente da un minuscolo forellino. In queste condizioni, la risoluzione risulta limitata non più dalla lunghezza d'onda della luce, ma dalla dimensione del forellino. I progressi tecnologici hanno consentito di realizzare soltanto in epoca recente questo tipo di strumento, che ha reso possibili scansioni estremamente accurate e ragionevolmente rapide. Il microscopio ottico a scansione in campo prossimo unisce il vantaggio di utilizzare luce trasmessa, e quindi di ottenere immagini convenzionali composte di luci, ombre e colori, alla possibilità di raggiungere risoluzioni non più limitate dalla lunghezza d'onda utilizzata.
Microscopia confocale
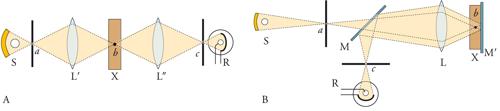
Il microscopio a scansione confocale, proposto nel 1957 da Marvin Minsky, che lo chiamò microscopio a scansione a doppia focalizzazione, risponde alla necessità di eliminare il disturbo provocato dalla radiazione luminosa diffusa e riflessa da piani del campione che sono fuori fuoco. In effetti, la condizione ideale per ottenere una rappresentazione di un singolo piano di un campione sarebbe quella di raccogliere solamente le radiazioni luminose riflesse da quel particolare piano. Nella microscopia ottica classica, invece, è illuminato l'intero campione; anche la materia posta al di sopra o al di sotto del piano focale, pertanto, riflette radiazioni luminose, causando un grave disturbo che si manifesta come nebulosità dell'immagine. Nel microscopio confocale, la soluzione del problema si ottiene illuminando un solo punto per volta di uno specifico piano focale e acquisendo, in ciascun momento, solamente l'immagine del punto illuminato. In pratica, nel microscopio confocale la luce proveniente dalla sorgente passa attraverso un forellino posto sull'asse del microscopio ed è focalizzata in un punto del campione da una lente, che funge da condensatore. Il campo di osservazione è limitato da un secondo forellino, confocale al primo e al punto del campione su cui è focalizzata la luce (fig. 4). In questo modo si ottiene un'immagine molto nitida e relativa soltanto a una regione molto piccola e sottile del campione. La rappresentazione di un intero piano è effettuata mediante la scansione del campione: punti successivi dello stesso piano focale sono illuminati progressivamente, spostando il campione stesso oppure, servendosi di specchi rotanti, il fascio luminoso. Per rendere più veloce la scansione è possibile utilizzare fasci luminosi multipli. Alcuni microscopi sono dotati di un disco con centinaia di forellini attraverso i quali è inviata e raccolta la luce: il disco ruota opportunamente per garantire la scansione dell'intero piano focale. Altri microscopi, per ridurre il tempo di scansione, ricorrono ad aperture a forma di fenditura. È ovviamente possibile ripetere la stessa operazione su altri piani focali, acquisendo progressivamente informazioni sull'intero campione in tutto il suo spessore. Questo principio può essere applicato, oltre che con luce trasmessa, anche per l'epi-illuminazione, come nel caso della fluorescenza (fig. 4).
La necessità di un'illuminazione intensa e puntiforme ha portato all'impiego del laser, sorgente luminosa monocromatica e collimata. È possibile utilizzare diversi laser a differenti lunghezze d'onda, che permettono di analizzare campioni colorati con più fluorocromi. Questa applicazione è particolarmente importante nel campo della immunofluorescenza, un settore in cui la microscopia confocale è risultata particolarmente vantaggiosa. Per quanto le tecniche di scansione siano oggi talmente rapide da rendere possibile l'osservazione di piani completi in tempo reale, normalmente l'immagine acquisita è memorizzata in un calcolatore e può essere rielaborata successivamente. La scansione di un singolo piano produce in pratica una sezione ottica costituita da tanti pixel, che può essere considerata analoga a una vera e propria fetta sottile del campione originale. Dal momento che sono analizzati più piani e che il calcolatore memorizza non soltanto la luminosità di ciascun punto, ma anche la sua localizzazione spaziale nel campione, ogni punto immagine, detto voxel, rappresenta l'equivalente del pixel di un'immagine a due dimensioni; esso è definito da tre coordinate, due (x e y) nel piano e una terza (z) perpendicolare al piano. Grazie a opportuni programmi è possibile manipolare con facilità i voxel, fino a pervenire a una ricostruzione tridimensionale delle immagini secondo differenti assi, per osservarle dalla prospettiva più favorevole. È anche possibile ottenere nuove sezioni ottiche: verticali, trasversali od oblique.
La prima generazione di microscopi confocali utilizzava un solo fotone. È stato successivamente proposto un microscopio multifotone, che eccita le molecole fluorescenti mediante un laser pulsante ultrarapido. Il microscopio multifotone, a due o più fotoni, si basa sul principio per cui una determinata molecola fluorescente, che normalmente sarebbe eccitata per assorbimento di un singolo fotone di una determinata lunghezza d'onda, può anche essere eccitata dall'energia derivante dall'assorbimento simultaneo di due o più fotoni di energia inferiore. La fluorescenza è proporzionale al quadrato dell'intensità di eccitazione e conferisce al microscopio a scansione laser multifotone (TPEF, Two-photon excited fluorescence microscopy) una buona risoluzione tridimensionale e quindi un vantaggio nell'analisi di campioni spessi. Tale microscopio è utile, inoltre, per lo studio di cellule in vivo, poiché è ridotto il danno che l'illuminazione provoca nel campione.
Oltre al perfezionamento delle apparecchiature, le applicazioni della microscopia confocale sono diventate sempre più numerose anche grazie alla scoperta di molecole fluorescenti, come la proteina GFP (Green fluorescent protein), che consentono lo studio di processi biologici in vivo. La GFP è una proteina che è stata isolata da una medusa oceanica e che emette naturalmente un segnale fluorescente. Se si costruiscono proteine chimeriche, in cui una qualsiasi proteina X è fusa con la GFP, è possibile monitorare il comportamento della proteina X. Sono state inoltre ottenute varianti della proteina GFP che emettono segnali fluorescenti di differente lunghezza d'onda e quindi di diverso colore. Tra le tecniche di fluorescenza in cui trova impiego il microscopio confocale ricordiamo: la FRET (Fluorescence resonance energy transfer), in cui la distanza di interazione tra due molecole è valutata grazie allo scambio di energia tra due fluorocromi diversi, ognuno legato a una delle due molecole e al conseguente cambiamento della lunghezza d'onda di emissione del fluorocromo accettore; la FRAP (Fluorescence recovery after photobleaching), in cui è analizzata la motilità di una molecola, che è localizzata, per esempio, su una membrana cellulare e a cui è legato un fluorocromo, dopo che è avvenuta l'irradiazione di una regione puntiforme con un potente raggio laser che annulla transitoriamente l'emissione di fluorescenza; la FLAP (Fluorescence localization after photobleaching), che serve a monitorare il movimento di una molecola a cui sono legati due fluorocromi, uno dei quali è irradiato da luce laser puntiforme che ne annulla l'emissione e l'altro è utilizzato per seguire il movimento delle molecole irradiate. Varianti delle tecniche descritte sono la FLIP (Fluorescence loss in photobleaching), la FLIM (Fluorescence lifetime imaging), la BRET (Bio-luminescence resonance energy transfer) e altre ancora.
Microscopio a raggi X
Il microscopio a raggi X si basa sull'uso di raggi X molli, di lunghezza d'onda compresa tra 2 e 4 nm, potenzialmente non in grado di garantire una risoluzione altrettanto elevata quanto quella del microscopio elettronico. Fino ad alcuni anni fa, non si era riusciti a ottenere uno strumento che fornisse prestazioni superiori a quelle del microscopio ottico e che potesse, almeno per alcune caratteristiche, competere anche con quello elettronico; ciò per la carenza di sorgenti di raggi X sufficientemente intense e di adeguati sistemi ottici e rivelatori, problemi che sono poi stati risolti con successo. Il miglioramento della luminosità delle sorgenti di raggi X è stato ottenuto grazie all'utilizzazione del sincrotrone e alla messa a punto di laser a raggi X e di plasmi che emettono raggi X. È stato inoltre possibile focalizzare i raggi X con estrema precisione, utilizzando principalmente il cosiddetto reticolo zonato di Fresnel, costituito da un alternarsi di anelli opachi e trasparenti la cui spaziatura decresce con la distanza dal centro, utili per focalizzare anche altri tipi di radiazioni. Infine, i rivelatori di raggi X sono stati notevolmente perfezionati con l'introduzione dei rivelatori elettronici e con la sostituzione, in molti casi, della pellicola fotografica con un materiale sensibile e privo di grani (resist) che, oltre a essere di basso costo, consente una risoluzione di quasi due ordini di grandezza superiore a quella di una normale pellicola fotografica.
Gli attuali microscopi a raggi X hanno una risoluzione di gran lunga migliore rispetto a quella dei microscopi ottici e, a differenza dei microscopi elettronici, offrono l'opportunità di osservare campioni in mezzo gassoso o acquoso; ciò è senza dubbio importante nel caso di campioni biologici e rappresenta la vera potenzialità futura di questi microscopi. Vi sono quattro metodi di impiego dei raggi X, che consentono di ottenere una risoluzione abbastanza elevata: la microscopia per contatto, la microscopia a focalizzazione, la microscopia a scansione e l'olografia. La microscopia per contatto è stato il primo e il più comune dei metodi utilizzati; la versione attuale si avvale di vari tipi di resist e di microscopi elettronici più perfezionati, con cui osservare le immagini impressionate nel resist. Nei microscopi a focalizzazione l'intero campione è illuminato una volta sola e le ottiche focalizzanti danno origine a un'immagine, ingrandita alcune centinaia di volte, per la cui registrazione non è necessario un rivelatore ad alta risoluzione. Nei più moderni microscopi a scansione, l'immagine è costruita un pixel alla volta, mentre il campione viene illuminato in un'area molto ristretta da un fascio focalizzato. La tecnica dell'olografia, come quella per contatto, non richiede un meccanismo di focalizzazione e permette di ottenere ulteriori informazioni sulla tridimensionalità del campione. I microscopi a raggi X possono essere impiegati anche nell'analisi della composizione elementare di un campione; oggi, per la loro risoluzione (20÷100 nm) e per le loro prestazioni generali, essi si collocano tra i microscopi ottici e quelli elettronici, pur non avendo ancora un'apprezzabile diffusione.
Microscopio acustico
Il microscopio acustico può essere considerato un'estensione della tecnologia delle immagini ultrasoniche. Fu proposto inizialmente da Sergei Y. Sokolov, intorno agli anni Quaranta del XX sec., ma si dovettero attendere gli anni Sessanta prima che fosse sviluppata la tecnologia necessaria per la produzione di onde a frequenza ultrasonica sufficientemente elevata da rendere accettabili le prestazioni dello strumento. Un microscopio acustico utilizza onde ultrasoniche con frequenze dell'ordine di 1 o 2 GHz (1 o 2 miliardi di cicli per secondo), circa 1000 volte più alte di quelle tipiche dei sistemi macroscopici per la formazione di immagini ultrasoniche, impiegati per esempio nella pratica medica per lo studio di organi interni del corpo umano (ecografi). La lunghezza d'onda di funzionamento dei più moderni microscopi acustici è pertanto dell'ordine di frazioni di µm, comparabile con quella delle onde elettromagnetiche della luce visibile. Le immagini che questo strumento consente di ottenere hanno di conseguenza una risoluzione teorica paragonabile a quella dei microscopi ottici convenzionali.
Poiché la sorgente del contrasto dei sistemi acustici è completamente diversa da quella dei sistemi ottici, è possibile ottenere informazioni su proprietà di oggetti microscopici precedentemente inaccessibili. È da tener presente, inoltre, che l'elemento focalizzante può essere molto più semplice della lente di un comune microscopio ottico e che la risoluzione risulta limitata quasi esclusivamente dalla lunghezza d'onda di funzionamento, poiché l'aberrazione non riveste un ruolo molto importante. Il principio chiave su cui si basa la formazione delle immagini in un microscopio acustico è la variazione di velocità che le onde sonore subiscono quando attraversano una superficie di separazione tra due materiali differenti. Tale variazione è di gran lunga maggiore che per le onde luminose: si consideri, infatti, che la velocità delle onde sonore può diminuire anche di un fattore dieci nell'attraversare un'opportuna interfaccia liquido-solido, mentre l'indice di rifrazione delle onde luminose non è mai superiore a 1,9. Ancora oggi i microscopi acustici hanno una scarsa diffusione, a causa della loro complessità e dei costi eccessivi.
Bibliografia
Aguayo 1986: Aguayo, James B. e altri, Nuclear magnetic resonance imaging of a single cell, ‟Nature", 322, 1986, pp. 190-191.
Binnig 1986: Binnig, Gerd - Quate, Calvin F. - Gerber, Christian, Atomic force microscope, ‟Physical review letters", 56, 1986, pp. 930-933.
Binnig, Rohrer 1985: Binnig, Gerd - Rohrer, Hermann, The scanning tunneling microscope, ‟Scientific American", 253, 2, 1985, pp. 40-46 (trad. it.: Il microscopio a scansione a effetto tunnel, ‟Le scienze", 35, 1985, pp. 34-40).
Binnig 1982: Binnig, Gerd e altri, Surface studies by scanning tunneling microscopy, ‟Physical review letters", 40, 1982, pp. 57-61.
Briggs 1922: Briggs, Andrew, Acoustic microscopy, Oxford, Clarendon, 1992.
Duke, Michette, 1990: Duke, Philip J. - Michette, Alan G., Modern microscopies: techniques and applications, New York, Plenum, 1990.
Hansma 1988: Hansma, Paul K. e altri, Scanning tunneling microscopy and atomic force microscopy: application to biology and technology, ‟Science", 242, 1988, pp. 209-216.
Howells 1991: Howells, Malcom R. - Kirz, Janos - Sayre, David, X-ray microscopy, ‟Scientific American", 264, 1991, 2, pp. 42-48 (trad. it.: Microscopi a raggi X, ‟Le scienze", 272, 1991, pp. 58-67).
Inoué 1986a: Inoué, Shinya, Video microscopy, New York 1986.
Inoué 1986b Inoué, Shinya, Progress in video microscopy, ‟Cell motility and the cytoskeleton", 10, 1988, pp. 13-17.
Lichtman 1994: Lichtman, Jeff W., Confocal microscopy, ‟Scientific American", 271, 2, 1994, pp. 30-35 (trad. it.: I microscopi confocali, ‟Le scienze", 314, 1994, pp. 56-61).
Minsky 1957: Minsky, Marvin, Microscopy apparatus, U.S. Patent n. 013467, 1957.
Minsky 1988: Minsky, Marvin, Memoir on inventing the confocal scanning microscope, ‟Scanning", 10, 1988, pp. 128-138.
Morris 1994: Morris, Victor J., Biological applications of scanning probe microscopies, ‟Progress in biophysics and molecular biology", 81, 1994, pp. 131-185.
Pawley 1990: Pawley, James B., Handbook of biological confocal microscopy, New York-London, Plenum, 1990.
Quate 1979: Quate, Calvin F., The acoustic microscope, ‟Scientific American", 241, 4, 1979, pp. 58-66 (trad. it.: Il microscopio acustico, ‟Le scienze", 136, 1979, pp. 38-46).
Quate 1980: Quate, Calvin F., Microwaves, acoustic and scanning microscopy, in: Scanned image microscopy, edited by Eric A. Ash, London, Academic Press, 1980, pp. 22-55.
Schnapp 1985: Schnapp, Bruce J. e altri, Single microtubules from squid axoplasm support bidirectional movement of organelles, "Journal of cell biology", 40, 1985, pp. 455-462.
White 1987: White, James G. - Amos, W. Brad - Fordham, Michael, An evaluation of confocal versus conventional imaging of biological structures by fluorescence light microscopy, ‟Journal of cell biology", 105, 1987, pp. 41-48.
Wickramasinghe 1989: Wickramasinghe, H. Kumar, Scanned-probe microscopes, ‟Scientific American", 241, 4, 1989, pp. 74-81 (trad. it.: Microscopi con sonda di scansione, ‟Le scienze", 256, 1989, pp. 86-96).