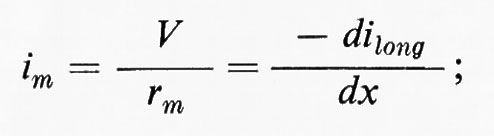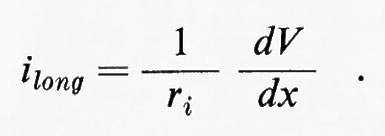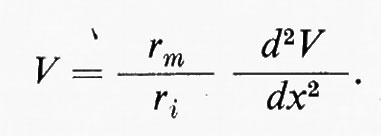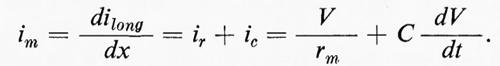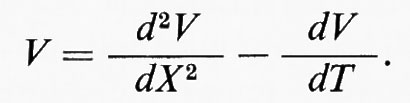Neurone e impulso nervoso
Neurone e impulso nervoso
di Harry Grundfest
Neurone e impulso nervoso
sommario: 1. Introduzione. 2. La cellula come conduttore elettrico. a) L'assone come cavo. b) Perdite di cavo. c) Caratteristiche elettriche del circuito equivalente. d) Assone e cavo: un paragone. 3. Il potenziale di azione assonico. a) Generatori bioelettrici. b) La risposta rigenerativa. c) Soglia di eccitamento. d) La risposta graduata locale. e) Latenza di scarica. f) Relazione intensità-durata. g) Forma e durata del potenziale di azione. 4. Conduzione dell'impulso. a) Fattore di sicurezza per la propagazione. b) Propagazione ortodromica e antidromica. c) Velocità di conduzione. d) Conduzione saltatoria. 5. Varietà di assoni. a) Morfologia. b) Assoni dei Mammiferi. c) Il potenziale di azione composto. 6. Attività ripetitiva. a) Refrattarietà; b) Altre variazioni nello stato di eccitabilità. c) Risposte ripetitive. 7. Normali modalità d'insorgenza dell'impulso. a) Nei neuroni sensitivi primari. b) Nelle cellule postsinaptiche. c) Nei sistemi di cellule recettrici. 8. Reazioni alle terminazioni dell'assone. a) Requisiti per la trasmissione. b) Varietà di mediatori. c) Vescicole sinaptiche. d) Liberazione del mediatore. 9. Controllo dell'attività secretrice: a) Controllo nervoso presinaptico (indiretto). b) Facilitazione e disfacilitazione. 10. Trasporto di materiali. a) Flusso intracellulare (citoplasmatico). b) Segnali intercellulari. □ 11. Accoppiamento elettrico. a) Correnti di campo. b) Giunzioni efaptiche. □ Bibliografia.
1. Introduzione
L'impulso nervoso può essere considerato come la manifestazione elettrofisiologica di un adattamento evolutivo (v. elettrofisiologia) che ha trasformato la primitiva cellula recettore-effettore in un neurone (v. Grundfest, Evolution of..., 1959 ed Excitation by..., 1961). Questo adattamento, ovvero la capacità di generare impulsi che si propagano senza decremento per le proprietà di cavo dell'assone, è una caratteristica peculiare dei neuroni (v. fig. 1), indipendente dalle loro rispettive proprietà funzionali: sensitive, motrici, ‛internunciali' o neurosecretive (v. fig. 2). L'assone collega la componente recettiva elettrogenica specificamente sensitiva, situata all'ingresso del neurone, con la componente secretrice all'uscita, superando così la limitazione inerente all'elemento primitivo recettore-effettore o ai suoi equivalenti più recenti, quali cellule ghiandolari e cellule recettrici. Nel neurone l'ingresso e l'uscita possono essere geograficamente separati da notevoli distanze, tuttavia un messaggio elettrico impresso sull'assone dall'elettrogenesi dell'ingresso si propaga lungo questo cavo fino all'uscita lontana, dove determina la secrezione di un agente trasmettitore specifico che attraverso la fessura sinaptica va ad agire sulla membrana postsinaptica di altre cellule. Nelle connessioni sinaptiche tra neuroni, o quando i neuroni formano sinapsi con organi effettori (elettroplacche, cellule muscolari o ghiandolari), l'agente trasmettitore trasferisce l'informazione all'ingresso della cellula postsinaptica, dove una componente specializzata reagisce allo stimolo chimico. I neuroni neurosecretori non sono accoppiati altrettanto strettamente con le rispettive cellule bersaglio: i prodotti della secrezione, liberati dalle loro terminazioni, raggiungono le cellule bersaglio attraverso le vie circolatorie.
Il neurone tipo (v. fig. 1), quale unità elementare del sistema nervoso, ha una configurazione morfofunzionale che si ripete con minime variazioni a tutti i livelli di complessità nell'ambito di un determinato sistema nervoso e in animali filogeneticamente diversi (v. fig. 2). In sostanza una simile organizzazione è quella che classicamente viene rappresentata come il complesso recettore-conduttore-trasmettitore dell'arco riflesso, mantenuto però nei confini di una singola cellula. La sua capacità di specializzazione funzionale nasce in virtù delle proprietà specifiche delle diverse componenti eccitabili della membrana cellulare. Sebbene quest'ultima sia un organello continuo che racchiude il citoplasma del neurone, e nonostante il fatto che, anche se esaminata con i più potenti mezzi risolutivi, la membrana sembra possedere una struttura uniforme in tutta la sua estensione, i dati elettrofisiologici dimostrano ampiamente che dal punto di vista funzionale la membrana è eterogenea e può essere molto complessa (v. Grundfest, Ionic mechanisms..., 1961, i contributi del 1966, Some comparative..., 1967 e 1971).
Le membrane elettricamente eccitabili rispondono a uno stimolo adeguato con una variazione (generalmente un aumento) della conduttanza, che riflette una variazione della permeabilità della membrana agli ioni (v. elettrofisiologia). Questa risposta provoca uno spostamento del potenziale di membrana dal suo valore di riposo. La componente recettiva dell'ingresso risponde elettrogenicamente agli stimoli specifici e, fatta eccezione per il caso dei recettori elettrici, essa ‛non è elettricamente eccitabile' (v. Grundfest, 1957). Nei neuroni sensitivi la risposta allo stimolo specifico (adeguato) consiste in un potenziale generatore depolarizzante (v. Granit, 1955; v. recettori). Quando un neurone riceve un'informazione da un altro neurone, lo stimolo genera potenziali postsinaptici eccitatori o inibitori (PPSE o PPSI). I PPSE sono depolarizzazioni che, come il potenziale generatore, possono dare l'avvio a impulsi nella membrana elettricamente eccitabile dell'assone. I PPSI sono risposte che diminuiscono l'ampiezza dei PPSE o dei potenziali generatori e ne deprimono pertanto gli effetti eccitatori. Gli impulsi (potenziali di azione) sono prodotti in prossimità dell'entrata recettiva e vengono condotti dall'assone fino alle terminazioni nervose, dove lo stimolo depolarizzante che essi recano induce un'attività secretrice, che a sua volta agisce sull'ingresso delle cellule successive (v. Eccles, 1964; v. sinapsi: Fisiologia della sinapsi centrale; v. Katz, 1969).
L'assone funziona come un cavo che trasporta senza decremento il messaggio codificato in impulsi. Le terminazioni di entrata e di uscita di un neurone possono quindi essere separate da una notevole distanza. Le fibre spinali d'una balena o di altri grandi vertebrati possono avere lunghezze dell'ordine dei metri. Nel gimnoto gli assoni scendono dal cervello lungo il midollo spinale fino ai neuroni elettromotori posti a un metro o più di distanza. Nell'uomo l'assone afferente o efferente degli arti può essere ugualmente lungo, così come quelli dei lunghi tratti spinali ascedenti e discendenti. Come vedremo, la propagazione di un messaggio elettrico attraverso un assone non è un problema così semplice come la conduzione in un cavo metallico di uguale lunghezza. Le difficoltà furono superate con la comparsa dell'elettrogenesi da potenziale di azione, che rappresenta la risposta caratteristica dell'assone.
La comparsa dell'elettrogenesi da potenziale di azione precedette probabilmente l'evoluzione dei Metazoi, dal momento che anche animali e piante unicellulari producono potenziali di azione (v. elettrofisiologia). Comunque, l'adattamento dell'elettrogenesi da potenziale di azione alle necessità specifiche di comunicazione in un organismo pluricellulare deve essere avvenuto precocemente nel corso dell'evoluzione. La combinazione della primitiva cellula recettrice-effettrice con un assone capace di generare potenziali di azione è uno degli straordinari successi della bioingegneria evolutiva. La comparsa dei neuroni rese possibile la definitiva differenziazione fra piante e animali.
2. La cellula come conduttore elettrico
a) L'assone come cavo
La capacità delle cellule di generare segnali elettrici, di condurli e di trasmetterli ad altre cellule ha ispirato analogie con le comunicazioni telegrafiche o telefoniche. In effetti la trasmissione elettrica per mezzo di un ‛fluido elettrico' circolante fra muscolo e nervo fu proposta agli albori dell'elettrotecnologia da L. Galvani, molto prima dell'invenzione di dispositivi per la comunicazione elettrica. Naturalmente lo sviluppo dell'elettrotecnologia si può considerare nato dalla famosa controversia fra Galvani e Volta sull'esistenza dell'elettricità animale. Fu nel tentativo di confutare l'esistenza di questa elettrogenesi che Volta sviluppò la batteria elettrochimica che rese possibile i successivi studi e le successive applicazioni dell'elettricità.
L'analogia divenne particolarmente popolare in seguito al fiorire delle conoscenze di anatomia e fisiologia del sistema nervoso e allo sviluppo della telegrafia nel XIX secolo. Il paragone è corretto, però, solo parzialmente e lo studio delle differenze è importante per comprendere la natura delle comunicazioni nel sistema nervoso.
La parte interna della cellula (citoplasma) si può considerare come un conduttore ionico con una modesta resistività (Ri = circa 50-250 Ω•cm); alta, però, se comparata con quella di un conduttore metallico. Nei Metazoi il citoplasma è separato da un altro conduttore (il mezzo di immersione) di resistività leggermente inferiore (Rest = circa 50-100 Ω cm), per mezzo di un isolatore (la membrana cellulare) di resistività relativamente alta. La resistenza della membrana (Rm) è in genere di 103 Ω•cm2 circa o, per una membrana dello spessore di 100 Å (10-6 cm), l'isolatore ha una resistività di circa 109 Ω•cm. Quindi la membrana, e in particolare la sua regione centrale idrofobica, forma fra il conduttore esterno e quello interno un dielettrico dello spessore di 50-100 Å. La costante dielettrica relativa (D) è di circa 5 e la capacità Cm = 1,1 × 10-12 D/4πdμF/cm2, dove d è lo spessore del dielettrico e μF sta per microfarad. Cm è quindi pari a circa 0,5-1μ F/cm2. La membrana funziona dunque come la combinazione di una resistenza in parallelo con una capacità.
I primi elettrofisiologi avevano osservato che quando si applicava corrente a un nervo o a un muscolo questa non passava soltanto nella regione interpolare fra i due elettrodi ma anche nelle zone extrapolari ai lati di entrambi gli elettrodi (v. figg. 3-5). Questo effetto fu chiamato ‛elettrotono'. Hermann (v., 1879 e 1899) trovò che la struttura anatomica e fisiologica della fibra nervosa la portava ad assomigliare ai cavi elettrici, che stavano allora entrando in uso nella trasmissione telegrafica e telefonica. Egli interpretò l'elettrotono come dovuto alla presenza di un conduttore relativamente buono (il citoplasma) circondato da un cattivo conduttore (la superficie cellulare). Hermann confermò la teoria del ‛conduttore interno' riproducendo l'elettrotono con un modello fisico. In questo modo suggerì l'ipotesi che fossero le proprietà di cavo dell'assone a rendere possibile la progressione dell'impulso nervoso. La corrente generata da un impulso nella parte attiva diffonde in una regione ancora inattiva, eccitandola fino a generare un potenziale di azione. Quindi, una volta che l'impulso è insorto, la diffusione di corrente lungo il cavo (l'assone) ne provoca la propagazione. Hermann (v., 1899) paragonò la progressione di un impulso al propagarsi dell'esplosione in una serie di granuli di polvere da sparo. Proprio come il calore generato dall'esplosione di un granulo accende il granulo vicino, così la corrente generata da un impulso in un determinato punto diffonde e va a eccitare la zona successiva.
Un'analisi completa teorica e sperimentale delle proprietà di cavo è stata realizzata solo di recente da Hodgkin e Rushton (v., 1946) e da Davis e Lorente de Nò (v., 1947). Hodgkin e Rushton hanno usato l'assone isolato del gambero marino teso tra due mollette (v. fig. 3). Tramite un paio di elettrodi fissi (B e C) veniva applicata all'assone una corrente la cui variazione temporale d'intensità era a ‛onda quadra'. La variazione di potenziale, provocata dall'impulso lungo l'assone, veniva misurata da un elettrodo mobile (D) rispetto a un elettrodo fisso (A). La colonna a sinistra della fig. 4 mostra (in alto) la forma di un impulso di ampiezza e durata costanti, mentre le tracce più in basso mostrano la progressiva variazione del potenziale quando l'elettrodo D era allontanato dal contatto con B e avvicinato all'elettrodo A. Anche nel punto B il potenziale cresce e decresce lentamente se paragonato con l'aumento e la caduta della corrente stimolante. Non appena l'elettrodo è allontanato, l'ampiezza del potenziale decresce considerevolmente e crescita e caduta del potenziale sono rallentate. Dopo essersi propagato di 2,5 mm lungo l'assone, il potenziale è diminuito del 10-15% rispetto a quello registrato nel punto B.
L'ampiezza di questo potenziale elettrotonico è funzione sia della distanza di diffusione, sia del tempo nel quale viene misurato. Il grafico in alto nella fig. 4 mostra come il potenziale si abbassa allontanandosi (± X dal punto dell'elettrodo B nella fig. 3) in tempi successivi a partire dal momento in cui inizia il passaggio di corrente (per T che varia da 0,015 ms a infinito). Il grafico in basso mostra il progressivo rallentamento del decorso temporale e la riduzione in ampiezza dei potenziali a una serie di distanze (X = da O a 3,0 mm). Le unità di questi grafici verranno definite in seguito.
Il comportamento illustrato nella fig. 4 si può spiegare rappresentando l'assone come il circuito equivalente di un cavo (v. fig. 5) costituito da una rete a maglie di elementi con ‛parametri non distribuiti'. Questi rappresentano un conduttore interno (raffigurato come una serie di resistenze) e un isolatore a perdita (la membrana cellulare) composto da un insieme di elementi resistivi (Pm) ciascuno dei quali in parallelo con un condensatore (Cm). In questo circuito equivalente semplificato dell'assone-cavo, la resistenza del liquido esterno è trascurata. Una corrente intracellulare è applicata a un punto in modo da produrre un potenziale V0 e le frecce mostrano come la corrente si divida per scorrere radialmente attraverso la membrana e longitudinalmente lungo l'assone. A ciascun punto successivo degli elementi resistivo-capacitativi la corrente longitudinale sarà diminuita per effetto della corrente che fluisce radialmente, così che, aumentando la distanza dal punto in cui si è applicato V0, vi sarà diminuzione della corrente longitudinale e conseguentemente caduta della tensione ai capi della resistenza del conduttore interno. La caduta di Vm è rappresentata in funzione della distanza nel diagramma al centro della fig. 5.
Nel circuito equivalente della fig. 5 (in alto) ciascuno degli elementi delle serie di resistenze interne ha il valore di ri = Ri/πρ2, dove ρ dove ρ è il raggio della fibra ed Ri è espressa in Ω•cm. La membrana è rappresentata dagli elementi resistivi rm = Rm/2πρ posti in parallelo con la capacità Cm. Per ottenere una valutazione precisa si deve tener conto anche della resistenza del liquido esterno.
b) Perdite di cavo
Trascureremo in un primo tempo la capacità della membrana. Una corrente (ilong) si trasmetterà lungo il conduttore interno e a ogni punto x avremo:
Parte della corrente (im) correrà anche radialmente attraverso la membrana:
il potenziale V sarà quindi in ogni punto x:
Nelle condizioni limite, per cui V = O quando x = ∞ e V = V0 quando x = O, la soluzione è
Quindi, come si può vedere nel diagramma della fig. 5, la tensione decresce esponenzialmente nelle due direzioni a partire da x = O. Se il logaritmo di V è rappresentato in funzione di x, ne risulterà una relazione lineare, come è dimostrato per le misure sperimentali del grafico di sinistra nella fig. 5. Per x = √-r-m-/-ri il potenziale scenderà a 0,37 V0. Questa distanza è indipendente dal valore iniziale di V0 ed è una lunghezza caratteristica dell'assone (costante di lunghezza ovvero costante di spazio λ). Se i dati per Vm in funzione di x vengono messi in diagramma esprimendo x in unità di λ : Χ = x/l la caduta dell'elettrotono dovrebbe essere indipendente dalle dimensioni fisiche dell'assone. Questo si dimostra vero nel grafico in basso a destra della fig. 5, dove i dati ricavati da molti assoni sono rappresentati con Vm espresso in unità relative e l'ascissa è normalizzata in termini di λ per ogni assone.
Queste relazioni risultano sufficientemente valide per il circuito equivalente di un cavo semplificato. Bisogna notare che λ = √-R-m-p-/-2-R-i. Quindi per un identico valore di Rm ed Ri, λ varierà in ragione della radice quadrata del raggio della fibra. Inoltre, la resistenza dell'isolatore (rm) diminuisce in seguito a un aumento dell'area della membrana in esame, mentre la resistenza interna (ri) aumenta per un incremento di lunghezza del tratto esaminato. Pertanto λ corrisponde approssimativamente alla lunghezza di una fibra per la quale rm = ri.
Si deve anche considerare la corrente che passa attraverso la capacità della membrana. Questa sarà massima inizialmente, quando la capacità si carica in risposta a un gradino della tensione, e cadrà a zero quando la capacità si è caricata a V. Quindi la tensione aumenta lentamente in ogni punto x a seconda del tempo richiesto per caricare il condensatore, la cui capacità è determinata da τ = TmCm. Ci limiteremo qui a dare solo un breve riassunto del lavoro di Hodgkin e Rushton (v., 1946) e di Davis e Lorente de Nò (v., 1947).
La corrente di membrana (im) ha due componenti, l'una resistiva (ir) e l'altra capacitativa (ic):
La soluzione di questa relazione si può semplificare se il tempo reale (t) e la distanza (x) sono normalizzati in termini di ‛unità analitiche' T = t/τ e X = x/λ. Allora per una distanza e un tempo qualsiasi:
Soluzioni esplicite di questa equazione comportano l'impiego di funzioni di errore e verranno qui tralasciate. Tuttavia, il successo della soluzione formulata da Hodgkin e Rushton (v., 1946) è dimostrato dalla coincidenza dei dati ottenuti sperimentalmente con quelli ricavabili dalle curve calcolate delle figg. 4 e 5. Particolarmente degno di nota è il fatto che quando un segnale dato in un punto dell'assone si propaga attraverso questo cavo elettrico, il suo livello stazionario scende circa al 10% di V0 a 2λ e a meno del 2% a 4λ. Esso diventa così lento e piccolo che si perde facilmente nel ‛rumore di fondo' del sistema di misura.
c) Caratteristiche elettriche del circuito equivalente.
La resistenza specifica della membrana, Rm, si può ricavare dalla misura della resistenza effettiva (Re11) della cellula, cioè dalla resistenza dell'intera rete della fig. 5, misurata all'ingresso dell'impulso esplorante. Per una cellula sferica la relazione è semplicemente Reff = V/l, dove I è la corrente applicata e V il potenziale finale; quindi Rm = πd2 Reff, dove d è il diametro della cellula. Per un cavo cilindrico il valore stazionario del potenziale V è 1/2 Iλexp-x/λ, dove, come già detto, λ = √-r-m-/-r-i. Per x = 0, Reff Q Reff = 1/2 √-r-m-/-r-i. Quindi sia rm sia ri si possono calcolare da misure di Reff e λ e possono a loro volta essere convertiti in Rm e Ri.
La capacità (Cm) della membrana si calcola generalmente partendo da misure della costante di tempo τ secondo la relazione τ = RmCm, osservando l'ascesa del potenziale di membrana quando inizia il passaggio di corrente, o la sua caduta quando la corrente cessa (v. fig. 4). Per molte cellule il valore di Cm oscilla all'incirca fra 0,5 e 1,0 μF/cm2, benché siano stati osservati anche valori molto più alti. La capacità dipende dallo spessore della fase lipidica del doppio strato e dalla sua costante dielettrica. Lo spessore della membrana oscilla probabilmente fra 50 e 100 Å e si pensa che la costante dielettrica vari fra 4 e 8. Quindi l'ambito di variabilità di Cm per cellule diverse sarebbe di circa 4. Di conseguenza valori di Cm superiori di circa 2μF/cm2 necessitano di controlli e interpretazioni particolarmente accurati. Per esempio, la membrana dei neuroni di Helix ha una capacità apparente di circa 25μF/cm2 (v. Gola e Romey, 1971). Tuttavia la superficie della membrana cellulare è molto irregolare e una correzione opportuna consiste nel considerare una superficie più estesa che aumenta il valore di Rm Prendendo in considerazione tale correzione si è visto che la capacità della membrana del neurone è di circa 2μF/cm2. L'apparente capacità di membrana delle elettroplacche di gimnoto è di circa 50μF/cm2 (v. Nakamura e altri, 1965; v. Morlock e altri, 1968), ma la superficie reale è molte volte maggiore di una superficie piana, a causa delle numerose protuberanze e invaginazioni che la membrana ha in corrispondenza della sua innervazione da parte degli assoni dei neuroni elettromotori (v. Mathewson e altri, 1961). La capacità di una membrana eccitabile rimane fondamentalmente costante in condizioni sperimentali che modificano altre proprietà della cellula. Questo conferma la conclusione che la capacità della membrana è funzione soltanto delle dimensioni e della costante dielettrica del componente lipidico.
Ri è dell'ordine di 100 Ω•cm e subisce variazioni relativamente piccole per i differenti tipi di cellule (5 volte circa). Rm dimostra tuttavia una notevole variabilità non soltanto fra differenti tipi di cellule, ma anche fra cellula e cellula nell'ambito dello stesso tipo di preparato. Per esempio, Hodgkin e Rushton (v., 1946) hanno calcolato che Ri, in un assone di granchio, variava da 40 a 80 Ω cm (60 Ω cm su una media 10 assoni), mentre invece Rm poteva essere compresa tra 500 e 7.000 (in media 2.300) Ω•cm2. La costante di tempo τ era compresa tra 0,75 e 5 ms (in media 2,3 ms), mentre invece λ era compresa tra 0,8 e 3 mm (in media 1,6 mm). Alcune di queste differenze si possono attribuire a danneggiamenti del preparato sperimentale. Il danno può divenire particolarmente significativo quando si effettuano le misurazioni con microelettrodi che penetrano all'interno della cellula.
In altre cellule la resistenza della membrana può essere molto maggiore, per es. di oltre 100 k Ω cm2 nelle elettroplacche di Gymnarchus (v. Bennett e Grundfest, 1965) e di circa 1,0 MΩ•cm2 nei neuroni di Anisodoris (v. Gorman e Mirolli, 1972), o molto più bassa, per es. di 5 II.cm2 nelle elettroplacche di gimnoto (v. Nakamura e altri, 1965; v. Morlock e altri, 1968; v. Ruiz-Manresa e altri, 1970) e di 10- 20 Ω•cm2 nella membrana nodale degli assoni di rana (v. Stämpfli, 1952; v. Tasaki, 1953 e 1959). Una differenza molto marcata si riscontra nelle fibre muscolari di rana (v. Stefani e Steinbach, 1969). La resistenza di membrana delle fibre scheletriche ‛rapide' è di circa 5.000 Ω•cm2 e la costante di tempo è di circa 20 ms. La resistenza di membrana delle fibre muscolari ‛lente' è moltò più alta (circa 100 kΩ•cm2) e la costante di tempo è corrispondentemente maggiore (circa 350 ms), poiché la capacità delle due membrane è pressoché la stessa (circa 4 μF/cm2). Come si è notato precedentemente, il calcolo della Rm si basa su un valore approssimativo della superficie ed è quindi soggetto a errori anche considerevoli.
d) Assone e cavo: un paragone
La presente discussione dimostra che la cellula, e in special modo l'assone, non è un conduttore di elettricità sufficientemente buono da funzionare esattamente come un cavo elettrico passivo nella propagazione di un segnale. La resistenza interna di un assone è molto più alta (di circa 8 ordini di grandezza) di quella di un filo di rame di diametro eguale. Come isolante la membrana è più scadente di 6 o più ordini di grandezza rispetto a materiali artificiali. Anche lo spessore della membrana è molto inferiore a quello di un isolatore elettrico. Perciò, mentre λ può essere di circa 7 mm nell'assone di calamaro che ha 1 mm di diametro, è di circa 4 × 103 km (cioè di circa 9 ordini di grandezza maggiore) in un filo di rame di 1 mm di diametro.
Sotto un altro aspetto, tuttavia, per la propagazione di un segnale elettrico, le caratteristiche elettriche di un assone sono più adatte di quelle di un cavo metallico. Mentre la diminuzione spaziale del segnale è molto più piccola nel cavo, la distorsione temporale nella salita e nella caduta del segnale è molto più grande. Sebbene la capacità sia piccola (per es. circa 25 pF/cm2 quando la costante dielettrica è 2 e lo spessore dell'isolatore è di circa 0,1 mm), la resistenza dell'isolatore è molto più alta: circa 1014 Ω cm2. Allora la costante di tempo (τ = Rx Cx) è di circa 250 s. Anche un segnale in codice Morse, impresso manualmente, viene malamente distorto e la distorsione è ancora peggiore per frequenze più alte, come quelle usate in telefonia.
Questa difficoltà è stata superata con l'avvento degli amplificatori elettronici. Il cavo viene interrotto per inserirvi un amplificatore ripetitore che ripristina (rimodella) il segnale originale. La trasmissione a lunga distanza richiede una serie di questi amplificatori ripetitori. Lo stesso principio opera anche negli assoni e nelle fibre muscolari conduttrici (generatrici di potenziali di azione), ma l'amplificazione è necessaria in primo luogo per correggere la perdita in ampiezza dovuta al decremento spaziale. Inutile dire che il processo di amplificazione è portato a termine in un modo specificamente biologico, secondo i mezzi a disposizione della cellula.
3. Il potenziale di azione assonico
a) Generatori bioelettrici
L'analogia fra un cavo per comunicazioni su lunga distanza e un assone può essere ancora estesa. In entrambi i casi esistono una sorgente di corrente elettrica, un dispositivo per dare avvio al segnale e uno strumento o alcuni strumenti per ovviare alle distorsioni introdotte dalle caratteristiche del cavo. La pratica ingegneristica ha adottato per quest'ultimo problema la stessa soluzione generale dello sviluppo evolutivo. In entrambi i casi sono utilizzati strumenti che hanno la funzione di amplificare e dare forma agli impulsi, in modo che il messaggio si propaghi senza il grave decremento e/o la perdita di comprensibilità che si potrebbe altrimenti verificare.
La soluzione biologica, tuttavia, utilizza un meccanismo molto differente rispetto a quello impiegato nella tecnologia elettronica, in rapporto alle limitate disponibilità che una cellula vivente ha di generare una corrente elettrica (v. elettrofisiologia). La cellula trae vantaggio dal fatto di essere in sostanza un ‛doppio sistema di Donnan' con un potenziale di riposo interno-negativo e con forze elettromotrici (fem) latenti interno-positive, dovute alle batterie ioniche dell'Na+ e dei cationi bivalenti. L'altra caratteristica utilizzata dalla cellula è la capacità della membrana di rispondere a uno stimolo elettrico depolarizzante, per cui la conduttanza della batteria (o batterie) interno-positiva è aumentata e i contributi delle loro fem diventano significativi.
b) La risposta rigenerativa
L'aumentata conduttanza per l'Na+ e/o il Ca2+ (o altri cationi con una fem interno-positiva) si risolve in una caratteristica deviazione negativa, con transizione rigenerativa, dal potenziale di riposo interno-negativo a un potenziale meno negativo all'interno o, più comunemente, a un potenziale interno positivo (capovolgimento) (v. elettrofisiologia). Quindi, una depolarizzazione di avvio relativamente piccola nella zona di un potenziale generatore o di un potenziale postsinaptico eccitatorio (PPSE), o una depolarizzazione indotta per applicazione di corrente, porta a uno spostamento che rovescia il potenziale di riposo in quello, positivo all'interno, di azione.
c) Soglia di eccitamento
La depolarizzazione necessaria per provocare (scatenare) il processo rigenerativo (‛soglia', o livello ‛critico' di scarica) è generalmente piccola in rapporto al picco del potenziale di azione stesso (circa 5-20 mV contro circa 80-120 mV). In questo senso, dunque, l'atto di generare un potenziale di azione implica un'amplificazione. Il livello critico di scarica è raggiunto quando la conduttanza dell'Na+(GNa) e/o di altri ioni, che formano le batterie ioniche interno-positive, aumenta fino a essere capace di provocare una corrente netta diretta verso l'interno. Dopo di ciò, la corrente diretta verso l'interno continua ad aumentare, raggiunge un massimo e decresce man mano che il potenziale di membrana si avvicina alla fem della batteria che fornisce la corrente. In questo ambito INa = ÀNa (EM − ENa), dove ÀNa è la conduttanza quando l'attivazione dell'N+a è completa (v. Hodgkin e Huxley, 1952; v. Hodgkin, 1964). INa è diretta verso l'interno fino a quando EM si avvicina o eguaglia ENa, allorché la corrente attraverso la membrana si avvicina allo zero. In teoria la membrana può rimanere indefinitamente al livello o nelle vicinanze della fem del generatore interno-positivo. In realtà si producono dei potenziali di azione prolungati (v. Grundfest, Excitation by..., 1961; v. Grundfest, Comparative electrobiology..., 1966). D'altra parte, altri processi, come un'inattivazione dell'Na+ e un'attivazione del K+, cambiamenti nella situazione ionica della membrana e probabilmente anche variazioni metaboliche tendono per solito a bloccare l'elettrogenesi del potenziale di azione. Il risultato è un impulso di ampiezza relativamente fissa, con forma e durata caratteristiche per ogni tipo di assone. In tutti i casi il potenziale di azione, una volta partito, è una risposta ‛autogena' che si mantiene da sola, poiché la corrente necessaria per generarla è fornita da una o più batterie della cellula stessa.
d) La risposta graduata locale
Prima che la depolarizzazione abbia raggiunto il livello critico di scarica caratteristico di una data cellula, la membrana genera un incremento graduale di depolarizzazione (v. fig. 6), che rappresenta la risposta graduata locale (v. Hodgkin, 1938). Quando la risposta graduata riesce a svilupparsi in un potenziale di azione (v. fig. 7), l'elettrogenesi si rende indipendente dallo stimolo iniziale, venendo così a dipendere solo dalle possibilità che il suo generatore, la batteria ionica, ha di fornire la fem e la corrente. Questa è la proprietà del ‛tutto o nulla' del generatore d'impulsi. Tale proprietà è chiaramente differente dalla capacità di rispondere in modo graduale propria dell'elettrogenesi elettricamente non eccitabile.
Una volta che il potenziale di azione è sorto nel punto di stimolazione, esso stesso può fungere da innesco elettrico; la corrente scorre allora verso le regioni vicine del conduttore assonico non ancora eccitato, provocandovi altri potenziali di azione. Quindi la capacità di generare potenziali di azione tutto o nulla in qualsiasi punto dell'assone fa sì che una volta iniziato l'impulso in una regione di entrata, il messaggio si propaghi senza subire diminuzioni (cioè senza perdita d'informazione) fino all'uscita della cellula stessa. È tuttavia evidente che il potenziale d'azione tutto o nulla è un ‛bit digitale', con conseguenti limitazioni del contenuto d'informazione distribuito all'uscita. In questo senso la generazione di un potenziale di azione è analoga alla formazione di impulsi digitali nei calcolatori.
e) Latenza di scarica
Quando la corrente applicata per caricare la capacità della membrana, e per portare quindi il suo potenziale al livello critico di scarica, è bassa, può esserci un periodo di latenza considerevolmente lungo, prima che si stabilisca l'elettrogenesi da potenziale di azione (v. fig. 7). È degno di nota il fatto che la latenza aumenta con la temperatura, mentre il decorso temporale della diminuzione della corrente capacitativa, e di conseguenza anche il suo aumento, sono essenzialmente indipendenti dalla temperatura. Per le registrazioni della fig. 7 lo stimolo era costituito da una corrente della durata di circa 10μs. In seguito a correnti dirette verso l'interno (iperpolarizzanti) d'intensità crescente, i potenziali di membrana a cui era caricata la capacità venivano dissipati sulla resistenza della membrana a riposo con un decorso temporale esponenziale. Per correnti dirette verso l'esterno (depolarizzanti), invece, la membrana rimaneva depolarizzata e, per una corrente liminare, la depolarizzazione cresceva a ritmo accelerato fino ad arrivare a un potenziale di azione. La fase iniziale, prima che il livello critico di scarica sia raggiunto, costituisce la risposta locale o subliminare (v. Hodgkin, 1938), che rappresenta lo spostamento della curva corrente-tensione (v. elettrofisiologia, figg. 14 e 16) verso un valore, a livello del quale una piccola corrente diretta all'interno e risultante dall'attivazione dell'Na+ contrasta e supera la corrente diretta verso l'esterno indotta dalla depolarizzazione. Dal momento in cui la corrente di stimolazione e l'attivazione dell'Na+ vengono aumentate, il livello critico di scarica può essere raggiunto più precocemente. Quando la corrente stimolante è aumentata abbastanza per caricare velocemente la capacità della membrana fino e oltre il livello critico di scarica, la latenza del potenziale di azione tende a diventare brevissima.
f) Relazione intensità-durata
I dati della fig. 7 sono stati ottenuti usando stimoli molto brevi, di durata costante e d'intensità crescente. Nella fig. 8 sono illustrati gli effetti ottenuti variando sia la durata sia l'intensità. I risultati presenti nella parte superiore della fig. 8 rendono ben evidente che per una corrente ‛di soglia', oltre che la carica indotta nella capacità dalla corrente depolarizzante, anche la depolarizzazione prodotta dalla risposta subliminare locale contribuisce a dare avvio al potenziale di azione. In effetti, la risposta locale può impiegare un tempo molto più lungo di quello richiesto, per caricare la capacità a opera della corrente applicata. Perciò in un intervallo ristretto di corrente applicata la soglia è indeterminata. Al più basso livello di soglia la corrente applicata deve essere d'intensità sufficiente per provocare una depolarizzazione subliminare locale che si sommi alla carica inadeguata della capacità di membrana. Al livello di soglia più alto, la corrente è abbastanza forte da caricare la capacità fino al livello critico di scarica e la risposta locale contribuisce poco o nulla al raggiungimento della soglia (v. Bennett e altri, 1970).
Le curve in basso nella fig. 8 illustrano la variazione del potenziale di membrana per stimoli d'intensità crescente e di durata costante. Per correnti della durata da 0,5 a 2 ms l'aumento del potenziale era pressoché lineare, indicando che la carica della capacità è la causa più importante della depolarizzazione, che deve raggiungere circa 13 mV per provocare un potenziale di azione (cerchi grandi, linea sottile). D'altra parte, quando lo stimolo aveva una durata di 4 ms la depolarizzazione aumentava più rapidamente, indicando che per stimoli di questa durata sia la risposta subliminare sia la carica della capacità sono implicate nella genesi del potenziale di azione. Quando invece la corrente durava 10 ms, il potenziale di membrana tendeva ad aumentare in modo progressivamente decrescente con l'aumentare della corrente. Quindi una corrente di poco inferiore a 10-5 A/cm2 era insufficiente, anche se prolungata per 10 ms, mentre una corrente di poco superiore generava un potenziale di azione se applicata per 4 ms.
Quando la corrente di stimolazione è molto breve non c'è abbastanza tempo perché avvengano le variazioni nelle proprietà della membrana elettricamente eccitabile. Quindi nell'eccitazione il fattore più importante è il tempo utile per caricare la capacità di membrana fino al valore di soglia. Quando la corrente è intensa e breve, la carica nella capacità di membrana è Q = It Cm Vsoglia ed è quasi costante. D'altra parte, quando si diminuisce la corrente ma si aumenta la durata (v. fig. 8), anche la carica della capacità aumenta. Espressa in valori di 10-9 coulomb/cm2 essa era di 17,5 per un impulso di 0,5 ms, 20 per 1 ms, 28 per 2 ms e 36 per 4 ms.
La relazione intensità-durata è riportata nel grafico di mezzo della fig. 8. Essa ha approssimativamente la forma di un'iperbole rettangolare; la sua caratteristica più evidente è il limite inferiore della corrente efficace. Una corrente di poco inferiore a 10-5 A/cm2 era inefficace per quanto la si prolungasse. Il limite efficace più basso è chiamato ‛reobase' (v. Lapicque, 1926). Come si è già visto nel grafico in basso, questo avviene perché l'effetto eccitatorio che carica la capacità viene disperso da fattori accomunati sotto il termine di ‛accomodazione'. Fra questi i più importanti sono l'effetto ripolarizzante dell'attivazione del K+ e l'inizio dell'inattivazione dell'Na+, poiché ambedue riducono la risposta subliminare che contribuisce all'eccitazione dell'assone per mezzo di deboli stimoli. Alle variabili fisiologiche che partecipano alla cinetica delle variazioni di conduttanza precedentemente descritte va aggiunta una molteplicità di condizioni che determina la distribuzione della corrente applicata e le modalità della sua applicazione ai tessuti (v. Grundfest, 1932). Lo stesso Lapicque introdusse il parametro ‛cronassia' che definisce la scala temporale della relazione intensità-durata. La cronassia è la durata minima efficace di uno stimolo la cui intensità è il doppio della reobase. Benché la relazione intensità-durata appaia come una semplice iperbole rettangolare, per la maggioranza dei tessuti eccitabili gli eventi alla base delle risposte liminari si sono dimostrati troppo complessi per poter essere formulati soddisfacentemente in modo matematico (v. Noble e Stein, 1966). D'altronde la cronassimetria si è dimostrata molto utile nella diagnostica delle deficienze della trasmissione neuromuscolare e in particolare per quelle dovute a lesioni del nervo (v. Grundfest e altri, 1956).
g) Forma e durata del potenziale di azione
In un dato tipo di assone la forma e la durata del potenziale di azione sono notevolmente costanti in determinate condizioni ioniche e di temperatura. Questo implica che i processi ionici che generano i potenziali di azione sono piuttosto stereotipati. La fase crescente del potenziale di azione sarà determinata dalla rapidità con cui si sviluppa la corrente dell'Na+ verso l'interno e dal valore istantaneo di GNa, come anche dalla forza portante ENa (v. Hodgkin e Huxley, 1952). L'ampiezza del potenziale di azione dipende in primo luogo dalla fem della batteria all'Na+ e dalla conduttanza massima della membrana rispetto all'Na+. Essa dipenderà, inoltre, dalla rapidità con la quale si sviluppa l'inattivazione dell'Na+ e l'attivazione del K+. La fase di caduta è determinata sia dalla cinetica di GK sia dal grado d'inattivazione dell'Na+.
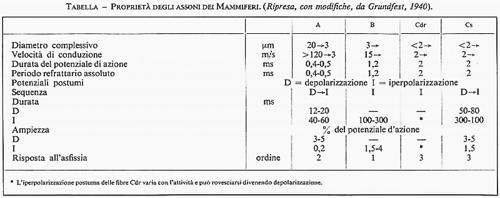
Poiché il rapporto [Na+est]/[Na+int] è in molti casi circa 10, ENa è approssimativamente 58 mV interno-positivo e i potenziali di azione degli assoni e dei neuroni sorpassano il livello O del potenziale di membrana da pochi mV fino a più di 50 mV (v. fig. 9). La durata oscilla da 0,5 ms a 1 s o più. I potenziali di azione terminano spesso con un ‛potenziale postumo'. Questo era già stato notato in rapporto con l'iperpolarizzazione postuma dell'assone di calamaro (v. figg. 7 e 8), dovuta all'aumento persistente della conduttanza del K+ che porta il potenziale di membrana più vicino all'EK di quanto non lo sia a riposo (v. elettrofisiologia, fig. 15). Altri assoni presentano depolarizzazione postuma (v. fig. 9) o addirittura nessun potenziale tardivo. Nei Mammiferi si distinguono quattro diverse specie di assoni, tre delle quali sono presentate nella fig. 10. La fibra A mielinica e di grosso calibro presenta una sequenza di depolarizzazione postuma (‛potenziale postumo negativo', secondo la convenzione della registrazione extracellulare) della durata di circa 15 ms (v. tabella), seguita da iperpolarizzazione postuma (‛potenziale postumo positivo') che si protrae per circa 70 ms (v. Gasser e Grundfest, 1936).
Le fibre mieliniche B di minor calibro presentano solo un'iperpolarizzazione postuma di lunga durata (v. Grundfest, 1939). Le fibre C amieliniche presentano due tipi di potenziale di azione. Le fibre C sensoriali afferenti (radici dorsali, Cdr) hanno solamente un' iperpolarizzazione postuma della durata di molte centinaia di ms (v. Gasser, 1950), mentre le fibre C efferenti autonome (Cs) hanno una depolarizzazione postuma iniziale seguita da un'iperpolarizzazione postuma di lunga durata (v. Grundfest e Gasser, 1938). I potenziali postumi sono caratteristici dei differenti tipi di fibre, ma le basi ioniche della loro elettrogenesi non sono ancora del tutto note. L'iperpolarizzazione postuma delle fibre C e forse anche delle fibre B è probabilmente dovuta all'elettrogenesi della pompa dell'Na+ (v. Rang e Ritchie, 1968). La depolarizzazione postuma dell'assone gigante mediale del gambero è stata analizzata di recente (v. Yamagishi e Grundfest, 1971). Oltre all'attivazione dell'Na+, che provoca il potenziale di azione, si verifica anche un aumento più piccolo della conduttanza per il Ca2+ la cui durata è maggiore di quella per l'Na+. Quindi la depolarizzazione postuma nell'assone è dovuta a un contributo di corrente dell'Eca interno-positivo, che persiste quando già la corrente dell'Na+ verso l'interno è cessata per l'inattivazione dell'Na+.
Abbassando la temperatura si rallentano le velocità a cui avvengono le variazioni della conduttanza (v. Hodgkin e Huxley, 1952; v. Hodgkin e altri, 1952) e tutti gli effetti collaterali a questa associati si modificano proporzionalmente (v. fig. 7; v. Guttman, 1971). Le costanti temporali di tutti e tre i processi (attivazione dell'Na+ e del K+, inattivazione dell'Na+) hanno approssimativamente gli stessi coefficienti di temperatura (Q10), compresi fra 2 e 3. Il valore stazionario della conduttanza varia relativamente poco (Q10 = da 1,3 a 1,5), la capacità della membrana e la resistenza dell'assoplasma subiscono solo piccole variazioni percentuali / °C Quindi gli effetti di maggior rilievo interessano la durata del potenziale di azione (fig. 7) e in minor misura l'eccitabilità. Gli effetti sulla velocità di conduzione verranno descritti più avanti.
4. Conduzione dell'impulso
a) Fattore di sicurezza per la propagazione
Poichè i potenziali di azione hanno un'ampiezza dell'ordine di 100 mV, mentre la soglia per dare origine al potenziale d'azione è generalmente di 10 o 20 mV, è chiaro che il potenziale di azione è uno stimolo sopramassimale per le regioni confinanti. Questo significa non solo che la latenza per iniziare un altro potenziale d'azione è ridotta (v. figg. 6-8), ma altresì che il potenziale che si propaga elettrotonicamente lungo il cavo assonico può ‛saltare' al di là di una regione che non risponda. Uno o più nodi di una fibra mielinica possono essere inattivati con agenti diversi senza alterare la conduzione (v. Tasaki, 1953). Quindi la differenza, relativamente grande, fra Esoglia ed ENa costituisce un ‛fattore di sicurezza' considerevole per il mantenimento della capacità di conduzione dell'assone.
b) Propagazione ortodromica e antidromica
Una volta che un potenziale di azione è partito, di solito in una regione strategica e particolarmente sensibile dell'assone (v. figg. 2 e 11), tale elettrogenesi è abbastanza grande da superare le differenze regionali di soglia. Un potenziale di azione può diffondersi non solo dal punto di partenza in avanti in direzione ‛ortodromica', ma anche all'indietro (‛antidromicamente'), se questa regione non è stata precedentemente invasa diventando di conseguenza refrattaria. Quindi l'invasione del soma del recettore da stiramento del gambero avviene antidromicamente (v. fig. 11 B-E), mentre il potenziale di azione si propaga anche ortodromicamente (da B ad A). In molti neuroni, d'altra parte, il soma non genera potenziali di azione; esso funge solo da punto per la sommazione di messaggi sinaptici o sensoriali. Non è d'altra parte improbabile che l'invasione antidromica del corpo cellulare e dei dendriti da parte dei meccanismi di elettrogenesi responsabili dei potenziali di azione possa avere effetti importanti alterando le condizioni elettrochimiche della membrana cellulare e/o alterando la sua permeabilità, o anche influendo su altre attività cellulari.
c) Velocità di conduzione
Una volta partito, l'impulso nervoso si propaga con una velocità finita che oscilla da oltre 100 m/s negli assoni a conduzione più rapida degli animali omeotermi, fino a forse pochi mm/s nelle fibre di più lenta conduzione. La velocità è determinata, in parte, dalle proprietà di cavo che condizionano la propagazione passiva dell'impulso (v. figg. 4 e 5) e, in parte, dalle caratteristiche fisiologiche della fibra, quali il livello critico di scarica (v. figg. 6-8) e l'ampiezza del potenziale di azione, che sono entrambi funzione dei processi ionici implicati nell'elettrogenesi.
La velocità di conduzione, negli assoni amielinici degli Invertebrati (v. Hodgkin, 1954), varia approssimativamente con la radice quadrata del diametro, come è previsto dalla teoria di cavo (v. Offner e altri, 1940; v. Rosenblueth e altri, 1948). Quindi, perché la velocità di conduzione aumenti di venti volte, il diametro dell'assone deve aumentare di circa 400 volte. L'assone gigante di gambero (circa 150 μm), che conduce a una velocità di circa 12 m/s, e gli assoni giganti di calamaro (circa 500 μm), che conducono a circa 20 m/s, si sono sviluppati particolarmente dove era necessaria una risposta molto rapida. La reazione di fuga di un calamaro richiede la rapida e quasi simultanea contrazione della muscolatura mantellare, in modo da espellere un getto d'acqua dalla cavità del corpo. Quindi gli assoni giganti, i cui diametri misurano da poche centinaia di μm fino a 1 o 2 mm, sono adattamenti specializzati per queste necessità funzionali. Gli assoni giganti, del diametro da 50 μm fino a varie centinaia di μm, si trovano in molti Invertebrati, inclusi i Vermi (v. Stough, 1926; v. Kao e Grundfest, 1957) e gli Artropodi (v. Johnson, 1924; v. Watanabe e Grundfest, 1961). Sono presenti anche nel pesce ‛volante' (Gasteropelecus), che deve eseguire rapidi movimenti muscolari (v. i contributi di Auerbach e Bennett, 1969).
d) Conduzione saltatoria
La velocità di conduzione è aumentata anche senza l'impiego di assoni giganti, grazie a un altro tipo di adattamento che si ritrova nei Vertebrati: la mielinizzazione segmentale degli assoni per mezzo delle cellule di Schwann. La mielina agisce come un isolatore ad alta resistenza e bassa capacità, riducendo grandemente il flusso trasversale di corrente diretto verso l'esterno della membrana cellulare. Poiché le cellule di Schwann contigue non si embricano l'una sull'altra, la mielina è interrotta a livello della linea di separazione fra due cellule, esponendo l'assone in corrispondenza del nodo di Ranvier. La corrente generata dal potenziale d'azione esce attraverso la membrana esposta del nodo, come nel caso degli assoni amielinici, ma poiché non vi sono continue perdite di corrente lungo il segmento mielinico, vi sarà un maggior flusso di corrente al nodo. La progressione dell'impulso nervoso avverrà quindi di nodo in nodo (v. fig. 12) ovvero saltatoriamente, evitando elettrotonicamente i segmenti internodali. Studiando l'analogo elettrochimico del nervo, il modello posto in stato passivo costituito da filo metallico isolato con una serie di manicotti di vetro, R. S. Lillie (v., 1925) predisse che la conduzione saltatoria avviene più rapidamente che non quella per eccitazione ininterrotta di un punto dopo l'altro. Un assone di rana, con un diametro complessivo di circa 16 μm o con un diametro assoplasmatico di circa 10 μm, conduce a una velocità di 20-25 m/s (20 °C), vale a dire pressappoco alla stessa velocità di conduzione di un assone gigante di calamaro di 0,5 mm. In sostanza, la conduzione saltatoria accelera la velocità di conduzione dell'impulso, riducendo il numero delle latenze e mantenendo la corrente di azione a un livello tale per cui questa può eccitare per diffusione elettrotonica a distanza considerevole rispetto al punto in cui nasce il potenziale di azione.
La conduzione saltatoria negli assoni, indicata per la prima volta da Erlanger e Blair (v., 1934), fu stabilita dagli studi di Tasaki e dei suoi collaboratori (v. Tasaki, 1953 e 1959) e confermata da Huxley e Stämpfli (v., 1949). La velocità di conduzione delle fibre mieliniche è approssimativamente funzione lineare del diametro (v. Hursh, 1939; v. figg. 17 e 18) e non della sua radice quadrata come negli assoni amielinici. Ma per questa differenza si hanno finora solo soluzioni approssimative (v. Rushton, 1951).
Un importante esempio di conduzione saltatoria che comporta una diffusione elettrotonica a lunga distanza si trova nel gamberetto del genere Penaeus (v. Kusano, 1966; v. Kusano e La Vail, 1971). Il cosiddetto assone ‛gigante' di questo gambero misura solo 10 μm di diametro, ma gli impulsi vi vengono condotti alla velocità di 100-200 m/s. L'assone giace in un tubo di circa 120 μm di diametro, composto da una guaina mielinica dello spessore di 10μm. Il tubo è attraversato da rami dell'assone a intervalli di 8-15 mm. L'eccitazione dovuta alla corrente di azione che fluisce verso l'esterno avviene presumibilmente in questi punti, dove la resistenza è relativamente bassa.
Una conseguenza interessante della conduzione saltatoria è che la velocità di conduzione è influenzata molto poco dal raffreddamento del segmento internodale, mentre raffreddando l'intera fibra la velocità subisce un rallentamento con un Q10 di circa 2 (v. Hodler e altri, 1952). Il rallentamento della velocità è dovuto al prolungarsi del tempo necessario a sviluppare l'attivazione dell'Na+, che ha un Q10 di circa 3 (v. Hodgkin e Huxley, 1952). Quindi, in qualsiasi punto dove si origini un potenziale di azione, la latenza si prolunga raffreddando la fibra. Poiché a temperature più basse l'inattivazione dell'Na+ e l'attivazione del K+ sono anch'esse rallentate, l'effetto della temperatura si nota particolarmente quando quello della risposta subliminare sulla soglia è più grande (v. figg. 7 e 8). La velocità di conduzione è maggiore nei Mammiferi e negli Uccelli che non nei pecilotermi a causa delle differenze di temperatura. Mentre nella rana a 20 °C una fibra di 16 μm conduce alla velocità di 20-25 m/s, nei Mammiferi a 37 °C la velocità è di circa 80- 100 m/s.
5. Varietà di assoni
a) Morfologia
I vari organelli intracellulari non contribuiscono direttamente alle funzioni elettrofisiologiche dell'assone. Tutto o gran parte dell'assoplasma può essere asportato senza che questo influenzi il meccanismo di generazione degli impulsi, meccanismo che risiede nella membrana (v. Oikawa e altri, 1961; v. Baker e altri, 1962). Gli organelli sono d'altro canto essenziali per la sintesi e il trasporto di materiali, compresi gli agenti trasmettitori che vengono liberati all'uscita, così come le sostanze necessarie alla conservazione dell'integrità della membrana cellulare.
La membrana cellulare non è direttamente in contatto con il mezzo ambiente, ma è ricoperta da vari tipi di tessuto connettivo. ‛Assoni amielinici' sono presenti in Invertebrati e costituiscono le fibre C dei Vertebrati. Negli Invertebrati il rivestimento può essere costituito da vari strati relativamente lassi (v. fig. 13). Nei Vertebrati (v. fig. 14 C) un gruppo di fibre è avvolto da una cellula di Schwann che, d'altra parte, non ingloba completamente gli assoni. In ambedue i casi esistono canali di uscita per mezzo dei quali la corrente generatasi durante il potenziale di azione può diffondere nel mezzo esterno. Per quanto riguarda gli assoni ‛mielinici' dei Vertebrati, esiste una situazione molto differente. Una cellula di Schwann circonda ogni singolo assone e, avvolgendosi attorno a esso, forma una spirale continua che lo inguaina (v. fig. 14A) per una lunghezza di circa 1-2 mm. Il citoplasma della cellula di Schwann si riassorbe, così che la membrana cellulare collabisce verso l'interno. Gli strati successivi della membrana collabita formano un anello continuo a spirale con gli strati formati dalle due superfici interne della membrana, distinguibili nella diffrazione a raggi X e nelle microfotografie al microscopio elettronico dagli strati interposti formati dalle due superfici esterne della membrana (v. fig. 14B). La parte lipidica della membrana, che si trova fra gli anelli della spirale che appaiono concentrici, determina un alto grado d'isolamento. Tuttavia la regione dove una cellula di Schwann termina e un'altra inizia (nodo di Ranvier) è priva di guaina mielinica e in corrispondenza di ciascun nodo la corrente può uscire dall'assone nel mezzo esterno attraverso la membrana cellulare. La distanza fra due nodi di Ranvier varia considerevolmente, entro i limiti di 0,75-2 mm. Si osserva una correlazione fra diametro dell'assone e mielinizzazione. Fibre che alla fine cresceranno fino a diametri superiori a 1-2 μm iniziano a essere mielinizzate, mentre i diametri delle fibre amieliniche dei Vertebrati non superano i 2μm. Come regola generale, l'area di sezione trasversa formata dall'anello di mielina è approssimativamente uguale all'area di sezione dell'assoplasma che essa avvolge.
b) Assoni dei Mammiferi
Gli assoni A, B e C del sistema nervoso dei Mammiferi (v. fig. 10) sono stati studiati e classificati molto dettagliatamente (v. Gasser e Grundfest, 1936 e 1939; v. Grundfest e Gasser, 1938; v. Grundfest, 1939; v. Gasser, 1950). Esistono correlazioni fra diametri degli assoni, velocità di conduzione, durata degli impulsi, comportamento dei potenziali postumi e altre proprietà (v. tabella; v. Grundfest, 1940 e 1952). In generale le fibre A, mieliniche, trasportano informazioni afferenti al sistema nervoso centrale e comandi efferenti alla muscolatura scheletrica. Esse formano anche la maggior parte delle vie d'intercomunicazione del sistema nervoso centrale, dove possono essere prontamente riconosciute nei preparati istologici per la loro mielinizzazione e per il loro calibro relativamente grande. Gli assoni del funicolo dorso-laterale del midollo (tratto dorso-spinocerebellare di Flechsig) rappresentano le fibre nervose più grandi e a più veloce conduzione nei Mammiferi (v. Grundfest e Campbell, 1942). Fibre A più sottili forniscono comandi anche ai neuroni dei gangli del sistema nervoso autonomo.
Le fibre B sono ugualmente mielinizzate e il loro diametro supera quello delle fibre A più sottili. D'altra parte, come si vede nella tabella, vi sono molti caratteri differenziali che permettono di distinguere fibre A e fibre B che abbiano diametri dello stesso ordine. Le fibre B e le fibre Cs amieliniche appartengono al sistema autonomo, dove possono costituire sia le fibre pregangliari afferenti ai neuroni terminali del sistema autonomo, sia gli assoni efferenti di questi neuroni. Le fibre Cdr costituiscono la maggior parte degli assoni afferenti al sistema nervoso centrale nel nervo sensoriale. Questi assoni, come le fibre mieliniche, trasportano sensazioni dolorifiche: le fibre A trasmettono rapidamente al sistema nervoso centrale, e le fibre Cdr molto più lentamente (v. fig. 15). È tuttavia ancora poco chiara una precisa identificazione dei canali di trasmissione del dolore. Nell'uomo casi d'insensibilità congenita al dolore possono essere associati con l'assenza delle sole fibre A più grandi, o con la mancanza delle sole fibre amieliniche, o anche con la perdita di entrambi i tipi (v. Thrush, 1973).
c) Il potenziale di azione composto
La distribuzione delle fibre A in rapporto al loro diametro differisce nei diversi nervi in maniera del tutto caratteristica (v. figg. 16 e 18). Il potenziale d'azione condotto da un tronco nervoso riflette le differenze nello spettro dei diametri (v. figg. 15, 17 e 18). Le caratteristiche onde del potenziale d'azione, associate a gruppi di fibre di particolare misura, sono state variamente denominate con lettere greche e numeri romani e sono state sviluppate alcune relazioni funzionali in questi diversi sottogruppi (v. Ruch e altri, 19662; v. recettori).
La durata degli impulsi in singoli assoni A è di circa 0,5 ms ed è indipendente dal diametro. La velocità di conduzione è approssimativamente funzione lineare del diametro; anche il contributo di ciascun assone al potenziale d'azione composto è direttamente proporzionale al diametro. Utilizzando queste relazioni è possibile prevedere il potenziale d'azione composto quando si conosca lo spettro dei diametri del tronco nervoso. La fig. 16 illustra la forma relativamente semplice dello spettro di dimensioni nel nervo frenico. Il potenziale d'azione di questo nervo (v. fig. 17) è stato calcolato supponendo che ciascuna fibra generasse un impulso triangolare. Gli impulsi condotti venivano ritardati opportunamente in rapporto alla velocità di conduzione che era stata presunta (grafico nell'inserto) e l'ampiezza di ciascun triangolo era proporzionata al numero di assoni presenti in ogni classe di grandezze. La deviazione fra potenziale d'azione misurato e quello calcolato è piccola (linea tratteggiata).
Un'analisi simile è stata fatta anche per il nervo safeno (v. fig. 18), che contiene un grande numero di fibre A di piccolo diametro (4 μm-1,5 μm). Si supponeva che le velocità fossero quelle riportate nel grafico del riquadro. Il potenziale di azione ricostruito si avvicinava ancora molto al potenziale registrato. Come si è notato in precedenza (v. fig. 15), la grande maggioranza delle fibre Cdr contribuisce soltanto con una piccola onda al potenziale di azione composto del nervo safeno.
6. Attività ripetitiva
a) Refrattarietà
Una volta che un potenziale d'azione è scattato, l'assone resta per qualche tempo ‛assolutamente refrattario' a un secondo stimolo, per quanto esso sia intenso. Il periodo refrattario assoluto ha generalmente la durata dell'impulso che lo ha determinato ed è probabilmente dovuto in massima parte ai processi depolarizzanti dell'inattivazione dell'Na+, che annullano la capacità della membrana di rispondere con un aumento della conduttanza per l'Na+ (v. Hodgkin e Huxley, 1952; v. Hodgkin e altri, 1952). La comparsa e la persistenza dell'attivazione del K+ consolida lo stato di refrattarietà. Il recupero dell'attivazione dell'Na+ e il decrescere dell'attivazione del K+ ripristinano gradualmente lo stato iniziale di responsività. Il periodo di transizione è una fase di ‛refrattarietà relativa' durante la quale lo stimolo necessario per ottenere una risposta liminare deve essere maggiore e l'elettrogenesi può solo consistere in una risposta graduata soggetta a decremento. Il decremento è particolarmente marcato quando λ è molto piccola, come nelle elettroplacche di gimnoto. Risposte che nel punto di stimolazione sono potenziali di azione con picco positivo decrescono rapidamente e l'elettrogenesi si esaurisce nello spazio di 1 mm o più a partire da quel punto (v. Altamirano e altri, 1955).
b) Altre variazioni nello stato di eccitabilità
Quando il potenziale di azione è associato a potenziali postumi, questi possono influenzare l'eccitabilità dell'assone (v. Gasser e Grundfest, 1936). Poiché i potenziali postumi hanno una durata molto maggiore del potenziale d'azione, anche le variazioni nell'eccitabilità sono di lunga durata. In generale la depolarizzazione postuma è associata a un aumento di eccitabilità, mentre l'iperpolarizzazione postuma a una diminuzione. Comunque, l'effetto del potenziale postumo sull'eccitabilità dipende dalla natura dell'elettrogenesi implicata nella sua produzione. Pertanto, se la depolarizzazione è dovuta a un aumento della conduttanza al K+(GK), l'eccitabilità potrà risultare depressa.
c) Risposte ripetitive
La capacità di un assone di rispondere in maniera ripetitiva a uno stimolo continuato liminare o sopraliminare è un importante requisito funzionale di alcuni assoni, e specificamente di quelli che portano l'informazione sensitiva al sistema nervoso. L'intensità e la durata di uno stimolo che induce un potenziale generatore opportunamente graduato possono essere valutate soltanto dal numero e dalla frequenza dei bits contenuti nei singoli eventi digitali rappresentati dai potenziali di azione. La conoscenza delle cinetiche dei processi ionici nell'elettrogenesi del potenziale di azione permette di calcolare la relazione frequenza-corrente negli assoni giganti di calamaro (v. Cooley e altri, 1965; v. Stein, 1967) ; questo si accorda soddisfacentemente con i dati sperimentali (v. Guttman e Barnhill, 1970). In generale, aumentando la corrente, gli assoni di calamaro rispondono con un aumento limitato a uno stretto intervallo di frequenze (circa 50-300/s a 20 °C), ma ciò avviene solo per brevi durate.
Tra i diversi assoni c'è un'enorme variabilità nella capacità di rispondere ripetitivamente. Gli assoni giganti di scarafaggio generano soltanto un potenziale di azione, anche per stimoli notevolmente al di sopra della soglia (v. Narahashi, 1963). Altre cellule rispondono su un ampio intervallo di frequenze non appena lo stimolo viene aumentato (v. Hodgkin, 1948). In condizioni sperimentali, quando l'intensità di una corrente di lunga durata viene aumentata, gli assoni capaci di scaricare ripetitivamente rispondono dapprima con un impulso, poi con due e infine con una sequenza che cresce progressivamente di frequenza con l'aumentare dello stimolo. Comunque, la sequenza può essere di breve durata o protrarsi per un lungo periodo di tempo (v. fig. 19) con variazioni soltanto minime di frequenza. Queste variazioni così impressionanti in due cellule differenti dello stesso animale (recettori da stiramento del gambero ad adattamento lento e rapido) sembrano essere dovute ad alcune differenze, non ancora del tutto chiarite, nelle proprietà di eccitabilità degli assoni (v. i contributi di Nakajima e Onodera, 1969), che possono essere comprese sotto il termine di ‛adattamento' menzionato in precedenza.
In questa differenza c'è un importante aspetto funzionale. Sotto questo profilo l'organismo riceve due tipi d'informazione. Il recettore a rapido adattamento ‛fasico' invia una considerevole quantità di informazione in rapporto soprattutto a una variazione di stiramento, mentre il recettore a lento adattamento ‛tonico' fornisce informazioni circa le condizioni stazionarie. Si noti come i processi trasduttivi, rappresentati dal potenziale generatore, siano essenzialmente gli stessi in entrambi i tipi di cellule e come la differenza tra le proprietà fasiche e toniche consista nella specializzazione delle cinetiche del processo che genera il potenziale di azione.
7. Normali modalità d'insorgenza dell'impulso
a) Nei neuroni sensitivi primari
L'elettrogenesi depolarizzante che rappresenta il potenziale generatore dei neuroni di senso non agisce sulla membrana recettiva all'ingresso, giacché quest'ultima non è elettricamente eccitabile. Pertanto, all'ingresso, l'elettrogenesi è graduata rispetto all'intensità dello stimolo specifico rilevato dalla membrana recettrice (v. fig. 19). L'ampiezza del potenziale generatore depolarizzante influenza di fatto la membrana elettricamente eccitabile generatrice d'impulsi, che può essere adiacente o frammista alla componente di membrana recettrice. Pertanto il neurone sensitivo inizia l'attività conduttiva nell'assone con un messaggio di impulsi, il cui numero e la cui frequenza costituiscono un codice d'informazione sull'intensità e la durata dello stimolo all'ingresso.
b) Nelle cellule postsinaptiche
Gli impulsi che nascono in seguito a trasmissione del messaggio attraverso una giunzione sinaptica originano analogamente come risultato dell'elettrogenesi depolarizzante dei PPSE. Comunque, dal momento che ciascun impulso digitale nel neurone presinaptico tende a liberare un pacchetto quantizzato di trasmettitore (v. Katz, 1969), la modulazione del messaggio che alla fine nascerà nell'assone del neurone postsinaptico deve presentare un notevole grado di raffinatezza. Vari tipi di facilitazione o di disfacilitazione modificano la fuoriuscita del trasmettitore dalle terminazioni presinaptiche; la desensibilizzazione o la sensibilizzazione di membrane postsinaptiche specificamente recettive ne modificano l'elettrogenesi, come avviene quando segnali inibitori giungono alla cellula sotto forma di PPSI. È di speciale importanza nei sistemi nervosi centrali la distribuzione topografica dell'informazione afferente alle diverse parti di un determinato neurone. Come è schematicamente illustrato nella fig. 2, la superficie recettiva di un neurone comprende un'area molto estesa corrispondente al grande numero di sinapsi dell'albero dendritico e così pure di quelle localizzate sulla superficie del corpo cellulare propriamente detto. Come regola generale gli impulsi insorgono in un punto dell'assone posto in prossimità del soma (v. figg. 2 e 11) e la membrana dendritica è spesso incapace di generare potenziali di azione (v. Grundfest e Purpura, 1956; v. Purpura e Grundfest, 1956). Quindi l'elettrogenesi evocata a livello delle sinapsi dendritiche diffonde alla zona d'insorgenza del potenziale di azione in virtù dell'elettrotono (cioè passivamente, come in un cavo) ed è sottoposta alle perdite di cavo. Un PPSE di una certa ampiezza che sia generato nelle sinapsi eccitatrici più lontane depolarizzerà la membrana elettricamente eccitabile generatrice d'impulsi in grado molto minore di un PPSE della stessa ampiezza generato a livello del soma. Non soltanto l'effetto di un PPS è ridotto dalle perdite che avvengono nel cavo dendritico, ma anche la forma del potenziale risulta alterata e può essere notevolmente prolungata (v. figg. 4 e 5). Comunque, dal momento che l'elettrogenesi sinaptica è altamente localizzata, molte zone dove ha luogo tale elettrogenesi possono essere attive simultaneamente. L'albero dendritico agisce quindi come un ‛luogo di sommazione' che riflette gli effetti di molte afferenze. L'accresciuta comprensione della funzione delle differenti componenti di risposta nel neurone e l'affinamento delle tecniche sperimentali hanno portato un numero crescente di documentazioni su questo aspetto del contenuto informativo nel sistema nervoso centrale (v. fig. 20).
c) Nei sistemi di cellule recettrici
Sistemi di cellule recettrici più complessi dei neuroni sensitivi primari si trovano nelle varie derivazioni del sistema della linea laterale dei Vertebrati e un sistema ancora più elaborato è presente nella retina dei Vertebrati. I recettori uditivi, vestibolari e gustativi dei Vertebrati non possiedono assoni e quindi in linea di principio sono cellule recettrici-effettrici (v. Grundfest, 1958, 1971 e Excitation by..., 1961) che liberano un mediatore; questo eccita le terminazioni recettive d'un assone ‛afferente', che conduce un messaggio al sistema nervoso centrale. L'effetto eccitatore alle sinapsi afferenti nei meccanocettori della linea laterale (v. fig. 21) è normalmente una risposta evocata dal movimento unidirezionale di un chinociglio che è orientato in maniera diversa nelle differenti cellule recettrici. Un assone che stabilisce rapporti sinaptici con cellule di un solo orientamento (v. fig. 21, a e b) può trasmettere al sistema nervoso centrale informazioni solamente sulla fase di rarefazione o di condensazione di uno stimolo. Assoni come il c e il c′ della stessa figura, che sono in connessione con cellule di entrambi gli orientamenti, generano impulsi in risposta sia alla rarefazione sia alla condensazione. Questo tipo di messaggio è ovviamente più complesso e la sua interpretazione implica un'ulteriore elaborazione a livello dei centri superiori. Un altro motivo di complessità in questi recettori è determinato dalla presenza di una sinapsi ‛efferente' (v. Flock, 1971). Le terminazioni nervose sono colinergiche e provocano iperpolarizzazione nella cellula recettrice (v. Fex, 1967). Ciò sembra in rapporto con una diminuita liberazione del mediatore eccitatorio nella sinapsi afferente, cosicché i centri superiori esercitano un certo grado di feedback inibitorio sui segnali che a essi pervengono dagli assoni afferenti (v. Fex, 1962).
Nei Vertebrati una sinapsi è presente anche tra le cellule gustatorie dei corpuscoli gustativi e gli assoni afferenti. Il messaggio che viene immesso nell'assone è complicato dal fatto che una data cellula può rispondere a stimoli differenti (v. Kimura e Beidler, 1961) e dal fatto che le caratteristiche elettrofisiologiche delle risposte ad agenti diversi possono essere diverse. Così alcune cellule rispondono con un aumento della conduttanza al dolce, al salato, o all'acido, ma il chinino determina una diminuzione della conduttanza (v. Ozeki, 1971). Non è noto se alla base di queste differenti risposte sia implicato un solo agente trasmettitore o se siano invece secrete sostanze diverse. In ogni caso, comunque, il messaggio trasmesso nell'assone è sempre lo stesso: una sequenza di potenziali di azione. La percezione di differenti sensazioni deve quindi comportare un'elaborazione del messaggio che consenta di riconoscere la modalità di stimolazione.
A prima vista può sembrare strano che terminazioni assoniche formino l'elemento postsinaptico in una sinapsi con le cellule recettrici. Tuttavia l'esistenza di una membrana d'ingresso specializzata è chiaramente evidente nei corpuscoli del Pacini e nell'epitelio olfattivo dei Vertebrati, così come in numerosi tipi di neuroni recettivi di Invertebrati. Una simile evenienza si verifica con ogni probabilità anche nelle cosiddette ‛terminazioni libere' chemo- e meccanosensitive che formano gran parte dell'apparato sensitivo dei Vertebrati. La natura specializzata della membrana d'ingresso non è svelata dalle tecniche morfologiche.
Un'organizzazione ancora più complessa si riscontra nella retina dei Vertebrati, che, essendo una porzione del cervello primitivo, contiene diversi strati di cellule interposti tra i fotorecettori (bastoncelli e coni) e i neuroni (cellule gangliari), i quali formulano un messaggio di impulsi che è condotto al cervello (v. fig. 22). Anche il modo in cui questo messaggio inizia è complesso (v. Baylor e Fuortes, 1970; v. Baylor e altri, 1971; v. Byzov e Trifinov, 1968; v. Cervetto, 1973; v. Dowling e Ripps, 1973; v. Fuortes e altri, 1973; v. Tomita, 1970). In assenza di luce i fotorecettori sono permeabili all'Na+ così che le cellule sono depolarizzate. Presumibilmente questo fatto è responsabile dell'incessante liberazione di trasmettitore (forse acido glutammico) e della depolarizzazione delle cellule orizzontali che sono connesse con i fotorecettori. La permeabilità dei recettori all'Na+ è ridotta dall'illuminazione. La conduttanza diminuisce e le cellule si ripolarizzano. Viene quindi a diminuire la liberazione del trasmettitore e anche le cellule orizzontali si ripolarizzano con una diminuzione della conduttanza. La prova di queste interazioni sinaptiche deriva dall'osservazione che la diminuzione di Ca2+ o l'aumento di Mg2+, condizioni in cui la liberazione di trasmettitore è ridotta, provocano altresì un'iperpolarizzazione e una diminuzione della conduttanza nelle cellule orizzontali.
Alcune cellule orizzontali risultano essere in contatto sinaptico con i coni e, mediante la depolarizzazione di questi elementi che esse provocano, si stabilisce sui fotorecettori un effetto di controreazione negativa. Questa ‛trasmissione ricorrente' è analoga agli effetti delle sinapsi ‛efferenti' nelle cellule ciliate. Nella retina le interazioni sono ulteriormente complicate dalle connessioni elettriche esistenti sia tra alcuni fotorecettori sia tra le cellule orizzontali. La sequenza degli eventi successivi non è stata ancora chiarita. Si può presumere che la liberazione del trasmettitore dalle cellule orizzontali agisca da segnale per le altre cellule nella sequenza. Lo stadio finale comporta l'insorgenza di potenziali postsinaptici nelle cellule gangliari e la conseguente nascita di potenziali di azione in questi neuroni (v. fig. 23). La complessità morfofunzionale della retina consente una grande varietà d'interazioni, alcune delle quali sono utilizzate per un'accurata rifinitura del messaggio che emerge dalla retina per portarsi al cervello. Un esempio importante e ben caratterizzato è quello dell'inibizione laterale (v. Hartline e altri, 1961; v. Kuffler, 1953).
8. Reazioni alle terminazioni dell'assone
a) Requisiti per la trasmissione
In molti casi l'assone termina stabilendo un contatto sinaptico con un altro neurone o con una qualche struttura effettrice: fibra muscolare, cellula ghiandolare o elettroplacca (v. Pappas e Purpura, 1972). Anche l'ingresso della cellula postgiunzionale (v. fig. 1) è, in generale, elettricamente non eccitabile (v. Grundfest, 1957) come quello del neurone pregiunzionale. Pertanto, come era stato suggerito da du Bois Reymond (v., 1877), la trasmissione dell'informazione dalla cellula presinaptica a quella postsinaptica deve avvenire in virtù di un segnale chimico che, liberato dalle terminazioni presinaptiche, agisce, più o meno specificamente, sulla membrana d'ingresso della cellula postsinaptica. Questo presuppone che il neurone presinaptico sintetizzi e immagazzini il mediatore adeguato all'elemento o agli elementi postsinaptici con cui è in rapporto; presuppone inoltre che la sostanza trasmettitrice sia liberata in quantità adeguata per eccitare la membrana postsinaptica, sotto il controllo dell'impulso che agisce da segnale per l'attività secretrice. (v. sinapsi: Fisiologia della sinapsi centrale e Fisiologia della sinapsi periferica).
b) Varietà di mediatori
Vi è con ogni probabilità un grandissimo numero di mediatori, per l'enorme numero di neuroni e cellule effettrici presenti nei Mammiferi più elevati. Alcuni di essi sono conosciuti, come ad esempio l'acetilcolina, le catecolammine e vari amminoacidi. Alcune di queste sostanze sono state identificate quali agenti trasmettitori negli Invertebrati e in particolare nei Crostacei, dove le condizioni sperimentali consentono d'isolare assoni con diverse caratteristiche funzionali, per esempio gli assoni eccitatori e inibitori diretti al muscolo (v. Gerschenfeld, 1973). Il GABA (ovvero l'acido γ-amminobutirrico), che è in grado di attivare le sinapsi inibitrici (v. Boistel e Fatt, 1958; v. Grundfest e altri, 1959), è molto più concentrato negli assoni ad azione inibitrice che non negli assoni ad azioni diverse (v. Kravitz, 1967; v. Sorenson, 1973). Sembra invece che i neuroni sensitivi utilizzino come mediatore l'acetilcolina (v. Barker e altri, 1972).
c) Vescicole sinaptiche
Il mediatore è presumibilmente formato nelle sedi di attività metabolica e sintetica, dalle quali, scorrendo lungo l'assone, giunge alle terminazioni nervose ove viene immagazzinato sotto forma di vescicole. Queste ultime generalmente si trovano raggruppate in zone specializzate dove le terminazioni prendono contatto con la membrana della cellula postsinaptica. Nella maggior parte dei casi le vescicole sono sferiche e relativamente trasparenti agli elettroni (v. fig. 24). Vescicole elettrondense si rinvengono tuttavia di frequente, in particolare nei complessi sinaptici che sono attivati dalle catecolammine. Nelle giunzioni neuromuscolari dei Crostacei e nei preparati di recettori da stiramento del gambero le vescicole sinaptiche degli assoni eccitatori e inibitori hanno caratteristiche morfologiche distinte (v. fig. 25). Esse sono sferiche e con un diametro approssimativo di 450 Å nelle terminazioni eccitatrici. Nelle terminazioni degli assoni inibitori esse sono ellittiche e di minori dimensioni, circa 350 Å (v. Uchizono, 1967; v. Atwood e Morin, 1970; v. Lang e Atwood, 1973; v. Nakajima e altri, 1973). La stimolazione iterativa degli assoni dell'uno o dell'altro tipo provoca la deplezione selettiva delle rispettive vescicole sinaptiche (v. Lang e Atwood, 1973).
d) Liberazione del mediatore
Il mediatore è probabilmente liberato per estrusione (esocitosi) dalla membrana cellulare; in seguito a un'intensa attività sinaptica, le terminazioni possono apparire svuotate delle vescicole (v. fig. 24). Lo stimolo adeguato a provocare la liberazione del mediatore è la depolarizzazione delle terminazioni nervose che viene determinata dai potenziali di azione. La liberazione del mediatore può essere prodotta applicando una corrente depolarizzante; l'effetto persiste anche dopo che l'elettrogenesi del potenziale d'azione è stata eliminata con tetrodotossina (TTX). L'attività secretrice non richiede quindi attivazione dell'Na+.
L'attività sinaptica evocata è probabilmente associata con la liberazione di un considerevole numero di vescicole. Comunque, un'attività postsinaptica minore (‛in miniatura') si verifica in seguito alla spontanea, più o meno casuale, liberazione di una o più vescicole sinaptiche, ciascuna delle quali contribuisce all'attività come quantità discreta. L'attività casuale si verifica sia nelle terminazioni inibitorie sia in quelle eccitatorie (v. fig. 26). Essa è pertanto indipendente dalla natura dell'assone e dal tipo di mediatore liberato.
Katz e i suoi collaboratori (v. Katz, 1969) hanno dimostrato che l'ingresso di Ca2+, in risposta alla depolarizzazione della membrana delle terminazioni, mette in moto l'attività secretrice. A livello delle giunzioni neuromuscolari dei Crostacei sia PPSI sia PPSE sono eliminati quando l'ingresso del Ca2+ viene bloccato mediante agenti diversi (per es. Mg2+ o Mn2+), mentre la membrana postsinaptica resta sensibile all'applicazione di mediatori fatta dall'esterno (v. April e Reuben, 1971). Quindi l'ingresso di Ca2+ è un requisito indipendente dalla natura del mediatore liberato dalle terminazioni.
La liberazione spontanea di mediatore persiste invece anche in assenza di Ca2+ (v. Longenecker e altri, 1970; v. Hurlbut e altri, 1971; v. Clark e altri, 1972) e quando il suo ingresso viene bloccato (v. Liley, 1956; v. April e Reuben, 1971). Il veleno del ragno vedova nera è in grado di bloccare i potenziali evocati nelle sinapsi dei Vertebrati e degli Artropodi, mentre mette in risalto l'attività spontanea (v. Longenecker e altri, 1970; v. Hurlbut e altri, 1971; v. Clark e altri, 1972; v. Kawai e altri, 1972). L'attività spontanea persiste anche dopo che l'elettrogenesi da potenziale di azione nell'assone è stata eliminata con la saxitossina (v. Reuben e Grundfest, Inhibitory and..., 1960) o con la tetrodotossina (v. Elmqvist e Feldman, 1965; v. Ozeki e altri, 1966).
Queste differenze tra la liberazione spontanea di mediatore e quella indotta non sono ancora state spiegate. È possibile che movimenti casuali attraverso la membrana solo di pochi ioni Ca2+ possano produrre la liberazione di una o più vescicole, determinando l'attività sinaptica spontanea, anche quando un influsso massivo di Ca2+ non può realizzarsi e le risposte indotte sono bloccate (v. Katz, 1969).
9. Controllo dell'attività secretrice
Questo può essere realizzato da una varietà di meccanismi, fra i quali i processi di natura metabolica, per cui la secrezione viene mantenuta dal riassorbimento o dalla captazione da parte delle terminazioni di alcuni prodotti della degradazione (v. Burn e Rand, 1959; v. Enero e altri, 1972). Esistono buone prove della captazione di materiale da parte delle vescicole ('endocitosi'; v. Holtzman e altri, 1971). La presente discussione sarà tuttavia limitata a due meccanismi elettrofisiologici di controllo.
a) Controllo nervoso presinaptico (indiretto)
L'inibizione presinaptica è un meccanismo ben definito che controlla la liberazione di mediatore dalle terminazioni nervose. Le connessioni sinaptiche asso-assoniche delle terminazioni nervose sono chiaramente evidenziate in preparati di Crostacei, dove sono state osservate differenze morfologiche tra le vescicole sinaptiche di assoni eccitatori e quelle di assoni inibitori (v. fig. 25). L'assone motorio che eccita la fibra muscolare di un recettore da stiramento del gambero è innervato asso-assonicamente da terminazioni con vescicole ellittiche che sono caratteristiche degli assoni inibitori (v. Nakajima e altri, 1973). Sono state osservate analoghe innervazioni presinaptiche mediante assoni inibitori a livello di assoni terminali eccitatori che innervano vari muscoli di Crostacei (v. Atwood e Morin, 1970) e questo fornisce la base dell'inibizione presinaptica (v. fig. 27) osservata in molti preparati, anche se non in tutti (v. Gainer e altri, 1967). Un impulso nervoso inibitore non solo riduce il PPSE indotto in una fibra muscolare da una scarica eccitatoria, ma riduce anche la corrente generata dall'impulso negli assoni eccitatori.
Il meccanismo di tale azione deriva probabilmente da un effetto del mediatore inibente (GABA) sulla conduttanza nelle terminazioni dell'assone eccitatore. Tale azione è stata dimostrata (v. Grundfest e Reuben, 1961) in preparati di gambero marino trattati con feniletilammina (PEA). In presenza di questo agente l'assone eccitatore scarica ripetitivamente in risposta a uno stimolo singolo. La scarica nelle terminazioni dell'assone presumibilmente insorge in quanto l'impulso nervoso iniziale genera un'ampia depolarizzazione postuma. La scarica ripetitiva dell'assone può essere osservata come una sequenza ripetuta di PPSE nella fibra muscolare (v. fig. 28). La scarica viene abolita dall'applicazione di GABA, probabilmente perché questo agente aumenta nelle terminazioni la conduttanza per il Cl- e riduce pertanto la depolarizzazione postuma indotta dal PEA. La picrotossina, che è l'antagonista del GABA nelle sinapsi inibitorie, contrasta lo stesso effetto inibitore del GABA anche nelle terminazioni nervose.
In alcuni preparati neuromuscolari di Crostacei l'aumento della conduttanza per il Cl-, che riflette l'attivazione delle sinapsi inibitrici, è molto più breve di quanto non sia l'inibizione provocata dalla stimolazione dell'assone inibitore o dall'applicazione di GABA (v. Epstein e Grundfest, 1970). Una simile discrepanza sorge per il fatto che i recettori della membrana postsinaptica diventano insensibili e non rispondono più alla presenza continuata di mediatore (v. Katz e Thesleff, 1957), mentre le terminazioni presinaptiche conservano la loro sensibilità. Pertanto, la membrana delle terminazioni nervose può differire farmacologicamente (e quindi nella struttura chimica) rispetto alla membrana dell'assone o ai recettori chemosensibili della membrana postsinaptica delle fibre muscolari.
Il controllo presinaptico inibitore della liberazione del mediatore eccitatore delle cellule ciliate è stato ricordato in precedenza (v. fig. 21). L'inibizione presinaptica è stata osservata diffusamente nel sistema nervoso dei Vertebrati (v. Eccles, 1964; v. Euler e altri, 1968). E anche possibile immaginare che vi siano terminazioni asso-assoniche eccitatrici; uno di questi casi può essere rappresentato dai contatti sinaptici su assoni inibitori che innervano i dendriti del recettore da stiramento del gambero (v. fig. 25). Questi contatti asso-assonici sono realizzati da terminazioni che contengono vescicole ellittiche e che quindi liberano con ogni probabilità GABA. Se la liberazione del mediatore dalle terminazioni ‛postsinaptiche' dell'assone inibitore è ridotta dal GABA, allora l'effetto dell'innervazione presinaptica sarebbe l'inibizione di una inibizione' quale ulteriore forma di modulazione dell'attività del recettore da stiramento.
b) Facilitazione e disfacilitazione
Un controllo viene pure esercitato dalla misura in cui un impulso nervoso causa liberazione di mediatore dalle terminazioni nervose. L'entità della facilitazione può essere considerevolmente modificata da impulsi nervosi che si susseguono. Uno dei casi più estremi si osserva nelle differenze tra le risposte delle cellule negli organi elettrici fondamentali e accessori del pesce elettrico Narcine (v. Mathewson e altri, 1958; v. Bennet e Grundfest, The electrophysiology..., 1961). Uno stimolo singolo applicato sul nervo dell'organo principale produce nella placca elettrica una scarica massimale (circa 60 mV), che rappresenta il potenziale postsinaptico della cellula elettricamente ineccitabile (v. fig. 29). Uno stimolo singolo massimale applicato alle fibre che innervano l'elettroplacca degli organi accessori determina solo una piccola depolarizzazione della cellula. Tuttavia con stimoli ripetuti iterativamente la risposta cresce fino a una depolarizzazione massima di circa 30-50 mV. In altri due pesci elettrici marini, l'elasmobranchio Torpedo (v. Bennett e altri, 1961) e il teleosteo Astroscopus (v. Bennett e Grundfest, The electrophysiology..., 1961), le risposte delle elettroplacche sono ancora potenziali posisinaptici e in entrambi i casi i PPS sono massimali, il che sta a indicare che l'impulso nervoso libera quantità molto grandi di mediatore. Nella maggior parte dei casi, tuttavia, e particolarmente nei neuroni, una singola scarica nelle terminazioni presinaptiche può evocare un PPS così piccolo da essere a malapena distinguibile dal rumore di fondo del sistema di registrazione. La ragione di queste differenze non è stata ancora chiarita, ma certamente esse sono all'origine d'importanti fenomeni nel sistema nervoso centrale, come ad esempio il reclutamento per stimolazione ripetitiva di neuroni che sono nella frangia subliminale (v. Creed e altri, 1932).
Il grado di mobilizzazione del mediatore liberato da un impulso singolo può essere modificato nelle due direzioni. La sostituzione nel mezzo di perfusione del K+ con il Cs+ provoca un aumento molto consistente dei PPS nei preparati neuromuscolari di Crostacei (v. Reuben e Grundfest, The action of cesium..., 1960; v. Gainer e altri, 1967; v. Lang e Atwood, 1973) e di rana (v. Ginsborg e Hamilton, 1968). L'effetto si osserva sia nella trasmissione eccitatrice sia in quella inibitrice ed è probabilmente dovuto al prolungamento del potenziale di azione in presenza di Cs+ (v. Gainer e altri, 1967). Il prolungamento è probabilmente dovuto a un blocco dei canali del K+ da parte del Cs+ e quindi al blocco dell'elettrogenesi ripolarizzante che risulta da un aumento della conduttanza per il K+.
La disfacilitazione, ovvero la diminuzione dei PPS in seguito a stimolazione ripetuta dell'assone, è un fenomeno relativamente più raro il cui meccanismo non è ancora chiaro. Essa potrebbe essere dovuta alla diminuzione della quantità di mediatore disponibile nel corso degli stimoli susseguenti, oppure risultare da un blocco dell'impulso mentre si sta propagando verso le terminazioni nervose. Man mano che l'assone si divide in diramazioni sempre più fini, l'impulso diventa maggiormente soggetto al blocco. La tendenza al blocco può essere accentuata dall'attività ripetitiva. In tal caso l'entità della depolarizzazione delle terminazioni nervose diverrebbe minore e la quantità di mediatore mobilizzato dagli impulsi successivi diminuirebbe.
Il grado d'invasione delle terminazioni nervose varia probabilmente in modo considerevole e si è supposto (v. Lang e Atwood, 1973) che questo fattore determini l'ampiezza dei PPS. Le terminazioni degli assoni che danno origine soltanto a piccoli PPS sarebbero invase in minor misura di quelle degli assoni che producono PPS grandi. In tal caso si può prevedere che le correnti registrate extracellularmente dalle terminazioni nervose saranno particolarmente intense nelle elettroplacche che rispondono con PPS massimali o quasi massimali a un solo impulso nervoso. Questo fatto non è stato osservato sperimentalmente (v. Grundfest, Comparative physiology..., 1967).
10.Trasporto di materiali
a) Flusso intracellulare (citoplasmatico)
Sebbene il soma e gli organelli del neurone non siano necessari per le manifestazioni dell'attività elettrofisiologica, essi sono essenziali per la sopravvivenza di quell'attività e per l'integrità strutturale della cellula. Quando parte di un assone è separata dal soma, questa porzione distale va incontro alla degenerazione walleriana nel giro di pochi giorni (gli assoni motori del gambero e probabilmente anche quelli di altri Crostacei rimangono funzionanti per molte settimane dopo essere stati tagliati; v. Girardier e altri, 1962; questo fenomeno non è stato ancora adeguatamente studiato). La porzione prossimale che resta in continuità con il soma sopravvive e può rigenerare l'intero assone. La differenza risiede indubbiamente nella capacità del nucleo e degli organelli citoplasmatici di realizzare un'attività sintetica che mantiene l'integrità del segmento prossimale e fornisce il materiale per la sua ricrescita. Data la sua lunghezza, l'assone offre un preparato particolarmente favorevole per lo studio dei meccanismi di trasporto (v. Ochs, 1972 e 1974). Meccanismi di trasporto simili sono probabilmente presenti anche in altre cellule.
Nell'assone si osservano due sistemi di trasporto distinti (‛veloce' e ‛lento'). La componente veloce spinge il materiale (piccole particelle e soluti) a una velocità di circa 400 mm al giorno. I materiali hanno pesi molecolari compresi tra 50.000 e 500.000 (proteine) e 5.000 e 10.000 (polipeptidi). Particelle di alto peso molecolare vengono trasportate dal sistema lento a una velocità di circa 1/100 rispetto a quella del sistema veloce. Il sistema veloce trasporta anche materiale dal soma ai dendriti (v. Kreutzberg e altri, 1973). Si può notare che anche la propagazione elettrica di un impulso condotto molto lentamente (per es. I mm/s) è circa 200 volte più veloce del sistema di trasporto ‛rapido'.
Mentre l'attività sintetica del soma è essenziale per la produzione di materiali, il trasporto di questi lungo l'assone è indipendente dal soma ed è mediato dai processi metabolici ossidativi localizzati lungo l'assone stesso. È stato ipotizzato che la motilità dei neurofilamenti e/o dei microtubuli, che è sostenuta dal punto di vista energetico dall'ATP, sia la causa dei flussi assoplasmatici. Tra i materiali identificati nella componente veloce vi sono vescicole sinaptiche contenenti acetilcolina, acetilcolinesterasi e catecolammine. È tuttavia probabile che alcune sostanze mediatrici siano sintetizzate anche localmente nelle terminazioni nervose.
b) Segnali intercellulari
Una quantità di fenomeni dimostra chiaramente che al di là dei meccanismi elettrofisiologici un neurone esercita sulle cellule con cui è connesso (inclusi altri neuroni) un ulteriore controllo. Questi controlli ‛trofici' sono mediati, presumibilmente, da segnali chimici, ma la natura di questi agenti è ancora sconosciuta.
Tra gli effetti trofici quello più anticamente conosciuto è probabilmente la ‛demielinizzazione', che si riscontra nel corso della degenerazione walleriana in assoni che sono stati separati dai loro corpi cellulari. Gli effetti sono chiaramente dovuti a una reazione locale tra l'assone in degenerazione e le cellule di Schwann che lo rivestono. Si conoscono diversi tipi di malattie demielinizzanti in cui gli assoni cessano di funzionare (v. Mc Donald, 1967). È probabile che, per lo meno in alcune di queste, la demielinizzazione sia l'evento primario e che la perdita di funzionalità da parte dell'assone sia l'effetto secondario provocato dalle cellule di Schwann. In tal caso il controllo trofico sarebbe bidirezionale.
Ipersensibilità da denervazione. - È un termine generale con il quale si è inteso descrivere l'osservazione che l'elemento postsinaptico (che può essere una cellula ghiandolare, una fibra muscolare, o un altro neurone) diventa più sensibile a un agente eccitatore allorché l'assone presinaptico viene fatto degenerare. Questo effetto è stato studiato in esteso nei preparati neuromuscolari dei Vertebrati (v. Thesleff, 1961 ; v. Fambrough, 1970). Dopo la denervazione, le strutture chemorecettive della membrana postsinaptica non restano più confinate alla placca terminale, ma si formano ovunque sulla membrana. Questa formazione è bloccata da agenti che interferiscono con la sintesi proteica della fibra muscolare ; conseguentemente nuovi recettori per l'acetilcolina devono essere formati dopo che la denervazione si è verificata. Allorché il nervo rigenera per formare contatti sinaptici con la fibra muscolare, i recettori extrasinaptici gradualmente scompaiono e la chemosensibilità si restringe di nuovo alla regione della placca terminale. I chemorecettori extrasinaptici sono elettricamente ineccitabili e presentano le stesse proprietà elettrofisiologiche di quelli della placca terminale (v. Grundfest, Generalphysiology..., 1961). La denervazione induce anche una modificazione nella membrana elettricamente eccitabile generatrice di potenziali di azione delle fibre muscolari ‛rapide' (v. Redfern e Thesleff, 1971; v. Grampp e altri, 1972). Le fibre muscolari denervate, oltre al potenziale di azione normale che è generato per un aumento della GNa ed è eliminato dalla tetrodotossina (TTX), generano un potenziale di azione che non è bloccato dalla TTX e che pare anch'esso dovuto all'attivazione dell'Na+. La comparsa della nuova componente di membrana può essere bloccata dall'inibizione della sintesi proteica.
La denervazione provoca inoltre sensibili modificazioni nelle proprietà delle fibre muscolari ‛lente' di rana (v. Elul e altri, 1970; v. Miledi e altri, 1971 ; v. Stefani e Schmidt, 1972; v. Stefani e Steinbach, 1969). Le fibre rispondono normalmente alla depolarizzazione con contratture di lunga durata e non generano potenziali di azione. Gli assoni che innervano tali fibre conducono lentamente (> 5 m/s), ma la trasmissione è colinergica come nelle fibre muscolari a scossa ‛rapida'. Dopo denervazione le fibre lente possono essere innervate da assoni a più rapida conduzione, ma questa reinnervazione non è necessariamente la causa per cui le fibre muscolari normalmente lente vengono a somigliare alle fibre rapide. Esse generano ora potenziali di azione che sono bloccati dalla mancanza di Na+ o dalla presenza di TTX e la loro risposta meccanica a depolarizzazioni prolungate è breve come quella delle fibre rapide. Tuttavia la resistenza elevata caratteristica delle fibre lente non è variata. Con il tempo, e probabilmente in rapporto alla reinnervazione da parte degli assoni a conduzione lenta, l'elettrogenesi da potenziale di azione scompare e come risposta ricompare la contrattura.
L'innervazione in una fibra muscolare di Mammifero esercita un certo controllo sia sopra le componenti intracellulari della fibra sia sopra quelle che formano la membrana. La trasposizione di nervi dai muscoli ‛rapidi' a quelli ‛lenti' (e viceversa) cambia la velocità di contrazione. Anche le differenze negli schemi metabolici caratteristici di ciascun tipo di muscolo sono modificate dalla innervazione crociata (v. Guth, 1968). Dal momento che nel muscolo scheletrico dei Vertebrati la trasmissione è colinergica, le differenze prodotte da assoni differenti comportano meccanismi trofici di controllo che sono indipendenti dalla sintesi e dalla liberazione del mediatore.
L'innervazione mantiene un controllo trofico anche sopra i neuroni, come è messo in luce dall'evenienza della degenerazione transneuronale nel sistema nervoso centrale. Gruppi interi di neuroni possono scomparire quando la loro innervazione è distrutta. I segnali non devono essere necessariamente diretti ortodromicamente. La degenerazione degli assoni postsinaptici in contatto con cellule recettrici di diverse modalità sensoriali influenza anche queste cellule. Infatti i calici gustativi si disintegrano quando il loro apporto nervoso è degenerato ed effetti simili si verificano nei recettori cutanei e in seguito alla denervazione dell'organo della linea laterale (v. Beidler e Smallman, 1965; v. Guth, 1967).
Segnali possono essere diretti dai neuroni verso le loro innervazioni. Il ganglio ciliare degli Uccelli contiene due gruppi di neuroni, coroidi e ciliari, che differiscono sotto molti aspetti (v. Marwitt e altri, 1971). I neuroni coroidi sono innervati da fibre che conducono a circa 3 m/s e quelli ciliari da fibre che conducono a una velocità circa doppia. La reinnervazione del ganglio denervato nel piccione adulto è altamente selettiva nella sua preferenza per la innervazione normale (v. Landmesser e Pilar, 1970). Un piccolo numero di fibre rapide, tuttavia, di fatto reinnerva neuroni coroidi; tali giunzioni sviluppano una capacità per la trasmissione elettrica che si osserva di norma solamente nei neuroni ciliari. Le terminazioni presinaptiche, quindi, possono modificare anche la condizione dei neuroni coroidi.
Si conoscono numerose altre interazioni tra le componenti nervose e quelle di altri tessuti, ma qui basti ricordare il notevole incremento nello sviluppo dei sistemi simpatico e sensoriale sotto l'influenza di un fattore proteico di accrescimento nervoso (NGF, Nerve Growth Factor) di cui sono particolarmente ricche le ghiandole salivari (v. Levi-Montalcini e Angeletti, 1968; v. Zaimis e Knight, 1972; v. neurogenesi). In considerazione della molteplicità delle interazioni trofiche conosciute, è probabile che processi di segnalazione di questo tipo possano partecipare ai fenomeni ancora sconosciuti della memoria e dell'apprendimento.
11. Accoppiamento elettrico
a) Correnti di campo
Si potrebbe prevedere che la corrente d'azione che fluisce nel mezzo extracellulare intorno a una cellula eccitata influenzi anche le altre cellule che si trovano lungo le linee percorse dalla corrente stessa. La possibilità, tuttavia, di un ‛discorso incrociato', che potrebbe confondere il messaggio veicolato nei singoli canali, è sorprendentemente scarsa. Il liquido extracellulare ha una resistenza molto più bassa di quella della membrana a riposo di una cellula inattiva; negli assoni mielinici, poi, lo strato di mielina aumenta ulteriormente la resistenza. Quindi, solo una piccola frazione della corrente estrinseca può entrare in cellule inattive. Si può prevedere che le regioni amieliniche dei neuroni, soma, dendriti e terminazioni nervose, siano maggiormente suscettibili a un simile discorso incrociato e, di fatto, taluni effetti delle correnti estrinseche di ‛campo' sono stati osservati sull'eccitabilità di cellule inattive del midollo spinale (v. Grundfest e Magnes, 1951; v. Nelson, 1966). Il campo elettrico generato da queste correnti estrinseche non è di regola uniformemente orientato, di modo che a ogni determinato punto la corrente che proviene da differenti fibre nervose può fluire all'interno o all'esterno della cellula a riposo (v. Grundfest, 1956). Questi effetti di campo possono quindi essere eccitatori, se il flusso netto di corrente è diretto verso l'esterno, oppure depressori, se il flusso netto è diretto verso l'interno, e quindi è improbabile che possano fornire un'informazione utile per il sistema nervoso. Sulla membrana postsinaptica delle sinapsi eccitatrici o inibitrici l'effetto sarà scarso o nullo, in quanto queste componenti della membrana sono elettricamente ineccitabili (v. Grundfest, 1956 e 1957).
L'eccitabilità di un assone a uno stimolo elettrico di controllo può essere influenzata dalla corrente generata durante un potenziale di azione in un assone adiacente. L'area tratteggiata nel rettangolo in basso della fig. 30 sta a indicare la zona in cui ha luogo il potenziale di azione in un assone e le frecce indicano la corrente che nello stesso istante fluisce tra questo assone e una fibra vicina quiescente. Parte della corrente che diffonde intracellularmente prima e dopo il potenziale di azione entra nella fibra adiacente (A1, A2) iperpolarizzandone la membrana. Nella regione in corrispondenza della quale ha luogo il potenziale di azione, una corrente diretta verso l'esterno diffonde dall'assone quiescente (C1, C2) depolarizzandone la membrana. La soglia elettrica è aumentata nelle regioni polarizzate anodicamente ed è abbassata dalla polarizzazione catodica (curva punteggiata).
In condizioni normali gli impulsi di un assone non inducono potenziali di azione nelle fibre vicine. Si possono tuttavia realizzare condizioni sperimentali in cui vi sia l'eccitazione degli assoni ‛destinatari' in seguito al potenziale di azione di fibre adiacenti attive (‛effetto Hering'; v. Marrazzi e Lorente de Nó, 1944). Un esempio istruttivo è quello della fig. 31. Due assoni giganti di Sepia erano disposti in modo che fossero in contatto uno con l'altro come mostrato nello schema (v. Arvanitaki, 1942). Con l'assone immerso nel suo mezzo normale (acqua di mare, I) uno stimolo subliminare evocava una risposta locale nell'assone direttamente eccitato, mentre nel secondo assone nulla si osservava, dal momento che la risposta locale non si propagava a quest'ultimo. Quando lo stimolo era aumentato in modo da generare un potenziale di azione nel primo assone, v'era nel secondo una risposta locale indicante che, quando il potenziale di azione si era propagato alla regione di contatto (efapsi artificiale), esso provocava nel secondo assone una risposta subliminare. Nella sequenza di registrazioni della fig. 31 II, veniva aggiunto citrato alla soluzione con lo scopo di ridurre la concentrazione del Ca2+ e di aumentare così l'eccitabilità degli assoni (v. Lehmann, 1937). Lo stimolo subliminare non provocava ancora alcuna risposta nel secondo assone, poiché la risposta locale non si propagava fino alla giunzione. Tuttavia, quando un potenziale di azione veniva evocato nel primo assone, in queste condizioni, un potenziale di azione appariva anche nel secondo assone.
b) Giunzioni efaptiche
Le correnti estrinseche hanno tuttavia marcati effetti in varie ‛giunzioni efaptiche' o ‛elettrotoniche', che si verificano normalmente, dove una cellula generatrice d'impulsi entra in stretto contatto elettrico con un'altra cellula elettricamente eccitabile capace di generare potenziali di azione (v. Grundfest, Synaptic and..., 1959, 1967 e 1969). (Ho evitato il termine ‛sinapsi elettrica', poiché esso confonde l'effetto relativamente semplice, e fondamentalmente eccitatore, del circuito locale di corrente in una giunzione efaptica, con il fenomeno di gran lunga più complesso che si verifica nelle sinapsi eccitatrici e inibitrici. Il termine ‛sinapsi' è riservato a quelle che vengono pleonasticamente definite ‛sinapsi chimiche'. Questo termine è tuttavia legittimo anche quando la natura ‛chimica' non è stata dimostrata, poiché vi sono oggi numerose prove indicanti che le sinapsi sono elettricamente ineccitabili).
Nell'accoppiamento efaptico la resistenza tra le due cellule deve essere bassa così che una quantità apprezzabile della corrente di azione dell'unità preefaptica possa fluire nella cellula postefaptica. In altre parole la trasmissione per accoppiamento elettrico è identica in linea di principio alla propagazione di un impulso nell'ambito di una stessa cellula in virtù dei circuiti locali, eccetto che il fattore di sicurezza può essere basso, poiché la corrente transefaptica viene ridotta dalla resistenza delle membrane della giunzione.
Gli assoni settati dei Crostacei e dei Vermi (v. Johnson, 1924; v. Stough, 1926) offrono un esempio semplice di trasmissione efaptica (v. Watanabe e Grundfest, 1961). In origine gli assoni sono segmentali, ma i segmenti terminano vicini l'un l'altro, essendo separati dalle loro membrane terminali o setti. In condizioni normali questi setti hanno una bassa resistenza (v. fig. 32). Il sistema è perciò strettamente accoppiato (v. Watanabe e Grundfest, 1961). Se un potenziale di azione è generato in un segmento (per es. mediante stimolazione intracellulare), esso può propagarsi nei segmenti adiacenti, poiché una quota sufficiente della sua corrente di azione fluisce attraverso il setto per dare origine a un potenziale di azione nel segmento transettale. La resistenza del setto può essere aumentata e l'accoppiamento indebolito da numerosi procedimenti sperimentali (v. Pappas e altri, 1971). In queste condizioni la trasmissione viene bloccata.
Il grado di accoppiamento può essere misurato applicando una corrente intracellulare a uno degli elementi e osservando la variazione di potenziale nell'altro elemento del sistema giunzionale (v. Watanabe e Grundfest, 1961; v. Bennett, 1966; v. Auerbach e Bennett, A rectifying..., 1969). L'accoppiamento è piuttosto debole nella maggioranza delle connessioni elettrotoniche, cosicché la propagazione di un potenziale attraverso la giunzione, come anche negli assoni settati, è relativamente rara. La variazione del potenziale attraverso la giunzione può tuttavia alterare l'eccitabilità della cellula postgiunzionale in misura maggiore dei potenziali postumi che seguono un potenziale di azione. La durata della variazione dell'eccitabilità è limitata alla durata dell'impulso rappresentato dal potenziale di azione, che è distorto (v. Bogue e Rosenberg, 1934) dalle proprietà di cavo del sistema (v. figg. 4 e 5).
In linea di principio la trasmissione efaptica non ha una polarità, così come la propagazione intracellulare di un potenziale di azione (v. fig. 32 in alto e fig. 33). Una polarizzazione della trasmissione si può verificare, tuttavia, come è stato dimostrato nei contatti elettrotonici degli assoni giganti e motori del gambero (v. Furshpan e Potter, 1959). Uno speciale adattamento, che però non è stato ancora adeguatamente analizzato, favorisce il flusso della corrente di azione dalla ‛prefibra' alla ‛postfibra' (v. fig. 32 in basso). La polarizzazione può essere dovuta a ‛rettificazione', per cui la membrana efaptica della cellula postgiunzionale si oppone alla corrente diretta verso l'esterno; oppure la membrana dell'elemento pregiunzionale si oppone a quella diretta verso l'interno. Una polarizzazione di questo tipo è stata osservata anche nella giunzione della fibra del motoneurone gigante del pesce Gasteropelecus (v. Auerbach e Bennett, A rectifying..., 1969).
Trasmissione efaptica polarizzata può verificarsi anche per via di fattori geometrici che favoriscono o contrastano il flusso di corrente. Per esempio il flusso di corrente può essere grande se la cellula pregiunzionale possiede un'ampia superficie e quella postgiunzionale una superficie meno estesa. Vi è quindi eccitazione efaptica in un nervo per la corrente di azione di un muscolo, ma di regola non l'inverso (v. Lloyd, 1942).
Il ganglio ciliare degli Uccelli presenta una situazione morfologica interessante per la trasmissione efaptica. Nel ganglio vi sono due tipi di neuroni: un gruppo invia gli assoni fuori del nervo coroide, l'altro gruppo nei nervi ciliari (v. Hess e altri, 1969; v. Marwitt e altri, 1971). Entrambi i tipi di neuroni sono attivati sinapticamente dall'afferenza pregangliare nel nervo oculomotore, ma solo i neuroni che formano gli assoni dei nervi ciliari possono essere eccitati altrettanto bene in via efaptica. Questa risposta avviene con una latenza molto più breve rispetto a quella indotta in via sinaptica. I neuroni da cui originano i nervi ciliari hanno uno strato di rivestimento mielinico e le terminazioni pregangliari penetrano in questa guaina. Presumibilmente è la presenza dello strato di mielina che potenzia il flusso della corrente di azione dalla terminazione all'interno del voluminoso corpo cellulare dell'elemento postefaptico.
Connessioni elettriche tra cellule sono comuni nei tessuti di origine epiteliale (v. Loewenstein, 1973; v. Sokolar, 1973) e sono di regola associate con le specializzazioni morfologiche delle ‛giunzioni per apposizione stretta' (v. Farquhar e Palade, 1963; v. Rose, 1971). L'evenienza di connessioni efaptiche tra cellule nervose può riflettere una condizione vestigiale che in taluni casi è stata adattata a funzioni specifiche. Le connessioni efaptiche si trovano spesso in situazioni dove c'è un vantaggio nell'attivazione simultanea di molte cellule. L'accoppiamento elettrico offre infine i mezzi per una controreazione positiva che manca nei meccanismi sinaptici.
Una simile controreazione positiva è evidenziata in particolare negli organi elettrici dei Pesci (v. Bennett, 1970 e 1973; v. Bennett e altri, 1967) e nel controllo della contrazione dei muscoli pettorali ('del volo') del pesce Gasteropelecus (v. Auerbach e Bennett, A rectiying..., 1969). Tuttavia connessioni efaptiche si rinvengono anche in sistemi dove una risposta rapida e sincronizzata non pare essere essenziale. Vi sono connessioni elettrotoniche tra i neuroni sopraspinali (v. fig. 33), ma la funzione di queste cellule non è conosciuta (v. Bennett e altri, 1959). Connessioni elettrotoniche esistono anche tra le fibre muscolari dei Crostacei (v. Reuben, 1960; v. Jahromi e Atwood, 1971), ma il loro significato funzionale è discutibile.
Le giunzioni elettriche possono essere dendro-dendritiche (connettono cioè i corpi di due cellule nervose), asso-somatiche (tra la fibra nervosa e il corpo cellulare), asso-assoniche, come tra i segmenti di assoni settati o tra due fibre muscolari. La morfologia di queste giunzioni è altamente variabile (v. Pappas e Purpura, 1972). In alcuni casi vi sono ‛giunzioni a fessura', ovvero siti dove le membrane sono fuse o strettamente addossate (v. fig. 33), che presumibilmente danno ragione della bassa resistenza elettrica. La resistenza può tuttavia essere alterata con trattamenti vari, senza chiare variazioni della morfologia (v. Rose, 1971; v. Pappas e altri, 1971).
Solamente il potenziale di azione genera abbastanza corrente da permettere la propagazione di un impulso attraverso una giunzione elettrotonica. Perciò gli effetti di una giunzione elettrica sono eccitatori, in marcato contrasto con le capacità della terminazione sinaptica di trasmettere sia l'inibizione sia l'eccitazione (v. Grundfest, Synaptic and..., 1959 e 1967). Vi è comunque un caso conosciuto d'inibizione elettrica, quello nel neurone di Mauthner. L'inibizione è indotta per stimolazione di un fascio di nervi spirali (v. Furukawa e Furshpan, 1963). Le fibre nervose sono disposte attorno all'assone amielinico della cellula di Mauthner non appena questo emerge dal segmento iniziale (v. Bodian, 1952). Perché si produca inibizione è necessario che gli impulsi nelle fibre spirali si estinguano prima di giungere alle terminazioni nervose. Vi sarà allora una corrente che diffonderà nel mezzo esterno a partire dalle terminazioni dove ha luogo l'elettrogenesi del potenziale di azione. Questa corrente, diffondendo verso l'interno attraverso la membrana della cellula di Mauthner (come nella fig. 30), iperpolarizzerebbe e deprimerebbe l'eccitabilità di quest'ultima. Questo meccanismo elettrico fu proposto per spiegare gli effetti inibitori nel sistema nervoso centrale (v. Brooks e Eccles, 1947) prima che l'esistenza delle sinapsi inibitorie fosse accettata e il loro modo di agire compreso. Eccezion fatta per la localizzazione dell'effetto inibitore dovuto alle relazioni geometriche del sistema, il meccanismo, una corrente di campo diretta verso l'interno, è analogo all'inibizione determinata dalle correnti di campo dirette verso l'interno nel midollo spinale di gatto (v. Grundfest, 1940; v. Grundfest e Magnes, 1951; v. Nelson, 1966).
bibliografia
Altamirano, M., Coates, C. W., Grundfest, H., Mechanisms of direct and neural excitability in electroplaques of electric eel, in ‟Journal of general physiology", 1955, XXXVIII, pp. 319-360.
April, S. P., Reuben, J. P., The effect of divalent cations upon the evoked and spontaneous release of excitatory transmitter at the crustacean neuromuscular junction, in ‟Federation proceedings", 1971, XXX, p. 557.
Arvanitaki, A., Effects evoked in an axon by activity of a contiguous one, in ‟Journal of neurophysiology", 1942, V, pp. 89-108.
Atwood, H. L., Crustacean neuromuscular mechanisms, in ‟American zoologist", 1967, VII, pp. 527-551.
Atwood, H. L., Morin, W.A., Neuromuscular and axoaxonal synapses of the crayfish opener muscle, in ‟Journal of ultrastructure research", 1970, XXXII, pp. 351-369.
Auerbach, A. A., Bennett, M. V. L., Chemically mediated transmission at a giant fiber synapse in the central nervous system of a vertebrate, in ‟Journal of general physiology", 1969, LIII, pp. 183-210.
Auerbch, A.A., Bennett, M. V. L., A rectifying electrotonic synapse in the central nervous system of a vertebrate, in ‟Journal of general physiology", 1969, LIII, pp. 211-237.
Baker, P.F., Hodgkin, A. L., Shaw, T. I., The effects of changes in internal ionic concentrations on the electrical properties of perfused giant axons, in ‟Juornal of physiology", 1962, CLXIV, pp. 355-374.
Barker, D. L., Herbert, E., Hildebrand, J. G., Kravitz, E. A., Acetylcholine and lobster sensory neurones, in ‟Journal of physiology", 1972, CCXXVI, pp. 205-229.
Baylor, D. A., Fuortes, M. G. F., Electrical responses of single cones in the retina of the turtle, in ‟Journal of physiology", 1970, CCVII, pp. 77-92.
Baylor, D. A., Fuortes, M. G. F., O'Bryan, P. M., Receptive fields of cones in the retina of turtle, in ‟Journal of physiology", 1971, CCXIV, pp. 265-294.
Beidler, L.M., Smallman, R. L., Renewal of cells within taste buds, in ‟Journal of cell biology", 1965, XXVII, pp. 263-272.
Bennett, M. V. L., Physiology of electrotonic junctions, in ‟Annals of the New York Academy of Sciences", 1966, CXXXVII, pp. 509-539.
Bennett, M. V. L., Comparative physiology: electric organs, in ‟Annual review of physiology", 1970, XXXII, pp. 471-528.
Bennett, M. V. L., Function of electrotonic junctions in embryonic and adult tissues, in ‟Federation proceedings", 1973, XXXII, pp. 65-75.
Bennett, M. V. L., Aljure, E., Nakajima, Y., Pappas, G. D., Electrotonic junctions between teleost spinal neurons: electrophysiology and ultrastructure, in ‟Science", 1963, CXLI, pp. 262-264.
Bennett, M. V. L., Crain, S. M., Grundfest, H., Electrophysiology of supramedullary neurons. I-III, in ‟Journal of general physiology", 1959, XLIII, pp. 159-250.
Bennett, M. V. L., Grundfest, H., The electrophysiology of electric organs of marine electric fishes. II. The electroplaques of the main and accessory organ of Narcine brasiliensis, in ‟Journal of general physiology", 1961, XLIV, pp. 805-818.
Bennett, M. V. L., Grundfest, H., The electrophysiology of electric organs of marine electric fishes. III. The electroplaques of the Stargazer, Astroscopus y-graecum, in ‟Journal of general physiology", 1961, XLIV, pp. 819-843.
Bennett, M. V. L., Grundfest, H., Electric organ discharge in the weakly electric fish, Gymnarchus niloticus, in 9th Annual Meeting Biophysical Society, 1965, p. 18.
Bennett, M. V. L., Hille, B., Obara, S., Voltage threshold in excitable cells depends on stimulus form, in ‟Journal of neurophysiology", 1970, XXXIII, pp. 585-594.
Bennett, M. V. L., Nakajima, Y., Pappas, G. D., Physiology and ultrastructure of electrotonic junctions. I-IV, in ‟Journal of neurophysiology", 1967, XXX, pp. 161-300.
Bennett, M. V. L., Wurzel, M., Grundfest, H., The electrophysiology of electric organs of marine electric fishes. I. Properties of electroplaques of Torpedo nobiliana, in ‟Journal of general physiology", 1961, XLIV, pp. 757-804.
Bodian, D., Introductory survey of neurons, in ‟Cold Spring Harbor Symposium on quantitative biology", 1952, XVII, pp. 1-13.
Bodian, D., Neurons, circuits and neuroglia, in The neurosciences. A study program (a cura di G.C. Quarton, T. Melnechuk e F. O. Schmitt), New York 1967, pp. 6-24.
Bogue, J. Y., Rosenberg, H., The rate of development and spread of electrotonus, in ‟Journal of physiology", 1934, LXXXII, p. 353.
Bois Reymond, E. du, Experimentalkritik der Entladungshypothese über die Wirkung von Nerf auf Muskel, in Gesammelte Abhandlungen zur allgemeinen Muskel- und Nervenphysik, vol. II, Leipzig 1977, pp. 698-736.
Boistel, J., Fatt, P., Membrane permeability change during inhibitory transmitter action in crustacean muscle, in ‟Journal of physiology", 1958, CXLIV, pp. 176-191.
Brooks, C. McC., Eccles, J. C., An electrical hypothesis of central inhibition, in ‟Nature", 1947, CLIX, pp. 760-764.
Brown, K. T., Wiesel, T. N., Intraretinal recording with micropipette electrodes in the intact cat eye, in ‟Journal of physiology", 1959, CXLIX, pp. 537-562.
Burn, J. H., Rand, M. J., Sympathetic postganglionic mechanism, in ‟Nature", 1959, CLXXXIV, pp. 163-165.
Byzov, . L., Trifinov, Y. A., The response to electric stimulation of horizontal cells in the carp retina, in ‟Vision research", 1968, VIII, pp. 817-822.
Cervetto, L., Influence of sodium, potassium and chloride ions on the intracellular responses of turtle photoreceptors, in ‟Nature", 1973, CCXLI, pp. 401-403.
Clark, A. W., Hurlbut, W. P., Mauro, A., Changes in the fine structure of the neuromuscular junction of the frog caused by black widow spider venom, in ‟Journal of cell biology", 1972, LII, pp. 1-14.
Cooley, J., Dodge, F., Cohen, H., Digital computer solutions for excitable membrane models, in ‟Journal of cellular and comparative physiology", 1965, LXVI, pp. 99-100.
Creed, R. S., Denny-Brown, D., Eccles, J. C., Liddell, E. G. T., Sherrington, C. S., Reflex activity of the spinal cord, Oxford 1932.
Davis, L. Jr., Lorente de nó, R., Contribution to the mathematical theory of the electrotonus, in A study of nerve physiology. I. (a cura di R. Lorente de Nó), New York 1947, pp. 442-496.
Dowling, J. E., Ripps, H., Effect of magnesium on horizontal cell activity in the skate retina, in ‟Nature", 1973, CCXLII, pp. 101-103.
Dowling, J. E., Werblin, F. S., Organization of the retina of the mudpuppy Necturus maculosus. I., in ‟Journal of neurophysiology", 1969, XXXII, pp. 315-338.
Eccles, J. C., The physiology of synapses, Berlin 1964.
Edwards, C., Ottoson, D., The site of impulse initiation in a nerve cell of a crustacean stretch receptor, in ‟Journal of physiology", 1958, CXLIII, pp. 138-148.
Elmqvist, D., Feldman, D. S., Spontaneous activity at a mammalian neuromuscular junction in tetrodotoxin, in ‟Acta physiologica scandinavica", 1965, LXIV, pp. 475-477.
Elul, R., Miledi, R., Stefani, E., Neural control of contracture in slow muscle fibers of the frog, in ‟Acta physiologica latinoamericana", 1970, XX, pp. 194-226.
Enero, M. A., Langer, S. Z., Rothlin, R. R., Stefano, F. J. E., Role of alpha-adrenoceptor in regulating noradrenaline overflow by nerve stimulation, in ‟British journal of pharmacology", 1972, XLIV, pp. 672-688.
Epstein, R., Grundfest, H., Desensitization of gamma aminobutyric acid (GABA) receptors in muscle fibers of crab Cancer borealis, in ‟Journal of general physiology", 1970, LVI, pp. 33-45.
Erlanger, J., Blair, E. A., Manifestation of segmentation in myelinated axons, in ‟American journal of physiology", 1934, CX, pp. 287-311.
Euler, C. von, Skoglund, S., Söderberg, U. (a cura di), Structure and function of inhibitory neuronal mechanisms, London 1968.
Fadiga, E., Brookhart, J. M., Interaction of excitatory p.s.p.'s generated at different sites of the frog motoneurons, in ‟Journal of neurophysiology", 1962, XXV, pp. 790-805.
Fambrough, D. M., Acetylcholine sensitivity of muscle fiber membrane: mechanism of regulation by motoneurons, in ‟Science", 1970, CLXVIII, pp. 372-373.
Farquhar, M G., Palade, G. E., Junctional complexes in vairous epithelia, in ‟Journal of cell biology", 1963, XVII, pp. 375-412.
Fex, J., Auditory activity in centrifugal and centerpetal fibers in cat: a study of a feedback system, in ‟Acta physiologica scandinavica", 1962, CLXXXIX, suppl., pp. 1-68.
Fex, J., Efferent inhibition in the cochlea related to hair cell D. C. activity of the crossed olivo-cochlear fibers in the cat, in ‟Journal of the Acoustical Society of America", 1967, XLI, pp. 666-675.
Flock, A., Sensory transduction in hair cells, in Handbook of sensory physiology. I. Principles of receptor physiology (a cura di W. A. Loewenstein), Berlin 1971, pp. 1-60.
Freeman, A. R., Reuben, J. P., Brandt, P. W., Grundfest, H., Osmometrically determined characteristics of the cell membrane of squid and lobster giant axons, in ‟Journal of general physiology", 1966, L, pp. 423-445.
Fuortes, M. G. F., Schwartz, E. A., Simon, E. J., Colour dependence of cone responses in the turtle retina, in ‟Journal of physiology", 1973, CCXXXIV, pp. 199-216.
Furshpan, E. J., Potter, D. D., Transmission at the giant motor synapses of the crayfish, in ‟Journal of physiology", 1959, CXLV, pp. 289-325.
Furukawa, T., Furshpan, E. J., Two inhibitory mechanisms in the Mauthner neurons of goldfish, in ‟Journal of neurophysiology", 1963, XXVI, pp. 140-176.
Furukawa, T., Ishii, Y., Neurophysiological studies on hearing in goldfish, in ‟Journal of neurophysiology", 1967, XXX, pp. 1377-1403.
Gainer, H., Reuben, J. P., Grundfest, H., The augmentation of postsynaptic potentials in crustacean muscle fibers by cesium. A presynaptic mechanism, in ‟Comparative biochemistry and physiology", 1967, XX, pp. 877-900.
Gasser, H. S., Unmedullated fibers originating in dorsal root ganglia, in ‟Journal of general physiology", 1950, XXXIII, pp. 651-690.
Gasser, H. S., Grundfest, H., Action and excitability in Mammalian A fibers, in ‟American journal of physiology", 1936, CXVII, pp. 113-133.
Gasser, H. S., Grundfest, H., Axon diameters in relation to the spike dimensions and conduction velocity in Mammalian A fibers, in ‟American journal of physiology", 1939, CXXVII, pp. 393-414.
Geren, B. B., The formation from the Schwann cell surface of myelin in the peripheral nerves of chick embryos, in ‟Experimental cell research", 1954, VII, pp. 558-562.
Gerschenfeld, H. M., Chemical transmission in Invertebrate central nervous systems and neuromuscular junctions, in ‟Physiological reviews", 1973, LIII, pp. 1-119.
Ginsborg, B. L., Hamilton, J. T., The effect of cesium ions on neuromuscular transmission in the frog, in ‟Quarterly journal of experimental physiology", 1968, LIII, p. 162.
Girardier, L., Reuben, J. P., Grundfest, H., Changes in membrane properties of crayfish muscle fibers caused by denervation, in ‟Federation proceedings", 1962, XXI, p. 357.
Gola, M., Romey, G., Réponses anomales à des courants sous-liminaires de certaines membranes somatiques (neurones géants d'Helix pomatia), in ‟Pflügers Archiv", 1971, CCCXXVII, pp. 105-131.
Gorman, A. L. F., Mirolli, M., The passive electrical properties of the membrane of a molluscan neurone, in ‟Journal of physiology", 1972, CCXVII, pp. 35-59.
Grampp, W., The impulse ctivity in different parts of the slowly adapting stretch receptor neuron of the lobster, in ‟Acta physiologica scandinavica", 1966, LXVI, suppl. 262, pp. 1-36.
Grampp, W., Haris, J. B., Thesleff, S., Inhibition of denervation changes in skeletal muscle by blockers of protein synthesis, in ‟Journal of physiology", 1972, CXXI, pp. 743-754.
Granit, R., Receptors and sensory perception, New Haven 1955.
Grundfest, H., Excitability of the single fibre nerve-muscle complex, in ‟Journal of physiology", 1972, CXXI, pp. 743-754.
Granit, R., Receptors and sensory perception, New Haven 1955.
Grundfest, H., Excitability of the single fibre nerve-muscle complex, in ‟Journal of physiology", 1932, LXXVI, pp. 95-115.
Grundfest, H., Properties of mammalian B fibers, in ‟American journal of physiology", 1939, CXXVII, pp. 252-262.
Grundfest, H., Bioelectric potentials, in ‟Annual review of physiology", 1940, II, pp. 213-242.
Grundfest, H., Mechanisms and properties of bioelectric potentials, in Modern trends in physiology and biochemistry (a cura di E. S. G. Barron), New York 1952, pp. 193-228.
Grundfest, H., Electric field effects and synaptic potentials in the functioning of the nervous system, in Problems of modern physiology of the nerve and muscle systems, Tbilisi 1956, pp. 81-97.
Grundfest, H., Electrical inexcitability of synapses and some of its consequences in the central nervous system, in ‟Physiological reviews", 1957, XXXVII, pp. 337-361.
Grundfest, H., An electrophysiological basis for cone vision in fish, in ‟Archives italiennes de biologie", 1958, XCLVI, pp. 135-144.
Grundfest, H., Evolution of conduction in the nervous system, in Evolution of nervous control (a cura di A. D. Bass), Washington 1959, pp. 43-86.
Grundfest, H., Synaptic and ephaptic transmission, in Handbook of physiology (a cura di J. Field), vol. I, Neurophysiology, Washington 1959, pp. 147-197.
Grundfest, H., Excitation by hyperpolarizing potentials. A general theory of receptor activities, in Nervous inhibition (a cura di E. Florey), London 1961, pp. 326-341.
Grundfest, H., General physiology and pharmacology of junctional transmission, in Biophysics of physiological and pharmacological actions (a cura di A. M. Shanes), Washington 1961, pp. 329-389.
Grundfest, H., Ionic mechanisms in electrogenesis, in ‟Annals of the New York Academy of Sciences", 1961, XCIV, pp. 405-407.
Grundfest, H., Comparative electrobiology of excitable membranes, in Advances in comparative physiology and biochemistry (a cura di O. E. Lowenstein), vol. II, New York 1966, pp. 1-116.
Grundfest, H., Heterogeneity of excitable membrane: electrophysiological and pharmacological evidence and some consequences, in ‟Annals of the New York Academy of Sciences", 1966, CXXXVII, pp. 901-949.
Grundfest, H., Comparative physiology of electric organs of elasmobranch fishes, in Sharks, skates and rays (a cura di P. W. Gilbert, R. F. Mathewson e D. P. Rall), Blatimore 1967, pp. 399-432.
Grundfest, H., Some comparative biological aspects of membrane permeability control, in ‟Federation proceedings", 1967, XXVII, pp. 1613-1626.
Grundfest, H., Synaptic and ephaptic transmission, in The neurosciences. A study program (a cura di G. C. Quarton, T. Melnechuk e F. O. Schmitt), New York 1967, pp. 353-372.
Grundfest, H., Synaptic and ephaptic transmission, in The structure and function of nervous tissues (a cura di G. H. Bourne), vol. II, New York 1969, pp. 464-491.
Grundfest, H., The general electrophysiology of input membrane in electrogenic excitable cells, in handbook of sensoryphysiology. I. Principles of receptor physiology (a cura di W. R. Loewenstein), Berlin 1971, pp. 135-165.
Grundfest, H., Campbell, B., Origin, conduction and termination of impulses in the dorsal spino-cerebellar tract of cats, in ‟Journal of neurophysiology", 1942, V, pp. 275-294.
Grundfest, H., Gasser, H. S., Properties of Mammalian nerve fibers of slowest conduction, in ‟American journal of physiology", 1938, CXXIII, pp. 307-318.
Grundfest, H., Magnes, J., Excitability changes in dorsal roots produced by electrotonic effects from adjacent afferent activity, in ‟American journal of physiology", 1951, CLXIV, pp. 502-508.
Grundfest, H., Oester, Y. T., Beebe, G. W., Electrical evidence of regeneration, in Peripheral nerve regeneration (a cura di B. Woodhall e G. W. Beebe), Washington 1956, cap. IV.
Grundfest, H., Purpura, D. P., Inexcitability of cortical dendrites to electric stimuli, in ‟Nature", 1956, CLXXVIII, pp. 416-417.
Grundfest, H., Reuben, J. P., Neuromuscular synaptic activity in lobster, in Nervous inhibition (a cura di E. Florey), London 1961, pp. 92-104.
Grundfest, H., Reuben, J. P., Rickles, W. H. Jr., The electrophysiology and pharmacology of lobster neuromuscular synapses, in ‟Journal of general physiology", 1959, XLII, pp. 1301-1323.
Guth, L., The effects of glossopharyngeal nerve transection on the circumvallate papilla of the rat, in ‟Anatomical record", 1967, CXXVIII, pp. 715-731.
Guth, L., ‛Trophic' influences of nerve on muscle, in ‟Physiological reviews", 1968, XLVIII, pp. 648-687.
Guttman, R., The effect of temperature on the function of excitable membranes, in Biophysics and physiology of excitable membranes (a cura di W. J. Adelman jr.), New York 1971, pp. 320-326.
Guttman, R., Barnhill, R., Oscillation and repetitive firing in squid axons, in ‟Journal of general physiology", 1970, LV, pp. 104-118.
Hagiwara, S., Oomura, Y., The critical depolarization for the spike in the squid giant axon, in ‟Japanese journal of physiology", 1958, VIII, pp. 234-245.
Hartline, H. K., Ratliff, F., Mille, W. H., Inhibitory interaction in the retina and its significance in vision, in Nervous inhibition (a cura di E. Florey), London 1961, pp. 241-284.
Hermann, L., Allgemeine Nervenphysiologie, in handbuch der Physiologie, vol. II, Leipzig 1879, pp. 1-196.
Hermann, L., Zur Theorie der Erregungsleitung und der elektrischen Erregung, in ‟Pflügers Archiv", 1899, LXXV, pp. 575-590.
Hess, A., Pilar, G., Weakly, J. N., Correlation between transmission and structure in avian ciliary ganglion synapses, in ‟Journal of physiology", 1969, CCII, pp. 339-354.
Hodgkin, A. L., The local electric changes associated with repetitive action in a non-medullated axon, in ‟Journal of physiology", 1948, CVII, pp. 175-181.
Hodgkin, A. L., A note on conduction velocity, in ‟Journal of physiology", 1954, CXXV, pp. 221-224.
Hodgkin, A. L., The conduction of the nervous impulse, Liverpool 1964.
Hodgkin, A. L., Huxley, A. F., A quantitative description of membrane current and its application to conduction and excitation in nerve, in ‟Journal of physiology", 1952, CXVII, pp. 500-544.
Hodgkin, A. L., Huxley, A. F., Katz, B., Measurement of current-voltage relations in the membrane of the giant axon of Loligo, in ‟Journal of physiology", 1952, CXVII, pp. 424-448.
Hodgkin, A. L., Rushton, W. A. H., The electrical constants of a crustacean nerve fibre, in ‟Proceedings of the Royal Society" (Series B), 1946, CXLIV, pp. 444-479.
Hodler, J., Stämpfli, R., Tasaki, I., The role of the potential wave spreading along the myelinated nerve fiber in excitation and contraction, in ‟American journal of physiology", 1952, CLXX, pp. 375-389.
Holtzman, E., Freeman, A. R., Kashner, L. A., Stimulation-dependent alterations in peroxidase uptake at lobster neuromuscular junctions, in ‟Science", 1971, CLXXIII, pp. 733-736.
Hurlbut, W. P., Longenecker, H. B. Jr., Mauro, A., Effects of calcium and magnesium on the frequency of miniature end-plate potentials during prolonged tetanization, in ‟Journal of physiology", 1971, CCXIX, pp. 17-38.
Hursh, J. B., Conduction velocity and diameter of nerve fibes, in ‟American journal of physiology", 1939, CXXVII, pp. 131-139.
Huxley, A. F., Stämpfli, R., Evidence for saltatory conduction in peripheral myelinated fibers, in ‟Journal of physiology", 1949, CVIII, pp. 315-339.
Jahromi, S. S., Atwood, H. L., Electrical coupoling and growth in lobster muscle fibers, in ‟Canadian journal of zoology", 1971, XLIX, pp. 1029-1034.
Johnson, G. E., Giant nerve fibers in crustaceans with special reference to Cambarus and Palaemonetes, in ‟Journal of comparative neurology", 1924, XXXVI, pp. 323-374.
Kao, C. Y., Grundfest, H., Postsynaptic electrogenesis in septate giant axons. I. Earthworm median giant axon, in ‟Journal of neurophysiology", 1957, XX, pp. 553-573.
Katz, B., The release of neural transmitter substances, Liverpool 1969.
Katz, B., Schmitt, O. H., Electric interaction between two adjacent nerve fibres, in ‟Journal of physiology", 1940, XCVII, pp. 471-488.
Katz, B., Thesleff, S., A study of the ‛desensitization' produced by acetylcholine at the motor end-plate, in ‟Journal of physiology", 1957, CXXXVIII, pp. 63-80.
Kawai, N., Mauro, A., Grundfest, H., Effect of black widow spider venom on the lobster neuromuscular junctions, in ‟Journal of general physiology", 1972, LX, pp. 658-664.
Kimura, K., Beidler, L. M., Microelectrode study of taste receptors of rat and hamster, in ‟Journal of cellular and comparative physiology", 1961, LVIII, pp. 131-140.
Kravitz, E. A., Acetylcholine, γ-aminobutyric acid, and glutamic acid: physiological and chemical studies related to their roles as neurotransmitter agents, in The neurosciences. A study program (a cura di G. C. Quarton, T. Melnechuk e F. O. Schmitt), New York 1967, pp. 433-444.
Kreutzberg, G. W., Schubert, P., Lux, H. D., Neuronal activity and neuroplasmic transport. Abstact in Golgi centennial symposium of the ‛Reazione Nera', 1973.
Kuffler, S. W., Discharge patterns and functional organization of Mammalian retina, in ‟Journal of neurophysiology", 1953, XVI, pp. 37-68.
Kusano, K., Electrical activity and structural correlates of giant nerve fibers in Kuruma shrimp (Penaeus japonicus), in ‟Journal of cell physiology", 1966, LXVIII, pp. 361-384.
Kusano, K., La Vail, M. M., Impulse conduction in the shrimp medullated giant fiber with special reference to the structure of functionally excitable areas, in ‟Journal of comparative neurology", 1971, CXLII, pp. 481-494.
Landmesser, L., Pilar, G., Selective reinnervation of two cell populations in the adult pigeon ciliary ganglion, in ‟Journal of physiology", 1970, CCXI, pp. 203-216.
Lang, F., Atwood, H. L., Crustacean neuromuscular mechanisms: functional morphology of nerve terminals and the mechanism of facilitation, in ‟American zoologist", 1973, XIII, pp. 337-355.
Lapicque, L., L'excitabilité en fonction du temps, Paris 1926.
Lehmann, J. E., The effect of changes in the potassium-calcium balance on the action of Mammalian A nerve fibers, in ‟American journal of physiology", 1937, CXVIII, p. 693.
Levi-Montalcini, R., Angeletti, P. U., Nerve growth factor, in ‟Physiological reviews", 1968, XLVIII, pp. 534-569.
Liley, A. W., The effects of presynaptic polarization on the spontaneous activity at the mammalian neuromuscular junction, in ‟Journal of physiology", 1956, CXXXIV, pp. 427-443.
Lillie, R. S., Factors affecting transmission and recovery in the passive iron nerve model, in ‟Journal of general physiology", 1925, VII, pp. 473-507.
Lloyd, D. P. C., Stimulation of peripheral nerve terminations by active muscle, in ‟Journal of neurophysiology", 1942, V, pp. 153-165.
Loewenstein, W. R., Membrane junctions in growth and differentiation,in ‟Federation proceedings", 1973, XXXII, pp. 60-64.
Longenecker, H. E., Hurlbut, W. P., Mauro, A., Clark, A. W., Effects of black widow spider venom on the frog neuromuscular junction, in ‟Nature", 1970, CCXXV, pp. 701-703.
Mc Donald, W. I., Structural and functional change in human and experimental neuropathy, in Modern trends in neurology (a cura di D. Williams), vol. IV, London 1967, pp. 145-164.
Marrazzi, A. S., Lorente de Nó, R., Interaction of neighboring fibers in myelinated nerve, in ‟Journal of neurophysiology", 1944, VII, pp. 83-102.
Marwitt, R., Pilar, G., Weakly, J. N., Characterization of two ganglion cell populations in avian ciliary ganglia, in ‟Brain research", 1971, XXV, pp. 317-334.
Mathewson, R.F., Mauro, A., Amatniek, E., Grundfest, H., Morphology of main and accessory electric organs of Narcine brasiliensis (Olfers) and some correlations with their electrophysiological properties, in ‟Biological bulletin", 1958, XV, pp. 126-135.
Mathewson, R. F., Wachtel, A., Grundfest, H., Comparative study of fine structure in electroplaques, in Bioelectrogenesis (a cura di C. Chagas e A. Paeas de Carvalho), Amsterdam 1961, pp. 25-53.
Miledi, R., Stefani, E., Steinbach, A. B., Induction of the action potential mechanism in slow muscle fibres of the frog, in ‟Journal of physiology", 1971, CCXVII, pp. 737-754.
Morlock, N. L., Benamy, D. A., Grundfest, H., Analysis of spike electrogenesis of eel electroplaques with phase plane and impedance measurementes, in ‟Journal of general physiology", 1968, LII, pp. 22-45.
Nakajima, S., Adaptation in stretch receptor neurons of crayfish, in ‟Science", 1964, CXLVI, pp. 1168-1170.
Nakajima, S., Onodera, K., Adaptation of generator potential in the crayfish stretch receptors under constant length and constant tension, in ‟Journal of physiology", 1969, CC, pp. 187-204.
Nakajima, S., Onodera, K., membrane properties of stretch receptor neurones of crayfish with particular reference to mechanisms of sensory adaptation, in ‟Journal of physiology", 1969, CCXX, pp. 161-185.
Nakajima, Y., Tisdale, A. D., Henkart, M. P., Presynaptic inhibition at inhibitory nerve terminals. A new synapse in the crayfish stretch receptor, in ‟Proceedings of the National Academy of Science", 1973, LXX, pp. 2462-2466.
Nakamura, Y., Nakajima, s., Grundfest, H., Analysis of spike electrogenesis and depolarizing K-inactivation in electroplaques of Electrophorus electricus L.,in ‟Journal of general physiology", 1965, XLIX, pp. 321-349.
Narahashi, T., The properties of Insect axons, in Advances in Insect physiology (a cura di J. W. L. Beament, J. E. Treherne e V. B. Wigslesworth), vol. I, New York 1963, pp. 175-256.
Nelson, P. G., Interaction between spinal motoneurons of the cat, in ‟Journal of neurophysiology", 1966, XXIX, pp. 275-287.
Noble, D., Stein, R. B., The thershold conditions for initiation of action potentials by excitable cells, in ‟Journal of physiology", 1966, CLXXXVII, pp. 129-162.
Ochs, S., Fast axoplasmic transport of materials in Mammalian nerve and its integrative role, in ‟Annals of the New York Academy of Sciences", 1972, CXCV, pp. 43-58.
Ochs, S., Axoplasmic transport and energy metabolism and mechanism, in Peripheral nervous system (a cura di J. I. Hubbard), New York 1974, cap. III.
Offner, F., Weinberg, A., Young, G., Nerve conduction theory: some mathematical consequences of Bernstein's model, in ‟Bulletin of mathematical biophysics", 1940, II, pp. 89-103.
Oikawa, T., Spyropoulos, C. S., Tasaki, I., Teorell, T., Methods for perfusing the giant axon of Loligo pealii, in ‟Acta physiologica scandinavica", 1961, LXII, pp. 195-196.
Ozeki, M., Conductance change associated with receptor potentials of gustatory cell in rat, in ‟Journal of general physiology", 1971, LVIII, pp. 688-699.
Ozeki, M., Freeman, A. R., Grundfest, H., The membrane components of crustacean neuromuscular systems. I. Immunity of different electrogenic components to tetrodotoxin and saxitoxin, in ‟Journal of general physiology", 1966, XLIX, pp. 1319-1334.
Pappas, G. D., Asada, Y., Bennett, M. V. L., Morphological correlates of increased coupling resistance at an electronic synapse, in ‟Journal of cell biology", 1971, XLIX, pp. 173-188.
Pappas, G. D., Purpura, D. P. (a cura di), Structure and function of synapses, New York 1972.
Purpura, D. P., Grundfest, H., Nature of dendritic potentials and synaptic mechanisms in cerebral cortex of cat, in ‟Journal of neurophysiology", 1956, XIX, pp. 573-595.
Rall, W., Burke, R.E., Smith, T. G., Nelson, P. G., Frank, K., Dendritic location of synapses and possible mechanisms for the monosynaptic EPSP in motoneurons, in ‟Journal of neurophysiology", 1967, XXX, pp. 1169-1193.
Rang, H. P., Ritchie, J. M., On the electrogenic sodium pump in Mammalian non-myelinated nerve fibres and its activation by various external cations, in ‟Journal of physiology", 1968, CXCLI, pp. 183-221.
Rasminsky, M., Sears, T.A., Internodal conduction in undissected demyelinated nerve fibres, in ‟Journal of physiology", 1972, CCXXVII, pp. 323-350.
Redfern, P., Thesleff, S., Action potential generation in denervated rat skeletal muscle. II. The action of tetrodotoxin, in ‟Acta physiologica scandinavica", 1971, LXXXII, pp. 70-78.
Reuben, J. P., Electrotonic connections between lobster muscle fibers, in ‟Biological bulletin", 1960, CXIX, p. 334.
Reuben, J. P., Grundfest, H., Inhibitory and excitatory miniature postsynaptic potentials in lobster muscle fibers, in ‟Biological bulletin", 1960, CXIX, p. 335.
Reuben, J. P., Grundfest, H., The action of cesium ions on neuromuscular transmission in lobster, in ‟Biological bulletin", 1960, CXIX, p. 336.
Robertson, J. D., The molecular structure and contact relationship of cell membranes, in ‟Progress in biophysics", 1960, X, pp. 344-418.
Rose, B., Intecellular communication and some structural aspects of membrane junctions in a simple cell system, in ‟Journal of membrane biology", 1971, V, pp. 1-19.
Rosenblueth, A., Wiener, N., Pitts, W., Garcia Ramos, J., An account of the spike potential of axons, in ‟Journal of cellular and comparative physiology", 1948, XXXII, pp. 275-318.
Ruch, T. C., Patton, H. D., Woodbury, J. W., Towe, A. L. (a cura di), Neurophysiology, Philadelphia 19662.
Ruiz-Manresa, F., Ruarte, A. C., Schwartz, T. L., Grundfest, H., Potassium inactivation and impedance changes during spike electrogenesis in eel electroplaques, in ‟Journal of general physiology", 1970, LV, pp. 37-47.
Rushton, W. A. H., A theory of the effects of fibre size in medullated nerve, in ‟Journal of physiology", 1951, CXV, pp. 101-122.
Sokolar, S. J., Cell coupling in epithelia, in ‟Experimental eye research", 1973, XV, pp. 693-698.
Sorenson, M. M., The free amino acids in peripheral nerves and in isolated inhibitory and excitatory nerve fibres of Cancer magister, in ‟Journal of neurochemistry", 1973, XX, pp. 1231-1245.
Stämpfli, R., Bau und Funktion isolierter markhaltiger Nervenfasern, in ‟Ergebnisse der Physiologie", 1952, XLVII, p. 70.
Stefani, E., Schmidt, H., Early stage of re-innervation of frog slow muscle fibers, in ‟Pflügers Archiv", 1972, CCCXXXVI, pp. 271-275.
Stefani, E., Steinbach, A. B., Resting potential and electrical properties of frog slow muscle fibres. Effect of different external solutions, in ‟Journal of physiology", 1969, CCIII, pp. 383-401.
Stein, R. B., The frequency of nerve action potentials generated by applied currents, in ‟Proceedings of the Royal Society" (Series B), 1967, CLXVII, pp. 64-86.
Stough, H. B., Giant nerve fibers of the earthworm, in ‟Journal of comparative neurology", 1926, XL, pp. 409-463.
Tasaki, I., Nervous transmission, Springfield, Ill., 1953.
Tasaki, I., Conduction of the nerve impulse, in Handbook of physiology (a cura di J. Field), vol. I, Neurophysiology, Washington 1959, pp. 75-121.
Thesleff, S., Nevous control of chemosensitivity in muscle, in ‟Annals of the New York Academy of Sciences", 1961, XCIV, pp. 535-546.
Thrushk, D.C., Autonomic dysfunction in four patients with congenital insensitivity to pain, in ‟Brain", 1973, XCVI, pp. 591-600.
Tomita, T., Electrical activity of Vertebrate photoreceptors, in ‟Quarterly review of biophysics", 1970, III, pp. 179-222.
Uchizono, K., Inibitory synapses on the stretch receptor neurone of the crayfish, in ‟Nature", 1967, CCXIV, pp. 833-834.
Watanabe, A., Grundfest, H., Impulse propagation at the septal and commisural junctions of crayfish lateral giant axons, in ‟Journal of membrane biology", 1971, V, 345-365.
Zaimis, E., Knight, J. (a cura di), Nerve growth factor and its antiserum, London 1972.