Neuroscienze
Neuroscienze
Parte introduttiva
di Pietro Calissano
Per neuroscienze si intende quell'insieme di discipline che studiano come è organizzato e come funziona il sistema nervoso, con particolare riferimento al cervello (v. a questo proposito la voce nervoso, sistema nell'Enciclopedia Italiana e nelle varie Appendici, e nell'App. V, neuroendocrinologia, iii, p. 657 e neurobiologia, iii, p. 653, per la quale v. anche oltre).
Ci si è domandato come possa lo sperimentatore essere al tempo stesso soggetto e oggetto della propria osservazione. Negli ultimi decenni, con la crescita, sviluppatasi a ritmo esponenziale, delle conoscenze nel campo delle scienze della vita, anche gli studi sul cervello hanno realizzato enormi progressi. Attualmente non si pone più il problema se sia possibile comprendere come funziona il cervello; il quesito è quando, in termini concreti, ciò sarà portato a compimento. Da quando l'uomo ha preso coscienza delle rimarchevoli prestazioni del suo cervello, uno dei temi prediletti di discussione - di filosofi prima e di scienziati nel 20° secolo - è se attività 'mentali' come il pensiero, le emozioni, l'autocoscienza, la volontà, siano funzioni differenti dalle attività 'cerebrali' (il movimento di un arto, la percezione di un colore ecc.) o se anch'esse rappresentino espressioni funzionali delle cellule nervose o neuroni che costituiscono il nostro cervello. Secondo i sostenitori di questa dicotomia, un semplice atto motorio come la flessione della gamba e l'atto volontario che governa questo gesto scaturiscono da 'entità' e si esplicano con meccanismi completamente differenti tra loro. La posizione di coloro che negano tale dualismo sostiene che le attività mentali e quelle cerebrali sono semplicemente espressioni dell'organo cervello diverse nella qualità e nei modi con cui si manifestano, ma che sono tutte dovute a uno stesso meccanismo, con il quale i neuroni comunicano fra loro e con il resto dell'organismo. Da quando questi due punti di vista si sono affermati e consolidati, si sono andate delineando due discipline distinte e spesso non comunicanti. Da una parte, la neurologia si è preoccupata di studiare funzioni e patologie del cervello, dall'altra la psichiatria si è dedicata a tempo pieno ai problemi della mente (v. memoria, XXII, p. 829, ripresa nelle App. IV e V, e cervello, IX, p. 829, ripresa in questa Appendice). Le rispettive discipline hanno in seguito generato - come spesso avviene, per motivi comprensibili ma non sempre nobili - delle sottodiscipline: dalla neurologia sono gemmate la neurofisiologia, la neurochimica (v. oltre: Comunicazione interneuronale), la neurofarmacologia e in genere tutti gli studi che sono preceduti dal prefisso neuro-; dalla psichiatria sono nate la psicologia, la psicoanalisi e in genere tutte le discipline che iniziano con il prefisso psico- (v. App. V e in questa Appendice). La distinzione fra attività mentali e attività cerebrali, pur essendo ancora operativa nella terminologia corrente, alla luce delle attuali conoscenze appare artificiosa a chi pratica una delle numerose discipline che costituiscono le n., poiché le une e le altre sono l'espressione unica e indivisibile dell'attività degli elementi neuronali e gliali che costituiscono l'organo cervello.
Secondo questa concezione, le attività cosiddette mentali debbono essere considerate proprietà emergenti, frutto di una somma talmente complessa di attività neuronali più semplici da costituire un salto qualitativo sostanzialmente ancora indecifrabile. Nata con Cartesio e ancora oggi sostenuta da tutti coloro che considerano il cervello dell'uomo come frutto di un salto evolutivo di natura scientificamente inaccessibile, questa dicotomia fra attività nervose e attività mentali non ha più, pertanto, ragion d'essere.
È bene ricordare, a questo proposito, che la vita stessa può essere considerata una proprietà emergente, espressione delle innumerevoli attività chimico-molecolari che si svolgono all'interno delle cellule; nessuna di queste attività, presa singolarmente, ha i connotati della vita, essendo una semplice attività enzimatica o di altra natura non vitale, ma nel loro insieme coordinato e organizzato entro i confini delle membrane cellulari queste attività permettono l'emergere e l'affermarsi di funzioni vitali.
L'ipotesi di lavoro che costituisce il fondamento delle n. è che, nello stesso modo in cui si vanno progressivamente e rapidamente delucidando tutte le proprietà che sono alla base della vita, così, in un futuro non lontano, si potranno conoscere tutte le proprietà del cervello che sono alla base dei processi 'mentali'. Analizzeremo brevemente gli approcci disciplinari delle n. che in questi decenni hanno fornito, e si presume forniranno in futuro, le conoscenze più utili a questo scopo.
Semplificando un problema altrimenti estremamente complesso, possiamo dividere le funzioni cerebrali in tre grandi livelli.
Il primo livello riguarda i meccanismi con i quali i neuroni, che nella misura di circa 100 miliardi formano l'encefalo, comunicano fra loro tramite un codice di natura particolare. Questo codice è basato sull'impiego di due 'simboli' di natura completamente differente: a) un insieme di sostanze chimiche denominate neurotrasmettitori o mediatori chimici; b) impulsi elettrici, variabili di frequenza ma non di intensità, che prendono il nome di potenziali d'azione.
Un potenziale d'azione si genera nel corpo del neurone in seguito a stimolazioni provenienti da altri neuroni e si propaga lungo le fibre nervose fino a giungere alle sue appendici più lontane dette sinapsi. All'interno delle sinapsi si trovano uno o più neurotrasmettitori che, quando giunge il potenziale d'azione, vengono liberati, diffondono nello spazio compreso fra porzione presinaptica e porzione postsinaptica, si legano a recettori situati nella membrana postsinaptica e, così facendo, provocano la generazione di un secondo potenziale d'azione. Questo eccita un altro neurone che genera a sua volta un altro potenziale d'azione e così via. Vi sono neurotrasmettitori i quali, invece di permettere il passaggio del potenziale da una sinapsi a un'altra, lo bloccano a livello della sinapsi ove sono liberati. Per questo motivo sono denominati neurotrasmettitori inibitori, mentre gli altri sono di natura eccitatoria (fig. 2). Tramite questo sistema di comunicazione (che nella realtà è molto più complesso di quanto qui riassunto per brevità), impiegato dai neuroni di tutti gli organismi viventi, queste cellule altamente specializzate comunicano fra loro e con il resto dell'organismo.
Sulla base di studi di varia natura si è ipotizzato che numerose malattie 'mentali', come le depressioni e la schizofrenia, siano provocate da alterazioni quantitative (nel caso delle depressioni) o qualitative (nel caso della schizofrenia) del funzionamento della parte chimica del codice di comunicazione neuronale. Grazie alle importanti conquiste di quelle parti delle n. denominate neurofisiologia, neurochimica e neurofarmacologia, si è ideato un crescente numero di farmaci che aiutano a tenere sotto controllo, e talvolta a rendere prive dei sintomi più dolorosi e socialmente invalidanti, queste malattie, che colpiscono nella misura del 4÷5% la collettività umana di ogni parte del globo (v. psichiatria, in questa Appendice).
Altre discipline, come la biologia dello sviluppo e la genetica, hanno consentito alle n. di ottenere brillanti risultati nell'analisi di questo primo livello di funzioni cerebrali. Queste discipline analizzano i meccanismi che presiedono alla formazione delle cellule nervose e delle cellule gliali a partire dai primi abbozzi del sistema nervoso. Il problema centrale di questi studi è quello di valutare quali sono le componenti genetiche e quali le influenze epigenetiche che presiedono alla progressiva specializzazione funzionale dei neuroni, e alla formazione di quel complesso intreccio di fibre nervose che costituisce un esempio finora insuperato di miniaturizzazione, tale da formare un insieme di circuiti dotati di circa 10¹⁵ contatti sinaptici in poco più di un chilogrammo di massa cellulare. Ciò che emerge dall'insieme di questi studi è che, in grandi linee, i circuiti e la loro realizzazione sono codificati nel genoma dell'animale, mentre gli stimoli ambientali svolgono un ruolo fondamentale per la definitiva realizzazione dei collegamenti sinaptici.
Nell'ultimo decennio, poi, si è affrontato il problema del perché, nel corso dello sviluppo del sistema nervoso, circa la metà dei neuroni generati vada incontro a morte prematura, obbedendo a un programma interno, contenuto nei geni di ogni cellula ma attivato da stimoli provenienti dal mondo esterno. L'esistenza di tale programma di morte, anche denominato apoptosi (dal greco ἀπόπτωσιϚ, che sta a indicare la caduta delle foglie; v. cellula, in questa Appendice), che coinvolgendo la stessa cellula che lo attiva riveste i connotati del suicidio, ha suscitato numerose riflessioni e speculazioni. Nell'ultimo decennio si è potuta fornire una risposta precisa circa il motivo di tale massiccia morte di intere popolazioni di neuroni. E si è scoperto che questo evento costituisce una variante della più generale e feroce selezione darwiniana del più adatto alla sopravvivenza. Nel corso dello sviluppo ogni neurone tenta di stabilire dei collegamenti con altri neuroni secondo meccanismi in parte codificati geneticamente e in parte determinati su istruzioni esterne. Questi collegamenti servono a inibire, tramite mezzi differenti e di varia natura, il programma di morte, che rimane tuttavia sempre in agguato e pronto ad attivarsi per eliminare la cellula. Se questi collegamenti risultano inappropriati o tali da non essere in grado di inibire il programma di morte, questo viene attivato e il neurone viene fagocitato da apposite cellule. Con questo meccanismo la natura garantisce l'eliminazione di ogni cellula 'inutile' in quanto non collegata funzionalmente con le altre. Si pensa che molte malattie degenerative del sistema nervoso, come il morbo di Parkinson e il morbo di Alzheimer, siano dovute all'attivazione impropria di questi programmi di morte, i quali causano la scomparsa di intere popolazioni di cellule che presiedono a funzioni cognitive come la memoria e lo stesso pensiero.
Il secondo livello di attività nervose riguarda i meccanismi mediante i quali i neuroni, organizzati in reti, gangli, centri e altre strutture altamente complesse, elaborano gli impulsi nervosi, li memorizzano, se necessario, ed emettono delle risposte comportamentali come il movimento in generale, la ricerca del cibo, l'accoppiamento, la fuga di fronte al pericolo ecc. Le unità di base di questi sistemi di elaborazione a livello della corteccia cerebrale sono le strutture colonnari, presenti nella corteccia dei mammiferi in quantità proporzionale al numero dei neuroni (fig. 3). Si calcola che ognuna di queste strutture sia composta da un minimo di 500 a un massimo di 10.000 neuroni. Una colonna costituisce una specie di modulo di computo; è collegata con altre colonne adiacenti o con quelle lontane, situate in altre aree corticali. Tramite questa organizzazione il cervello elabora l'informazione contemporaneamente in serie e in parallelo. Le colonne sono presenti in tutte le aree corticali devolute alla percezione degli stimoli, alla loro elaborazione e all'emissione di una risposta.
Di tutte queste aree, quella analizzata più a fondo è la corteccia visiva. Si conosce attualmente in modo molto preciso il percorso compiuto dalle fibre nervose emergenti dalla retina a formare il nervo ottico fino alla loro destinazione finale - dopo tappe intermedie di varia natura che dipendono dalla specie - nella corteccia visiva. Gli studi condotti negli ultimi decenni hanno chiarito molte fasi dell'elaborazione di questi stimoli. Si sa che ogni immagine che colpisce la retina viene scomposta, quando raggiunge l'area 17 della corteccia, in un numero impressionante di punti, linee, barre verticali, oblique e orizzontali. Si verificano successivamente operazioni complesse che 'ricostruiscono' questa immagine in aree differenti della corteccia. Questa seconda fase di ricostruzione viene effettuata da elementi neuronali disposti in modo ferreamente gerarchico. Mentre l'idea dell'esistenza di quelli che G. Stent definì i neuroni pontificali, cioè neuroni devoluti a 'vedere' l'intera immagine, è stata scartata, si sono recentemente scoperti neuroni che operano delle sintesi di parti più semplici dell'immagine precedentemente dissezionata, in modo tale che una particolare categoria di essi è in grado di rispondere alla visione di una forma nella sua interezza: un oggetto, il viso di una persona o il muso di un animale. Gli stessi neuroni non rispondono a stimoli più semplici come un impulso luminoso di intensità e durata varie. In sostanza, queste unità gnostiche - termine impiegato per definirle - esercitano delle sintesi dei segnali più semplici: esse rilevano il tutto e non una parte né tantomeno i singoli punti che la definiscono. Si ipotizza che vi sia una organizzazione gerarchica che procede a sintesi successive e sempre più globali, al termine delle quali l'intera immagine viene di nuovo percepita nella sua unitarietà e interezza. Vi sono pazienti neurologici i quali presentano la specifica inabilità a riconoscere, per es., i visi degli esseri umani, pur mostrando normali capacità per tutte le altre funzioni. Questi soggetti sarebbero affetti da una degenerazione specifica in determinate aree cerebrali denominata prosopoagnosia, che nei primati è stata localizzata nel solco temporale superiore.
È presumibile che questa organizzazione gerarchica che procede per sintesi successive operi anche in altre aree corticali devolute all'elaborazione degli stimoli uditivi, tattili, gustativi. Sulla scia di queste scoperte recenti gli studiosi di intelligenza artificiale progettano una nuova categoria di elaboratori che, al contrario di quelli precedenti, operano in serie e in parallelo simulando il funzionamento delle reti neurali. Queste ricerche presentano il duplice vantaggio di generare nuovi tipi di elaboratori, molto sofisticati, e al contempo di comprendere in modo più dettagliato il funzionamento negli animali.
Collegato con il processo dell'elaborazione è quello della memorizzazione degli eventi che devono essere registrati per un periodo più o meno lungo. È ancora controverso se esistano particolari tipi di neuroni deputati a tale scopo nell'ambito di ciascuna rete neurale, o se la capacità di memorizzare sia presente in tutti i neuroni. La conclusione della maggior parte dei neurobiologi è per la seconda possibilità: ogni neurone è dotato degli elementi molecolari che gli permettono di fissare gli eventi sinaptici per un determinato periodo. Tale funzione cerebrale, essenziale per ogni attività nervosa di qualsiasi animale, è da lungo tempo oggetto di studi della più svariata natura.
Mentre sarebbe troppo lungo enumerare le analisi che su questa funzione sono state condotte dalla psicologia e, più di recente, dalle scienze cognitive, un rilievo particolare va dato agli studi tesi a delucidare le basi cellulari e molecolari della fissazione dei ricordi. Impiegando l'approccio riduzionista, diversi scienziati hanno iniziato a identificare i meccanismi e le molecole che sono coinvolti direttamente nella fissazione dello stimolo mnemonico in animali dal sistema nervoso di dimensioni molto ridotte. L'assunto fondamentale è che le basi neuronali della memoria sono eguali più o meno in tutte le specie, poiché eguali sono i neuroni che costituiscono il cervello. Nel corso dell'evoluzione sono semplicemente aumentati a dismisura gli interneuroni, cioè le cellule collocate fra i neuroni sensoriali (che percepiscono il mondo esterno) e i neuroni motori (che mettono in esecuzione le decisioni prese dagli interneuroni). Ne sta emergendo un insieme di nozioni molto precise, attraverso l'identificazione di un numero crescente di proteine coinvolte nella fissazione dei ricordi o dei meccanismi che, all'interno dei neuroni, attivano specifici programmi genici per il mantenimento dei ricordi per periodi di tempo che spesso coprono l'intero arco della vita. Vi sono, inoltre, particolari aree cerebrali che svolgono un ruolo determinante in talune fasi della memorizzazione. La più nota è l'ippocampo, che studi clinici e sperimentali hanno mostrato essere fondamentale nel processo di consolidamento della memoria breve in memoria di lunga durata. Individui cerebrolesi che hanno subito una lesione confinata a questa struttura presentano un deficit gravissimo nella memoria anterograda, mentre sono normalmente capaci di memoria retrograda. Hanno memoria normale dei ricordi passati, anche infantili, ma dimenticano di avere incontrato il loro medico pochi minuti dopo che questo incontro è avvenuto.
Con approcci multidisciplinari e interdisciplinari si prospetta dunque nel prossimo futuro la possibilità di delucidare piuttosto a fondo i meccanismi tramite cui i neuroni, organizzati in strutture tridimensionali di varia natura e di varia entità, elaborano l'informazione in arrivo, la memorizzano - se necessario - ed emettono una risposta comportamentale. Questi studi cominciano a fornire informazioni di fondamentale importanza anche sul problema più complesso - secondo taluni irrisolvibile - che concerne i meccanismi che presiedono alla coscienza: sui meccanismi mediante i quali il nostro encefalo, nello stesso momento in cui opera l'elaborazione degli input sensoriali, ci rende coscienti dell'insieme di queste operazioni; sul tipo di circuiti o attività nervose con cui possiamo decidere un determinato atto motorio o rievocativo del passato; in altre parole, sulla natura di processi 'mentali' come coscienza, volontà, memoria.
Questo tipo di problemi costituisce il nocciolo del terzo, e ovviamente più complesso, livello di funzioni cerebrali. Il problema della comprensione dei processi mentali è metaforicamente paragonabile a quello della decrittazione dei geroglifici incisi sulla stele di Rosetta. Come è noto, si giunse alla soluzione dell'enigma rappresentato dalla lingua egizia espressa in geroglifici in seguito al ritrovamento di una stele - poi divenuta famosa in tutto il mondo con il nome del luogo ove fu rinvenuta - sulla quale era inciso un medesimo testo in tre scritture diverse: il greco, il demotico, che rappresentava una versione volgare della lingua egizia, e il geroglifico. Mediante la conoscenza delle prime due lingue si poté giungere alla decrittazione dei geroglifici.
È probabile che una volta compresi a fondo i primi due livelli delle funzioni cerebrali, quello delle funzioni dei singoli neuroni e quello dell'attività delle reti neurali, si potrà giungere un giorno alla delucidazione dei geroglifici del cervello che corrispondono ai meccanismi che generano i processi mentali.
Attualmente diverse teorie sono state avanzate da scienziati che sono passati dalle sponde sicure di discipline come l'immunologia, la biologia molecolare o la fisica quantistica alle neuroscienze. Fra questi ricordiamo G. Edelman, F.O. Crick e R. Penrose. Le loro teorie sono tutte basate sulle conoscenze acquisite nei primi due livelli di attività cerebrale ai quali si è accennato. Queste teorie riflettono gli aspetti peculiari delle conoscenze di un determinato settore delle n. e, pertanto, soffrono della mancanza di una sintesi globale. Edelman, per es., poggia la sua ipotesi principalmente su concetti di tipo darwiniano per quanto concerne la formazione dei circuiti che presiedono ai processi mentali, e sulle nozioni evoluzionistiche per quanto riguarda il progressivo generarsi della coscienza. Crick si ispira alle conoscenze acquisite nello studio della fisiologia della visione, che costituisce il settore più avanzato del secondo livello e, di recente, ha messo in evidenza meccanismi neurali che collegano le funzioni visive squisitamente sensoriali con quelle che presiedono ad atti volontari a esse collegati. Penrose, infine, studioso neofita, prestato dalla fisica alle n., cerca di adattare le sue riconosciute competenze nel campo della fisica quantistica alla comprensione dei processi mentali, giungendo a una ipotesi stimolante, anche se al limite dell'azzardo. Secondo Penrose, le funzioni espletate dai neuroni e brevemente riassunte in precedenza sono sufficienti per i primi due livelli funzionali, ma non per il terzo. L'autocoscienza può generarsi solo per mezzo di attività quantistiche collettive (coerenti) che si possono generare entro strutture dinamiche come i microtubuli presenti e operanti all'interno degli stessi neuroni. Come è facile intuire, queste ipotesi rimangono ancora nel puro campo della speculazione, ma è confortante constatare come scienziati che hanno guadagnato la loro reputazione con una sperimentazione rigorosa, in solidi campi delle scienze biologiche e fisiche, e che li ha portati ai più alti riconoscimenti internazionali, prestino la loro attività creativa al più arduo dei problemi scientifici. Non è azzardato ipotizzare che i loro tentativi un giorno non lontano si concretizzeranno nel successo più ambito da quando l'uomo ha preso coscienza di sé e del mondo che lo circonda: portare a compimento l'esortazione socratica del "conosci te stesso".
bibliografia
F. Jacob, Logique du vivant. Une histoire de l'hérédité, Paris 1970 (trad. it. Torino 1971).
D.H. Hubel, T.N. Wiesel, I meccanismi cerebrali della visione, in Le scienze, 1979, 23, p. 90.
R. Levi-Montalcini, P. Calissano, The nerve-growth factor, in Scientific american, 1979, 240, 6, pp. 68-77.
Principles of neural science, ed. E.R. Kandel, J.H. Schwartz, New York 1981 (trad. it. Milano 1988).
D. Purves, J.W. Lichtman, Principles of neural development, Sunderland (Mass.) 1985.
G.M. Edelman, Neural darwinism. The theory of neuronal group selection, New York 1987 (trad. it. Torino 1995).
G. Fink et al., Transmitter molecules in the brain, 2° vol., Berlin-New York 1987.
I. Rosenfield, Invention of memory. A new view of the brain, New York 1988 (trad it. Milano 1989).
J.-P. Changeux, A. Connes, Matière à pensée, Paris 1989 (trad. it. Pensiero e materia, Torino 1991).
P. Calissano, Neuroni; mente ed evoluzione, Milano 1992.
M.S. Gazzaniga, Nature's mind, New York 1992 (trad. it. Milano 1997).
R. Penrose, Shadows of the mind, Oxford-New York 1994 (trad. it. Milano 1996).
E. Boncinelli, Il cervello, la mente e l'anima, Verona 1999.
Frontiere della vita, vol. 3°, 1ª parte: Il cervello di Homo sapiens, a cura di E. Bizzi, P. Calissano, V. Volterra, Istituto della Enciclopedia Italiana, Roma 1999.
Neurobiologia
di Jacopo Meldolesi, Flavia Valtorta
Per neurobiologia si intende il complesso di conoscenze e ipotesi di lavoro relative al tessuto nervoso, o meglio ai sistemi che da questo tessuto sono composti, il sistema nervoso centrale (SNC) e quello periferico (SNP). Gli sviluppi verificatisi negli ultimi trent'anni hanno progressivamente condotto a un'integrazione della neurobiologia, da un lato, con aspetti dell'attività nervosa per molto tempo ritenuti difficilmente riconducibili a una dimensione biologica, quali il pensiero e l'attività psichica; dall'altro lato, con la patologia e la clinica, sia neurologica che psichiatrica, che si sono nel frattempo aperte progressivamente all'interpretazione neurobiologica.
Il tessuto nervoso è probabilmente il più specializzato dell'intero organismo. Sino a poco tempo fa prevaleva l'idea che la sua specializzazione strutturale e funzionale poggiasse sull'unicità dei meccanismi molecolari e di funzionamento del neurone rispetto alle altre cellule. Perciò la ricerca in neurobiologia era spesso focalizzata sull'identificazione di fenomeni e proprietà esclusivi di quelle cellule. La ricerca più recente ha però evidenziato, oltre alla specializzazione e alla ricchezza dell'espressione genetica (nel SNC sono espressi molti più geni che in ogni altro organo), l'esistenza di una marcata conservazione evolutiva tra molte funzioni del neurone e le funzioni comuni alle altre cellule, fino agli organismi semplici quali i lieviti.
Per approfondire il problema si prendano in considerazione i meccanismi di segnalazione. Fino a circa trent'anni or sono si riteneva che nel sistema nervoso la segnalazione avvenisse essenzialmente tramite correnti elettriche, che peraltro non sono specifiche dei neuroni, ma funzionano anche nei muscoli e in molte cellule endocrine. Senza nulla togliere all'importanza dei fenomeni elettrici, soprattutto per quanto riguarda la rapidità di trasmissione delle informazioni, appare però ormai evidente che il funzionamento coordinato della intricata rete di neuroni, nonché i fenomeni complessi, quali l'apprendimento, la memoria e l'attività psichica, richiedono che all'arrivo di un impulso elettrico seguano modificazioni biochimiche dell'attività cellulare, molte delle quali hanno un'ampia distribuzione nel mondo delle cellule eucariote. Per la loro natura queste modificazioni hanno una durata assai più lunga del potenziale d'azione. Alcune tra le più importanti modificazioni biochimiche, quali le fosforilazioni di proteine e l'attivazione della trascrizione genica, saranno riprese più avanti nei paragrafi sulla plasticità neuronale e sinaptica (v. anche rimodellamento, in questa Appendice).
Lo sviluppo delle nuove conoscenze sul neurone ha condotto anche a sostanziali modifiche della neurobiologia. La disciplina, infatti, non ha più soltanto aspetti specialistici, ma è diventata un territorio di frontiera in cui si misurano biologi cellulari interessati allo studio di una varietà di meccanismi base che nei neuroni presentano alti livelli di espressione: dai processi di fusione di membrana alla trasduzione dei segnali, dall'apoptosi al citoscheletro. Sotto parecchi punti di vista, quindi, il neurone può essere considerato come la cellula più evoluta dell'intero organismo, in relazione al quale è possibile sviluppare modelli sperimentali unici, importanti anche per lo studio generale di molteplici funzioni cellulari.
Sviluppo del SNC
Sia la semplice osservazione macroscopica del SNC sia la straordinaria eterogeneità delle aree cerebrali, facilmente verificabile a ogni livello (cellulare, intercellulare, di tessuto), suggeriscono la complessità dei processi necessari per lo sviluppo, a partire dalla semplicità del tubo neurale dell'embrione. I neuroni, per raggiungere la loro collocazione definitiva e per stabilire i contatti necessari al loro funzionamento, sono guidati dall'espressione prima di fattori di trascrizione per specifici geni, quindi dai prodotti di questi ultimi. Tra i prodotti di espressione genica coinvolti si annoverano sia i fattori di crescita necessari per il controllo a distanza, sia le molecole specifiche della membrana plasmatica (o di sue specifiche regioni) attraverso le quali le cellule possono riconoscersi 'al tatto'. Si tratta di processi attivati non stabilmente ma 'per finestre temporali', tali quindi da poter evolvere nel tempo senza rischiare confusioni che potrebbero rendere difficili, se non impossibili, eventi previsti in tempi successivi. Alla complessità spazio-temporale si aggiunge la molteplicità dei meccanismi, che possono essere diversi per i vari processi (migrazione, emissione di prolungamenti, stabilirsi di sinapsi) nelle varie aree del SNC e, nella stessa area, per i vari tipi di neuroni. La regolazione, prima della moltiplicazione e della migrazione delle cellule immature, poi del differenziamento neuronale è dimostrata anche dall'esistenza di malattie genetiche nelle quali la presenza di eventi apparentemente indipendenti tra loro (per es. la mancanza del senso dell'olfatto, anosmia, e il deficit dello sviluppo sessuale nella malattia di Kallmann) è risultata derivare da un difetto nella migrazione di un singolo gruppo di neuroni, normalmente destinati a separarsi e migrare successivamente in due diverse direzioni fino a raggiungere siti di localizzazione differenti dove svolgeranno funzioni assai difformi.
Una caratteristica comune dei processi di sviluppo è la loro realizzazione per eccesso. In generale, infatti, sia il numero di neuroni prodotti per ogni area, sia l'arborizzazione delle fibre assonali e le connessioni sinaptiche stabilite con i bersagli sono molto più abbondanti in fase di sviluppo rispetto a quanto riscontrato nell'animale adulto. In termini finalistici si tratta, evidentemente, di un 'criterio di garanzia' stabilito per escludere la possibilità che il sistema nervoso finisca per trovarsi in difetto. Questo criterio è basato sulla capacità di eliminare quanto costruito di troppo, ancora una volta attraverso l'analisi di segnali di diversa natura e intensità che le cellule sono capaci di inviare, ricevere e interpretare. Una volta divenuti quasi tutti incapaci di riprodursi, e quindi di turbare le complesse strutture del sistema nervoso, i neuroni vanno incontro a una fase di ampia selezione negativa che riguarda sia le cellule stesse (eliminate per apoptosi; v. cellula, in questa Appendice) sia le loro fibre e sinapsi, e che si accompagna a un esteso rimodellamento, strutturale e molecolare, delle cellule sopravviventi. Quello che ne risulta costituisce il sistema nervoso, funzionante per tutta la vita. La sua plasticità, seppure limitata a livelli apparentemente modesti, sarà comunque atta a sostenere tutti i cambiamenti necessari, compresi quelli di apprendimento e di pensiero, dalla memoria all'attività psichica più complessa.
Morte neuronale
La morte neuronale non avviene soltanto, come già detto, nel corso dello sviluppo, ma anche nel corso dell'intera vita dell'uomo. Si tratta di un evento difficilmente compensabile a prima vista perché, come è ben noto, una volta completato lo sviluppo, la maggior parte dei neuroni è incapace di riprodursi. Il risultato finale, quindi, è una loro diminuzione numerica. Essendo tra le cellule che più dipendono dall'apporto di ossigeno, in caso di trombosi o emorragia cerebrale i neuroni delle aree non più irrorate, e quindi anossiche, muoiono rapidamente per necrosi, cioè per rapida disintegrazione della struttura. Nelle ore successive, tutt'intorno a ogni area necrotica si va inoltre a formare un'area ben più ampia, definita come penombra, i cui neuroni continueranno a morire per giorni attraverso un altro processo, l'apoptosi o morte programmata. Lo stesso succede in neuroni esposti a sovrastimolazione, come può verificarsi anche in casi di epilessia. L'apoptosi è una specie di suicidio, nel corso del quale la cellula procede all'autodigestione delle sue macromolecole, proteine e acidi nucleici, alla condensazione del suo protoplasma e infine alla sua frammentazione, per essere fagocitata senza lasciar traccia dai macrofagi. Dallo studio di questo modello di morte si è sviluppato un concetto del tutto nuovo del neurone. Quest'ultimo infatti vive e funziona finché i segnali che riceve dall'ambiente, cioè da altri neuroni, dalle cellule gliali e, nel caso di neuroni del SNP, anche dagli altri bersagli funzionali, ne giustificano la sopravvivenza. Il programma apoptotico rimane comunque sempre 'pronto', attivabile da 'fattori di morte' come il TNF-α (Tumor Necrosis Factor α), che funzionano attraverso recettori specifici, o da aumenti incontrollati del Ca²+ citosolico. I fattori di crescita, quali il fattore di crescita nervoso (NGF, Nerve Growth Factor: v. in questa Appendice) o quello derivato dalle cellule gliali (GDNF, Glial Derived Nerve Factor), esercitano invece sui neuroni un effetto di protezione, antiapoptotico. L'attività coordinata dei neuroni è anch'essa un potente elemento di protezione che si realizza attraverso fattori oggi in via di identificazione. Tutti i nostri neuroni, seppure in grado diverso, sono esposti al rischio apoptotico, e la loro protezione appare legata a un'armonica integrazione funzionale in cui le varie attività cerebrali, da quella psichica a quella motoria, trovano spazi adeguati.
Glia
Oltre ai neuroni, tipiche del sistema nervoso sono le cellule gliali, che nel SNC sono presenti in numero più che 10 volte maggiore rispetto ai primi (nell'uomo circa mille miliardi di cellule!). A differenza dei neuroni, le cellule gliali sono proliferanti, cioè capaci di attiva riproduzione. Fino a tempi recenti l'interesse per queste cellule è rimasto modesto, limitato soprattutto al riconoscimento della loro eterogeneità. A ciascuna delle tre famiglie di cellule gliali si riconosce infatti un ruolo diverso, la cui comprensione è tuttora in rapida espansione. Le cellule microgliali sono in realtà macrofagi, in equilibrio con i macrofagi circolanti attraverso la barriera emato-encefalica. Al loro ruolo tradizionale di eliminazione per fagocitosi dei detriti cellulari rilasciati nel SNC viene oggi aggiunta la capacità di produrre sostanze, quali citochine e derivati delle prostaglandine, capaci di stimolare astrociti e anche neuroni. Fondamentale è infine il loro ruolo in tutte le malattie neuroimmunologiche, nelle quali la presentazione di antigeni specifici scatena la risposta dei linfociti T estravasati nel sistema nervoso.
Degli oligodendrociti, che sono presenti solo nel SNC, era nota da molto tempo l'azione protettiva delle fibre assonali intorno alle quali formano le guaine mieliniche, costituite dal ripetuto arrotolarsi attorno agli assoni di espansioni, sottili e ampie, del loro citoplasma. Lo sviluppo delle conoscenze ha portato a identificare nell'intimo contatto assone-oligodendrocita l'instaurarsi di meccanismi regolativi, mediati sia dal rilascio di fattori di crescita sia da interazioni dirette cellula-cellula. In specifiche fasi dello sviluppo queste interazioni contribuiscono a indirizzare l'assone verso i suoi bersagli. In fase stazionaria, invece, esse non solo contribuiscono all'eutrofia assonale, ma hanno anche un ruolo nel blocco della rigenerazione dell'assone dopo lesione, un'attività che, data la complessità delle connessioni all'interno del SNC ormai sviluppato, finirebbe per ledere ulteriormente, piuttosto che restaurare, i rapporti interneuronali. Da questo punto di vista gli oligodendrociti differiscono sostanzialmente dai loro corrispettivi presenti nel SNP, le cellule di Schwann, che al contrario stimolano la ricrescita assonale e giocano quindi un ruolo fondamentale nella rigenerazione dell'innervazione periferica, soprattutto a livello motorio.
Le più numerose tra le cellule gliali del SNC sono però quelle della terza famiglia, gli astrociti, i cui prolungamenti si insinuano a rivestire i neuroni, mentre a livello vasale essi contribuiscono al funzionamento della barriera emato-encefalica. A questa attività 'di sostegno' gli astrociti aggiungono quella di 'cicatrizzazione', cioè di sostituzione del parenchima neuronale in caso di morte di quest'ultimo. Gli studi recenti hanno mostrato però che il ruolo degli astrociti è più importante di quanto fin qui ritenuto. Infatti essi, pur essendo poveri di canali voltaggio-dipendenti, ed essendo quindi formalmente ineccitabili, attraverso l'espressione di numerosi recettori e di giunzioni comunicanti (gap junctions) sono capaci di costituire reti di segnali, quali onde di Ca²⁺, importanti per l'omeostasi ambientale del SNC. Integrato con questa attività è il ruolo degli astrociti nella captazione e nel metabolismo di neurotrasmettitori, quali il glutammato. Si tratta di attività che, da un lato, proteggono i neuroni dal rischio della sovrastimolazione, dall'altro, partecipano al ricambio dei neurotrasmettitori stessi e quindi, seppure indirettamente, alla funzionalità sinaptica. Infine anche gli astrociti, come gli oligodendrociti, sono competenti per il rilascio regolato di fattori di crescita, citochine e altri segnali intracellulari. La funzione tradizionalmente attribuita agli astrociti, quella di supporto meccanico nei confronti dei neuroni, deve quindi essere reinterpretata in termini di assai più ampia assistenza e collaborazione, senza la quale né lo sviluppo né il funzionamento del SNC potrebbero avere luogo.
Neuroni e sinapsi
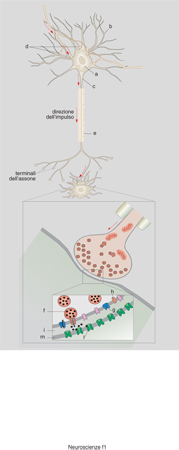
I neuroni non vivono e non funzionano individualmente, ma sono organizzati in complessi sistemi di integrazione, quali circuiti o reti, dove i dispositivi di collegamento (sinapsi) svolgono ruoli fondamentali. Fino a qualche anno fa si riteneva, almeno implicitamente, che le attività plastiche, a cominciare dall'apprendimento e dalla memoria, fossero da attribuire ai neuroni concepiti come strutture unitarie, presenti nel numero di oltre 100 miliardi nel cervello umano. È poi divenuto chiaro che anche le varie sinapsi di ogni singolo neurone, alcune migliaia in media, pur possedendo caratteri comuni (per es. esse funzionano tutte attraverso la liberazione degli stessi neurotrasmettitori), possono presentare specificità tanto molecolari che funzionali di grande importanza per le attività cerebrali. Da qui l'interesse che circonda oggi le sinapsi di numerose aree cerebrali, a cominciare da quelle dell'ippocampo, la struttura che contiene la corteccia cerebrale più elementare.
Strutturalmente ogni sinapsi è costituita da tre componenti: 1) la terminazione nervosa (o presinaptica), il contributo del neurone che fornisce l'informazione: si tratta di un rigonfiamento, specifico per morfologia e funzione, localizzato (per lo più) all'estremità dell'assone e delle sue arborizzazioni; 2) lo spazio sinaptico, cioè lo spazio extracellulare tra i due neuroni, che può essere molto stretto (0,1 μm); 3) la struttura postsinaptica, che può essere localizzata in tutte le porzioni del neurone che riceve l'informazione, eccettuato l'assone: sul corpo cellulare; sui dendriti (dove spesso non si distribuisce a caso ma su piccole estroflessioni, le cosiddette spine sinaptiche); sulle terminazioni sinaptiche, a loro volta in contatto con altri neuroni.
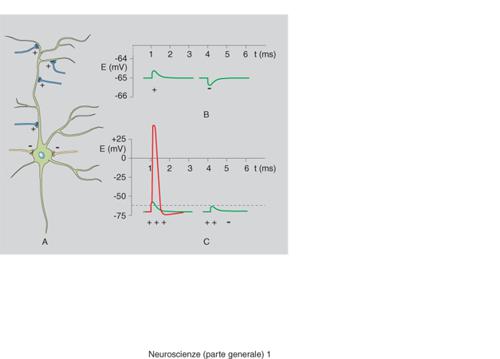
Il funzionamento delle sinapsi deve essere concepito non per sé, ma integrato nel complesso del neurone cui esse appartengono. I segnali, pur risultando da complesse elaborazioni, possono essere condotti molto rapidamente lungo gli assoni sotto forma di semplici eventi elettrici, i ben noti potenziali d'azione, dovuti alla successiva attivazione di canali ionici sensibili al voltaggio. Questi ultimi sono oggi conosciuti anche nella loro struttura molecolare. Giunti al termine della corsa, nei terminali sinaptici appunto, i segnali elettrici sono rapidamente (⟨0,1 ms) convertiti in segnali chimici (tramite il processo di liberazione dei neurotrasmettitori), che rispetto ai segnali elettrici presentano il vantaggio di essere più modulabili e molto più diversificati (esistono diverse decine di neurotrasmettitori diversi). I segnali chimici, riversati nello spazio sinaptico, sono riconosciuti da recettori sia della membrana presinaptica, con funzione regolatoria, sia della struttura postsinaptica, dove possono essere ritrasformati, dopo integrazione ed elaborazione, in segnali elettrici. Eventi di questo genere corrispondono di fatto a conversioni analogico-digitali (e viceversa), essendo il segnale chimico graduato mentre il segnale elettrico è un fenomeno 'tutto o nulla', che può variare in frequenza ma non in ampiezza. Questo concetto spiega come proprio la sinapsi sia la struttura neuronale più importante dal punto di vista dell'elaborazione delle informazioni.
Più in dettaglio, nei terminali sinaptici esiste, in considerevole numero, un tipo speciale di organulo, la vescicola sinaptica, riempita di neurotrasmettitori. Una sottopopolazione di queste vescicole si trova legata a siti specializzati della membrana plasmatica in cui sono destinate a incorporarsi tramite il processo di esocitosi (fusione). A riposo, però, la probabilità del processo di fusione è molto bassa. L'arrivo del potenziale d'azione provoca l'apertura di canali per lo ione Ca²⁺ con conseguente aumento (fino a 1000 volte) della concentrazione dello ione Ca²⁺ in prossimità delle vescicole legate. Il Ca²⁺ rimuove il blocco della fusione e i neurotrasmettitori contenuti nelle vescicole (i cosiddetti 'quanti', uno per vescicola) vengono così riversati nello spazio sinaptico, entrando in rapido contatto con la superficie della struttura postsinaptica. Il loro legame specifico con macromolecole proteiche, i recettori, ne causa l'attivazione inducendone cambiamenti conformazionali e quindi funzionali. Nel caso di recettori-canale l'attivazione può dare luogo all'insorgenza del potenziale elettrico postsinaptico, che sarà di tipo eccitatorio o inibitorio a seconda della natura positiva o negativa dello ione trasportato dal recettore stesso. Inoltre, se lo ione coinvolto è il Ca²⁺, esso può anche attivare reazioni biochimiche locali nel neurone postsinaptico. Infatti il Ca²⁺ è l'unico tra gli ioni capace di svolgere un ruolo non solo elettrico, ma anche di (secondo) messaggero intracellulare.
Plasticità sinaptica
Come già accennato, l'attività sinaptica è altamente plastica: si adatta cioè alle necessità fisiologiche e protegge il SNC dagli effetti della stimolazione eccessiva. L'adattamento può avere luogo a livello sia presinaptico (fusione di vescicole) sia postsinaptico (attivazione recettoriale ed eventi a valle). Una prima regolazione dipende già dal livello del potenziale di riposo nelle rispettive membrane. I neuroni inibitori (abbondanti soprattutto tra i neuroni piccoli, cosiddetti interstiziali), attraverso specifici neurotrasmettitori e i relativi recettori, aumentano il potenziale elettronegativo delle membrane neuronali e le rendono così meno sensibili alle specifiche depolarizzazioni indotte, rispettivamente, dai potenziali d'azione e dall'attivazione di recettori stimolatori. A questo proposito è interessante notare che nella maggior parte dei circuiti cerebrali i neuroni eccitatori e quelli inibitori lavorano coordinatamente, talvolta anche in sequenza, e che solo l'equilibrio tra le due componenti permette di ottenere risultati equilibrati. Si pensi, in proposito, alla sintomatologia di ipereccitazione (convulsiva) dovuta al prevalere della componente motoria eccitatoria, che compare in seguito a blocco di sinapsi inibitorie in condizioni quali l'infezione tetanica o l'intossicazione da stricnina.
Per plasticità si intendono però soprattutto le modifiche di funzionalità che si realizzano in una sinapsi in relazione alla sua stessa attività. A seconda della durata esse si distinguono in plasticità a breve e a lungo termine, cioè in variazioni della risposta che vengono mantenute per pochi secondi oppure per lunghi periodi, fino a diversi giorni. I meccanismi molecolari responsabili di questi fenomeni, quantunque molto diversi tra loro, sembrano dipendere in larga misura dallo ione Ca²⁺. Per la plasticità a breve termine è stata proposta la 'teoria del Ca²⁺ residuo', basata sulla constatazione che, dopo una stimolazione, l'espulsione del Ca²⁺ dal terminale è relativamente lenta, tale che alcuni siti importanti per la secrezione possono essere ancora occupati dallo ione all'arrivo di uno stimolo successivo, con conseguente aumento della risposta. Per forme più complesse di plasticità a breve termine, che sembrano dipendere direttamente da aumentata concentrazione di Ca²⁺ nell'intero terminale, il bersaglio sembra essere la sinapsina. Si tratta di una proteina che tiene legate le vescicole sinaptiche al citoscheletro, lontano dai siti di fusione, fino a quando, in conseguenza dell'aumento di Ca²⁺, essa non viene fosforilata da un enzima specifico. Aumenta così il numero delle vescicole disponibili per legarsi alla membrana plasmatica della terminazione e, successivamente, per fondersi e liberare i propri quanti di neurotrasmettitore. Questi processi, che pure sono transienti, possono modificare significativamente il flusso delle informazioni in un circuito neuronale e avere quindi grande importanza fisiologica.
Oggi però l'interesse maggiore è focalizzato sulle forme prolungate di plasticità chiamate, rispettivamente, potenziamento e depressione a lungo termine, ltp e ltd, rivelate dal persistente aumento o diminuzione della risposta a uno stimolo standardizzato. Riconosciute in numerosi tipi di neuroni che impiegano come neurotrasmettitore il glutammato, esse sono considerate i meccanismi base per l'immagazzinamento delle informazioni, i primi processi che permettono di fornire una spiegazione neurobiologica a fenomeni quali l'apprendimento e la memoria. Per l'induzione di questi processi la sinapsi deve ricevere una serie di stimoli in rapida successione, un tetano, come si dice. Se la frequenza di questi stimoli sarà alta, per esempio 100 Hz, potrà svilupparsi una ltp, se sarà bassa (⟨10 Hz) una ltd. Qui la plasticità non riguarda solo il terminale presinaptico ma la sinapsi nel suo complesso. La stimolazione da parte del glutammato della struttura postsinaptica, con aumento della concentrazione del Ca²⁺, induce infatti l'immediato invio di un segnale retrogrado, costituito probabilmente dal messaggero gassoso NO (ossido nitrico). L'integrazione temporale dei vari processi di segnalazione bidirezionale permette alla sinapsi di modificare il proprio programma funzionale attivandone uno più (o meno) efficace di quello base, in termini sia di fusione di vescicole (attività presinaptica) sia di ricezione del segnale del neurotrasmettitore (attività postsinaptica). In seguito il programma modificato viene stabilizzato (per giorni) anche grazie a specifiche variazioni dell'espressione genica, e l'informazione stabilizzata può così indurre la comparsa di modifiche anche irreversibili in aree lontane del cervello.
La neurobiologia delle funzioni superiori
Come già accennato, sino a pochi anni or sono l'esplorazione delle basi cellulari e molecolari delle funzioni superiori del SNC era del tutto impensabile, nonostante esistesse un accordo pressoché generale riguardo al fatto che la coscienza, il pensiero e l'attività psichica più in generale derivassero dall'attività dei neuroni del cervello. L'indagine delle funzioni superiori era quindi condotta con altre tecnologie. Oltre che dalle discipline classiche (quali la neuroanatomia e la neurofisiologia, che hanno fornito una mappatura delle connessioni neuronali e studiato l'attività dei circuiti in modelli animali), informazioni importanti sono venute dalla psicologia cognitiva (v. App. V), che si occupa essenzialmente del funzionamento della mente indipendentemente dal substrato neurofisiologico, e dalla neuropsicologia, che individua la sede di una funzione studiando la sua alterazione in seguito a lesioni di specifiche aree cerebrali (v. mente: Neuroscienze e modelli della mente, App. V).
In tempi più recenti, però, l'avvento di nuove tecniche di indagine, quali la risonanza magnetica nucleare e la tomografia a emissione di positroni (NMR e PET: v. nervoso, sistema, App. V), ha consentito di affrontare lo studio delle funzioni superiori in un'ottica diversa. Anche se il problema della coscienza rimane troppo complesso per poterne studiare le basi neurobiologiche, tuttavia esso può essere scomposto in parti più semplici da affrontare separatamente.
Notevoli, per es., sono stati i progressi compiuti nello studio della consapevolezza e delle reazioni alle sensazioni, in particolare quelle indotte dagli stimoli visivi. Già negli anni Sessanta e Settanta gli studi neurofisiologici di D.H. Hubel e T.N. Wiesel avevano chiarito nel dettaglio quali sono le vie seguite dagli stimoli visivi, a partire dai fotoni che colpiscono la retina sino alla formazione dell'immagine nelle varie aree della corteccia visiva. Questi studi, però, erano stati compiuti su animali anestetizzati, e non potevano perciò chiarire il problema della percezione (sensazione cosciente) dello stimolo visivo. Gli sviluppi più recenti hanno invece portato a una sia pure iniziale comprensione dei meccanismi attraverso i quali si forma una rappresentazione mentale. I concetti fondamentali derivanti da questi studi sono due. In primo luogo, le varie componenti dello stimolo visivo (colore, movimento ecc.) possono essere analizzate dal cervello attraverso meccanismi almeno parzialmente distinti. In secondo luogo, l'immagine visiva che viene a formarsi nella nostra mente non costituisce una rappresentazione accurata dell'immagine reale, in quanto è andata incontro a processi di aggiustamento. Nella gerarchia delle strutture che partecipano all'aggiustamento visivo questi processi possono avvenire 'dall'alto verso il basso' oppure 'dal basso verso l'alto', coinvolgendo, o meno, meccanismi volontari. I meccanismi neurali che sottendono alla consapevolezza della percezione sono perciò distribuiti lungo l'intera via visiva, in contraddizione con l'ipotesi prevalente in passato, secondo la quale la via visiva corrispondeva semplicemente al trasporto dell'informazione, mentre la consapevolezza della percezione era acquisita in qualche altro centro, a quell'epoca ancora non ben identificato. Concetti simili a quelli della sensazione visiva appaiono essere applicabili agli altri tipi di percezione.
In base alle conoscenze moderne, perciò, le funzioni cerebrali, anche quelle meno complesse, coinvolgono ampie aree del cervello, e un singolo stimolo risulta in grado di attivare neuroni localizzati anche in aree distanti tra loro. In altre parole, i neuroni funzionano in una rete di connessioni che sono decisamente più ampie e integrate di quanto si pensasse in precedenza. Anche nel campo dei processi di memoria e apprendimento i neuroni che acquisiscono le informazioni non sono gli stessi in cui l'informazione viene alla fine conservata. Per es., mentre l'ippocampo è considerato una struttura fondamentale per la rapida acquisizione di nuove informazioni, queste ultime, per poter essere conservate in maniera permanente o semi-permanente, devono essere trasferite e consolidate altrove, per es. nella neocorteccia cerebrale. Possiamo quindi concludere che il concetto di regione focale, specifica per una singola funzione, è stato sostituito da quello di circuito e di funzione distribuita, così come il concetto di cambiamenti statici della struttura del SNC è stato sostituito da quello di plasticità.
bibliografia
G.M. Shepherd, Neurobiology, New York 1983, 1994³.
I.B. Levitan, L. K. Kaczmarek, The neuron. Cell and molecular biology, New York 1991, 1997².
M. Kuno, The synapse. Function, plasticity and neurotrophism, Oxford-New York 1995.
Neuroglia, ed. H. Kettenmann, B.R. Ransom, New York 1995.
Cognitive neurosciences, in Science, 1997, 275, pp. 1580-610 (nr. speciale).
Comunicazione interneuronale
di Francesco Clementi
La neurochimica ha fatto in questi ultimi anni grandissimi passi avanti dovuti soprattutto al progresso della biologia cellulare e della biologia molecolare, che non solo hanno permesso di descrivere quanto avviene da un punto di vista neurobiologico sia nel cervello sano sia in quello patologico, ma hanno anche fornito spesso una spiegazione molecolare per molte delle funzioni cerebrali e per alcune patologie.
Le tecniche di biologia molecolare hanno permesso di clonare molte molecole chiave della trasmissione sinaptica delle quali si avevano solo conoscenze indirette o, spesso, non si conosceva affatto l'esistenza; si pensi, fra l'altro, alle molte forme di recettori, ai trasportatori dei mediatori, agli enzimi responsabili della sintesi dei mediatori, ai canali voltaggio dipendenti. Inoltre, la localizzazione, attraverso la ibridizzazione in situ, degli mRNA specifici per le diverse molecole sopra citate è stata determinante per conoscere la funzione di queste molecole nei diversi circuiti neuronali. L'individuazione del bersaglio molecolare di molte malattie, assieme al grande sviluppo della genetica molecolare, ha inoltre permesso di rintracciare le cause genetiche di numerose patologie e di svolgere quindi anche un'azione di prevenzione.
La perfezione raggiunta dalle tecniche non invasive di visualizzazione del cervello come la Nuclear Magnetic Resonance (NMR), ma soprattut-to la Positron Emission Tomography (PET), la Single-Photon Emission Computerized Tomography (SPECT) e la Magneto Encephalography (MEG) (Lounasmaa, Hamalainen, Hari et al. 1996; Volkov, Rosen, Farde 1997), ha permesso di ottenere un'ottima risoluzione sia temporale sia spaziale e un'alta sensibilità ai traccianti neurochimici. Si è potuto in tal modo correlare i dati ottenuti sui pazienti con quanto si era trovato in precedenza negli animali da esperimento o in studi post mortem (tab. 1). Sono tipici per es. gli studi sui neurotrasmettitori e sui loro recettori durante esercizi di apprendimento o in molte situazioni patologiche (Nordberg 1995).
Da ultimo, il perfezionamento delle tecniche di indagine nell'uomo da parte della psicologia cognitiva ha permesso di collegare molti dati neurochimici sperimentali con processi mentali ben caratterizzati.
L'identificazione molecolare delle cause di molte patologie del SN o almeno dei loro sintomi clinici ha dato il via a una ricerca mirata di nuovi e più specifici farmaci. L'introduzione in terapia di molecole con un meccanismo d'azione noto ha poi prodotto, con un effetto rebound, un ulteriore sviluppo della conoscenza della patogenesi di molte malattie. Si è così iniziata un'epoca nella quale le distanze tra la ricerca di base e quella applicata si sono ridotte, anzi in molti casi sono diventate punti di vista diversi su problemi comuni. Questa feconda interazione tra clinica e scienze sperimentali si riflette in un risveglio anche della clinica che passa da descrizione, spesso infeconda, di sintomi e classificazioni a interpretazioni fondate di ipotesi patogenetiche e di interventi terapeutici più mirati. Gli anni Novanta sono stati chiamati il 'decennio del cervello' e molti governi e agenzie private di finanziamento della ricerca si sono impegnati a contribuire a potenziare i fondi per questi studi. Non vi è dubbio quindi che agli inizi del 2000 si assisterà a una continua e stimolante corsa verso la comprensione di questo organo così complesso e affascinante che è il cervello.
In questa trattazione si intende dare un'idea di alcune delle più importanti conquiste recenti nel campo della neurochimica, dando particolare risalto alla comunicazione tra neuroni e quindi ai neurotrasmettitori e ai loro recettori.
La sinapsi
Nel sistema nervoso i neuroni sono organizzati in circuiti multicellulari con caratteristiche spaziali, organizzative e funzionali tipiche delle varie aree cerebrali (v. nervoso, sistema, App. V). La costruzione di tali circuiti dipende da come le cellule nervose sono tra loro legate, da come si riconoscono e da come comunicano tra di loro.
La caratteristica dei circuiti nervosi consiste soprattutto nella specificità delle connessioni neuronali che si realizzano attraverso strutture particolari chiamate sinapsi; la specificità è ottenuta sia attraverso collegamenti precisi sul piano spaziale, sia attraverso il riconoscimento tra neurotrasmettitore secreto dalla parte presinaptica e recettori presenti nella parte postsinaptica.
La sinapsi è la struttura che permette il passaggio unidirezionale dell'informazione da una cellula a un'altra. Questa struttura si trova alla fine dell'assone ed è il punto di contatto, tra l'assone e la cellula innervata, nel quale avviene la trasmissione dell'informazione (fig. 8). La sinapsi ha alcune proprietà che sono essenziali per formare un corretto circuito neuronale: 1) la trasmissione del segnale è unidirezionale, dall'assone alla cellula non innervata e non viceversa; 2) la trasmissione è focalizzata, avviene cioè non solo con una cellula ben precisa, ma anche con una porzione precisa della cellula, in modo che il segnale sia localizzato e puntiforme; 3) la trasmissione è specifica, si basa sull'interazione tra il neurotrasmettitore liberato dalla parte presinaptica e un recettore specifico presente sulla membrana postsinaptica; solo quando i due elementi, trasmettitore e recettore, sono compatibili avviene la trasmissione nervosa; 4) la risposta postsinaptica dipende dal tipo di recettore attivato; per es. l'acetilcolina può indurre una trasmissione assai rapida dell'impulso nervoso se ecciterà recettori di tipo nicotinico, mentre potrà indurre un risposta lenta e di tipo metabolico se ecciterà recettori di tipo muscarinico; 5) la trasmissione del segnale può essere modulata nell'intensità attraverso sofisticati meccanismi che controllano sia la secrezione del neurotrasmettitore, sia la presenza e la reattività dei recettori, sia infine l'interazione tra neurotrasmettitore e recettore. Per ottemperare a queste funzioni la sinapsi ha una struttura particolare (Eccles 1982).
Le sinapsi hanno una loro struttura di base comune che consiste in: a) una parte presinaptica, che contiene gli enzimi per sintetizzare i neurotrasmettitori e le vescicole sinaptiche con il complesso macchinario per immagazzinarli e secernerli; b) uno stretto spazio intrasinaptico ricco di proteine della matrice extracellulare, nel quale viene rilasciato il neurotrasmettitore, talvolta di enzimi implicati nel metabolismo del neurotrasmettitore; la sua funzione è quella di fissare meccanicamente il contatto sinaptico tra le due cellule attraverso le numerose molecole di adesione, di provvedere a uno spazio limitato nel quale il mediatore può temporaneamente rimanere senza essere diluito dal liquido extracellulare, di cooperare al mantenimento della struttura della membrana pre e postsinaptica soprattutto favorendo la corretta localizzazione delle molecole necessarie alla comunicazione sinaptica; c) una membrana postsinaptica nella quale sono presenti i recettori specifici per il neurotrasmettitore liberato dalla presinapsi; la funzione più importante della membrana postsinaptica è quella di contenere recettori per i neurotrasmettitori e altre molecole necessarie alla trasduzione del segnale, come canali ionici, trasportatori per neurotrasmettitori e pompe; essa inoltre garantisce che queste molecole si trovino nella giusta posizione per svolgere il loro lavoro: per es. i recettori debbono essere localizzati proprio dove esce il neurotrasmettitore secreto dalla parte presinaptica. Questo è possibile in quanto nella parte citoplasmatica, sotto la membrana plasmatica, vi è un citoscheletro con un'organizzazione spaziale ben precisa cui i recettori e altre molecole di membrana sono ancorati attraverso proteine specifiche. Questo complesso citoscheletro-recettori conferisce alla membrana postsinaptica, vista al microscopio elettronico, un particolare aspetto denso e spesso.
La funzione della sinapsi è relativamente semplice. Nel momento in cui la membrana presinaptica è invasa dal potenziale d'azione, essa si depolarizza e questo cambiamento di voltaggio viene percepito dai canali per il calcio voltaggio-dipendenti. Essi si aprono, il Ca²⁺ entra e, attraverso un meccanismo complesso (Söllner, Rothman 1994; Goda 1997), permette che le vescicole sinaptiche ricche di neurotrasmettitore si fondano con la membrana plasmatica e liberino il neurotrasmettitore nello spazio sinaptico (fig. 8). Il neurotrasmettitore liberato attiva i recettori postsinaptici e in questo modo il segnale viene trasmesso dalla fibra presinaptica alla cellula innervata. Successivamente le vescicole sinaptiche vuote di neurotrasmettitore ritornano all'interno della sinapsi per ricaricarsi ed essere pronte per iniziare un nuovo ciclo (McPherson, De Camilli 1994; Sudhof 1995). Il neurotrasmettitore liberato nello spazio sinaptico viene rimosso attraverso diversi meccanismi che possono anche funzionare contemporaneamente: può essere ripreso dalla presinapsi, attraverso trasportatori specifici recentemente clonati (Attwell, Barbour, Szatkowski 1993; Attwell, Mobbs 1994) e immagazzinato nelle vescicole (per es. le catecolamine e la serotonina), oppure essere distrutto da enzimi (per es. l'acetilcolina dall'acetilcolinesterasi), o catturato dalle cellule gliali che circondano la giunzione (per es. il glutammato), o diluito dal liquido extracellulare (per es. i neuropeptidi).
La risposta che la cellula innervata produce è quantitativa in funzione del numero di molecole di neurotrasmettitore uscite dalla parte presinaptica e del numero di recettori postsinaptici attivati, e qualitativa in relazione al tipo di recettore attivato. Si comprende quindi che la vera specificità della sinapsi risiede soprattutto nella specificità di incontro neurotrasmettitore-recettore.
I neurotrasmettitori
Le molecole che trasportano l'informazione neuronale attraverso la sinapsi sono i neurotrasmettitori. Essi vengono sintetizzati nel citoplasma della sinapsi, immagazzinati in vescicole e, quando l'impulso depolarizzante invade la sinapsi, vengono secreti in modo quantitativo nello spazio sinaptico. Qui essi raggiungono i recettori e li stimolano. Contemporaneamente alla secrezione si pongono in atto i meccanismi deputati alla rimozione del neurotrasmettitore dallo spazio sinaptico per terminare l'eccitazione della sinapsi.
Essi possono essere divisi in quattro gruppi fondamentali: i neurotrasmettitori classici e gli aminoacidi, i neuropeptidi e i gas (McQueen 1987; Dawson, Dawson 1996).
I neurotrasmettitori classici sono l'acetilcolina (5÷10% delle sinapsi del SN sono colinergiche), le monoamine (catecolamine, serotonina e istamina, secrete dall'1÷2% delle sinapsi cerebrali) e gli aminoacidi (GABA o acido γ-aminobutirrico, glicina, glutammato, aspartato, taurina, secrete da circa il 40% delle sinapsi centrali).
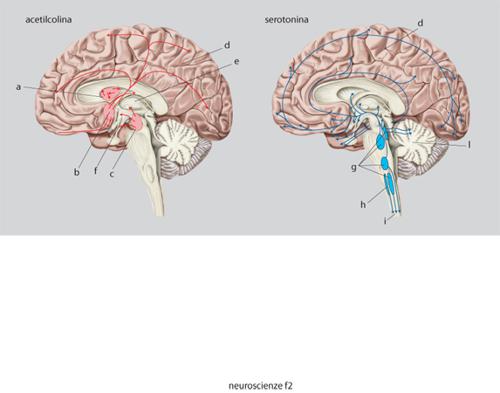
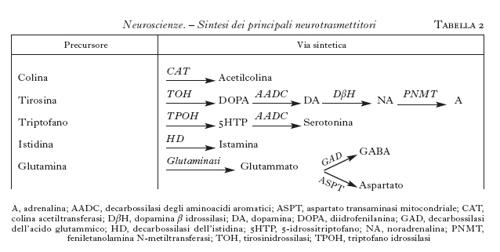
Questi neurotrasmettitori sono sintetizzati nel citoplasma, soprattutto a livello della sinapsi, da una serie di enzimi specifici, partendo da un precursore molto comune e che facilmente può essere disponibile nel neurone (tab. 2). Ogni neurone può sintetizzare solamente un neurotrasmettitore di tipo convenzionale; si hanno così neuroni colinergici, dopaminergici, GABAergici ecc., che sono raggruppati in nuclei specifici del SNC e da cui proiettano assoni anche a zone distanti dove stabiliscono le connessioni sinaptiche. Si hanno così delle vie neuronali ben precise destinate a convogliare i neurotrasmettitori ai siti specifici dove devono agire. Una parte di queste vie è schematizzata nella fig. 9.
L'acetilcolina è sintetizzata a partire dalla colina (che entra nei neuroni attraverso uno specifico trasportatore) da un enzima, la colinoacetiltransferasi; essa viene distrutta dalle acetilcolinesterasi, presenti nello spazio sinaptico. I nuclei colinergici sono raggruppati soprattutto nel nucleo magnocellulare di Maynert, nel nucleo del septo mediale e in alcuni nuclei pontini. Da lì essi proiettano assoni alla corteccia in modo diffuso, al talamo e all'ippocampo (fig. 9). I recettori per l'acetilcolina si dividono in due tipi: nicotinici, canali per i cationi, e muscarinici, accoppiati alle proteine G. In genere l'acetilcolina è un mediatore eccitatorio.
Le monoamine costituiscono una grande famiglia della quale fanno parte la noradrenalina, l'adrenalina, la dopamina, la serotonina e l'istamina. La loro sintesi coinvolge più enzimi (tab. 2). Nonostante che le fibre monoaminergiche siano minoritarie, esse sono molto diffuse e possono avere un'influenza assai importante su molte funzioni cerebrali. Molti farmaci psicotropi, dagli antidepressivi agli antiparkinson, ai farmaci usati nella schizofrenia, agiscono modulando la secrezione o la sintesi o la liberazione di questi neurotrasmettitori.
La noradrenalina è sintetizzata da neuroni confinati nel midollo allungato, nel ponte e nel nucleo del tratto solitario. Essi proiettano in modo diffuso in quasi tutte le regioni del SNC, soprattutto nella corteccia, nell'ipotalamo e nel midollo spinale. L'adrenalina è meno diffusa della noradrenalina, i neuroni adrenergici sono soprattutto localizzati nel midollo allungato e proiettano a vari nuclei ipotalamici e al midollo spinale. I recettori adrenergici sono diversi, raggruppati in due grandi famiglie α e β, sempre accoppiati a proteine G (v. oltre). L'effetto dell'adrenalina o della noradrenalina dipende dal tipo di recettore eccitato e in genere è di tipo inibitorio.
La dopamina è sintetizzata soprattutto in neuroni concentrati nella sostanza nera, ipotalamo e bulbo olfattivo. La via più studiata è quella tra la sostanza nera e lo striato dove controlla la regolazione della mobilità. La degenerazione delle cellule dopaminergiche porta a una patologia imponente come quella del morbo di Parkinson, che può essere parzialmente curato somministrando un precursore della dopamina, la L-DOPA. Si conoscono almeno quattro recettori per la dopamina e tutti agiscono attraverso le proteine G.
La serotonina è sintetizzata a partire dal triptofano attraverso diverse tappe metaboliche, ed è distrutta dalle monoaminossidasi (tab. 2). I neuroni che la producono sono localizzati soprattutto nel rafe e nel midollo allungato e proiettano in modo diffuso alla corteccia, al midollo spinale e al cervelletto (fig. 9). La serotonina è connessa con importanti processi affettivi e conoscitivi e con il controllo di alcune funzioni importanti come la temperatura e l'appetito.
Molti farmaci antidepressivi si pensa funzionino attraverso un'attivazione delle vie serotoninergiche. I recettori serotoninergici sono di almeno cinque tipi: i recettori 5HT1, 2, 4 e 5 sono legati a proteine G; il 5HT3 è invece un canale ionico.
Aminoacidi. - Questi neurotrasmettitori sono tra i più abbondanti nel SNC e comprendono aminoacidi inibitori, come il GABA (acido γ-aminobutirrico) e la glicina, ed eccitatori, come il glutammato e l'aspartato. Il GABA è il più importante neurotrasmettitore inibitorio del SNC.
Il GABA è sintetizzato soprattutto da piccoli interneuroni distribuiti in quasi tutto il SNC; esso è anche sintetizzato da alcuni neuroni che proiettano dallo striato alla sostanza nera. I recettori per il GABA sono dei canali ionici selettivi per il cloro. Farmaci assai attivi nel sistema nervoso come ansiolitici e ipnotici, per es. le benzodiazepine e i barbiturici, come antiepilettici, per es. l'acido valproico, agiscono potenziando il sistema GABAergico.
La glicina è il neurotrasmettitore inibitorio presente nel midollo spinale. L'acido glutammico è il mediatore eccitatorio più diffuso nel SNC ed è sintetizzato da neuroni sparsi in molti nuclei del cervello; la sua secrezione è responsabile del controllo di molte funzioni importanti, quali la percezione di sensazioni e del dolore, l'apprendimento e la memoria. Inoltre, una disregolazione della sua secrezione che innalzi il suo livello negli spazi sinaptici, come si ha in un periodo di anossia, può portare a degenerazione neuronale.
Da un punto di vista sperimentale particolarmente studiato è il circuito ippocampale nel quale il glutammato è responsabile di un fenomeno molto importante, la long term potentiation, che è uno dei modelli più preziosi per analizzare i meccanismi con i quali si instaura e si mantiene la memoria (Sejnowski 1996).
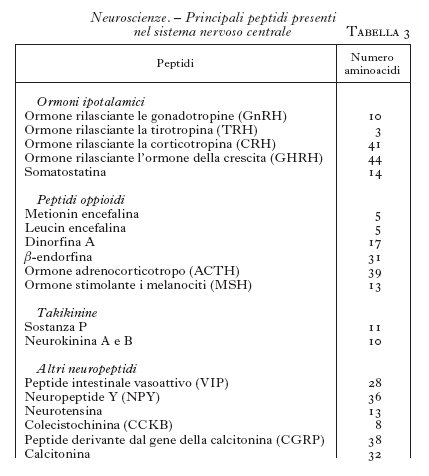
Neuropeptidi. - Dagli anni Settanta si è cominciato a isolare dal SNC alcuni piccoli peptidi che si è visto poi possedere attività neurotrasmettitoriali (Harmor 1987). Questi peptidi possono essere sintetizzati dagli stessi neuroni che sintetizzano i neurotrasmettitori classici. I primi studiati sono stati la ossitocina e la vasopressina, seguiti poi dagli ormoni ipotalamici, quali la somatostatina, il fattore per la liberazione della tirotropina (TRH), il fattore per la liberazione dell'ormone luteinizzante (LHRH), la colecistochinina, il peptide intestinale vasoattivo (VIP) ecc. Ma la scoperta più rilevante in questo settore ha riguardato i peptidi oppioidi, come le endorfine e le encefaline, peptidi che stimolano i recettori per la morfina. Finalmente si è capito in che modo funziona la morfina e con quale meccanismo essa produce gli effetti analgesici e quelli stimolanti o depressivi sul SNC. Si sperava anche di poter arrivare a farmaci analgesici che non avessero contemporaneamente gli effetti indesiderati della morfina, per es. la depressione dei centri respiratori o la farmacodipendenza; purtroppo, nonostante molte ricerche, non si è ancora ottenuto un farmaco analgesico ideale.
La scoperta di peptidi neurotrasmettitori così numerosi (v. un elenco dei più importanti in tab. 3) ha permesso di ampliare molto le conoscenze sulla trasmissione a livello del SNC e soprattutto di dare delle basi funzionali ad attività nervose non comprensibili sulla base delle attività dei neuromediatori classici. I neurotrasmettitori peptidici agiscono su recettori accoppiati a proteine G.
Dal punto di vista della biologia cellulare vi è una grande differenza tra i neurotrasmettitori classici e i neuropeptidi. Mentre i primi sono sintetizzati a livello del citoplasma sinaptico e trasportati poi nelle vescicole sinaptiche attraverso dei trasportatori, i neuropeptidi sono sintetizzati invece nel corpo cellulare, nel reticolo endoplasmatico, e di lì trasferiti nei granuli di secrezione che vengono poi trasportati fino alla sinapsi. Mentre le vescicole sinaptiche possono essere ricaricate di neurotrasmettitore dopo averlo liberato, questo non può avvenire per i granuli che contengono i peptidi; una volta svuotati del loro contenuto, essi non possono più essere ricaricati e la sinapsi deve essere rifornita di nuovi granuli dal corpo cellulare (McPherson, De Camilli 1994).
In genere si può ipotizzare che i veri neurotrasmettitori siano quelli di tipo classico, mentre i neuropeptidi agirebbero soprattutto da modulatori dell'attività neuronale. Solo le endorfine possono essere considerate dei veri neurotrasmettitori.
Citochine. Molto recentemente si è osservato che una serie di peptidi, estremamente importanti nella modulazione delle reazioni immunitarie, le citochine (IL-1; IL-12; TNF-α; LIF), hanno una azione rilevante sul sistema nervoso centrale e periferico (Rothwell, Hopkins 1995). Esse e i loro recettori sono presenti nelle cellule del cervello, sia neuroni che glia; non sembra abbiano funzioni come neurotrasmettitori, ma hanno grande influenza sulla liberazione dei neurotrasmettitori sia classici che peptidici. Esse hanno anche un effetto importante sulla crescita e sul differenziamento dei neuroni. Queste ricerche sono assai promettenti, non solo perché permettono di conoscere una nuova famiglia di modulatori del SN, ma anche perché finalmente permettono di entrare in quella scatola nera che sono i rapporti tra sistema nervoso e sistema immunitario. È noto che durante un periodo di stress è più facile ammalarsi per carenza di difese immunitarie; così anche in alcune patologie del sistema immunitario si hanno ripercussioni sul funzionamento del sistema nervoso. La neuropsicoimmunologia, dunque, costituisce una nuova branca delle neuroscienze che porterà molte nuove conoscenze, a loro volta sicuramente foriere di applicazioni di interesse clinico.
Gas. - Anche in questo caso piuttosto di recente, è stata trovata una nuova classe di neurotrasmettitori che è composta di due molecole: l'ossido d'azoto o monossido d'azoto o ossido nitrico (NO) e il monossido di carbonio (CO) (Bredt, Snyder 1994; Garthwaite 1991; Gross, Wolin 1995; Dawson, Dawson 1996). Queste due molecole (v. anche molecola: Molecole messaggere gassose, in questa Appendice) erano conosciute da molto tempo come gas tossici derivati da processi di combustione, di lavorazione industriale o di metabolismo batterico, presenti nel fumo di sigarette e considerati indicatori tipici per valutare l'inquinamento atmosferico. Studi recenti hanno potuto dimostrare che essi sono anche prodotti da cellule di mammiferi e che svolgono un ruolo assai rilevante come messaggeri biologici nel controllo di processi immunologici, cardiovascolari e anche nel sistema nervoso. La difficoltà di scoprire il ruolo biologico di queste molecole ha una ragione essenzialmente tecnica, in quanto esse sono dei gas con vita media assai breve, di qualche secondo. Mancavano quindi fino a oggi i mezzi per la loro precisa identificazione e per la loro determinazione. I recenti progressi della biologia molecolare hanno permesso di clonare gli enzimi che sintetizzano questi gas e quindi di studiare la loro localizzazione e funzione. La scoperta della funzione di neurotrasmettitori di queste sostanze ha sconvolto gli schemi classici elaborati in base ai neurotrasmettitori conosciuti e fin qui descritti, in quanto NO e CO: a) non sono contenuti in vescicole sinaptiche e rilasciati per esocitosi in seguito a depolarizzazione, come tutti gli altri mediatori; b) sono sintetizzati su richiesta da parte di enzimi la cui attività è quindi specificamente regolata; c) non si legano a recettori di membrana, ma diffondono liberamente tra ed entro le cellule, attivando enzimi o effettori intracitoplasmatici senza confini cellulari precisi; inoltre la loro azione termina quando incontrano un substrato o in seguito a decomposizione. Tali caratteristiche rendono questi trasmettitori molto particolari, perché il controllo della loro azione è soprattutto sugli enzimi che li sintetizzano, sugli effettori e su quei fattori che possono controllarne la diffusione o la vita media.
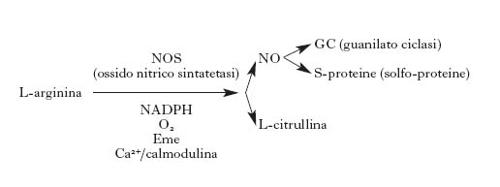
L'ossido di azoto è un mediatore presente in circa l'1÷2% dei neuroni centrali, distribuiti in molte regioni del SNC, ma soprattutto nella corteccia, nello striato e nell'ippocampo. La sua funzione fondamentale sarebbe quella di favorire la liberazione dei neurotrasmettitori potenziando così la risposta sinaptica. In particolare si è visto che NO è uno dei fattori essenziali per il manifestarsi del già citato fenomeno della long term potentiation (Barinaga 1991). Nel sistema nervoso periferico NO è un trasmettitore in alcuni punti essenziali, come nel plesso mienterico nell'intestino, dove regola il rilasciamento di quest'organo, e nei neuroni del pene, dove regola l'erezione. Inoltre NO è presente in molti gangli e nervi che regolano il rilassamento delle arteriole cerebrali, controllando quindi, attraverso il circolo cerebrale, l'attività metabolica dei distretti cerebrali. Ci sono chiare evidenze che molti effetti neurotossici che si manifestano nel SNC in seguito a insulti anossici o tossici sono mediati da una produzione esagerata di NO. Quest'ultimo è sintetizzato dalla NO sintetasi a partire dalla L-arginina, che viene convertita in L-citrullina e NO in presenza di NADPH (nicotinammideadenindinucleotide-2-fosfato ridotto) e ossigeno con il concorso di cinque elettroni.
Sono state clonate almeno tre forme di NO sintetasi: una endoteliale, una neuronale e una presente in cellule immunocompetenti e macrofagi. La NO sintetasi neuronale è sempre presente nei neuroni ma in qualche modo silente; la sua attività è scatenata da un aumento della concentrazione di calcio nel citosol. Un aumento di calcio produce quindi un immediato aumento di NO con l'attivazione degli effettori specifici. Tra le molecole che sono influenzate da NO il bersaglio più importante è certamente la guanilatociclasi, che viene attivata con un conseguente aumento del cGMP (guanosinmonofosfatociclico). Questo secondo messaggero sarebbe responsabile di molti degli effetti fisiologici di NO. Ma NO è un radicale libero e interagisce con molte altre molecole cellulari; esso S-nitrosila molti recettori, per es. il recettore glutammatergico di tipo NMDA, regolando così la trasmissione glutammatergica; deprime la glicolisi ADP, ribosilando la gliceraldeide-3-fosfato deidrogenasi; può inibire la sintesi di DNA attraverso l'inibizione della ribonucleotide reduttasi, e così molte altre molecole chiave del metabolismo neuronale possono essere controllate da NO.
NO reagisce anche con l'anione superossido producendo un potente ossidante, molto tossico per il neurone. Si pensa che in condizioni di anossia, quando vi è un'aumentata produzione di glutammato e quindi un forte aumento di calcio intracitoplasmatico, si abbia una attivazione massiccia della NO sintetasi, una produzione eccessiva di NO e la formazione di radicali ossidanti che portano a morte cellulare. Questo sarebbe il meccanismo della citotossicità di NO (Garthwaite 1991; Gross, Wolin 1995; Dawson, Dawson 1996).
Il monossido di carbonio fa parte della stessa famiglia di molecole e anche per questa ci sono evidenze che possa essere un neurotrasmettitore centrale. CO è formato dalla emeossigenasi (HO) che converte l'eme a CO e biliverdina, che è poi rapidamente trasformata in bilirubina. CO è un potente attivatore della guanilato ciclasi e quindi, come NO, potrebbe essere un regolatore fisiologico del cGMP. La HO è presente nel cervello in aree discrete come l'ippocampo, l'ipotalamo e il sistema olfattivo. In quest'area sembra che CO possa svolgere una funzione importante sia come mediatore del segnale sinaptico, sia come regolatore dello sviluppo durante l'ontogenesi (Broillet, Firenstein 1996).
Recettori
Le altre molecole chiave nella trasmissione neuronale sono i recettori. Essi trasducono il messaggio portato dal neurotrasmettitore all'interno della cellula postsinaptica (Clementi 1996).
Per recettore si intende una molecola che lega in modo specifico, definito e con affinità precisa, uno o più mediatori endogeni e che da questo legame subisce una trasformazione conformazionale capace di far scaturire un effetto biologico. Non è quindi sufficiente che una proteina leghi un ormone o un neurotrasmettitore per definirla un recettore: per es. l'albumina, che lega gli acidi grassi, o la ceruloplasmina, che lega il rame, non sono recettori.
I recettori per i neurotrasmettitori trasducono il segnale dall'esterno all'interno della cellula in quanto i mediatori che attivano questi recettori sono sostanze idrofile che difficilmente passano la membrana cellulare. I meccanismi di trasduzione del segnale sono molto diversi per i vari recettori, ed è attraverso questa diversità che si attua la specificità della risposta cellulare ai vari neurotrasmettitori.
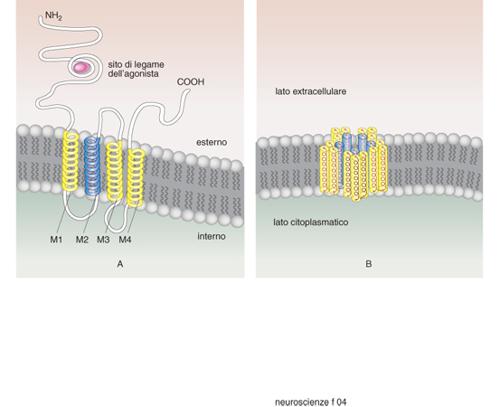
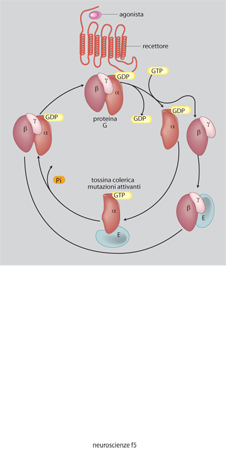
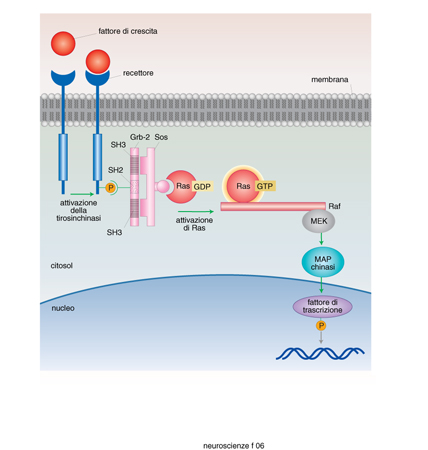
Le superfamiglie recettoriali. - I recettori per i neurotrasmettitori si possono raggruppare in quattro famiglie composte ciascuna da numerosi membri: recettori-canale, recettori accoppiati alle proteine G, recettori che attivano una tirosinchinasi intrinseca, e da ultimo la piccola famiglia dei recettori che attivano una guanilatociclasi intrinseca (fig. 10). La maggioranza dei neurotrasmettitori agisce attivando recettori associati a canali o a proteine G, e i fattori di crescita attivando i recettori proteinchinasici (Heinemann, Stühmer 1993). La stimolazione da parte di un neurotrasmettitore di un tipo di recettore rispetto a un altro non è evento indifferente. L'apertura di un canale comporta una trasduzione del segnale molto rapida, mentre l'attivazione di una proteina G o di una proteinchinasi porta a una risposta più lunga e più lenta. Quasi tutti i neurotrasmettitori possono attivare sia canali sia G proteine (tab. 4) e indurre quindi nella cellula bersaglio risposte rapide o lente. È importante conoscere quali sottotipi recettoriali sono presenti in una cellula per capire quale sarà la sua risposta a un determinato neurotrasmettitore.
Recettori-canale. - Sono costituiti da un canale ionico che viene aperto in seguito al legame con il neurotrasmettitore o con farmaci agonisti. L'attivazione di questi recettori porta perciò a rapidi cambiamenti delle concentrazioni ioniche intracellulari e quindi del potenziale elettrico a cavallo della membrana plasmatica (Bertrand, Changeux 1995; Gotti, Fornasari, Clementi 1997; Stephenson 1995; Sargent 1993; Unwin 1993; Gotti, Clementi 1996). A questa famiglia appartengono i recettori nicotinici, il recettore A per il GABA, il recettore per la glicina, i recettori ionotropi per il glutammato, il recettore HT3 per la serotonina. Essi hanno tutti una struttura simile e hanno una particolare storia evolutiva (Ortells, Lunt 1995): sono composti da 4 o 5 subunità che delimitano un canale idrofilo attraverso il quale passano gli ioni (fig. 11).
Ogni subunità è formata da una catena polipeptidica che attraversa quattro volte la membrana plasmatica in corrispondenza di altrettante regioni ricche di aminoacidi idrofobici (regioni chiamate M). Il canale è delimitato dalle regioni M2 di ciascuna subunità. La selettività della carica ionica che attraversa il canale è data dalla presenza di aminoacidi elettricamente carichi posti nella regione M2 di ciascuna subunità in posizione tale da costituire degli anelli di carica positiva o negativa all'interno del canale. Il recettore canale seleziona quindi gli ioni sia per la loro dimensione sia per la loro carica.
Il sito di legame per il neurotrasmettitore o per i farmaci - il sito cioè responsabile della apertura e chiusura del canale - è posto all'esterno della membrana cellulare in un territorio vicino al terminale amminico nella subunità. Sulla superficie extracellulare del recettore sono spesso presenti siti di legame per altre sostanze regolatrici, detti siti allosterici, in quanto la loro occupazione modifica le caratteristiche di attivazione recettoriale da parte dell'agonista principale. Nella parte citoplasmatica i recettori possono contenere dei siti di fosforilazione, importanti per la regolazione delle cinetiche di apertura e chiusura del canale ionico, e dei siti di legame con le proteine del citoscheletro che ne garantiscono la stabilità e la giusta localizzazione nella membrana cellulare.
I farmaci attivi su questa classe di recettori possono avere come bersaglio il sito di legame per l'agonista naturale (per es. i curari, che impediscono l'apertura del recettore nicotinico), oppure possono legarsi al sito allosterico (per es. le benzodiazepine, che favoriscono l'apertura del recettore A del GABA). Infine, alcuni farmaci possono interferire con le proprietà biofisiche e funzionali del canale legandosi a siti posti nel lume del canale stesso (per es. i barbiturici che, legandosi nel canale del recettore GABA A, lo tengono sempre aperto favorendo un aumento eccessivo dei processi inibitori).
Recettori accoppiati alle proteine G. Questa è la famiglia più numerosa di recettori e il bersaglio della maggior parte dei farmaci utilizzati in terapia. La caratteristica di questi recettori è di trasdurre il segnale generato dal legame con il mediatore attivando una proteina G (Coughlin 1994; Hille 1992; Linder, Gilman 1992; Vallar, Vicentini 1996). Le proteine G rappresentano una famiglia di molecole proteiche eterotrimeriche e derivano il loro nome dalla capacità di legare il GTP e di possedere una attività GTPasica intrinseca. Le tre subunità che costituiscono ciascuna proteina G vengono chiamate α, β e γ ed è solo la subunità α che è capace di legare e idrolizzare il GTP.
Quando uno di questi recettori viene attivato dal suo agonista, esso subisce una modificazione conformazionale grazie alla quale riesce ad attivare una specifica proteina G che, a sua volta, lega una molecola di GTP presente nel citoplasma; il legame con il GTP provoca la dissociazione delle tre subunità e l'attivazione della subunità α. Quest'ultima rimane attiva finché non riesce a idrolizzare il GTP in GDP grazie alla sua attività GTPasica intrinseca. Durante la fase di attivazione, la subunità α modula l'attività di effettori quali le adenilatociclasi, le fosfolipasi C e A2 e alcuni canali ionici (Berridge 1993; Hille 1992; Tang, Gilman 1992; Vallar, Vicentini 1996; fig. 12). Ogni proteina G attiva in modo specifico solo determinati effettori (tab. 5). L'attivazione delle adenilatociclasi e delle fosfolipasi produce la sintesi di secondi messaggeri, quali adenosin monofosfato ciclico (cAMP), inositolo trisfosfato (IP3), diacilglicerolo (DG), acido arachidonico, che attivano una serie di reazioni enzimatiche a cascata responsabili dell'effetto biologico indotto dall'attivazione recettoriale.
Quindi il legame dell'agonista con un recettore accoppiato a proteine G può portare alla produzione di molte molecole di secondi messaggeri, ciascuna delle quali può attivare numerose altre molecole enzimatiche in una cascata che sempre più si amplifica.
Una conseguenza di questa cascata amplificatrice di eventi biochimici è che la durata degli effetti indotti dall'attivazione di questa classe di recettori può essere anche dell'ordine di minuti e dipende non solo dalla durata dell'interazione farmaco-recettore, ma soprattutto dall'efficienza di meccanismi cellulari specifici preposti alla riduzione della concentrazione del secondo messaggero e all'abolizione delle modificazioni post-traduzionali da esso indotte.
I recettori accoppiati a proteine G sono inclusi in un'unica superfamiglia genica, in quanto hanno una organizzazione molecolare comune: essi sono formati da una singola catena polipeptidica che attraversa sette volte la membrana plasmatica in corrispondenza di altrettante regioni idrofobiche e che si organizza spazialmente nella membrana in modo da costituire una particella globulare (fig. 10). Il sito di legame per il neurotrasmettitore si trova nelle porzioni transmembranarie o extracellulari della sequenza aminoacidica. Il tratto di sequenza compreso tra le regioni transmembrana 5 e 6 è rivolto verso il citoplasma e presenta siti di fosforilazione, importanti per la funzionalità del recettore, e un sito per il riconoscimento delle proteine G; questo sito permette a ciascun recettore di riconoscere e di legarsi solo ad alcuni tipi di proteina G ed è quindi responsabile della specificità di interazione tra recettore e proteina G.
Recettori con attività tirosinchinasica. A questa famiglia appartengono i recettori non di neurotrasmettitori ma di fattori responsabili del trofismo, del differenziamento e della sopravvivenza dei neuroni (Comoglio, Boccaccio 1996; Fantl, Johnson, Williams 1993). Tra questi il primo a essere stato conosciuto è il fattore per la crescita neuronale (NGF, Nerve Growth Factor), scoperto da R. Levi-Montalcini, al quale se ne sono associati altri come il Brain Derived Growth Factor (BDGF), i Neurotrophic Factors (NT3 e NT4). Essi sono costituiti da una catena polipeptidica che attraversa una sola volta la membrana cellulare e sono caratterizzati dal fatto di possedere un'attività tirosinchinasica intrinseca: sono quindi capaci di fosforilare substrati proteici in corrispondenza di residui tirosinici (fig. 10). L'interazione ligando-recettore avviene a livello della porzione extracellulare della sequenza aminoacidica e porta alla dimerizzazione del recettore, che è la tappa responsabile della attivazione della tirosinchinasi intrinseca. L'autofosforilazione di residui tirosinici presenti nella porzione citoplasmatica del recettore porta alla sua associazione con una serie di proteine citoplasmatiche, alcune delle quali sono enzimi che iniziano una complessa cascata di eventi che inducono la cellula a proliferare o a differenziarsi (fig. 13). Molti oncogeni sono recettori per fattori di crescita che, a causa di mutazioni o delezioni di parte della proteina, hanno perso la loro regolazione fisiologica.
Modulazione patologica e farmacologica della comunicazione neuronale
Integrazione di più informazioni e risposta neuronale. - Come si è detto, un neurone è in grado di ricevere alla sua superficie più di 100.000 sinapsi, ognuna portatrice di una particolare informazione da un particolare circuito nervoso. Se si suppone che in ogni sinapsi ci possa essere più di un tipo di trasmettitore e/o più di un recettore, si può ben immaginare quante informazioni possano arrivare contemporaneamente a un neurone e influenzarne la risposta. Inoltre, l'attivazione di un recettore non rimane isolata, ma può riflettersi sulla funzionalità di altri recettori o canali. L'attivazione di un recettore β-adrenergico, per es., produce un aumento di AMP ciclico e una attivazione di proteinchinasi A; queste possono fosforilare non soltanto il β recettore disattivandolo, ma anche altri recettori e altri canali ionici di membrana, modificandone le proprietà. Vi è quindi spesso un controllo reciproco tra i vari recettori che può portare a un aumento o diminuzione delle loro attività.
La cellula neuronale quindi è una sorta di computer che riceve informazioni molteplici, le elabora in modi non ancora del tutto chiariti e infine produce la sua risposta. La compromissione della funzione di una sola molecola neuronale, sia un canale o un recettore, per opera di farmaci o di agenti patogeni, può quindi portare a grandi modificazioni della risposta di un neurone squilibrando molto l'omeostasi dei circuiti neuronali.
Come è facile ipotizzare, molte patologie umane nascono da modificazioni di numero o di struttura di molecole coinvolte nella trasmissione dell'impulso nervoso. Spesso le alterazioni sono più supposte, per es. attraverso l'azione positiva di farmaci, che non sperimentalmente provate; ci si limiterà quindi a esaminare alcune patologie nelle quali le modificazioni sono conclamate e sperimentalmente provate, in quanto esse possono dare un'idea precisa di come l'omeostasi di un sistema può venire perturbata con la modifica di una di queste molecole, portando alcuni esempi che coinvolgono i recettori e i sistemi di trasduzione del messaggio neuronale.
a) I recettori nicotinici. La miastenia grave è una patologia che colpisce la giunzione neuromuscolare provocando una difficoltà della trasmissione tra nervo e muscolo; questo porta a una affaticabilità dei muscoli e a una progressiva loro paralisi. In questi ultimi anni si è scoperto che la paralisi era dovuta a un numero minore di recettori colinergici nicotinici presenti nella giunzione neuromuscolare; l'acetilcolina, quindi, secreta in quantità e con modalità normali dalla sinapsi, trova a livello postsinaptico un numero minore di recettori con i quali interagire e non può garantire una efficiente trasmissione dell'impulso. La diminuzione dei recettori è provocata da anticorpi anti-recettore nicotinico che ne aumentano la distruzione. La terapia che oggi si attua consiste in parte nell'aumentare la vita dell'acetilcolina nello spazio sinaptico attraverso l'inibizione dell'acetilcolinesterasi, ma fondamentalmente nel bloccare la produzione di autoanticorpi attraverso farmaci immunosoppressori (Drachman 1994). In questi anni si sono poi scoperte numerose forme di miastenia congenita dovute a mutazione del recettore nicotinico muscolare, che, mutato, cambia le sue proprietà funzionali (Engel, Ohno, Milone et al. 1997). Ancora una mutazione del recettore nicotinico, ma di tipo neuronale, sulla subunità α4 sembra essere responsabile di una grave forma di epilessia (Steilein, Muller, Propping et al. 1997).
b) Trasduzione del segnale. In questi anni sono state descritte molte patologie legate a mutazioni o dei recettori o delle proteine G a essi associate. Tra le prime si ricordano la retinite pigmentosa causata da rodopsina alterata, il diabete insipido nefrogenico causato da un recettore mutato per la vasopressina, alcune forme di nanismo dovute all'alterazione del recettore per l'ormone della crescita; tra le seconde: adenomi dell'ipofisi dovuti ad attivazione congenita della proteina Gsa, tumori della tiroide dovuti ad attivazione della proteina Gia. Recentemente sono state descritte mutazioni anche dei recettori α1, α2, β2 per le catecolamine che probabilmente possono spiegare alcune patologie del SNP (Vallar, Vicentini 1996). Con la diffusione sempre più ampia delle tecniche di biologia molecolare è prevedibile che patologie del SNC con alta familiarità possano essere spiegate attraverso mutazioni strutturali di proteine coinvolte nella trasmissione nervosa.
Oltre a queste patologie conclamate, vi sono poi numerose situazioni patologiche nelle quali si sospetta che possa essere presente un'alterazione in alcuni punti della trasmissione nervosa, senza avere però delle prove precise. Le maggiori indicazioni vengono dall'uso dei farmaci. Per es. si conosce l'uso benefico delle benzodiazepine nell'ansia; dato che esse agiscono sul recettore GABAergico, si suppone che nell'ansia vi sia una alterazione di questo sistema di trasduzione dell'informazione nervosa.
I farmaci come strumenti specifici per analizzare e modificare la comunicazione nervosa. - I farmaci non solo sono stati strumenti essenziali per capire il funzionamento del SN, ma hanno anche permesso di intervenire terapeuticamente su molte malattie del SN, recuperando, almeno in parte, alla vita e alla dignità umana persone che sarebbero altrimenti o relegate ai confini della società o schiacciate da grandi dolori e angosce. Si pensi, per es., all'evoluzione della schizofrenia, della depressione, della paranoia: l'introduzione degli psicofarmaci ha contribuito a modificare profondamente anche l'ospedalizzazione dei malati di queste patologie e a trasformare radicalmente gli ospedali psichiatrici.
La complessa struttura che sottostà alla trasmissione nervosa fa sì che vi siano molti possibili bersagli per un intervento farmacologico. Nella tab. 6 sono riportati alcuni esempi di farmaci che vengono comunemente usati in terapia per mostrare come essi agiscano su un bersaglio ben preciso e come, agendo su bersagli comuni, si possano avere effetti diversi; per es. i farmaci che bloccano i canali al Na⁺ voltaggio-dipendenti possono svolgere azione insetticida se bloccano i canali al Na⁺ degli insetti, azione anestetica locale se bloccano i canali posti nei nervi, antiaritmica se bloccano i canali del cuore o antiepilettica se bloccano i canali nel SNC. Spesso queste azioni possono essere possedute da una stessa molecola, ma più frequentemente si è saputo sfruttare alcune piccole differenze nelle molecole, o una loro diversa localizzazione tessutale, in modo da rendere il farmaco il più specifico possibile.
Nonostante i grandi progressi della biologia molecolare e della farmacologia, bisogna riconoscere che si è ancora molto lontani dal comprendere quale sia la causa delle malattie del SNC; è, quindi, ancora molto lontana la messa a punto di una terapia causale e specifica. Altrettanto vero, però, è che i progressi fin qui fatti permettono, pur se l'approccio non può dirsi ottimale, di alleviare molti sintomi delle malattie nervose e, quindi, di tenerle sotto controllo.
bibliografia
J.C. Eccles, Sinapsi, in Enciclopedia del Novecento, 4° vol., Istituto della Enciclopedia Italiana, Roma 1982, ad vocem.
A.J. Harmor, Neuropeptides, in Transmitter molecules in the brain, contributions by G. Flink et al., Berlin-New York 1987, pp. 17-26.
J.K. McQueen, Classical transmitters and neuromodulators, in Transmitter molecules in the brain, contributions by Flink et al., Berlin-New York 1987, pp. 7-16.
M. Barinaga, Is nitric oxide the 'retrograde messenger'?, in Science, 1991, 254, pp. 1296-97.
J. Garthwaite, Glutamate, nitric oxyde and cell-cell signalling in the nervous system, in Trends in neurosciences, 1991, 14, pp. 60-67.
B. Hille, G Protein-coupled mechanisms and nervous signaling, in Neuron, 1992, 9, pp. 187-95.
M.E. Linder, A.G. Gilman, Le proteine G, in Le Scienze, 1992, 289, pp. 40-49.
W.J. Tang, A.G. Gilman, Adenylcyclases, in Cell, 1992, 70, pp. 869-72.
D. Attwell, B. Barbour, M. Szatkowski, Nonvesicular release of neurotransmitter, in Neuron, 1993, 11, pp. 401-07.
M.J. Berridge, Inositol trisphosphate and calcium signalling, in Nature, 1993, 361, pp. 315-25.
W.J. Fantl, D.E. Johnson, L.T. Williams, Signalling by receptor tyrosine kinases, in Annual review of biochemistry, 1993, pp. 453-81.
S. Heinemann, W. Stühmer, Signalling mechanisms, in Current opinion in neurobiology, 1993, pp. 407-500.
P.B. Sargent, The diversity of neuronal nicotinic acetylcholine receptors, in Annual review of neurosciences, 1993, pp. 403-43.
N. Unwin, Neurotransmitter action: opening of ligand-gated ion channels, in Cell, 1993, 72, pp. 31-41.
D. Attwell, P. Mobbs, Neurotransmitter transporters, in Current opinion in neurobiology, 1994, pp. 353-59.
D.S. Bredt, S.H. Snyder, Nitric oxide: a physiologic messenger molecule, in Annual review of biochemistry, 1994, pp. 175-95.
S.R. Coughlin, Expanding horizons for receptors coupled to G proteins: diversity and disease, in Current opinion in cell biology, 1994, 6, pp. 191-97.
D.B. Drachman, Myasthenia gravis, in New England journal of medicine, 1994, 330, pp. 1797-810.
P.S. McPherson, P. De Camilli, Recycling and biogenesis of synaptic vesicles, in Seminars in neurosciences, 1994, pp. 137-47.
T. Söllner, J.E. Rothman, Neurotransmission: harnessing fusion machinery at the synapse, in Trends in neurosciences, 1994, pp. 344-48.
D. Bertrand, J.-P. Changeux, Nicotinic receptor, an allosteric protein specialized for intercellular communication, in Seminars in neurosciences, 1995, pp. 75-90.
S.S. Gross, M.S. Wolin, Nitric oxide: pathophysiological mechanisms, in Annual review of physiology, 1995, pp. 737-69.
A. Nordberg, Imaging of nicotinic receptors in human brain, in Brain imaging of nicotine and tobacco smoking, ed. E.F. Domino, Ann Arbor (Mich.) 1995, pp. 45-57.
M.O. Ortells, G. Lunt, Evolutionary history of the ligand-gated ion-channel superfamily of receptors, in Trends in neurosciences, 1995, pp. 121-27.
N.J. Rothwell, S.J. Hopkins, Cytokines and the nervous system. ii: Actions and mechanisms of action, in Trends in neurosciences, 1995, pp. 130-36.
F.A. Stephenson, The GABA A receptors, in Biochemical journal, 1995, 310, pp. 1-9.
T. Sudhof, The synaptic vesicle cycle: a cascade of protein-protein interactions, in Nature, 1995, 375, pp. 645-53.
M.C. Broillet, S. Firestein, Gaseous second messengers in vertebrate olfaction, in Journal of neurobiology, 1996, pp. 49-57.
F. Clementi, I recettori, in Farmacologia generale, a cura di F. Clementi, G. Fumagalli, Torino 1996, pp. 42-49.
P.M. Comoglio, C. Boccaccio, I recettori per i fattori di crescita, in Farmacologia generale, a cura di F. Clementi, G. Fumagalli, Torino 1996, pp. 83-92.
V.L. Dawson, T.M. Dawson, Nitric oxide actions in neurochemistry, in Neurochemistry international, 1996, pp. 97-110.
C. Gotti, F. Clementi, I recettori-canale, in Farmacologia generale, a cura di F. Clementi, G. Fumagalli, Torino 1996, pp. 50-59.
O. Lounasmaa, M. Hamalainen, R. Hari et al., Information processing in the human brain: magnetoencephalographic approach, in Proceedings of the National Academy of Sciences of the United States of America, 1996, pp. 8809-15.
T. Sejnowski, Synapses get smarter, in Nature, 1996, 382, pp. 759-60.
L. Vallar, L.M. Vicentini, Recettori accoppiati alle proteine G, in Farmacologia generale, a cura di F. Clementi, G. Fumagalli, Torino 1996, pp. 60-71.
A. Engel, K. Ohno, M. Milone et al., Congenital myasthenic syndromes caused by mutations in acetylcholine receptor genes, in Neurology, 1997, Suppl. 5, pp. 28-35.
Y. Goda, SNAREs and regulated vesicle exocytosis, in Proceedings of the National Academy of Sciences of the United States of America, 1997, pp. 769-72.
C. Gotti, D. Fornasari, F. Clementi, Human neuronal nicotinic receptors, in Progress in neurobiology, 1997, 53, pp. 199-237.
O. Steilein, J. Muller, P. Propping et al., A missense mutation in the neuronal nicotinic receptor alpha-4 subunit is associated with autosomal dominant nocturnal frontal lobe epilepsy, in Nature genetics, 1997, 11, pp. 201-03.
N.D. Volkov, B. Rosen, L. Farde, Imaging the living human brain. Magnetic resonance imaging and positron emission tomography, in Proceedings of the National Academy of Sciences of the United States of America, 1997, pp. 2787-88.