OGM vegetali
OGM vegetali
La sigla OGM (Organismi geneticamente modificati), quando viene riferita all’agricoltura, indica le piante il cui patrimonio genetico è stato modificato ricorrendo agli strumenti dell’ingegneria genetica. In sostanza si tratta di piante in cui sono stati inseriti in modo mirato uno o più geni estranei (i cosiddetti transgeni), che servono a produrre proteine normalmente assenti in quella specie vegetale e sono in grado di conferirle caratteristiche agronomiche o qualitative desiderate. Più raramente il transgene che viene introdotto, piuttosto che a produrre una nuova proteina, serve a sopprimere l’azione di un gene endogeno responsabile di caratteristiche indesiderate. In entrambi i casi si ottengono piante che sarebbe più opportuno definire transgeniche, perché le varietà agricole prodotte per incrocio – e chiamate convenzionali – in realtà sono state anch’esse geneticamente modificate per mezzo di strumenti diversi da quelli dell’ingegneria genetica.
Rispetto a queste tecniche convenzionali di miglioramento genetico attraverso incroci, o breeding, l’ingegneria genetica offre almeno due vantaggi sostanziali, in termini di efficienza e di ampiezza del raggio di azione. Gli specialisti che si dedicano al miglioramento genetico utilizzando i sistemi classici (breeder) possono trasferire un carattere alla specie di interesse solo se questo carattere è presente in una pianta donatrice che sia sessualmente compatibile con la ricevente o che possa essere resa tale in condizioni di laboratorio. Un biotecnologo, invece, può cercare in qualsiasi specie (batterica, vegetale o animale) il carattere che desidera trasferire e ha quindi la possibilità di raggiungere risultati che al breeder sono preclusi. Inoltre il breeding è un processo lungo e laborioso, che richiede in media una decina di anni, perché l’incrocio comporta il completo mescolamento dei genomi delle due piante parentali e l’ibrido prodotto, oltre ad acquisire la caratteristica richiesta, eredita dalla pianta donatrice anche migliaia di geni indesiderati che devono essere eliminati attraverso molti cicli di reincrocio. L’ingegneria genetica, invece, consente di effettuare interventi mirati, perché il gene di interesse viene isolato dall’organismo donatore, modificato in modo da poter essere trascritto efficientemente dall’organismo ricevente e quindi inserito in cellule vegetali che, poste nel terreno di coltura appropriato, sono in grado di dividersi, sviluppare radici e rigenerare intere piante.
Queste caratteristiche di efficienza e versatilità appaiono utili per portare avanti l’opera di miglioramento genetico che l’uomo ha avviato con la nascita dell’agricoltura e ha proseguito con gli strumenti che la tecnologia rendeva via via disponibili. L’innovazione tecnologica in agricoltura, infatti, si prefigura come una necessità pressante anche per il XXI sec., nei paesi sviluppati e ancor più in quelli in via di sviluppo. L’agricoltura è chiamata ad affrontare molteplici sfide: produrre sempre di più e meglio, in un mondo alle prese con i cambiamenti climatici, oltre che con agenti patogeni in continua evoluzione, soddisfacendo le complesse esigenze alimentari di una popolazione che è destinata a crescere ancora per alcuni decenni e contribuendo a uno sviluppo sostenibile. Per riuscirci sarebbe necessario replicare gli exploit della ‘rivoluzione verde’, che nella seconda metà del secolo scorso ha ridotto significativamente la denutrizione in Asia e America Latina, ma senza pagare gli stessi costi in termini di impatto ambientale. Gli ostacoli principali in questa direzione sono di natura politica ancor prima che scientifica, a cominciare dalla scarsità degli investimenti a favore della ricerca agraria nel Sud del mondo.
Trasferimento genetico
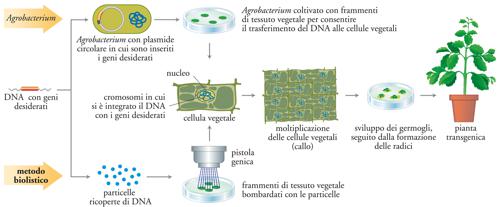
Il trasferimento di geni nelle cellule vegetali può avvenire sfruttando un batterio (Agrobacterium tumefaciens) che è una sorta di ‘ingegnere’ naturale perché è dotato di un piccolo cromosoma circolare, chiamato plasmide tumor inducing, capace di indurre la formazione di tumori vegetali integrandosi nei cromosomi della pianta ospite. Una volta rimossi i geni responsabili del tumore e inseriti i geni che si vogliono trasferire alla pianta di interesse, l’Agrobacterium diventa un efficace vettore per la trasformazione delle cellule vegetali. Tra i metodi disponibili c’è anche quello biolistico, che sfrutta un getto di aria compressa per bombardare le cellule vegetali con microproiettili di metallo ricoperti con il DNA contenente i geni desiderati (fig. 2): solo alcune delle cellule vegetali risulteranno trasformate, perciò il gene di interesse viene affiancato da un gene marcatore la cui presenza consente di distinguere rapidamente le cellule transgeniche (tra i primi marcatori utilizzati figurano geni per la resistenza agli erbicidi o agli antibiotici non più in uso nella pratica clinica). Da quando l’Acrobacterium è stato ottimizzato anche per le piante monocotiledoni, comunque, il sistema biolistico è meno utilizzato. Qualunque sia il metodo di trasformazione adottato, non è ancora possibile dirigere l’inserzione del transgene in punti prescelti del genoma vegetale; è perciò necessario esaminare le piante transgeniche prodotte per selezionare quelle in cui il gene estraneo si esprime correttamente senza danneggiare le funzioni vitali e le prestazioni agronomiche della pianta.
Miglioramento genetico convenzionale
Benché l’attenzione generale sia rivolta esclusivamente alle piante transgeniche, molte metodiche convenzionali di miglioramento genetico attualmente in uso sono altrettanto artificiali e invasive dell’ingegneria genetica. I breeder, infatti, possono forzare l’incrocio tra piante di specie – talvolta addirittura di generi – diverse, producendo combinazioni impossibili da ottenere in natura. Una variante di queste tecniche, nota con il nome di salvataggio degli embrioni, consente di prelevare gli embrioni abortiti che derivano da questi incroci estremi e di coltivarli in condizioni artificiali simili a quelle fornite dall’endosperma e dai tessuti materni del seme. Se l’incrocio non è possibile neppure in questo modo, si può ricorrere alla fusione di cellule somatiche, fino ad arrivare a veri e propri interventi di manipolazione dei nuclei cellulari o di ingegneria cromosomica. Per velocizzare il lavoro, inoltre, in alcuni casi si può ricorrere al cosiddetto breeding aploide, ossia all’incrocio di piante ottenute raddoppiando artificialmente il corredo cromosomico dei gameti vegetali (polline od ovuli) che quindi hanno due copie identiche di ogni gene. Un’altra tecnica di miglioramento genetico convenzionale è il cosiddetto mutation breeding, che consiste nell’esporre le piante di interesse ad agenti mutageni (sostanze chimiche o radiazioni ionizzanti) che inducono mutazioni casuali nel loro genoma. La quasi totalità di queste mutazioni ha effetti dannosi o addirittura letali, ma in qualche caso può comparire un tratto genetico interessante dal punto di vista commerciale. In alternativa i breeder possono stimolare le cellule vegetali a dividersi formando una massa callosa, selezionando poi le cellule mutate a causa della proliferazione incontrollata e uccidendo chimicamente tutte le altre.
Paradossalmente, l’opposizione di parte dell’opinione pubblica agli OGM potrebbe contribuire a un rilancio di queste tecnologie, che sono assai più imprecise dell’ingegneria genetica, ma non sono soggette a obblighi di etichettatura. Alla fine degli anni Novanta, per esempio, sono state messe in commercio una varietà di soia e una di colza resistenti agli erbicidi, prodotte per mutagenesi chimica la prima, e ricorrendo alla selezione cellulare la seconda. Una delle obiezioni mosse agli OGM riguarda la possibilità che il gene estraneo passi attraverso l’impollinazione ad altre specie sessualmente compatibili presenti nella stessa area geografica. Ma è evidente che la diffusione accidentale ad altre specie vegetali di un carattere nuovo (per es., la resistenza a un erbicida) presenta lo stesso tipo di rischi, indipendentemente dal fatto che questo carattere derivi da un intervento di ingegneria genetica o da mutagenesi indotta. Considerazioni analoghe valgono anche per il rischio che l’inserzione del transgene possa interferire con il normale metabolismo della pianta, determinando la comparsa di nuove tossine o una maggiore produzione delle molecole tossiche normalmente presenti. Il miglioramento genetico convenzionale, infatti, può causare lo stesso genere di incidenti e in letteratura sono riportati alcuni casi in cui ciò si è verificato. Ciò nonostante, prima di ottenere il via libera alla commercializzazione, le piante transgeniche vengono sottoposte a severi controlli: a partire dallo studio del profilo molecolare fino alle prove tossicologiche su cavie; mentre per piante analoghe, prodotte con tecniche convenzionali, vale una sorta di deregulation.
Dai laboratori ai campi
La corsa scientifica
I primi OGM vegetali hanno ricevuto l’autorizzazione dalle autorità competenti americane a metà degli anni Novanta e sono stati coltivati su scala commerciale, coronando gli sforzi decennali di un piccolo numero di laboratori impegnati a contendersi meriti scientifici e diritti di proprietà intellettuale su ogni scoperta chiave. La nascita ufficiale dell’ingegneria genetica vegetale risale al 18 gennaio 1983, quando al Miami winter symposium on molecular genetics of plants and animals, tre gruppi di ricerca annunciarono contemporaneamente di aver trasferito per la prima volta in cellule vegetali un gene marcatore, quello per la resistenza all’antibiotico kanamicina. Si tratta di due gruppi (quello di Mary-Dell Chilton, della Washington University di St. Louis, Stati Uniti, e quello di Jeff Schell e Marc van Montagu, dell’Università di Gent in Belgio) che avevano già contribuito a fondare la nascente disciplina svelando i segreti dell’Agrobacterium tumefaciens e di un’industria agrochimica destinata a guidare la rivoluzione biotecnologica in agricoltura, la Monsanto di St. Louis. Proprio la Monsanto vanta il primato di essere riuscita a produrre le prime piante transgeniche (delle petunie) utilizzando cellule vegetali ingegnerizzate; pur assicurandosi i diritti di proprietà intellettuale sul promotore virale più utilizzato per far esprimere i transgeni nelle piante (il 35S), questa industria non è riuscita a ottenere il brevetto sull’utilizzazione dell’Agrobacterium. Per tutti gli anni Ottanta, quindi, la prima generazione di biotecnologie vegetali è andata alla ricerca di applicazioni pratiche per gli strumenti molecolari appena messi a punto. Il primo successo commerciale ottenuto dall’ingegneria genetica vegetale è consistito nella produzione di piante resistenti agli erbicidi ad azione totale, che hanno permesso di utilizzare un unico prodotto diserbante per eliminare tutte le specie infestanti senza danneggiare le piante di interesse, liberando gli agricoltori dal compito di diserbare meccanicamente il terreno prima della semina e poi di controllare la crescita delle infestanti applicando diversi prodotti ad azione selettiva. A battere tutti sul tempo fu una piccola compagnia californiana, la Calgene, che nel 1985 utilizzò un gene per la resistenza all’erbicida Roundup identificato in un batterio mutante. Qualche anno dopo essa sarebbe divenuta famosa per la commercializzazione del primo prodotto transgenico (un pomodoro che poteva essere conservato per un lungo periodo grazie al silenziamento del gene che provocava il rammollimento durante la maturazione, scomparso però rapidamente dal mercato). Risultati via via migliori nel campo della resistenza agli erbicidi furono conseguiti anche da altre compagnie, tra cui la casa produttrice del Roundup, la Monsanto, utilizzando dapprima un gene di petunia, poi un gene batterico. Nel 1986 fu la volta della resistenza ai virus: un ricercatore della Monsanto, infatti, riuscì a introdurre nel DNA del tabacco il gene che esprime una proteina virale di superficie, riproducendo quel fenomeno naturale per cui le piante possono acquisire una certa immunità agli attacchi virali quando sono infettate da un virus. Subito dopo fu raggiunto il traguardo della resistenza agli insetti (Coleotteri, Lepidotteri, Ditteri), grazie all’impiego di una classe di geni che derivano da un batterio del suolo, il Bacillus thuringiensis, le cui spore sono utilizzate da decenni in agricoltura in quanto una volta ingerite risultano letali per le larve. Questi geni, chiamati Bt, rappresentarono da subito uno dei principali obiettivi di tutti i gruppi di ricerca del settore e furono alla base di alcuni dei prodotti transgenici di maggiore successo. Nel 1987 si ottennero le prime piante di tabacco Bt, sviluppate dalla compagnia fondata da Marc van Montagu (la Plant genetic systems), anche se non mancarono le contese sull’effettiva paternità dell’invenzione e sui relativi diritti di proprietà intellettuale. Negli anni successivi si è tentato di replicare gli stessi risultati nelle specie di interesse commerciale, le quali, però, si dimostrarono assai meno malleabili alla trasformazione delle piante modello utilizzate nei primi esperimenti. Nella seconda metà degli anni Novanta nacquero invece i prodotti destinati ad arrivare sul mercato quali: (a) mais, soia, colza e cotone resistenti agli erbicidi; (b) mais Bt resistente alla piralide; (c) cotone Bt resistente a diverse specie di Lepidotteri; (d) papaya resistente al papaya ringspot virus; (e) zucchine resistenti a diversi virus; (f) patate Bt resistenti alla dorifora (ritirate dal mercato dopo il 2001). Infine nel 2006 negli Stati Uniti è stata commercializzata per la prima volta una pianta perenne transgenica: l’erba medica resistente agli erbicidi. Le incertezze di mercato, invece, hanno suggerito di rimandare la commercializzazione di grano e riso transgenici.
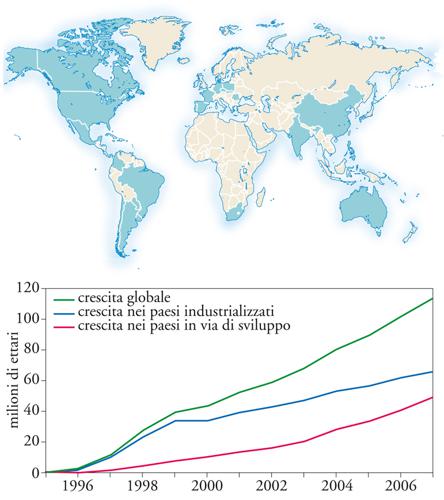
Il successo commerciale
Nel 2007 il numero di paesi che hanno autorizzato l’importazione di prodotti OGM per il consumo umano e per uso zootecnico è arrivato a 52. Di questi, 23 coltivano piante transgeniche sul proprio territorio. Nei 12 anni successivi al loro debutto commerciale, dunque, il tasso di adozione delle piante transgeniche è stato il più alto mai registrato nella storia recente delle innovazioni in campo agrario. Nel 2007 l’area adibita a colture transgeniche ha superato i 114 milioni di ettari, una superficie equivalente a oltre tre volte l’Italia. Gli Stati Uniti sono rimasti il paese leader (50% del totale), seguiti da Argentina, Brasile, Canada, India, Cina, Paraguay, Sud Africa, Uruguay, Filippine, Australia, Spagna, Messico, Colombia, Cile, Francia, Honduras, Repubblica Ceca, Portogallo, Germania, Slovacchia, Romania e Polonia. In questi paesi, equamente suddivisi tra mondo sviluppato e in via di sviluppo, vive oltre la metà della popolazione mondiale e si trova oltre la metà della superficie coltivata del mondo (fig. 3). Gli agricoltori che hanno scelto l’opzione transgenica hanno superato i 12 milioni, di cui il 90% sono piccoli coltivatori di paesi emergenti. Gli specialisti, quindi, parlano degli OGM come di una tecnologia scale-free, nel senso che è utilizzabile con successo su grandi e piccoli appezzamenti. Le piante transgeniche più diffuse continuano a essere soia (51%), mais (31%), cotone (13%) e colza (5%). I tratti dominanti su scala globale restano la resistenza agli erbicidi e agli insetti, ma sempre più spesso queste proprietà si trovano combinate nello stesso prodotto. Leinfezioni virali, invece, rappresentano un problemasecondario per le colture su cui ha puntato la prima generazione di OGM.
Secondo l’osservatorio internazionale più accreditato, l’ISAAA (International Service for the Acquisition of Agri-biotech Applications), i benefici economici globali per gli agricoltori nei dieci anni compresi tra il 1996 e il 2006 sono stati di 34 miliardi di dollari, ripartiti quasi a metà tra paesi sviluppati e in via di sviluppo. Le piante transgeniche attualmente in commercio non innalzano il tetto di produttività rispetto alle varietà da cui derivano, ma la resistenza agli insetti consente di proteggere il raccolto dalle infestazioni e di ridurre la spesa per i pesticidi. Anche la resistenza agli erbicidi ha avuto un impatto economico positivo, consentendo una riduzione delle spese di gestione e lasciando ai coltivatori il tempo per dedicarsi ad altre attività. La quantità di piante OGM (mais, soia e colza) destinate alla produzione di biocarburante è in forte aumento. Nel 2007, inoltre, è stata registrata per la prima volta la coltivazione di 250.000 alberi OGM di pioppo Bt sviluppata in Cina con il contributo della ricerca italiana.
L’impatto sull’ambiente
Riducendo le applicazioni di pesticidi, le piante Bt comportano evidenti vantaggi per l’ambiente oltre che per la salute degli agricoltori. Calcolare l’impatto ambientale delle piante resistenti agli erbicidi, invece, è più complicato perché la quantità di erbicidi applicati non è diminuita in modo omogeneo in tutte le aree geografiche. Poiché prodotti fitosanitari diversi hanno caratteristiche di tossicità, mobilità e persistenza differenti, è stato proposto di utilizzare un quoziente di impatto per ettaro che viene calcolato per ogni prodotto agrochimico e consente di stimare in modo più approfondito l’impronta ecologica dell’agricoltura transgenica. Utilizzando quest’approccio, anche le piante resistenti agli erbicidi risultano decisamente vantaggiose dal punto di vista ambientale, perché hanno segnato l’affermazione dell’erbicida più eco-friendly (il glifosato) e l’abbandono dei prodotti più inquinanti utilizzati in precedenza. Complessivamente dal 1996 al 2006 le piante transgeniche hanno fatto risparmiare 289 milioni di kg di prodotti agrochimici, alleggerendo la loro impronta ecologica del 15%. I benefici maggiori derivano dalla soia, perché questa è la pianta transgenica più diffusa.
La riduzione nel numero di applicazioni di pesticidi comporta anche un minore consumo di carburante e in generale dell’energia utilizzata per la coltivazione, perciò anche delle emissioni di gas serra. Secondo l’ISAAA nel 2006 gli OGM avrebbero consentito di ridurre le emissioni di anidride carbonica di una quantità equivalente a quella che si otterrebbe togliendo dalla circolazione mezzo milione di veicoli. Inoltre, le piante tolleranti agli erbicidi consentono di ridurre gli interventi sul terreno e quindi l’erosione del suolo, aumentando i composti del carbonio che vi rimangono sequestrati. Questo, secondo le stime dell’International Panel on Climate Change, rappresenterebbe un risparmio ancora maggiore. Perciò, complessivamente, le emissioni evitate nel 2006 sarebbero equivalenti a quelle rilasciate in un anno da 6,5 milioni di veicoli.
Le politiche europee
Dai falsi allarmi al doppio standard della biosicurezza
La rapida diffusione delle colture OGM è sorprendente se si considera che, sin dall’arrivo dei primi carichi di soia e mais transgenici nei porti europei nel 1996, una parte dell’opinione pubblica del Vecchio Continente ha iniziato a manifestare una decisa opposizione ai prodotti transgenici, opposizione che ha raggiunto il culmine tra il 1998 e il 1999. Una serie di polemiche innescate da controversi lavori scientifici sui rischi degli OGM ha spinto dapprima supermercati e industrie alimentari a boicottare i prodotti transgenici, inducendo poi alcuni paesi membri dell’Unione Europea a intraprendere politiche ostili alle biotecnologie agrarie.
L’opposizione agli OGM è partita dal Regno Unito, dove l’opinione pubblica era ancora scossa dall’emergenza determinata dell’encefalopatia spongiforme bovina (BSE, Bovine spongiform encephalopathy), per poi estendersi in tutta Europa. L’episodio che ha scatenato le polemiche nel 1998 è la rivelazione, subito contestata dalla comunità scientifica internazionale, che ratti nutriti con una varietà di patate transgeniche, mai entrata in commercio, avrebbero mostrato anomalie a carico dell’apparato digerente. Successivamente, un esperimento di laboratorio, poi smentito da ricerche più approfondite, fece scoppiare il caso delle farfalle monarca, suggerendo che il polline del mais Bt mettesse a rischio questa specie di insetti benefici.
Nonostante il parere favorevole agli OGM espresso da tutte le principali accademie scientifiche internazionali, a causa di questi falsi allarmi in Europa venne bloccato il processo delle autorizzazioni per nuovi OGM, decretando una moratoria di fatto che è durata dal 1999 al 2004. Questo blocco è stato giudicato illegittimo dalla Organizzazione Mondiale del Commercio (WTO, World Trade Organization), perché varato in assenza di evidenze scientifiche credibili su eventuali rischi per la salute o per l’ambiente; ma ha temporaneamente compromesso le prospettive del settore, al punto da innescare, alla fine del 1999, un’ondata di riorganizzazioni industriali. La stagione delle fusioni finì e le grandi compagnie separarono il proprio comparto farmaceutico da quello agrobiotecnologico. L’approvazione di nuovi prodotti, anche nei paesi d’Oltreoceano, rallentò inevitabilmente: segregare perfettamente le sementi transgeniche da quelle convenzionali è difficile e costoso, e il rischio in caso di contaminazione accidentale è quello di vedere sequestrati i carichi esportati in Europa.
La fine della moratoria arrivò dopo l’entrata in vigore di un quadro regolatorio modificato in senso restrittivo rispetto al precedente, che era già stato ispirato alla precauzione. Si assistette, quindi, a una graduale apertura dell’UE, che nel 2007 ospitava colture transgeniche in 8 dei suoi Stati membri, seppure su superfici ridotte (Spagna, Francia, Repubblica Ceca, Portogallo, Germania, Slovacchia, Romania e Polonia). Sull’importazione di mangimi OGM, inoltre, si basava ormai l’intero comparto zootecnico europeo. Alcuni paesi però, tra cui l’Italia, hanno continuato sulla via dell’ostruzionismo, per esempio attraverso l’approvazione di misure nazionali particolarmente severe per la coesistenza con le agricolture biologica e convenzionale, allo scopo di rendere l’agricoltura transgenica impraticabile. Il nostro Paese, inoltre, è l’unico che abbia bloccato anche la ricerca su campo con piante transgeniche, oltre alla coltivazione commerciale, causando forti proteste da parte della comunità scientifica italiana.
Non esiste un giudizio unanime su quanto la regolamentazione peserà sullo sviluppo immediato del settore, ma il doppio standard normativo, uno per le piante transgeniche e uno per quelle convenzionali, scelto dall’Europa è destinato a durare per qualche tempo e a condizionare le politiche adottate in altre aree geografiche. L’Agenzia per lo sviluppo delle Nazioni Unite (UNDP, United nations development programme), per esempio, ha rilevato che l’approccio precauzionale europeo rischia di condizionare le decisioni dei paesi in via di sviluppo, prevalendo sul criterio di una scelta autonoma, basata su una valutazione rischi/benefici effettuata su scala locale. Sul lungo termine, comunque, sembra inevitabile un ripensamento dei criteri di valutazione del rischio connesso a piante e alimenti, che dovrebbero dipendere più dalle caratteristiche dei singoli prodotti che dai metodi utilizzati per svilupparli. Sebbene alcuni analisti invochino un’attenuazione delle normative sugli OGM, giudicate eccessive, c’è chi ritiene che per rispondere all’accresciuta sensibilità pubblica in materia di protezione dell’ambiente e di diritti dei consumatori si debba procedere nella direzione opposta, cercando le risorse per estendere almeno parte dei controlli a cui sono sottoposti gli OGM anche alle altre pratiche agricole.
La percezione pubblica degli OGM
È convinzione diffusa che relativamente ai prodotti dell’ingegneria genetica si verifichi una distorsione nella percezione pubblica del rischio, perché i pericoli che appaiono arcani e invisibili tendono a generare maggiore ansia rispetto a quelli concreti e visibili. La diversa accoglienza riservata agli OGM in Europa e negli Stati Uniti, spesso indicata con l’espressione Atlantic divide, viene generalmente spiegata con molteplici argomentazioni, il cui peso relativo è difficilmente quantificabile. Certamente l’ingresso delle biotecnologie sulla scena americana è avvenuto in maniera più graduale – con l’ausilio di istituzioni e infrastrutture più sviluppate e che godono della fiducia dell’opinione pubblica, senza interventi normativi straordinari – in una cultura tradizionalmente favorevole alle innovazioni tecnologiche, che ha sempre sostenuto gli investimenti in ricerca e sviluppo e le sinergie tra scienza e mercato. L’Europa è partita in ritardo, senza poter contare sulla stessa capacità di pianificazione strategica né sulla condivisione sociale di un modello di sviluppo economico ben definito, senza agenzie o istituzioni che godano di un’autorevolezza paragonabile a quelle americane, con il peso di scandali alimentari gestiti in maniera talvolta inadeguata e una concreta difficoltà ad armonizzare gli approcci dei diversi Stati membri all’interno di un sistema politico europeo ancora in via di costruzione. Mentre negli Stati Uniti gli OGM sono subito apparsi come uno strumento per ridurre i costi di produzione, sostenendo le esportazioni e risolvendo il problema del calo dei redditi agricoli, gli stessi prodotti sono arrivati in Europa in un momento di riforma delle politiche agricole comunitarie, in cui l’annunciato ridimensionamento dei sussidi ha fatto temere alle associazioni di categoria la concorrenza dell’agricoltura d’Oltreoceano. Le strategie di marketing delle grandi compagnie agrobiotecnologiche, inoltre, hanno trascurato le differenze culturali esistenti tra le due sponde dell’Atlantico, finendo per generare maggiore ostilità. L’opinione pubblica europea, già di per sé meno aperta ai cambiamenti e più propensa a identificarsi con le tradizioni alimentari locali, è stata sottoposta a una campagna mediatica sbilanciata in favore degli oppositori delle biotecnologie agricole. L’assenza in Europa di ampi spazi occupati da ecosistemi selvatici, infine, potrebbe aver favorito una percezione delle campagne come aree naturali da preservare e una reazione di sconcerto di fronte all’industrializzazione delle attività agricole già operante anche nel nostro continente. La risultante di tutti questi fattori è che, secondo i sondaggi svolti nei 15 paesi membri dell’UE, l’indice di ottimismo nei confronti di tutte le applicazioni biotecnologiche si è ridotto in modo sostanziale durante gli anni Novanta, penalizzando particolarmente le agrobiotecnologie. Dopo il 1999, però, la popolarità degli OGM è tornata lentamente a crescere. La maggior parte dei cittadini europei, per esempio, si dichiara disponibile ad acquistare prodotti alimentari transgenici che siano più salutari di quelli convenzionali o contengano meno residui di pesticidi. È interessante notare a questo proposito che questi requisiti in realtà sono già soddisfatti dagli OGM in commercio. Infatti, la resistenza agli insetti, oltre a ridurre l’uso di pesticidi, consente di contrastare anche la proliferazione nel mais di muffe produttrici di micotossine con effetti cancerogeni e teratogeni.
La diffidenza nei confronti degli OGM risulterebbe legata a timori relativi ai rischi alimentari prima che ambientali. Questo contribuisce a spiegare perché la diffusione del cotone transgenico non abbia incontrato gli stessi ostacoli delle piante usate per l’alimentazione e lascia intravedere prospettive rosee per le applicazioni industriali ed energetiche oltre che ornamentali. Inoltre, sul giudizio degli europei sembra pesare la convinzione di una scarsa utilità e di una bassa accettabilità morale di questi prodotti in quanto ritenuti innaturali. A differenza dei sondaggi, le analisi qualitative (focus group) suggeriscono che l’ostilità dell’opinione pubblica sarebbe dovuta piuttosto a preoccupazioni che riguardano l’equità delle agrobiotecnologie, in particolar modo la presunta asimmetria con cui rischi e benefici degli OGM sarebbero distribuiti in segmenti diversi della società, e a una scarsa fiducia nei confronti della capacità del mondo politico e delle istituzioni di difendere il benessere collettivo resistendo alle pressioni economiche in gioco. Anche se entrambi i tipi di indagine, quantitativa e qualitativa, mettono in dubbio l’esistenza di un rapporto causale diretto tra esposizione mediatica al tema e accettazione delle biotecnologie agricole, esistono chiare evidenze di una scarsa conoscenza scientifica di base da parte del pubblico e di una forte richiesta di informazioni in materia di OGM. I giudizi espressi dai cittadini europei, comunque, non consentono di prevedere i comportamenti effettivi dei consumatori di fronte al ritorno sul mercato dei prodotti transgenici etichettati. Alcuni studi di economia sperimentale su campioni limitati di consumatori, infatti, inducono a ritenere che solo una piccola parte delle opinioni ostili potrebbe concretizzarsi in atti di boicottaggio e che un segmento di popolazione non trascurabile potrebbe decidere di non modificare le propria propensione all’acquisto di fronte a prodotti che siano dichiaratamente transgenici.
Tendenze, sfide e prospettive delle biotecnologie
Progettare gli OGM del futuro
Gli OGM sono spesso classificati in tre generazioni. Nella prima generazione la modificazione genetica agisce sugli input necessari alla coltivazione della pianta e quindi produce caratteristiche che sono utili soprattutto agli agricoltori. Ne fanno parte gli OGM attualmente in commercio resistenti agli insetti e agli erbicidi, ma anche quelli attualmente allo studio per rendere le colture più resistenti agli stress ambientali come la siccità.
Le piante di seconda generazione, invece, sono quelle dotate di caratteristiche finali più gradite ai consumatori. L’ingegneria genetica, infatti, consente di migliorare la qualità degli alimenti, abbassando la concentrazione delle sostanze nocive normalmente presenti in alcune piante o aumentando il contenuto di sostanze utili all’organismo umano. Il celebre golden rice (il riso arricchito di provitamina A) è stato ideato per attenuare le carenze alimentari diffuse nei paesi in via di sviluppo, ma la lista dei prodotti a elevato valore dietetico-nutrizionale che potrebbero essere sviluppati è lunga: alimenti ipoallergenici, olio di semi ad alto contenuto di acido oleico, pomodori arricchiti con sostanze antitumorali come il licopene, cereali a elevato contenuto proteico, varietà di soia con una diversa concentrazione di estrogeni vegetali a seconda delle tipologie di consumatori, e così via. Prima che questi prodotti arrivino ai consumatori, però, saranno necessari complessi aggiustamenti nella catena di produzione e di marketing.
La terza generazione di OGM, infine, è costituita da prodotti estranei ai tradizionali comparti alimentare e tessile. Le piante transgeniche, infatti, possono essere utilizzate come biofabbriche per la produzione di farmaci e vaccini, alcuni dei quali sono già in uno stato avanzato di sperimentazione, oppure possono essere modificate per migliorare il processamento dei biocarburanti, attualmente ancora troppo inefficiente per poter rappresentare un’alternativa energetica su larga scala. Oltre a modificare il mais e la soia per facilitare la produzione di etanolo e biodiesel, si lavora su piante erbacee che non sono usate a scopo alimentare e richiedono minori attenzioni per la coltivazione.
Una fotografia dei filoni di ricerca più perseguiti può essere scattata analizzando i test in campo aperto autorizzati dal Dipartimento dell’agricoltura degli Stati Uniti (USDA, United States Department of Agriculture). Dal 1987 al 2005 i rilasci sperimentali sono stati 10.700 e hanno riguardato le principali piante di interesse agricolo, a cominciare dal mais. I tratti interessati sono stati: (a) resistenza agli erbicidi (3587 sperimentazioni); (b) resistenza agli insetti (3141); (c) qualità del prodotto per ciò che riguarda le caratteristiche organolettiche, estetiche e nutrizionali (2314); (d) resistenza ai virus (1239) e (e) proprietà agronomiche come la resistenza alla siccità (1043) e ai funghi (647).
La crescente attenzione pubblica per i rischi alimentari e ambientali, inoltre, ha dato impulso alla ricerca di strategie per innalzare il più possibile gli standard di biosicurezza. Gli OGM del futuro potrebbero essere dotati di promotori inducibili, capaci di attivare la produzione delle proteine estranee solo nei tessuti vegetali che richiedono la loro presenza e solo in risposta a precisi stimoli. Se un parassita si nutre solo delle foglie, per esempio, l’obiettivo sarà quello di far produrre la proteina insetticida soltanto in questo tessuto e magari soltanto in seguito all’attacco del parassita, e non in altre parti della pianta destinate al consumo umano. Per limitare il rischio che i transgeni si diffondano dagli OGM alle piante selvatiche affini sono allo studio diverse tecniche di contenimento genico, come la sterilità maschile (sono già in commercio piante di colza modificate in modo da non produrre polline) o l’ingegneria genetica dei cloroplasti (il transgene può essere inserito nel DNA di questi organelli di cui il polline è generalmente privo). Un’altra tecnologia, che non è ancora stata sperimentata sul campo ma ha suscitato ugualmente forti opposizioni politiche, è quella della sterilità dei semi, nota anche con il nome terminator (la germinazione dei semi viene bloccata da una serie di reazioni innescate da uno stimolo chimico esterno). Tra gli approcci più avveniristici figurano la cleistogamia (che mira a modificare lo sviluppo dei fiori in modo che possano autofecondarsi senza aprirsi), l’incompatibilità genomica (che mira a rendere le colture geneticamente incompatibili con le piante selvatiche affini) e l’escissione temporale del transgene (che servirebbe a rimuovere il DNA estraneo dal genoma della pianta prima della fioritura). L’ingegneria genetica di precisione punterà a dirigere l’inserzione dei transgeni in punti noti del genoma vegetale per limitare al massimo qualsiasi interferenza con i geni della pianta ricevente. E quando possibile si cercherà di evitare del tutto il trasferimento di DNA estraneo, modificando in modo mirato soltanto alcune basi dei geni endogeni della pianta o intervenendo esclusivamente sulla loro regolazione. Un contributo prezioso in questo senso arriverà dal sequenziamento del genoma di un numero crescente di specie vegetali. Dopo la pianta modello Arabidopsis thaliana, il riso e il pioppo, è partito il sequenziamento di una ventina di specie tra cui mais, patata, pomodoro, soia, vite. La genomica consentirà di individuare i geni endogeni della pianta su cui occorre intervenire per potenziare determinati caratteri, e se la pianta non dispone di geni utili allo scopo serviràa identificarli in piante affini a quella di interesse in modo da ridurre i trasferimenti genici tra specie distanti dal punto di vista evolutivo. Tra gli oppositori delle bio-tecnologie c’è chi crede che la modernizzazione delbreeding resa possibile dalla genomica – che va sottoil nome di selezione assistita da marcatori o MAS(Marker assisted selection) – stia rendendo l’ingegneria genetica obsoleta, ma la comunità scientifica è concor-de nel ritenere che questi strumenti si completino an-ziché porsi in alternativa.
Rivoluzionare l’agricoltura
Nonostante gli OGM evochino immagini grandiose, nel bene e nel male, il contributo dell’ingegneria genetica alla produzione alimentare globale è destinato a concretizzarsi in modo non dissimile da quello delle innovazioni agricole che l’hanno preceduta. Le sue potenzialità, si tradurranno probabilmente in tanti piccoli progressi incrementali, piuttosto che in un’unica improvvisa rivoluzione. Alcuni di questi passi in avanti, però, potranno avere un forte impatto locale in particolari contesti sociali ed ecologici. In linea teorica, per esempio, le conoscenze attuali consentono già di salvaguardare le rese dei piccoli agricoltori subsahariani difendendo le coltivazioni da malattie che nelle annate peggiori possono arrivare a distruggere l’intero raccolto. L’affermazione secondo cui le biotecnologie sconfiggeranno la fame è caricaturale, perché il miglioramento genetico non può porre rimedio alla carenza di infrastrutture o all’instabilità politica delle aree sottosviluppate. Ma se la resistenza alla siccità fosse introdotta con successo nelle piante su cui si basa l’alimentazione africana, si potrebbe realizzare anche in Africa un circolo virtuoso simile a quello della ‘rivoluzione verde’ che nella seconda metà del Novecento si è sviluppata in Asia e in America latina. Alcune industrie avrebbero già raggiunto risultati promettenti su soia, riso e mais, ma i dettagli scientifici non sono stati ancora diffusi e questi sforzi dovranno essere replicati su specie come sorgo, manioca, fagiolo dall’occhio. In prospettiva, comunque, l’ingegneria genetica potrebbe rivelarsi utile per estendere le superfici coltivabili senza sacrificare gli ecosistemi naturali ancora integri grazie allo sviluppo di piante capaci di crescere nelle zone del pianeta che sono ecologicamente marginali, e non soltanto a causa della siccità. Il 40% circa della terra arabile, infatti, è interessato da fenomeni di acidificazione, che rendono solubile l’alluminio ostacolando la produzione agricola, mentre l’eccessiva salinità del terreno è un problema che affligge oltre 80 milioni di ettari di terra arabile. Le prime piante prototipo sviluppate con l’aiuto dell’ingegneria genetica hanno dimostrato di poter tollerare questi stress ambientali meglio delle piante convenzionali.
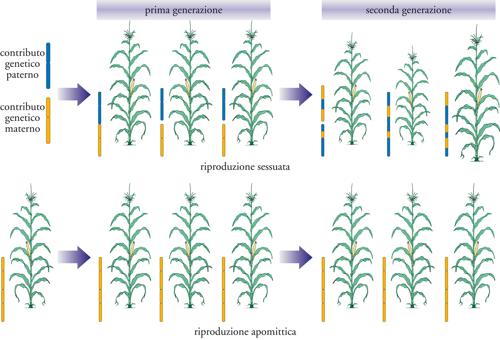
Tra i progetti più ambiziosi per aumentare la produttività c’è quello di replicare l’efficiente sistema fotosintetico tipico del mais in piante come il grano o il riso, ma caratteri multigenici come questi sembrano difficili, forse impossibili, da ricostruire artificialmente perché richiedono un perfetto coordinamento dell’attività di decine di geni. Una delle sfide più appassionanti, infine, riguarda la riproduzione asessuata dei semi, o apomissi (fig. 5). Lo sviluppo degli ibridi ha contribuito in modo sostanziale all’aumento globale delle rese, perché le piante che derivano dall’incrocio di due diverse linee pure manifestano un fenomeno chiamato vigore dell’ibrido che garantisce prestazioni agronomiche superiori a quelle delle piante parentali. Nei paesi in via di sviluppo, però, non tutti hanno potuto godere di questi benefici; infatti, i semi prodotti per incrocio devono essere acquistati ogni anno dalle compagnie sementiere, perché se si semina parte del raccolto dell’anno precedente, le rese degli ibridi (diversamente da quanto accade con le linee pure) subiscono una flessione. Oltre 400 specie vegetali sono in grado di riprodursi per via asessuata producendo semi geneticamente identici alla pianta madre, e se fosse possibile trasferire questo carattere alle specie che ne sono prive non solo si ridurrebbero tempi e costi per lo sviluppo e la produzione di nuovi ibridi, ma gli agricoltori potrebbero riciclare i semi indefinitamente. Se l’ingegneria genetica dovesse raggiungere l’obiettivo, l’industria sementiera potrebbe cambiare volto e l’accesso alle varietà di ibridi più sofisticate potrebbe finalmente diventare generalizzato.
Bibliografia
Bicknell, Koltunow 2004: Bicknell, Ross A. - Koltunow, Anna M., Understanding apomixis: recent advances and remaining conundrums, “Plant cell”, 16, suppl., 2004, S228-S245.
Brookes, Barfoot 2006: Brookes, Graham - Barfoot, Peter, GM crops: The first ten years - Global socio-economic andenvironmental impacts. ISAAA Brief n. 36, Ithaca (N.Y.), International Service for the Acquisition of Agri-biotech Applications, 2006.
Charles 2001: Charles, David, Lords of the harvest: biotech, big money and the future of food, Cambridge (Mass.), Perseus, 2001.
Chrispeels, Sadava 2002: Chrispeels, Maarten J. - Sadava, David E., Plants, genes and crop biotechnology, Sudbury (Mass.), Jones & Bartlett, 2002.
Daniell 2001: Daniell, Henry - Streatfield, Stephen J. - Wycoff, Keith, Medical molecular farming: production of antibodies, biopharmaceuticals and edible vaccines in plants, “Trends in plant sciences”, 6, 2001, pp. 219-226.
Daniell 2002: Daniell, Henry, Molecular strategies for gene containment in transgenic crops, “Nature biotechnology”, 20, 2002, pp. 581-586.
Ewen, Pusztai 1999: Ewen, Stanley - Pusztai, Arpad, Effetcs of diets containing genetically modified potatoes expressing Galanthus nivalis lectin on rat small intestine, “Lancet”, 354, 1999, pp. 1353-1354.
Fernández-Cornejo, Caswell 2006: Fernández-Cornejo, Jorge - Caswell, Margriet, The first decade of genetically engineered crops in the United States, “Economic information bulletin”, 11, 2006.
Gaskell 2006: Gaskell, George e altri, Europeans and biotechnology in 2005: patterns and trends, Eurobarometer 64.3, A report to the European Commission’s Directorate-General for Research, May 2006.
Gaskell, Bauer 2001: Gaskell, George - Bauer, Martin W., Biotechnology 1996-2000: the years of controversy, London, Science Museum Edition, 2001.
Hellmich 2001: Hellmich, Richard L. e altri, Monarch larvae sensitivity to Bacillus thuringiensis purified proteins and pollen, “Proceedings of the National Academy of Sciences USA”, 98, 2001, pp. 11925-11930.
Himmel 2007: Himmel, Michael E. e altri, Biomass recalcitrance: engineering plants and enzymes for biofuels production, “Science”, 315, 2007, pp. 804-807.
James 2007: James, Clive, Global status of commercialized Biotech/GM crops: 2007, ISAAA Brief n. 37, Ithaca (N.Y.), International Service for the Acquisition of Agri-biotech Applications, 2007.
Knight 2007: Knight, John G. e altri, Acceptance of GM food, an experiment in six countries, “Nature biotechnology”, 25, 2007, pp. 507-508.
Kuiper 1999: Kuiper, Harry A. - Noteborn, Hub P.J.M. -Peijnenburg, Ad A.C.M., Adequacy of methods for testingthe safety of genetically modified foods, “Lancet”, 354, 1999, pp. 1315-1316.
Le biotecnologie vegetali e le varietà OGM, Rapporto della Commissione congiunta delle Accademie Nazionali dei Lincei e delle Scienze, Roma, Tipografia della Pace, 2003.
Losey 1999: Losey, John E. - Rayor, Linda S. - Carter, Maureen E., Transgenic pollen harms monarch larvae, “Nature”, 399, 1999, p. 214.
Marris 2001: Marris, Claire e altri, Public perceptions of agricultural biotechnologies in Europe, Final report of the PABE research project funded by the Commission of European Communities, December 2001.
McHughen 2000: McHughen, Alan, Pandora’s picnic basket: the potential and hazards of genetically modified foods, New York, Oxford University Press, 2000.
Meldolesi 2001: Meldolesi, Anna, Organismi geneticamente modificati: storia di un dibattito truccato, Torino, Einaudi, 2001.
Miller, Conko 2004: Miller, Henry I. - Conko, Gregory, The Frankenfood myth: how protest and politics threaten the biotech revolution, Westport, Praeger, 2004.
National Research Council, Committee on Environmental Impacts Associated with Commercialization of Transgenic Plants 2002: Environmental effects of transgenic plants: the scope and adequacy of regulation, Washington D.C., National Academy Press, 2002.
National Research Council, Committee on Genetically Modified Pest-protected Plants 2000: Genetically modified pest-protected plants: science and regulation, Washington D.C., National Academy Press, 2000.
Oberhauser 2001: Oberhauser, Karen S. e altri, Temporal and spatial overlap between monarch larvae and corn pollen, “Proceedings of the National Academy of Sciences”, 98, 2001, pp. 11913-11918.
Paine 2005: Paine, Jacqueline A. e altri, Improving the nutritional value of Golden rice through increased pro-vitamin A content, “Nature biotechnology”, 23, 2005, pp. 482-487.
Pleasants 2001: Pleasants, John M. e altri, Corn pollen deposition on milkweeds in and near cornfields, “Proceedings of the National Academy of Sciences USA”, 98, 2001, pp. 11919-11924.
Ruffieux, Robin 2002: Ruffieux, Bernard - Robin, Stéphane, Analyse économique de la disposition à payer des consommateurs pour des produit garantis ‘sans utilisation d’OGM’ et choix du signal distinctif pertinent, Grenoble, Université de Grenoble, 2002.
Sala 2005: Sala, Francesco, Gli OGM sono davvero pericolosi?, Roma-Bari, Laterza, 2005.
Sears 2001: Sears, Mark K. e altri, Impact of Bt corn pollen on monarch butterfly populations: a risk assessment, “Proceedings of the National Academy of Sciences USA”, 98, 2001, pp. 11937-11942.
Stanley-Horn 2001: Stanley-Horn, Diane E. e altri, Assessing the impact of Cry1Ab-expressing corn pollen on monarch butterfly larvae in field studies, “Proceedings of the National Academy of Sciences USA”, 98, 2001, pp. 11931-11936.
Transgenic plants and world agriculture, Report prepared under the auspices of the Royal Society of London etc., Washington D.C., National Academy Press, 2000.
United Nations Development Programme 2001: Human development report 2001: making new technologies work for human development, New York, Oxford University Press, 2001.
Ye 2000: Ye, Xudong e altri, Engineering the provitamin A(ß-carotene) biosynthetic pathway into (carotenoid-free) rice endosperm, “Science”, 287, 2000, pp. 303-305.
Zangerl 2001: Zangerl, Arthur R. e altri, Effects of exposureto event 176 Bacillus thuringiensis corn pollen on monarch and black swallowtail caterpillars under field conditions,“Proceedings of the National Academy of Sciences USA”, 98, 2001, pp. 11908-11912.