Proteine. Sintesi delle proteine e ribosomi
Proteine. Sintesi delle proteine e ribosomi
La sintesi proteica (o biosintesi delle proteine o traduzione) è il processo responsabile, nelle cellule viventi, della produzione di proteine sulla base dell'informazione genetica contenuta nella sequenza nucleotidica dell'mRNA (RNA messaggero) e quindi del DNA da cui l'mRNA è stato precedentemente codificato. La traduzione, uno dei processi più conservati in tutti gli organismi viventi, è il processo cellulare più complesso per numero di componenti e di interazioni molecolari implicate e impegna una gran parte delle risorse energetiche della cellula. Infatti, l'apparato di sintesi proteica include, oltre all'mRNA e ai ribosomi (costituiti da 50-80 diverse proteine e vari RNA ribosomali), anche più di trenta tipi di tRNA (RNA transfer o di trasferimento), una ventina di enzimi implicati nell'attivazione degli amminoacidi, numerosi fattori proteici necessari per le fasi di inizio, allungamento e terminazione della traduzione. In una cellula procariotica ci sono circa 20.000 ribosomi e 200.000 molecole di tRNA per tradurre 1000-2000 molecole di mRNA; in complesso, tra il 30 e il 50% del peso secco di una cellula procariotica è dedicato alla sintesi proteica. Nelle cellule degli eucarioti superiori, ribosomi, tRNA e mRNA sono molti di più (per es., ci sono 200.000-1.000.000 di ribosomi per cellula), ma rappresentano una percentuale minore della massa secca essendo le cellule eucariotiche molto più grandi e strutturalmente molto più complesse delle cellule procariotiche.
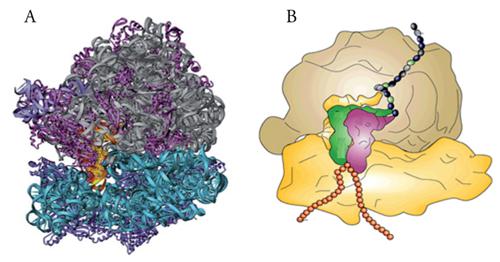
La sintesi proteica consiste nella costruzione di proteine da parte del ribosoma che, con l'ausilio di altri componenti dell'apparato di traduzione, scorre sull'mRNA decifrandone l'informazione codificata e catalizza l'aggiunta progressiva di amminoacidi, uno alla volta, alla catena proteica nascente. L'mRNA viene 'letto' dai ribosomi sempre nella direzione 5′→3′, mentre la proteina viene sintetizzata sempre nella direzione ammino→carbossiterminale. La velocità di allungamento della catena amminoacidica è di circa venti amminoacidi al secondo nei procarioti ed è quasi dieci volte inferiore negli eucarioti. L'efficienza della produzione di proteine è inoltre aumentata dal fatto che più ribosomi possono legarsi in successione allo stesso mRNA e procedere in fila lungo lo stesso formando così un 'polisoma'. Lo studio del meccanismo molecolare della sintesi proteica ha recentemente fatto un salto di qualità grazie alla straordinaria impresa scientifica e tecnologica che ha portato alla risoluzione a livello atomico della struttura del ribosoma (fig.1). Ciò ha permesso infatti il passaggio da una descrizione alquanto schematica e superficiale delle strutture e interazioni molecolari coinvolte nella traduzione al loro studio e alla loro comprensione a livello molecolare molto più fini, compiti che terranno ancora impegnati molti gruppi di ricerca nei prossimi anni. In questa sede si tratteranno prima i principali componenti dell'apparato di traduzione (ribosomi, tRNA, mRNA) per passare poi alla descrizione del meccanismo distinguendo per convenienza le tre fasi, di inizio, di allungamento e di terminazione, sempre confrontando i processi nei procarioti e negli eucarioti. Sarà poi affrontato il problema della regolazione della traduzione a livello globale e a livello di specifici mRNA, per finire con un cenno alle implicazioni di difetti dell'apparato di traduzione nella patologia.
RNA ribosomale e ribosoma
Già dagli anni 1940-1950 era stata osservata una stretta correlazione tra la quantità di RNA nelle diverse cellule e la loro capacità di sintesi proteica, il che suggeriva un ruolo diretto dell'RNA nella sintesi proteica. Negli anni successivi, l'introduzione dell'uso di radioisotopi (in particolare 14C) per studiare l'incorporazione di amminoacidi nelle proteine di nuova sintesi e l'uso di metodi di microscopia elettronica e di ultracentrifugazione hanno permesso di identificare piccole particelle dense contenenti RNA, in parte libere nel citoplasma e in parte attaccate al reticolo endoplasmatico, che venivano indicate con vari nomi quali 'granuli basofili', 'microsomi', 'nucleoproteine' e altri. Divenne presto chiaro che questo componente particolato rappresentava la sede della sintesi proteica. A partire dal 1960 compare nella letteratura il termine 'ribosoma'.
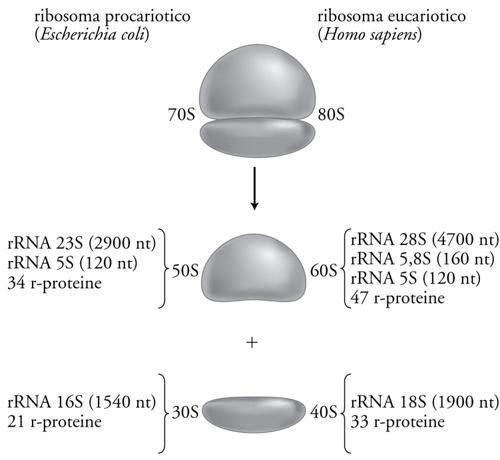
I ribosomi sono delle 'macchinette' molecolari che sintetizzano le proteine decodificando l'informazione portata dall'mRNA. Nonostante alcune differenze di grandezza e composizione che si riscontrano tra ribosomi di varie specie, le loro struttura e funzione sono rimaste altamente conservate durante l'evoluzione. Tutti i ribosomi procariotici ed eucariotici sono particelle ribonucleoproteiche, cioè sono composti da RNA e proteine assemblati a costituire due subunità ribosomali distinte, una maggiore e una minore. I ribosomi e le loro subunità vengono generalmente denominati in base alla loro velocità di sedimentazione, misurata mediante ultracentrifugazione ed espressa in unità Svedberg. Così i ribosomi procariotici vengono chiamati 70S perché hanno una velocità di sedimentazione di 70 Svedberg, mentre quelli citoplasmatici eucariotici, che sono un po' più grandi e sedimentano più velocemente, vengono chiamati 80S. Come schematizzato nella fig. 2, i ribosomi procariotici 70S sono costituiti dalle due subunità chiamate 50S e 30S, e quelli eucariotici 80S dalle subunità 60S e 40S. Va notato che i valori in S delle subunità non sono additivi rispetto a quelli dei ribosomi interi, perché la velocità di sedimentazione dipende non solo dalle dimensioni ma anche dalla forma e non è quindi una misura della massa. Inoltre occorre precisare che questi valori di sedimentazione dei ribosomi, delle loro subunità e degli RNA ribosomali, sono valori nominali, utili per la loro identificazione ma molto approssimativi.
La fig. 2 mostra anche come ciascuna subunità sia costituita da una o più molecole di rRNA e da numerose r-proteine (proteine ribosomali). La subunità 30S dei ribosomi procariotici contiene l'rRNA 16S costituito da circa 1540 nt (nt = nucleotidi) e 21 r-proteine diverse (chiamate S1, S2, S3, ecc.), mentre la subunità 50S contiene l'rRNA 23S (2900 nt), il piccolo RNA ribosomale 5S (120 nt) e 34 r-proteine (chiamate L1, L2, L3, ecc.). Nel complesso la massa del ribosoma procariotico è di circa 2500 kDa ed è costituita per circa metà da RNA e metà da proteine. Come si può vedere nella fig. 2, il ribosoma eucariotico è simile a quello procariotico, ma ha rRNA più lunghi, un numero maggiore di proteine e di conseguenza anche una massa maggiore, pari a circa 4200 kDa. Va detto che le cellule eucariotiche contengono, oltre ai tipici ribosomi 80S citoplasmatici, anche ribosomi all'interno dei mitocondri e, nel caso delle piante, anche nei cloroplasti. Questi ribosomi sono per vari aspetti più simili ai 70S procariotici che non agli 80S eucariotici, a ricordarci l'origine di questi organelli come endosimbionti procariotici. Il numero di ribosomi per cellula è molto variabile a seconda del tipo di cellula e delle sue condizioni di crescita. Una cellula di Escherichia coli contiene circa 20.000 ribosomi, mentre una cellula eucariotica ne contiene da 200.000 a 1.000.000, ma cellule particolarmente grandi, come, per esempio, gli ovociti, ne possono contenere anche miliardi.
Capire a fondo il meccanismo della sintesi proteica comporta la conoscenza dettagliata della struttura dei ribosomi. Quattro decenni di lavoro di numerosi gruppi di ricerca che hanno utilizzato varie tecniche progressivamente più complesse e raffinate, hanno portato nel 2001 alla risoluzione a livello atomico della struttura del ribosoma 70S. La fig. 3 mostra la struttura delle subunità 30S e 50S del ribosoma del batterio Thermus thermophilus. È interessante notare che questi importanti studi strutturali sono stati fatti su ribosomi preparati da organismi estremofili, quali Th. thermophilus e Haloarcula marismortui, che, proprio perché crescono rispettivamente in condizioni di alta temperatura e di alta concentrazione salina, hanno ribosomi con struttura particolarmente stabile e quindi adatti a sopportare le condizioni non ottimali a cui sono sottoposti durante l'analisi.
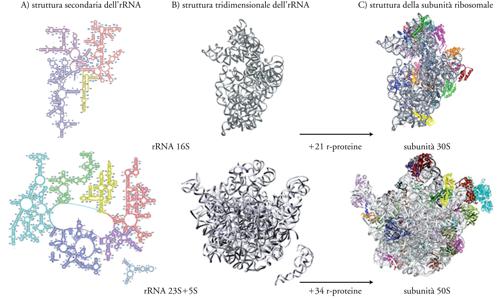
Come si può osservare nella fig. 3A, gli rRNA 16S e 23S assumono strutture specifiche secondarie per appaiamento intramolecolare di basi complementari. Essi si ripiegano poi in precise strutture tridimensionali (fig. 3B). Nella struttura delle subunità ribosomali gli rRNA costituiscono una specie di impalcatura su cui si assemblano le r-proteine (fig. 3C); alcune di queste stabiliscono legami forti direttamente con l'rRNA, mentre altre vi si legano solo dopo che si sono legate le prime. Nel complesso le r-proteine tendono a trovarsi nella parte esterna del ribosoma e presentano spesso prolungamenti che si infilano nella struttura dell'rRNA. Importante è l'osservazione che ci sono poche proteine all'interfaccia tra le due subunità; in particolare non ce ne sono nei due importanti siti del ribosoma, il centro di decodificazione e il centro della peptidiltransferasi e ciò indica che è l'rRNA, e non le r-proteine, il responsabile di queste reazioni.
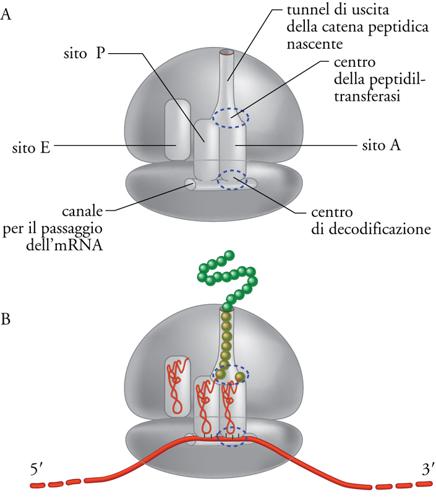
Il ribosoma contiene siti di legame per gli altri componenti dell'apparato di traduzione, l'mRNA e il tRNA, e per la catena proteica nascente. La fig. 4 mostra una rappresentazione schematica del ribosoma con i suoi siti attivi, mentre una rappresentazione grafica un po' più realistica e la struttura effettiva del ribosoma, determinata mediante cristallografia, sono mostrate nella fig. 1. Come indicato nella fig. 4A, la subunità minore del ribosoma contiene un canale in cui scorre l'mRNA, mentre il sito di uscita della catena peptidica nascente è costituito da un tunnel che attraversa la subunità maggiore. Ci sono tre siti di legame per tRNA: il sito A (amminoacilico o accettore) che lega il tRNA amminoacilato in ingresso, il sito P (peptidilico) che lega l'ultimo tRNA entrato e porta la catena peptidica nascente, e il sito E (exit) che lega il tRNA ormai scarico che deve essere rilasciato. I siti A e P si trovano all'interfaccia tra le due subunità, cosicché ciascuno di essi è composto di due emisiti, uno nella subunità minore e uno nella subunità maggiore del ribosoma. La fig. 4B mostra che i tRNA sono posizionati in modo che gli anticodoni, che si trovano all'estremo del braccio lungo della struttura a L dei tRNA, si possano appaiare con i codoni dell'mRNA nella subunità minore del ribosoma, in quello che viene chiamato 'centro di decodificazione'. Invece le estremità del braccio corto della struttura a L dei tRNA, che portano l'amminoacido e il peptide nascente, si trovano nella subunità maggiore e in particolare nel 'centro della peptidiltransferasi', sito responsabile appunto della formazione dei legami peptidici.
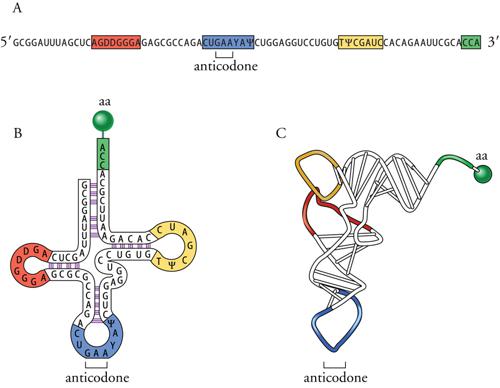
RNA transfer e amminoacil-tRNA-sintetasi
Verso la fine degli anni Cinquanta del Novecento Francis Crick ipotizzò l'esistenza di 'adattatori' molecolari in grado di riconoscere da una parte i codoni (triplette di nucleotidi) del messaggio genetico e dall'altra parte gli specifici amminoacidi da inserire nella sequenza delle proteine. Negli stessi anni era stata scoperta una classe di piccole molecole di RNA, che si rivelarono presto essere gli adattatori ipotizzati e che sono ora chiamati tRNA (RNA transfer o di trasferimento). In ogni cellula esiste almeno un tipo di tRNA per ciascuno dei venti tipi di amminoacidi utilizzati nella sintesi proteica, ma spesso ve ne è più di uno. Tutti i tRNA sono piccole molecole costituite da una sequenza di 75÷90 nt. Alcune regioni della sequenza sono conservate nei diversi tRNA, altre sono specifiche per ciascuno di essi. La fig. 5 mostra, come esempio, la struttura del tRNA per la fenilalanina di Saccharomyces cerevisiae e, in particolare nella fig. 5A, è riportata la sequenza nucleotidica di questo tRNA che, come tutti i tRNA, presenta una caratteristica struttura secondaria a trifoglio risultante dall'appaiamento di basi complementari tra diverse regioni della molecola, come mostrato nella fig. 5B. Riconosciamo nella struttura uno stelo, formato dalle due estremità della molecola, su cui si legherà l'amminoacido specifico, e tre anse. Di queste, quella centrale, opposta allo stelo, contiene l'anticodone, cioè la sequenza di tre nucleotidi che riconosce, per appaiamento di basi, il codone del messaggio genetico. La struttura secondaria a trifoglio di tutti i tRNA è ripiegata su sé stessa, come mostrato nella fig. 5C, a formare una struttura terziaria (tridimensionale) cosiddetta 'a L', in cui troviamo l'anticodone all'estremità del braccio lungo della L e l'amminoacido caricato sull'estremità del braccio corto della L.
In effetti i tRNA non possono da soli svolgere il ruolo di adattatori molecolari ipotizzato da Crick. Infatti, mentre essi sono in grado di riconoscere direttamente (seppure con l'aiuto del ribosoma) il codone mediante interazioni specifiche codone-anticodone, non hanno però alcuna diretta affinità specifica per gli amminoacidi che devono caricare. Il processo di caricamento degli mRNA sui corrispondenti tRNA viene catalizzato da una classe di enzimi, chiamati 'amminoacil-tRNA-sintetasi', che completano il ruolo di adattatori dei tRNA caricandoli, prima del loro utilizzo nella sintesi proteica, con gli specifici amminoacidi.
Come i tRNA, le amminoacil-tRNA-sintetasi sono come minimo venti, essendone necessaria almeno una per ciascun tipo di amminoacido. Ogni amminoacil-tRNA-sintetasi è capace di riconoscere specificamente sia l'amminoacido sia il corrispondente tRNA e catalizza poi la formazione di un legame esterico ad alta energia tra il gruppo carbossilico dell'amminoacido e il gruppo ossidrilico 2′ o 3′ dell'adenosina, che costituisce l'estremità 3′ del tRNA. Questa energia di legame è molto importante perché verrà utilizzata successivamente per la formazione del legame peptidico nel corso della sintesi proteica; essa è derivata dall'idrolisi di una molecola di ATP al momento dell'attivazione dell'amminoacido da parte dell'amminoacil-tRNA-sintetasi stessa. Questa reazione avviene in due passaggi consecutivi catalizzati dalla stessa amminoacil-tRNA-sintetasi (aa = amminoacido):
aa+ATP → aa∼AMP+PP
aa∼AMP+tRNA → aa∼tRNA+AMP
Questa doppia reazione è molto complessa anche perché è essenziale, per l'accuratezza della sintesi delle proteine, che ogni tRNA sia caricato correttamente con l'amminoacido corrispondente. A tal fine entra in gioco un doppio meccanismo di correzione di bozze (proofreading) per cui i due processi, riconoscimento del corretto tRNA da parte della sintetasi e riconoscimento e caricamento dell'amminoacido corrispondente, vengono svolti e rivisti in due stadi successivi, in modo da abbassare la probabilità di errore.
RNA messaggero
Nel loro fondamentale lavoro del 1961 sulla regolazione dell'operone lattosio, François Jacob e Jacques Monod esclusero, sulla base di dati sperimentali, che l'rRNA (l'RNA strutturale dei ribosomi) con la sua grande stabilità metabolica potesse svolgere il ruolo di portatore dell'informazione per la sintesi delle proteine e ipotizzarono, quindi, l'esistenza di una distinta classe di molecole di RNA metabolicamente instabili, che chiamarono 'RNA messaggero', la cui vita media molto breve permettesse alla cellula di rispondere rapidamente ai cambiamenti ambientali adattando la produzione di proteine alle esigenze del momento. Così, delle tre classi di RNA coinvolte nella sintesi proteica, l'mRNA è quello che è stato scoperto per ultimo, anche perché più difficile da isolare e analizzare rispetto agli altri due componenti, rRNA e tRNA. Infatti, l'mRNA rappresenta quantitativamente una bassa percentuale degli RNA cellulari (2÷5% rispetto all'80% di RNA ribosomale e al 15% di tRNA). Inoltre, poiché una cellula produce migliaia di mRNA diversi per codificare le migliaia di differenti proteine che la caratterizzano, la popolazione di molecole di mRNA è estremamente eterogenea per grandezza e sequenza nucleotidica.
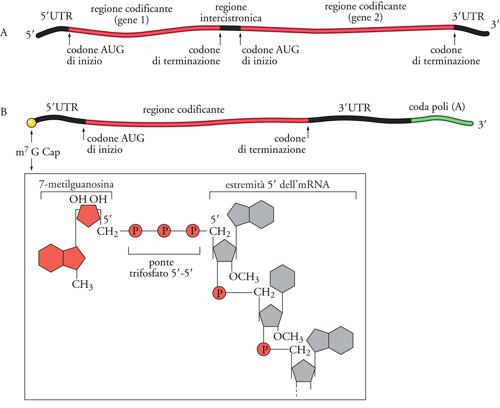
Tutti gli mRNA di tutte le cellule procariotiche ed eucariotiche hanno almeno una regione codificante, cioè una serie di triplette di nucleotidi (codoni) che determinano l'ordine degli amminoacidi nella proteina sintetizzata seguendo le regole di corrispondenza codone/amminoacido del codice genetico. Inoltre, negli mRNA sono presenti anche regioni non codificanti (UTR, Untranslated region) che si trovano all'inizio (estremità 5′) e alla fine (estremità 3′) della molecola, e in alcuni casi anche all'interno della sequenza. Come mostrato nella fig. 6A, gli mRNA procariotici possono essere policistronici, cioè possono essere il prodotto della trascrizione di più geni adiacenti nel genoma (operoni) e codificare quindi per più proteine. In tal caso questi mRNA contengono, oltre a una 5′UTR all'estremità 5′ e una 3′UTR all'estremità 3′, anche una o più regioni non codificanti intergeniche (usualmente piuttosto corte, al massimo di qualche decina di nucleotidi), che separano le regioni che codificano per le varie proteine. Gli mRNA eucariotici sono invece quasi sempre monocistronici, cioè ogni mRNA codifica per una sola proteina essendo costituito da una 5′UTR seguita dalla regione codificante e poi da una 3′UTR (fig. 6B).
Un'altra caratteristica degli mRNA eucariotici è costituita dalla presenza di modificazioni delle due estremità 5′ e 3′, modificazioni che avvengono nel nucleo e che rientrano nei processi di maturazione degli mRNA, prima che questi vengano trasportati nel citoplasma. In particolare, come mostrato nella fig. 6B, l'estremità 5′ è protetta da una struttura chiamata 5′Cap (cappuccio), formata da una base insolita (m7G, cioé Guanina metilata in posizione 7) unita, con un particolare legame fosfodiesterico 5′-5′ trifosfato, al primo nucleotide dell'mRNA. L'estremità 3′ degli mRNA eucariotici è estesa da una coda di poli(A), cioè una sequenza di circa duecento adenine che vengono aggiunte da uno specifico complesso enzimatico al momento della terminazione della trascrizione. Ambedue queste modificazioni, 5′Cap e poli(A) al 3′, non soltanto proteggono le estremità degli mRNA da attacchi esonucleolitici, ma possono anche svolgere un ruolo nel processo di inizio della traduzione. Gli mRNA eucariotici e procariotici si distinguono inoltre per un ulteriore aspetto. Nei procarioti dove non è presente una compartimentazione nucleo/citoplasma, gli mRNA interagiscono con i ribosomi ancora prima di essere completamente trascritti, cosicché la trascrizione di un mRNA e la sua traduzione sono processi accoppiati. Invece negli eucarioti gli mRNA vengono trascritti e maturati all'interno del nucleo, per passare successivamente nel citoplasma dove possono interagire con i ribosomi per la sintesi proteica.
2. Il meccanismo della sintesi proteica
Inizio
La sintesi di tutte le proteine inizia sempre all'estremità amminoterminale con l'amminoacido metionina, codificata quasi sempre dal codone AUG. La metionina che dà inizio alla traduzione è caricata su un particolare tRNA, il tRNA di inizio (tRNAi) diverso dal tRNA utilizzato per le metionine che verranno inserite all'interno della sequenza amminoacidica. Nei procarioti, ma non negli eucarioti, questa metionina di inizio è modificata chimicamente per aggiunta di un gruppo formilico che ne blocca il gruppo amminico. Il fatto che tutte le proteine inizino a essere sintetizzate con una metionina non comporta necessariamente che tutte le proteine degli organismi viventi abbiano una metionina all'estremità amminoterminale. Infatti spesso la metionina iniziale o anche più amminoacidi vengono specificamente rimossi dalla proteina neosintetizzata. Sia nei procarioti sia negli eucarioti l'inizio della traduzione coinvolge sempre l'interazione preliminare tra la subunità minore 30S del ribosoma, il tRNA di inizio caricato con la metionina (fMet-tRNAi) e l'mRNA in corrispondenza del codone di inizio AUG; solo successivamente si ha il reclutamento della subunità maggiore 50S e la formazione del ribosoma intero 70S che poi procede nell'allungamento.
Procarioti ed eucarioti utilizzano però due meccanismi sostanzialmente differenti per assemblare il complesso di inizio in corrispondenza del codone AUG. Nei procarioti la subunità minore del ribosoma interagisce direttamente in corrispondenza del codone di inizio, cosicché una molecola di mRNA può avere anche più sequenze codificanti, ciascuna fornita di un suo codone di inizio. Negli eucarioti invece la subunità minore del ribosoma interagisce con l'estremità 5′ dell'mRNA e da lì migra, mediante un processo di scansione (scanning), lungo il 5′UTR fino a trovare il primo AUG che verrà utilizzato come codone di inzio della traduzione. È chiaro che questo meccanismo di inizio è incompatibile con la presenza di più sequenze codificanti in una singola molecola di mRNA; infatti la grande maggioranza degli mRNA eucariotici è monocistronica, cioè ogni mRNA codifica una sola proteina.
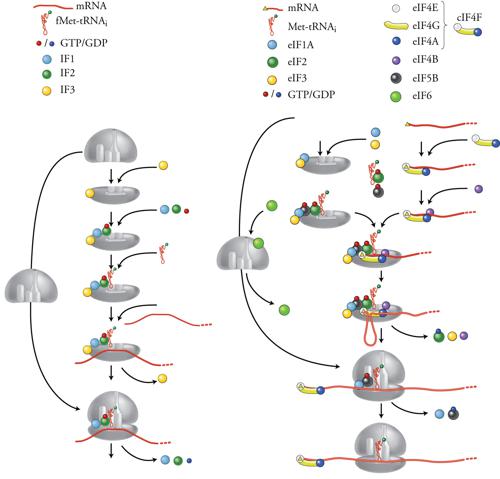
Per il processo di inizio sono necessari, in aggiunta all'mRNA, alle due subunità ribosomali e al tRNA di inizio caricato con la metionina (fMet-tRNAi), anche vari fattori proteici. Mentre nei procarioti i fattori di inizio sono solo tre, negli eucarioti sono molto più numerosi, più numerose le interazioni coinvolte e la situazione è sostanzialmente più complessa. I tre fattori di inizio procariotici sono IF1, IF2 e IF3 (IF, Initiation factor). Come mostrato nella fig. 7A, IF3 si lega alla subunità minore 30S del ribosoma e la rende disponibile per un nuovo inizio impedendo che si riassoci alla subunità maggiore. Anche IF2 interagisce, insieme a IF1, con la subunità 30S e media poi l'ingresso di fMet-tRNAi nell'emisito P della subunità minore del ribosoma. Più o meno allo stesso tempo anche l'mRNA si lega alla subunità 30S, facilitato dall'appaiamento di basi complementari tra il codone AUG e l'anticodone del tRNA di inizio fMet-tRNAi e tra una sequenza di 5÷6 nt (chiamata Shine-Dalgarno e che si trova pochi nucleotidi a monte dell'AUG) e una regione dell'rRNA 16S della subunità ribosomale. A questo punto, il rilascio di IF3 permette l'associazione della subunità maggiore 50S del ribosoma, il rilascio dei fattori IF1 e IF2 e infine l'inizio della serie di cicli di allungamento della sintesi proteica. Tutto questo complesso processo necessita di energia che viene fornita da una molecola di GTP legata e poi idrolizzata da IF2.
Nelle cellule eucariotiche la situazione è notevolmente più complicata e non è ancora stata chiarita altrettanto bene che nei procarioti, come illustrato nella fig. 7B. I fattori di inizio necessari sono più di dieci, chiamati con la sigla eIF (Eukaryotic initiation factor) seguita da numeri e lettere di specificazione. Inoltre ciascuno di questi fattori è composto da varie subunità (fino a dodici subunità di eIF3), per cui in totale sono necessarie circa trenta diverse catene proteiche per l'inizio della traduzione. Ci limiteremo qui a considerare solo alcuni dei fattori principali: eIF1A, eIF2 ed eIF3 svolgono le stesse funzioni, ancorché con sostanziali differenze, di IF2 e IF3 procariotici, cioè interagiscono con la subunità minore del ribosoma e con il tRNA di inizio favorendone il legame. Con l'aggiunta di eIF5B si completa la formazione del complesso di preinizio 43S. Nel frattempo eIF4F, costituito da varie subunità, si lega all'estremità 5′ dell'mRNA mediante il riconoscimento specifico tra la sua subunità eIF4E e la struttura 5′Cap dell'mRNA. A questo punto l'interazione tra complesso di preinizio 43S ed eIF4F/mRNA risulta nel legame dell'estremità 5′ dell'mRNA alla subunità ribosomale 40S. Questa inizia il processo di scansione migrando lungo il 5′UTR, facilitata dai fattori eIF4A ed eIF4B, che sono delle elicasi con la funzione di svolgere e aprire le strutture secondarie che nel 5′UTR dell'mRNA sarebbero di impedimento alla scansione. Quando la subunità 30S raggiunge il primo codone AUG di inizio della traduzione, il rilascio dei fattori di inizio permette l'associazione della subunità maggiore 60S del ribosoma e quindi l'inizio della serie di cicli di allungamento della sintesi proteica.
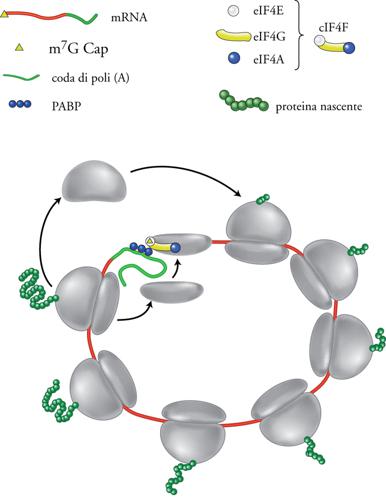
Per non complicare ulteriormente la fig. 7B, è mostrato separatamente nella fig. 8 un ulteriore elemento che sembra essere coinvolto nell'inizio della traduzione eucariotica. Si tratta della PABP (Poly(A) binding protein), proteina associata in varie copie alla coda poli(A) che si trova all'estremità 3′ degli mRNA eucariotici. Infatti la PABP, pur rimanendo legata alla poli(A), interagisce con il fattore di inizio eIF4F legato all'estremità 5′ dello stesso mRNA. Il risultato di questa interazione è l'assunzione da parte dell'mRNA di una configurazione circolare (o ad ansa) in cui i ribosomi che terminano la traduzione al 3′ dell'mRNA vengono rilasciati in prossimità del 5′. Secondo un modello sostenuto da vari autori, la struttura ad ansa dell'mRNA oltre a stabilizzare la molecola ne aumenterebbe l'efficienza di traduzione, comportandosi quindi come un fattore di inizio. Anche se la grande maggioranza degli mRNA eucariotici utilizza il meccanismo di inizio Cap-dipendente, che comporta l'assemblaggio della subunità piccola del ribosoma all'estremità 5′ dell'mRNA e la scansione fino a trovare il primo codone di inizio AUG, va detto che esistono delle eccezioni. La più notevole è quella utilizzata soprattutto da alcuni virus, che infettano le cellule eucariotiche, ma anche da alcuni mRNA cellulari. In questi casi si ha un'entrata della subunità piccola del ribosoma in un sito interno all'mRNA. Affinché ciò avvenga è necessario che l'mRNA contenga, nel tratto che precede la regione codificante, una sequenza nucleotidica particolare che, con l'ausilio di specifici fattori proteici, sia in grado di reclutare la subunità ribosomale. Tale sequenza, che permette un inizio di traduzione Cap-indipendente, prende il nome di IRES (Internal ribosome entry site).
Allungamento e terminazione
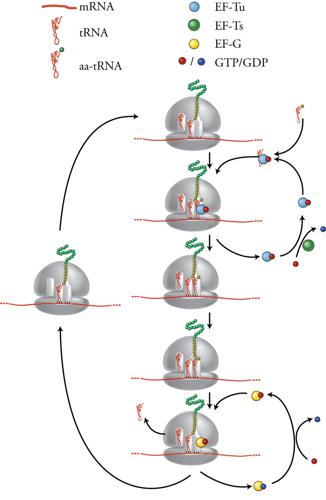
Il reclutamento della subunità maggiore e la formazione del ribosoma intero permettono l'inizio dei cicli di allungamento della sintesi proteica. Come mostrato nella fig. 9, ogni ciclo è costituito dal susseguirsi di tre fasi. All'inizio abbiamo il sito P occupato dall'ultimo tRNA che è entrato nel ribosoma e che porta alla sua estremità 3′ la catena peptidica nascente, mentre il sito A è vuoto e il sito E è occupato dal precedentre tRNA ormai scarico. Durante la prima fase si inserisce nel sito A il successivo amminoacil-tRNA, accompagnato dal fattore di allungamento EF-Tu complessato con una molecola di GTP. Per una corretta sintesi proteica è essenziale che in questo passaggio venga selezionato il giusto amminoacil-tRNA. L'accuratezza di questa selezione, che si fonda sulle interazioni tra le basi del codone sull'mRNA e quelle dell'anticodone sul tRNA secondo le regole del codice genetico, viene verificata da interazioni molecolari che avvengono nel centro di decodificazione della subunità minore del ribosoma e che coinvolgono principalmente l'rRNA piuttosto che le proteine ribosomali. Solo se l'appaiamento codone-anticodone è corretto, il processo procede con l'idrolisi del GTP, il rilascio di EF-Tu e l'associazione stabile dell'amminoacil-tRNA al sito A del ribosoma. Per poter essere utilizzato in un altro ciclo di allungamento, EF-Tu deve essere ricaricato con GTP da parte di un altro fattore di allungamento, EF-Ts.
La seconda fase del ciclo di allungamento consiste nella formazione del legame peptidico tra l'ultimo amminoacido della catena peptidica nascente, che si trova legato all'estremità 3′ del tRNA presente nel sito P, e l'amminoacido portato dal nuovo amminoacil-tRNA appena entrato nel sito A, con conseguente spostamento della catena peptidica dal tRNA che si trova nel sito P al tRNA nel sito A. È stato recentemente rilevato che questa attività peptiltransferasica, che rappresenta la vera essenza della sintesi proteica, non richiede alcun fattore proteico accessorio. Infatti essa è portata avanti direttamente dalla subunità maggiore del ribosoma e in particolare dal centro della peptidiltransferasi, che è formato da una regione dell'rRNA 23S mancante di proteine ribosomali. Il fatto che i due importanti centri funzionali del ribosoma, il centro di decodificazione e il centro della peptidiltransferasi, siano ambedue costituiti da solo RNA senza componenti proteici, è alla base dell'assegnazione del ribosoma alla classe di strutture chiamate 'ribozimi', e suggerisce che l'attuale ribosoma ribonucleoproteico si sarebbe evoluto in tempi molto precoci della storia della vita sulla Terra, da un primitivo ribosoma costituito essenzialmente solo di RNA. La terza fase del ciclo di allungamento è quella che consiste nello spostamento del peptidil-tRNA dal sito A al sito P, contemporaneamente allo spostamento del tRNA ormai scarico dal sito P al sito di uscita E da cui viene poi rilasciato. Insieme ai due tRNA si sposta anche l'mRNA, che in questa maniera espone il prossimo codone nel centro di decodificazione del sito A vuoto, che è disponibile per iniziare un nuovo ciclo di allungamento. Questa fase del ciclo, che si chiama 'traslocazione', richiede un altro fattore di allungamento, EF-G, la cui funzione è associata a idrolisi di GTP.
I cicli di allungamento si interrompono quando un codone di terminazione (UAA, UAG o UGA) dell'mRNA entra nel sito A. Non esistono tRNA con anticodoni complementari ai codoni di terminazione. Questi sono invece riconosciuti da fattori proteici RF (Release factors) che attivano l'idrolisi del polipeptide dal peptidil-tRNA: tre nei procarioti, RF1, RF2 e RF3, e uno negli eucarioti, eRF1.
3. La regolazione della traduzione
Benché il controllo dell'espressione genica avvenga principalmente a livello della trascrizione, cioè regolando l'efficienza della sintesi degli mRNA, essa può essere controllata anche a livello traduzionale, cioè regolando l'efficienza di utilizzazione degli mRNA da parte dei ribosomi. Questo livello di controllo è importante nei procarioti ma sopratutto negli eucarioti, dove va diventando sempre più evidente in varie situazioni fisiologiche, tra cui lo sviluppo embrionale e lo sviluppo e il funzionamento del sistema nervoso. Quello che rende la regolazione traduzionale particolarmente efficace è il fatto che si tratta di una regolazione molto rapida e reversibile: pochi minuti sono sufficienti per bloccare la sintesi di una proteina il cui mRNA può poi, in pochi minuti, essere riattivato. La regolazione traduzionale, che opera generalmente sull'inizio della sintesi proteica, può essere globale, cioè riguardare l'efficienza di traduzione di tutti gli mRNA della cellula, oppure specifica per uno o più mRNA.
Il meccanismo più comune della regolazione globale della traduzione negli eucarioti si basa sulla modificazione di fattori di inizio o di proteine che legano i fattori di inizio. Per esempio, la fosforilazione del fattore eIF2 operata da specifiche chinasi quando le cellule sono deprivate di fattori di crescita, risulta in una inibizione di tutta la sintesi proteica. Anche il fattore di inizio eIF4E, che si lega al 5′Cap degli mRNA, è soggetto a fosforilazione. In questo caso la fosforilazione avviene solo in presenza di fattori di crescita e risulta in una stimolazione, anziché in una repressione, della traduzione. Inoltre eIF4E è inibito dal legame di altri fattori proteici, chiamati 4EBP, che in presenza di fattori di crescita vengono fosforilati e si staccano da eIF4E, con conseguente stimolazione della traduzione. Questi pochi esempi danno un'idea di come segnali esterni o intracellulari possano regolare l'efficienza generale della sintesi proteica.
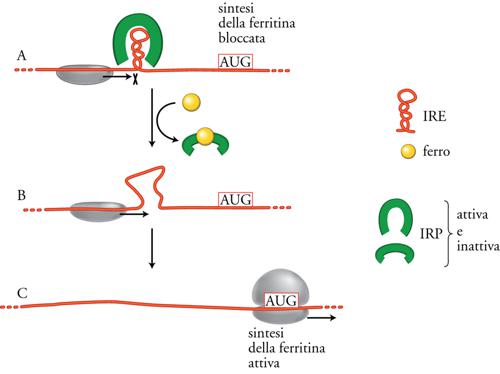
Per quanto riguarda la regolazione specifica della traduzione di alcuni mRNA, essa è dovuta per lo più a fattori proteici che si legano agli mRNA e ne impediscono il legame con i ribosomi, funzionando così da 'repressori traduzionali', analogamente ai classici repressori della trascrizione che, legandosi al DNA a monte dei geni, ne controllano l'efficienza di trascrizione. In alcuni casi, come per esempio nella sintesi delle proteine ribosomali in E. coli o della tubulina in cellule eucariotiche, si ha una regolazione feedback della produzione delle proteine. Infatti queste, se prodotte in eccesso, vanno a legarsi al loro stesso mRNA impedendone l'ulteriore traduzione. In altri casi la regolazione della traduzione è dovuta all'interazione di una particolare sequenza dell'mRNA con uno specifico repressore traduzionale, diverso dalla proteina codificata dall'mRNA stesso. Un caso relativamente semplice e molto studiato è quello della sintesi nelle cellule eucariotiche della ferritina, proteina che serve a immagazzinare il ferro all'interno delle cellule. Come mostrato nella fig. 10, questa regolazione è mediata dalla proteina IRP (Iron responsive protein, detta 'aconitasi') che, in assenza di ferro, si lega a una specifica sequenza IRE (Iron responsive element) nella regione 5′UTR dell'mRNA per la ferritina, bloccandone la traduzione. L'aggiunta di ferro provoca un cambiamento conformazionale di IRP, che non legando più IRE, permette la sintesi della ferritina.
Esistono numerose variazioni sul tema. Le sequenze bersaglio della regolazione non sono sempre localizzate nel 5′UTR, ma spesso anche nel 3′UTR, come d'altra parte ci si può aspettare se consideriamo la 'circolarizzazione' degli mRNA dovuta all'interazione PABP/eIF4G. Inoltre spesso non è coinvolto un singolo repressore proteico, ma possono esservi più proteine, che interagiscono con l'mRNA e/o tra di loro, alcune con effetto positivo, altre con effetto negativo sulla traduzione. In taluni casi la regolazione traduzionale passa attraverso il controllo della lunghezza della coda di poli(A) degli mRNA. Per esempio, durante l'oogenesi sono sintetizzati molti mRNA con code di poli(A) assai corte (ca. 20 nt), che non vengono tradotti ma immagazzinati in forma inattiva. Raggiunta una certa fase dello sviluppo, si ha un allungamento della coda di poli(A) e la conseguente attivazione della traduzione di questi mRNA. È stato recentemente notato che la regolazione della traduzione di alcuni mRNA è dovuta, anziché a repressori proteici, a piccoli RNA non codificanti che interagiscono, per appaiamento di basi, con regioni del 3′UTR degli mRNA bersaglio. Questi RNA non codificanti fanno parte dell'importante classe dei microRNA (miRNA) che svolgono un ruolo di regolatori dell'attività genica a vari livelli. Meccanismi che coinvolgono interazioni di fattori proteici o di miRNA con specifici mRNA non solo regolano l'efficienza della traduzione, ma sono alla base anche di regolazioni della stabilità degli mRNA che, come il controllo della traduzione, ha effetti sull'efficienza di produzione delle proteine.
4. Patologie dell'apparato di traduzione
Poiché la sintesi proteica rappresenta uno dei processi di base essenziali per la vita delle cellule e degli organismi, ci si aspetta che difetti genetici dell'apparato di traduzione abbiano conseguenze molto gravi, in genere letali. Tuttavia, ci possono essere situazioni intermedie di difetti abbastanza limitati che, pur creando problemi, restano compatibili con la sopravvivenza. Nell'uomo sono state recentemente osservate alcune correlazioni tra specifiche situazioni patologiche e alcuni geni coinvolti nella produzione e nella funzione dell'apparato traduzionale, come nel caso dell'anemia di Diamond-Blackfan (DBA), della discheratosi congenita (DC), e della CACH (o VWM), una forma di ataxia infantile con ipomielizzazione del sistema nervoso.
Disordini ematologici e anemia ricorrono spesso nei casi di mutazioni di componenti dell'apparato traduzionale. Ciò suggerisce che l'ematopoiesi comporti una massima richiesta di sintesi proteica e che sia la prima a essere colpita quando l'apparato di traduzione è deficitario. Inoltre, poiché una corretta regolazione della crescita e proliferazione cellulare non può prescindere da una corretta regolazione della sintesi proteica globale, non è da stupirsi che sia stato più volte rilevato che difetti della traduzione e della sua regolazione sono implicati nei processi di cancerogenesi. Si possono prevedere interessanti sviluppi in cui la conoscenza dei meccanismi di traduzione permetterà di capire alcune situazioni patologiche, che forniranno materiale utile per allargare le nostre conoscenze di base.
Bibliografia
Ellis, Massey 2006: Ellis, Steven R. - Massey, Amy T., Diamond Blackfan anemia: a paradigm for a ribosome-based disease, "Medical hypotheses", 66, 2006, pp. 643-648.
Noller 1998: Noller, Harry F., I ribosomi e la traduzione del codice genetico, in: Frontiere della vita, Roma, Istituto della Enciclopedia Italiana, 1998, I, pp. 497-523.
Ruggero, Sonenberg 2005: Ruggero, Davide - Sonenberg, Nahum, The Akt of translational control, "Oncogene", 24, 2005, pp. 7426-7434.
Sonenberg 2000: Sonenberg, Nahum - Hershey, John W.B. - Mathews, Michael B., Translational control of gene expression, Cold Spring Harbor, Cold Spring Harbor Laboratory Press, 2000.
Yusupov 2001: Yusupov, Marat M. e altri, Crystal structure of the ribosome at 5.5 A resolution, "Science", 292, 2001, pp. 883-896.