Trapianto di midollo
Trapianto di midollo
Negli ultimi anni, l'uso terapeutico di cellule staminali ha attratto grande attenzione da parte della comunità scientifica nonché suscitato numerose speranze. Queste cellule presentano come loro caratteristica principale la capacità di rigenerarsi, dando vita a una cellula simile ‒ e quindi staminale ‒ e a una cellula che inizia a specializzarsi e diventerà parte di un tessuto dell'organismo. L'uso di cellule staminali ha sollevato numerose controversie scientifiche ed etiche soprattutto per ciò che riguarda l'uso di cellule prelevate da embrioni, che hanno la capacità di specializzarsi in tutti i tessuti dell'organismo adulto. Tuttavia, anche nell'organismo adulto esistono numerose nicchie di cellule staminali, che hanno capacità proliferativa ma minore plasticità. Esse garantiscono il ricambio dei tessuti per mantenere il funzionamento dell'organismo.
Se solo oggi le cellule staminali sono arrivate all'attenzione del grande pubblico, non vuol dire che non siano state utilizzate prima a scopo terapeutico. Infatti, è da oltre due decenni che viene praticato con successo il cosiddetto 'trapianto di midollo osseo', una procedura che consiste nel trapianto di cellule staminali emopoietiche (CSE), cioè di quelle cellule che sono in grado di produrre i diversi componenti del sangue, rendendo quindi possibile la continua rigenerazione dei suoi elementi nella forma funzionale alla sopravvivenza dell'organismo. Il trapianto di CSE può essere definito come l'espansione in vivo di cellule primitive (staminali), raccolte dal midollo osseo o dal sangue circolante, allo scopo di ricostituire il tessuto midollare osseo non più funzionante per effetto di un processo morboso o per l'azione tossica di farmaci o di radiazioni. L'approccio trapiantologico offre oggi la possibilità di guarigione per una significativa percentuale di pazienti affetti da malattie fino a pochi anni fa considerate incompatibili con una lunga sopravvivenza, tra le quali malattie ereditarie del sangue e patologie tumorali. Tecnicamente, la parte più complicata della procedura è la raccolta delle CSE dal donatore. Una volta isolate, vengono espanse in vitro, così da averne a disposizione un buon numero per la reinfusione nel ricevente, che avviene molto semplicemente per via endovenosa.
Come nelle altre pratiche di trapianto di organi, per la riuscita della procedura è fondamentale che vi sia la maggiore compatibilità possibile tra le cellule che vengono infuse e quelle del ricevente. Il sistema immunitario (controllato dai geni del cosiddetto 'complesso maggiore di istocompatibilità', MHC) è responsabile per il controllo della risposta di rigetto, e quindi il trapianto riuscirà molto bene se il donatore e il ricevente sono la stessa persona (il cosiddetto 'trapianto autologo', o autotrapianto). Con persone diverse (il 'trapianto allogenico') la compatibilità è necessariamente più bassa (a causa del diverso genoma degli individui), aumentando per contro il rischio dovuto al rigetto. Grazie all'introduzione di farmaci immunosoppressivi, è diventato possibile controllare almeno in parte le reazioni immunitarie. Tuttavia, per minimizzare la somministrazione di farmaci si cerca solitamente un parente stretto che possa fare da donatore. Va comunque sottolineato che dopo un tempo variabile tra i sei mesi e l'anno, se si è riusciti a far attecchire le cellule viene di fatto indotta una tolleranza immunologica, che consente di sospendere la terapia farmacologica.
Il tessuto midollare emopoietico
Il midollo osseo, sebbene distribuito in vari settori del corpo, e cioè ovunque esistano segmenti scheletrici, va considerato a tutti gli effetti un vero e proprio organo, indispensabile per la vita. È costituito da un particolare tessuto cui compete la funzione di produrre gli elementi corpuscolati del sangue, e cioè globuli rossi, globuli bianchi e piastrine. Accanto a elementi maturi o in via di maturazione delle varie linee cellulari, nel midollo risiede una piccola quota di cellule multipotenti, in grado di differenziarsi verso tutte le linee cellulari, dette cellule staminali emopoietiche; alcune di queste cellule circolano anche nel sangue periferico. In linea puramente teorica, anche una singola cellula staminale sarebbe sufficiente per ripopolare tutto il midollo, ma bisognerebbe essere certi che sarà accettata dall'organismo, e darle tutto il tempo necessario affinchè da una sola cellula si riproducano molti miliardi di cellule, garantendo la sopravvivenza per tutto il periodo di espansione con una totale protezione da processi infettivi ed eventi emorragici. In realtà, in un uomo adulto la ricostituzione del tessuto emopoietico in un midollo deserto richiede l'infusione di almeno 70 milioni di cellule staminali; questo numero di cellule consente la ripopolazione nell'arco di due o tre settimane.
La funzione emopoietica del midollo può venir meno per motivi diversi: invasione midollare da parte di cellule tumorali, come nelle leucemie, distruzione del tessuto per effetto di alte dosi di farmaci citotossici o di radiazioni utilizzate per curare un tumore maligno, aggressione immunologica del tessuto emopoietico, come nell'aplasia midollare. Il blocco totale della funzione midollare porta a morte in poche settimane; ne sono dolorosi esempi i soggetti colpiti da alte dosi di radiazioni ionizzanti, quali quelle derivanti da bombardamenti atomici o incidenti in centrali nucleari. Le trasfusioni, che consistono nell'infusione della parte corpuscolata del sangue prodotta da altre persone, risolvono solo transitoriamente il problema: l'infusione di globuli rossi va ripetuta ogni 15-20 giorni, ma per globuli bianchi e piastrine, corpuscoli a vita breve, sarebbe necessaria un'infusione pressocché quotidiana, e in ogni caso con il passare del tempo insorgerebbero nel ricevente reazioni immunologiche che distruggerebbero rapidamente le cellule infuse. È chiaro quindi che a un paziente con midollo non più funzionante più che particelle preconfezionate bisogna infondere cellule staminali, che provvederanno poi a ripopolare il midollo. Mentre la raccolta delle cellule staminali è sempre una procedura piuttosto complessa, l'infusione nel ricevente è di estrema semplicità: è sufficiente somministrare le cellule per via endovenosa, come una banale trasfusione di sangue, perché esse vengano trasportate verso il parenchima midollare ove, tramite la mediazione di specifiche molecole di adesione, riconoscono i siti in cui è più opportuno collocarsi (nicchie emopoietiche) per dare inizio alle fasi di proliferazione, differenziazione e maturazione che marcano la ripresa dell'emopoiesi.
Cenni storici
L'idea di trapiantare cellule staminali emopoietiche (CSE) si è fatta strada nella seconda metà del XX secolo. I primi tentativi, effettuati in pazienti terminali o in soggetti esposti a radiazioni per incidenti in centrali nucleari, risultarono infruttuosi, perché si tentavano trapianti allogenici in un periodo in cui ancora non era nota l'esistenza del complesso maggiore di istocompatibilità. Intorno al 1970 gli immunologi scoprirono che sul cromosoma 6 del nostro genoma sono contenuti numerosi geni che codificano per proteine espresse sulla maggior parte delle cellule dell'organismo (MHC, Major histocompatibility complex), soprattutto sui globuli bianchi (HLA, Human leukocyte antigens); esse sono diverse da un soggetto all'altro e consentono al sistema immunitario di ogni organismo di riconoscere le proprie cellule e differenziarle da quelle di altri individui, anche se appartenenti alla stessa specie.
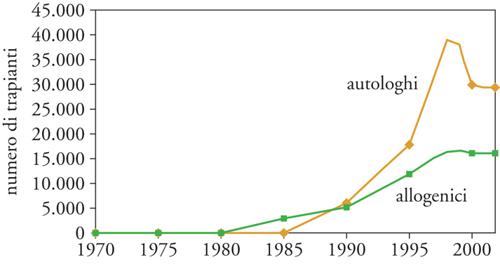
Poiché la regione HLA è ereditata in blocco con il cromosoma 6, si fece subito strada l'ipotesi che non sarebbe stato difficile trovare un donatore istocompatibile se il paziente disponeva di diversi fratelli o sorelle. Infatti, poiché ciascun individuo riceve un cromosoma 6 da ciascuno dei genitori, c'è il 25% di probabilità che due fratelli abbiano la stessa coppia di cromosomi 6 e siano pertanto HLA identici tra loro (mentre il 50% avrà un cromosoma 6 uguale e uno diverso e il 25% avrà entrambi i cromosomi diversi). La storia dei trapianti di CSE è quindi iniziata con i trapianti tra fratelli e si è diffusa nel mondo in maniera esponenziale (fig. 2), anche perché l'intervento non comporta rischi né mutilazioni nel donatore. In maniera apparentemente paradossale, il trapianto di CSE più semplice, quello in cui donatore e ricevente sono la stessa persona (autotrapianto) si è sviluppato solo in un secondo momento, anche se gode oggi di grande popolarità. In Europa, nel 2005 sono stati effettuati 8000 trapianti allogenici e 15.000 trapianti autologhi. Le procedure trapiantologiche sono costose e richiedono strutture adeguate; esse sono ampiamente disponibili nei Paesi più sviluppati (dove però diventa sempre più difficile trovare un donatore familiare per la ridotta natalità), mentre sono poco accessibili nei Paesi in via di sviluppo, dove l'alta natalità renderebbe più facile il reperimento di un fratello HLA identico. Nel mondo occidentale si fa sempre più frequentemente ricorso a donatori HLA identici non familiari (MUD, Matched unrelated donor), che hanno identità per gli antigeni HLA conosciuti, ma hanno naturalmente cromosomi 6 diversi; di conseguenza i trapianti da MUD presentano maggiori rischi di complicanze immunologiche.
Implicazioni immunologiche
Rigetto e rigetto inverso
Come avviene per i trapianti di organo, perché il trapianto di CSE attecchisca è necessario che l'organismo ricevente accetti il tessuto infuso. Questo avviene senza problemi nel caso dell'autotrapianto, nel quale si reinfondono cellule dello stesso paziente, e si verifica con facilità nel caso di trapianto fra gemelli monoovulari (trapianto singenico), nel qual caso donatore e ricevente hanno esattamente lo stesso corredo genomico (tutti i cromosomi sono uguali, inclusi i due cromosomi 6). Nei casi di trapianto allogenico, il ricevente, anche se HLA identico, tende a eliminare le cellule estranee attraverso i suoi sistemi di difesa immunitaria, con meccanismo identico a quello del rigetto nei trapianti di organi solidi. Clinicamente, il rigetto si manifesta con un mancato attecchimento (mancata risalita dei valori ematologici dopo 4÷6 settimane dal trapianto) o con la perdita del tessuto attecchito (azzeramento dei valori ematologici dopo un'iniziale risalita). Un intenso trattamento immunosoppressivo nel periodo immediatamente precedente il trapianto è in genere efficace nel bloccare i meccanismi alla base del rigetto.
Nel trapianto di CSE si verifica però un fenomeno aggiuntivo, che è sconosciuto nei trapianti di organo. Le cellule staminali trapiantate non solo determinano la ricostituzione della funzione emopoietica del midollo, ma, producendo linfociti del donatore, creano anche un nuovo sistema immunitario, che però è quello proprio del donatore. Una volta sviluppatosi, questo sistema può non riconoscere come propri i vari tessuti dell'organismo di cui è ospite, inducendo gravi malattie di natura immunologica che vanno sotto il nome di rigetto inverso, o malattia da trapianto contro ospite (GvHD, Graft versus host disease). Questa complicanza può presentarsi precocemente (da uno a tre mesi dopo il trapianto) in forma acuta o tardivamente in forma cronica. Per evitarla, è necessario che il paziente sia trattato con farmaci immunosoppressivi per un lungo periodo di tempo (da sei a dodici mesi) dopo il trapianto, con inevitabili rischi di complicanze infettive legati alla inattivazione dei sistemi difensivi dell'organismo.
La gravità dei fenomeni di rigetto e di rigetto inverso è tanto maggiore quanto maggiore è la diversità tra gli antigeni di istocompatibilità del ricevente rispetto a quelli del donatore. Questi fenomeni sono assenti nel trapianto autologo, hanno gravità moderata nei trapianti tra fratelli HLA identici, maggiore nei trapianti da donatore HLA identico non familiare e massima nei casi di donatore HLA non identico. Va però detto che nei trapianti effettuati per trattare malattie tumorali (per es., leucemie) una moderata reazione immunitaria post-trapianto può essere desiderabile, se aiuta a distruggere con un meccanismo immunologico le cellule leucemiche residue. Questo fenomeno, riconosciuto e sfruttato solo recentemente, viene definito 'effetto trapianto contro leucemia' (GvL, Graft versus leukemia) e spiega come mai un autotrapianto o un trapianto da gemello monoovulare possa essere gravato da maggiori rischi di recidiva di malattia leucemica rispetto a quello effettuato utilizzando come donatore un fratello non gemello.
Induzione della tolleranza
Nel trapianto allogenico, dopo 6÷12 mesi dall'ottenimento dell'attecchimento si instaura una tolleranza immunologica tra le cellule del ricevente e quelle del donatore che consente l'arresto della terapia immunosoppressiva. Il paziente è diventato quello che si dice una 'chimera biologica', cioè un organismo in cui coesistono tessuti di due diversi individui: il sistema emopoietico e quello immunologico sono del donatore, mentre tutti gli altri tessuti e apparati appartengono al ricevente. Se donatore e ricevente avevano gruppo sanguigno diverso, dopo il trapianto il ricevente cambia gruppo per acquisire quello del donatore. Se donatore e ricevente sono di sesso diverso, nelle cellule emopoietiche del ricevente e nelle sue cellule linfoidi sono riconoscibili i marcatori del sesso del donatore, mentre le altre cellule (per es., i bulbi piliferi e le cellule della mucosa buccale) conservano i marcatori del sesso del ricevente. Una controprova quasi paradossale dell'efficacia della ricostituzione emopoietica è data dai rarissimi casi nei quali, a distanza di anni dal trapianto, il trapiantato è stato a sua volta utilizzato per donare CSE al suo donatore originale, nel frattempo ammalatosi.
Tipi di trapianto
Una classificazione dei tipi di trapianto di CSE oggi possibili può essere basata sul grado di diversità immunologica tra ricevente e donatore (tab. 1).
Trapianto autologo. Donatore e ricevente sono la stessa persona. Le cellule staminali sono state raccolte e congelate perché il paziente ha una malattia di origine tumorale (per es., linfoma, mieloma) e deve essere sottoposto a una intensa terapia citotossica; le cellule verranno utilizzate subito dopo la somministrazione del trattamento citotossico intensivo, che lede irreversibilmente tutte le cellule presenti nel midollo nel corso del trattamento. Questo approccio consente l'utilizzo di farmaci a dosi letali, tali da distruggere sia il tumore sia il tessuto midollare; quest'ultimo viene però ricostituito con l'infusione delle staminali preventivamente raccolte. Poiché le cellule appartengono allo stesso paziente, non vi sono problemi immunologici e non vi è necessità di trattamento immunosoppressivo; a distanza di pochi mesi sia il sistema emopoietico che quello immunologico sono ricostituiti e funzionanti. In realtà non si tratta di un trapianto vero e proprio, ma della reinfusione di staminali autologhe.
Trapianto singenico. Il paziente ha indicazione al trapianto di CSE e dispone di un gemello monoovulare. Anche in questo caso non vi sono barriere immunologiche, non vi è necessità di trattamento immunosoppressivo, l'attecchimento è rapido e non vi sono complicanze immunologiche, ma, come nell'autotrapianto, viene a mancare l'effetto GvL.
Trapianto allogenico da fratello HLA identico. L'identità HLA assicura l'assenza di violente reazioni di rigetto o di rigetto inverso, ma non garantisce l'assenza di incompatibilità minori. È pertanto necessario instaurare il trattamento immunosoppressivo subito prima e per un lungo periodo dopo il trapianto, utilizzando farmaci che controllino la crescita delle cellule immunocompetenti senza interferire con la ripopolazione midollare (immunosoppressivi non mielosoppressivi, come cortisonici e ciclosporina A). Una volta instaurata la tolleranza immunologica, il trattamento immunosoppressivo può essere interrotto.
Trapianto allogenico da donatore HLA identico non correlato. Se il paziente necessita di un trapianto allogenico ma non ha fratelli o sorelle HLA identici, è possibile reperire un donatore HLA identico nel Registro dei donatori volontari di CSE, ricco ormai di più di 10 milioni di potenziali donatori residenti in centinaia di Paesi nel mondo. Tutti i soggetti di età compresa fra 18 e 35 anni possono chiedere di entrare nell'elenco dei donatori volontari di cellule staminali; essi saranno sottoposti a un banale prelievo di sangue venoso, su cui viene effettuata la tipizzazione HLA. I risultati della tipizzazione sono inseriti in un sistema informatico che è reso disponibile su base mondiale. Nel momento in cui un paziente con identico sistema HLA ha necessità di essere trapiantato, il donatore volontario viene contattato, ristudiato per confermare la compatibilità e l'assenza di patologie, e infine invitato a effettuare la donazione nella sua zona di residenza; le cellule raccolte sono inviate per via aerea al Centro Trapianti dove è degente il ricevente. La ricerca, relativamente rapida, consente di trovare un donatore compatibile al 30÷40% dei richiedenti nel giro di alcuni mesi. Questo tipo di trapianto ha rischi maggiori di rigetto e di rigetto inverso, e necessita di trattamento immunosoppressivo più intenso rispetto al trapianto da fratello HLA identico. Recenti tecniche, peraltro, consentono di verificare l'istocompatibilità a livelli molto più precisi (tipizzazione molecolare), riducendo rischi e gravità dei fenomeni di rigetto.
Trapianto allogenico da donatore non completamente HLA compatibile. In assenza di donatore HLA identico e per patologie estremamente severe che non hanno alternative terapeutiche, si tenta talora di utilizzare donatori HLA mismatched, che hanno uno o più antigeni HLA diversi dal ricevente. Infatti, frequente è il ricorso a donatori aploidentici, rappresentati dai genitori o dai figli del paziente, che per definizione avranno certamente un cromosoma 6 in comune, ma l'altro è totalmente o parzialmente diverso. I problemi di rigetto e di rigetto inverso sono molto più gravi, l'immunosoppressione deve essere massiccia e prolungata e i risultati rimangono incerti.
Trapianto da cellule cordonali. Il sangue dei neonati è ricco di cellule staminali; una parte di esso, quello che rimane nella placenta, resta inutilizzato. Esso può essere raccolto e congelato. Sono nate numerose banche di sangue cordonale, ed è oggi possibile utilizzare le cellule congelate per trapiantare bambini (il numero di cellule disponibili non è sufficiente per trapiantare un adulto). Anche per il sangue cordonale bisogna rispettare la compatibilità HLA, ma in caso di compatibilità incompleta le reazioni immunologiche sono meno frequenti e meno gravi rispetto al trapianto di staminali da adulto. L'attecchimento però è meno sicuro e i tempi di recupero ematologico sono in genere più lunghi rispetto al trapianto di cellule di provenienza midollare.
Fonti delle cellule staminali emopoietiche
Per molti anni le CSE sono state raccolte esclusivamente dal midollo osseo, con donatori in anestesia (totale o spinale), mediante 30-40 punture sulle creste iliache da cui possono ricavarsi 1000÷1500 ml di succo midollare nel quale le cellule staminali sono frammiste a cellule mature, precursori e progenitori emopoietici. L'espianto non provoca danni al donatore, che ricostituisce in poche settimane il tessuto perso. Poiché la perdita rapida di oltre un litro di sangue midollare potrebbe provocare condizioni di shock, è necessario che nel corso dell'espianto il donatore riceva due unità di sangue. Se il donatore è un volontario normale, il sangue utilizzato per la trasfusione appartiene allo stesso individuo, prelevato una e due settimane prima dell'espianto (autotrasfusione). Il donatore lascia l'ospedale il giorno dopo l'espianto. La sacca contenente il succo midollare raccolto può essere infusa immediatamente al ricevente per via endovenosa, o essere congelata in azoto liquido e utilizzata successivamente.
Da alcuni anni si è scoperto che è possibile indurre una grande quantità di cellule staminali a lasciare il midollo e trasferirsi nel sangue circolante, mediante la procedura della 'mobilizzazione'. Questo avviene nel corso del recupero successivo alla chemioterapia: infatti, dopo circa dieci giorni dal trattamento e per la durata di pochissimi giorni, c'è un'onda di cellule staminali che si versa nel sangue periferico, che incrementa il numero di staminali circolanti di oltre cento volte. Un fenomeno analogo può essere ottenuto trattando una persona sana con un fattore di crescita (G-CSF, Granulocyte-colony stimulating factor): dopo cinque o sei giorni di somministrazione, aumenta il numero dei globuli bianchi e compaiono in circolo molte cellule staminali. Se nel periodo di massimo incremento il donatore è collegato a una speciale apparecchiatura (separatore cellulare) è possibile raccogliere dal sangue venoso le cellule staminali (leucoaferesi) per poi infonderle endovena nel ricevente. Nel periodo che intercorre fra raccolta e infusione, per evitare perdita di vitalità, le cellule staminali prelevate vengono congelate in azoto liquido in presenza di un criopreservante, il dimetilsulfossido (DMSO), dove possono essere tenute anche per mesi o anni (criopreservazione), per scongelarle subito prima dell'utilizzo. La tecnica della mobilizzazione, inizialmente molto utilizzata per l'autotrapianto, in cui si sfrutta l'azione combinata del recupero post-chemioterapia e quella della somministrazione di G-CSF, è stata poi allargata ai trapianti allogenici, nei quali si offre oggi l'opzione al donatore di mobilizzare le cellule staminali con la somministrazione del solo fattore di crescita G-CSF e quindi di raccoglierle mediante aferesi, evitando in tal modo anestesia, punture delle creste iliache e autotrasfusione.
È inoltre possibile ottenere del sangue placentare contenente CSE dal cordone ombelicale. Dopo il parto, a cordone ombelicale legato e reciso e prima dell'espulsione della placenta, si possono prelevare, in condizioni di sterilità, 30÷40 ml di sangue placentare. Il materiale raccolto è sottoposto a tutti i controlli necessari, compreso il conteggio delle cellule staminali, e congelato in azoto liquido in presenza di criopreservante (DMSO). Esiste una rete di banche di sangue cordonale che rende disponibili ai centri pediatrici diverse migliaia di unità di cellule cordonali.
Indicazioni
I costi e i rischi connessi con la procedura trapiantologica richiedono che questo tipo di trattamento sia riservato a specifiche malattie e a un selezionato gruppo di pazienti. Gli ammalati che possono maggiormente giovarsi di un trapianto sono quelli più giovani e in buone condizioni fisiche. Le patologie per le quali vi può essere indicazione al trapianto sono elencate di seguito.
Sindromi da insufficienza midollare. La perdita totale e persistente della funzione emopoietica midollare può derivare da cause congenite (per es., anemia di Fanconi) oppure acquisite (per es., esposizione accidentale a radiazioni ionizzanti, aplasia midollare su base immunologica). Se è disponibile un donatore HLA identico, il trapianto allogenico può consentire il recupero della funzione midollare.
Leucemie. In queste malattie a carattere neoplastico del midollo osseo il trapianto ha lo scopo di sostituire l'organo malato. Tuttavia, l'indicazione al trapianto non è estesa a tutte le forme di leucemia, perché alcune di esse possono guarire con la sola chemioterapia (per es., leucemia acuta linfoide del bambino, leucemia promielocitica), o perché la malattia si può essere mostrata resistente a qualsiasi forma di chemioterapia ed è quindi da considerarsi ineradicabile. In ogni caso, il paziente va avviato al trapianto quando è in buone condizioni cliniche, cioè dopo che una chemioterapia adeguata abbia già determinato una regressione di sintomi e segni della malattia. La leucemia mieloide acuta e la leucemia linfoide acuta ad alto rischio sono attualmente le forme in cui più frequentemente si ricorre al trapianto come terapia di consolidamento dei risultati ottenuti con la chemioterapia. Se non è disponibile un donatore HLA identico e la malattia ha raggiunto una buona remissione con la chemioterapia, nelle leucemie acute può essere utilizzato un approccio autotrapiantologico, utilizzando cellule staminali raccolte nel corso della remissione. La leucemia mieloide cronica ha rappresentato fino a pochi anni fa una delle principali indicazioni al trapianto allogenico, ma essa può oggi essere controllata nella larga maggioranza dei pazienti con l'uso di una nuova classe di inibitori cellulari con bersaglio specifico (i cosiddetti farmaci intelligenti, quali l'imatinib mesilato), che ha reso più raro il ricorso al trapianto allogenico.
Tumori chemiosensibili. Per pazienti con tumori solidi sensibili alla chemioterapia (per es., linfomi, alcuni carcinomi), che non rispondono completamente alla chemioterapia standard o che recidivano dopo tale terapia, si può tentare di eradicare la malattia neoplastica con citostatici associati a trapianto autologo (più raramente allogenico) di midollo. Poiché nei tumori solidi il trapianto di CSE ha come scopo principale quello di consentire l'uso di dosi molto elevate di citotossici, se il tumore è chemio- e radioresistente (evenienza frequente in molti tumori solidi, quali quelli del polmone, del colon, del pancreas) non vi è indicazione al trapianto.
Talassemie, emoglobinopatie. In casi gravi di anomalie congenite della produzione di emoglobina (talassemia maggiore, anemia falciforme) il trapianto allogenico può consentire la produzione di globuli rossi ricchi di emoglobina normale. Naturalmente il beneficio del trapianto va bilanciato con i rischi connessi alla procedura.
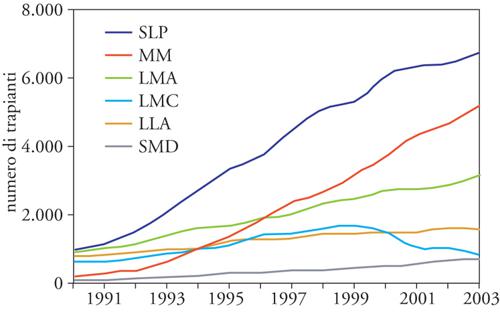
Immunodeficienze congenite, errori congeniti del metabolismo. In questi casi il trapianto di midollo è utilizzato non per sostituire il tessuto emopoietico, che è normale, ma per creare un sistema immunitario funzionante (nelle immunodeficienze) o per consentire la produzione di enzimi congenitamente carenti. Si tratta in questi casi sempre di trapianto allogenico, da effettuare precocemente, prima che la malattia produca danni irreversibili. La fig. 3 documenta i trapianti effettuati in Europa dal 1990 in poi, suddivisi secondo le principali patologie ematologiche.
Procedure
Il trapianto segue una routine ormai standard che è composta da tre fasi principali, in cui il paziente viene trattato prima con una chemioterapia al fine di eradicare la malattia presente e di far sì che non vi sia reazione di rigetto immunitario ('condizionamento'). Successivamente avverrà la cosiddetta 'infusione' delle CSE, e da ultimo si seguirà una procedura di protezione del paziente durante la 'fase aplastica', quando vi sarà un forte deficit delle difese immunitarie
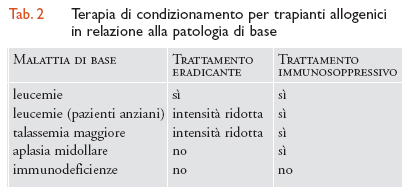
Condizionamento. Il paziente che deve ricevere il trapianto di CSE è sottoposto a un trattamento chemioterapico intensivo che precede l'infusione delle cellule staminali. Nelle leucemie sottoposte a trapianto allogenico, questo trattamento ha il duplice scopo di eradicare la malattia di base e di sopprimere le difese immunitarie che tenderebbero a rigettare le cellule estranee. Il regime di condizionamento varia a seconda della patologia da trattare: nell'anemia aplastica non c'è bisogno di trattamento eradicante, in quanto il midollo è già vuoto; nelle immunodeficienze congenite non vi è necessità né di eradicazione né di immunosoppressione, poiché il paziente è già immunosoppresso. Al contrario, nell'autotrapianto è necessaria un'intensa eradicazione ma non occorre immunosoppressione (tab. 2). Il regime di condizionamento determina comunque un'estrema riduzione delle difese dell'organismo, per cui il paziente deve soggiornare in ambiente protetto fino a recupero ematologico. L'età del paziente come fattore limitante all'uso di procedure trapiantologiche si sta modificando nel tempo. Oggi si sottopongono ad autotrapianto di midollo pazienti di qualsiasi età, anche dopo i 60 anni; per i trapianti allogenici sono stati disegnati regimi di condizionamento a intensità ridotta che consentono di effettuare questa procedura anche fra i 50 e i 60 anni. Resta però l'assunto che le possibilità di successo sono tanto maggiori quanto più giovane è l'età del paziente.
Infusione. La sacca di tessuto da reinfondere (sangue midollare o staminali periferiche raccolte dopo mobilizzazione) è somministrata al paziente per via endovenosa. Se esiste differenza di gruppo sanguigno fra donatore e ricevente, la sacca è sottoposta a procedure di sedimentazione o di centrifugazione per eliminare i globuli rossi o il plasma.
Fase aplastica. Nel tempo necessario per la ripopolazione midollare (2-4 settimane) la vita del paziente dipende dalla rigorosa osservanza di strette norme igieniche e terapeutiche. Anzitutto, il paziente deve soggiornare in un ambiente a carica batterica estremamente ridotta (camere sterili, camere a flusso laminare, camere a pressione positiva di aria filtrata), dove può ricevere visitatori solo a condizione che siano state prese le opportune precauzioni. Infatti, anche medici e infermieri devono indossare mascherine, camici, cuffie, calzari e guanti sterilizzati. La terapia di supporto è intensiva: trasfusione di globuli rossi, di piastrine, antibiotici, antivirali, antimicotici, farmaci immunosoppressori e, se necessario, alimentazione parenterale. I primi segni dell'attecchimento sono rappresentati dalla comparsa in circolo di globuli rossi giovani (reticolociti) e dall'aumento di globuli bianchi e piastrine. Superati i 1000 globuli bianchi e le 20.000 piastrine per mm3, il paziente lascia l'ambiente protetto ma continua a richiedere un regime di vita particolarmente riservato, specie se ha ricevuto un trapianto allogenico ed è quindi sotto terapia immunosoppressiva.
Patologie da trapianto di cellule emopoietiche
In conseguenza delle forti dosi di farmaci citotossici, della prolungata fase aplastica, della somministrazione di immunosoppressori e del nuovo assetto immunologico, dopo un trapianto di CSE possono manifestarsi una serie di malattie, talora anche di estrema gravità, alcune delle quali sconosciute nella patologia spontanea.
Malattia da trapianto contro ospite (GvHD). È una patologia specifica del trapianto di CSE. La forma acuta, precoce, colpisce cute, fegato o intestino (causando quindi dermatiti esfoliative, epatiti fulminanti, enteropatie essudative); la forma cronica ha un quadro clinico che ricorda la dermatomiosite. Va trattata incrementando l'immunosoppressione mediante l'utilizzo di cortisonici e di anticorpi antilinfocitari.
Infezioni da agenti opportunisti. Sono infezioni causate da microrganismi (batteri, virus, funghi) che aggrediscono solo soggetti le cui difese immunitarie sono fortemente deficitarie. Particolarmente frequenti le infezioni da citomegalovirus, che è ospite innocuo nella maggior parte della popolazione umana e si virulenta in seguito a immunosoppressione.
Polmonite interstiziale. È una grave infiammazione del tessuto polmonare che colpisce più frequentemente i pazienti che ricevono regimi di condizionamento in cui sono incluse le radiazioni.
Malattia veno-occlusiva epatica ed endotelite tossica. Sono patologie dovute a lesioni delle cellule endoteliali che rivestono i vasi sanguigni; i piccoli vasi si occludono e si verifica essudazione di plasma nei tessuti. Il presentarsi di queste gravi patologie è responsabile della mortalità legata al trapianto di CSE, che incide per circa il 20% nei trapianti allogenici.
Risultati e prospettive future
Per alcuni tipi di patologie, l'approccio trapiantologico allogenico rappresenta oggi il miglior trattamento possibile, in grado di portare a guarigione definitiva un numero significativo di pazienti: quasi il 90% nella talassemia maggiore, il 60% nella leucemia acuta mieloide. I limiti di questa procedura sono rappresentati dall'età del paziente, dalla disponibilità di un idoneo donatore, dalla incidenza di complicanze, soprattutto immunologiche. Il trapianto autologo comporta meno rischi, ma è gravato da maggiori possibilità di recidiva della malattia di base.
Per i prossimi decenni è prevedibile che le indicazioni al trapianto di CSE per malattie neoplastiche possano ridursi, quando verranno realizzati nuovi farmaci in grado di agire direttamente sulle cellule tumorali inducendole a perdere la loro aggressività nei confronti dell'organismo. È quello che è già avvenuto per la leucemia mieloide cronica, in cui l'uso dell'imatinib mesilato annulla il vantaggio proliferativo che la cellula neoplastica ha sviluppato in seguito all'acquisizione di una lesione genetica (traslocazione cromosomica con formazione del cromosoma Philadelphia). Nel contempo, potranno nascere nuove indicazioni e nuove tecnologie. Si sta studiando la possibilità di curare gravi malattie immunologiche (lupus eritematoso sistemico, artrite reumatoide, sclerosi multipla) con trapianto autologo. La terapia genica si propone di modificare in vitro le cellule staminali alterate per poi reinfonderle nell'organismo (autotrapianto con staminali ingegnerizzate): è una tecnica che potrebbe guarire la talassemia e molte altre malattie ereditarie senza correre i rischi del trapianto allogenico. Tuttavia, mentre è già possibile inserire i geni corretti nelle singole cellule, permangono ancora problemi nel determinare il vantaggio proliferativo necessario alle cellule ingegnerizzate per sostituirsi al tessuto ammalato.
Grandi speranze sono anche riposte nella possibilità di espandere in vitro le cellule staminali purificate; questo consentirebbe, per esempio, di utilizzare il sangue cordonale anche per trapianti in adulti. Purtroppo, finora i tentativi di espansione in vitro sono risultati infruttuosi perché le cellule staminali, indotte a proliferare, tendono a differenziarsi e a maturare, perdendo così le caratteristiche di staminalità. Infine, molte discipline non ematologiche guardano con interesse al possibile utilizzo di cellule staminali emopoietiche per riparare tessuti diversi dal midollo osseo: viene studiata la possibilità che esistano fra di esse cellule staminali totipotenti, in grado di differenziarsi anche in cellule di organi diversi (miociti nel cuore, cellule del sistema nervoso centrale, epatociti, cellule pancreatiche producenti insulina, ecc.), che potrebbero essere utilizzate per riparare gravi danni degenerativi di questi importanti sistemi somministrandole per via venosa, o arteriosa, o iniettandole in loco. Esistono però ancora numerosi problemi da risolvere in questo settore.
Bibliografia
Bacigalupo 2000: Bacigalupo, Andrea - Frassoni, Francesco - van Lint, Maria Teresa, Bone marrow or peripheral blood as a source of stem cells for allogeneic transplants, "Current opinion in hematology", 7, 2000, pp. 343-347.
Blume 2004: Thomas' hematopoietic cell transplantation, 3. ed., edited by Karl G. Blume, Stephen J. Forman, Frederick R. Appelbaum, Malden (Mass.)-Oxford, Blackwell, 2004.
Gratwohl 2002: Gratwohl, Alois e altri, Current trends in hematopoietic stem cell transplantation in Europe, "Blood", 100, 2002, pp. 2374-2386.
Gratwohl 2005: Gratwohl, Alois e altri, Change in stem cell source for hematopoietic stem cell transplantation (HSCT) in Europe: a report of the EBMT activity survey 2003, "Bone marrow transplantation", 36, 2005, pp. 575-590.
Lazarus 2006: Lazarus, Hillard M. e altri, Autotransplantation versus HLA-matched unrelated donor transplantation for acute myeloid leukaemia: a retrospective analysis from the Center for International Blood and Marrow Transplant Research, "British journal of haematology", 132, 2006, pp. 755-769.
Ljungman 2006: Ljungman, Per e altri, Allogeneic and autologous transplantation for haematological diseases, solid tumours and immune disorders: definitions and current practice in Europe "Bone marrow transplantation", 37, 2006, pp. 439-449.