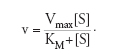Enzimi
Enzimi
Il segreto della vita è negli enzimi. Questi catalizzatori naturali sono i responsabili dei processi vitali e quindi anche della crescita e dello sviluppo di tutti gli animali, piante e microrganismi della Terra. Modificano le sostanze, le trasformano una nell'altra, costruiscono nuovi tessuti e riciclano i costituenti dei vecchi. Essi traducono l'informazione genetica contenuta nel DNA, sono gli agenti attivi dietro l'evoluzione e gli ecosistemi, sono i creatori e sostenitori del nostro corpo e del regno dei viventi. Giocano un ruolo fondamentale nei processi naturali che vanno dall'utilizzazione degli alimenti, al funzionamento della retina dell'occhio, alla trasmissione dei messaggi nel cervello e del sistema nervoso centrale, alla dissoluzione dei coaguli del sangue e alla luminosità delle lucciole. Mediante l'azione di enzimi, le piante trasformano l'anidride carbonica in zuccheri complessi che poi altri esseri viventi utilizzano come nutrimento, liberando ossigeno nell'atmosfera. Enzimi contenuti in batteri che proliferano sul suolo riciclano un altro elemento vitale, l'azoto. Alcuni rilasciano il gas nell'atmosfera da animali e piante in decomposizione, altri lo fissano in una forma che può essere riutilizzata dalle piante per crescere. Gli enzimi vengono utilizzati, anche inconsapevolmente, dall'uomo da millenni, per esempio nella produzione del vino e del formaggio, e attualmente sono impiegati nel trattamento del cotone, della lana, delle pelli e del grano, del riso, della frutta e di molti altri cibi. La loro utilizzazione industriale costituisce la base delle biotecnologie ed è in forte aumento in quanto la loro applicazione conferisce al prodotto una caratteristica 'biologica' in linea con un processo ecocompatibile.
Il termine 'enzima' deriva dal greco e letteralmente significa 'nel lievito'. La definizione è di oltre un secolo fa e si deve a Wilhelm Kuhne. Egli osservò nel lievito la presenza di sostanze responsabili di fenomeni 'fermentativi', dal latino fervere, cioè bollire, in quanto il processo avveniva con lo svolgimento di gas e, nel caso specifico, di anidride carbonica. Successivamente Louis Pasteur dimostrò che 'cellule viventi' di lieviti o di altri microrganismi erano responsabili di tali fenomeni. Nel 1897 Eduard Buchner scoprì che la fermentazione poteva avvenire anche se le cellule di lievito erano state rotte, dimostrando la non indispensabilità dell'integrità cellulare e la presenza nel lievito di fattori che facevano avvenire la fermentazione. Questi fattori avevano la caratteristica di trasformare grandi quantità di una certa sostanza in prodotti di reazione senza essere consumati e, per la loro presenza in esseri viventi, furono denominati 'biocatalizzatori'. Già Lazzaro Spallanzani aveva messo in evidenza fenomeni biocatalitici, anche senza produzione di gas, con cui frammenti di carne erano resi solubili, cioè idrolizzati, da sostanze presenti nello stomaco di rapaci. Lo studio di questi fattori impegnò i biochimici e i biologi per lungo tempo sino a quando James B. Summer, nel 1926, riuscì a ottenere allo stato puro il primo enzima, una ureasi, che idrolizza l'urea in ammoniaca e anidride carbonica. L'enzimologia ha inizio da questa data, con i risultati ottenuti da Summer, che confermarono l'idea che Jöns J. Berzelius, molti anni prima, aveva avanzato ipotizzando che tutte le reazioni chimiche, che avvengono nelle cellule e negli organismi viventi, fossero catalizzate da questi fattori; tali fattori, appartenenti al gruppo delle proteine, furono successivamente denominati enzimi.
Enzimi come proteine nel metabolismo cellulare
Le proteine sono le macromolecole più abbondanti presenti nelle cellule e sono gli strumenti attraverso i quali è espressa l'informazione genetica. Alle migliaia di geni presenti nel DNA di una cellula, ciascuno codificante per una distinta caratteristica di un organismo, corrispondono migliaia di differenti tipi di proteine, ognuna delle quali svolge un ruolo specifico. Esistono dunque proteine di nutrimento e riserva, proteine di trasporto, proteine contrattili e per il movimento, proteine per la difesa della cellula, proteine di regolazione e proteine enzimatiche. In una singola cellula sono stati identificati 2000÷3000 enzimi, altri ne vengono continuamente scoperti.
Gli enzimi sono le unità funzionali del metabolismo cellulare. Organizzati in sequenze, catalizzano le numerose reazioni attraverso le quali le sostanze nutrienti sono degradate, estraendone energia e piccoli precursori che sono a loro volta utilizzati per la sintesi di molecole indispensabili a tutte le funzioni vitali. Un esempio interessante è la digestione della carne, composta essenzialmente di proteine, da parte del nostro apparato gastrointestinale. La carne ingerita è scissa, in solo due ore circa, nei vari componenti dagli enzimi secreti dallo stomaco e dall'intestino; si consideri, come confronto, che per ottenere chimicamente la stessa degradazione occorre bollire la carne per una notte in acido cloridrico concentrato. I peptidi e gli aminoacidi prodotti dalla idrolisi sono a loro volta utilizzati per la sintesi di nuove proteine e nel metabolismo cellulare.
Struttura e classificazione degli enzimi
Gli enzimi, come tutte le proteine, sono costituiti da piccole molecole organiche: gli amminoacidi. La composizione e la sequenza amminoacidica di ogni proteina conferiscono a essa una precisa struttura tridimensionale che ne determina la funzione. La struttura e le proprietà di un enzima sono determinate dal tipo e dalla sequenza secondo cui si susseguono gli amminoacidi nella catena. Essi sono costituiti da un numero variabile tra 100 e 2500 amminoacidi raggiungendo pesi molecolari tra circa 10.000 e 1.000.000 di Dalton (Da), dove Da è l'unità di massa atomica. Il sito dove si lega il substrato, 'sito attivo', occupa solo una piccola parte della molecola proteica ma è il risultato finale di tutte le interazioni degli amminoacidi che la compongono con l'ambiente esterno, l'acqua, e tra le catene laterali presenti. In genere enzimi che esplicano funzioni più complesse sono relativamente più grandi. Infatti, un enzima coinvolto in una via metabolica oltre a contenere il sito attivo e un eventuale sito di regolazione, deve anche riconoscere gli enzimi posizionati prima e dopo nella via stessa o eventualmente legati alla membrana.
Alcuni enzimi sono costituiti solo da catene polipeptidiche, altri invece contengono 'cofattori' e/o coenzimi. I cofattori sono in genere ioni inorganici come Fe, Zn, Mo mentre i coenzimi sono molecole organiche complesse (come il FAD, Flavina adenin dinucleotide; il NAD, Nicotinammide adenin dinucleotide; ecc.) che prendono il nome di 'gruppi prostetici'.
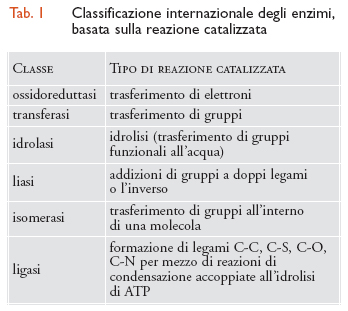
La prima maniera di definire un enzima era quella di aggiungere il suffisso -asi al nome del substrato: l'enzima che trasforma l'urea ha il nome di ureasi. Successivamente è stata insediata una Enzyme Commission (EC) che ha classificato tutti gli enzimi in sei classi; ognuna possiede diverse sottoclassi, in base al tipo di reazione catalizzata (tab. 1). La maggior parte degli enzimi catalizza il trasferimento di elettroni, atomi o gruppi funzionali. Essi sono perciò classificati da un numero di codice e da un nome che tiene conto del tipo di trasferimento, dal gruppo donatore e dal gruppo accettore. Esistono sei gruppi principali.
Un esempio tipico è quello dell'enzima che catalizza la reazione:
ATP + glucosio → ADP + glucosio6 − fosfato.
Il nome volgare di questo enzima è esochinasi, il nome sistematico è ATP: glucosio fosfotransferasi EC.2.7.1.1. Questo indica che esso catalizza il trasferimento di un gruppo fosforico dall'ATP al glucosio e il numero che segue indica la classificazione dell'Enzyme Commission. Il primo numero, 2, indica che l'enzima appartiene alla classe delle transferasi, il secondo, 7, alla sottoclasse delle fosfotransferasi, il terzo, 1, alla sotto-sottoclasse delle fosfotranferasi con gruppo ossidrilico come accettore, il quarto, 1, indica che il glucosio è l'accettore.
Cinetica enzimatica
Gli enzimi hanno capacità catalitiche straordinarie, generalmente molto più alte dei normali catalizzatori. A questa proprietà associano un'elevata specificità per il loro substrato e portano alla formazione di un solo prodotto di reazione in condizioni blande di temperatura, pH e forza ionica compatibili con la vita. Il meccanismo con cui gli enzimi accelerano le reazioni chimiche è oggetto della cinetica, quel ramo della chimica che studia la velocità delle reazioni.
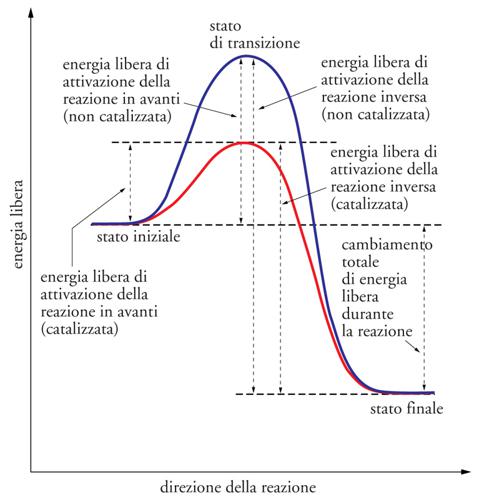
Le molecole riescono a reagire soltanto quando entrano in contatto tra loro; quindi, qualsiasi fattore aumenti la frequenza delle collisioni permette di migliorare l'efficienza delle reazioni, come per esempio, tra i catalizzatori non biologici, la maggiore concentrazione di reagenti o l'aumento della temperatura. D'altra parte, non tutte le molecole che entrano in collisione possono reagire, ma esse devono possedere sufficiente energia per superare una barriera di energia potenziale nota come 'energia di attivazione'. Nella fig. 2 sono illustrati i profili energetici di una reazione non catalizzata e di una catalizzata. La reazione non catalizzata si può paragonare a una palla che deve superare un ostacolo (una pietra o un dosso). Se la palla si trova sulla cima del dosso potrà rotolare oltre l'ostacolo; viceversa, se la palla è collocata alla base del dosso tenderà a rimanere in quella posizione. Il dosso rappresenta l'energia di attivazione e, nel primo caso, il reagente ‒ cioè la palla ‒ contiene già sufficiente energia per superare la barriera energetica; invece se il reagente si trova nello stato energetico iniziale difficilmente riuscirà a superare la barriera di energia potenziale.
La spiegazione più convincente riguardo alla presenza dell'energia di attivazione nelle reazioni chimiche è stata proposta da Henry Eyring negli anni Trenta del XX sec. con la teoria dello 'stato di transizione'. Secondo questa teoria, in ogni reazione si forma una specie chimica instabile, intermedia tra reagenti e prodotti, che deve ritornare in uno stato energetico più stabile. L'energia di attivazione è l'energia necessaria per portare i reagenti allo stato di transizione (la palla sulla sommità del dosso nell'esempio precedente); successivamente, lo stato di transizione potrà formare il prodotto o tornare allo stato di reagente, entrambi con un contenuto energetico inferiore.
Come è illustrato nella fig. 2 i catalizzatori agiscono abbassando l'energia di attivazione delle reazioni chimiche senza essere a loro volta modificati irreversibilmente. Nel caso degli enzimi, essi si legano ai reagenti formando uno stato di transizione diverso da quello delle reazioni non catalizzate e a più bassa energia. È importante notare che lo stato energetico dei reagenti e dei prodotti è lo stesso nelle reazioni catalizzate e in quelle non catalizzate, quindi il catalizzatore non modifica la differenza energetica totale della reazione chimica.
Lo stato di transizione si forma quando l'enzima si lega al suo substrato; un'altra caratteristica degli enzimi è la loro estrema specificità di substrato. Già nel 1890 Hans Fischer propose la presenza sulla superficie degli enzimi di una regione complementare al substrato, simile a quella di una serratura per la sua chiave. Questo modello 'chiave-serratura' non era molto lontano dalla realtà ed ebbe anche il merito di introdurre il concetto di sito attivo, cioè di una regione nella molecola enzimatica che contiene gli amminoacidi in grado di legare il substrato e di svolgere la catalisi. Più tardi, nel 1958, Daniel Koshland, sulla base di studi di cristallografia ai raggi X e di risonanza magnetica nucleare (NMR), propose un nuovo modello secondo cui il sito attivo diveniva complementare al substrato solo in presenza di quest'ultimo. Questo modello, detto dell'adattamento indotto, è molto più realistico in quanto tiene conto della capacità della struttura dell'enzima di adattarsi al substrato.
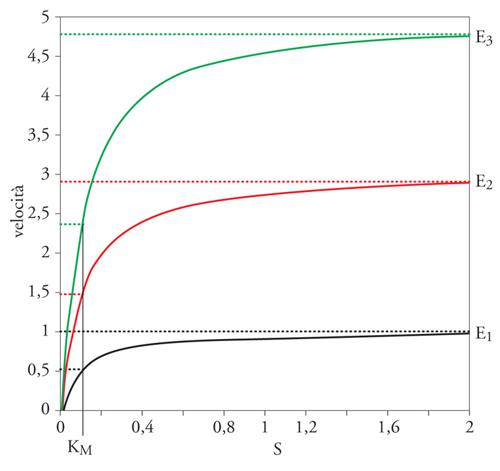
La formazione del complesso enzima-substrato, in realtà, era nota già da tempo e si basava sullo studio della velocità delle reazioni catalizzate da enzimi: la 'cinetica enzimatica'. Infatti, nel 1902, Adrian Brown dimostrò che la velocità dell'idrolisi del saccarosio a opera dell'enzima invertasi non era direttamente proporzionale alla concentrazione del reagente, come avviene nell'idrolisi chimica, ma riportando in un grafico la velocità iniziale in funzione della concentrazione del substrato si otteneva una iperbole rettangolare (fig. 3).
La spiegazione di questa caratteristica delle reazioni enzimatiche fu fornita dallo stesso Brown che propose che l'enzima ‒ che è presente in concentrazione costante ‒ e il substrato si combinano formando 'un complesso enzima-substrato' secondo la reazione:
Questa equazione ‒ che è di valore generale per gli enzimi a singolo substrato ‒ è di importanza centrale per tutta l'enzimologia.
Nella fig. 3 è mostrato il diagramma di una tipica cinetica di una reazione catalizzata da un enzima. Si nota che a concentrazioni di substrato molto basse, la velocità della reazione è lineare con l'aumentare della concentrazione del substrato stesso in quanto si forma il complesso ES. Quando il substrato è presente in largo eccesso rispetto all'enzima, la velocità diventa costante in quanto tutto l'enzima è saturato dal substrato ed esso si trova tutto sotto forma del complesso ES.
In questo caso, la velocità della reazione dipende principalmente dalla scissione del complesso ES in E e P, mentre è indipendente dalla concentrazione di substrato, visto che ogni ulteriore aggiunta non ne modifica la velocità di reazione. Per questo motivo, con il substrato saturante, si raggiunge la velocità massima della reazione (Vmax). Il problema che si poneva era come si potesse determinare la velocità della reazione se il substrato era continuamente consumato dalla reazione stessa. Nel caso in cui il substrato è in largo eccesso rispetto all'enzima si poteva determinare la velocità nei primi momenti della reazione, ovvero la cosiddetta 'velocità iniziale'. A queste condizioni la concentrazione di prodotto che si forma è trascurabile e l'equazione diventa:
La trattazione più completa della cinetica enzimatica fu fatta da Leonor Michaelis e Maud L. Menten nel 1913 e poi modificata da George E. Briggs e John B.S. Haldane nel 1925. L'assunzione di Michaelis e Menten era che si creava un equilibrio tra E, S e il complesso ES e che la scissione di quest'ultimo fosse il passo limitante più lento. Di conseguenza, quando si effettuava la misura della velocità di reazione la concentrazione del substrato variava in modo trascurabile. Più tardi Briggs e Haldane introdussero un'assunzione diversa, secondo cui il complesso ES si trova in uno stato stazionario nel quale la concentrazione del complesso rimane costante perché le velocità di formazione e di scissione sono uguali. La trattazione dello stato stazionario si è in seguito rivelata come quella applicabile al maggior numero di casi ed è largamente adottata a tutt'oggi con le equazioni di cinetica enzimatica che hanno prodotto le costanti cinetiche. Infatti, applicando le suddette assunzioni si ricava quella che è nota come 'equazione di Michaelis e Menten', che mette in relazione la velocità iniziale della reazione con la concentrazione di substrato attraverso due costanti chiamate Vmax e KM, che sono dette le 'costanti cinetiche degli enzimi':
Questa equazione descrive bene la cinetica enzimatica. Infatti, quando la concentrazione di substrato è bassa KM+[S]≈KM per cui la velocità di reazione è lineare con l'aumento di substrato, v=(Vmax/KM)[S].
Quando invece il substrato è presente in concentrazioni saturanti KM+[S]≈[S] per cui v=Vmax, cioè la velocità della reazione è quella massima e non dipende più dalla concentrazione di substrato. Inoltre, la velocità massima è direttamente correlata alla concentrazione di enzima usato dalla relazione Vmax=kcat[E]; questa relazione introduce la costante kcat, chiamata 'numero di turnover', che è uguale alla Vmax quando la [E] è unitaria. La kcat rappresenta il numero massimo di molecole di substrato che vengono convertite in prodotto da una molecola di enzima per unità di tempo. Per esempio, il numero di turnover per un gran numero di enzimi è compreso tra 1 e 104 per secondo, il che significa che ciascuna molecola di enzima trasforma da 1 a 10.000 molecole di substrato al secondo.
La KM, o 'costante di Michaelis', rappresenta la concentrazione di substrato a cui l'enzima mostra la metà della velocità massima (fig. 3). Questa è una costante caratteristica dell'enzima, indipendente dalla sua concentrazione e, tipicamente, è compresa tra 10−2 e 10−6 M. Essa è utile per stabilire l'affinità dell'enzima per diversi substrati: quanto più bassa è la KM per un certo substrato tanto più elevata è l'affinità dell'enzima per quel substrato. Come si vede dalla fig. 3, la KM non varia con la concentrazione di enzima mentre la Vmax dipende dalla concentrazione dell'enzima presente. Questa caratteristica permette il dosaggio quantitativo dell'attività enzimatica: per un certo enzima, a una concentrazione saturante di substrato (generalmente valori di 10 volte superiori alla KM per quel substrato) la determinazione della Vmax ci permette di ricavare la quantità di enzima presente in un campione.
L'importanza delle costanti cinetiche sta nel fatto di permetterci di confrontare tra loro le proprietà di enzimi diversi indipendentemente dalla natura del substrato o dell'organismo da cui vengono estratti. È importante sottolineare che questa trattazione semplice della cinetica enzimatica è la base per trattazioni più complesse come quelle che riguardano il comportamento degli enzimi in presenza di inibitori, o di enzimi che mostrano un comportamento cinetico più complesso: gli enzimi 'allosterici'.
Inibizione enzimatica
Gli inibitori degli enzimi sono piccole molecole che, legandosi all'enzima, ne riducono l'attività. Gli inibitori possono legarsi all'enzima in modo reversibile o irreversibile. Nel primo caso essi possono venire allontanati (per es., per dialisi) mentre nel secondo generalmente si legano covalentemente a residui essenziali del sito attivo e non possono essere allontanati semplicemente. L'inibizione reversibile viene studiata con i metodi cinetici descritti prima, in quanto l'enzima va incontro a un equilibrio con l'inibitore così come avviene con il substrato. Quando l'inibitore è strutturalmente simile al substrato e si lega al sito attivo dell'enzima libero si parla di 'inibizione competitiva'. In questo caso, l'inibitore compete con il substrato per il sito attivo rendendo la catalisi improduttiva. In altri tipi di inibizione reversibile l'inibitore si lega al complesso ES ('inibizione acompetitiva' o 'incompetitiva'), oppure sia all'enzima libero che al complesso ES ('inibizione non competitiva'). In alcuni enzimi si assiste alla 'inibizione da eccesso di substrato' caratterizzata da una diminuzione della Vmax a elevate concentrazioni di substrato.
In ogni caso l'inibizione può essere riportata alla semplice equazione:
E + I = EI
per cui
Ki = [E][I]/[EI]
dove Ki è la costante di inibizione. Quando tutto l'enzima è legato all'inibitore, cioè [E]=[EI], allora Ki=[I], da cui si deduce che Ki rappresenta la concentrazione che inibisce l'enzima al 50%. Questo metodo semplice ci permette di paragonare l'efficacia della inibizione da parte di vari composti. Quanto più piccolo è il Ki tanto più è efficace l'inibitore.
L'inibizione irreversibile non può essere trattata con i metodi cinetici della velocità iniziale perché non si crea un equilibrio tra enzima e inibitore, ma l'inibizione avviene in modo progressivo. Gli inibitori irreversibili vengono spesso utilizzati per identificare la natura degli amminoacidi presenti nel sito attivo. Per esempio, alcuni agenti alchilanti come lo iodoacetato si legano specificamente all'amminoacido cisteina o il di-isopropil fosfofluoridrato si lega irreversibilmente ai residui di serina presenti nel sito attivo. In alcuni casi gli inibitori non sono piccole molecole organiche, ma delle piccole proteine. Questo è il caso degli inibitori delle proteasi che si legano al sito attivo dell'enzima limitandone l'attività per motivi fisiologici e metabolici. Gli enzimi sono coinvolti nel metabolismo della cellula e alcune loro caratteristiche (pH ottimale, KM per un determinato substrato, sensibilità all'idrolisi delle proteasi responsabili del turnover cellulare, ecc.) si sono evolute in modo tale da rendere ottimale il loro funzionamento concertato con le attività cellulari. Gli inibitori di specifici enzimi hanno un'importanza fondamentale in medicina e nelle terapie e costituiscono la base molecolare dell'azione di molti farmaci come antibiotici, antinfiammatori, chemioterapici, anti-HIV, ecc.
Regolazione dell'attività degli enzimied enzimi allosterici
Negli organismi viventi molte reazioni avvengono simultaneamente e la loro integrazione armonica, attuata attraverso la regolazione o il controllo degli enzimi che le catalizzano, è estremamente importante. Infatti, anche gli enzimi, come tutte le proteine cellulari, sono continuamente sintetizzati e degradati, cioè hanno un turnover che è indispensabile affinchè la cellula si possa adattare a nuove esigenze e a nuovi ambienti.
La regolazione dell'attività degli enzimi avviene essenzialmente in due modi: (a) variando la quantità di un enzima, regolando la sua sintesi e degradazione; (b) modificando l'attività dell'enzima stesso. Il secondo modo include la disponibilità di substrato o di cofattore, l'inibizione da prodotto, modifiche covalenti e cambiamenti dell'attività a opera di ligandi. Quest'ultimo caso riveste particolare interesse negli enzimi allosterici e permette di regolare una via metabolica attraverso la cosiddetta inibizione da feedback. Essa riguarda la regolazione di una via metabolica a cui partecipano vari enzimi mediante l'inibizione del primo enzima da parte del prodotto finale. Tale meccanismo fa in modo che non si accumulino prodotti intermedi e che si sintetizzi il prodotto finale nella quantità richiesta.
Il nome di enzimi allosterici è dovuto al fatto che piccole molecole, denominate effettori o modulatori, molto differenti strutturalmente dal substrato, si legano reversibilmente a un sito diverso dal sito attivo (allosterico=altro sito) determinando un cambiamento dell'attività dell'enzima. Si può osservare una inibizione dell'attività dell'enzima (modulazione negativa), o un'attivazione (modulazione positiva).
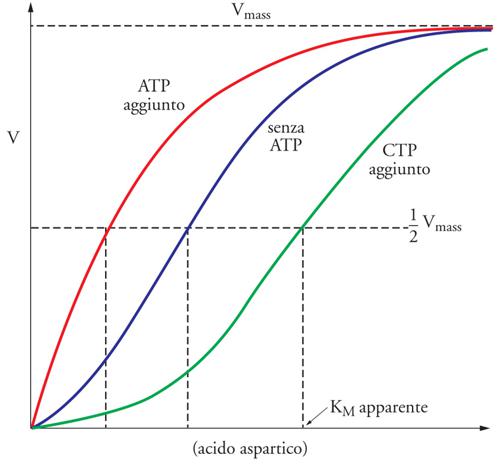
Gli enzimi allosterici sono molto spesso multimerici, cioè costituiti da diverse subunità, e, in genere, non seguono un comportamento cinetico riconducibile alla trattazione classica di Michaelis e Menten. Infatti, molti enzimi allosterici mostrano una curva sigmoide nel grafico della velocità iniziale della reazione catalizzata in funzione della concentrazione di substrato (fig. 4). Questa curva sigmoide indica che il legame di una molecola di substrato in un sito dell'enzima favorisce il legame delle successive molecole negli altri siti. In questo caso si parla di 'cooperatività positiva' tra i siti attivi degli enzimi. Va sottolineato che non tutti gli enzimi allosterici hanno un comportamento cooperativo e che la cooperatività può essere anche negativa. Un classico esempio di enzima allosterico è l'aspartato transcarbamilasi (ATCasi), il cui substrato è l'acido aspartico, l'ATP è il modulatore positivo e la citidina trifosfato (CTP) il modulatore negativo (fig. 4). Come si vede, l'aggiunta del modulatore positivo riduce la KM apparente, mentre il modulatore negativo la aumenta. Questo dimostra i vantaggi dell'allosteria: a concentrazioni di substrato non saturante, come quelle che si verificano nella cellula, l'ATCasi mostra la Vmax più elevata in presenza del modulatore positivo (fig. 4).
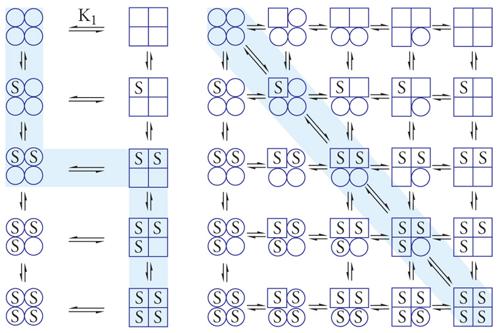
Il meccanismo molecolare secondo il quale gli enzimi allosterici seguono un comportamento cooperativo presenta molte analogie con il legame dell'emoglobina all'ossigeno e fu studiato in maniera dettagliata da J.L. Monod, J. Wyman e J.P. Changeaux (1965) e da Koshland, G. Nemethy e D. Filmer (1966). Questi due gruppi proposero due diverse spiegazioni dell'andamento sigmoide tra concentrazione di substrato e velocità della reazione. Entrambi erano concordi nel ritenere che le singole subunità di un enzima allosterico potessero avere due sole conformazioni: una a bassa affinità e una ad alta affinità (rispettivamente il cerchio e il quadrato nella fig. 5). Secondo Monod, Wyman e Changeaux il legame della prima molecola di substrato aumenta la tendenza delle altre subunità a passare nella conformazione ad alta affinità secondo un meccanismo 'tutto o niente' per cui tutte le subunità si vengono a trovare in una delle due forme. Questo è stato definito il 'modello simmetrico'. Invece, secondo Koshland, Nemethy e Filmer, le subunità dell'enzima allosterico possono subire cambiamenti conformazionali individuali, immaginando, quindi, che le forme a bassa e ad alta affinità possano coesistere nella molecola; per questo fu definito 'modello sequenziale'. Il comportamento cinetico degli enzimi allosterici è molto complesso e richiede una trattazione particolare; inoltre, non è possibile escludere a priori che non esista un unico modello valido per tutti gli enzimi allosterici.
Determinazione dell'attività enzimatica
La prima fase del lavoro dell'enzimologo, consiste nel predisporre un metodo per valutare le capacità catalitiche dell'enzima e poter applicare le regole della catalisi enzimatica. Poiché un enzima trasforma un substrato in un prodotto, si deve predisporre un metodo per determinare quantitativamente il prodotto formatosi in certe condizioni nell'unità di tempo con una determinata quantità di enzima. Esistono diverse tecniche che possono determinare l'attività degli enzimi; esse sfruttano le proprietà chimiche (metodi elettrochimici o per radioattività) o ottiche (spettrofotometria o fluorimetria) del prodotto.
Da queste tecniche sono scaturite alcune importanti definizioni: (a) Unità internazionale di enzima (UIE) che indica la quantità di enzima che trasforma una micromole di substrato in prodotto in un minuto a 25°C nelle condizioni ottimali di saggio (pH, forza ionica, tipo di tampone, ecc); (b) attività specifica di un enzima, cioè le unità di enzima per milligrammo di proteine. Queste due grandezze sono di notevole importanza per conoscere il grado di purezza dell'enzima, per confrontare l'efficienza nello svolgere la catalisi su uno stesso substrato da parte di enzimi estratti da diverse fonti naturali e, soprattutto, per dosare quantitativamente l'attività dell'enzima, per esempio, in fluidi biologici. Ciò è di fondamentale importanza nel caso degli enzimi di interesse medico e diagnostico.
Applicazioni degli enzimi
La capacità degli enzimi di catalizzare le reazioni chimiche con grande efficienza e specificità ha da sempre attratto l'uomo per scopi applicativi. Per esempio, la coagulazione del latte per ottenere il formaggio è prodotta dall'enzima rennina, o chimosina, prodotta dagli stomaci degli agnelli o dei vitelli. Nel tempo, con l'acquisizione delle conoscenze relative alla natura e alle caratteristiche di enzimi sempre nuovi, le loro applicazioni si sono sviluppate enormemente diventando una delle basi della moderna biotecnologia, la scienza che utilizza sostanze di origine biologica per migliorare la qualità della vita dell'uomo con un maggiore rispetto verso l'ambiente. Oggi molti enzimi trovano largo impiego in prodotti di uso quotidiano: proteasi, amilasi, lipasi e cellulasi sono tra i costituenti più importanti dei detergenti di uso domestico e permettono di eliminare macchie di proteine, grassi e amidi e, insieme, di rinnovare il colore dei tessuti. Occorre notare il notevole risparmio energetico ottenuto con l'utilizzo degli enzimi nella detergenza, in quanto questo permette il lavaggio a temperature molto più basse con un processo più ecocompatibile.
Gli enzimi sono impiegati anche nelle industrie farmaceutiche, chimiche, alimentari, tessili e cosmetiche, anche se spesso la loro intrinseca fragilità strutturale ne limita le applicazioni a causa anche delle condizioni di utilizzo. Un notevole passo avanti nell'utilizzazione industriale degli enzimi è stato lo sviluppo di tecniche di immobilizzazione degli enzimi su supporti solidi. L'immobilizzazione permette l'uso in continuo e il riutilizzo di essi senza difficili processi di recupero.
Negli ultimi anni una delle nuove frontiere dell'enzimologia è stato lo studio di enzimi isolati da microrganismi che vivono in condizioni estreme di temperatura, pH, salinità e pressione. Infatti, organismi estremofili che vivono a temperature di oltre 100 °C o a 0 °C contengono enzimi adattati a queste condizioni di vita e con proprietà molto interessanti. Lo studio del rapporto tra struttura e funzione di questi enzimi ha dato la possibilità di chiarire alcuni dei meccanismi molecolari che sono alla base della stabilità delle proteine e ha permesso di stabilizzare enzimi già noti con tecniche di ingegneria proteica.
L'utilità degli enzimi per la salute dell'uomo è particolarmente evidente in campo sia diagnostico che medico. Prima degli anni Quaranta del XX sec. meno del 5% delle analisi svolte nei laboratori clinici riguardava il dosaggio di enzimi; oggi questo valore supera il 25% e riguarda più di venti enzimi diversi. L'azotemia, la glicemia, il colesterolo, i trigliceridi, ecc., sono tutti determinati mediante l'utilizzo di enzimi che permettono di unire semplicità e specificità. La ragione di questo incremento va ricercata negli studi svolti a livello molecolare ‒ che hanno fatto comprendere il ruolo metabolico degli enzimi ‒ e nell'acquisizione di metodi sofisticati e precisi per il saggio delle attività enzimatiche. Il dosaggio di specifiche attività enzimatiche in liquidi organici facilmente accessibili è di importanza fondamentale per la diagnosi di numerose malattie: per esempio, la presenza di valori alterati delle transaminasi nel sangue è indice di diversi tipi di malattie epatiche. D'altra parte il saggio quantitativo di particolari attività enzimatiche è di grande importanza anche per seguire l'andamento di terapie, il recupero dopo gli interventi chirurgici e valutare eventuali rigetti nei trapianti. Un caso molto noto è quello degli enzimi cardiaci creatina-chinasi, aspartico amminotrasferasi e lattato deidrogenasi, il cui dosaggio permette di stabilire la gravità di un infarto e di esprimere una prognosi.
Enzimi come target nelle terapie
Il trattamento di infezioni di tipo batterico, fungino o virale si basa su sostanze che agiscono selettivamente su una via metabolica dell'agente infettante senza danneggiare il metabolismo dell'ospite. Nel passato si selezionavano, più o meno a caso, gruppi di sostanze naturali e sintetiche; ora si sa che queste molecole colpiscono enzimi specifici: un esempio è rappresentato dall'antibiotico e antivirale rifampicina, che è un inibitore specifico dell'enzima RNA-polimerasi. Questo farmaco è stato usato con successo per il trattamento della tubercolosi, in quanto colpisce specificamente l'enzima dei micobatteri impedendo la sintesi dell'RNA messaggero e non ha effetto sul corrispondente enzima umano. Altri farmaci diretti all'inibizione di enzimi specifici comprendono quelli per il trattamento dell'HIV che hanno il ruolo di inibire una proteasi del virus ‒ essenziale per la maturazione delle particelle virali ‒ e non una proteasi umana, la renina, che ha un ruolo essenziale per regolare la pressione sanguigna. Nelle trasformazioni tumorali si cerca di inibire la sintesi del DNA delle cellule cancerose, che è molto più rapida di quelle normali, inibendo con ametopterina o metotrexato la diidrofolato-reduttasi, un enzima indispensabile per la sintesi dei nucleotidi. La ricerca attuale con le nuove tecnologie molecolari intende identificare le differenze tra cellule malate e cellule sane da utilizzare come obiettivi per nuovi farmaci.
Un approccio alternativo consiste nell'utilizzare gli enzimi stessi come farmaci: la terapia enzimatica. Attualmente essa utilizza gli enzimi streptochinasi o urochinasi per la rimozione dei coaguli sanguigni ed enzimi proteolitici per insufficenze pancreatiche e per la degradazione di tessuti necrotici. Un approccio innovativo delle terapie enzimatiche riguarda il trattamento di alcuni tumori; in questo caso l'enzima viene somministrato al paziente accoppiato a un anticorpo specifico per il tumore bersaglio e al farmaco antitumorale in forma inattiva. L'anticorpo veicola il sistema sul bersaglio dove l'enzima, selezionato appositamente, rende il farmaco attivo; in questo modo il farmaco, che spesso ha effetti tossici anche sulle cellule sane, può svolgere la sua azione in modo localizzato ed efficiente. Tra gli esempi di queste terapie c'è l'attivazione del metotrexato da parte di amminopeptidasi o carbossipeptidasi.
Lo sviluppo tecnologico legato all'uso degli enzimi nei vari campi descritti è ancora ai suoi albori; l'aumento di conoscenze su questi biocatalizzatori e la biodiversità dei viventi permetterà di isolare sempre nuovi enzimi e di sviluppare applicazioni sempre più vantaggiose per la salute dell'uomo.
Bibliografia
Alberghina, Cernia 1996: Alberghina, Lilia - Cernia, Enrico, Biotecnologie e bioindustria, Torino, UTET, 1996.
Berg 2003: Berg, Jeremy M. - Tymoczko, John L. - Stryer, Lubert, Biochimica, 5. ed., Bologna, Zanichelli, 2003.
Bergmeyer 1982: Bergmeyer, Hans-Ulrich, Principi di analisi enzimatica, Padova, Piccin, 1982.
Duranti, Pagani 1998: Duranti, Marcello - Pagani, Silvia, Enzimologia: dai fondamenti alle applicazioni, Padova, Piccin, 1998.
Fersht 1989: Fersht, Alan, Struttura e meccanismi d'azione degli enzimi, Bologna, Zanichelli, 1989.
Galzigna 1996: Galzigna, Lauro, Elementi di enzimologia, 2. ed., Padova, Piccin, 1996.
Lehninger 1982: Lehninger, Albert L., Biochimica, 2. ed., Bologna, Zanichelli, 1982.
Moran 1996: Moran, Laurence A. e altri, Biochimica, a cura di Alessandro Finazzi-Agrò e Pietro Guerrieri, Milano, _McGraw-Hill, 1996.
Palmer 1991: Palmer, Trevor, Understanding enzymes, 3. ed., Chichester, Ellis Horwood, 1991.
Price, Stevens 1996: Price, Nicholas C. - Stevens, Lewis, Principi di enzimologia, 2. ed., Roma, A. Delfino, 1996.
Rawn 1990: Rawn, David J., Biochimica, a cura di Alessandro Finazzi-Agrò, Milano, McGraw-Hill, 1990.
Siliprandi, Tettamanti 1998: Siliprandi, Noris - Tettamanti, Guido, Biochimica medica, 2. ed., Padova, Piccin, 1998.
Simone, Quagliariello 1985: Simone, Simone - Quagliariello, Ernesto, Fondamenti di enzimologia, Padova, Piccin, 1985.