Secondi messaggeri
Secondi messaggeri
In senso stretto la locuzione 'secondo messaggero' si applica a piccole molecole organiche (ma anche ioni inorganici) che in moltissimi tipi cellulari si formano (o si liberano) in seguito a stimolazione e sono capaci di controllare una miriade di processi cellulari. Il concetto di secondo messaggero compare per la prima volta nella letteratura scientifica nel 1957, grazie al lavoro di Earl W. Sutherland. Studiando l'azione dell'adrenalina sulla degradazione del glicogeno a glucosio (glicogenolisi) nel fegato di cane, egli comprese che gli ormoni, i 'primi messaggeri', sono in grado di generare a livello di omogenati di fegato o di preparati di membrane cellulari, ma non di frazioni citosoliche, un fattore solubile (secondo messaggero) in grado di attivare la fosforilasi, l'enzima chiave della glicogenolisi. Tale fattore, grazie alla sua elevata stabilità al caldo e all'acidità, fu rapidamente isolato e identificato nel 1959 come l'adenosin-monofosfato ciclico 3′,5′ (cAMP). Superato lo scetticismo iniziale e grazie alla rapida messa a punto di metodi per il dosaggio del cAMP in frazioni cellulari (tramite saggio enzimatico e traccianti radioattivi), il periodo compreso tra gli anni Settanta e Novanta del Novecento fu segnato dalla caratterizzazione di un numero elevato di processi biologici controllati da cAMP e dall'individuazione sia di nuovi secondi messaggeri ‒ quali il guanosin-monofosfato ciclico 3′,5′ (cGMP), lo ione calcio (Ca2+), l'inositolo 1,4,5-trifosfato (IP3) e il diacilglicerolo (DAG) ‒ sia delle vie enzimatiche che portano alla loro formazione (o liberazione) e degradazione (o rimozione).
In quegli anni si fece strada un nuovo settore della ricerca in campo biologico e medico, che prese il nome di 'trasduzione del segnale' e che ha avuto un impatto profondo sulla ricerca farmacologica. La rilevanza di tale settore è stata chiaramente consacrata dall'assegnazione a Sutherland del Premio Nobel per la medicina o fisiologia nel 1971, e da almeno altri cinque premi Nobel assegnati, da allora a oggi, per scoperte nel campo dei nucleotidi ciclici e della trasduzione del segnale. Solo per citarne alcuni, ricordiamo quelli per le scoperte delle fosforilazioni reversibili delle proteine come meccanismo rapido di regolazione biologica (1992); delle proteine G per il loro ruolo nella trasduzione del segnale (1994); del cGMP e dell'ossido di azoto (NO), più impropriamente detto 'ossido nitrico', per le loro azioni sui sistemi cardiovascolare (1998) e nervoso.
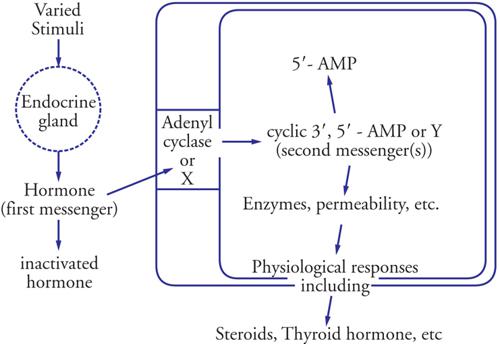
L'aspetto più intrigante della trasduzione del segnale via secondi messaggeri è l'apparente semplicità del sistema. Infatti poche molecole sembrano in grado di controllare nello stesso tipo cellulare funzioni complesse, spesso tra loro opposte, che vanno dalla regolazione del metabolismo energetico al controllo del movimento e della secrezione di ormoni e neurotrasmettitori, alla ricezione degli stimoli esterni (odori, luce, ecc.), alla formazione della memoria a breve e a lungo termine, alla divisione e morte cellulare. Gli anni più recenti hanno visto infatti uno sforzo notevole nel risolvere questa ambiguità, grazie allo sviluppo di tecniche molto sofisticate che consentono di seguire in tempo reale e a livello di singola cellula o tessuto, le variazioni dei principali secondi messaggeri, in primis il Ca2+ e, più recentemente, anche cAMP, IP3 e DAG. (Fig. 1)
Messaggeri classici
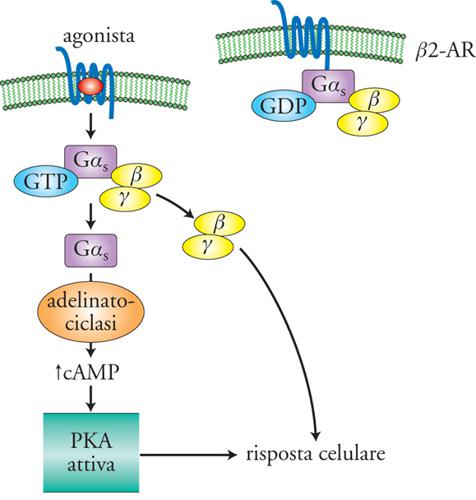
La fig. 2 mostra gli elementi base della via di trasduzione che porta al cAMP: il recettore del segnale extracellulare (agonista) è una proteina a 7 domini transmembrana (7TM); l'effettore, localizzato sulla membrana plasmatica, è l'enzima adenilato-ciclasi che forma sul lato citosolico cAMP da ATP. È poi presente un complesso, detto 'proteina G', formato da 3 subunità proteiche (GαS, β e γ), che accoppia il recettore all'effettore, da cui il nome di 'G protein-coupled receptors' (GPCR) più spesso utilizzato per i recettori a 7TM. I livelli basali di cAMP sono generalmente piuttosto bassi (∼ 0,1 μM) e in seguito a stimolazione del recettore, nel caso specifico il recettore adrenergico di tipo β2 (β2-AR), si assiste a un brusco (msec÷sec) e ampio (fino a ca. 1÷10 μM) aumento del cAMP. L'attivazione del recettore favorisce infatti il legame della subunità GαS con il GTP e la dissociazione del complesso βγ; GαS attiva l'adenilato-ciclasi per tutto il tempo che mantiene legato il GTP. Il segnale viene poi spento grazie all'idrolisi del GTP a GDP da parte della stessa subunità GαS, che si associa nuovamente al complesso βγ. I livelli di cAMP ritornano ai livelli iniziali grazie all'idrolisi del cAMP a opera di enzimi detti 'fosfodiesterasi' (PDE).
Il cAMP può agire sia direttamente, come attivatore specifico di canali ionici sulla membrana plasmatica, i cosiddetti 'Cyclic nucleotide-gated channels' (canali CNG), particolarmente rilevanti nella ricezione e trasmissione degli stimoli nel sistema nervoso, sia indirettamente, attraverso l'attivazione di proteine-chinasi A (PKA), che catalizzano il trasferimento di fosfato dall'ATP su residui di serina e treonina di altre proteine, attivandole o inibendole. Si tratta di complessi proteici tetramerici, formati da 2 subunità catalitiche e 2 subunità regolatorie. Il legame cooperativo di 4 molecole di cAMP con le subunità regolatorie determina il distacco e l'attivazione delle subunità catalitiche. La PKA così attivata può fosforilare diversi substrati, tra cui anche molti canali ionici. Nel cuore, la fosforilazione dei canali del Ca2+ attivati dal voltaggio (VOCC, Voltage operated calcium channels) comporta aumento della frequenza e della forza di contrazione, una risposta tipica degli ormoni simpatico-mimetici. Ricordiamo poi il canale del cloro, associato alla fibrosi cistica (CFTR, Cystic fibrosis transmembrane conductance regulator): l'attivazione di questo canale comporta uscita di cloro dalla cellula con conseguente richiamo di sodio e acqua, che favorisce la formazione di una secrezione più abbondante e fluida. Nella patologia sopra indicata è il canale stesso a essere difettoso, mentre un'alterazione della modulazione del canale si osserva nell'intossicazione con la tossina del vibrione del colera. L'effetto della tossina è quello di un'attivazione irreversibile della proteina GαS, cui segue una produzione eccessiva di cAMP. Il canale CFTR resta così permanentemente attivo e, a livello dei villi intestinali, l'efflusso di cloro che ne segue porta a perdita di acqua (diarrea acquosa) e disidratazione.
Va poi ricordato come, a livello neuronale, diversi neurotrasmettitori, favoriscono la chiusura, via PKA, di canali del potassio. La depolarizzazione che ne segue comporta il prolungamento del potenziale di azione presinaptico, un maggior ingresso di Ca2+ e quindi il potenziamento della neurotrasmissione. Altri substrati della PKA sono diverse proteine del citoscheletro e degli organuli intracellulari, tra cui numerose altre chinasi, in grado di controllare la motilità cellulare e la secrezione di vescicole. Infine, la subunità catalitica della PKA è in grado di attraversare i pori nucleari e attivare per fosforilazione un fattore di trascrizione (CREB, CRE binding), che si lega a sequenze specifiche di DNA indicate come 'cAMP-responsive-element' (CRE), presenti in circa un centinaio di promotori genici. CREB fosforilato, legandosi al DNA, recluta una proteina che interagisce con la RNA-polimerasi II, attivando la trascrizione genica. Oltre ai canali attivati da cAMP e PKA, negli ultimi anni sono state identificate altre proteine capaci di legare il cAMP e di attivare specifiche vie di segnale. In particolare le proteine EPAC, che funzionano da regolatrici di proteine G monomeriche.
Gli effetti riportati per il cAMP variano quindi sia nel tempo sia nello spazio. Infatti l'attivazione diretta di un canale ionico a livello della membrana plasmatica richiede pochi micro-millisecondi, mentre la modulazione dell'attività di proteine citosoliche richiede secondi o minuti; ore o giorni sono invece richiesti per la formazione e l'accumulo di nuove proteine, conseguenti agli effetti del cAMP sulla trascrizione genica. La terminazione del segnale via cAMP è costantemente sotto il controllo delle fosfodiesterasi (PDE), enzimi che catalizzano l'idrolisi dei nucleotidi ciclici, altamente regolati nella cellula e sensibili all'azione inibitoria di composti che attraversano la membrana, come le metilxantine (tra le più note ricordiamo la caffeina e la teofillina). Nelle cellule sono presenti anche altri recettori adrenergici (tipo α) accoppiati a proteine Gαi in grado di inibire, anziché attivare, l'adenilato-ciclasi, che contribuiscono quindi ad abbassare livelli tonici elevati di cAMP. Il complesso βγ ha anch'esso un ruolo come trasduttore del segnale, in quanto a livello della membrana plasmatica funziona sia come inibitore della Gαs, sia come modulatore di canali ionici e di altre vie di segnalazione. L'esempio classico è l'attivazione, che si instaura in tempi rapidissimi (μsec), dei canali del potassio sensibili all'acetilcolina presenti nelle cellule del pacemaker cardiaco. Agendo sui recettori muscarinici, via βγ, il neurotrasmettitore (acetilcolina), rilasciato dal nervo vago, attiva rapidamente i canali del potassio che controllano il potenziale di riposo, rendendo le cellule autoritmiche del cuore meno eccitabili, e modulando, battito per battito, la frequenza cardiaca.
Nel 1963 venne individuato anche il cGMP, la cui presenza nelle urine insieme al cAMP fu subito correlata allo stato ormonale dell'animale. Il suo ruolo come secondo messaggero venne tuttavia scoperto molto più tardi (1975) ed è legato alla comprensione dei meccanismi che portano alla trasduzione dei segnali luminosi nella retina dei Mammiferi. In questo caso, a essere stimolato dalla luce è un recettore a 7TM (rodopsina) che accoppia una proteina G (o Gαt, transducin) all'attivazione di una PDE specifica. Il cGMP mantiene aperto un canale cationico responsabile della depolarizzazione del fotorecettore al buio; la sua idrolisi, attivata dalla luce attraverso una cascata di eventi che coinvolge la rodopsina, la Gαt e la PDE associata, riporta il potenziale di membrana ai valori di riposo. Questa risposta è un ottimo esempio di amplificazione del segnale via proteine G, in quanto un singolo fotone di luce porta alla chiusura di centinaia di canali CNG e a circa 1 mV di iperpolarizzazione della membrana del fotorecettore.
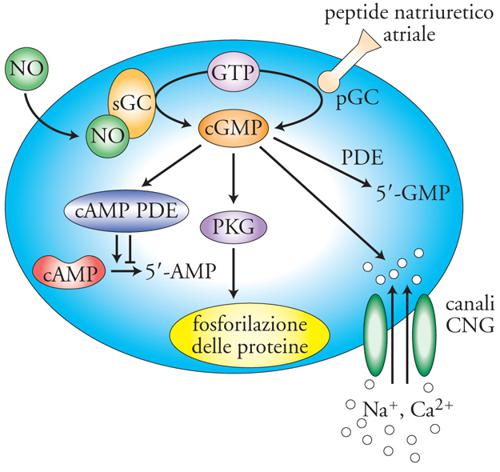
La centralità del cGMP nella trasduzione del segnale arriva tuttavia dalle scoperte inerenti la contrazione del muscolo liscio. Tra gli anni Ottanta e Novanta furono individuati gli enzimi che portano alla sintesi del cGMP, in particolare, la guanilato-ciclasi solubile (sGC), sensibile all'azione del fattore rilasciante prodotto dall'endotelio (EDRF), più tardi identificato come il gas ossido di azoto (NO), e la guanilato-ciclasi di membrana (pGC), sensibile all'azione di un peptide prodotto dal cuore o peptide natriuretico atriale (ANP). Tra le proteine che presentano siti allosterici per il cGMP vi sono, oltre ai canali cationici CNG, anche proteine-chinasi G (PKG) e fattori che, controllando lo scambio tra GTP e GDP, modulano l'attività delle proteine G (fig. 3). Nel muscolo liscio l'attivazione della PKG favorisce il rilassamento della fibra, opponendosi all'azione contrattile del Ca2+. L'azione più nota al pubblico sotto controllo del cGMP è quella esercitata dal viagra. Questo farmaco è un inibitore selettivo della PDE5, un'isoforma delle PDE particolarmente espressa nel tessuto erettile; l'inibizione di questo enzima prolunga e aumenta gli effetti di NO e cGMP nel muscolo liscio dei corpi cavernosi, favorendo l'afflusso di sangue e quindi l'erezione.
Il fatto che il Ca2+ fosse importante nel controllo della contrazione muscolare era noto da molto tempo, ma l'idea che potesse anche funzionare come secondo messaggero in altri tipi cellulari si sviluppò solo intorno agli anni Settanta quando fu dimostrato il suo ruolo nella secrezione. Per alcuni anni lo studio del ruolo del Ca2+ come secondo messaggero fu concentrato soprattutto sui fenomeni della contrazione muscolare e della neurosecrezione, e in particolare sui meccanismi che regolano i canali della membrana plasmatica attraverso cui il Ca2+ può diffondere nel citoplasma. Una svolta importante in questo campo si verificò grazie agli studi sull'azione della serotonina nella secrezione salivare degli Insetti. In quest'ultimo modello, gli studi condotti da Michael J. Berridge dimostrarono che il neurotrasmettitore stimola il movimento transepiteliale dell'acqua secondo gradiente osmotico, favorendo l'uscita di potassio e cloro dalla cellula. Due recettori diversi sono responsabili del fenomeno: il primo stimola il trasporto del potassio, attraverso la via già nota del cAMP, il secondo stimola l'efflusso di cloro, attraverso un canale attivato dal Ca2+. L'aspetto più sorprendente di questo studio era che la principale sorgente di Ca2+ fosse stata individuata all'interno, e non all'esterno, della cellula, nei cosiddetti 'depositi intracellulari'. Il legame tra attivazione del recettore e aumenti di Ca2+ citoplasmatico restò tuttavia misterioso per molto tempo, finché non emerse chiaramente la relazione stretta tra aumenti di Ca2+ e idrolisi di un particolare lipide della membrana plasmatica, il fosfatidilinositolo (PI).
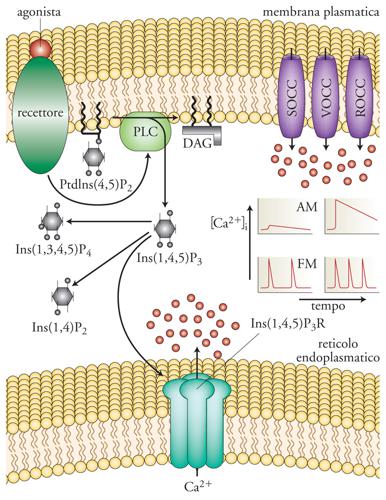
L'azione di agonisti sull'idrolisi di questi lipidi era nota già dal 1953, ma soltanto più tardi, grazie al lavoro di Robert H. Michell, si intuì che solo i recettori che usano come secondo messaggero il Ca2+, e non il cAMP, sono anche in grado di stimolare la formazione di inositolo 1-fosfato (IP1), una piccola molecola idrofilica, diffusibile, potenzialmente in grado di veicolare il messaggio dalla membrana ai depositi del Ca2+ intracellulare. Così come, nei primi studi sul cAMP, un aiuto venne dagli inibitori degli enzimi che degradano il messaggero (le metilxantine), anche in questo caso, un contributo venne dalla scoperta (o meglio riscoperta) del litio che è un potente inibitore della degradazione dell'IP1 a inositolo. L'impiego del litio permise di studiare il turnover del PI, misurando l'accumulo dei precursori dell'IP1 in parallelo con i flussi di Ca2+ durante la stimolazione con agonisti, marcando le cellule con inositolo e Ca2+ radioattivi. Inoltre, il confronto tra le cinetiche di attivazione dei canali del cloro da parte del Ca2+ e di produzione dei fosfoinositoli portò a identificare nell'inositolo 1,4,5-trifosfato (IP3), e non nell'IP1, il mediatore del rilascio di Ca2+ dai depositi intracellulari, attraverso canali specifici, oggi definiti 'recettori dell'IP3' (IP3R). Tali studi permisero di concludere che il precursore dell'IP3 in membrana era più propriamente il fosfatidil-inositolo 4,5-difosfato (PIP2) e non il PI, come proposto nei primi modelli (fig. 4). L'idrolisi del PIP2 è sotto controllo delle fosfolipasi C (PLC), enzimi che possono essere attivati o da proteine G, attraverso recettori a 7TM, o in seguito alla loro fosforilazione promossa da recettori dei fattori di crescita con attività chinasica specifica per residui di tirosina, i cosiddetti 'Receptor tyrosin-kinase' (RTK).
L'incoronazione dell'IP3 come secondo messaggero avvenne nel 1983, quando fu possibile dimostrare direttamente che l'IP3 induceva il rilascio di Ca2+ dai depositi intracellulari in maniera specifica e dose-dipendente. Negli stessi anni si comprese anche che l'idrolisi del PIP2, oltre a liberare IP3, produce anche diacilglicerolo (DAG), una molecola lipofilica che rimane ancorata alla membrana cellulare e funziona da attivatore selettivo di una famiglia di chinasi che fosforilano le proteine in serina e treonina. Queste proteine-chinasi possono essere anche attivate dal solo Ca2+ (a concentrazioni però soprafisiologiche), da cui il nome di PKC (Protein kinase Ca2+ activated). Ci sono voluti quindi trent'anni per capire che la stimolazione del turnover del PI da parte di segnali extracellulari porta alla formazione di diversi secondi messaggeri, quali il DAG, l'IP3 (e i suoi derivati) e il Ca2+. Di tutti i secondi messaggeri, il Ca2+ è sicuramente il più versatile, in quanto i suoi effetti si esplicano in molteplici modi. Dall'attivazione diretta di canali ionici ed enzimi, alla loro modulazione anche attraverso il legame con effettori cellulari (calcium-sensors), di cui la calmodulina è il rappresentante più noto. Il complesso calcio-calmodulina interagisce con altri substrati, come le chinasi calcio-calmodulina dipendenti (CaM-chinasi). Sia il DAG che l'IP3 sono poi in grado di modulare l'attività di diversi canali nella membrana plasmatica.
La comprensione dei meccanismi attraverso i quali è possibile mantenere un elevato livello di specificità di risposta, pur utilizzando percorsi di trasduzione del segnale che si presentano altamente conservati dai lieviti ai Mammiferi e molto simili tra loro, passando, per esempio, da una cellula endoteliale a una nervosa, rappresenta una sfida e un campo di indagine in continua evoluzione. Infatti non solo stimoli extracellulari diversi utilizzano lo stesso secondo messaggero in cellule differenti, ma sorprendentemente, nella stessa cellula, stimoli con azione differente utilizzano lo stesso secondo messaggero. Notevoli passi avanti nella soluzione di questa apparente contraddizione sono stati fatti grazie allo sviluppo delle tecniche di biologia molecolare e cellulare, da una parte, e delle tecniche di indagine microscopica dall'altra. Le prime hanno permesso di apprezzare l'enorme complessità presente a livello molecolare anche all'interno di una singola via di trasduzione del segnale, le seconde hanno permesso di visualizzare la complessità spaziale e temporale dei livelli intracellulari dei secondi messaggeri.
I seguenti fattori possono infatti contribuire a garantire la specificità: la molteplicità dei componenti molecolari coinvolti, la presenza di isoforme specifiche per il tessuto e la fase di sviluppo, la presenza di molteplici livelli di regolazione e interazione (cross-talk) tra secondi messaggeri, la possibilità di compartimentazione dei segnali. Per esempio, si conoscono più di 800 recettori a 7TM, almeno 20 subunità α, 5 β, 16 γ e 10 isoforme di adenilato-ciclasi. L'attività dei recettori a 7TM è poi sotto controllo inibitorio delle stesse PKA e PKC, con controllo anche di tipo eterologo (cross-desensitizzazione). Sono poi presenti chinasi che inibiscono specificamente solo i recettori attivati (G-protein receptor kinases, GRK), e proteine che stimolano l'attività GTPasica (GAP), favorendo lo spegnimento del segnale. Si sa inoltre che recettori a 7TM formano, tramite proteine adattatrici, complessi sovramolecolari che avvicinano nello stesso microambiente tutti i componenti della via di trasduzione, compresi i depositi del Ca2+; in questo modo i secondi messaggeri, come DAG e Ca2+, prodotti localmente in grande quantità, possono attivare solo un numero limitato di effettori. Occorre notare poi che molte risposte cellulari sono il risultato della convergenza di più segnali. Per esempio, nel muscolo scheletrico l'attivazione della glicogenolisi è massima durante la contrazione, in quanto la fosforilasi-chinasi è doppiamente regolata dallo stimolo adrenergico (cAMP) e da quello contrattile (Ca2+) via, rispettivamente, PKA e CaM-chinasi. Infine i recettori a 7TM possono, sia direttamente sia attraverso adattatori specifici, e in maniera indipendente dalle proteine G, reclutare e attivare tirosina-chinasi nel citosol, agganciandosi per esempio alla cascata delle Mitogen-activated protein kinases (MAPK). La formazione di reti tra segnali diversi aggiunge un ulteriore livello di complessità e specificità.
Misure in vivo
Se il cAMP è stato il messaggero inizialmente più studiato, il Ca2+, che è giunto poco più tardi allo stesso traguardo, è stato il primo segnale di cui si è potuto seguire le dinamiche in tempo reale in cellule intatte, inizialmente solo a livello di popolazioni cellulari, poi anche a livello di singola cellula e infine di compartimenti subcellulari. La misura dei livelli di cAMP in cellule vive è invece una conquista molto più recente. La produzione per sintesi chimica di indicatori fluorescenti del Ca2+ nei primi anni Ottanta dello scorso secolo e lo sviluppo della microscopia a fluorescenza e confocale hanno consentito di quantificare le variazione del Ca2+ citosolico, di capire la complessità e varietà del segnale a livello di singola cellula, sia in colture cellulari sia in fettine di tessuto o in organi interi. Altri approcci si sono basati sulla luminescenza della fotoproteina equorina con la possibilità, inizialmente, di iniettarla solo in grosse cellule e, successivamente, con le tecniche di biologia molecolare, di farla produrre alle cellule stesse, indirizzandola anche a diversi organuli e compartimenti subcellulari. Attualmente l'impiego di equorine ricombinanti è limitato a popolazioni cellulari, data la bassa intensità del segnale generato dall'equorina.
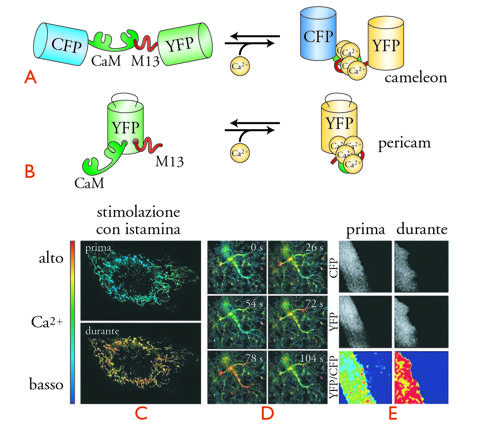
Un approccio alternativo, per lo studio della compartimentazione spaziale e temporale del segnale Ca2+ a livello di singola cellula, sfrutta le proprietà di fluorescenza di una proteina, la Green fluorescent protein (GFP), inizialmente isolata da una medusa, l'Aequorea victoria. Mediante sofisticate tecniche di ingegneria molecolare i ricercatori sono riusciti a produrre delle GFP modificate, la cui fluorescenza varia in funzione della concentrazione di Ca2+. Non solo, ma queste proteine artificiali possono essere espresse nelle cellule viventi e localizzate sia nel citoplasma sia all'interno di organuli cellulari (per es., nei mitocondri). Un'idea della struttura e dell'impiego dei biosensori molecolari del Ca2+ è suggerita nella fig. 5. Va sottolineato che i principî di funzionamento di questi sensori sono simili a quelli con cui sono stati in seguito disegnati biosensori per altri messaggeri, quali cAMP, IP3, e DAG.
In generale, l'impiego di queste tecniche ha consentito di capire che nelle cellule l'informazione dall'ambiente esterno può essere codificata sia come variazioni di ampiezza (AM) che di frequenza (FM) del segnale. La seconda modalità è la più usata in quanto, favorendo il rapporto segnale/rumore, permette di codificare intervalli di intensità molto più ampi. Già con le sonde per il Ca2+ di sintesi chimica (per es., fura-2 e indo-1) e la microscopia confocale, era stato possibile rivelare variazioni del segnale Ca2+ citoplasmatico estremamente localizzate nello spazio e nel tempo. Inoltre, si è visto che le oscillazioni non sono una caratteristica esclusiva del segnale Ca2+, ma riguardano anche altri segnali intracellulari. Da notare che oscillazioni del cAMP erano state osservate per la prima volta nel ciclo contrattile del cuore e nel rilascio ritmico di ormoni, nei primi anni Settanta del XX sec., ma il fatto di renderle visibili a livello di singola cellula è stato possibile solo grazie all'impiego di sonde fluorescenti per il cAMP.
Queste sonde non solo hanno permesso di rivelare oscillazioni di cAMP, ma hanno messo anche in evidenza che un messaggero così diffusibile può essere efficace in microdomini spaziali, grazie alla presenza di proteine adattatrici che formano complessi macromolecolari tra recettore, enzimi (AC e PDE) ed effettori. Lo sviluppo delle tecniche di imaging e di biologia molecolare ha permesso di creare sonde fluorescenti basate su proteine ricombinanti per diversi altri secondi messaggeri, come il DAG e l'IP3. Attualmente è possibile seguire variazioni di Ca2+, DAG e IP3, contemporaneamente nella stessa cellula. Date le difficoltà di calibrazione, queste sonde tuttavia danno spesso informazioni sulle variazioni relative, piuttosto che assolute, di concentrazione del messaggero. Come proteine ricombinanti, che devono essere introdotte nelle cellule per trasfezione, possono inoltre interferire con il segnale e presentare difficoltà di espressione e di localizzazione in strutture complesse quali i neuroni.
Nuovi messaggeri
Recentemente sono stati individuati diversi altri secondi messaggeri. In particolare, è emerso il ruolo chiave svolto dal PIP2 che, oltre a essere il precursore dell'IP3 e del DAG, funziona anche come segnale responsabile dell'attivazione o dell'inibizione di diversi canali ionici. Inoltre, anche il fosfatidil-inositolo 3,4,5-trifosfato (PIP3), che si forma per fosforilazione del PIP2 in risposta a stimoli extracellulari, agisce come segnale, reclutando in membrana proteine che riconoscono specificamente i fosfaditil-inositoli tramite i domini PH (Pleckstrin homology). Il PIP3 favorisce la polimerizzazione dell'actina e la riorganizzazione del citoscheletro, svolgendo un ruolo chiave nella motilità cellulare e nella chemotassi. Sia per il PIP2 che per il PIP3 esistono biosensori specifici. Negli ultimi anni, sono stati anche individuati altri secondi messaggeri in grado di mobilizzare Ca2+ dal reticolo endoplasmatico in risposta a segnali extracellulari, quali l'ADP ribosio ciclico (cADPR) e l'acido nicotinico adenin dinucleotide fosfato (NAADP), ampliando così la complessità del segnale Ca2+. Inoltre, l'ADPR, il NAD+ e lo stesso cADPR agiscono da attivatori di canali cationici. La produzione di questi secondi messaggeri può avvenire sia a livello di membrana plasmatica, da parte di un enzima multifunzionale noto come CD38, sia a livello del nucleo per azione di poli-ADPR-glicoidrolasi (PARG). Queste molecole sono state implicate nei processi di crescita e differenziamento cellulare e nei meccanismi di riparazione del DNA; a oggi non vi sono tuttavia sonde specifiche per questi messaggeri.
Bibliografia
Beavo, Brunton 2002: Beavo, Joseph - Brunton, Laurence L., Cyclic nucleotide research - still expanding after half a century, "Nature reviews. Molecular cell biology", 3, 2002, pp. 710-718.
Berridge 2003: Berridge, Michael J. - Bootman, Martin D. - Roderick, H. Llewelyn, Calcium signalling: dynamics, homeostasis and remodelling, "Nature reviews. Molecular cell biology", 4, 2003, pp. 517-529.
Berridge 2005: Berridge, Michael J., Unlocking the secrets of cell signaling, "Annual review of physiology", 67, 2005, pp. 1-21.
Cullen, Lockyer 2002: Cullen, Peter J. - Lockyer, Peter J., Integration of calcium and Ras signalling, "Nature reviews. Molecular cell biology", 3, 2002, pp. 339-348.
Lipkin 1959: Lipkin, David - Cook, William H. - Markham, Roy, Adenosine -3′, 5′- phosphoric acid: a proof of structure, "Journal of the American Chemical Society", 81, 1959, pp. 6198-6203.
Nahorski 2003: Nahorski, Stefan R. e altri, Visualizing phosphoinositide signalling in single neurons gets a green light, "Trends in neurosciences", 26, 2003, pp. 444-452.
Pierce 2002: Pierce, Kristen L. - Premont, Richard T. - Lefkowitz, Robert J., Seven-transmembrane receptors, "Nature reviews. Molecular cell biology", 3, 2002, pp. 639-650.
Rudolf 2003: Rudolf, Rüdiger e altri, Looking forward to seeing calcium, "Nature reviews. Molecular cell biology", 4, 2003, pp. 579-586.
Streb 1983: Streb, Hanspeter e altri, Release of Ca2+ from a nonmitochondrial intracellular store in pancreatic acinar cells by inositol-1,4,5-trisphosphate, "Nature", 306, 1983, pp. 67-68.
Wettschureck, Offermanns 2005: Wettschureck, Nina - Offermanns, Stefan, Mammalian G proteins and their cell type specific functions, "Physiological reviews", 85, 2005, pp. 1159-1204.
Wosilait, Sutherland 1957: Wosilait, Walter D. - Sutherland, Earl W., The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase, "Journal of biological chemistry", 218, 1957, pp. 469-481.
Zaccolo, Pozzan 2002: Zaccolo, Manuela - Pozzan, Tullio, Discrete microdomains with high concentration of cAMP in stimulated rat neonatal cardiac myocytes, "Science", 295, 2002, pp. 1711-1715.