Fattori di trascrizione
Fattori di trascrizione
I geni sono unità dinamiche. Determinano infatti una funzione soltanto se vengono espressi, cioè se l'informazione in essi contenuta come sequenza desossiribonucleotidica (DNA) viene convertita in un prodotto. Un gene può quindi esistere in uno stato inattivo (nessun prodotto) e in uno stato attivo con vari gradi di attività (poco o molto prodotto, con una grande varietà di stati intermedi). Il prodotto finale di un gene può essere sia una sequenza di ribonucleotidi (un RNA) ovvero una sequenza di amminoacidi (una proteina). Qualunque ne sia il prodotto finale, la prima tappa nell'espressione di un gene è la sua trascrizione, cioè la trasformazione della sequenza di DNA in una sequenza di RNA seguendo la regola della complementarietà delle basi.
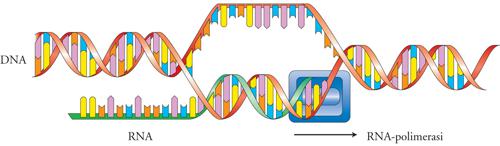
La reazione schematizzata nella (fig. 1) illustra il principio chiave della trascrizione: data una sequenza di DNA, un enzima, l'RNA-polimerasi, produce una copia del DNA in RNA legando covalentemente ribonucleotidi in una sequenza complementare a una delle due eliche dello stampo. La trascrizione è quindi una reazione biochimica complessa, che avviene con modalità analoghe dagli organismi viventi più semplici (i virus) a quelli più complessi, quali l'uomo. Eppure le RNA-polimerasi dai virus all'uomo mostrano un aumento di complessità molecolare. L'RNA-polimerasi dei virus è di solito costituita da una singola catena polipeptidica relativamente piccola (ca. 800 amminoacidi), mentre l'RNA-polimerasi dei Mammiferi è un grande complesso proteico formato da circa 12 subunità e che nell'insieme è costituita da più di 5000 amminoacidi. Qual è la ragione di questo aumento di complessità per svolgere la stessa reazione biochimica? La risposta è nell'aumento della complessità della regolazione trascrizionale tra organismi semplici e complessi. Un virus che penetra nella cellula ha il solo scopo di replicarsi e nei virus più semplici non ha alternative se non trascrivere i propri geni. La trascrizione, quindi, avviene sempre e non è regolata. Negli organismi superiori ogni gene è soggetto a regolazioni complesse. Un gene può essere regolato da ormoni e da metaboliti ed essere soggetto a regolazione nello spazio e nel tempo, in quanto espresso solo in alcune cellule e solo in determinate fasi dello sviluppo. Il terminale di queste regolazioni è appunto l'RNA-polimerasi, che deve decidere se e quando avviare il suo macchinario biochimico per trasformare la sequenza di DNA di un gene in RNA e con quanta potenza. Una polimerasi complessa, come quella dei Mammiferi, deve quindi rispondere a più segnali ed ecco la ragione della sua grandezza molecolare. Come vengono inviati segnali alla RNA-polimerasi? Questo è il ruolo dei 'fattori di trascrizione', proteine capaci di legarsi a sequenze specifiche di DNA e di influenzare, in senso positivo o negativo, la trascrizione di geni.
Struttura dei fattori di trascrizione
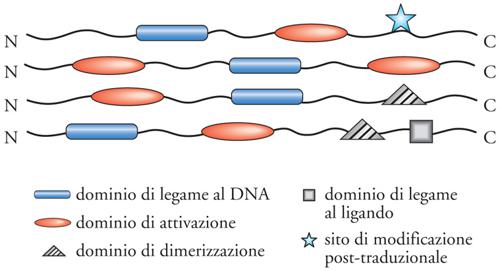
I fattori di trascrizione (FT) sono proteine modulari, composte cioè da segmenti (domini) che hanno funzione e struttura indipendenti l'uno dall'altro, anche se sono parte di una stessa catena polipeptidica. Nella forma più semplice gli FT sono costituiti da due domini, uno che riconosce una sequenza di DNA, cioè il dominio legante il DNA, (DLD), e l'altro che attiva o reprime la trascrizione, cioè il dominio attivo (DA). Le regioni di collegamento tra il DLD e il DA sono di solito segmenti flessibili, che danno la possibilità al DLD e al DA di posizionarsi nello spazio in maniera piuttosto indipendente. Ci sono poi altri domini funzionali, che danno ai fattori di trascrizione la possibilità di aumentare la complessità del loro ruolo regolativo: domini di dimerizzazione, che permettono ad alcuni fattori di trascrizione di associarsi con un partner, e domini di legame a un ligando, che rendono alcuni fattori di trascrizione sensibili alla presenza di piccole molecole, come ormoni steroidei, tiroidei, ecc. (fig. 2).
Domini che legano il DNA
Da un punto di vista strutturale i DLD sono costituiti da strutture proteiche elicoidali (α-eliche) che sono orientate in modo da inserirsi nel solco maggiore del DNA, dove gli atomi delle proteine formano specifici legami a idrogeno e interazioni di van der Waals con gli atomi del DNA. Anche le interazioni con gli atomi dello scheletro di zucchero e fosfato, e in alcuni casi con gli atomi del solco minore del DNA, contribuiscono al legame. Esiste però una corrispondenza univoca tra sequenza di DNA riconosciuta e sequenza amminoacidica del DLD, per cui un determinato fattore di trascrizione riconosce solo quelle sequenze di DNA compatibili con la sequenza amminoacidica del suo DLD. I DLD dei fattori di trascrizione possono classificarsi proprio in base alle caratteristiche strutturali del DLD. La maggior parte dei motivi strutturali presenti nei domini che legano il DNA corrisponde a caratteristiche sequenze consenso di amminoacidi: di conseguenza, quando un nuovo fattore di trascrizione viene caratterizzato, si può frequentemente classificarlo una volta che sia stato clonato e sequenziato il corrispondente gene o RNAm. I più comuni DLD di cui è stata determinata la struttura tridimensionale includono: il motivo elica-curva-elica (helix-turn-helix), il motivo a dita con zinco (zinc finger), il motivo cerniera di leucine (leucine zipper), il motivo elica-ansa-elica (helix-loop-helix).
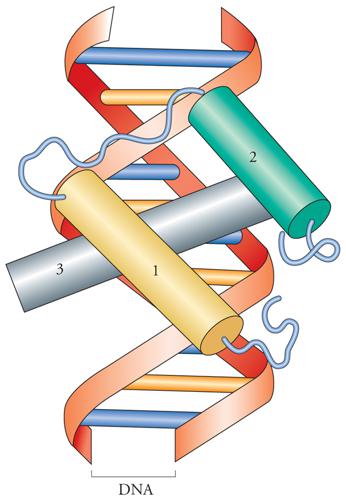
Il motivo elica-curva-elica (fig. 3) è stato ritrovato in molte proteine regolatrici procariotiche e nelle proteine cosiddette a 'omeodominio' degli eucarioti. I fattori che contengono un omeodominio sono stati identificati per la prima volta come prodotti di un gruppo di geni di Drosophila dotati di importanti ruoli nello sviluppo embrionale di tale organismo. Infatti, le mutazioni di questi geni, che sono chiamati 'geni omeotici', si manifestano nel corso dello sviluppo embrionale e hanno come conseguenza la trasformazione di una parte del corpo in un'altra. Il motivo elica-curva-elica consiste di circa sessanta amminoacidi che sono altamente conservati in tutti i fattori di trascrizione che lo posseggono. Dato che la sequenza di DNA che codifica per questo dominio veniva spesso rappresentata in un riquadro (box) quando si confrontavano le sequenze di diversi geni, cominciò a essere conosciuta come homeobox. Questa sequenza è stata ritrovata anche in geni di Vertebrati, compresi geni umani, che hanno funzioni simili a quelli di Drosophila nel controllo del piano di sviluppo embrionale. Il dominio elica-curva-elica è generalmente costituito da tre eliche. Un'elica si dispone nel solco maggiore del DNA, prende contatto con le basi esposte e realizza il contatto principale con il DNA (elica di riconoscimento). Le altre due eliche sono in grado di realizzare contatti con altre proteine (altri fattori di trascrizione).
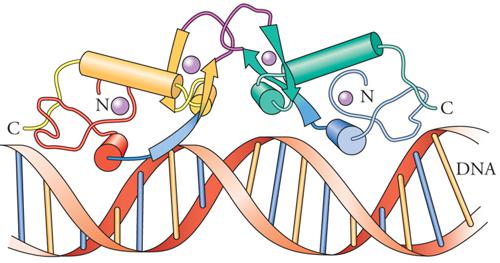
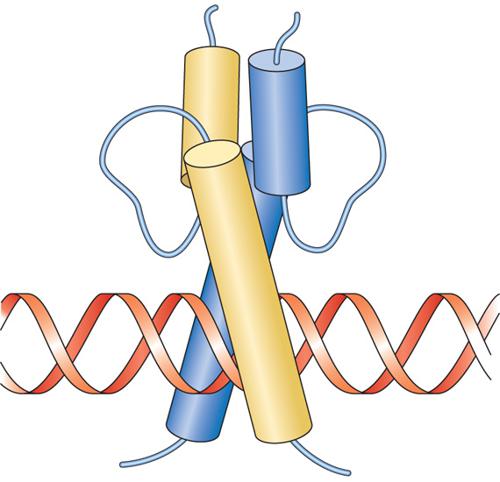
Il motivo a dita con zinco è così chiamato in ragione della presenza di residui ripetuti di cisteina e di istidina, che si avvolgono in una struttura tridimensionale coordinata da uno ione zinco (simboleggiato da un pallino viola nella fig. 4). Questo motivo strutturale è estremamente comune tra i fattori di trascrizione come la proteina Sp1, la famiglia dei recettori degli steroidi e le proteine responsabili di errori embrionali nella Drosophila. Nel genoma dei Mammiferi esistono centinaia di geni codificanti fattori a dita con zinco. È stato dimostrato che è proprio la struttura a dita con zinco a conferire a queste proteine la specificità di legame al DNA. Tuttavia, questo motivo strutturale, che fu inizialmente identificato in domini che legano il DNA, ora si sa che è presente anche in proteine che non legano il DNA. Sono state identificate tre diverse classi di motivi a dita con zinco. Il motivo a dita con zinco C2H2 contiene due cisteine e due istidine, che legano uno ione zinco. È uno dei motivi che legano il DNA che si riscontra più frequentemente nei fattori di trascrizione eucariotici. La banca dati delle sequenze proteiche registra attualmente più di un migliaio di queste proteine. Un secondo tipo di motivo, denominato 'a dita con zinco C4', si trova in un centinaio di fattori di trascrizione. I primi membri di questo gruppo a essere identificati furono specifiche proteine intracellulari in grado di formare un legame ad alta affinità con gli ormoni steroidei, ossia, dei recettori, da cui il nome di 'famiglia dei recettori steroidei'. Poiché successivamente furono trovati recettori intracellulari simili per ormoni non steroidei, questi fattori di trascrizione vengono ora chiamati 'recettori nucleari'. Il motivo a dita con zinco C4 fu inizialmente denominato così per analogia con il motivo a dita con zinco C2H2, ma si trovò più tardi che le strutture tridimensionali di questi domini che legano il DNA sono decisamente diverse tra loro. Una differenza importante tra i due è che le proteine a dita con zinco C2H2 contengono generalmente un complesso di tre o più dita e si legano al DNA come monomeri, mentre le proteine a dita con zinco C4 generalmente contengono solo due dita e si legano al DNA come omodimeri o eterodimeri. Il terzo tipo di dominio a dita con zinco è conosciuto come 'dita con zinco C6'. Le proteine di questa classe contengono sei cisteine che legano due ioni zinco, ripiegando la regione in un dominio globulare compatto.
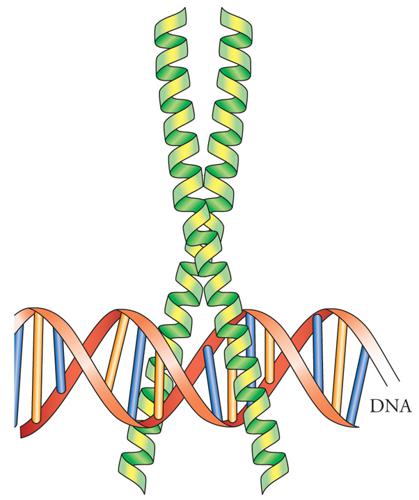
Il motivo a cerniera di leucine (fig. 5) deve il suo nome alla ripetizione di quattro o cinque residui di leucina, posti precisamente alla distanza di sette amminoacidi l'uno dall'altro. Questi domini realizzano delle interfacce idrofobiche attraverso le quali i fattori di trascrizione a cerniera di leucine interagiscono fra loro per formare dimeri, che possono essere di proteine identiche (omodimeri) o di proteine diverse (eterodimeri). Immediatamente adiacente alla cerniera di leucine, dalla parte amminoterminale, si trova un dominio arricchito in amminoacidi carichi positivamente, arginina e lisina; questa regione è il dominio di legame al DNA. L'assegnazione di tali funzioni è stata effettuata basandosi su risultati di esperimenti di mutagenesi delle proteine in questione. Mutazioni nella cerniera di leucine impediscono sia la dimerizzazione sia il legame al DNA, poiché i monomeri non sono in grado di legarsi al DNA; mutazioni nel dominio carico positivamente aboliscono il legame al DNA ma non prevengono la formazione del dimero. Quindi la specificità della formazione del dimero risiede nella cerniera di leucine. Lo scambio di cerniera di leucine fra fattori di trascrizione di questa classe cambia il partner con il quale esse formeranno il dimero.
Una quarta famiglia di fattori di trascrizione è composta dalle proteine elica-ansa-elica (fig. 6). Queste proteine sono simili alla famiglia a cerniera di leucine in quanto anche esse legano il DNA come dimeri, sia omodimeri che eterodimeri, e presentano un dominio carico positivamente in grado di riconoscere il sito di legame sul DNA. Queste proteine contengono due eliche unite da un'ansa di struttura ignota. Come per la struttura a cerniera di leucine si ritiene che queste eliche realizzino delle superfici per la formazione di dimeri proteici, mentre una terza elica ricca in amminoacidi carichi positivamente è responsabile del legame al DNA. Nella famiglia elica-ansa-elica si trovano diverse proteine che hanno ruoli importanti nel controllo della crescita e del differenziamento cellulare. Fra esse è presente una proteina chiamata MyoD, che possiede la proprietà di convertire alcuni tipi cellulari in cellule muscolari.
Risulta chiaro dalla descrizione delle diverse classi di fattori di trascrizione che alcuni di essi possono formare eterodimeri. L'esistenza di fattori di trascrizione eterodimerici aumenta le potenzialità combinatorie del controllo dell'espressione genica. Infatti, mentre i monomeri hanno diverse specificità di legame per il DNA, la formazione di eterodimeri aumenta il numero di potenziali sequenze di DNA, che una famiglia di fattori può legare. Le regole che governano le interazioni dei membri di una classe di fattori di trascrizione sono complesse. Tale complessità combinatoria incrementa sia il numero di siti di DNA, a partire dai quali questi fattori possono attivare la trascrizione, sia i modi in cui essi possono essere regolati, cosa che non avviene per i fattori di trascrizione che si legano come monomeri o omodimeri.
Domini attivi
Un dominio attivo è una sequenza polipeptidica che attiva o reprime la trascrizione interagendo con il complesso proteico della RNA-polimerasi (fig. 7). I domini di attivazione, ovvero le regioni richieste per attivare la trascrizione una volta che essi si siano portati sui promotori grazie al loro dominio di legame al DNA, sono meno ben caratterizzati. Sebbene numerose sequenze amminoacidiche possano fungere da domini di attivazione, è da tenere presente che in molti domini di attivazione si riscontra una percentuale insolitamente alta di alcuni amminoacidi come l'acido aspartico e l'acido glutammico (amminoacidi acidi). Tali domini di attivazione contengono quindi una forte carica negativa e questa caratteristica è importante per la loro funzione. Sono generalmente in grado di stimolare la trascrizione in quasi tutti i tipi di cellule eucariotiche (cellule di funghi, animali e piante). In aggiunta al dominio di attivazione acido, sono stati identificati altri domini come, per esempio, i domini di attivazione ricchi in glutammina, altri ricchi in prolina, altri ancora particolarmente ricchi in serina e treonina. Tuttavia, in alcuni domini di attivazione non si evidenzia una particolare abbondanza di alcun amminoacido specifico.
È stato dimostrato che alcuni domini di attivazione acidi sono piccoli e organizzati in regioni non strutturate, ad avvolgimento casuale di polipeptidi fino al momento in cui interagiscono con un'altra proteina. Questa interazione induce il dominio d'attivazione a ripiegarsi in un'α-elica, detta 'anfipatica', che presenta le sue cariche tutte da un lato dell'elica e che si ritiene entri in contatto con una superficie complementare dell'altra proteina. Altri domini di attivazione sono più grandi e più strutturati. Per esempio, i domini che legano il ligando di alcuni recettori nucleari funzionano come domini di attivazione solo quando si legano allo specifico ligando che ne induce un cambiamento conformazionale, permettendo così al dominio di interagire con altre proteine. L'esistenza di tale varietà di domini di attivazione ha generato la domanda se tali domini fossero funzionalmente equivalenti nella loro capacità di attivare la trascrizione. Evidenze sperimentali hanno indicato che esistono chiare differenze funzionali tra i diversi domini di attivazione. Ovviamente questo è importante da tenere presente quando si vuole determinare l'attività funzionale di diversi fattori di trascrizione, poiché tali diversità verosimilmente riflettono le differenze nel meccanismo di azione dei fattori che li contengono.
Funzionamento dei fattori di trascrizione
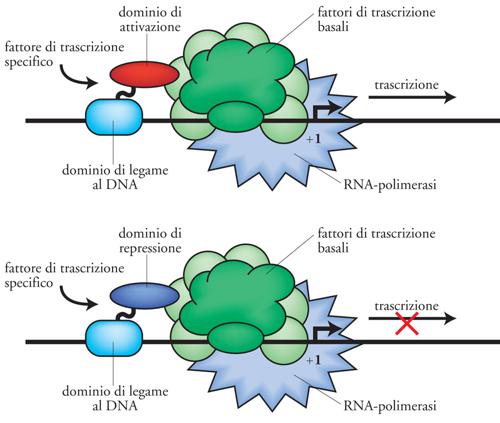
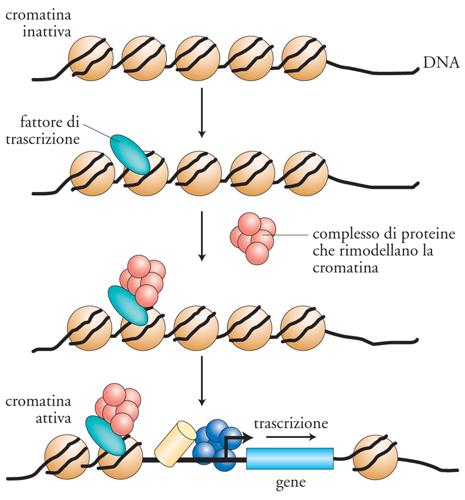
Il controllo della trascrizione nelle cellule eucariotiche è prevalentemente mediato da una rete di fattori di trascrizione, che interpretano i segnali di regolazione e li trasmettono alla macchina trascrizionale della RNA-polimerasi di tipo II. Sono passati circa venti anni da quando i primi fattori di trascrizione sono stati identificati. Da allora, la nostra capacità di comprendere come essi funzionino è molto aumentata, anche se è risultato evidente che i meccanismi di azione da essi utilizzati sono assai complessi. I fattori di trascrizione per poter produrre i loro effetti devono, nella maggior parte dei casi, essere in grado di legare il DNA e successivamente di influenzare la trascrizione genica positivamente o negativamente. Un fattore di trascrizione tipico attiva la trascrizione legandosi a siti specifici sul DNA e contattando, con il suo dominio di attivazione, il complesso multiproteico della macchina trascrizionale (fig. 8). Tuttavia, ulteriori elaborazioni di questo semplice schema sono emerse negli anni. Per esempio, un fattore di trascrizione può agire sull'impacchettamento del DNA in una struttura di ordine superiore, la cromatina, determinandone uno stato aperto (cromatina attiva) o chiuso al macchinario trascrizionale (cromatina inattiva). Un concetto che è diventato sempre più chiaro è che i fattori di trascrizione non funzionano generalmente da soli, ma al contrario operano reclutando altre proteine (coattivatori trascrizionali) attraverso interazioni proteina-proteina.
Regolazione dei fattori di trascrizione
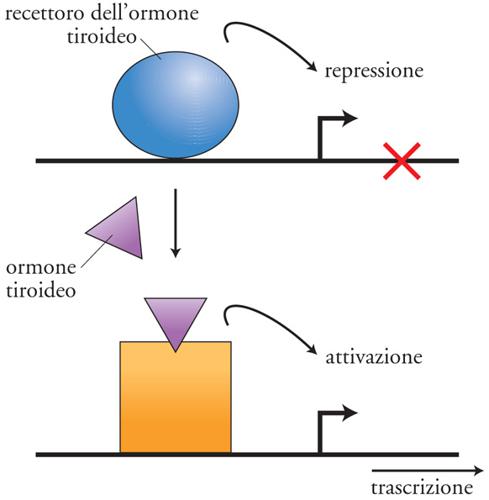
L'attività dei fattori di trascrizione è spesso finemente regolata. Tale regolazione è mediata da piccole molecole (ligandi) o da modificazioni post-traduzionali. Piccole molecole, infatti, possono promuovere una modifica strutturale di un fattore di trascrizione e indurne o modificarne l'attività (fig. 9). Le modificazioni post-traduzionali più spesso coinvolte nella regolazione dell'attività di fattori di trascrizione sono la fosforilazione, l'acetilazione, l'ubiquitinazione. La fosforilazione può regolare teoricamente tutte le funzioni di un fattore di trascrizione sia positivamente sia negativamente. Tali funzioni includono la capacità di legare il DNA, che può essere modulata sia positivamente sia negativamente, la capacità di oligomerizzare, la capacità di legare proteine coattivatrici mediante il dominio di attivazione. In aggiunta, la fosforilazione può regolare anche la stabilità e la localizzazione cellulare dei fattori di trascrizione. L'acetilazione è un'altra modificazione post-traduzionale che riveste un ruolo importante nella regolazione dell'attività dei fattori di trascrizione. Infatti, è ormai evidente che l'acetilazione modifica l'attività dei fattori di trascrizione in modo simile alla fosforilazione.
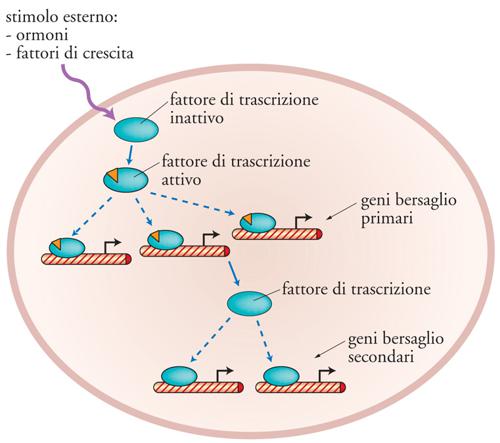
Poiché l'azione di un fattore di trascrizione si esplica nel nucleo della cellula, un cambiamento della sua localizzazione cellulare è un modo molto efficace per regolarne l'attività. Per esempio, se un fattore di trascrizione viene sequestrato nel citoplasma della cellula viene reso inattivo, poiché non ha accesso alla sequenza di DNA a cui si lega. Esistono infatti molti fattori di trascrizione che sono soggetti a questo tipo di regolazione. Un ulteriore meccanismo di controllo per un fattore di trascrizione riguarda la regolazione del suo livello di sintesi e di degradazione all'interno della cellula. In altri termini, la quantità di un fattore di trascrizione presente in una cellula può essere soggetta a regolazione e tale regolazione avviene attraverso il sistema dell'ubiquitina e del proteasoma. In conclusione i fattori di trascrizione, a causa della loro capacità di sentire stimoli esterni, accoppiata con la proprietà di riconoscere sequenze specifiche di DNA, sono i mediatori che trasportano su geni specifici gli stimoli provenienti dall'esterno della cellula (fig. 10), svolgendo così il ruolo fondamentale di armonizzare le funzioni della cellula con quelle dell'ambiente esterno.
Bibliografia
Latchman 2004: Latchman, David S., Eukaryotic transcription factors, 4. ed., Amsterdam-London, Elsevier/Academic, 2004.
Lodish 1999: Molecular cell biology, edited by Harvey Lodish e altri, New York-Basingstoke, Freeman, 1999 (trad. it.: Biologia molecolare della cellula, 2. ed., Bologna, Zanichelli, 2002).
Ptashne, Gann 2002: Ptashne, Mark - Gann, Alexander, Genes and signals, Cold Spring Harbor-New York, Cold Spring Harbor Laboratory Press, 2002 (trad. it.: Geni e segnali, Bologna, Zanichelli, 2004).