Immunologia
Immunologia
L'immunologia è la disciplina scientifica che studia il sistema immunitario, un insieme di cellule e molecole circolanti nel sangue, nella linfa e negli organi linfoidi, le cui funzioni principali sono il controllo dell'integrità dei tessuti e la protezione dell'organismo dall'attacco degli agenti infettivi. Le prime osservazioni empiriche sulle difese immunitarie risalgono ad almeno due millenni e mezzo fa: già nel V sec. a. C., al tempo dell'epidemia di peste di Atene descritta da Tucidide, c'era la consapevolezza che gli individui adulti, che da bambini erano sopravvissuti a una precedente epidemia di peste, erano protetti dal rischio di contrarre la malattia. La nascita dell'immunologia come scienza moderna è più recente e risale ai secc. XVIII, con le prime osservazioni di Edward Jenner sul vaccino contro il vaiolo, e XIX, con gli studi di Robert Koch e Louis Pasteur sui microrganismi causa di malattie infettive e sulle reazioni di difesa contro di essi. Negli ultimi decenni, l'immunologia ha fatto registrare rapidi progressi, grazie all'interazione con altre discipline biomediche, quali la genetica, la biologia molecolare, la biologia cellulare, la medicina molecolare, nonché all'integrazione tra l'approccio sperimentale e l'elaborazione di modelli teorici. L'immunologia sperimentale si avvale attualmente di avanzati metodi di studio, sia in vitro sia in vivo; in quest'ultimo caso vengono utilizzati prevalentemente animali di laboratorio che sviluppano patologie simili a quelle umane e sui quali vengono sperimentate nuove terapie. Nonostante i notevoli progressi, numerose sono le questioni dell'immunologia ancora aperte e intensamente dibattute.
Compito essenziale del sistema immunitario è quello di sviluppare risposte protettive contro i microrganismi infettivi, per esempio produrre anticorpi capaci di inibire la disseminazione degli agenti patogeni e favorirne l'eliminazione. Tuttavia, il sistema immunitario non deve reagire contro le cellule sane dell'individuo, e nemmeno contro i microrganismi non patogeni, come la normale flora batterica intestinale. Secondo quali regole il sistema immunitario stabilisce se sviluppare o meno una risposta contro una cellula, o contro una molecola da essa prodotta? Si tratta di una decisione estremamente importante, spesso una questione di vita o di morte. Diverse ipotesi sono state formulate al riguardo. Una di queste sostiene che il sistema immunitario sia in grado di discriminare tra le molecole proprie dell'individuo (self) e quelle estranee (non-self), e attivi una risposta unicamente contro le molecole non-self. Un'altra ipotesi propone che il sistema immunitario sia attivato dalla presenza di tessuti danneggiati e/o di un processo infiammatorio (segnale di danger), e che in questo contesto si sviluppi una risposta diretta principalmente contro l'agente infettivo causa della patologia. In effetti, esperimenti effettuati sugli animali di laboratorio hanno mostrato che è possibile indurre una risposta immunitaria contro molecole innocue, o addirittura contro molecole self, mescolandole con sostanze che inducono infiammazione, gli adiuvanti. Ciò suggerisce che il contesto in cui il sistema immunitario è esposto a una molecola è determinante per l'induzione di una risposta contro di essa.
La risposta immunitaria
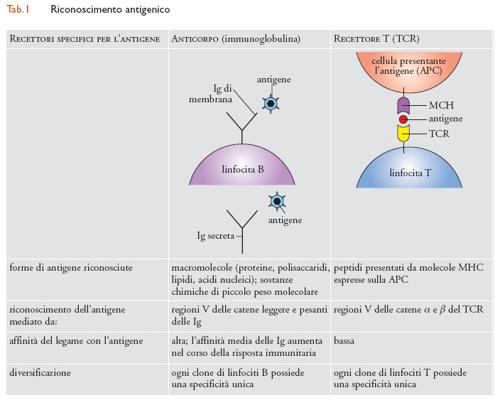
Le molecole contro cui sono dirette le risposte immunitarie sono chiamate 'antigeni'. Si tratta per lo più di proteine, glicoproteine, peptidi, carboidrati, ma anche gli acidi nucleici e i lipidi possono funzionare da antigeni. Il riconoscimento degli antigeni da parte delle cellule del sistema immunitario avviene mediante recettori specializzati, chiamati BCR (B cell receptor) e TCR (T cell receptor, tab. 1). I linfociti B riconoscono gli antigeni nella loro forma nativa mediante il BCR, o anticorpo o immunoglobulina (Ig) di membrana. I linfociti T, mediante il TCR, riconoscono gli antigeni proteici sotto forma di peptidi presentati sulla membrana di altre cellule in associazione alle molecole MHC (Major histocompatibility complex). Si distinguono due principali sottopopolazioni di linfociti T: i linfociti T CD8+ riconoscono un complesso formato dalle molecole MHC di classe I e da un peptide antigenico di 8-10 amminoacidi, mentre i linfociti T CD4+ interagiscono con le molecole MHC di classe II che presentano un peptide antigenico di 12-24 amminoacidi.
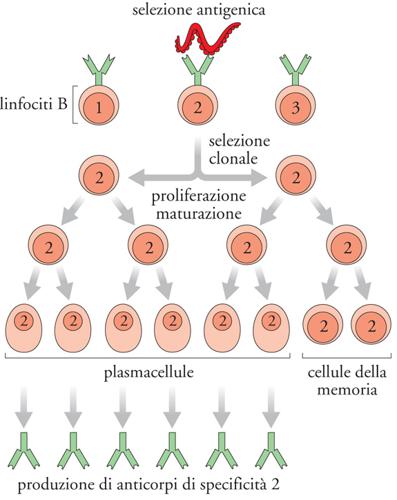
I recettori per l'antigene sono molecole altamente diversificate: nello stesso individuo, in seguito al riarrangiamento genico che avviene durante lo sviluppo linfocitario, viene generato un numero enorme (nell'ordine di miliardi) di diversi TCR e BCR, potenzialmente in grado di riconoscere una moltitudine di antigeni differenti, incluse molecole non esistenti in natura e proteine mutate di agenti infettivi. Le regole del riarrangiamento genico linfocitario sono state svelate a partire dagli esperimenti pionieristici di Susumu Tonegawa negli anni Settanta del Novecento: nei linfociti B e T la ricombinazione di segmenti genici V, D, J determina la formazione di un gene composito che codifica per il recettore per l'antigene insieme ai segmenti C. I recettori per l'antigene sono distribuiti in maniera clonale, nel senso che ogni singolo linfocita T o B esprime rispettivamente un proprio TCR o BCR diverso da quelli degli altri linfociti e lo trasmette alle cellule figlie quando prolifera. In ogni individuo esistono pochi linfociti specifici (meno dello 0,0001%) per un antigene mai incontrato in precedenza, ma durante la risposta immunitaria il numero di tali linfociti aumenta notevolmente grazie a numerosi cicli di divisione cellulare. È l'antigene a stimolare in maniera selettiva la proliferazione dei linfociti che lo riconoscono, operando così un processo di selezione nell'ambito della popolazione dei linfociti presente in ogni individuo che è estremamente eterogenea per specificità antigenica (selezione clonale, fig. 2 ).
Ogni risposta immunitaria si compone di una fase di induzione, o braccio afferente, e di una fase effettrice. Se si tratta della prima esposizione all'antigene, la risposta immunitaria è di tipo primario e coinvolge linfociti vergini. Nella fase di induzione, il linfocita vergine riconosce il proprio antigene mediante il TCR o BCR e quindi, in presenza di segnali accessori di membrana e/o solubili adeguati, si attiva, prolifera e genera le cellule figlie effettrici e quelle della memoria. Nella seconda fase della risposta, le cellule effettrici svolgono diversi tipi di funzioni specializzate, volte all'eliminazione dell'antigene. Le cellule effettrici derivate dai linfociti B sono le plasmacellule, specializzate nella secrezione di grandi quantità di anticorpi specifici per l'antigene che ha indotto la risposta. Per quanto riguarda i linfociti T, le cellule effettrici possono direttamente uccidere cellule bersaglio, per esempio cellule infettate da virus, oppure produrre citochine che stimolano altre cellule del sistema immunitario. Al termine di una risposta immunitaria efficace, l'antigene è eliminato e la maggioranza dei linfociti effettori muore. Solo alcuni dei linfociti coinvolti nella risposta sopravvivono e persistono per lungo tempo come cellule della memoria. A un incontro successivo con lo stesso antigene, il sistema immunitario sviluppa una risposta molto più rapida ed efficiente (risposta secondaria o della memoria).
L'immunità innata
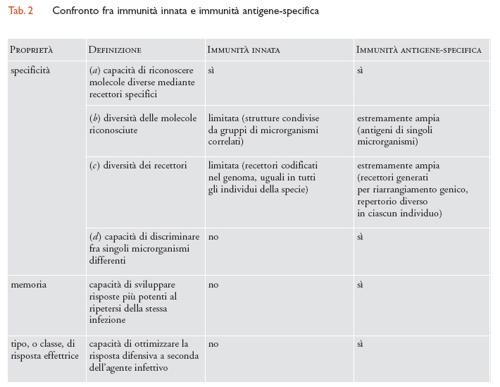
La fase di induzione della risposta immunitaria specifica per l'antigene dura alcuni giorni. Tipicamente, nel caso di una risposta primaria, gli anticorpi specifici per l'antigene compaiono nel sangue dopo 5÷10 giorni dall'immunizzazione, mentre nel caso di una risposta secondaria la concentrazione degli anticorpi nel sangue aumenta dopo 1÷3 giorni. Nelle prime ore di infezione, la difesa nei confronti dei patogeni è data dall'immunità innata o naturale, capace di sviluppare una risposta molto rapida. A differenza della risposta immunitaria specifica per l'antigene, la protezione data dall'immunità innata è diretta verso un numero limitato di molecole e non si modifica dopo esposizioni ripetute allo stesso agente patogeno. L'immunità innata è filogeneticamente molto antica e, in forme diverse, presente in tutti gli organismi multicellulari. L'immunità innata è attivata dalla presenza di sostanze potenzialmente dannose, che sono componenti costitutivi dei microrganismi, come per esempio il lipopolisaccaride batterico (LPS), i mannani dei lieviti, i peptidi formilati batterici, le ripetizioni multiple di unità carboidratiche, l'RNA virale a doppia elica. Tali strutture sono raggruppate sotto la definizione di PAMP (Pathogen associated molecular patterns) e sono riconosciute da recettori espressi dalle cellule dell'immunità innata chiamati PRR (Pattern recognition receptors). Esempi di recettori PRR sono il recettore per il mannosio e i recettori scavenger (spazzini); si tratta di proteine invarianti, spesso filogeneticamente conservate. Un gruppo di recettori PRR cruciali per l'infiammazione e la difesa dalle infezioni sono quelli della famiglia TLR (Toll-like receptor, la proteina prototipo di questo gruppo), di cui fanno parte il recettore per l'LPS e il recettore per l'RNA virale a doppia elica. I membri di questa famiglia sono presenti anche in Drosophila melanogaster (in cui è stato identificato il primo membro, Toll), e sono altamente conservati in altre specie, uomo incluso. I recettori TLR riconoscono per lo più strutture di microrganismi, ma possono anche interagire con componenti self (per es., proteine indotte da stress, come quelle della famiglia HSP, Heat shock proteins). In seguito all'interazione con il proprio ligando, cioè la molecola riconosciuta, i recettori della famiglia TLR trasmettono segnali intracellulari che portano all'attivazione del fattore trascrizionale NF-κB, un elemento chiave nel controllo dell'espressione di molti geni della risposta immunitaria.
In presenza di un agente infettivo, le cellule dell'immunità innata, quali i granulociti neutrofili, i monociti, i linfociti NK (Natural killer), si attivano e rilasciano mediatori dell'infiammazione e citochine, tra cui interleuchina-1, interleuchina-6, interleuchina-12 e TNF-α (Tumor necrosis factor di tipo α), inducendo la risposta della fase acuta. Rapidamente, i meccanismi effettori dell'immunità innata entrano in azione e determinano l'eliminazione dei microrganismi infettivi: neutrofili e macrofagi uccidono e fagocitano i batteri, le proteine del sistema del complemento (un insieme di glicoproteine del siero che regolano la fagocitosi, la citotossicità, l'infiammazione) si attaccano alla membrana dei microrganismi e la perforano direttamente, oppure funzionano da segnale di riconoscimento per il legame dei fagociti ai patogeni. L'immunità innata e l'immunità antigene-specifica forniscono dei meccanismi complementari di difesa contro gli agenti infettivi: la prima dà una risposta rapida, ma poco selettiva e scarsamente modulabile, la seconda fornisce una risposta più lenta, ma altamente specifica e più potente in un incontro successivo con lo stesso patogeno. L'integrazione dei due tipi di risposta immunitaria avviene attraverso un intenso scambio di informazioni tra cellule poste all'intersezione tra i due sistemi di difesa (tab. 2).
Le cellule dendritiche
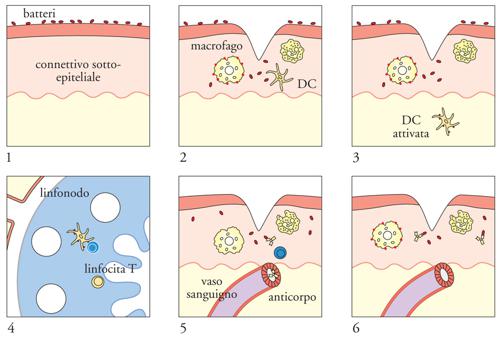
Le cellule dendritiche (DC) sono cellule dell'immunità innata di derivazione ematopoietica, presenti nel sangue, negli organi linfoidi e nei tessuti, che svolgono un ruolo centrale nella risposta immunitaria antigene-specifica. Il numero scarso delle cellule dendritiche nelle sedi di localizzazione, le difficoltà incontrate nel purificarle e mantenerle in coltura in vitro, l'assenza di marcatori distintivi rispetto ad altre cellule simili, sono stati elementi sfavorevoli che hanno impedito la caratterizzazione di queste cellule per lungo tempo. Tuttavia, negli ultimi anni si è registrato sia un notevole avanzamento nelle tecniche di laboratorio, sia un aumento di interesse per le cellule dendritiche, per cui la loro biologia e le loro funzioni sono ora meglio definite. È stato così evidenziato che le cellule dendritiche sono estremamente eterogenee per fenotipo, funzione e origine; è stato dimostrato che esse possono essere sia di derivazione mieloide sia linfoide. Attualmente sono in corso di sperimentazione nell'uomo numerosi protocolli di vaccinazione terapeutica che utilizzano cellule dendritiche in combinazione con l'antigene.
La funzione principale delle cellule dendritiche è quella di presentare l'antigene ai linfociti T e di fornire, mediante molecole di membrana e solubili, segnali in grado di modulare l'attivazione linfocitaria. Le cellule presentanti l'antigene più efficienti che si conoscono sono le cellule dendritiche mature. Esse esprimono elevati livelli di molecole MHC di classe I e di classe II e di molecole costimolatorie, cioè capaci di fornire segnali accessori per l'attivazione dei linfociti T, come i membri della famiglia B7, CD80 e CD86. All'interno dell'organismo e in assenza di stimoli, le cellule dendritiche sono distribuite in tutti i tessuti, dove sono in uno stato immaturo o di quiescenza. In presenza di un agente infettivo, riconosciuto mediante i PRR, le cellule dendritiche captano gli antigeni rilasciati nel tessuto danneggiato ed espongono i peptidi antigenici sulla loro membrana plasmatica in associazione alle molecole MHC. Per effetto di LPS e altri prodotti batterici, e di mediatori dell'infiammazione, come TNF-α, le cellule dendritiche presenti nel tessuto maturano e migrano ai linfonodi. Dati sperimentali recenti suggeriscono che le cellule dendritiche dei tessuti possano maturare anche in presenza di cellule morte per necrosi (in seguito a un processo patologico), ma non per apoptosi (morte fisiologica): di conseguenza la risposta specifica potrebbe essere scatenata da qualsiasi tipo di danno che induca necrosi cellulare anche in assenza di un agente infettivo; tuttavia i risultati di laboratori di ricerca diversi sono contrastanti e ancora non è stata raggiunta una certezza al riguardo. Nel linfonodo, le cellule dendritiche mature si incontrano con i linfociti T e inducono l'attivazione selettiva dei rari linfociti T specifici per l'antigene. Un'ipotesi largamente accreditata è che le cellule dendritiche mature presenti nel linfonodo abbiano la duplice funzione di presentare l'antigene ai linfociti T (segnale 1, complesso MHC-peptide) e di segnalare la presenza di un processo infettivo e/o infiammatorio nel tessuto di provenienza (questa informazione sarebbe contenuta nel segnale 2, che viene fornito in maniera adeguata solo dalle cellule dendritiche mature, in conseguenza della loro precedente esposizione a stimoli maturativi; non è stata identificata in maniera definitiva un'unica molecola che fornisce il segnale 2, ma è stato proposto il coinvolgimento di diverse molecole di costimolazione in questa funzione).
I linfociti natural killer
I linfociti NK sono cellule dell'immunità naturale derivate dal midollo osseo. Inizialmente si riteneva che la principale funzione di questi linfociti fosse quella antitumorale, perché si era osservato che essi avevano la capacità di uccidere cellule tumorali in assenza di una precedente sensibilizzazione (il nome linfociti natural killer fa riferimento alla loro innata attività citotossica). Successivamente è stato documentato che i linfociti NK sono coinvolti nel rigetto dei trapianti di midollo osseo e possono modulare la risposta immunitaria antigene-specifica sia attraverso il rilascio di citochine, sia attraverso l'interazione con le cellule dendritiche. Inoltre, le cellule NK della placenta svolgono un ruolo immuno-regolatorio nell'interazione materno-fetale durante la gravidanza.
La funzione primaria dei linfociti NK è probabilmente quella antivirale; infatti, individui che hanno un deficit selettivo nei linfociti NK sono soggetti a infezioni virali ripetute, in particolare da parte di virus della famiglia Herpes. L'attivazione dei linfociti NK può avvenire mediante diversi meccanismi: riconoscimento di PRR in caso di infezione; stimolazione da parte di molecole self inducibili, espresse solo da cellule danneggiate o alterate, per esempio cellule tumorali; mancato riconoscimento di molecole MHC di classe I self costitutive, normalmente espresse dalle cellule sane. Quest'ultimo meccanismo di attivazione, chiamato anche riconoscimento del missing self, si basa sulla mancanza di un segnale di inibizione, normalmente fornito ai linfociti NK dalle molecole MHC di classe I espresse dalle cellule sane, e sulla contemporanea presenza di segnali di attivazione per questi linfociti. Lo studio del delicato equilibrio tra segnali attivatori e inibitori che regolano la funzione dei linfociti NK ha aiutato a comprendere che l'attivazione e l'inibizione linfocitaria, anche quelle dei linfociti T e B, risultano dalla continua integrazione all'interno della cellula di stimoli, di segno uguale od opposto, provenienti dalla membrana.
L'immunità specifica
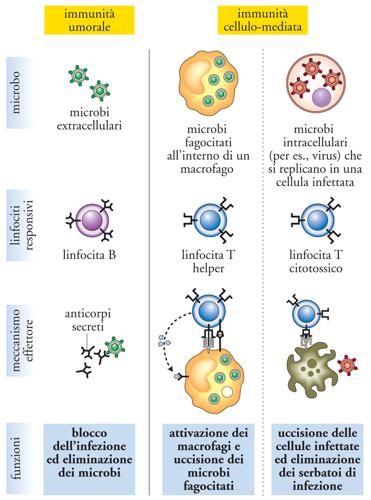
L'immunità specifica, o adattativa, o acquisita, è filogeneticamente più recente di quella naturale, essendo comparsa circa 400 milioni di anni fa con i Vertebrati. La risposta immunitaria specifica ha due componenti: quella umorale, dovuta ai linfociti B e agli anticorpi da essi prodotti, e quella cellulare, data dai linfociti T. Nella fase di induzione di una risposta immunitaria efficace, l'antigene è presentato ai linfociti T vergini dalle cellule dendritiche mature. In ogni tipo di risposta immunitaria, un ruolo centrale è svolto dai linfociti T CD4+, anche chiamati cellule helper, che cooperano nell'attivazione sia dei linfociti B, sia dei linfociti T CD8+. La funzione help dei linfociti T CD4+ è mediata da interazioni di membrana e citochine solubili, per esempio interleuchina-2 e interleuchina-4.
È stato dimostrato che il segnale help è fornito dai linfociti T CD4+ helper ai linfociti T CD8+ attraverso le cellule dendritiche. Tali cellule presentano l'antigene nel contesto delle molecole MHC di classe II ai linfociti T CD4+ helper e ricevono uno stimolo (o condizionamento) attraverso la molecola di membrana CD40 che interagisce con il suo ligando espresso dai linfociti T CD4+. Le cellule dendritiche così 'condizionate' presentano poi l'antigene in associazione alle molecole MHC di classe I ai linfociti T CD8, che ricevono quindi tutti i segnali necessari per l'induzione della risposta immunitaria primaria. Le cellule dendritiche possono in alcuni casi attivare i linfociti T CD8+ in assenza di linfociti T CD4+, per esempio quando le cellule dendritiche sono infettate dal virus dell'influenza, che rappresenta uno stimolo sufficiente all'induzione di una risposta T CD8+ citotossica indipendente dalla funzione help. Tuttavia, studi recenti suggeriscono che i linfociti T CD4+ helper devono partecipare alla fase di induzione affinché si sviluppi una risposta della memoria duratura ed efficace. La funzione help per le risposte anticorpali richiede la presentazione dell'antigene da parte dei linfociti B ai linfociti T CD4+: i linfociti B captano l'antigene attraverso l'anticorpo specifico di membrana, lo sottopongono a processamento e lo espongono in forma di peptidi associati alle molecole MHC di classe II di membrana. I linfociti T CD4+ riconoscono l'antigene così presentato mediante il loro TCR, si attivano e forniscono ai linfociti B dei segnali di stimolo, sia attraverso il ligando del CD40, che interagisce con il CD40 espresso dai linfociti B, sia mediante altre molecole di membrana e citochine secrete.
Dopo la stimolazione antigenica, i linfociti T e B si attivano, proliferano e si differenziano in cellule figlie specializzate, in grado di svolgere diverse funzioni. Nell'ambito delle cellule figlie, i linfociti effettori hanno vita breve, mentre i linfociti della memoria persistono a lungo. I due tipi principali di linfociti T CD4+ helper specializzati sono le cellule TH1 e TH2, caratterizzate dalla produzione di due profili diversi di citochine e da due funzioni difensive distinte. Anche se tale distinzione non è assoluta, in linea generale i linfociti TH1 producono principalmente interferone γ e sono importanti per la difesa contro gli agenti infettivi intracellulari (per es., batteri intracellulari), mentre i linfociti TH2 producono soprattutto interleuchina-4 e cooperano con i linfociti B per la produzione di anticorpi, svolgendo un ruolo di difesa dagli agenti infettivi extracellulari (per es., gli elminti). I linfociti T CD8+ stimolati dall'antigene si differenziano per lo più in cellule effettrici citotossiche, ma possono svolgere un ruolo difensivo anche mediante la produzione di citochine, quali TNF-α e interferone γ. Il bersaglio dell'attività citotossica dei linfociti T CD8+ sono cellule che esprimono in membrana il peptide antigenico associato alle molecole MHC di classe I, per esempio cellule infettate da virus.
La differenziazione terminale dei linfociti B dà origine alle plasmacellule, capaci di rilasciare nell'ambiente extracellulare grandi quantità di Ig di diverse classi. La porzione dell'Ig che riconosce l'antigene è distintiva di ciascun clone linfocitario (e delle sue plasmacellule figlie) e nel cambio di classe viene cambiata quella parte della molecola responsabile di funzioni non specifiche per l'antigene (per es., il legame con le proteine del complemento o con recettori di membrana per la porzione conservata delle Ig). Si conoscono 5 classi di Ig nell'uomo: IgA, IgG, IgM, IgD, IgE; le IgG e le IgA sono divise in sottoclassi. Le classi (e sottoclassi di Ig) sono specializzate in diverse funzioni: per esempio le IgG (soprattutto IgG1 e IgG3) e le IgM promuovono la fagocitosi degli antigeni a cui si legano, le IgG (soprattutto IgG1 e IgG3) e le IgE facilitano l'eliminazione dell'antigene attraverso l'attivazione dell'attività citotossica anticorpo-dipendente o ADCC (Antibody dependent cell-mediated cytotoxicity). Le classi di Ig si differenziano anche per la loro distribuzione negli ambienti extracellulari, per esempio le IgG si trovano principalmente nel sangue, le IgA nelle secrezioni (lacrime, latte, saliva, ecc.). Nel corso della differenziazione dei linfociti B indotta dall'antigene, i geni delle Ig vanno incontro a mutazioni puntiformi con una frequenza circa 100 volte superiore a quella spontanea (mutazione somatica); le cellule B che producono Ig capaci di legare meglio l'antigene sopravvivono e proliferano di più, per cui nel corso della risposta prevalgono gli anticorpi a maggiore affinità (maturazione dell'affinità).
Il tipo di risposta effettrice, o classe, è diverso a seconda della differenziazione dei linfociti T e B che avviene dopo il loro incontro con l'antigene (cellule TH1 oppure TH2, plasmacellule producenti IgG oppure IgA, ecc.) ed è solitamente quello più appropriato per combattere in maniera efficace l'agente patogeno che ha indotto la risposta.
Le cellule T regolatorie
È stato da tempo documentato che le risposte immunitarie possono essere inibite da linfociti T con funzione regolatoria, e diverse ipotesi sono state formulate al riguardo. Una possibilità è che le cellule T regolatorie siano specializzate nella funzione inibitoria, siano cioè delle cellule soppressorie per tutte le risposte immunitarie. Un'altra possibilità è che si tratti di cellule che favoriscono un tipo di risposta immunitaria e ne inibiscono un altro, per esempio che inducono la produzione di una classe di anticorpi e riducono l'attività citotossica. Un esempio di questo tipo di regolazione è quello che si verifica nel caso delle risposte di tipo TH1 e TH2, infatti i linfociti TH2 potenziano la differenziazione di altri linfociti TH2 ma inibiscono quella dei linfociti TH1, e il contrario accade per le risposte TH1. Un'ulteriore possibilità è che i linfociti T regolatori non siano delle cellule differenziate che svolgono unicamente la funzione inibitoria, bensì cellule parzialmente o diversamente attivate, che sotto stimolo appropriato possono svolgere una funzione effettrice differente.
Negli ultimi anni sono state identificate diverse sottopopolazioni di linfociti T CD4+ con funzione regolatoria: le cellule T-reg (T regolatorie); le cellule TH3 (così chiamate per differenziarle dalle TH1 e dalle TH2); le cellule TH3 che producono principalmente la citochina TGF-β (Transforming growth factor di tipo β); le cellule T CD4+CD25+. Queste ultime cellule sono caratterizzate dall'espressione in membrana della molecola CD25, ossia la catena α del recettore per l'interleuchina-2. Anche se i linfociti T CD4+ helper, stimolati nel corso di una risposta antigene-specifica, possono esprimere in fase di attivazione il CD25, nel caso delle cellule regolatorie T CD4+CD25+ l'espressione di tale molecola sarebbe costitutiva. Le cellule regolatorie T CD4+CD25+ sono caratterizzate dall'espressione del fattore di trascrizione Foxp3, spesso usato come marcatore per identificare queste cellule.
Il riconoscimento antigenico
Gli antigeni solubili sono riconosciuti dagli anticorpi di membrana dei linfociti B nella fase di induzione della risposta immunitaria e dagli anticorpi secreti dalle plasmacellule nella fase effettrice della risposta. Gli anticorpi o Ig sono glicoproteine formate da due catene leggere identiche (catene L, Light) e due catene pesanti identiche (catene H, Heavy), per un peso molecolare complessivo di circa 150 kDa. Nella sequenza amminoacidica degli anticorpi si osserva la ripetizione di una sequenza conservata, lunga circa 110 amminoacidi, che corrisponde a un'unità globulare compatta stabilizzata da un ponte disolfuro: si tratta del cosiddetto 'dominio immunoglobulinico', presente non solo nelle Ig, bensì anche nel TCR e in molte altre molecole del sistema immunitario. La struttura dell'anticorpo ricorda una Y, con ciascun braccio formato da una catena L appaiata a metà di una catena H, e lo stelo costituito dalle restanti metà delle catene H. Ciascuna catena è formata da una regione costante e una regione variabile; le regioni variabili delle catene H e L si trovano all'estremità dei bracci della Y e interagiscono con l'antigene. In particolare, il sito di legame dell'antigene è formato da quella parte delle regioni variabili in cui si concentra la maggiore diversità tra gli anticorpi; tali regioni sono chiamate CDR (Complementarity determining regions). Solitamente le Ig hanno due siti di legame per l'antigene, ma alcune classi di anticorpi (IgM, IgA) sono formate da più unità Y complessate fra loro, per cui si possono avere fino a 10 siti di legame per l'antigene. Il riconoscimento antigenico avviene mediante un'interazione stretta tra la regione dell'antigene chiamata 'epitopo' e il sito complementare corrispondente dell'anticorpo, formato dalle regioni CDR: è un'interazione stabile, ad alta affinità di legame.
Il TCR è un recettore di membrana dei linfociti T che riconosce l'antigene esposto sulla membrana di un'altra cellula in associazione a molecole di tipo MHC (tab. 1). Il TCR è formato da due catene: nella maggior parte dei linfociti T maturi si tratta delle catene denominate α e β, mentre una minoranza di linfociti T esprime altre due catene, chiamate γ e δ. Ciascuna catena del TCR è formata da una regione variabile, che corrisponde al sito di legame dell'antigene, e da una regione costante. Il TCR di tipo γδ può riconoscere ligandi non proteici, per esempio lipidi di derivazione batterica, in associazione a molecole simili a quelle MHC. Il TCR di tipo αβ riconosce il peptide antigenico in associazione alle molecole MHC di classe I e di classe II. Il riconoscimento del complesso MHC-peptide coinvolge le regioni variabili di entrambe le catene del TCR, e in particolare le loro regioni CDR, in analogia a quanto avviene per le Ig.
Mediante cristallografia a raggi X è stato possibile studiare in maniera dettagliata il complesso formato dal TCR e dal suo ligando MHC-peptide, identificando i residui amminoacidici coinvolti nel legame e l'orientamento delle molecole nello spazio. Il TCR entra in contatto sia con il peptide sia con le molecole MHC; si può anche dire che il TCR riconosce le molecole MHC 'modificate' dall'associazione con il peptide antigenico. A differenza dell'interazione antigene-anticorpo, il legame del TCR al complesso MHC-peptide è un legame a bassa affinità. Esso è stabilizzato dalle molecole accessorie CD8 e CD4, che interagiscono rispettivamente con le molecole MHC di classe I e di classe II. Inoltre, non si tratta del legame tra un singolo TCR e un complesso MHC-peptide, bensì del coinvolgimento di più molecole TCR, diversi complessi MHC-peptide e un gran numero di molecole accessorie, che sono coinvolte nell'interazione cellula-cellula nel punto di contatto tra le due membrane plasmatiche (sinapsi immunologica).
Il processamento e la presentazione dell'antigene
Le molecole MHC di classe I sono glicoproteine di membrana formate da una catena pesante α e da una catena leggera, la β2-microglobulina. Tali molecole che, con l'eccezione dei globuli rossi, sono espresse da tutte le cellule dell'individuo, hanno la funzione di presentare peptidi antigenici derivati da proteine intracellulari ai linfociti T CD8+. Tali peptidi sono accolti in una tasca formata dalla catena α. Gli antigeni localizzati nel citosol della cellula sono processati in diverse tappe prima di essere associati in forma di peptidi alle molecole MHC di classe I ed essere presentati in membrana. La prima tappa è il taglio enzimatico delle proteine antigeniche in frammenti, a opera di un complesso di proteasi, il cosiddetto 'proteasoma', che è una componente della via di degradazione delle proteine citosoliche dipendente dall'ubiquitina. Il proteasoma è formato da 28 subunità organizzate in una struttura cilindrica ed esiste in due forme, una costitutiva, l'altra inducibile, detta 'immunoproteasoma'; quest'ultima contiene 3 nuove subunità indotte dall'interferone γ e ha una specificità di substrato leggermente diversa dal proteasoma costitutivo. I peptidi generati dal proteasoma nel citosol sono trasportati all'interno delle vescicole del reticolo endoplasmatico rugoso (REG) mediante proteine trasportatrici TAP-1 e TAP-2 (Transporters associated with antigen processing-1 e -2). All'interno del REG tali peptidi si associano alle molecole MHC di classe I, consentendo così alla catena α e alla β2-microglobulina di assumere la corretta conformazione. Finché non si assemblano correttamente e legano i peptidi, le molecole MHC di classe I si trovano associate ad altre proteine (calnexina, calreticulina, Erp57, tapasina) nel REG. Le molecole MHC di classe I-peptide correttamente assemblate sono trasportate al complesso del Golgi e di qui alla membrana plasmatica.
Le molecole MHC di classe II sono glicoproteine di membrana formate da due catene, α e β, che insieme formano la tasca in cui è accolto il peptide antigenico. Tali molecole sono espresse costitutivamente da cellule specializzate del sistema immunitario, quali le cellule dendritiche, i macrofagi e i linfociti B, e la loro espressione può essere indotta su altre cellule dall'interferone γ. La presentazione in associazione alle molecole MHC di classe II riguarda antigeni extracellulari internalizzati mediante vescicole di endocitosi oppure molecole di patogeni che sopravvivono all'interno di vescicole intracellulari, per esempio micobatteri e Leishmania. In entrambi i casi, gli antigeni vengono degradati negli endosomi, vescicole intracellulari ricche di proteasi attivate in ambiente acido. I peptidi generati dalla degradazione degli antigeni incontrano le molecole MHC di classe II quando gli endosomi si fondono con vescicole provenienti dal REG, che contengono le molecole MHC di classe II appena sintetizzate. Nel REG e fino alla fusione con gli endosomi, le molecole MHC di classe II sono associate alla cosiddetta 'proteina invariante', il cui segmento occupa la tasca antigenica e impedisce il legame di altri peptidi. Dopo la fusione con gli endosomi, tale frammento viene scalzato e sostituito dai peptidi antigenici e le molecole MHC di classe II-peptide sono trasportate alla membrana plasmatica. Molecole accessorie cooperano affinché il peptide antigenico sia correttamente accolto nella tasca delle molecole MHC di classe II.
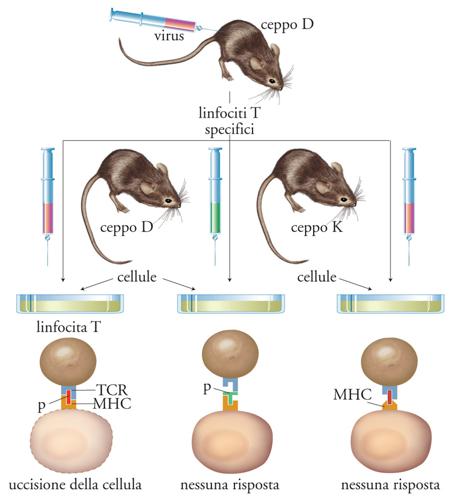
Le molecole MHC di classe I e di classe II appartengono a una famiglia poligenica (nello stesso individuo sono coespressi numerosi geni per la catena α delle molecole MHC di classe I e per entrambe le catene delle molecole MHC di classe II) e polimorfica (nella popolazione esiste una moltitudine di alleli diversi per ciascun gene MHC). Ciò rende possibile la presentazione di una grande varietà di antigeni di agenti infettivi diversi. Ciascun individuo è portatore di un proprio insieme di alleli MHC, o aplotipo. L'aplotipo di ciascun individuo restringe le possibilità di interazione con l'antigene da parte dei suoi linfociti T, che sono vincolati alla presentazione dei peptidi antigenici da parte dei propri alleli MHC (restrizione MHC, fig. 4). L'estremo polimorfismo delle molecole MHC (nell'uomo chiamate HLA, Human leukocyte antigens) è alla base del rigetto dei trapianti, in quanto un'elevata percentuale (compresa fra l'1 e il 10%) dei linfociti T di ciascun individuo è stimolata da cellule di aplotipo HLA diverso non correlato. Inoltre, i linfociti NK ricevono normalmente un segnale inibitorio dalle molecole HLA self; l'assenza di tali molecole sulla membrana delle cellule trapiantate può contribuire al rigetto del trapianto, come si è osservato nei trapianti di midollo osseo.
L'ontogenesi dei linfociti
I precursori linfocitari si trovano nel midollo osseo e lo sviluppo dei linfociti B e T avviene rispettivamente nel midollo osseo e nel timo, i cosiddetti 'organi linfoidi primari'. Per evitare che la risposta immunitaria possa rivolgersi contro i componenti normali dell'ospite (antigeni self ), i linfociti sono sottoposti a un processo di selezione negativa nel corso del loro sviluppo: tutti i linfociti che riconoscono antigeni self espressi negli organi linfoidi primari sono eliminati (tolleranza centrale). Cosa accade dei linfociti che riconoscono come antigeni proteine tessuto-specifiche, per esempio l'insulina, espressa unicamente nelle isole del pancreas? Per quanto riguarda i linfociti T, studi recenti hanno mostrato che essi sono esposti nel corso della maturazione ad alcuni antigeni tessuto-specifici, che vengono espressi nel timo da particolari cellule, denominate 'cellule stromali timiche', sotto il controllo del gene AIRE (Autoimmune regulator). Mutazioni di questo gene causano una grave malattia autoimmunitaria chiamata APECED (Autoimmune poly-endocrinopathy candidiasis ectodermal distrophy). Durante le fasi iniziali del loro sviluppo nel timo, i linfociti T sono sottoposti anche a un processo di selezione positiva, che consente la maturazione completa di quei linfociti in grado di interagire a bassa affinità con le molecole MHC self. Si ritiene che ciò sia importante affinché le cellule T mature riconoscano gli antigeni estranei in associazione alle proprie molecole MHC.
La tolleranza periferica
Nonostante la selezione negativa, nel sangue e negli organi linfoidi secondari (milza e linfonodi) sono presenti linfociti maturi autoreattivi: si tratta di cellule specifiche per antigeni self assenti o poco espressi negli organi linfoidi primari. Queste cellule autoreattive, potenzialmente pericolose, sono normalmente tenute a bada da una serie di meccanismi di regolazione (tolleranza periferica). Il principale meccanismo consiste nell'attivazione non produttiva che porta a un'inibizione specifica per l'antigene. L'attivazione linfocitaria produttiva avviene solo in presenza di due stimoli: il segnale specifico o segnale 1, dato dall'antigene, e un segnale accessorio, il segnale 2 o costimolo, fornito ai linfociti T dalle cellule presentanti l'antigene. Il linfocita T che riconosca il proprio antigene in assenza di adeguato costimolo va incontro a uno stato di inattivazione funzionale (anergia) o addirittura può morire per apoptosi. Solo il linfocita T che abbia ricevuto entrambi i segnali si attiva e prolifera, generando cellule effettrici e della memoria. Risultati recenti indicano che in condizioni fisiologiche le cellule dendritiche immature captano gli antigeni self dei normali tessuti e migrano al linfonodo drenante. In assenza di un processo patologico nel tessuto, le cellule dendritiche non maturano in maniera classica, per cui forniscono ai linfociti T specifici un segnale di attivazione incompleto o negativo, determinando l'inibizione della risposta. Ciò può avvenire sia mediante un'inibizione diretta dei linfociti T specifici per l'antigene, sia mediante l'attivazione di cellule T-reg. Queste ultime possono essere reclutate nell'inibizione delle risposte autoreattive anche mediante altri meccanismi e si ritiene che esse contribuiscano in maniera determinante alla tolleranza periferica. Un'ulteriore possibilità è che alcuni antigeni self siano ignorati dal sistema immunitario e le cellule che li esprimono non vengano normalmente in contatto con i linfociti.
Quando i linfociti specifici per gli antigeni self sono attivati e i meccanismi che mantengono la tolleranza sono insufficienti, si sviluppano le malattie autoimmuni (per es., il diabete mellito di tipo I, la miastenia grave, ecc.). La comprensione dei meccanismi che determinano tali patologie è importante per progettare terapie che spengano la risposta autoimmune. Al contrario, nel rapporto tra tumore e ospite, una reazione immunitaria contro antigeni espressi dalle cellule neoplastiche può essere utilizzata per curare un tumore già stabilizzato, o prevenire la trasformazione di lesioni precancerose in cancro.
La dinamica della risposta immunitaria
La comprensione dei meccanismi che regolano la migrazione linfocitaria è essenziale per capire come il sistema immunitario possa sviluppare delle risposte localizzate, appropriate per i diversi organi (per es., il polmone o la cute), e al tempo stesso fornire una protezione sistemica, estesa a tutto il corpo. La maggior parte dei linfociti è in continuo movimento tra gli organi linfoidi secondari e i tessuti, circolando attraverso il sangue e la linfa. Questa circolazione non è casuale, bensì finemente regolata da interazioni tra linfociti e cellule endoteliali, che indirizzano i linfociti dal sangue all'ambiente extravascolare attraverso quattro tappe successive: contatto o adesione primaria, attivazione, arresto o adesione secondaria, attraversamento dell'endotelio. L'adesione primaria è transitoria e reversibile: attraverso recettori di membrana, il linfocita prende contatto con la cellula endoteliale e rotola su di essa, rallentando la sua velocità di circolazione nel sangue. A questo punto, in presenza di segnali adeguati, il linfocita si attiva nel giro di pochi secondi e si arresta. L'attivazione è dovuta all'interazione tra le chemiochine, prodotte dalle cellule endoteliali, e i recettori corrispondenti sulla membrana dei linfociti. Molecole di adesione della famiglia delle integrine mediano l'arresto dei linfociti sulla superficie endoteliale e la migrazione attraverso di essa, o diapedesi. Superata la parete del vaso, i linfociti si muovono nell'ambiente extravascolare guidati da gradienti chemiotattici e da interazioni di membrana (fig. 5).
La migrazione delle cellule del sistema immunitario è molto importante sia per l'induzione della risposta, sia per lo svolgimento delle funzioni effettrici dei linfociti. Nel primo caso, affinché la risposta a un antigene possa svilupparsi, deve verificarsi l'incontro tra almeno due rare cellule migranti, cioè la cellula dendritica presentante l'antigene e il linfocita T che esprime il TCR specifico per lo stesso antigene. Si tratta di cellule presenti in piccolo numero e disperse in un insieme eterogeneo di altre cellule con caratteristiche diverse. L'incontro avviene di solito nel linfonodo, dove le cellule dendritiche giungono mediante i vasi linfatici dopo aver captato l'antigene nei tessuti infiammati; i linfociti T vergini, invece, sono veicolati dal circolo ematico ed entrano dal sangue nei linfonodi attraversando le venule a endotelio alto. Quei rari linfociti T che riconoscono l'antigene presentato dalle cellule dendritiche sono stimolati e danno inizio alla risposta immunitaria specifica. I linfociti T che non incontrano il loro antigene escono dai linfonodi e riprendono a circolare. Per lo svolgimento delle funzioni effettrici immunitarie, è necessario che i linfociti T attivati migrino nei tessuti infiammati, dove sonolocalizzati gli antigeni e/o gli agenti infettivi. I linfociti T che hanno già incontrato il loro antigene nei linfonodi oppure nella milza (cellule effettrici e cellule della memoria) hanno la capacità di migrare dal sangue nei tessuti sede del danno. Dal tessuto, i linfociti T della memoria rientrano nei linfonodi drenanti attraverso la linfa.
I linfociti effettori e della memoria possono avere capacità migratorie diverse in dipendenza della loro differenziazione. Si è osservato, per esempio, che i linfociti TH1 e quelli TH2 si indirizzano verso siti di infiammazione diversi, forse anche in conseguenza della loro differente espressione di recettori per chemiochine. Un altro caso è quello delle plasmacellule esprimenti IgA, che migrano preferenzialmente alle mucose. In aggiunta ai 'canonici' linfociti T e B circolanti, in diversi organi sono presenti sottopopolazioni linfocitarie proprie di quel distretto, che svolgono funzioni specializzate legate alla loro localizzazione. Questo è il caso dei linfociti NK dell'utero, dei linfociti T che esprimono il TCR-γδ nella mucosa intestinale, dei linfociti NKT nel fegato. Queste ultime sono cellule con funzione immuno-regolatoria che esprimono sia un TCR-αβ sia alcuni marcatori tipici dei linfociti NK.
La memoria immunitaria
La memoria immunitaria è tipicamente di lunga durata: il secondo incontro con lo stesso antigene può avvenire anche a distanza di diversi anni dal primo, eppure il sistema immunitario è in grado di sviluppare una risposta di tipo secondario (fig. 3). D'altra parte, pur conservando memoria degli antigeni incontrati nel passato, il sistema immunitario è in grado di rispondere a nuovi antigeni mai visti in precedenza. Non è stato ancora chiarito come questo sia possibile, considerando anche che il numero dei linfociti, sia T che B, del sangue e degli organi linfoidi è grosso modo costante, quindi la proliferazione di alcuni linfociti deve essere compensata dalla morte di altri. Quali siano i meccanismi responsabili della memoria immunitaria è una questione di grande interesse per la scienza di base, che allo stesso tempo ha notevoli ricadute applicative in medicina, per la prevenzione e la cura delle malattie infettive, di quelle autoimmunitarie e dei tumori.
È stato proposto che i linfociti della memoria siano, per loro proprietà intrinseche, delle cellule longeve, capaci di sopravvivere per lunghi anni senza alcuno stimolo e senza moltiplicarsi, a differenza dei linfociti vergini, che sarebbero invece predisposti a morire dopo breve tempo in assenza di stimolazione antigenica. Tuttavia, i risultati di esperimenti nei topi di laboratorio hanno mostrato che quei cloni linfocitari che non si dividono per lungo tempo sono destinati a scomparire, perché diluiti e rimpiazzati da altri linfociti che rispondono agli stimoli da cui il sistema immunitario è continuamente sollecitato. Si è affermata perciò una visione più dinamica della memoria immunitaria, secondo la quale i linfociti della memoria sono cellule proliferanti. Resta centrale l'interrogativo su quale sia lo stimolo che induce la proliferazione dei linfociti della memoria a distanza di molto tempo dalla risposta primaria. Un'ipotesi è che l'antigene che ha indotto originariamente la risposta primaria possa persistere nell'individuo e ristimolare periodicamente le cellule della memoria. L'antigene potrebbe rimanere a lungo come componente di un agente patogeno responsabile di un'infezione cronica o sotto forma di complessi antigene-anticorpo. In alternativa, i linfociti della memoria specifici per un antigene potrebbero essere ristimolati da antigeni apparentemente non correlati (fenomeno della cross-reazione). Infine, un'ulteriore possibilità è che i linfociti della memoria possano proliferare in risposta a citochine, per esempio è stato dimostrato che i linfociti T CD8+ della memoria si espandono notevolmente in risposta all'interleuchina-15.
Il campo in cui la capacità del sistema immunitario di conservare una memoria specifica degli antigeni incontrati in precedenza ha trovato finora la sua più efficace applicazione è quello delle vaccinazioni, la cui diffusione ha consentito di ridurre enormemente l'incidenza di numerose malattie infettive. Malgrado ciò, è ancora notevole il bisogno di ricerca e sviluppo in questo settore. In tal senso, tra le prospettive ancora aperte si collocano sia la messa a punto di nuovi vaccini, in quanto contro molti agenti infettivi non esistono ancora né terapia né prevenzione efficace, sia il perfezionamento di quelli già in uso, per esempio migliorando la risposta protettiva e riducendo il rischio di patologie associate alla vaccinazione.
Bibliografia
Janeway 2005: Immunobiology: the immune system in health and disease, 6. ed., edited by Charles A. Janeway jr e altri, New York, Garland Science, 2005.
Paul 2003: Fundamental immunology, 5. ed., edited by William E. Paul, Philadelphia, Lippincott Williams & Wilkins, 2003.