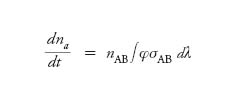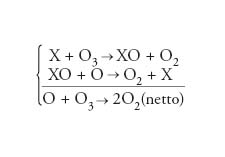Ozono atmosferico
Ozono atmosferico
L'ozono (O3) è una forma allotropica dell'ossigeno: la molecola è costituita da tre atomi di ossigeno, a differenza dell'ossigeno molecolare, uno dei componenti principali dell'aria, che ne ha solo due. La formazione dell'ozono atmosferico avviene essenzialmente nella stratosfera a causa di reazioni indotte dall'assorbimento della radiazione solare ultravioletta responsabili anche della struttura termica di quella regione. La concentrazione dell'ozono, espressa come rapporto di mescolamento in volume relativo rispetto all'aria, raggiunge un massimo di circa 8 parti per milione in volume (ppmv) a una quota di circa 30 km: la regione atmosferica in prossimità di tale massimo è detta ozonosfera. Dalla stratosfera l'ozono si diffonde nella troposfera, dove la vita media della molecola è di oltre un anno. Formazione di ozono (smog fotochimico) si ha poi nelle atmosfere urbane o industriali fortemente inquinate.
L'esistenza dell'ozonosfera è di importanza fondamentale per lo sviluppo e il mantenimento delle forme di vita sulla Terra, poiché ha la funzione di scudo per le radiazioni ultraviolette in grado di uccidere o modificare le cellule viventi: un eventuale assottigliamento di essa produrrebbe un aumento del flusso ultravioletto incidente sulla superficie, con temuti effetti di carattere sanitario e genetico. Recentemente è stato messo in evidenza come l'ozonosfera venga assottigliata dall'azione catalitica di sostanze antropogeniche, i clorofluorocarburi (CFC), presenti in concentrazione migliaia di volte minore di quella dell'ozono stesso; il fenomeno si manifesta in modo catastrofico nella stratosfera antartica primaverile ed è preceduto dalla formazione, nel periodo invernale, di nubi stratosferiche polari, la cui presenza determina una serie di reazioni eterogenee, precorritrici del fenomeno.
Il primo a suggerire l'esistenza dell'ozono, sulla base del particolare odore percettibile in occasione di temporali, e ad attribuirgli tale nome, fu Christian Friedrich Schönbein nel 1840; tuttavia, la sua origine esatta fu dedotta da Auguste de la Rive, che lo produsse in laboratorio mediante scariche elettriche in ossigeno nel 1845. In occasione dell'Anno geofisico internazionale 1957-1958 si diede avvio a un regolare servizio di misurazione del contenuto colonnare di ozono, mediante una rete mondiale di spettrofotometri. In varie stazioni si è aggiunta successivamente la capacità di misurare profili verticali mediante sonde elettrochimiche portate da piccoli palloni fino a circa 30 km di quota (palloni sonda). Attualmente, osservazioni effettuate in modo continuo da satelliti consentono l'analisi su scala planetaria del contenuto di ozono e di altre specie mediante strumenti basati su misure radiometriche (SAGE, TOMS). La tecnica di osservazione al lembo, che nel caso dallo strumento SAGE utilizza l'occultazione del Sole, è stata estesa negli ultimi anni a una nuova generazione di strumenti che utilizzano l'emissione termica dell'atmosfera (MLS, MIPAS) e combinano la misura della distribuzione in quota ottenuta con l'osservazione al lembo con l'estesa copertura geografica resa possibile dalle misure continue fatte in emissione.
Inoltre mediante l'uso di radar ottici (LIDAR) si possono ricavare da terra profili di ozono e di altre specie importanti. Misure di eccezionale sensibilità si ottengono mediante spettroscopi nel medio e lontano infrarosso, montati su palloni.
La chimica omogenea dell'ozono atmosferico
La concentrazione dell'ozono nell'atmosfera è determinata dall'equilibrio tra processi di formazione, distruzione e trasporto. Nella stratosfera l'equilibrio è fondamentalmente dovuto a una serie di reazioni chimiche e fotochimiche studiate inizialmente, nel 1930, da Sydney Chapman e costituenti il cosiddetto modello di Chapman:
[1] O2 + hν (λ 〈 242 nm) = 2O (3P)
[2] O2 + hν (λ 〈 175 nm) = O (3P) + O (1D)
[3] O + O2 + M = O3 + M + 24 (kcal/mole)
[4] O3 + hν = O + O2
[5] O + O3 = O2 + O2 + 94 (kcal/mole)
[6] O + O + M = O2 + M + 118 (kcal/mole)
essendo h la costante di Planck, ν e λ, rispettivamente, la frequenza e la lunghezza d'onda del fotone assorbito; M indica una specie molecolare di fondo (di fatto, N2).
Le reazioni [1], [2] e [4] esprimono la capacità della radiazione solare di lunghezza d'onda appropriata di fotodissociare sia l'O2 sia l'O3. In particolare, uno dei due atomi di ossigeno prodotti dalla reazione [2] si trova nello stato eccitato O(1D) e ha un elevato grado di reattività. Ricordiamo che nelle reazioni di fotodissociazione il numero di particelle della specie A formate al secondo in un volume unitario d'aria può essere espresso in funzione della densità numerica nAB della specie molecolare AB che viene fotodissociata, come
[7] formula
dove l'integrale misura la probabilità che la molecola AB venga fotodissociata nell'unità di tempo, φ è la densità spettrale di flusso fotonico, σAB è la sezione d'urto della specie AB. I flussi fotonici, a loro volta, sono dati da espressioni integrali, poiché dipendono dall'assorbimento dell'intensità della radiazione, dalla diffusione, e così via.
Metodi di misurazione
Le caratteristiche spettroscopiche dell'ossigeno nelle varie forme sono alla base sia della complessa fotochimica che ha luogo nella stratosfera, sia dei metodi di misurazione e di telemisurazione utilizzati per la determinazione del contenuto atmosferico delle varie specie.
Misurazioni in situ
Per determinare in situ il contenuto di gas secondari e di particolato (aerosol) e altre grandezze fisiche di interesse per l'ozono si utilizzano metodi basati sull'assorbimento e la diffusione della radiazione elettromagnetica, che vengono classificati come metodi passivi oppure metodi attivi, a seconda che la sorgente di radiazione sia naturale oppure artificiale; a loro volta, i metodi passivi possono essere classificati come metodi di assorbimento oppure metodi in emissione. Sarebbe auspicabile conoscere per le varie specie il contenuto totale nella colonna d'aria, il profilo verticale della concentrazione, nonché le variazioni geografiche e temporali di queste grandezze.
Tra le apparecchiature adatte per la misurazione in situ del contenuto di ozono menzioniamo le celle elettrochimiche, il cui principio di funzionamento (Brewer) è riportato di seguito. L'aria contenente ozono passa in una cella elettrolitica con anodo d'argento, contenente una soluzione di ioduro di potassio, inserita in un circuito con un generatore di tensione; il passaggio dell'ozono provoca una serie di reazioni, qui omesse per semplicità, a seguito delle quali si determina un passaggio di corrente la cui intensità è proporzionale alla quantità di ozono. Celle compatte e leggere vengono correntemente utilizzate con palloni sonda di spinta ridotta. Il metodo non è adatto a sondaggi a quote maggiori di 30 km, dove, a causa della riduzione della pressione e dell'abbassamento della temperatura, la soluzione può evaporare o ghiacciare.
Telemisurazioni
La determinazione da terra del contenuto di varie specie può essere effettuata con metodi spettrofotometrici di telemisurazione passiva in assorbimento, osservando l'estinzione della radiazione solare nell'attraversamento dell'atmosfera. Questi metodi furono introdotti nello studio dell'ozono da Charles Fabry ed Henri Buisson, che nel 1921 utilizzarono lastre fotografiche per la rivelazione, e successivamente perfezionati da Gordon M. Dobson con l'impiego di rivelatori fotoelettrici. Il principio di funzionamento dello strumento ideato da Dobson è basato sull'assorbimento differenziale. Un doppio spettroscopio isola due ristrette regioni spettrali nell'ultravioletto, scelte in modo che la radiazione a lunghezza d'onda maggiore è poco affetta dall'assorbimento dovuto all'ozono, mentre quella a lunghezza d'onda minore è fortemente assorbita; le osservazioni sono effettuate puntando lo strumento verso il Sole oppure verso lo zenit. La misura del rapporto tra le intensità della radiazione ricevuta nelle due regioni spettrali permette di calcolare la quantità di ozono attraversata dalla radiazione solare e quindi il contenuto colonnare, conoscendo l'angolo zenitale del Sole. Lo strumento consente anche di ricavare in modo approssimato la distribuzione verticale dell'ozono mediante il metodo Umkehr. Questo metodo, introdotto da Paul Götz, si basa sull'osservazione che la radiazione diffusa allo zenit è relativamente più intensa alle lunghezze d'onda minori quando l'angolo zenitale solare è prossimo a 85° rispetto a quando tale angolo è minore. Ciò è dovuto al diverso peso di due effetti con la quota: la diminuzione della densità dell'aria, da cui dipende l'intensità della diffusione, e il diverso percorso della radiazione solare e quindi il diverso assorbimento nel percorso Sole-volume diffondente-osservatore; ne consegue che il rapporto tra le due intensità ha un tipico andamento con l'angolo zenitale solare, dal quale è possibile ottenere il profilo dell'ozono attraverso una complessa procedura d'inversione. Le misure ottenute con il metodo Umkehr risultano in buon accordo con contemporanee misure ottenute con sonde elettrochimiche.
Profili della concentrazione dell'ozono e di altre specie possono essere ottenuti utilizzando, invece della radiazione solare, la radiazione coerente emessa da sorgenti laser, cioè utilizzando LIDAR (Light imaging detection and ranging), che sono radar ottici, con sorgenti laser di opportuna lunghezza d'onda e un telescopio che riceve la luce retrodiffusa dalle particelle presenti nell'atmosfera. Tali strumenti sono largamente utilizzati per la rivelazione degli aerosol; essi, in particolare, consentono di seguire l'evoluzione delle nubi stratosferiche nella notte polare, quando altri metodi di telemisurazione non sono in grado di funzionare. Profili della concentrazione dell'ozono e di altre specie possono essere ottenuti utilizzando un LIDAR che misura contemporaneamente a due o più lunghezze d'onda diversamente assorbite dalla specie misurata. Questa tecnica di assorbimento differenziale è detta DIAL (Differential absorption lidar).
All'incirca dal 1982 sono in funzione strumenti installati su satelliti, che forniscono con relativa continuità informazioni globali sulla concentrazione dell'ozono. Osservazioni vengono effettuate principalmente dalla NASA con strumenti affini agli spettrofotometri Dobson detti TOMS (Total ozone monitoring system) che dall'alto osservano la riflettività diffusa della superficie e dell'atmosfera terrestri (albedo) in funzione della lunghezza d'onda, oppure mediante strumenti che utilizzano l'occultazione del Sole per fornire profili verticali della concentrazione dell'ozono (SAGE, Stratospheric aerosol and gas experiment).
La tecnica dell'osservazione al lembo, di cui fanno parte le misure per occultazione, consiste nell'analisi del segnale emesso o assorbito dall'atmosfera lungo una linea di vista orizzontale prossima alla superficie terrestre. A causa della curvatura terrestre la linea di vista penetra nell'atmosfera fino a una distanza minima dalla superficie e poi riemerge nuovamente verso lo spazio. La distanza minima è detta altezza di tangenza in quanto in quel punto la linea di vista è tangente a una superficie ideale a quota costante. Il segnale osservato è determinato in modo preponderante dalle proprietà dell'atmosfera all'altezza di tangenza dove il percorso è più lungo e dove anche la densità atmosferica è maggiore rispetto alle altre quote attraversate. Una sequenza di osservazioni fatte ad altezze di tangenza contigue consente di ricavare con opportune tecniche d'inversione il profilo in altezza della concentrazione delle specie osservate. La risoluzione verticale ottenuta con il metodo della misura al lembo è tipicamente dell'ordine di 3 km. Questa risoluzione è nettamente inferiore a quanto ottenuto con le misure dei palloni sonda e con gli strumenti DIAL ma si ricava con strumenti operanti da satellite che possono contemporaneamente fornire una misura globale su tutto il pianeta.
Nel 2002 è stato lanciato dall'ESA (European Space Agency) il satellite Envisat con a bordo tre strumenti per lo studio dell'atmosfera che misurano ciascuno l'ozono atmosferico con il metodo di osservazione al lembo. Questi strumenti utilizzano tre tecniche diverse (emissione atmosferica, occultazione stellare, radiazione solare scatterata) che forniscono misure più frequenti rispetto all'occultazione solare e consentono di avere mappe tridimensionale della distribuzione dell'ozono.
La distribuzione osservata dell'ozono
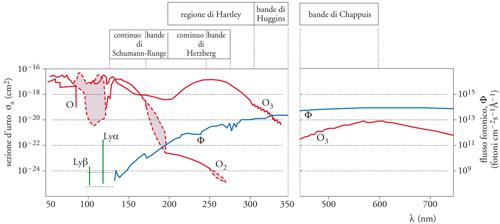
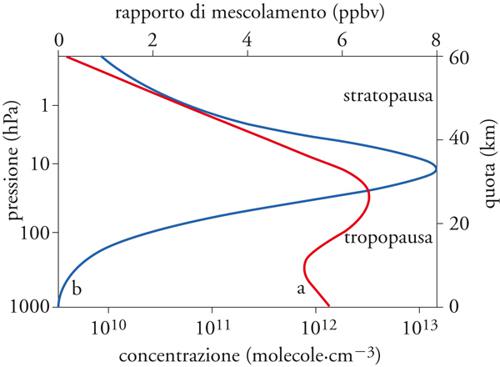
A titolo esemplificatore di misurazioni di base, la fig. 2 indica la sezione d'urto in assorbimento di O, O2, O3, in funzione della lunghezza d'onda, nonché il flusso fotonico solare incidente all'esterno dell'atmosfera; si riconoscono, per l'O2, i continui e le bande, rispettivamente, di Schumann di Runge e di Herzberg: nei due continui l'energia fotonica è responsabile della fotodissociazione di O2 con la formazione di atomi, rispettivamente, nello stato fondamentale (3P) o eccitato (1D) della [2]. Analogamente, la fig. 3 mostra i profili verticali medi di concentrazione dell'ozono, espressi sia come densità numerica (in numero di molecole per cm3), sia come rapporto di mescolamento in volume relativo (in parti per miliardo in volume, ppbv); il massimo del rapporto di mescolamento si trova a circa 30 km di quota, mentre la pressione parziale dell'ozono ha un massimo intorno a 25 km di quota.
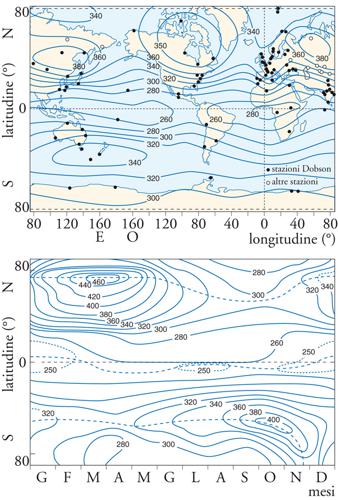
Nel nostro caso conviene prendere in esame i risultati delle osservazioni globali del contenuto di ozono e vedere in quale misura l'interpretazione basata sulla semplice teoria di Chapman si possa considerare soddisfacente. Nella fig. 4 è riportata la distribuzione globale media dell'ozono totale per il periodo 1958-1977 e la variazione media in funzione della latitudine e della stagione. L'unità di misura è l'unità Dobson, pari a 0,001 atm∙cm; questo particolare modo di esprimere la massa di un componente atmosferico indica l'altezza in centimetri che avrebbe lo strato di ozono se fosse ridotto alla pressione di un'atmosfera. Essendo un'unità Dobson pari a un millesimo di cm, 300 unità Dobson corrispondono a uno spessore di 3 mm.
La distribuzione globale mostra valori minimi nelle zone equatoriali e valori massimi nelle zone subpolari. Ciò non è in accordo con quanto ci si attenderebbe sulla base del modello di Chapman, che prevede concentrazioni maggiori nelle zone equatoriali, dove la fotochimica è più intensa a causa della maggiore insolazione.
Tale discrepanza è dovuta al fatto che la teoria di Chapman non tiene conto degli effetti della circolazione dell'atmosfera sul trasporto dell'ozono. Difatti i massimi alle alte latitudini sono dovuti al trasporto dell'ozono dall'alta stratosfera equatoriale, dove vi è la maggior produzione di ozono, alla bassa e media stratosfera nelle regioni polari, dove l'ozono risulta relativamente inerte dal punto di vista fotochimico. Il massimo delle alte latitudini è maggiore nell'emisfero Nord che nell'emisfero Sud a causa del più efficace mescolamento orizzontale che si ha in quell'emisfero, e ciò è a sua volta una conseguenza del diverso rapporto terre emerse-oceano (si noti, peraltro, la scarsa densità di stazioni di rilevamento nell'emisfero australe). Per la variazione media, si vede un forte massimo a circa 70° N nel periodo primaverile e un massimo simile, ma a latitudine minore e meno intenso, nell'emisfero Sud.
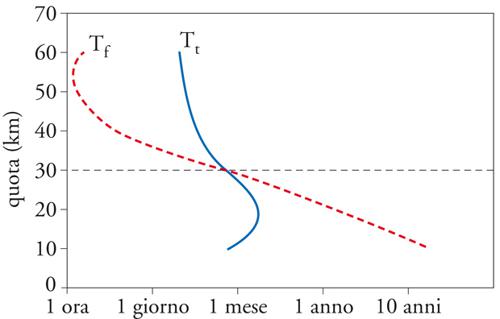
Molto importanti sono i dati illustrati nella fig. 5, cioè i tempi caratteristici teorici dell'ozono in funzione della quota: questi tempi rappresentano il rapporto tra con-tenuto totale e sorgente. La figura mostra separatamente i risultati prendendo in esame la sola fotochimica (Tf) ovvero il solo trasporto (Tt). A una quota di circa 30 km (indicata nella figura da una riga tratteggiata orizzontale) cambia il meccanismo predominante che è fotochimico ad alta quota e di trasporto a bassa quota. Si vede come da un punto di vista fotochimico l'ozono è praticamente inerte (T ≥ 10 anni) nella troposfera.
I cicli catalitici e i clorofluorocarburi
Le reazioni [1]÷[6] del modello di Chapman coinvolgono solo l'ossigeno, sotto varie forme, ed energia sotto forma di calore e di radiazione. L'esistenza nella stratosfera di molte altre specie chimiche rende il fenomeno più complesso.
Importante è anche il ruolo dei radicali liberi, che, prodotti nell'atmosfera per decomposizione fotochimica, manifestano la capacità di spostare gli equilibri di altre specie. In particolare, la concentrazione dell'ozono può essere fortemente condizionata da cicli catalitici, espressi genericamente nella forma seguente:
[8] formula.
Il catalizzatore X è rappresentato da specie quali H, OH, NO, NO2, Cl e Br, presenti nell'atmosfera in quantità ridottissime. I gas OH e H hanno origine dal metano e dal vapor d'acqua, gli NOx (NO e NO2) dallo N2O prodotto dalla biosfera, il Cl e il ClO prevalentemente da prodotti industriali, come il cloruro di metile (CH3Cl), il tetracloruro di carbonio (CCl4) e i clorofluorocarburi (CFC o freon), mentre il bromo ha origine dagli Halon, anch'essi di produzione industriale. La caratteristica del catalizzatore è d'intervenire nella catena di reazioni chimiche uscendone alla fine inalterato; la sua presenza anche in piccole quantità, in certi casi può spostare gli equilibri fino alla scomparsa di alcune specie chimiche.
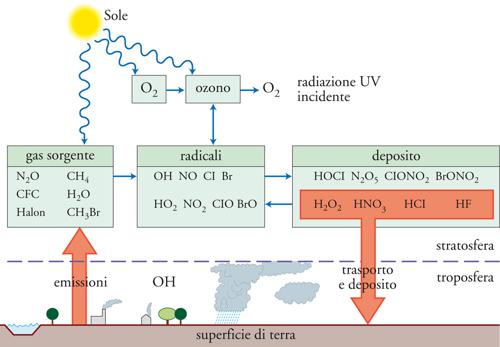
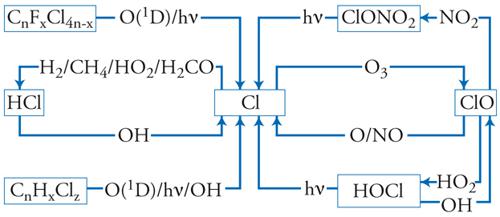
Pertanto, come riassunto nella fig. 6, la chimica dell'ozono è controllata oltre che dalle reazioni fotochimiche di Chapman anche da reazioni distruttive di tipo catalitico causate da alcuni radicali che si formano nella stratosfera a seguito della scomposizione di alcuni gas sorgente di origine troposferica che raggiungono la stratosfera attraverso moti convettivi. I radicali possono essere sottratti temporaneamente dalle reazioni catalitiche attraverso la formazione di alcuni gas deposito che legano fra di loro i radicali. Alcuni dei gas deposito, grazie alla loro solubilità, sono intrappolati in nubi stratosferiche e trasportati per deposizione dalla stratosfera alla troposfera.
I gas sorgente possono essere di origine naturale o antropica. Tipicamente naturale è il vapore acqueo che, favorendo la formazione del radicale OH, introduce un importante meccanismo di contenimento della concentrazione dell'ozono ad alta quota, come descritto per la prima volta da David Bates e Marcel Nicolet nel 1950.
Ricerche sull'azione catalitica degli ossidi dell'azoto furono avviate negli anni Settanta, motivate dal timore che un sostanziale aumento del numero di aeroplani operanti a quote stratosferiche potesse determinare una riduzione della concentrazione dell'ozono.
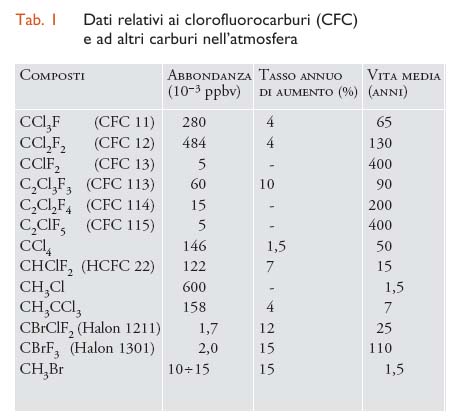
Richard S. Stolarsky e Ralph J. Cicerone hanno per primi preso in considerazione il ciclo catalitico del cloro come meccanismo di distruzione dell'ozono, ma questo ciclo ha acquistato importanza a seguito della successiva pubblicazione con cui Frank S. Rowland e Mario J. Molina nel 1974 segnalavano che la maggiore sorgente di Cl e dei suoi ossidi in stratosfera poteva essere la fotodissociazione dei freon e degli Halon. Questi sono composti organici alogenati molto stabili nella bassa atmosfera, dove la componente spettrale della radiazione in grado di decomporli è assente; trovano un largo impiego nei processi industriali, nella refrigerazione, nei dispositivi antincendio, nelle plastiche termoisolanti, ma anche per usi non essenziali (confezioni spray ecc.). La famiglia dei CFC comprende primariamente il CFC-11 (CFCl3) e il CFC-12 (CF2Cl2), le cui vite medie nell'atmosfera sono stimate, rispettivamente, intorno a 80 anni e a 170 anni (tab. 1).
Nei paesi industrializzati dell'Occidente i consumi di CFC erano alla fine degli anni Settanta di circa 1 kg per abitante all'anno ed era plausibile che, con il migliorare del tenore di vita, questi valori potessero divenire tipici per l'intera popolazione mondiale, portando il tasso d'immissione globale a 0,1÷1 ppbv all'anno.
Dati i lunghi tempi di residenza di tali sostanze nell'atmosfera, il contenuto totale in cloro equivalente, che nell'era preindustriale era pari a 0,7 ppbv, mentre alla fine degli anni Settanta era di circa 2,5÷2,8 ppbv, dopo 100 anni avrebbe potuto essere paragonabile alla massa stessa di ozono, che, mediata su tutta l'atmosfera, è dell'ordine di 100 ppbv.
Queste proiezioni sono state motivo di preoccupazione per il possibile indebolimento della protezione fornita dall'ozono stratosferico. L'allarme è stato però ben presto ridimensionato dalla individuazione per il cloro di un efficace gas deposito, il ClONO2, che sottrae la maggior parte dei radicali del cloro dall'azione catalitica distruttiva riducendo allo stesso tempo anche l'effetto dei radicali dell'azoto. Questo meccanismo di contenimento, che ha spiegato la mancata manifestazione della distruzione d'ozono alle medie latitudini nella misura prevista da Rowland e Molina, agisce però solo in modo discontinuo nelle regioni polari dove, come discusso nel prossimo paragrafo, si forma il buco dell'ozono.
Il buco antartico
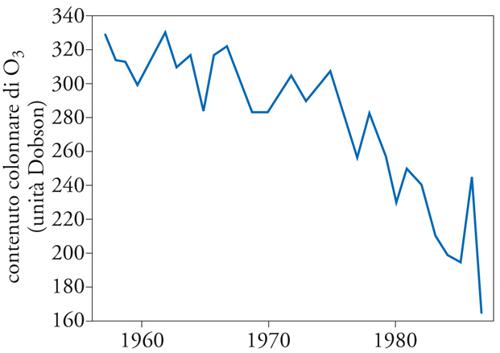
Anomalie nell'andamento stagionale del contenuto colonnare di ozono osservato nella stazione antartica giapponese Syowa venivano riportate nel 1984 da Shigeru Chubachi. Nel 1985 Joseph C. Farman e i suoi collaboratori del British Antarctic Survey mettevano in evidenza la progressiva e sostanziale diminuzione del contenuto colonnare di ozono nella stazione di Halley Bay: il fenomeno si manifestava in occasione della primavera antartica, e cioè nel periodo settembre-ottobre, con regolarità e ampiezza crescente a partire dal 1979 (fig. 8). Tali risultati erano attribuiti all'effetto catalitico del cloro presente nella stratosfera in seguito alla fotodissociazione dei CFC e furono prontamente confermati dalle osservazioni effettuate mediante TOMS. Nel 1987 la riduzione dell'ozono nei mesi di settembre-ottobre raggiungeva livelli del 55% nell'intera colonna e intorno al 100% in un ristretto intervallo di quote. L'entità, l'estensione geografica e il carattere progressivo del fenomeno costituirono un segnale inatteso e allarmante.
Bisogna osservare, a questo riguardo, che le zone antartiche sono caratterizzate dalla concorrenza di alcune situazioni particolari rispetto al resto del pianeta: (a) il ritmo semestrale nell'assenza o presenza della radiazione solare; (b) la relativa regolarità geografica dell'emisfero Sud, evidenziata dall'ininterrotta estensione degli oceani in un'ampia fascia di latitudini; nell'inverno antartico la circolazione è caratterizzata dalla presenza di un vortice stabile e regolare, senza le perturbazioni tipiche dell'emisfero settentrionale che producono un continuo rimescolamento di masse d'aria tra le diverse latitudini; (c) nella stratosfera antartica si raggiungono temperature invernali estremamente basse, tali da consentire la condensazione dell'acido nitrico e dell'acqua, dando luogo alla formazione di nubi stratosferiche polari (che coincidono con le cosiddette nubi madreperlacee che erano state osservate fin dall'Ottocento). In sostanza, nella lunga notte invernale, l'Antartide è un sistema isolato dal punto di vista sia radiativo sia dinamico e la sovrastante stratosfera si comporta come un grande e ideale reattore chimico; ne consegue che essa è un luogo ove gli equilibri sono più delicati e dove le tendenze climatiche dovrebbero manifestarsi in anticipo e con maggiore evidenza.
Campagne di misurazione effettuate nelle zone polari hanno posto in risalto il ruolo delle nubi stratosferiche polari nel convertire i composti del cloro da forme non attive a forme attive. Una scoperta importante è stata il rilevare all'interno del vortice antartico concentrazioni di ClO 500 volte maggiori che all'esterno. La grande quantità di Cl e di ClO può essere giustificata mediante reazioni eterogenee tra ClONO2 e H2O e tra HCl e NO2 in presenza di nubi polari formate dalla solidificazione dell'acido nitrico 3-idrato (HNO3 + 3H2O). La deposizione del condensato formatosi in queste nubi provoca una denitrificazione della stratosfera. Al termine della notte polare, la presenza della radiazione e di elevate concentrazioni di cloro in forma attiva per il mancato effetto inibitore dell'azoto innesca la catena di reazioni catalitiche illustrata nella fig. 9. Di fatto, nella stratosfera antartica il processo catalitico descritto dalle reazioni [8] con X=Cl risulta poco importante, a causa della ridotta presenza di ossigeno; viceversa, sembra più efficace un ciclo basato sul dimero Cl2O2.
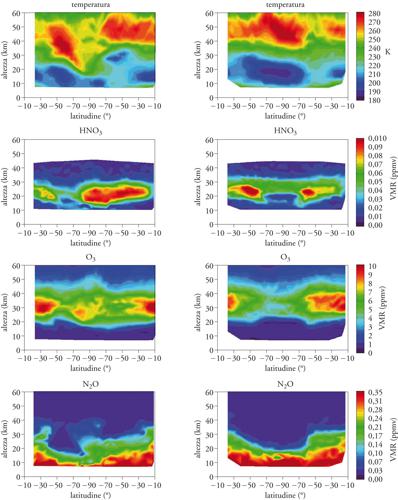
Come esempio dei processi che avvengono nell'atmosfera antartica la fig. 10 mostra il confronto fra la composizione dell'atmosfera nel 2002 e nel 2003. In questi due anni il vortice polare antartico ha avuto comportamenti completamente diversi: nel 2002 il vortice è stato perturbato e si è frammentato generando un buco dell'ozono frastagliato e di intensità ed estensione ridotta; nel 2003 il vortice è stato invece regolare e intenso e sono state raggiunte un'intensità e un'estensione elevata del buco dell'ozono. La figura mostra le misure effettuate dallo strumento MIPAS (Michelson interferometer for passive atmospheric sounding) operante su Envisat in un giorno tipico nel 2002 e alla stessa data nel 2003. Per ciascuna delle grandezze osservate (temperatura, HNO3, ozono e N2O) è mostrata una mappa con una sezione verticale dell'atmosfera fra 0 e 60 km lungo un meridiano a partire da −10° di latitudine passando dal polo Sud a −90° e risalendo nuovamente lungo il meridiano opposto fino a −10°. Il valore della grandezza è visualizzato attraverso una scala di colori.
Nel caso della temperatura, nel 2002 si osserva un certo rimescolamento che rende irregolare la variazione della temperatura in funzione della quota e della latitudine e impedisce il raggiungimento di valori estremi, mentre nel 2003 la stabilità del vortice rende possibile un raffreddamento più intenso. Questa temperatura è rappresentativa di quanto è avvenuto anche nelle settimane precedenti con importanti conseguenze per la concentrazione dell'acido nitrico (HNO3). A temperature inferiori ai 185 K si sono formate le nubi polari stratosferiche che hanno provocato una denitrificazione. Come si vede nella mappa dell'HNO3 il massimo della denitrificazione avviene intorno ai 18 km di quota e coincide sempre con i minimi di temperatura. Le diverse temperature raggiunte nei due anni fanno sì che la denitrificazione sia estesa nel 2003 e sia circoscritta a una piccola area nel 2002. In corrispondenza delle zone in cui si è verificata la denitrificazione si osserva un depauperamento dell'ozono e quest'ultimo è conseguentemente più esteso nel 2003.
Tuttavia, nel 2003 si osserva mediamente anche una maggiore riduzione dell'ozono a quote superiori ai 25 km. In questo caso la denitrificazione non può essere la causa e l'effetto osservato è molto probabilmente dovuto alla subsidenza di masse d'aria ad alta quota povere di ozono. La diversa subsidenza nei due anni può essere osservata nelle ultime mappe che mostrano il perossido d'azoto (N2O): esso si forma a bassa quota e viene lentamente distrutto ad alta quota. Questa caratteristica lo rende un ottimo tracciante che consente di distinguere le masse d'aria di origine troposferica (alta concentrazione di N2O) da quelle di origine stratosferica (bassa concentrazione di N2O). Dalla distribuzione del perossido di azoto si deduce che nel 2002 la subsidenza è stata localizzata pur avendo avuto una grande capacità di penetrazione (si notano significative riduzioni di N2O anche a bassa quota) mentre nel 2003 la subsidenza è stata lenta, ma di maggiore estensione.
L'intensa ed estesa riduzione dell'ozono antartico del 2003 è pertanto il risultato di due diversi meccanismi: la denitrificazione a bassa quota e la subsidenza ad alta quota, che hanno una causa comune nelle proprietà del vortice polare.
Aspetti evolutivi dell'ozono
Ci si può chiedere perché il buco nell'ozonosfera si sia manifestato solo nell'emisfero Sud e non nell'emisfero Nord: la spiegazione è che, come detto sopra, la circolazione atmosferica nell'emisfero Nord è molto più varia e il sistema non ha le stesse caratteristiche di isolamento, le temperature sono più alte e le nubi stratosferiche vengono osservate con minore frequenza. Con l'avvento di più frequenti e dettagliate osservazioni anche in Artide è stata osservato un processo di depauperamento dell'ozono secondo meccanismi analoghi a quelli antartici, tuttavia la dimensione e l'entità in Artide sono decisamente inferiori.
Alle latitudini medie i segnali rappresentativi di un possibile cambiamento sono appena percettibili, però la sensibilità e il dettaglio delle misure acquisite hanno consentito di mettere in evidenza una riduzione media di circa il 3% nel 2000 rispetto al 1980 della colonna di ozono alle latitudini comprese fra 60° N e 60° S.
Normativa e proiezioni evolutive
La gravità del problema dell'assottigliamento dell'ozonosfera, riconosciuta internazionalmente in una Convenzione dell'UNEP (United Nations Environment Programme) firmata a Vienna nel 1985, ha spinto vari paesi, tra cui l'Italia e i principali produttori, ad accordarsi su misure restrittive nel consumo e nella produzione di alcuni tipi di freon e di Halon. Tali misure sono contenute in un Protocollo della Convenzione, firmato a Montreal nel 1987 e operativo dal 1989, al quale è seguita una serie di emendamenti sempre più restrittivi. Tale Protocollo impegna le nazioni firmatarie a bandire gli usi superflui e a ridurre progressivamente gli altri usi sostituendo i CFC con i meno dannosi idrocloroflourometani (HCFC). Sono stati inoltre posti dei vincoli al commercio con i paesi non firmatari ed è stata fatta un'eccezione per i paesi in via di sviluppo dove i consumi annui sono limitati a 0,3 kg/abitante. A seguito di questi accordi internazionali il consumo mondiale dei CFC è passato da oltre un milione di tonnellate nel 1986 a meno di centomila tonnellate nel 2000.
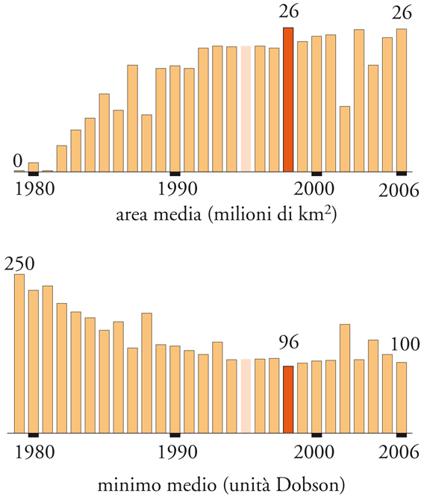
Nonostante la macroscopica riduzione dei consumi gli effetti in atmosfera sono destinati a manifestarsi lentamente a causa delle lunghe costanti di tempo dei processi coinvolti. È iniziata dopo il 2000 una piccola riduzione della concentrazione dei CFC in troposfera, e la crescita del fenomeno del buco dell'ozono è stata arrestata. La fig.11 mostra l'entità del buco dell'ozono in termini di estensione e depauperamento dal 1980 al 2006. Dopo il rapido aggravarsi che è continuato fino ai primi anni Novanta del secolo scorso la situazione è divenuta stazionaria con fluttuazioni che impediscono di rilevare il segno della tendenza degli ultimi anni.
È previsto che l'evoluzione del fenomeno possa dipendere dai cicli solari e dai cambiamenti di temperatura, trasporto e composizione che avvengono nell'atmosfera. Pertanto, pur confermando che il rischio di un pericoloso assottigliamento dello scudo d'ozono è scongiurato e prevedendo una lenta scomparsa del buco dell'ozono antartico, la variabilità dell'atmosfera rende difficile la previsione di quali saranno i tempi del recupero e quali saranno le condizioni d'equilibrio verso cui l'ozono sta evolvendo.
Bibliografia
Horváth 1985: Horváth, Márton - Bilitzkj, László - Hüttner, Jenoe, Ozone, Amsterdam, Elsevier, 1985.
Nicolet 1978: Nicolet, Marcel, Étude des réactions chimiques de l'ozone dans la stratosphère, Bruxelles, Institut Royal Météorologique de Belgique, 1978.
Visconti 1989: Visconti, Guido, L'atmosfera, Milano, Garzanti, 1989.