Microbiologia industriale
Microbiologia industriale
L’uso biotecnologico dei microrganismi ha radici antichissime, in particolare per le cosiddette biotecnologie classiche che sfruttano i microrganismi per la trasformazione spontanea delle materie prime alimentari. Fanno parte di questo vasto e ormai antico insieme di utilizzi la fermentazione di succhi zuccherini ottenuti da frutta, la produzione di aceto, di diversi tipi di latte fermentato e di formaggi.
L’identificazione degli agenti responsabili di tali processi è all’origine delle moderne biotecnologie, sistemi di trasformazione pilotati e controllati che hanno avuto un vorticoso sviluppo nel corso degli ultimi due secoli. Uno degli esempi più significativi in questo senso è costituito dalla messa a punto del processo di produzione della birra: solo nel 1883, Emil Christian Hansen presso la Carlsberg in Danimarca, ha allestito il processo di birrificazione impiegando per la prima volta una coltura pura di un ceppo di lievito, segnando una decisa evoluzione per una produzione dalle radici molto antiche, risalenti già ai Sumeri.
Poco prima di Hansen, nel 1846, era già stato messo a punto, in Austria, il processo di produzione di lievito da impiegare specificatamente nella panificazione. Tuttavia, sono le ricerche di Louis Pasteur sulla fermentazione lattica e alcolica a essere considerate come pietra miliare per la nascita della microbiologia industriale. Con i suoi studi Pasteur dimostrò che la produzione di vino, birra e altri processi fermentativi sono di origine microbica e non processi chimici. Tuttavia, solo alla fine del XIX sec. si è passati da processi condotti in sistemi non isolati (vale a dire non sterili), a processi realizzati in condizioni controllate (in sterilità). In seguito, tra il 1900 e il 1940, sono stati messi a punto processi che hanno consentito di ottenere numerosi prodotti su larga scala, quali i solventi acetone e butanolo e gli acidi organici (in particolare l’acido citrico).
A partire dagli anni della Seconda guerra mondiale, le biotecnologie sono state protagoniste dello sviluppo dei processi di produzione industriale di penicillina e altri antibiotici, mentre dagli anni Ottanta del Novecento l’interesse commerciale dei processi fermentativi si è spostato verso piccoli volumi di prodotti ad alto valore aggiunto, in particolare alcune molecole ad attività biologica da impiegare per la prevenzione o la cura di diverse patologie. Inoltre, grazie a tecniche genetiche è stato possibile modificare microrganismi allo scopo di ottenere molecole normalmente prodotte dalle cellule animali, quali l’insulina, l’ormone della crescita, l’interferone e così via. Le applicazioni di tali tecnologie hanno avuto un impatto importante sull’industria fermentativa, rappresentando un deciso cambiamento qualitativo, poiché non sarebbe stato possibile raggiungere questi risultati con le tecniche tradizionali.
I prodotti della microbiologia industriale
L’applicazione tecnologica deliberata e controllata di agenti biologici semplici, quali i microrganismi o loro componenti, consente di ottenere beni e servizi, grazie all’integrazione di discipline tecnologiche e scientifiche (fig. 2).
L’ampia eterogeneità del metabolismo microbico rende potenzialmente possibile ottenere un’ampia gamma di prodotti. Sfruttando il metabolismo anaerobico è, per esempio possibile ottenere prodotti accumulati spontaneamente dalle cellule microbiche, quali gli acidi lattico, propionico e butirrico. Diverso significato hanno invece i prodotti del metabolismo aerobico, che occupano una posizione importante nel mercato dei prodotti ottenibili da microrganismi. A questa classe appartengono prodotti molto diversi tra loro, ottenibili sia dal metabolismo microbico primario, sia dal metabolismo secondario biosintetico.
I prodotti del metabolismo primario, essenziali per la vita e la riproduzione della cellula, possono essere suddivisi in diverse classi in funzione delle loro caratteristiche. Tra questi prodotti sono comprese le stesse cellule e i loro costituenti, nonché gli intermedi metabolici, che possono essere prodotti in eccesso rispetto alle esigenze fisiologiche e accumulati all’interno o all’esterno della cellula. I prodotti ottenibili dal metabolismo secondario, che non sono invece essenziali per lo sviluppo e la riproduzione cellulare, sono generalmente accumulati all’esterno della cellula e non sempre hanno un chiaro significato metabolico o una funzione a livello cellulare.
Biomasse microbiche
La classe di prodotti più facilmente ottenibile è costituita dalle biomasse cellulari, risultato di reazioni degradative-energetiche (catabolismo) e assimilative-biosintetiche (anabolismo), ottenute in funzione del loro contenuto o della loro attività. Le biomasse microbiche vengono utilizzate integralmente per l’alimentazione animale o come integratori dietetici per l’uomo, per il loro contenuto in proteine, vitamine e sali minerali, e sono ottenute grazie all’impiego, come substrati di sottoprodotti del settore agro-industriale o di surplus agricoli. Le biomasse microbiche possono costituire una valida alternativa alle fonti proteiche convenzionali, in quanto caratterizzate da un contenuto proteico sulla sostanza secca del 50÷80% nei batteri, 45÷60% nei lieviti, 30÷55% nelle muffe e 45÷60% nelle alghe.
Esempi di biomasse ottenibili con processi microbiologici e impiegabili per l’alimentazione animale sono rappresentati da Candida utilis (lievito) da substrati zuccherini, Methylococcus capsulatus (batterio) da gas naturale, Paecilomyces variotii (muffa) da liscivio solfitico, residuo della lavorazione del legname. Tra le biomasse microbiche utilizzate per l’alimentazione umana troviamo Saccharomyces cerevisiae, impiegabile come integratore in virtù del suo contenuto di sali minerali e vitamine del gruppo B, i funghi a carpoforo e la biomassa ottenibile dal processo QuornTM.
La messa a punto del processo per la produzione di funghi a carpoforo (comunemente conosciuti come funghi), a partire dalla fine del XVII sec. in Francia, ha consentito di ottenere prodotti quali Agaricus bisporus, compresa la varietà hortensis (commercialmente conosciuti come champignon), Pleurotus ostreatus (orecchietta), Lentinula edodes (conosciuto come shiitake), Volvariella volvacea (fungo cinese). Per altri generi simbionti quali le specie di Boletus (che comprende anche il porcino) e di Tuber (funghi ipogei, meglio conosciuti come tartufi), approfondite ricerche hanno permesso di individuare i rapporti intercorrenti tra fungo e piante, consentendo di riprodurre i processi naturali grazie a protocolli di infezione delle radici di specifiche piante con le spore fungine. Tali piante, in seguito messe a dimora, dovrebbero favorire lo sviluppo di funghi quali porcini e tartufi.
Nel processo QuornTM è stata messa a punto la produzione di una biomassa fungina per alimentazione umana da un ceppo di Fusarium venenatum, impiegabile come fonte di proteine in alternativa alla carne. Privi di colesterolo, i prodotti a base di questa micoproteina sono commercializzati in alcuni Paesi, proposti in forme che ricordano l’aspetto della carne, grazie al fatto che la struttura microfilamentosa allineata ne simula le fibre.
Per estrazione da biomasse microbiche possono essere inoltre ottenuti metaboliti diversi, quali lisati cellulari (per es., proteico-vitaminici), enzimi, lipidi, acidi nucleici e loro derivati, impiegabili nei settori alimentare e farmaceutico.
Le biomasse microbiche possono essere anche prodotte e impiegate in forma vitale per la loro attività svolta in ambienti complessi, quali quelli del settore alimentare, o in biotrasformazioni su substrati specifici. Una delle principali applicazioni è costituita dalla produzione di Saccharomyces cerevisiae, lievito impiegato nella panificazione per la sua peculiare capacità fermentativa. Occorre inoltre ricordare le colture starter impiegate in numerose produzioni alimentari, quali il settore caseario e l’enologico, nonché le biomasse applicate in agricoltura (colture azotofissatrici e insetticide).
Metaboliti primari
A questa classe appartengono i prodotti finali o intermedi del metabolismo energetico, che vengono prevalentemente riversati all’esterno della cellula, nel mezzo colturale, dal quale avviene l’estrazione e la purificazione. Questi prodotti possono derivare dal metabolismo anaerobico, come prodotti finali, per esempio acido lattico da Lactobacillus, acido propionico da Propionibacterium e acido butirrico da Clostridium. Per il ruolo che ricoprono a livello metabolico, questi prodotti sono accumulati spontaneamente, anche in concentrazioni significative: il Lactobacillus delbrüeckii, ssp. bulgaricus, per esempio, può produrre acido L-lattico con una concentrazione di 130÷140 g di acido per litro di coltura.
Altri acidi organici, per esempio l’acido citrico, sono invece ottenibili dal metabolismo aerobico, direttamente come intermedi del ciclo degli acidi tricarbossilici TCA (o ciclo di Krebs). Altri ancora, come l’acido itaconico, sono sintetizzati a partire da intermedi quali il cis-aconitato. Gli intermedi del ciclo del TCA non sono tuttavia spontaneamente accumulati dalla cellula. Occorre pertanto intervenire a livello dei sistemi di controllo, in particolare sulla sintesi e sull’attività di enzimi specifici, che vanno incontro a meccanismi di inibizione/repressione da feedback operata dal prodotto. Nell’ambito degli intermedi del TCA è importante la produzione di acido citrico (120÷150 g di acido citrico per litro di coltura) ottenibile dalla muffa Aspergillus niger, impiegando substrati carboidratici, e dal lievito Yarrowia lipolytica, impiegando n-alcani. A questa classe di prodotti appartiene anche l’etanolo, metabolita ottenibile per fermentazione di substrati zuccherini (in prevalenza residui agro-industriali o surplus agricoli), impiegando in prevalenza il lievito Saccaharomyces cerevisiae. In questo caso, il processo fermentativo costituisce una via alternativa a quella chimica; l’etanolo è infatti ottenibile anche per ossidazione dell’etilene. Per questo prodotto, il vantaggio della via fermentativa rispetto a quella chimica, è dovuto al costo della materia prima di partenza, che incide in misura significativa sui costi totali di processo.
Anche gli amminoacidi appartengono alla classe di metaboliti primari ottenibili da microrganismi, con procedure sviluppate in alternativa all’isolamento da proteine. Molte specie appartenenti ai corinebatteri sono in grado di produrre amminoacidi, in particolare ceppi mutanti appartenenti ai generi Corynebacterium e Flavobacterium. La via microbiologica è oggi potenzialmente sfruttabile per la produzione della maggior parte degli amminoacidi, anche se non per tutti è stato messo a punto il processo produttivo su larga scala. Tra quelli prodotti industrialmente da microrganismi, spiccano l’acido glutammico e la lisina, le cui produzioni sono localizzate soprattutto nell’Est asiatico (Giappone, Corea e Taiwan).
L’acido glutammico è ottenuto impiegando ceppi batterici quali Corynebacterium glutamicum e Flavobacterium flavum, per azione di una specifica deidrogenasi che agisce sull’acido α-chetoglutarico, intermedio del ciclo dei TCA. Da questi stessi ceppi batterici può essere ottenuta la lisina, prodotta in alternativa da Enterobacter aerogenes, per trasformazione del precursore acido diamminopimelico, ottenibile a sua volta da Escherichia coli.
Enzimi
In diversi settori industriali gli enzimi rappresentano una valida alternativa alla catalisi chimica. L’amilasi è stato il primo enzima prodotto industrialmente, negli Stati Uniti. Anche per gli enzimi, l’eterogeneità del metabolismo microbico e l’ampia variabilità tra i diversi generi e specie sono alla base della potenzialità di sviluppo dei processi per l’ottenimento di enzimi con specifiche attività catalitiche. In particolare, le principali applicazioni industriali delle attività enzimatiche sono nel settore dei detergenti, in quello lattiero-caseario e nell’idrolisi dell’amido.
Il principale ruolo commerciale tra gli enzimi è detenuto dalla produzione di idrolasi, in particolare amilasi e proteasi. Le amilasi di origine microbica attualmente disponibili sono in prevalenza di origine batterica (da ceppi di diverse specie del genere Bacillus quali B. subtilis, B. amyloliquefaciens, B. stearothermophilus, B. licheniformis) e fungina (da molti generi tra i quali Aspergillus, Penicillium, Mucor e Rhizopus). In funzione del tipo di attività svolta dalle amilasi sull’amido, si possono ottenere prodotti diversi quali destrine, maltosio e glucosio. La produzione di sciroppi di glucosio a partire dall’amido costituisce la principale applicazione delle amilasi.
Anche le proteasi, che detengono circa il 60% del mercato degli enzimi, sono prodotte a partire da ceppi batterici e fungini. Le principali proteasi microbiche appartengono alle classi alcaline e acide, con le prime ottenute da molte specie batteriche del genere Bacillus (B. licheniformis, B. lentus, B. alcalophilus, B. megaterium ecc.) e utilizzate principalmente nel settore dei detergenti. Alla classe delle proteasi acide appartiene invece la rennina, endoproteasi ottenibile da ceppi fungini di Cryphonectria parasitica, Rhizomucor miehei e Rhizomucor pusillus, impiegata nel settore caseario per la produzione di formaggi, in sostituzione del caglio animale, tradizionalmente ottenuto dallo stomaco (abomaso) di vitelli o ovicaprini lattanti.
Tra le altre idrolasi extracellulari ottenibili a livello industriale da microrganismi vanno inoltre ricordate le lipasi, le emicellulasi e le cellulasi.
Le disaccaridasi ottenibili da ceppi di lievito sono classificate come enzimi ‘di parete’, in quanto sono localizzate a livello del periplasma, struttura cellulare compresa tra parete e membrana. Appartengono a questo gruppo di enzimi la lattasi (β-galattosidasi) ottenibile da specie del genere Kluyveromyces per l’idrolisi del lattosio, e l’invertasi (β-fruttofuranosidasi) da Saccharomyces cerevisiae per l’idrolisi del saccarosio. Entrambe queste disaccaridasi, che trovano largo impiego nel settore alimentare, possono essere ottenute alternativamente in forma extracellulare da ceppi di Aspergillus.
Anche gli enzimi non idrolitici, responsabili di attività molto eterogenee, sono ottenuti su larga scala da microrganismi. Gli esempi più significativi sono rappresentati dalla glucosio ossidasi, ottenibile da ceppi di Aspergillus niger e Penicillium, utilizzata nel settore diagnostico, e la glucosio e xilosio isomerasi, da Bacillus coagulans e Streptomyces, per la produzione di fruttosio a partire da glucosio.
Un settore emergente è quello relativo alla produzione di enzimi coinvolti nella sintesi di molecole ad alto valore aggiunto nei settori chimico, alimentare e farmaceutico. Un esempio significativo è costituito dalle attività enzimatiche responsabili della sintesi di specifici enantiomeri o la risoluzione di miscele racemiche.
Metaboliti secondari
I metaboliti secondari, definiti anche prodotti di biosintesi, derivanti da meccanismi di sintesi microbica, sono prodotti molto eterogenei dal punto di vista della struttura chimica e delle funzioni a livello cellulare. La sintesi di tali prodotti avviene generalmente a partire da metaboliti primari o loro intermedi, attraverso vie metaboliche in alcuni casi molto complesse. A tale classe appartengono prodotti ad attività biologica quali antimicrobici, immunomodulanti, antitumorali, inibitori di specifiche attività enzimatiche e promotori della crescita.
Numerosi processi sono stati sviluppati su larga scala, e un esempio significativo è rappresentato dagli antibiotici ottenibili da ceppi batterici e fungini. Tra questi occorre ricordare la penicillina, il primo antibiotico disponibile: scoperta da Alexander Fleming nel 1928, solo intorno agli anni Quaranta del secolo scorso è stata utilizzata per la prima volta contro le infezioni batteriche, mentre la sua produzione su larga scala si è sviluppata negli Stati Uniti a partire dal 1943.
Dalla scoperta di questo primo antibiotico ad oggi sono state caratterizzate circa 4000 molecole, ma solo per una piccola parte (non più di 50) sono stati sviluppati processi e applicazioni su larga scala. Le ragioni che hanno limitato lo sviluppo della produzione di gran parte delle molecole caratterizzate a livello di ricerca sono generalmente legate all’attività esplicata in rapporto agli effetti secondari (in particolare quelli legati ai meccanismi di tossicità), nonché ai costi di produzione. La ricerca riguardante le molecole ad attività biologica è tutt’ora in corso ed è finalizzata all’individuazione di nuovi prodotti o alla modificazione di quelli esistenti, così da ottenere antibiotici con minore tossicità e uno spettro di attività più ampio, tenendo in considerazione anche l’aumento dei ceppi microbici resistenti.
La tossicità di tale classe di metaboliti è correlata al meccanismo d’azione: tanto più il meccanismo è specifico per le cellule microbiche (per es., attività esplicata a livello della parete cellulare), tanto più bassi saranno gli effetti di tossicità sull’uomo. Quando invece il meccanismo d’azione è basato sull’interferenza in processi comuni ai microrganismi e all’uomo (per es., sintesi proteica, replicazione degli acidi nucleici, alterazione della membrana plasmatica ecc.), gli effetti tossici possono essere anche importanti.
Gli antibiotici β-lattamici, in particolare penicilline e cefalosporine, ottenibili da muffe, sono tra gli antibiotici più conosciuti. Relativamente alla classe delle penicilline, prodotte da ceppi di Penicillium chrysogenum, e delle cefalosporine, ottenibili da Acremonium chrysogenum, particolare importanza hanno assunto i derivati di semisintesi, in relazione all’ampio spettro di attività. Tali derivati sono attualmente ottenuti per modificazione, tramite un processo chimico-enzimatico, delle penicilline e cefalosporine naturali, ottenute in precedenza da microrganismi: da qui nasce il termine semisintesi.
Dopo le penicilline e le cefalosporine, le tetracicline sono tra gli antibiotici più usati. Il primo antibiotico di questa classe a essere isolato è stata la clorotetraciclina ottenuta nel 1945 da Streptomyces aureofaciens. Allo stesso genere appartengono le diverse specie batteriche produttrici di questa tipologia di antibiotico.
Molti altri antibiotici utilizzati in medicina sono di origine microbiologica. Tra gli antibatterici si possono citare la streptomicina, da Streptomyces griseus; la bacitracina, da Bacillus subtilis; la polimixina, da Paenibacillus polymyxa; la neomicina, da Streptomyces fradiae. La vancomicina, ottenibile da Amycoplanes orientalis, all’inizio è stata impiegata limitatamente alle infezioni da batteri gram-positivi, ma più recentemente ha conosciuto un crescente interesse, per la sua attività nei confronti di ceppi resistenti ad altri antibiotici. I principali antifungini sono ottenibili da ceppi di Streptomyces quali la nistatina da S. noursei e l’amfotericina B da S. nodosus.
Tra gli altri metaboliti secondari ad attività biologica, inibitori di specifiche attività enzimatiche, particolare interesse presentano le statine, molecole ad attività anticolesterolemica ottenibili da ceppi fungini di Aspergillus terreus e specie del genere Monascus, quali M. ruber e M. anka.
In tempi più recenti, altre classi di prodotti quali antitumorali, antivirali, immunosoppressivi sono risultati disponibili in relazione a nuove strategie di ricerca, associate a crescenti esigenze terapeutiche. Tra queste un ruolo importante ha la ciclosporina A ottenuta dal ceppo fungino Tolypocladium inflatum, la cui attività immunosoppressiva è stata evidenziata negli anni Settanta del XX sec., e ha trovato largo impiego nelle terapie antirigetto che seguono i trapianti di organi.
Prodotti complessi
Una classe particolare è costituita dai prodotti della microbiologia industriale cosiddetti complessi, poiché è impossibile isolare il prodotto, costituito dal substrato trasformato e, nella maggior parte dei casi, dai microrganismi responsabili della modificazione. Tali prodotti, ottenuti in processi sviluppati a partire da tecnologie tradizionali, appartengono in larga misura al settore alimentare quali il lattiero-caseario, quello delle bevande alcoliche e dei vegetali fermentati.
I batteri lattici trovano numerose applicazioni industriali per la produzione di diversi tipi di latte fermentato e formaggi. Lo yogurt è il principale latte fermentato termofilo ottenuto per l’azione sinergica, sul substrato (il latte), di Streptococcus thermophilus e Lactobacillus delbrueckii ssp. bulgaricus. Lo yogurt è caratterizzato non solo dalla trasformazione del lattosio in acido lattico, ma anche dalla presenza di una serie di metaboliti dovuti alla fermentazione batterica, che conferiscono al prodotto caratteristiche organolettiche univoche. Prodotti tradizionali basati sull’impiego di batteri lattici per la produzione di prodotti analoghi allo yogurt sono diffusi in tutto il mondo, ottenuti dall’uomo sin da tempi remoti, mediante l’uso di tecnologie tradizionali finalizzate alla trasformazione del latte, prodotto deperibile, in un alimento maggiormente conservabile.
L’uso dei batteri lattici mesofili nella trasformazione dei vegetali, appartenenti ai generi Leuconostoc, Lactobacillus e Pediococcus, è antico ed è alla base di tecnologie per l’ottenimento di prodotti quali, per esempio, crauti, olive, cetrioli e foraggi insilati. In tali prodotti, il contributo del metabolismo microbico produce modificazioni significative del substrato, impedendo l’instaurarsi di fenomeni putrefattivi e rendendo il prodotto conservabile. Un esempio storico è costituito dai crauti, ottenuti per fermentazione del cavolo operata da batteri lattici, con produzione di un alimento ricco in vitamine (e particolarmente la vitamina C), dunque molto utile in passato per la prevenzione dello scorbuto.
Anche la produzione di bevande alcoliche ha radi-ci antichissime, documentata in tutte le aree geografiche. La fermentazione è stata da sempre condotta, impiegando tecnologie tradizionali, a partire da succhi zuccherini da frutti, miele o amido di cereali pretrattati. In alcuni casi i prodotti sono utilizzati in tem-pi brevi dalla loro produzione (per es., birra), ma più frequentemente dopo un periodo relativamente lungo di conservazione, in cui il prodotto subisce significative modificazioni delle caratteristiche organolettiche, come il vino. I microrganismi coinvolti nella produzione di bevande alcoliche sono sostanzialmente ceppi di lievito, in coltura pura selezionata (birra) o mista di origine naturale (vino). Il genere più rappresentato è Saccharomyces, responsabile della fermentazione alcolica, processo basato sulla trasformazione di zuccheri semplici in etanolo e anidride carbonica.
La birra è ottenuta per fermentazione, a partire prevalentemente da orzo e in misura minore da altri cereali, preceduta da maltizzazione, procedura in cui si ha la trasformazione dell’amido in zuccheri fermentabili. Tale passaggio è indispensabile in quanto i ceppi di Saccharomyces non sono in grado di utilizzare direttamente l’amido. I ceppi coinvolti in tale processo appartengono al genere Saccharomyces, in particolare alle specie S. cerevisiae (fermentazione alta, 15÷23 °C) e S. pastorianus (fermentazione bassa, 8÷15 °C). Le caratteristiche organolettiche di questo prodotto sono dovute non solo al metabolismo microbico, ma anche alla presenza del luppolo, infiorescenza addizionata nel corso del processo con la finalità di fornire alla birra la nota amaricante.
Va inoltre ricordata, per i settori enologico e caseario, la produzione di biomasse selezionate in funzione di specifiche attività o caratteristiche, impiegabili come colture starter per la gestione di processi su larga scala, in condizioni controllate e standardizzate.
Biotrasformazioni
Nei prodotti ottenuti per biotrasformazione viene sfruttata la capacità dei microrganismi di operare reazioni in definite molecole, in posizione specifica e in modalità stereoselettiva. Le applicazioni più avanzate di tale approccio hanno portato in alcuni casi allo sviluppo di processi che prevedono l’impiego di microrganismi immobilizzati. I prodotti ottenibili per biotrasformazione sono eterogenei, dall’acido gluconico (ottenuto per ossidazione diretta e selettiva del glucosio, per azione dell’enzi-ma glucosio ossidasi, in posizione C1, a opera di ceppi fungini di Aspergillus niger, o batterici di Gluconobactersuboxydans) a prodotti ad alto valore aggiunto, quali steroidi e alcuni antibiotici per uso terapeutico. Gli steroidi sono impiegati per trattamenti quali allergie, infiammazioni, contraccettivi orali, e sono prodotti in prevalenza con ceppi di muffe appartenenti ai generi Rhizopus, Curvularia, Fusarium e Aspergillus.
DNA ricombinante
Più recenti sono i processi che sfruttano le tecnologie di ingegneria genetica basate sul DNA ricombinante. Alcuni di questi prodotti sono ottenuti da ceppi microbici in cui è stato inserito materiale genetico proveniente da cellule animali. È il caso relativo alla produzione di molecole quali l’insulina, l’interferone e l’ormone della crescita (somatotropina o GH, Growth hormone), ottenibili da diversi ceppi modificati e appartenenti alla specie Escherichia coli.
Tra gli esempi applicati si possono citare i ceppi modificati di Saccharomyces cerevisiae utilizzati per la produzione di vaccino per l’epatite B e insulina, la chimosina (enzima utilizzabile nel settore lattiero-caseario ottenuta da Kluyveromyces marxianus var. lactis) e la vitamina riboflavina da Bacillus subtilis.
L’ottenimento tramite tecniche genetiche di tali metaboliti, in alcuni casi alternativo all’estrazione da organi o cadaveri, ha reso disponibili prodotti con caratteristiche chimico-strutturali costanti e definite e in quantità adeguate alle richieste di mercato. Tale approccio ha inoltre posto i soggetti, trattati con molecole ottenute con le tecnologie del DNA ricombinante, al riparo dai rischi di contaminazione da agenti virali o prioni, potenzialmente presenti nei derivati ottenuti per estrazione da organi, come si è verificato in passato per l’ormone della crescita.
I substrati utilizzati nei processi microbiologici
A livello industriale l’economicità dei processi microbiologici è condizionata dall’impiego di substrati adeguati. I costi legati al terreno di coltura possono infatti raggiungere il 50÷70% del costo totale del processo, come nel caso della produzione delle biomasse microbiche usate per i mangimi. I terreni colturali utilizzati in laboratorio sono generalmente costituiti da ingredienti con composizione nota e in forma pura, mentre quelli di uso industriale sono formulati impiegando materie prime grezze, frequentemente residui del settore agro-industriale o surplus agricoli, eventualmente pretrattati (per es., idrolizzati, chiarificati ecc.).
La formulazione di un terreno colturale deve comprendere una fonte di carbonio ed energia, una fonte di azoto, oltre a eventuali sali minerali e vitamine o, più in generale, fattori di crescita, nelle giuste proporzioni non solo per le esigenze di sviluppo del microrganismo, ma anche per la biosintesi dei metaboliti desiderati.
Il melasso residuo dell’estrazione del saccarosio dalla canna da zucchero o dalla barbabietola costituisce un esempio di fonte di carbonio tradizionalmente impiegata in numerosi processi industriali (per es., produzione di lievito da pane, etanolo, acido glutammico ecc.). Tale materia prima grezza si presenta come sciroppo viscoso, di colore bruno, contenente circa il 50÷60% di zuccheri (prevalentemente saccarosio) sulla sostanza secca, a seconda della fonte vegetale e del processo estrattivo utilizzato. In molti processi il melasso è stato tuttavia sostituito dall’impiego di sciroppi di glucosio ottenuti per idrolisi enzimatica dell’amido proveniente da fonti diverse (mais, patata ecc.). Altri esempi di fonti di carbonio in forma grezza sono costituiti dal siero di latte (contenente lattosio, sottoprodotto del settore caseario), orzo maltizzato, amido e maltodestrine, cellulosa e liscivio solfitico (residuo del processo di produzione della cellulosa da legname). Tra le fonti non carboidratiche si possono ricordare gli idrocarburi gassosi, gli alcoli, gli alcani e gli oli.
Le più semplici fonti di azoto utilizzate a livello industriale sono i sali di ammonio (per es., cloruri e solfati), impiegabili solo con i microrganismi in grado di utilizzare fonti inorganiche. Tra le materie prime grezze, di tipo organico, trovano largo impiego il corn steep (acqua di macerazione residua del pretrattamento nel processo di produzione dell’amido da mais) e le farine di semi di oleaginose (residui dell’estrazione di olio da mais, soia, arachide ecc.).
I peptoni di origine sia vegetale sia animale, nonché l’estratto di lievito e gli idrolizzati di caseina, in teoria fonti di azoto, vengono utilizzati industrialmente solo in quantità moderata, come fonti di vitamine o fattori di crescita a causa dei costi relativamente elevati. Occorre inoltre ricordare che l’acqua rappresenta un ingrediente fondamentale, poiché la sua composizione minerale può influenzare il processo industriale. Un esempio rilevante è costituito dalla produzione della birra, in cui dalle caratteristiche dell’acqua dipendono in larga misura le caratteristiche finali del prodotto. In altri casi, dalla presenza/assenza di specifici ioni può dipendere l’attivazione/inibizione di enzimi che esplicano un ruolo chiave nelle vie metaboliche che portano all’accumulo dei metaboliti desiderati.
Aspetti tecnologici
I processi della microbiologia industriale avvengono soprattutto all’interno di fermentatori (o bioreattori), il cui sviluppo tecnologico ha consentito significativi progressi nell’ambito della microbiologia applicata. Il bioreattore è un reattore (generalmente verticale) che nasce e si evolve a partire dagli analoghi impianti utilizzati in chimica, la cui applicazione industriale è precedente rispetto alla microbiologia.
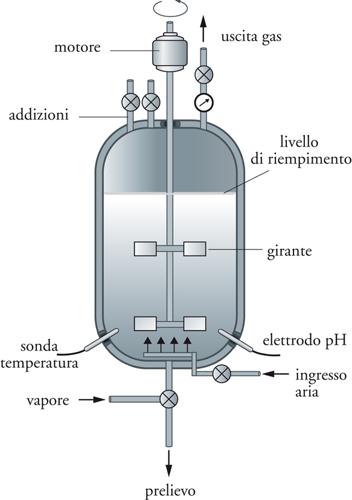
Le caratteristiche tecnologiche dell’impianto, e in particolare del bioreattore, dipendono dal metabolismo del microrganismo coinvolto, che a seconda della fisiologia può richiedere condizioni aerobiche o anaerobiche. Le dimensioni del bioreattore, operante nella maggior parte dei processi in condizioni di sterilità, variano in funzione del processo, e vanno da qualche decina di m3 (per es., produzione di alcuni biofarmaci) fino a 1000 m3 (per es., produzione di etanolo). Nella parte alta del bioreattore (testata) sono posizionate diverse entrate e uscite, controllate da elettrovalvole. Le entrate sono necessarie per l’inoculo della coltura ed eventuali addizioni (nutriliti, correttori di pH, agenti antischiuma ecc.) nel corso del processo. Le uscite sono impiegate per l’aria esausta ed eventuali prelievi di coltura effettuati nel tempo per monitorare il processo (fig. 6).
I bioreattori sono inoltre dotati di dispositivi (elettrodi) per il controllo delle diverse variabili di processo quali temperatura, pH, formazione di schiuma, concentrazione di nutriliti, metaboliti e cellule. Solo alcune di queste variabili quali temperatura, pH, flusso e pressione d’aria sono sempre misurate e/o regolate, mentre altre lo sono in relazione al tipo di processo. I dispositivi per la misura e la regolazione delle variabili, che interessano un processo microbiologico, un tempo semplici accessori meccanici, sono stati sostituiti da complessi sistemi elettronici, generalmente gestiti via computer.
La temperatura all’interno del bioreattore è mantenuta a livelli ottimali in relazione alle esigenze del microrganismo, mediante dispositivi interni o esterni. Il sistema a serpentino interno, tecnologia tradizionale messa a punto con lo sviluppo tecnologico dei primi bioreattori, presenta problemi tecnici, non solo in termini di efficienza, ma anche relativamente alla normale manutenzione o in seguito a cattivo funzionamento (o foratura) del circuito, in quanto la posizione all’interno del reattore ne rende difficile l’ispezione e l’eventuale riparazione. Tra i sistemi esterni, il cosiddetto a camicia, è formato da un’intercapedine che avvolge il bioreattore, in cui circola acqua a un’adeguata temperatura. Pur superando le limitazioni dei dispositivi interni, questo sistema presenta l’inconveniente di una limitata superficie specifica (superficie di scambio di calore in rapporto al volume del bioreattore e quindi della coltura), che ne condiziona l’efficienza nel caso dei bioreattori di grosse dimensioni e nel caso di processi fortemente esotermici.
Le limitazioni dovute ai sistemi più tradizionali di controllo e regolazione della temperatura sono state superate grazie all’impiego di scambiatori di calore esterni. Lo scambiatore a piastre, oltre a presentare i vantaggi di un dispositivo esterno (facilità di ispezione e manutenzione), presenta un’alta efficienza nei riflessi dello scambio di calore. Questi impianti sono tecnologicamente analoghi a quelli utilizzati in altri settori industriali, come per esempio, la produzione di latte sterilizzato (UHT).
Un sistema fermentativo, tranne alcune eccezioni (per es., i processi di produzione di bevande alcoliche), è generalmente mantenuto in agitazione per rendere omogeneo l’ambiente, evitando la formazione di gradienti relativi non solo alla temperatura, ma anche alla biomassa cellulare, ai nutriliti e ai gas. I dispositivi di agitazione hanno diverso design in funzione delle caratteristiche del processo, in particolare della macromorfologia cellulare. Il dispositivo di agitazione è costituito dal motore e da un albero motore a cui sono ancorate le giranti. Tra gli agitatori veloci, caratterizzati da un rapporto diametro agitatore/diametro reattore compreso nell’intervallo 0,2÷0,4 e impiegabili con microrganismi unicellulari (per es., lieviti e la maggior parte dei batteri), i più diffusi sono quelli a elica marina, a palette e a turbina (la turbina Rushton è la più diffusa). Tra gli agitatori lenti, caratterizzati da un rapporto diametro agitatore/diametro reattore compreso tra 0,8 e 1 e impiegabili con microrganismi miceliari (per es., muffe e alcuni batteri), i più diffusi sono quelli a gabbia, ad ancora e a vite senza fine.
Nei processi aerobici l’agitazione esplica un ruolo di primaria importanza in rapporto alla dispersione uniforme della fase gassosa (aria), in tutta la coltura, condizione fondamentale per il costante apporto di ossigeno alle cellule microbiche. Dall’accoppiata aerazione-agitazione può dipendere l’andamento del processo: in particolare, i livelli di ossigeno disciolto devono essere attentamente monitorati, al fine di evitare che si instauri una concentrazione di ossigeno che può condizionare la velocità delle reazioni metaboliche e conseguentemente l’intero processo. A tal fine l’aria atmosferica è immessa nel bioreattore utilizzando quella parte dell’impianto identificata come ‘linea dell’aria’. L’ossigeno necessario per il metabolismo cellulare è rifornito alla coltura come aria, che è prelevata dall’atmosfera e compressa, in quanto la sovrappressione costituisce la forza motrice in base alla quale l’aria viene non solo convogliata all’interno del bioreattore, previa sterilizzazione per filtrazione, ma risulta anche in grado di vincere la pressione idrostatica dovuta alla coltura. Occorre, infatti, che le bolle di aria, distribuite alla base del bioreattore, attraverso un sistema di distribuzione (sparger), siano in grado di risalire all’interno della coltura, fino alla superficie, cedendo nel cammino l’ossigeno e recuperando l’anidride carbonica risultante dal metabolismo cellulare.
Relativamente all’evoluzione tecnologica dei bioreattori, occorre ricordare che la maggior parte dei nuovi prodotti, in particolare le molecole ad attività biologica (biofarmaci), sono generalmente ottenuti in processi aerobici. È per tale ragione che si è assistito prevalentemente allo sviluppo di bioreattori per colture aerobiche, con nuove caratteristiche. In tale contesto, sono stati messi a punto reattori privi di agitazione meccanica (reattori non convenzionali) che, a fronte di una maggiore efficienza di processo, relativamente al trasferimento di massa e calore, presentano un minor assorbimento energetico, rispetto al tradizionale bioreattore convenzionale ad agitazione meccanica. Tuttavia, a oggi, il bioreattore tradizionale, conosciuto come Stirred tank reactor (STR), è ancora molto diffuso.
Tra i reattori non convenzionali di nuova concezione vengono annoverati i reattori a circolazione, così definiti poiché la brodocoltura e la fase gassosa ricircolano nel bioreattore con moti paralleli, come diretta conseguenza della risalita dell’aria (bioreattore air lift). Tali bioreattori sono caratterizzati da un efficiente effetto di agitazione e un basso tempo di mescolamento e non presentano parti interne rotanti, quale il sistema di agitazione meccanico, che può presentare problemi di tenuta.
Va inoltre considerato che la progettazione e la messa a punto di un bioreattore di produzione (risultato della sinergia tra ingegneri, microbiologi e biochimici, senza prescindere dagli aspetti economici) prevede solitamente una prima verifica sperimentale del processo su scala pilota, effettuata modulando opportunamente i parametri significativi e modificando le condizioni in base ai risultati ottenuti.
Bibliografia
Asenjo, Merchuk 1995: Asenjo, Jan A. - Merchuk, José C., Bioreactor system design, New York, Marcel Dekker, 1995.
Bailey, Ollis 1977: Bailey, James - Ollis, David F., Biochemical engineering fundamentals, Tokyo, McGraw-Hill, 1977.
Calwell 1995: Calwell, Daniel R., Microbial physiology and methabolism, Oxford, Brown, 1995.
Chisti, Moo-Young 2001: Chisti, Yusuf - Moo-Young, Murray, Bioreactor design, in: Basic biotechnology, 2. ed., edited by Colin Ratledge, Bjørn Kristiansen, Cambridge, Cambridge University Press, 2001.
Cooney 1983: Cooney, Charles L., Bioreactor: design andoperation, “Science”, 219, 1983, pp. 728-733.
Crueger, Crueger 1990: Crueger, Wulf - Crueger, Anneliese, Biotechnology: a textbook of industrial microbiology, 2. ed., Sunderland, Sinauer, 1990.
Demain, Davies 1999: Demain, Arnold L. - Davies, Julian E., Industrial microbiology and biotechnology, Washington D.C., ASM Press, 1999.
Demain 2000: Demain, Arnold L., Microbial biotechnology, “Trends in biotechnology”, 18, 2000, pp. 26-31.
Kennedy, Krouse 1999: Kennedy, M.J. - Krouse, D., Strat-egies for improving fermentation medium performance: areview, “Journal of industrial microbiology and biotechno-logy”, 23, 1999, pp. 456-475.
Madigan 2003: Biologia dei microrganismi. Microbiologia ambientale, biomedica e industriale, a cura di Michael T. Madigan, John M. Martinko, Jack Parker, Milano, Ambrosiana, II, 2003.
Manzoni 2005: Manzoni, Matilde, Microbiologia industriale, Milano, Ambrosiana, 2005.
Perry 2004: Perry, Jerome J. - Staley, James T. - Lory, Stephen, Microbiologia. Ecologia, microbiologia medica, microbiologia applicata, Bologna, Zanichelli, 2004.
Prokop 1995: Prokop, Ales, Challenges in commercial biotechnology. Part I: product, process, and market discovery, “Advances in applied microbiology”, 40, 1995, pp. 95-154.
Schügerl, Sitting 1996: Schügerl, Karl - Sitting, W., Bioreactor, in: Biotechnology, edited by Hans-Jürgen Rehm, Gerald Reed, Weinheim, VCH, 1996.
Scragg 1991: Scragg, Alan H., Bioreactor in biotechnology.A practical approach, New York, Ellis Horwood, 1991.
Sharma, Gurtu 1993: Sharma, M.C. - Gurtu, A.K., Asepsis in bioreactors, “Advances in applied microbiology”, 3, 1993, pp. 1-27.
Sikyta 1995: Sikyta, Bohumil, Cultivation device, “Progress in industrial microbiology”, 31, 1995, pp. 170-240.
Stoppok, Buchholz 1996: Stoppok, Eberhard - Buchholz, Klaus, Sugar-based raw materials for fermentation applications, in: Biotechnology, edited by Hans-Jürgen Rehm, Gerald Reed, Weinheim, VCH, 1996.
Stanbury 1995: Stanbury, Peter F. - Whitaker, Allen - Hall, Stephen J., An introduction to fermentation processes, in: Principles of fermentation technology, Oxford, Pergamon, 1995.
Turner 1971: Turner, William B., Fungal metabolites, London, Academic Press, 1971.
Waites 2001: Waites, Michael J. e altri, Industrial microbio-logy: an introduction, Oxford, Blackwell Science, 2001.
Walker 1998: Walker, Graeme M., Yeast physiology and biotechnology, Chichester, Wiley, 1998.
Ward 1991: Ward, Owen P., Bioreactors in bioprocessing, in: Id., Bioprocessing, Buckingham, Open University Press, 1991.
Zoebelein 1997: Zoebelein, Hans, Dictionary of renewableresources, Weinheim, VCH, 1997.