reazione chimica
reazione chimica
La trasformazione delle sostanze
Un fiammifero che brucia o la cottura del cibo sono esempi di reazioni, più o meno complesse, che trasformano certe sostanze in altre. Nel nostro stesso corpo avvengono ogni secondo migliaia di reazioni diverse. I chimici cercano di controllare tutti gli aspetti delle reazioni, compresa la velocità, che essi modificano mediante catalizzatori. Le reazioni di sintesi permettono ai chimici di ottenere in laboratorio le sostanze che si trovano in natura e molte altre del tutto nuove. Ma vi sono ancora molti problemi insoluti, fra cui quello delle reazioni che, all’origine della vita sulla Terra, hanno trasformato sostanze inerti in un organismo vivente
Reazioni ovunque
Quando si accende un fiammifero, dalla capocchia si sprigiona una piccola fiamma che presto consuma il bastoncino di legno. Sfregando la capocchia del fiammifero su una superficie ruvida abbiamo iniziato ciò che i chimici chiamano reazione, più precisamente abbiamo causato una reazione di combustione. Gli aspetti sorprendenti di questa reazione sono molti; infatti ci si può chiedere cosa generi la luce e il calore e che fine facciano le sostanze che costituiscono la capocchia e il legno, dato che una volta spenta la fiamma rimangono solamente una piccola parte del bastoncino con la punta annerita e un po’ di cenere.
Le reazioni di combustione sono state le prime a essere studiate dai chimici (chimica), ma molte altre si sviluppano sotto i nostri occhi ogni giorno e in qualsiasi momento, senza che ce ne rendiamo conto. La cottura di una bistecca corrisponde a un complesso insieme di reazioni, mentre la digestione e la nostra stessa crescita sono il risultato di migliaia di reazioni diverse che avvengono all’interno del nostro corpo, come in quello di tutti gli esseri viventi. Non sono quindi soltanto la curiosità e un interesse scientifico che ci spingono a sapere cosa sia una reazione chimica, ma il fatto che siamo letteralmente circondati, in ogni momento della nostra vita, da reazioni.
Sostanze e materiali
Prendiamo il sale e il pepe. Per i chimici il sale da cucina è una sostanza, alla quale corrisponde la formula NaCl, dove con il simbolo Na si indica un atomo di sodio e con Cl un atomo di cloro. Il più piccolo granellino di sale è costituito da molti miliardi di queste coppie di atomi e, se il sale è puro, contiene solo sodio e cloro: ogni minuscola parte del granellino ha la medesima composizione, in quanto gli atomi di sodio e di cloro vi sono costantemente presenti nel rapporto di 1:1.
Il pepe, invece, è un materiale naturale, costituito da diverse sostanze: un granellino di pepe contiene circa il 10% di acqua, il 10% di proteine, un po’ di grassi, molte fibre vegetali (cellulosa) e parecchi tipi di molecole organiche che conferiscono il tipico sapore piccante al pepe. Sappiamo che esistono tipi diversi di pepe, più o meno forti, e quindi, come tutti i materiali, il pepe può avere una composizione variabile.
Gli oggetti che ci circondano sono di solito costituiti da molti materiali, come la pagina di un libro, in cui si trovano sia cellulosa della carta trattata con diverse sostanze, sia inchiostri neri e colorati.
Dai reagenti ai prodotti
Una reazione chimica è un processo in cui una o più sostanze si trasformano in altre. La chimica è appunto la scienza che studia queste trasformazioni. Anche i materiali si trasformano, come il piccolo legno del fiammifero, ma i chimici preferiscono concentrarsi sulle trasformazioni delle sostanze, perché sono più semplici, hanno caratteristiche meglio definite e danno risultati esatti e riproducibili.
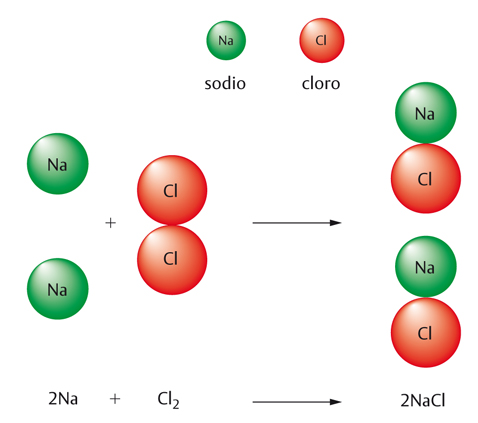
Spesso il risultato di una reazione è sorprendente, nel senso che le proprietà delle sostanze che risultano da essa non hanno nulla a che fare con quelle delle sostanze di partenza. Prendiamo proprio il caso del sale da cucina. Abbiamo visto che la sua formula chimica è NaCl; i chimici indicano la formazione del sale da cucina in questo modo, con un’equazione chimica:
2 Na+Cl2 → 2 NaCl
Questa scrittura abbrevia una ‘narrazione’ abbastanza lunga: due atomi di sodio (Na) reagiscono con una molecola di cloro (Cl2, costituita da due atomi di cloro), per dare due unità di cloruro di sodio (NaCl). La freccia (→) è il segno che i chimici hanno scelto come simbolo di reazione per segnalare che le sostanze a sinistra del segno, chiamate reagenti, si trasformano completamente nelle sostanze a destra, denominate prodotti. Si deve anche notare che il numero e la qualità degli atomi che compaiono dalle due parti della frecciolina non cambiano: due atomi di sodio e due di cloro a sinistra, e altrettanti a destra. In effetti, mai durante una reazione chimica compaiono nuovi atomi, oppure ne scompaiono di vecchi: ciò che cambia è il modo di unirsi degli atomi.
Novità emergenti
La nuova unione degli atomi in seguito a una reazione può dar luogo a qualcosa di completamente diverso dalle sostanze di partenza. È il caso della reazione del sodio con il cloro. Per quanto riguarda i reagenti, il sodio è un metallo lucente, leggero e molto reattivo; il cloro, invece, è un gas giallastro, estremamente pericoloso, mortale se respirato. Per quanto riguarda il prodotto, non solo il sale NaCl è innocuo, ma viene largamente usato per insaporire il cibo.
Dalla trasformazione delle sostanze si ottengono dunque altre sostanze in cui emergono nuove proprietà, fisiche, chimiche e fisiologiche: i cristalli di sale da cucina non hanno più le proprietà del metallo sodio e del gas cloro, ma ne hanno di nuove, come quella di sciogliersi in acqua senza reagire, o quella di poter essere ingeriti da noi senza ustionarci, come farebbe il sodio, o ucciderci, come farebbe il cloro.
Atomi e molecole in equilibrio
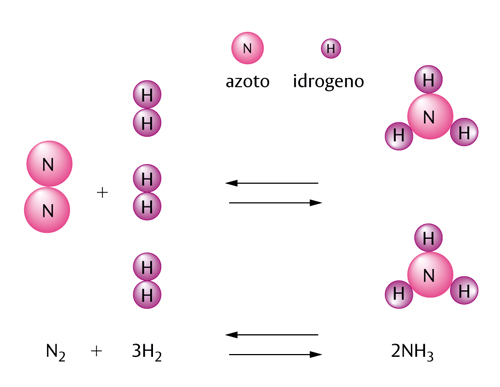
In molte reazioni i reagenti non si trasformano completamente nei prodotti perché si stabilisce un equilibrio particolare. Una delle reazioni più importanti per l’industria chimica è quella dell’azoto (N2) e dell’idrogeno (H2), che si uniscono per dare ammoniaca (simbolo NH3). Tutte e tre le sostanze sono gassose e reagiscono secondo l’equazione:
N2+3 H2 ⇄ 2NH3
Per certi aspetti questa scrittura è analoga a quella già vista per il sale da cucina: due molecole di azoto (N2) reagiscono con tre molecole di idrogeno (H2) per dare due molecole di ammoniaca (NH3). Compare però un nuovo simbolo: due frecce, rivolte in direzioni opposte, che si riferiscono alla presenza contemporanea di due trasformazioni contrapposte. È questo il simbolo dell’equilibrio chimico.
Nel caso che stiamo considerando l’equilibrio si realizza quando il numero di molecole di ammoniaca che si formano (la reazione verso destra: →) è eguale al numero di molecole di ammoniaca che si decompongono per dare nuovamente azoto e idrogeno (la reazione verso sinistra ←).
Quando la situazione di equilibrio in una reazione chimica non viene raggiunta in un istante, può richiedere l’intervento della natura (enzimi) o dei chimici (catalizzatore, catalisi) per diventare più veloce. Comunque, quando si è raggiunto l’equilibrio, a livello macroscopico non si assiste più a nessuna trasformazione e così alla fine della reazione, oltre alla formazione di una certa quantità di prodotto è possibile trovare (al contrario di quanto avviene nelle reazioni irreversibili) anche una certa quantità di reagenti.
L’effetto della temperatura sull’equilibrio e sulla velocità della reazione
Le particelle dei gas, per esempio le molecole di azoto e di idrogeno, si muovono velocissime in ogni direzione e cozzano fra loro migliaia di volte in un secondo. Per reagire e trasformarsi in ammoniaca le molecole di azoto e di idrogeno devono urtarsi con grande energia, altrimenti al momento dell’urto semplicemente rimbalzano, rimanendo tali e quali. L’effetto su qualsiasi corpo di un aumento di temperatura è quello di agitare con maggiore energia le molecole che lo costituiscono. Così, quando viene fornito calore a una miscela di azoto e idrogeno (con conseguente aumento della sua temperatura), aumenta il numero di molecole che urtandosi reagiscono, e il punto di equilibrio è raggiunto più rapidamente.
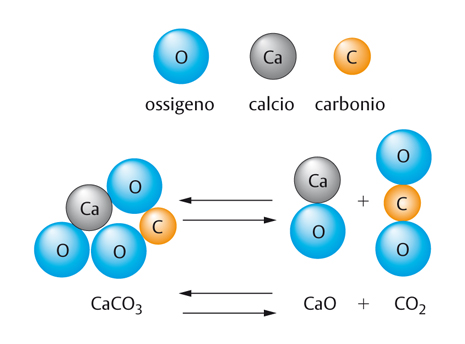
Talvolta l’aumento di temperatura non si limita a rendere più veloce il raggiungimento dell’equilibrio, ma addirittura inverte l’andamento complessivo di una reazione. Consideriamo la reazione che coinvolge il carbonato di calcio (formula CaCO3), l’ossido di calcio (CaO) e l’anidride carbonica (CO2):
CaCO3 ⇄ CaO+CO2
Il carbonato di calcio è la sostanza di cui è fatto quasi al 100% il materiale marmo. Se alle temperature delle nostre regioni prevalesse la reazione da sinistra verso destra (freccia →), molte grandi opere d’arte in marmo sarebbero scomparse, avendo rilasciato nell’atmosfera il gas anidride carbonica (CO2) ed essendo ridotte a un mucchio polverulento di calce viva (CaO). In realtà, a temperatura ambiente il marmo è (per nostra fortuna) assolutamente stabile, e si verifica soltanto la reazione da destra verso sinistra. Solo aumentando la temperatura oltre 1.200 °C il carbonato di calcio si decompone, dando calce viva – utile in edilizia – e anidride carbonica.
Più veloci con i catalizzatori
La velocità di una reazione è tanto maggiore quanto più rapidamente si raggiunge l’equilibrio. Oltre che dalla temperatura, la velocità di una reazione può essere modificata dalla presenza di altre sostanze, chiamate catalizzatori. Questi non sono né reagenti né prodotti, ma favoriscono l’unione dei reagenti e guidano la formazione dei prodotti. I catalizzatori agiscono al livello delle molecole e, al termine della reazione, quando viene raggiunto l’equilibrio, si ritrovano tali e quali come erano prima della reazione, come se non vi avessero partecipato. Molti metalli, fra cui il platino, sono ottimi catalizzatori, ma è negli organismi viventi che si trovano moltissimi catalizzatori straordinari, gli enzimi.
Tanti enzimi per tante reazioni
In ogni organismo vivente sono sempre in corso, in ogni istante, migliaia di reazioni diverse. Non tutte queste ci sono note, ma possiamo stimare il loro numero proprio in base al numero degli enzimi. Un enzima è una proteina, più o meno complessa, che catalizza una specifica reazione. Vediamo un caso particolare.
Un costituente fondamentale della pasta è l’amido, che appartiene alla categoria dei carboidrati: la molecola dell’amido non è altro che una lunga catena di molecole di glucosio unite tra loro. L’amido come tale non è assimilabile dall’organismo umano: lo diventa soltanto quando reagisce con l’acqua in una reazione detta idrolisi. Ma l’idrolisi dell’amido è una reazione che avverrebbe molto lentamente in assenza di un catalizzatore; noi invece digeriamo in fretta la pasta, perché le ghiandole salivari e il pancreas secernono l’amilasi, un enzima che ha il compito di accelerare l’idrolisi dell’amido rompendo le catene in molecole più semplici, assimilabili e nutrienti come quelle del glucosio. Anche un organismo unicellulare come un batterio ha circa quattromila enzimi, in grado di controllare altrettante reazioni.
Dal punto di vista chimico la vita non è altro che l’armonioso intrecciarsi di una moltitudine di reazioni, in un delicato equilibrio fisiologico.
Combustione e ossidazione
Ci sono molti tipi differenti di reazioni chimiche e alcuni di questi hanno un nome preciso: data l’importanza, è bene precisarne il significato.
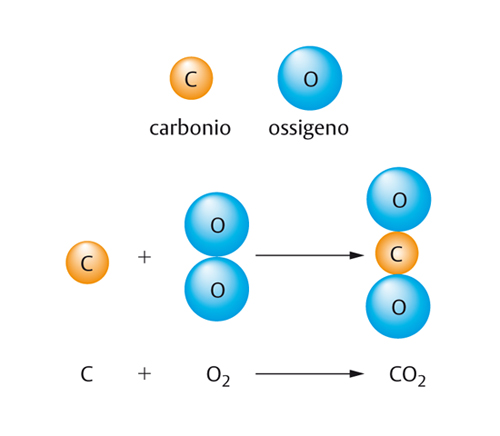
La reazione più nota di tutte è quella di combustione, in cui una sostanza (o un materiale), detto combustibile, reagisce con un gas (usualmente ossigeno), detto comburente, per dare, oltre a nuove sostanze, calore e luce. Il carbone che brucia all’aria è rappresentato con questa equazione:
C+O2 → CO2
Il carbone è costituito in massima parte da carbonio (C); l’equazione afferma che il carbonio reagisce con l’ossigeno (O2) per dare l’anidride carbonica (CO2). Man mano che brucia, il carbone si consuma; il suo carbonio si unisce all’ossigeno e si disperde nell’aria come CO2.
Per poter bruciare, il carbone, come il legno, deve essere portato ad alta temperatura, in modo tale che le sue particelle acquistino abbastanza energia e siano in grado di combinarsi con l’ossigeno. La capocchia del fiammifero da cui abbiamo iniziato il nostro ragionamento è costituita da un impasto di sostanze che reagiscono per semplice sfregamento, generando abbastanza calore da accendere il bastoncino di legno. Tutte le reazioni di combustione non soltanto trasformano le sostanze che vi partecipano, ma mutano anche l’energia chimica che i reagenti posseggono in altre forme di energia: termica e luminosa, cioè in quel calore e in quella luce di cui ci eravamo chiesti l’origine parlando del fiammifero acceso.
Una ossidazione non è altro che una combustione molto lenta, cioè una reazione fra una sostanza, il ferro per esempio, e l’ossigeno; in presenza di acqua l’ossidazione del ferro lo trasforma in ruggine. In questo caso la reazione produce solo una quantità minima di calore diluita nel tempo senza emissione di luce.
Analisi e sintesi
Esistono due tipi di reazione che sono l’uno il contrario dell’altro. Quando una sostanza è scomposta in sostanze più semplici si ha una reazione di analisi; quando invece da sostanze più semplici si ricava una sostanza più complessa si ha una reazione di sintesi. Consideriamo ancora questa equazione chimica:
N2+3 H2 ⇄ 2 NH3
La freccia verso destra indica una reazione di sintesi. I reagenti, azoto e idrogeno, sono elementi, e le molecole di ciascuno di essi sono costituite da due atomi di un solo tipo; il prodotto è ammoniaca, un composto, le cui molecole contengono quattro atomi di due tipi diversi. Il prodotto è più complesso dei reagenti. La freccia verso sinistra indica, invece, una reazione di analisi; in questo caso si parte da un composto per giungere agli elementi che lo costituiscono.
Per molto tempo le reazioni di analisi sono state l’unico processo che permetteva ai chimici di riconoscere se una sostanza fosse un elemento o un composto. Fu il celebre chimico francese Antoine-Laurent de Lavoisier a indicare nel 18° secolo il profondo significato teorico di questa procedura sperimentale. Così Lavoisier sottolineò che l’acqua non era un elemento, come si credeva fin dai tempi dei Greci, ma un composto, in quanto da essa si ottenevano due sostanze più semplici, l’idrogeno e l’ossigeno.
Una sintesi organica: la fotosintesi
Le piante sono maestre eccelse di sintesi. Tutti gli aromi, i profumi, i colori, i sapori dei prodotti vegetali sono dovuti a sostanze complesse sintetizzate dalle piante. Ma la reazione più importante, quella da cui dipende la vita sulla Terra, è la fotosintesi clorofilliana. La clorofilla è la sostanza verde che colora le foglie delle piante e insieme alla luce solare è indispensabile per realizzare la reazione che trasforma l’anidride carbonica (CO2) presente nell’atmosfera e l’acqua (H2O) proveniente dal suolo in modo da ottenere il glucosio, la cui molecola C6H12O6 è molto più complessa e ricca di energia. La cellulosa e l’amido non sono che ulteriori elaborazioni chimiche del prodotto della fotosintesi, ma ancora più importante è il fatto che tutta l’energia consumata dagli esseri viventi – compresa quella che consumiamo con i cibi – deriva dalla reazione di fotosintesi, pur con molti passaggi intermedi di nuove sintesi che portano a sostanze di ogni tipo, dalle vitamine alle proteine.
Anche i chimici sono maestri di sintesi, in particolare nel campo della chimica dei composti del carbonio, un settore chiamato anche chimica organica perché si occupa delle innumerevoli sostanze che si trovano nel mondo degli esseri viventi. Mediante le reazioni di sintesi i chimici sono in grado di riprodurre in laboratorio tutte le sostanze naturali; anzi, la sintesi organica ha prodotto molte sostanze utili che non sono presenti in natura, come l’acido acetilsalicilico, il principio attivo dell’aspirina®, o che è più economico sintetizzare a livello industriale, come il cortisone.
I problemi più difficili
La natura ha ancora molte cose da insegnare ai chimici: per esempio, i batteri sono gli unici organismi in grado di convertire direttamente l’azoto atmosferico in ammoniaca, nelle normali condizioni ambientali. I chimici, invece, per fare avvenire la stessa reazione devono impiegare alte temperature ed elevate pressioni.
Altri problemi molto difficili sono quelli legati al fatto che in natura non esistono mai singole reazioni isolate, ma sempre sistemi di reazioni, dovuti alla compresenza di molte sostanze in grado di reagire fra loro.
In questo contesto, il problema più affascinante, e tuttora senza soluzione, è quello dell’origine della vita. Si deve ancora scoprire quale sistema di reazioni possa trasformare la materia inorganica in un essere vivente in grado di riprodursi e di evolversi. Problemi più specifici, ma altrettanto complessi, sono posti dai sistemi di reazioni che nelle nicchie ecologiche collegano gli esseri viventi fra loro e con il mondo inorganico. Una vera protezione dell’ambiente dipende anche dalla nostra conoscenza di questi sistemi di reazioni.
Il viaggio del carbonio
Le avventure di un atomo di carbonio sono state raccontate mirabilmente nel libro Il sistema periodico (1975) dallo scrittore e chimico Primo Levi, che così descrive la reazione di decomposizione del carbonato di calcio: «Venne arrostito affinché si separasse dal calcio, il quale rimase per così dire con i piedi per terra e andò incontro a un destino meno brillante che non narreremo; lui, tuttora fermamente abbarbicato a due dei tre suoi compagni ossigeni di prima, uscì per il camino e prese la via dell’aria. La sua storia, da immobile, si fece tumultuosa». L’atomo di carbonio, ‘aggrappato’ a due atomi di ossigeno nella molecola CO2, «fu colto dal vento, abbattuto al suolo, sollevato a dieci chilometri. Fu respirato da un falco, discese nei suoi polmoni precipitosi, ma non penetrò nel suo sangue ricco, e fu espulso. Si sciolse per tre volte nell’acqua del mare, una volta nell’acqua di un torrente in cascata, e ancora fu espulso. Viaggiò col vento per otto anni, ora alto, ora basso, sul mare e fra le nubi, sopra foreste, deserti e smisurate distese di ghiaccio; poi incappò nella cattura e nell’avventura organica».