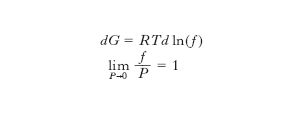fugacità
fugacità In chimica fisica, grandezza che tiene conto delle deviazioni presentate dai sistemi gassosi reali nei riguardi delle espressioni termodinamiche valide per i gas perfetti. Fu introdotta dal chimico americano G.N. Lewis nel 1908. Per i sistemi termodinamici a un solo componente la f. (f) è definita dalle espressioni:
[1]
[2]
dove P è la pressione, T la temperatura termodinamica, R la costante del gas, G l’energia libera del sistema. La [2] equivale alla condizione che la f. coincide con la pressione quando quest’ultima tende a zero, cioè quando il comportamento termodinamico del sistema equivale a quello di un gas perfetto. Il rapporto Φ=f/P è chiamato coefficiente di fugacità e tanto più differisce dall’unità quanto più il comportamento del sistema si allontana da quello di un gas perfetto. La definizione di f. può inoltre essere estesa anche a sistemi polifasici a più componenti e il suo utilizzo è di fondamentale importanza nella determinazione degli equilibri termodinamici. Infatti l’uguaglianza dei potenziali chimici tra fasi coesistenti, che determina la condizione di equilibrio termodinamico, può tradursi in virtù della [1] nell’uguaglianza (più comoda dal punto di vista applicativo) fra le corrispondenti fugacità.