alcoli
Composti chimici organici di formula generale R−OH dove R è un residuo saturo o insaturo mentre il gruppo ossidrilico è necessariamente legato a un atomo di carbonio saturo. Secondo la posizione del gruppo ossidrilico nella molecola, si distinguono in primari, secondari e terziari; i primari hanno il gruppo caratteristico −CH2OH, i secondari quello =CHOH e i terziari ≡COH; a seconda poi del numero dei gruppi ossidrilici presenti si distinguono a. mono-, bi-, trivalenti ecc. (a un atomo di carbonio non può essere mai fissato più di un gruppo alcolico).
La nomenclatura ufficiale della IUPAC (International Union of Pure and Applied Chemistry) individua un a. con il nome dell’idrocarburo da cui esso deriva, e al quale si aggiunge il suffisso -olo (o -diolo, -triolo, nel caso che siano presenti due, tre ecc. gruppi alcolici). Molto spesso al posto di questa nomenclatura si usa quella che all’aggettivo derivato dall’idrocarburo d’origine antepone la parola a.: così a. metilico (= metanolo), a. etilico (= etanolo) ecc.
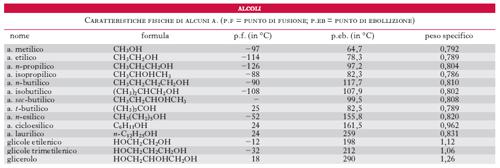
Gli a. monovalenti saturi (cioè quelli derivanti dall’idrocarburo saturo) si trovano in natura sotto forma di esteri in diverse essenze o si possono ottenere da processi di fermentazione di sostanze zuccherine (a. etilico, butilico ecc.); si possono formare per azione della potassa o dell’ossido d’argento sugli alogenuri alchilici, per riduzione delle aldeidi (i secondari invece per riduzione dei chetoni) ecc. Sono in genere liquidi incolori, miscibili con l’acqua (la miscibilità diminuisce rapidamente con l’aumentare del numero di atomi di carbonio della molecola); gli a. contenenti più di 10 atomi di carbonio sono solidi a temperatura ambiente. In tabella sono riassunte le proprietà fisiche degli a. più comuni. Gli a. primari, secondari o terziari si distinguono per i diversi prodotti d’ossidazione: i primari danno le aldeidi corrispondenti, i secondari i chetoni, i terziari invece danno prodotti (acidi o chetoni) a minor numero di atomi di carbonio. Gli a. possono sostituire l’idrogeno dell’ossidrile con i metalli per dare gli alcolati, reagiscono con gli acidi per dare gli esteri, con l’ammoniaca per dare le ammine ecc.
Gli a. non saturi (derivanti da idrocarburi non saturi) per la loro reattività si prestano a numerose sintesi.
Gli a. polivalenti hanno nomi diversi a seconda del numero di gruppi alcolici: così i glicoli o dioli quelli con due gruppi alcolici; glicerine, eritriti, pentiti, essiti, eptiti, quelli contenenti rispettivamente tre, quattro, cinque, sei, sette gruppi alcolici. Quando la sostituzione del gruppo ossidrile avviene in un atomo d’idrogeno di un gruppo alchilico di un composto aromatico o eterociclico si hanno a. detti rispettivamente aromatici o eterociclici, che hanno proprietà molto simili a quelle degli a. alifatici. Se la sostituzione dell’ossidrile avviene sull’anello aromatico del gruppo alchilico, non si hanno gli a. ma i fenoli. Molti a. hanno notevoli impieghi nell’industria: come solventi, per la preparazione degli esteri, degli eteri, delle aldeidi, per la preparazione di plastificanti, tensioattivi, antischiuma.
Dal punto di vista biochimico, l’ a. etilico viene degradato nel fegato: si forma dapprima acetaldeide a opera della alcole-deidrogenasi, quindi acetato a opera della acetaldeide-deidrogenasi, infine acetil-CoA che entra nel ciclo dell’acido citrico. Nel corso di questo processo viene favorita la formazione di acidi grassi cui si aggiunge una loro minore degradazione per l’effetto tossico dell’a. etilico sui mitocondri. La concentrazione di a. etilico nel sangue ( alcolemia) entro certi limiti è in rapporto con la quantità di alcol etilico ingerito. Quando supera il valore di 0,05 g per 100 cm3 di sangue alcuni processi psichici risultano alterati; il valore di 0,15 g esprimerebbe «ubriachezza netta, ma non bisognosa di cure»; al di sopra di 0,20 g si ha «ubriachezza conclamata, con necessità di cure»; al tasso di 0,50 g si hanno sempre conseguenze letali.