carbonio
Elemento chimico di simbolo C, numero atomico 6, peso atomico 12,01, di cui sono noti in natura gli isotopi stabili 126C, 136C (che ne costituiscono rispettivamente il 98,892% e l’1,108%), e 146C radioattivo (che si forma nell’atmosfera in conseguenza di reazioni nucleari tra l’azoto atmosferico e i neutroni lenti della componente secondaria dei raggi cosmici).
Caratteristiche
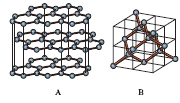
In natura il c. si trova sia allo stato libero sia in combinazione in numerosissimi composti. Il c. nativo si presenta nelle due forme allotropiche di diamante e grafite (fig. 1); inoltre si ottiene c. amorfo, nero, opaco, infusibile carbonizzando lo zucchero, o in forma meno pura, per riscaldamento a temperatura elevata di sostanze contenenti carbonio (coke, carbone di legna, nerofumo ecc.) al di fuori del contatto dell’aria; nel c. amorfo si hanno strutture microcristalline del tipo della grafite. Si possono anche ottenere strutture chiuse particolari formate da poche decine di atomi di carbonio (➔ fullereni). Il c. puro è inodore, insapore, insolubile nei solventi ma solubile in molti metalli fusi (ferro, cobalto, platino ecc.). Il c. fonde, alla pressione atmosferica, a circa 3800 °C; le diverse forme allotropiche hanno differente densità (diamante 3,51 g/cm3, grafite 2,1-2,3 g/cm3) e durezza Mohs (10 il diamante, 1 la grafite). A temperatura ordinaria è stabile (può reagire col fluoro), a temperatura più alta si combina rapidamente con l’ossigeno, con lo zolfo, col silicio, col boro e con molti metalli. Dal punto di vista chimico si comporta come un elemento non metallico, tetravalente.
Il c. era noto fin dall’antichità: Plinio descrive l’impiego del nerofumo nella preparazione di inchiostri, ma spetta ad A.L. Lavoisier il merito di averlo riconosciuto come elemento. J.J. Berzelius ne determinò il peso atomico, F.A. Kekulé ne stabilì la tetravalenza e J.H. Van’t Hoff la proprietà di dare origine a composti esistenti in forme enantiomorfe, otticamente attive, saturando le sue valenze con atomi o gruppi atomici differenti.
Impiego
Il c. si impiega nella forma amorfa come combustibile, come adsorbente, come ingrediente di vernici, inchiostri, per la carica della gomma ecc.; nella forma di grafite come lubrificante, per la preparazione di crogioli, di elettrodi ecc.; entra come elemento essenziale nella costituzione degli acciai e delle ghise (leghe ferro-c.); il diamante oltre che come pietra preziosa si usa industrialmente per abrasivi ecc. Il c. trova impiego anche come materiale di rinforzo ( fibre di c.) in materiali compositi; come materie prime per la preparazione delle fibre di c. si impiegano il poliacrilonitrile e le peci residue della lavorazione del carbone o del petrolio. Il trattamento che conduce alla produzione di fibre consiste essenzialmente in una ossidazione seguita da carbonizzazione in atmosfera inerte e, eventualmente, da grafitizzazione. I materiali compositi resina/fibra di c. presentano un elevato carico di rottura e trovano pertanto impiego nell’industria nautica, nella fabbricazione di attrezzi sportivi, nella costruzione di autovetture da competizione ecc.; materiali compositi costituiti da fibre di grafite in una matrice di c. amorfo vengono usati nella costruzione di freni per treni e per aerei militari.
Il c. in natura
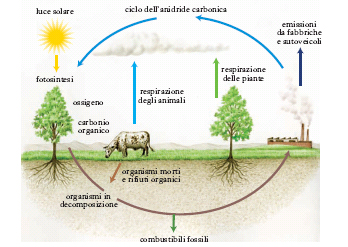
Il c. è un costituente fondamentale della materia vivente, presente sia sotto forma inorganica (carbonati e bicarbonati), sia soprattutto in forma organica. Come tutti gli elementi biogeni, subisce una serie di trasformazioni cicliche e passa continuamente dal mondo minerale a quello degli esseri viventi e viceversa. In fig. 2 è rappresentato in forma schematica il ciclo del c. che si compie in natura attraverso gli organismi terrestri e acquatici. Nei Mammiferi si trova in media il 22% in peso di c.; nel corpo di un uomo di circa 70 kg sono presenti circa 14 kg di c., cioè circa il 20%; nei vegetali le percentuali oscillano dal 54 all’11%. Tutto il c. degli organismi viventi proviene direttamente o indirettamente da quello dell’anidride carbonica atmosferica; i vegetali verdi (organismi autotrofi) mediante la funzione clorofilliana utilizzano l’anidride carbonica dell’atmosfera per sintetizzare, con l’intervento dell’energia solare (fotosintesi), una serie di composti organici che sono poi utilizzati dalle piante stesse e dagli animali (organismi eterotrofi) come materiale plastico da costruzione e per il loro metabolismo. Insieme ai due isotopi stabili, anche quello radioattivo, 146C, viene così a essere presente nella sostanza organica, la quale può essere perciò usata come materiale per un metodo di datazioni assolute (➔ datazione).
Si è calcolato che annualmente 80 miliardi di kg di anidride carbonica vengono sottratti all’atmosfera; un ettaro di foresta ne fissa da 2000 a 3000 kg, uno di terreno coltivato da 1400 a 2000 kg. Una quantità considerevole di anidride carbonica viene immessa nell’atmosfera anche attraverso le varie combustioni. Tale quantità è aumentata di circa il 25% negli ultimi 100 anni.
Composti
I composti del c. si dividono in due classi: inorganici e organici. I primi comprendono i derivati dell’acido carbonico (i vari carbonati), i composti con alcuni non metalli (solfuri, alogenoderivati, composti cianici ecc.), coi metalli (carburi vari); i secondi comprendono i composti del c. con idrogeno (idrocarburi), con idrogeno e ossigeno (composti ternari) e con idrogeno, ossigeno e azoto (composti quaternari). Il numero straordinariamente grande dei composti organici del c. è dovuto al fatto che gli atomi di c. hanno la proprietà di legarsi fra loro in gran numero formando lunghe catene aperte o cicliche e al fatto che il legame C−C è relativamente forte; inoltre la tetravalenza del c. consente la formazione di numerosissime combinazioni molecolari che, al crescere della complessità delle strutture, danno luogo a una grande quantità di sostanze isomere tra loro.
Per il biossido di c. ➔ carbonica, anidride.
Ossido (o monossido) di c. Gas incolore e inodore di formula CO, quasi insolubile in acqua, molto solubile in soluzione ammoniacale di cloruro di rame, velenosissimo; è più leggero dell’aria, bolle a −190 °C e solidifica a circa −200 °C. In natura si trova a volte nelle emanazioni vulcaniche. A differenza degli altri gas non è facilmente adsorbibile dal carbone attivo. Brucia con fiamma azzurra sviluppando 285 kJ/mol; miscele di aria e ossido di c. contenenti dal 12,5% al 75% di quest’ultimo sono esplosive. Si combina con il cloro formando fosgene, COCl2; a 120-130 °C si combina con l’idrossido sodico dando il formiato sodico e con gli alcolati per dare i sali dei corrispondenti acidi carbossilici; a temperatura elevata reagisce con lo zolfo formando ossisolfuro; con l’idrogeno, a 300 °C e in presenza di catalizzatori forma l’alcol metilico; miscele di ossido di c. e idrogeno danno anche luogo a diversi prodotti importanti per l’industria dei carburanti (processo Fischer-Tropsch); con il vapor d’acqua forma idrogeno e anidride carbonica (questa reazione è sfruttata nel processo di conversione del gas d’acqua); con il ferro, con il cobalto, con il nichel ed altri metalli forma carbonili. Per la sua tendenza a combinarsi con l’ossigeno ha la proprietà di ridurre, specie ad alta temperatura, numerosi ossidi metallici; ciò si sfrutta nella metallurgia del ferro, dello zinco e di numerosi altri metalli. L’ossido di c. si produce nella combustione incompleta del carbone. Industrialmente si prepara per riduzione a caldo dell’anidride carbonica con carbone, per ossidazione incompleta del carbone, o si ottiene come sottoprodotto nella fabbricazione dell’idrogeno.
L’azione tossica dell’ossido di c. si manifesta chiaramente sul sangue: l’affinità dell’emoglobina verso di esso è circa 220 volte più grande che non per l’ossigeno, ragion per cui la carbossiemoglobina è molto più stabile della ossiemoglobina; perciò soggiornando per un certo tempo in un’atmosfera che ne contenga anche piccole quantità (1 parte su 800) si può andare incontro alla morte per anossiemia. L’avvelenamento acuto si rivela con prevalenti disturbi nervosi (cefalea, vertigini, vomito, sonnolenza, paresi, perdita di coscienza, convulsioni) e con gravi necrosi dei gangli della base ed estese demielinizzazioni nel cervello (encefalopatia da CO); si ha pure ipotensione, glicosuria, dispnea e adinamia cardiaca. Il colore rosso vivo della carbossiemoglobina dà agli avvelenati da CO un caratteristico colorito rosso-ciliegia.
Solfuro di c. Composto, CS2, scoperto da W.A. Lampadius nel 1796; allo stato puro è un liquido incolore, di odore etereo, estremamente volatile, che s’infiamma con molta facilità producendo anidride carbonica e anidride solforosa. Bolle alla temperatura di 46,25 °C e fonde a −108,6 °C; è miscibile con benzene, alcol ed etere, poco solubile in acqua. Alla luce, specialmente in presenza di impurezze, tende a ingiallire. Nell’industria si ottiene per reazione fra zolfo e c. alla temperatura di circa 900 °C in storte riscaldate esternamente o in forni elettrici. Reagisce con gli alcali in soluzione alcolica formando gli xantogenati, identica reazione avviene con l’alcali-cellulosa: ne deriva lo xantogenato di cellulosa, importante intermedio nella fabbricazione dal raion alla viscosa. Con il cloro e in presenza di ferro e cloruro di zolfo si trasforma nel tetracloruro di carbonio. È impiegato come solvente per oli, grassi e cere, nella fabbricazione del raion, del cellofan, del tetracloruro di c., di xantogeneti, come insetticida e fumigante ecc.
Tetracloruro di c. Composto, CCl4; liquido incolore, denso, di odore etereo, velenoso (produce lesioni dell’apparato respiratorio, del fegato, dei reni ecc.), non infiammabile; bolle a 76,7 °C e fonde a −22,95 °C. È miscibile con alcol, etere, cloroformio e benzene; è invece poco solubile in acqua; si ottiene per reazione del cloro secco sul solfuro di c. in presenza di un catalizzatore o per clorurazione completa del metano. È impiegato nella preparazione di fluoroclorometani come solvente di oli, grassi, resine, cere, vernici, per la estrazione di sostanze odorose, come agente clorurante, nella fabbricazione del cloroformio, per sgrassare la lana e smacchiare tessuti ecc.