azoto
Generalità
Elemento chimico di numero atomico 7, simbolo N (lat. Nitrogenum), peso atomico 14,008, di cui sono noti diversi isotopi, alcuni naturali (147N, 157N), altri radioattivi. Il suo nome deriva dal fr. azote, voce coniata da G. de Morveau (1787) con il gr. ἀ- priv. e ζωή «vita». Infatti l’a. elementare, pur non essendo tossico, non mantiene la vita: un animale o una pianta posti in un’atmosfera di a. muoiono.
L’a. è diffuso in natura, sia allo stato libero, costituendo circa i 4/5 dell’aria ( a. atmosferico), sia in numerosi composti inorganici e organici (nitrato di sodio o nitro del Cile, sostanze proteiche ecc.). Gas biatomico, incolore, inodore, poco solubile nell’acqua; a 0 °C e pressione atmosferica ha densità assoluta 1,2505 kg/m3 e, relativa all’aria, 0,9682; ridotto allo stato liquido, bolle a −195,8 °C; solidifica a −210 °C. Ha temperatura critica di −147,1 °C e pressione critica di ≃34 bar. È pochissimo reattivo, essendo, dopo i gas nobili, l’elemento più inerte; a temperatura ambiente non si combina con quasi nessun elemento. Nei suoi composti si comporta come trivalente e pentavalente.
L’a. oggi si prepara, industrialmente, per distillazione frazionata dell’aria liquida. Si impiega come gas inerte per creare atmosfere controllate (in lavorazioni chimiche, metallurgiche, elettroniche), per travasare liquidi infiammabili ecc., ma l’uso più importante è nella preparazione di alcuni suoi composti, fondamentali nell’industria, quali ammoniaca, sali d’ammonio, acido nitrico, calciocianammide, cianuri, azoturi ecc., usati come base per fertilizzanti, esplosivi, materie plastiche, tensioattivi ecc.
Per misurare l’a. che si sviluppa dalla combustione di sostanze organiche azotate si impiega l’ azotometro, apparecchio costituito da un tubo graduato, pieno di una soluzione di idrato potassico, nel quale vengono inviati i prodotti di combustione, assorbiti tutti dalla soluzione, a eccezione dell’a. il cui volume si può leggere sulla graduazione del tubo.
Fissazione dell’a. atmosferico
Processo mediante il quale l’a. dell’atmosfera viene combinato per formare un composto; si presentano due casi a seconda che la fissazione avvenga per mezzo di batteri o artificialmente. Il primo caso interessa l’agricoltura in quanto, per l’azione di microrganismi, l’a. libero si trasforma in composti direttamente utilizzabili dalle piante. Il secondo caso interessa l’industria, che produce composti azotati in diverse maniere; i principali metodi sono quelli di preparazione:
a) dell’ossido d’a., NO (in forni elettrici a temperature elevatissime) che per qualche tempo servì alla preparazione dell’acido nitrico;
b) dell’ammoniaca, NH3, per sintesi diretta dagli elementi sotto l’azione del calore, pressione e catalizzatori; è il metodo oggi più usato perché il più economico;
c) della calciocianammide (➔) per unione dell’a. al carburo di calcio, dei cianuri e degli azoturi.
Inoltre bisogna tener conto che nell’atmosfera, per l’azione di scariche elettriche, l’a. libero dell’aria si combina in piccola parte, per formare composti, con l’ossigeno.
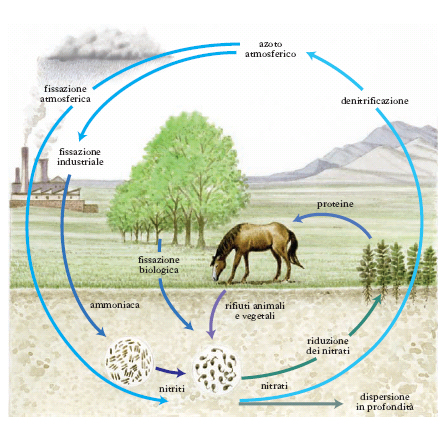
Ciclo dell’azoto
Benché l’a. venga sottratto continuamente all’atmosfera in quantità enormi, la composizione di questa non varia apprezzabilmente, dimostrando così che l’a., dopo aver partecipato a una serie ciclica di trasformazioni, viene nuovamente restituito all’atmosfera. Il ciclo biologico dell’a., che è uno dei processi fondamentali per il mantenimento della vita terrestre, inizia con la fissazione dell’a. atmosferico da parte dei microrganismi del terreno. I microrganismi che intervengono in questo processo appartengono a due tipi fondamentali: a) microrganismi a vita libera come i clostridi, le alghe blu, i batteri purpurei e soprattutto gli Azotobacter; b) microrganismi simbionti, dei quali l’esempio più noto è quello dei batteri del genere Rhizobium, che vivono nei noduli radicali delle leguminose, in simbiosi con queste. L’associazione pianta-batteri fissa l’a. atmosferico e produce amminoacidi tra cui acido aspartico e acido glutammico, che la pianta da sola non sarebbe in grado di sintetizzare. L’enzima responsabile della fissazione dell’a. atmosferico è la nitrogenasi, che richiede la presenza di cofattori, in particolare molibdeno e ferro e il cui meccanismo d’azione non è stato ancora completamente chiarito.
Il processo inverso di restituzione di a. all’atmosfera avviene anch’esso per opera dei microrganismi del terreno che idrolizzano mediante i loro enzimi le molecole organiche, fino ad amminoacidi, i quali vengono poi deamminati mediante meccanismi diversi e liberano ammoniaca. Infine, nel suolo sono presenti numerosi batteri che permettono la trasformazio;ne di prodotti ammoniacali, dannosi oltre certi limiti di concentrazione per la vita vegetale, in nitriti e poi in nitrati. Negli organismi animali l’a. viene assimilato unicamente attraverso l’apparato digerente, come componente delle sostanze proteiche, ed escreto attraverso i reni e l’intestino e in piccola parte mediante la pelle, per sudorazione.
Aspetti biomedici
Insieme a carbonio, ossigeno e idrogeno l’a. è uno degli elementi biogeni fondamentali: costituisce infatti il 2,4% del corpo umano. Esso entra nella costituzione delle sostanze proteiche ( a. proteico), costituenti essenziali del protoplasma cel;lulare, degli acidi nucleici e di molti altri composti biochimici. Si indica come bilancio dell’a. la relazione esistente fra l’a. ingerito da un organismo umano (sotto forma di proteine) e quello espulso nell’urina (sotto forma di urea, ammoniaca, acido urico e altre sostanze azotate: azoturia).
L’ azotemia è la concentrazione di a. che rimane nel sangue dopo che le proteine sono state da esso allontanate con opportuni reagenti e che si indica anche come a. incoagulabile. Questo a. non proteico è dato da composti che sono prodotti di rifiuto dell’organismo e vengono continuamente eliminati con l’urina, come l’urea e l’acido urico; da composti che sono di continuo utilizzati dai tessuti, come gli amminoacidi e i polipeptidi, e da altri prodotti azotati (ammoniaca, creatina, creatinina ecc.). Il valore normale dell’a. non proteico oscilla tra g 0,20 e 0,50‰ qualora si faccia riferimento all’urea e tra g 0,10 e 0,23‰ qualora si consideri il solo azoto. Mentre la diminuzione dell’azotemia al di sotto dei valori normali è evenienza poco frequente (per lo più connessa a grave insufficienza epatica), l’aumento patologico è clinicamente assai significativo (➔ iperazotemia). L’a. ureico rappresenta la frazione più importante (45%) di tutto l’a. non proteico, e più accuratamente riflette il catabolismo proteico. Nelle disfunzioni renali aumenta più rapidamente e in misura nettamente superiore rispetto agli altri composti azotati.
Derivati dell’azoto
Biossido d’a. Gas fortemente colorato in rosso bruno di formula NO2; per raffreddamento si condensa in un liquido chiaro nel quale sono presenti le molecole dimere (ipoazotide); fra le due forme esiste un equilibrio N2O4⇄2NO2 che si sposta verso destra con il crescere della temperatura.
Bromuro d’a. Liquido pesante, irritante, lacrimogeno, di formula NBr3.
Cloruro d’a. Liquido oleoso, dall’odore sgradevole e irritante, di formula NCl3; è pericolosissimo per la facile tendenza a decomporsi con esplosione.
Fluoruro d’a. Gas incolore, stabile al calore, di formula NF3;
Ioduro d’a. Benché non si conosca il composto corrispondente alla formula NI3, ne sono noti alcuni composti di addizione con l’ammoniaca (con formula NI3‧nNH3), che sono in genere tanto meno esplosivi quanto maggiore è il numero n di molecole d’ammoniaca presenti.
Ossido d’a. Gas incolore, poco solubile in acqua, di formula NO, capace di reagire con notevole facilità con l’ossigeno per dare il biossido d’a.; si può formare per sintesi diretta dagli elementi a elevata temperatura secondo la reazione N2+O2⇄2NO; questo metodo di fissazione dell’a. atmosferico ha costituito il primo stadio del primo processo di sintesi dell’acido nitrico.
Protossido d’a. Gas incolore, inodore, di sapore dolciastro, di formula N2O. Detto anche ossidulo d’a., o gas esilarante, è abbastanza solubile in acqua e ancor più in alcol. Se respirato dà una leggera ebbrezza; ha proprietà anestetiche; si somministra diluito con aria od ossigeno e provoca narcosi prive di gravi azioni collaterali.
Solfuro d’a. Composto formato da zolfo e a.; se ne conoscono 3: N2S4, N2S5 e N4S4. Il primo si presenta in cristalli di color rosso-arancio che esplodono per percussione (per cui è stato proposto come detonante). Il secondo è un liquido rosso scuro che tende a decomporsi con formazione di ammoniaca e separazione di zolfo. Il terzo, solido cristallino giallo, si decompone in modo esplosivo per riscaldamento.
Per il pentossido d’a., sinonimo di anidride nitrica N2O5 ➔ nitrico, acido. Per il tetrossido d’a. ➔ ipoazotide.