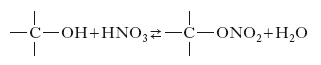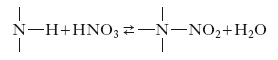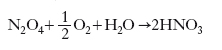nitrico, acido
Il più importante degli acidi derivati dall’azoto, detto anticamente acqua forte o spirito di nitro.
Caratteri generali
Ha formula HNO3 e si trova in natura sotto forma di sali (nitrati). L’acido puro solidifica a −41,6 °C e bolle a 86 °C decomponendosi facilmente; è un energico ossidante; i metalli al suo contatto formano i nitrati corrispondenti senza sviluppare idrogeno perché una parte dell’acido si riduce a ossido di azoto. I metalli nobili non sono attaccati dall’acido anche se concentrato, altri (come l’alluminio) sono attaccati dall’acido diluito ma non dal concentrato. L’acido n. ossida la maggior parte dei composti organici o li trasforma in nitroderivati ; caratteristica è la colorazione gialla che conferisce alla pelle (reazione xantoproteica).
L’acido n. è uno degli acidi di maggior consumo: si usa nella preparazione di esplosivi, di fertilizzanti, di coloranti organici artificiali e di numerosissimi composti organici, impiegati per preparare prodotti farmaceutici, profumi. L’acido è messo in commercio sotto forma di acido n. fumante (di colore giallo-rosso per la presenza di NO2) o sotto forma di soluzioni acquose (a densità 1,35-1,40 g/cm3 [ca. 60-65% di HNO3], e 1,52 [99,5% di HNO3]).
Metodi di produzione
Sintesi. - All’inizio del Novecento acquistò importanza il processo di sintesi diretta dell’ossido di azoto dall’ossigeno e dall’azoto dell’aria:
La reazione è endotermica e quindi l’equilibrio risulta tanto più spostato verso la formazione di NO quanto maggiore è la temperatura; si utilizzano, pertanto, le alte temperature ottenibili con un arco elettrico, avendo cura di raffreddare la miscela il più rapidamente possibile dopo il passaggio fra i due elettrodi, per evitare la decomposizione di NO.
Ossidazione. - La preparazione di NO per sintesi dagli elementi, pur rimanendo oggetto di numerose ricerche, non è competitiva, dal punto di vista economico, con il metodo di preparazione basato sull’ossidazione parziale dell’ammoniaca con aria secondo la reazione: formula
Occorre operare in presenza di un catalizzatore opportuno, a temperatura controllata (820-850 °C), con un tempo di contatto estremamente breve (ca. 10−4 s); verificandosi tali condizioni, avviene la reazione precedente e non quella di combustione totale: formula
Il catalizzatore è costituito da una rete (con più di 1000 maglie/cm2) di fili di platino cui si addizionano piccole percentuali di rodio e osmio (5-10%). L’ossido di azoto viene ossidato a biossido di azoto secondo la reazione:
Questa reazione è esotermica e, come tale, è favorita dalle basse temperature: NO2 comincia a formarsi a temperature inferiori a 600 °C e a 150 °C l’ossidazione è praticamente totale; a temperature inferiori a 150 °C, NO2 tende a dimerizzarsi formando ipoazotide: formula
Anche questa reazione è esotermica ed è, pertanto, spostata tanto più verso la formazione di ipoazotide quanto più bassa è la temperatura; a 30 °C circa il 50% di NO2 è in forma dimerizzata. Infine si fa reagire la miscela di NO2 e N2O4 con acqua; si hanno le reazioni:
[1] formula[2]
Per aumentare la resa in HNO3, conviene che l’assorbimento (con reazione chimica) di NO2 e N2O4 avvenga a bassa temperatura e che, contemporaneamente all’assorbimento, possa aver luogo l’ossidazione dell’ossido di azoto. In definitiva il metodo di produzione di acido n. per ossidazione parziale di ammoniaca, dal punto di vista chimico è descritto dalle reazioni precedenti.
Pressione. - Si distinguono diversi processi: quelli nei quali tutte le reazioni sopraddette avvengono a pressione atmosferica, quelli che operano sia la ossidazione dell’ammoniaca sia le fasi successive sotto pressione (di solito 3-8 bar), quelli che operano l’ossidazione dell’ammoniaca a pressione atmosferica e la successiva ossidazione degli ossidi d’azoto sotto pressione. Nella fig. è riportato lo schema di un processo di produzione del primo tipo; il gas contenente NO ottenuto nel bruciatore a cede una parte del proprio calore sensibile nel generatore di vapore b e viene infine raffreddato a 30-40 °C nel refrigerante c. L’assorbimento dei gas nitrosi in acqua avviene nelle torri d collegate in serie e realizzanti il principio della controcorrente fra soluzione assorbente e gas: l’ultima torre, infatti, è alimentata con acqua e l’acido diluito che si raccoglie in fondo alla torre stessa viene raffreddato nel refrigerante e e costituisce la soluzione assorbente della torre precedente, e così via fino alla prima torre. In tal modo la corrente gassosa, man mano che si va esaurendo in NO nel percorrere le torri di assorbimento, incontra soluzioni assorbenti sempre più diluite in acido n.; questa disposizione consente di mantenere apprezzabili i salti motori e, quindi, le velocità di trasferimento di materia fra la fase gassosa e quella liquida in ogni punto della sezione di assorbimento. Il gas uscente dalla torre alimentata con acqua attraversa la torre f dove subisce un lavaggio con alcali che assorbono gli ossidi di azoto ancora contenuti nel gas stesso; questo è infine scaricato attraverso un camino. L’acido n. (al 50% ca.), ottenuto in fondo alla prima colonna di assorbimento, viene inviato nella colonna g, dove una corrente di aria rimuove gli ossidi di azoto in soluzione.
Nel processo che opera a pressione atmosferica i bruciatori e le torri di assorbimento sono piuttosto grandi, ma la resa in NO è elevata e la perdita del catalizzatore è relativamente modesta. Nei sistemi a pressione, invece, il catalizzatore subisce una usura molto più spinta; il volume dei gas è minore, perciò a parità di produzione si hanno impianti più compatti; poiché però la reazione di ossidazione dell’ammoniaca è sfavorevolmente influenzata dalla pressione, le rese di trasformazione dell’ammoniaca sono un po’ inferiori a quelle ottenibili nei sistemi che lavorano a pressione atmosferica. Nei processi del terzo tipo si vengono a sfruttare i vantaggi dei processi dei due tipi precedenti; essi hanno però l’inconveniente di richiedere compressori, in acciaio inossidabile, per comprimere i gas provenienti dall’ossidazione dell’ammoniaca opportunamente raffreddati.
Acido concentrato. - Con i procedimenti precedenti si ottiene un acido n. di concentrazione non superiore al 60-65%. Quando si vuole un acido di concentrazione superiore si ricorre o a una concentrazione per distillazione o a sistemi che portano direttamente a un acido più concentrato. Poiché acqua e acido n. formano un azeotropo col 68% di acido n., questa concentrazione costituisce la massima raggiungibile con una distillazione semplice; volendo tenori più elevati occorre operare la distillazione in presenza di un disidratante, come, per es., l’acido solforico concentrato o una soluzione di nitrato di magnesio.
Vi sono sistemi d’ossidazione dell’ammoniaca che consentono di arrivare direttamente a un acido concentrato; essi si basano sull’eliminazione rapida di parte delle molecole di acqua, che si sviluppano nell’ossidazione dell’ammoniaca, ancor prima che s’inizi l’ossidazione degli ossidi d’azoto; si può anche operare una separazione selettiva di N2O4 dai gas che lo contengono, ossidandolo poi ad anidride nitrica (N2O5), composto che si presenta in cristalli incolori che fondono a 30 °C e che, in presenza della quantità stechiometrica di acqua, dà acido n. al 100%. La separazione dell’N2O4 si opera o per condensazione o per assorbimento in un liquido di lavaggio. Nel primo caso la condensazione dell’N2O4 è preceduta dalla condensazione di parte dell’acqua che si produce nell’ossidazione dell’ammoniaca; ciò si realizza, per es., mediante raffreddamento dei gas della combustione, fatti passare in una caldaia a vapore che può essere incorporata nel bruciatore stesso, subito al di sotto delle reti di platino. La trasformazione dell’N2O4 ad acido n. concentrato si realizza in autoclavi, dove l’N2O4 viene messo a reagire con ossigeno e acqua (o acido n. diluito) a circa 50 bar e 70 °C; si produce così la reazione: formula
che porta ad acido n. al 100% se la quantità di acqua aggiunta (come tale e sotto forma di acido n. diluito) è quella stechiometrica necessaria.
Nitrati
I nitrati sono i sali dell’acido nitrico. Sono quasi tutti facilmente solubili in acqua, alcuni si decompongono a contatto con essa. Alcuni metalli formano, oltre ai nitrati normali, anche nitrati basici. I nitrati dei metalli alcalini fondono senza decomporsi e a temperature più elevate si trasformano in nitriti (➔ nitroso, acido) perdendo un atomo d’ossigeno; quelli degli altri metalli invece si decompongono per riscaldamento in ossido metallico, ipoazotide e ossigeno. Alcuni nitrati formano sali doppi. I nitrati di sodio, NaNO3, di potassio, KNO3, di ammonio, NH4NO3, e di calcio, Ca(NO3)2, hanno particolare importanza tecnica perché usati largamente come fertilizzanti e anche per miscele esplosive. Nella maggior parte dei paesi essi si preparano partendo dall’acido n. di sintesi. La presenza dello ione nitrato in un’acqua è spesso indice di inquinamento in quanto tale ione risulta il prodotto finale del processo ossidativo dell’azoto ammoniacale di origine organica.
In chimica organica, si chiamano nitrati gli esteri dell’acido n. ottenuti per azione dell’acido n. o della miscela solfonitrica sugli alcoli. Sono liquidi di odore gradevole, instabili al riscaldamento. Molto importanti sono gli esteri dell’acido n. con gli alcoli polivalenti (nitroglicerina, nitrocellulosa). Si hanno anche i nitrati acilici che risultano dall’unione di un radicale acido col gruppo −NO2, come, per es., il nitrato d’acetile, C2H3COONO2, e di benzoile, C6H5COONO2.
Nitronio
Il nitronio è lo ione NO2+ che si forma quando l’acido n. è in presenza di acidi fortissimi quali il solforico, il perclorico e il fluoborico; in questi casi ha luogo una reazione acido-base nella quale l’acido n. si comporta da base:
HNO3 + H2SO4 → NO2+ + HSO4− H2O.
Lo ione nitronio è di difficile individuazione e le prove della sua esistenza sono state ricavate da misure crioscopiche e dalla determinazione della struttura di alcuni sali (fluoborato e perclorato di nitronio) tramite raggi X; è stato anche dimostrato che tali sali nitrano con facilità i composti aromatici. Questi dati sperimentali hanno permesso di concludere che lo ione nitronio costituisce l’intermedio elettrofilo del meccanismo della nitrazione aromatica.