ossigeno
Elemento chimico, simbolo O, gassoso, incolore, inodore, insapore, contenuto nell’aria e in forma combinata nell’acqua; alimenta la respirazione ed è perciò indispensabile alla vita.
Chimica
Generalità
L’o. ha numero atomico 8, peso atomico 15,9994; ne sono noti gli isotopi 168O (99,76%), 178O (0,04%), 188O (0,20%) e anche gli isotopi 148O, 158O, 198O, che sono però instabili, con vita media molto breve. L’o. è l’elemento più abbondante e più diffuso in natura: allo stato libero è contenuto nell’aria (20,95% del volume o 23,14% della massa), combinato si trova nell’acqua (88,8% in massa) e costituisce circa il 27% della crosta terrestre. La densità rispetto all’aria è 1,10535, rispetto all’idrogeno è 15,9; un litro di o. a 0 °C e a pressione atmosferica, al livello del mare e alla latitudine di 45°, ha una massa di 1,429 g; la temperatura critica è −118,4 °C, la pressione critica è 50,8 bar. È poco solubile in acqua, alquanto più solubile in alcol e in acetone; si discioglie anche in diversi metalli fusi. L’o. liquido è di colore azzurro chiaro, bolle a −182,9 °C e solidifica a −218,4 °C in cristalli esagonali di colore blu. L’o. ordinario forma molecole biatomiche O2, che si scindono soltanto a temperature molto elevate (la scissione completa si ha a circa 5000 °C).
Direttamente o indirettamente l’o. si combina con tutti gli elementi a eccezione dei gas rari; la sua velocità di combinazione è molto influenzata dalla presenza di tracce di umidità. Allo stato assolutamente secco, condizione che in pratica si verifica raramente, l’o. è pressoché inattivo: il fosforo e lo zolfo possono essere distillati in atmosfera secca di o. e il carbonio può essere riscaldato al calore rosso senza che si abbia combustione. Le reazioni di combinazione dell’o. (➔ ossidazione) si compiono con sviluppo di calore (tranne rarissimi casi) e, quando la velocità di reazione e l’aumento della temperatura sono notevolmente elevati, il processo va sotto il nome generico di combustione. Il verificarsi di queste condizioni dipende, oltre che dall’affinità dell’o. per la sostanza reagente, anche dallo stato di suddivisione di questa: così il ferro, che in forma compatta si ossida lentamente, allo stato suddiviso reagisce infiammandosi spontaneamente (ferro piroforico). Altri elementi e composti, quali il fosforo, il cesio, l’idrogeno fosforato liquido, reagiscono con l’o. a temperatura ordinaria infiammandosi; in altri casi l’ossidazione diventa rapida soltanto a temperatura elevata. I metalli nobili si ossidano con estrema difficoltà. Altre reazioni di ossidazione avvengono soltanto in presenza di catalizzatori, come nel caso dell’ossidazione dell’ammoniaca ad acido nitrico, dell’anidride solforosa a solforica ecc. Il platino e il palladio finemente suddivisi assorbono notevoli quantità di o., che cedono soltanto al calor rosso; l’o. liberato in tali condizioni è molto più attivo di quello ordinario ed è capace di provocare l’ossidazione del benzene a fenolo, di decolorare l’indaco ecc. Sotto l’azione di scariche elettriche l’o. atmosferico (O2) viene trasformato in ozono (O3). Nei composti l’o. è bivalente; forma però cationi (per es., idrossido, ossonio) nei quali la sua valenza formale è tre. La determinazione analitica dell’o. in un’acqua si effettua con il saggio di Winkler (➔ Winkler, Clemens).
L’o. è uno degli elementi fondamentali nella costituzione degli organismi viventi. È utilizzato dagli organismi aerobi come accettore finale di elettroni nella catena respiratoria (➔ fosforilazione), in cui la citocromoossidasi catalizza la reazione finale di trasferimento di 4 elettroni dal citocromo c all’o. molecolare. A causa della struttura elettronica dei suoi orbitali p esterni, l’o. può subire una riduzione parziale accettando un solo elettrone e dando così luogo allo ione radicalico superossido O2− da cui si possono generare altre specie radicaliche dotate di elevata tossicità (➔ radicale).
Produzione e impiego
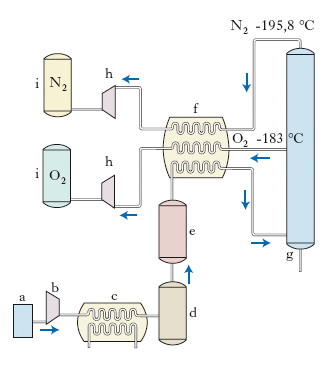
Industrialmente l’o. si ottiene per distillazione frazionata dell’aria liquida: attraverso un filtro a (v. fig. ) l’aria passa in un compressore b e quindi in uno scambiatore di calore aria-acqua c, dove viene raffreddata a 4 °C; di qui l’aria viene inviata, attraverso un deumidificatore d e un filtro a setaccio molecolare e, nello scambiatore di calore in controcorrente f, dove passa allo stato liquido, e quindi inviata alla torre g dove, per distillazione frazionata, si ricavano i gas e azoto sfruttando la loro differente temperatura di ebollizione (−183 °C per l’o. e −195,8 °C per l’azoto). I gas, dopo il passaggio nello scambiatore di calore, vengono compressi in h e immagazzinati in i. In questo modo si ottiene circa il 97% della produzione totale di ossigeno.
Per produzioni inferiori e meno esigenti dal punto di vista della purezza si vanno sempre più affermando due metodi condotti a temperature prossime a quella ambiente, il setacciamento molecolare e la separazione a membrana. L’uso dei setacci molecolari a base di zeoliti consente di rimuovere dall’aria in modo selettivo l’azoto, l’acqua e l’anidride carbonica, ottenendosi così aria arricchita in o. (massima purezza: 95%); il metodo è realizzabile in condizioni economicamente convenienti quando la capacità produttiva è compresa fra 10 e 100 t al giorno. Aria arricchita in o. (massima purezza: 40%; capacità produttiva: 5410 t al giorno) può essere ottenuta anche tramite separazione in fase gassosa operata da membrane permselettive; dal 2002 sono in via di sviluppo membrane di tipo speciale capaci di produrre aria arricchita in o. fino all’80%.
L’o. è impiegato nei cannelli ossidrici e ossiacetilenici per le saldature autogene, per il taglio di lamiere e di blocchi metallici e per raggiungere in genere alte temperature necessarie per speciali lavorazioni (fusione e lavorazione del quarzo, del platino ecc.); in processi di gassificazione; nell’industria dei composti organici (ossidazione dell’aldeide acetica ad acido acetico, dell’alcol metilico ad aldeide formica ecc.); in siderurgia, nei moderni processi di preparazione dell’acciaio; in taluni processi biologici di depurazione delle acque di rifiuto; per ossidare gli oli siccativi; per imbiancamento; l’o. liquido è impiegato come ossidante nei polipropellenti (➔ propellente).
Il forte incremento di consumo di o. (dovuto soprattutto alla sua utilizzazione nel campo metallurgico e siderurgico) ha portato all’accrescersi delle dimensioni degli impianti di produzione; l’aumento di consumo di o. ha portato anche a variazioni nel sistema di distribuzione. In molti casi i maggiori consumatori hanno costruito impianti propri evitando così il trasporto di gas. In altri casi si è fatto ricorso a trasporto mediante tubazione, cioè a ossigenodotti. Il trasporto dell’o. compresso in bombole è economicamente conveniente solo per moderati quantitativi e per distanze relativamente brevi poiché la massa del contenitore di acciaio, pari a 5-10 volte quella del contenuto, viene a incidere notevolmente sul costo di trasporto. Si è diffuso invece il trasporto di o. allo stato liquido a pressione bassa (15-20 bar), e a temperatura di poco inferiore a quella di liquefazione (che è di −183 °C); si utilizzano a questo scopo serbatoi di dimensioni variabili a seconda dei casi, trasportabili con mezzi diversi (ferrovia, autocarri, navi ecc.); per l’o. liquido la massa del contenitore può essere al massimo uguale, ma di solito inferiore, fino anche alla metà di quella dell’o. contenuto. Analogamente lo stoccaggio dell’o. si effettua allo stato liquido in serbatoi fissi della capacità anche di 500-1000 m3.
Ecologia
La determinazione dell’o. è di fondamentale importanza negli ecosistemi acquatici, nei quali costituisce un importante fattore limitante per la vita degli organismi. La quantità di o. in questi ecosistemi è il risultato del bilancio tra la produzione e la respirazione della comunità: di solito, per valutare lo stato di salute di uno stagno o di un lago, relativamente alla presenza di o., si usa la tecnica nota come metodo della bottiglia chiara e scura. Bottiglie chiare e scure vengono riempite con l’acqua dell’ecosistema e lasciate in situ per 24 ore. In queste bottiglie, che contengono la comunità planctonica, viene quindi misurata la quantità di o. presente, che rappresenta rispettivamente la produzione netta (bottiglia chiara, in cui avvengono fotosintesi e respirazione) e la respirazione (bottiglia scura, in cui non può avvenire la fotosintesi) della comunità, ipotizzando che le bottiglie all’inizio del saggio contengano la stessa comunità planctonica. Nei sistemi in buona salute la produzione di o. è maggiore della respirazione, e ciò garantisce la persistenza della comunità. Nel caso di immissione di reflui, è oltremodo importante valutare quale sarà l’impatto degli stessi sulla quantità di o. presente; a questo scopo è possibile determinare due indici, il BOD e il COD.
Geologia
Stadio isotopico dell’o. Valore estremo del rapporto isotopico dell’o. 18/16O, misurato nei gusci degli organismi marini, le cui variazioni sono connesse a oscillazioni climatiche come quelle che si sono verificate durante il Quaternario e il Pliocene.
Medicina
Ossigenoterapia Terapia basata sulla somministrazione di o., o di miscele gassose contenenti o., a una pressione parziale superiore a quella dell’o. atmosferico a livello del mare. È praticata per inalazione di o. a pressione parziale inferiore a 760 mm Hg (ossigenoterapia normobarica) mediante cannule nasali, maschere, tende, in tutte le forme di anossia: insufficienza respiratoria, diminuzione della massa sanguigna circolante, edema polmonare acuto ecc.; oppure per somministrazione di o. a pressione parziale superiore a 760 mmHg (ossigenoterapia iperbarica) in speciali apparecchiature, dette camere iperbariche, nel trattamento di intossicazioni da ossido di carbonio, di alcune infezioni, degli stati di shock ecc.
Per l’ossigenoterapia vengono usate camere e tende a o.: le prime sono camere di piccole dimensioni, a chiusura perfettamente ermetica, fornite di aria condizionata, in cui la concentrazione di o. può essere variata secondo le necessità; le seconde sono tende di materiale plastico trasparente che si applicano al letto del malato e in cui, mediante un erogatore, si immette o. alla pressione e alla concentrazione richieste.
L’ossigenatore è un apparecchio che sostituisce la funzione polmonare assicurando l’apporto extracorporeo di o. al sangue che, mediante apposite pompe, vi viene convogliato per derivazione dalle vene cave e viene poi reimmesso nell’aorta del paziente: è utilizzato in cardiochirurgia per l’esecuzione di interventi in circolazione extracorporea totale e, più raramente, nell’ossigenoterapia in casi di grave insufficienza respiratoria acuta.