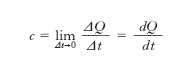calore
Particolare forma di energia (energia termica) che si trasmette, si trasferisce, si propaga da un punto a un altro di un corpo, da un corpo a un altro, da un sistema a un altro per il solo effetto di una differenza di temperatura.
Fisica
Come ogni forma di energia, il c. può trasformarsi in altre forme o originarsi da energia di natura diversa. Il c. trasmesso a un corpo non si accumula in esso come tale, ma sotto forma di energia interna in quanto il c., avendo significato soltanto come forma di energia in trasferimento, non può essere posseduto dai corpi. Il c. è la causa di numerosi fenomeni, quali la dilatazione dei corpi o i cambiamenti di stato (ebollizione, fusione, sublimazione ecc.).
Teorie sulla natura del calore
Le varie teorie sulle quali si è basata l’interpretazione della natura del c. possono molto schematicamente essere suddivise in cinetiche (secondo le quali il c. è il movimento delle parti minime dei corpi) e sostanzialistiche (il c. è una sostanza sui generis). Le radici di queste concezioni sono presenti nell’opera dei grandi filosofi dell’antichità classica: per Eraclito il fuoco, alla base di tutto, era un principio dinamico; Empedocle poneva il fuoco tra i quattro principi immutabili (elementi) dai quali si è costituita la materia; Aristotele, accanto ai quattro elementi empedoclei, poneva la quintessenza, che avrebbe svolto un ruolo rilevante nell’interpretazione di alcuni fenomeni termici; nella teoria atomistica di Democrito sono presenti gli atomi di caldo e di freddo, e questa concezione è illustrata da Lucrezio nel De rerum natura.
Le concezioni classiche furono riprese e sottoposte a un attento vaglio critico nel Rinascimento, anche alla luce delle numerose informazioni che si andavano raccogliendo sulla fenomenologia del calore. Galileo condivideva la concezione democritea del c. e riteneva (Il Saggiatore, 1623) che negli oggetti che producono la sensazione di caldo fosse presente una moltitudine di corpicelli minimi (ignicoli, minimi ignei) animati da un veemente moto di agitazione, ma precisava che il freddo altro non era che una privazione di calore. F. Bacone nel Novum Organum (1620) inseriva, per illustrare come andasse applicato il metodo induttivo, un vero e proprio trattatello sul c. nel quale, basandosi sulla produzione del c. per attrito, concludeva che il c. è un moto di espansione, trattenuto e impedito, il quale opera per parti minime; per Cartesio (Principia philosophiae, 1644) ciò che nei corpi veniva chiamato c. era una piccola agitazione delle particelle dei corpi stessi; anche I. Newton (Opticks, 1704) affermò che il c. consiste in un movimento vibratorio delle parti dei corpi.
Tra i chimici prevale la concezione sostanzialistica che si riallaccia alla tradizione empedoclea-aristotelica. Un notevole influsso sulle teorie del c. fu esercitato dalle cosiddette teorie del flogisto che contengono implicazioni dirette sulla natura del c.; secondo la classica teoria di G.E. Stahl (1716). Il flogisto, principio non isolabile che si libera nei processi di combustione e nella calcinazione dei metalli, è non solo un ente adatto al movimento igneo ma proprio quello che vi sembra unicamente destinato, è cioè la vera materia del fuoco.
D. Bernoulli (Hydrodinamica, 1738) sviluppò la prima vera teoria cinetica dei gas in senso moderno, basata sull’assunto che il c. è un crescente movimento intestino delle particelle dei corpi. In un clima di grandissimo interesse per la fisica del c., nel 1783 A. Lavoisier e P.-S. Laplace presentarono all’Accademia delle scienze di Parigi il Mémoire sur la chaleur, nel quale si precisa che non vi era accordo tra i fisici circa la natura del c., da molti considerato un fluido e da altri un movimento insensibile delle molecole della materia. Essi tuttavia non ritennero di dover operare una scelta tra le due ipotesi, che potrebbero ambedue sussistere: infatti, poiché queste sarebbero state le uniche ipotesi per spiegare la natura del c., accettano i principi comuni a entrambe. Lavoisier e gli altri autori della nuova nomenclatura chimica stabilirono nel 1787 di chiamare calorico la sostanza del c.: pochi altri enti avevano ricevuto tante denominazioni diverse quante questa sostanza che, indicata nella simbologia chimica con Δ, di volta in volta era stata chiamata c. fissato, c. latente, c. occulto, fluido igneo, materia del fuoco, materia del c., principio del fuoco o fuoco principio, principio espansibile, principio infiammabile o flogisto. Nei due decenni successivi, Laplace e S.-D. Poisson elaborarono un sofisticato modello caloricistico degli aeriformi, con il quale erano in grado di spiegare la quasi totalità dei fenomeni termici nei gas e di calcolare la velocità del suono nell’aria in perfetto accordo con il valore sperimentale. Anche J. Dalton e A. Avogadro aderirono incondizionatamente alla concezione caloricistica.
Praticamente il solo T. Young, portato dai suoi studi sull’interferenza della luce ad ammetterne la natura ondulatoria ed essendo a conoscenza delle notevoli analogie riscontrate da W. Herschel tra il comportamento della luce e del calore raggiante, rifacendosi esplicitamente a Newton sosteneva apertamente che il c. era un moto vibratorio delle particelle dei corpi. Una posizione particolare assunse J.-B.-J. Fourier nella Théorie analytique de la chaleur (1822), rigettando ogni modello e prescindendo nella trattazione della propagazione del c. da ogni ipotesi sulla natura del c. stesso. Contemporaneamente S. Carnot (Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, 1824), affrontò il problema dell’ottimizzazione delle macchine a vapore, il cui impiego si andava rivelando sempre più importante per le economie nazionali; Carnot sviluppò una teoria generale del rendimento delle macchine termiche, basata sulla concezione caloricistica della natura del c., nella quale stabiliva l’impossibilità di produrre con continuità lavoro con il c. prelevato da una sola sorgente; al momento della pubblicazione le Réflexions ebbero una scarsissima divulgazione e la valutazione dell’equivalente termico del lavoro meccanico eseguita poco dopo da Carnot (prima che da Joule), che aveva nel frattempo rigettato la concezione caloricistica in favore di quella cinetica (sotto la spinta delle analogie tra luce e c. raggiante), fu pubblicata postuma soltanto nel 1878. La teoria di Carnot fu ripresa e formalizzata da Clapeyron, nel 1834. A.-M. Ampère (Ideés sur la chaleur et la lumière, 1832) riteneva che (sulla base della natura ondulatoria della luce definitivamente confermata dalle ricerche di A.-J. Fresnel e della strettissima analogia tra luce e c. raggiante, che sarà completamente messa in evidenza dalle ricerche di M. Melloni) l’unica interpretazione plausibile per la natura del c. fosse quella cinetica.
Profondamente influenzato dalle concezioni di M. Faraday sulla convertibilità delle forze, J.P. Joule iniziò nel 1842 una magistrale campagna di misure che lo portano a dimostrare l’equivalenza del lavoro meccanico e del c. (e a determinare con grande precisione l’equivalente termico del lavoro): questa dimostrazione costituì la prova decisiva a favore della teoria cinetica. Del tutto indipendentemente, nel 1842, R. Mayer, sulla base di considerazioni aprioristiche, fornì un enunciato nel quale si può intravedere il principio di conservazione dell’energia e calcolò l’equivalente termico del lavoro meccanico. W. Thomson, lord Kelvin, nel 1848, basandosi sulla traduzione inglese della memoria di Clapeyron, scoprì la teoria di Carnot e l’anno successivo, dopo essere finalmente riuscito a entrare in possesso di una copia delle Réflexions, rese edotta la comunità scientifica dell’enorme importanza dell’opera del grande fisico francese; anche se con notevoli perplessità, conoscendo i risultati ottenuti da Joule, Kelvin accettò l’ipotesi sostanzialistica perché l’ipotesi cinetica gli sembrava inconciliabile con la teoria di Carnot.
R.J.E. Clausius nella fondamentale memoria Über die bewegende Kraft der Wärme und die Gezetze, welche sich daraus für die Wärmelehre selbst ableiten lassen (1850) riformulò la teoria di Carnot sulla base della teoria cinetica del c. e sgombrò così il campo dalle residue perplessità che ancora potevano sussistere sulla concezione cinetica, dimostrando la conciliabilità di quelli che sono il I e il II principio della termodinamica, i quali negano rispettivamente la possibilità di realizzare un moto perpetuo di prima specie (creazione di energia dal nulla, ma anche la sua distruzione) e di seconda specie (produzione continua di lavoro meccanico prelevando c. da una sola sorgente). In tale memoria Clausius adattò alla concezione cinetica, oltre la teoria di Carnot, anche molte considerazioni relative ai fenomeni termici nei gas sviluppate dai grandi caloricisti. Clausius formulò inoltre il primo principio nella forma δQ=dU+pdV (Q essendo la quantità di c., U una funzione che dipende solo dai parametri che caratterizzano lo stato del sistema che si sta considerando, p e V rispettivamente pressione e volume, di modo che pdV esprime il lavoro elementare) giungendo alla distinzione tra c. Q ed energia interna U e stabilendo così in modo inequivocabile che il c. non è una funzione di stato come avevano ritenuto i caloricisti: la quantità di c. scambiata da un sistema passando da uno stato a un altro dipende non solo da stato iniziale e finale ma anche dalla particolare trasformazione seguita dal sistema. La memoria di Clausius segnò la definitiva affermazione della concezione cinetica del c. e, con la memoria di Kelvin On the dynamical theory of heat (1851), sancì la nascita della moderna termodinamica.
La teoria cinetica del c., secondo la quale l’energia termica è essa pure energia meccanica, più precisamente cinetica, dovuta al perpetuo, disordinato, rapidissimo moto delle molecole e degli atomi nell’interno dei corpi, trovò la prima importante applicazione nella teoria cinetica dei gas che, sviluppata e approfondita da S. König, Clausius, J.C. Maxwell e L. Boltzmann, permise, dopo la metà del 19° sec., di dedurre le leggi dello stato gassoso, in armonia con l’esperienza, sulla base della semplice premessa che le molecole di un gas sono animate da rapidi moti rettilinei, ma con velocità alterate, a brevissimi intervalli di tempo, dagli urti che avvengono fra molecola e molecola oppure fra queste e le pareti del recipiente. La conferma che questi risultati hanno avuto in svariati campi della fisica ha fatto sì che l’ipotesi cinetica sulla costituzione della materia passasse dal rango di modello a quello di realtà fisica.
Considerazioni generali sul calore
La definizione più generale della quantità di c., data da M. Born, dipende esplicitamente dal I principio della termodinamica che viene enunciato nel modo seguente: «il lavoro L fatto da un sistema quando passa senza ‘scambi termici’da uno stato A a uno stato B non dipende dalla particolare trasformazione adiabatica eseguita ma solo dagli stati iniziale e finale». Da questo enunciato segue che deve esistere una funzione dello stato del sistema U (energia interna) tale che
Ladiab=U(A)−U(B)=−ΔU;
deve sempre esistere, inoltre, un processo adiabatico (reversibile o no) che colleghi due qualsiasi stati A e B di un sistema. Per un processo non adiabatico si ha che L≠−ΔU; la somma L+ΔU può essere presa come misura della quantità di calore Q scambiata in un processo: Q=L+ΔU. La quantità di calore Q è così definita per ogni processo, è indipendente da qualsivoglia sostanza particolare ed è anche indipendente dalla scala delle temperature.
Un’altra definizione della quantità di c. può essere data ricorrendo ai cambiamenti di stato: per trasformare una sostanza da uno stato di aggregazione a un altro occorre una quantità di calore Q proporzionale alla massa m di sostanza che cambia di stato, Q=λ Δm (dove λ è la costante di proporzionalità). Questa definizione non dipende dalla scelta di una scala delle temperature perché ogni cambiamento di stato ha luogo (a una determinata pressione) a temperatura costante.
La quantità di c. può essere inoltre definita con il metodo delle mescolanze. Se si mescolano due masse m1 e m2 di una sostanza inizialmente alle temperature t1 e t2, alla fine la mescolanza si trova alla temperatura t3, ed è valida, in assenza di cambiamenti di stato, di reazioni chimiche e di scambi termici con l’esterno, la relazione m1 (t3−t1) = m2 (t2−t3); si può assumere che ciascun membro di questa eguaglianza rappresenti una quantità proporzionale al calore Q scambiato tra le sostanze; in particolare a quello ceduto dalla sostanza inizialmente a temperatura più elevata e assorbito da quella a temperatura più bassa: Q=cm Δt (dove c è la costante di proporzionalità). Quest’ultima definizione può essere illustrata sulla base di semplici considerazioni microscopiche. Poiché la temperatura è una misura dell’energia cinetica media delle molecole, quando si pongono in contatto termico due corpi a temperature diverse, nelle collisioni che hanno luogo tra le molecole dell’uno contro le molecole dell’altro, in media perdono energia le molecole che ne posseggono in misura maggiore. Il corpo alla temperatura maggiore perde in questo modo energia che viene acquistata dal corpo alla temperatura inferiore e il processo continua fino a quando le energie cinetiche medie delle molecole dei due corpi sono uguali, cioè sono uguali le loro temperature: dal punto di vista macroscopico questo processo viene descritto dicendo che del c. fluisce dal corpo più caldo a quello più freddo, finché non viene raggiunto l’equilibrio termico. Raggiunto quest’ultimo, non ha più senso alcuno parlare di c. e in particolare di c. contenuto in un corpo o in un sistema, ma solo di energia (interna) posseduta da un corpo o da un sistema: è impossibile suddividere l’energia interna in una parte di origine meccanica e in una parte di origine termica. L’energia interna di un sistema si identifica infatti con la somma delle energie cinetiche e delle energie potenziali delle singole molecole che costituiscono il sistema.
La trasmissione del c. può avvenire per conduzione, per convezione, per irraggiamento: in quest’ultimo modo, che a differenza degli altri due non ha bisogno dell’intermediario di un mezzo materiale, il c. si propaga per onde elettromagnetiche. Le quantità di c. che due (o più) corpi si scambiano possono venire misurate e di tali misurazioni si occupa la calorimetria (➔); l’unità di misura per le quantità di calore nel sistema internazionale (SI) è il joule (J), anche se in alcuni settori, per es. in quello dell’alimentazione, con particolare riferimento al contenuto energetico degli alimenti, è ancora talvolta impiegata la caloria. La caloria (simbolo cal) è pari alla quantità di c. che occorre somministrare a 1 grammo di acqua distillata per portarne, a pressione atmosferica normale, la temperatura da 14,5 °C a 15,5 °C. Nel sistema internazionale, dunque, 1 cal=4,1868 J.
Se non ha un senso parlare del c. contenuto in un corpo, è possibile invece misurare la temperatura (su una scala convenzionale o su quella assoluta) alla quale un corpo si trova: di tali misurazioni si occupa la termometria. La temperatura è cosa ben diversa dal c.; non solo c. e temperatura non si identificano, ma neppure si deve pensare che fornendo c. a un corpo la sua temperatura debba necessariamente aumentare: l’assorbimento di una certa quantità di c. può infatti essere accompagnato da una produzione di lavoro o da un cambiamento dello stato di aggregazione e, quindi, non necessariamente tradursi in un aumento della temperatura. L’assorbimento di c. da parte di un corpo, anche se non è tale da portare il corpo alla soglia di un cambiamento di stato, provoca tuttavia sempre in esso un’alterazione delle proprietà e spesso delle dimensioni: si hanno così fenomeni di dilatazione termica, lineare, superficiale o cubica a seconda dei casi. Particolarmente importante è lo studio delle dilatazioni che può subire un gas. Le trasformazioni di c. in energia meccanica si realizzano nelle macchine termiche motrici (➔ termodinamica).
C. di trasformazione e c. latente
Si chiama c. di trasformazione (o totale), il c. da somministrare o da sottrarre all’unità di massa di una sostanza per portarla dallo stato iniziale a quello finale di una trasformazione termodinamica, quale un cambiamento di stato d’aggregazione, una variazione di struttura cristallina ecc.
C. latente è la quantità di c. che occorre dare o sottrarre, a seconda dei casi, all’unità di massa di una sostanza per farle cambiare stato (da solido a liquido, da liquido a solido ecc.) dopo che questa abbia raggiunto la temperatura alla quale avviene il cambiamento di stato. La denominazione deriva dal fatto che tale cessione o sottrazione di c. non è rivelata da una variazione di temperatura: la trasformazione è isoterma. Il c. latente non provoca variazioni nell’energia cinetica molecolare, ma corrisponde all’energia necessaria per realizzare il cambiamento dello stato di aggregazione molecolare. I c. latenti relativi a due passaggi di stato inversi sono sempre uguali tra loro e nel seguito si definiscono vari c. latenti per specifiche trasformazioni di stato.
C. di condensazione (o di liquefazione) Quantità di c. ceduta dall’unità di massa di un vapore saturo nel condensarsi; coincide, a ogni determinata temperatura, con il c. di evaporazione.
C. di cristallizzazione Quantità di c. assorbita o ceduta nel passaggio allo stato cristallino di una mole di una sostanza sciolta in un solvente; coincide, a ogni determinata temperatura, con il c. di soluzione.
C. di evaporazione Quantità di c. che si deve somministrare all’unità di massa di un liquido a una determinata temperatura per trasformarlo in vapore saturo alla stessa temperatura.
C. di formazione Quantità di c. svolta nella combinazione diretta degli elementi per formare una mole del composto considerato. Poiché nei cambiamenti di stato degli elementi o dei composti entrano in gioco i c. di fusione, di vaporizzazione ecc., nell’indicare i c. di formazione occorre specificare lo stato di aggregazione sia del reagente sia del composto.
C. di fusione Quantità di c. che occorre somministrare all’unità di massa di una sostanza, portata alla temperatura di fusione, per ottenerne la fusione.
C. di solidificazione Quantità di c. che deve essere sottratta all’unità di massa di una sostanza, portata alla temperatura di solidificazione, per ottenerne la solidificazione. È pari al c. di fusione.
C. di soluzione Quantità di calore che accompagna la dissoluzione di una sostanza.
C. di sublimazione Quantità di c. che deve essere somministrata all’unità di massa di una sostanza solida per ottenerne il passaggio allo stato di vapore.
C. totale (o c. di trasformazione) In una trasformazione termodinamica di un corpo, quantità di c. necessaria per portare il corpo dalla condizione iniziale a quella finale.
Per il c. di reazione, il c. messo in gioco da una reazione chimica ➔ termochimica.
C. specifico
Il c. specifico è la quantità di c. che occorre somministrare all’unità di massa di una sostanza per aumentarne di 1 °C la temperatura; è uguale, pertanto, al rapporto fra la capacità termica di una sostanza e la sua massa. Si chiama c. specifico medio (cm) di un corpo fra due temperature t e t1, il rapporto tra la quantità di calore ΔQ somministrata all’unità di massa del corpo in una determinata trasformazione che ne porti la temperatura da t a t1 e il salto di temperatura Δt=t1−t:cm=ΔQ/Δt. Generalmente, variando la temperatura t, il c. specifico varia: si definisce c. specifico alla temperatura t la quantità
Nelle applicazioni, per intervalli di temperature non molto estesi, c si può tuttavia considerare molto spesso costante. Stante la definizione di caloria, l’acqua ha c. specifico pari a 1 cal/g °C fra 14,5 e 15,5 °C e a pressione normale. Il c. specifico varia in generale da sostanza a sostanza, e inoltre, per ogni sostanza, con la trasformazione termodinamica che questa subisce; per una sostanza è generalmente maggiore nello stato liquido rispetto allo stato solido o gassoso. Particolare importanza hanno, specialmente per i gas, il c. specifico a pressione costante (cp) e il c. specifico a volume costante (cv) rispettivamente corrispondenti al caso che durante la trasformazione si mantenga costante la pressione o il volume. In varie questioni interviene il rapporto γ=cp/cv: per i gas monoatomici esso è pari a ~ 1,66; per l’aria, così come per molti gas biatomici, ha un valore prossimo a 1,41 (➔ gas). Il c. specifico di tutti i corpi tende a zero al tendere della temperatura allo zero assoluto (III principio della termodinamica): una teoria di P. Debye rende ragione di questo fatto.
Il prodotto del c. specifico di un elemento per il suo peso atomico corrisponde al c. atomico, quantità di c. che occorre somministrare a una mole di atomi di un elemento per aumentarne di 1 °C la temperatura. Come il c. specifico, così anche il c. atomico può esser considerato a pressione costante oppure a volume costante: per gli elementi solidi a temperatura ordinaria, il primo oscilla intorno a 2,6, il secondo intorno a 25 J/mol∙K (6,3 e 6 cal/mol K), in accordo con la legge di Dulong e Petit. Questa si giustifica pensando che ogni grado di libertà di un atomo contribuisce in eguale misura all’energia interna media di un sistema e, quindi, che uno stesso numero di gradi di libertà totali – quali quelli presenti in uno stesso numero complessivo di atomi di un grammoatomo – alla stessa temperatura possiede la medesima energia interna e lo stesso c. atomico. Per i gas perfetti monoatomici il c. atomico a pressione costante vale 5R/2 e quello a volume costante 3R/2, essendo R la costante dei gas perfetti.
Il prodotto del c. specifico per il peso molecolare è il c. molecolare (o molare). Secondo la regola di Neumann e Kopp il c. molecolare di un composto allo stato solido è la somma dei c. atomici degli elementi che ne costituiscono la molecola.
C. raggiante
Il c. raggiante è l’energia, di natura elettromagnetica, di frequenza corrispondente prevalentemente alla zona infrarossa dello spettro, emessa, per irraggiamento termico, dai corpi; al crescere della temperatura aumenta in modo molto rilevante l’emissione, lo spettro si va estendendo nella zona del visibile e i corpi finiscono con l’apparire incandescenti. Un notevole esempio del c. raggiante è il c. solare: il Sole invia sulla Terra un flusso di energia pari a circa 1,4 kW/m2 (costante solare), che è solo una piccolissima frazione dell’energia totale irradiata, pari a circa 1034J/anno. La produzione di una così grande quantità di energia è dovuta a reazioni termonucleari di fusione dell’idrogeno in elio, sotto l’azione catalizzatrice del carbonio e dell’azoto (➔ radiazione, stella).
Medicina
L’uso del c., umido o secco, ha numerose applicazioni terapeutiche, sia generali, sia locali. Le prime, oltre il comune bagno caldo esplicante azione sedativa sul sistema nervoso, comprendono tra l’altro le soste in grotte e i bagni a vapore (➔ idroterapia). Le applicazioni locali del c., che si effettuano a scopo antispastico, antidolorifico, antiflogistico ecc., possono essere attuate impiegando tanto il c. umido (cataplasmi, impacchi caldo-umidi ecc.) quanto il c. secco (termofori, recipienti con acqua calda, impacchi di paraffina, forni alla Bier ecc.).
Colpo di c. Quadro clinico causato dall’azione in tutto l’organismo di temperature elevate. Differisce dal colpo di sole soprattutto per non essere in rapporto con l’azione diretta dei raggi solari.
Ipotesi del c. puntiforme Ipotesi formulata da F. Dessauer per spiegare il meccanismo dell’effetto biologico dei raggi X e γ: l’energia delle radiazioni si trasformerebbe, per successive degradazioni, in c. nei punti di assorbimento, determinando coagulazione delle albumine cellulari.